木姜叶柯(Lithocarpus litseifolius(Hance)Chun),别名甜茶,在我国民间已有上千年的食用历史,是一种药食两用、兼具茶、糖、药3种功能的植物,其中以四川、湖南和云南资源最为丰富[1]。民间常采集木姜叶柯的嫩叶食用,据称有生津止渴、消除疲劳之功效[2],其生物资源量巨大,仅我国木姜叶柯年产量可达数万吨。《中华中药志》《全国中草药汇编》和《本草纲目》都对木姜叶柯的药理作用和实践应用有相关记载,鉴于木姜叶柯的药理作用以及民间千百年实践应用已证实其安全、无毒副作用,木姜叶柯已被批准为新食品原料[3]。由于木姜叶柯叶片中含有些许涩味,影响其口感,所以雅安当地居民习惯将其制备成全发酵木姜叶柯茶,以降低其涩味,同时保留甘甜的特色。
研究发现木姜叶柯的主要活性成分为黄酮类化合物,主要分布于叶部位,目前已从其叶中分离鉴定至少22种黄酮类成分[4]。三叶苷、根皮苷和3-羟基根皮苷等二氢查尔酮类化合物为其主要黄酮类成分,其甜度为蔗糖的300倍[5],而热量极低,是非常理想的天然低热量功能性甜味剂,并且根皮苷在糖尿病及其并发症的防治中具有独特的效果[6]。除此之外,木姜叶柯中三叶苷和根皮苷还被广泛的证明具有降血脂、降血糖、抗氧化、抗肿瘤、抑菌、抗病毒、预防/治疗血管疾病等生物活性[7-10]。然而,目前多为对木姜叶柯干燥叶或鲜叶生物学活性的研究,未见对其全发酵茶的降血糖活性研究。因此,本研究通过传统的全发酵茶加工工艺制备木姜叶柯全发酵茶,并对其总多酚、总黄酮、三叶苷、根皮苷以及儿茶素类化合物的含量进行测定,以全面评价全发酵茶加工工艺对木姜叶柯潜在活性成分的影响。同时,本研究探究木姜叶柯和木姜叶柯全发酵茶的乙醇提取物对链脲佐菌素(streptozotocin,STZ)诱导的糖尿病小鼠的降血糖、降血脂和抗氧化作用。
1 材料与方法
1.1 材料与试剂
木姜叶柯(2019年11月采摘),由芦山县树虫草茶农民专业合作社提供;没食子酸标准品(含量>98%)、芦丁标准品(含量>98%)、甲醇(HPLC级)、冰乙酸(HPLC级),成都浩搏优科技有限公司;三叶苷标准品(含量>98%)、根皮苷标准品(含量>98%)、儿茶素(catechins,C)标准品(含量>98%)、表儿茶素(epicatechin,EC)标准品(含量>98%)、表没食子儿茶素(epigallocatechin,EGC)标准品(含量>98%)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)标准品(含量>98%)、表儿茶素没食子酸酯(epicatechin gallate,ECG)标准品(含量>98%)、没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)标准品(含量>98%),成都德思特生物技术公司;格列本脲和STZ,Sigma-Aldrich公司;SXT血糖仪和血糖试纸,三诺生物有限公司;胰岛素、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)、总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、低密度脂蛋白胆固醇(low density lipoprotein chesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)的检测试剂盒,南京建成生物工程研究所;其余试剂均为分析纯;实验所用水均为超纯水。
1.2 仪器与设备
U3000高效液相色谱仪(包括1260DAD型检测器)、Varioskan LUX酶标仪,赛默飞世尔科技有限公司;AB1104-N电子分析天平,Mettler Toledo公司;DSA100-GL1超声波清洗机,福州德森精工有限公司;TDZ4-WS台式低速离心机,湖南赛特湘仪离心机仪器有限公司。
1.3 实验动物
雄性ICR小鼠(18±2) g,成都达硕动物有限公司,饲养于恒温恒湿条件下[温度(22±2) ℃,相对空气湿度(55±5)%]的房间(12 h照明,12 h黑暗),所有小鼠均可自由饮食和饮用水。待小鼠完全适应饮食和环境后,一周后开始实验。
1.4 实验方法
1.4.1 木姜叶柯全发酵茶加工工艺
加工工艺流程如下:
木姜叶柯鲜叶→萎凋→杀青→揉捻→发酵→干燥→木姜叶柯全发酵茶
具体操作步骤如下:
(1)采用自然萎调的方法进行摊凉,木姜叶柯鲜叶均匀散放在通风网架上,厚度3~5 cm,摊晾24 h;
(2)用燃烧加热式小型滚筒杀青机将摊晾叶杀青,锅温380~400 ℃,杀青6~8 min;
(3)采用茶叶揉捻机进行揉捻,揉捻30 min;
(4)揉捻后的木姜叶柯叶放入恒温恒湿培养箱中发酵,温度25~30 ℃,相对空气湿度85%以上,时间24 h;
(5)将发酵叶放入鼓风干燥箱,100 ℃烘至足干。
1.4.2 木姜叶柯活性成分的测定
总多酚含量的测定参照GB/T 8313—2018《茶叶中茶多酚和儿茶素类含量的检测方法》,采用Folin-Ciocalteu比色法测定样品总多酚含量[11]。总黄酮含量的测定参照SN/T 4592—2016《进出口食品中黄酮的测定》,采用Al3+比色法测定样品总黄酮含量[12]。
三叶苷和根皮苷含量的测定是参照CHEN等[13]所述方法,并进行修改。准确称取0.25 g样品,加入适量70 ℃的70%乙醇溶液,用玻璃棒充分搅拌至均匀湿润,60 ℃超声处理(100 W,40 kHz)30 min,经冷却后,放入离心机中,在3 500 r/min下离心10 min,取上清液0.5 mL至50 mL容量瓶中,用70%乙醇溶液定容,过0.45 μm的滤膜,提取液用于高效液相色谱(high performance liquid chromatography,HPLC)分析。色谱柱:Target C18(250 mm×4.6 mm,5 μm);流动相:100%甲醇(A)∶0.2%冰乙酸(B)=48∶52;流速:1 mL/min;柱温:30 ℃;进样量:20 μL;检测波长:285 nm。
儿茶素含量的测定参照GB/T 8313—2018[11]所述方法,并进行修改。准确称取0.20 g样品,加入经过70 ℃的70%甲醇溶液10 mL,用玻璃棒充分搅拌至均匀湿润,立即移入70 ℃水浴中,浸提20 min(隔10 min搅拌一次),冷却后,放入离心机中,在3 500 r/min下离心10 min,将上清液过滤至25 mL容量瓶中,残渣再用10 mL 70%甲醇水溶液提取一次,重复以上操作,合并提取液,用甲醇溶液定容至25 mL,过0.45 μm的滤膜,提取液用于HPLC分析。色谱柱:Target C18(250 mm×4.6 mm,5 μm);流动相:100%甲醇(A)∶0.2%冰乙酸(B);流速:0.9 mL/min;柱温:35 ℃;进样量:10 μL;检测波长:278 nm。
表1 儿茶素各组分测定梯度洗脱表
Table 1 Linear gradient elution of catechin components
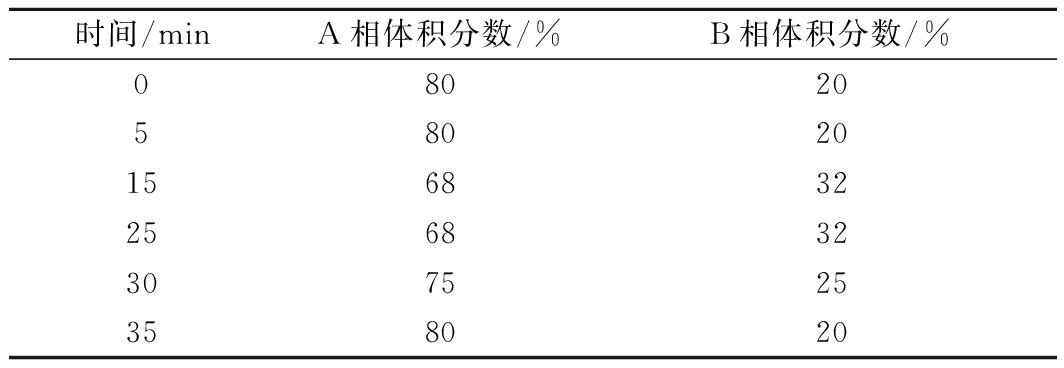
时间/minA相体积分数/%B相体积分数/%0802058020156832256832307525358020
1.4.3 木姜叶柯提取物的制备
木姜叶柯提取物(Lithocarpus litseifolius extracts,LLEs)的制备参照LIANG等[14]所述方法。将木姜叶柯(1 kg)粉碎过60目筛,并用5 L 70%乙醇回流提取2次,每次2 h。提取液过滤后,用旋转蒸发仪浓缩,并在真空干燥器中于105 ℃干燥成粉末,得LLEs。木姜叶柯全发酵茶提取物(Lithocarpus litseifolius whole fermentation tea extracts,LLFEs)的制备与此方法一致。
1.4.4 动物模型的建造、分组与给药
随机选取造模备选小鼠,禁食12 h后称重。将STZ溶于缓冲液(0.1 mol/L柠檬酸钠和0.1 mol/L柠檬酸,pH 4.2~4.5),并迅速腹腔注射(注射剂量为100 mg/kg)[15]。72 h后,对多饮、多尿的小鼠进行空腹血糖测试,血糖水平大于16.8 mmol/L的则为模型成功。
将造模成功的小鼠被随机分配到以下实验组里(每组6只小鼠):
(1)组Ⅰ(对照):正常小鼠;
(2)组Ⅱ(阳性对照):经STZ诱导的糖尿病小鼠口服格列苯脲[灌胃量20 mg/(kg·d)];
(3)组Ⅲ(阴性对照):经STZ诱导的糖尿病小鼠(灌胃蒸馏水);
(4)组Ⅳ:经STZ诱导的糖尿病小鼠口服LLEs[灌胃量200 mg/(kg·d)];
(5)组Ⅴ:经STZ诱导的糖尿病小鼠口服LLFEs[灌胃量200 mg/(kg·d)]。
1.4.5 小鼠待测组织的采集与制备
经30 d饲养,所有供试的小鼠禁食12 h。测定小鼠的体重和血糖,并对小鼠眼球取血,将收集的血液迅速离心(5 000 r/min、5 min、4 ℃)获得血清,保藏于-80 ℃冰箱;采用颈椎脱位法处死所有供试小鼠,并切取小鼠的胰腺、部分肾脏和肝脏用于组织病理学分析(苏木精-伊红染色),其余肾脏和肝脏保藏于-80 ℃冰箱,待测试。
1.4.6 小鼠生理指标测试
小鼠尾部取血后,用血糖仪测定小鼠血糖水平;血清中胰岛素、TC、TG、LDL-C和HDL-C的含量遵照相应试剂盒的说明书进行测定;小鼠胰腺、肾脏和肝脏组织分别加入冰冷的5 mmol/L三羟甲基氨基甲烷盐酸(包含2 mmol/L 乙二胺四乙酸,pH 7.4)缓冲液于匀浆器中匀浆(置于冰上),均质后离心(3 000 r/min,10 min,4 ℃),上层液体用于GPx、SOD、CAT活性和MDA水平的测定(具体操作参照相应试剂盒的说明书)。
1.5 统计学分析
采用SPSS 22.0软件进行数据统计分析。实验数据采用平均值±标准差(SD)表示,采用t检验进行数据统计分析,以P<0.05表示有显著统计学意义。
2 结果与分析
2.1 全发酵茶加工对木姜叶柯主要活性成分含量的影响
表2为全发酵茶加工对木姜叶柯主要活性成分含量的影响。由表2可知,木姜叶柯全发酵茶总多酚和总黄酮的含量均降低,其中总多酚的含量由12.71%下降到9.36%,下降26.39%;总黄酮的含量1.46%下降到1.12%,下降23.29%。三叶苷和根皮苷是木姜叶柯中的主要甜味成分[16],由表2可知,木姜叶柯经萎调、杀青、揉捻、发酵和干燥等工艺后,木姜叶柯全发酵茶中三叶苷和根皮苷的含量均降低,其中三叶苷由276.38 mg/g下降至248.09 mg/g,下降10.24%;根皮苷由39.09 mg/g下降至23.70 mg/g,下降39.37%。李胜华等[17]通过比较不同加工过程木姜叶柯中二氢查耳酮的含量发现,木姜叶柯在加工成茶叶的过程中二氢查尔酮的含量基本不变,仍然可维持较高的甜味,与本研究的结果基本一致。这可能是由于二氢查耳酮类化合物不易受多酚氧化酶的作用,且二氢黄酮类与查耳酮类成分发生较明显异构化反应所需的温度较高,因此加工过程中二氢查耳酮含量基本不变[18]。
表2 全发酵茶加工对木姜叶柯活性成分含量的影响
Table 2 Effect of Lithocarpus litseifolius on content of
active components in traditional process
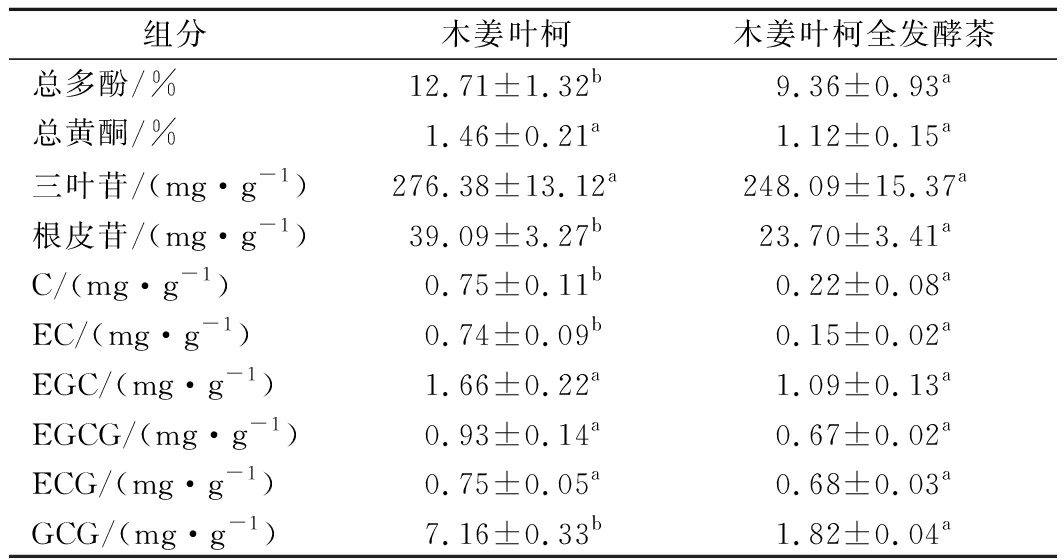
组分木姜叶柯木姜叶柯全发酵茶总多酚/%12.71±1.32b9.36±0.93a总黄酮/%1.46±0.21a1.12±0.15a三叶苷/(mg·g-1)276.38±13.12a248.09±15.37a根皮苷/(mg·g-1)39.09±3.27b23.70±3.41aC/(mg·g-1)0.75±0.11b0.22±0.08aEC/(mg·g-1)0.74±0.09b0.15±0.02aEGC/(mg·g-1)1.66±0.22a1.09±0.13aEGCG/(mg·g-1)0.93±0.14a0.67±0.02aECG/(mg·g-1)0.75±0.05a0.68±0.03aGCG/(mg·g-1)7.16±0.33b1.82±0.04a
注:每个数值均表示为3次测试的平均值±SD(n=3);同一行中不同的字母表示具有显著差异(P<0.05)
儿茶素类化合物是木姜叶柯中主要涩味物质,由表2可知,木姜叶柯全发酵茶中6种儿茶素含量均降低,其中C、EC和GCG的含量大幅下降,分别下降70.67%、79.73%和74.58%。这是由于儿茶素类化合物在加工过程中多酚氧化酶的作用下参与众多反应,儿茶素B环中含有酚羟基,极易被氧化为邻醌,再通过苯骈环化反应生成茶黄素类物质,且儿茶素类化合物是参与构成全发酵茶中茶黄素的前体物质,从而提升茶汤品质,因此在加工过程中含量大幅下降[19]。
2.2 木姜叶柯提取物对STZ糖尿病小鼠的影响
2.2.1 对STZ糖尿病小鼠的体重及其血糖、胰岛素水平的影响
在本研究中,STZ对小鼠有明显的糖尿病诱导作用,小鼠表现为多饮、多食和多尿的糖尿病症状[20]。由表3可知,与正常小鼠相比,经STZ诱导的糖尿病小鼠出现体重下降,其中糖尿病小鼠(组Ⅲ)的体重相对于正常小鼠(组Ⅰ)显著降低(P<0.05),而空腹血糖水平却显著升高(P<0.05),这可能是由于结构蛋白的丢失或降解所致[21]。在分别服用LLEs、LLFEs(组Ⅳ和组Ⅴ)和格列本脲(组Ⅱ)治疗30 d后,糖尿病小鼠的血糖恢复至正常水平(<16.8 mmol/L),显著低于没有服用任何药物的糖尿病小鼠(P<0.05),但略高于正常小鼠(组Ⅰ),组Ⅴ小鼠的血糖水平较组Ⅳ小鼠更低(P<0.05)。同时,测定小鼠体重发现,与阴性对照组(组Ⅲ)相比,组Ⅱ、Ⅳ和Ⅴ小鼠的体重并没有显著提高(P>0.05)。结果表明LLEs和LLFEs均能够降低经STZ诱导糖尿病小鼠的血糖水平,具有较好的降糖作用,但并不能改善糖尿病小鼠体重减轻的情况。
由表3可知,STZ诱导的糖尿病小鼠胰岛素水平下降。与阴性对照组(组Ⅲ)小鼠相比,格列本脲治疗糖尿病小鼠的的胰岛素水平显著升高,这主要是由于格列本脲增加胰岛β细胞内钙的水平[22]。此外,经LLEs和LLFEs处理的糖尿病小鼠的胰岛素水平显著高于组Ⅲ,但低于组Ⅰ和组Ⅱ。表明LEs能够调节其降血糖的可能作用机制是通过增加胰岛素分泌,这与ZHOU等[23]的研究结果一致。最新研究表明,食用植物类黄酮可通过保护和增加胰岛β细胞的增殖,并通过激活cAMP/PKA信号通路增加胰岛素分泌,从而预防或治疗糖尿病[24]。
2.2.2 木姜叶柯提取物对糖尿病小鼠抗氧化酶活性的影响
研究表明氧化应激在糖尿病及其并发症中起重要作用,可导致活性氧(reactive oxygen species,ROS)的产生、降低抗氧化防御系统的响应水平,并且会导致机体(特别是肾脏和肝脏)的氧化损伤[25]。机体内的抗氧化酶(GPx、SOD和CAT)被认为是抗氧化应激的第一道防线,能够清除自由基并保护细胞免受ROS的损伤。此外,MDA是脂质过氧化的最终产物,可作为细胞损伤的指标。体内MDA的水平越高,说明氧化损伤越严重,且能够使抗氧化酶活性降低。
表3 木姜叶柯提取物对糖尿病小鼠的体重及其血糖、胰岛素水平的影响
Table 3 Effect of LLEs on body weight, blood glucose and insulin level in STZ-induced diabetic mice
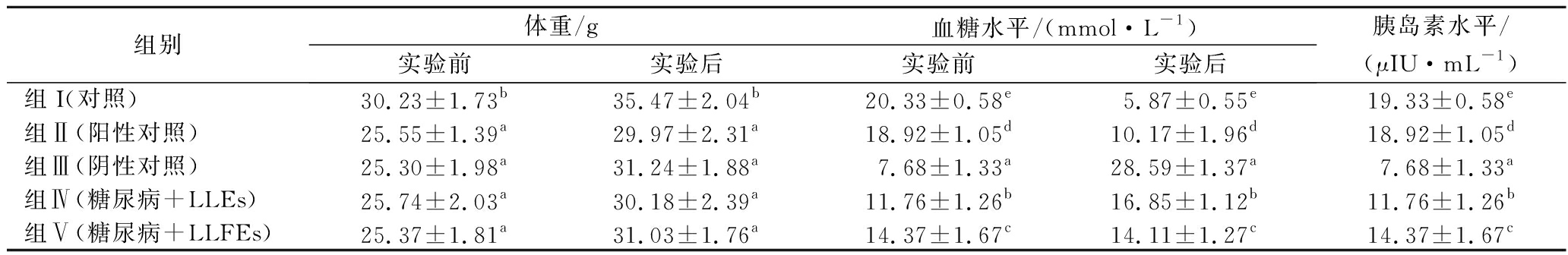
组别体重/g血糖水平/(mmol·L-1)实验前实验后实验前实验后胰岛素水平/(μIU·mL-1)组I(对照)30.23±1.73b35.47±2.04b20.33±0.58e5.87±0.55e19.33±0.58e组Ⅱ(阳性对照)25.55±1.39a29.97±2.31a18.92±1.05d10.17±1.96d18.92±1.05d组Ⅲ(阴性对照)25.30±1.98a31.24±1.88a7.68±1.33a28.59±1.37a7.68±1.33a组Ⅳ(糖尿病+LLEs)25.74±2.03a30.18±2.39a11.76±1.26b16.85±1.12b11.76±1.26b组Ⅴ(糖尿病+LLFEs)25.37±1.81a31.03±1.76a14.37±1.67c14.11±1.27c14.37±1.67c
注:每个数值均表示为3次测试的平均值±SD(n=6),同一列中不同的字母表示具有显著差异(P<0.05)
本研究测定肾脏和肝脏中GPx、SOD和CAT的活性和MDA的水平。如图1所示,与正常小鼠(组Ⅰ)相比,STZ诱导的糖尿病小鼠(组Ⅲ)肾脏和肝脏中GPx、SOD和CAT的活性显著降低(P<0.05),MDA水平显著升高(P<0.05)。有研究表明STZ可产生ROS,表明抗氧化药物可能有利于治疗糖尿病引起的机体氧化损伤[26]。在服用格列本脲治疗30 d后,组Ⅱ中糖尿病小鼠肾脏和肝脏中GPx、SOD和CAT的活性均无显著差异,MDA的水平无显著差异(P>0.05)。结果表明,格列本脲对肾脏和肝脏的抗氧化酶活性没有调节作用,这与之前的研究[27]所观察到的结果一致。此外,与组Ⅱ和Ⅲ相比,经LLEs和LLFEs(组Ⅳ和Ⅴ)治疗30 d后,糖尿病小鼠肾脏和肝脏中GPx、SOD和CAT的活性显著提高(P<0.05),MDA的水平显著降低(P<0.05)。肾脏和肝脏中MDA的水平降低可能是由于抗氧化酶活性的增强,这与单思聪等[28]的研究结果一致。
值得注意的是,组Ⅴ肾脏中SOD的活性、MDA水平和肝脏中GPx、SOD的活性与正常小鼠无显著差异(P>0.05),表明经LLFEs治疗,糖尿病小鼠的抗氧化指标基本恢复正常。这些结果也表明,LLEs和LLFEs均可清除活性氧自由基,并且提高这些抗氧化酶的活性。同时,与组Ⅳ相比,组Ⅴ除肾脏中CAT的活性无显著差异(P>0.05)外,其余抗氧化酶的活性均显著上升(P<0.05),且糖尿病小鼠肾脏和肝脏中MDA的水平显著降低(P<0.05)。这可能是全发酵茶加工过程中,酚类物质在多酚氧化酶的作用下发生复杂的化学反应,从而增加全发酵茶中酚类化合物的种类,导致LLFEs清除自由基的能力增加[29]。

A-GPx活性;B-SOD活性;C-CAT活性;D-MDA水平
图1 木姜叶柯提取物对糖尿病小鼠的抗氧化酶活性的影响
Fig.1 Effect of LLEs on activities of antioxidant enzymes in kidney and liver of STZ-induced diabetic mice
2.2.3 木姜叶柯提取物对糖尿病小鼠血清中脂质水平的影响
糖尿病是一种常见代谢慢性疾病,脂质代谢异常是糖尿病常见的代谢紊症状,可导致血脂异常、多种器官功能损害、心血管疾病等一系列并发症。脂质代谢异常具体表现在TC、TG和LDL-C的含量升高,HDL-C的含量降低[30]。有研究表明,HDL-C在胆固醇从外周转运至肝脏的过程中发挥重要作用,对血脂有积极的调控作用,可降低心血管疾病的风险[31]。因此,研究了正常小鼠和STZ诱导的糖尿病小鼠血清中脂质水平(TC、TG、LDL-C和HDL-C)的变化。
由图2可知,与正常小鼠(组Ⅰ)相比,STZ诱导的糖尿病小鼠(组Ⅲ)TC、TG和LDL-C的含量显著升高(P<0.05),HDL-C的含量显著降低(P<0.05)。在给药治疗30 d后,与未给药糖尿病小鼠相比,组Ⅱ、Ⅳ和Ⅴ中糖尿病小鼠TC、TG和LDL-C的含量显著降低(P<0.05),HDL-C的含量均显著升高(P<0.05)。表明格列本脲和LEs可通过调节糖尿病小鼠血脂异常而降低心血管疾病的发生。此外,与组Ⅳ相比,组Ⅴ中糖尿病小鼠TG和LDL-C的含量显著降低(P<0.05),HDL-C的含量显著升高(P<0.05),且与正常小鼠无显著差异(P>0.05)。表明LLFEs对STZ诱导糖尿病小鼠的降血脂作用比LLEs更明显。
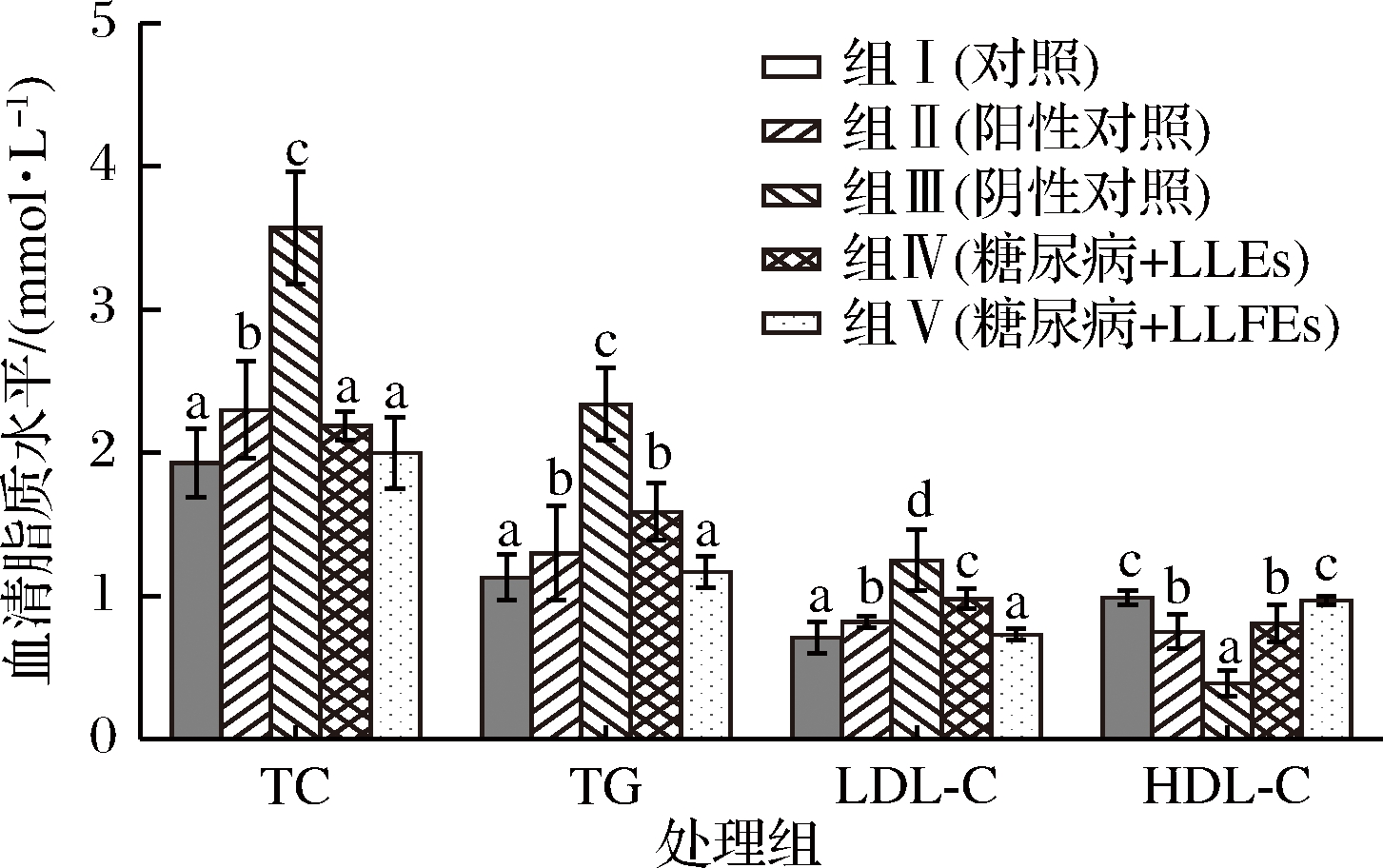
图2 木姜叶柯提取物对糖尿病小鼠血清中脂质水平的影响
Fig.2 Effect of LLEs on lipids levels in
STZ-induced diabetic mice
2.3 病理组织学分析
2.3.1 木姜叶柯提取物对糖尿病小鼠胰腺组织的病理学影响
如图3-C所示,经STZ诱导的糖尿病小鼠(组Ⅲ)胰腺组织病理学变化表现为胰腺泡萎缩,胰岛细胞数量减少,部分胰岛细胞凋亡并被大量溶解的红细胞代替,其间毛细血管扩张充血,胰岛及间质血管周围有少量炎细胞浸润。服用LLEs和LLFEs治疗 30 d 后,与组Ⅲ(图3-C)相比,糖尿病小鼠胰腺组织部分恢复正常,胰腺泡萎缩减弱,毛细血管扩张充血减弱,且炎细胞浸润消失(图3-D和3-E)。表明LLEs和LLFEs均对糖尿病小鼠的胰腺组织有明显的修复作用和保护功效。与组Ⅳ相比,组Ⅴ糖尿病小鼠(图3-E)胰腺泡减弱和胰腺间质淤血消失更明显,表明LLFEs对糖尿病小鼠胰腺组织的修复作用更显著。由图3-B可知,服用格列本脲的糖尿病小鼠(组Ⅱ)的胰腺组织损伤并未得到修复,且出现大量组织坏死、胰岛细胞溶解被红细胞代替,表明格列本脲对糖尿病小鼠的胰腺没有修复作用。

A-组Ⅰ(对照);B-组Ⅱ(阳性对照);C-组Ⅲ(阴性对照);
D-组Ⅳ(糖尿病+LLEs);E-组Ⅴ(糖尿病+LLFEs)
图3 木姜叶柯提取物对糖尿病小鼠胰腺组织的病理学影响(×100)
Fig.3 Effects of LLEs treatment on pancreas damage in
STZ-induced diabetic mice
注:病理学影响采用苏木精-伊红染色处理(下同)
2.3.2 木姜叶柯提取物对糖尿病小鼠肾脏组织的病理学影响
如图4-C所示,经STZ诱导的糖尿病小鼠(组Ⅲ)肾脏组织病理学变化表现为肾小球结构不清晰,有部分纤维化现象,少部分肾小管结构被破坏且伴有部分肾小管上皮细胞空泡变性,间质内有少量淤血和蛋白沉淀物。服用LLEs和LLFEs治疗30 d后,与组Ⅲ相比,糖尿病小鼠肾脏组织结构基本恢复正常,肾小球结构清晰且无纤维化迹象,肾小管上皮细胞空泡变性减弱,间质内只有少量淤血和蛋白沉淀物(图4-D和4-E)。表明LLEs和LLFEs均对糖尿病小鼠的肾脏组织有明显的修复和保护功效。同时,组Ⅳ和组Ⅴ的肾脏组织之间也没有显著性的病理差别,表明经全发酵茶加工后木姜叶柯提取物对小鼠肾脏的保护作用没有明显提升。由图4-B可知,服用格列本脲的糖尿病小鼠(组Ⅱ)的肾脏组织损伤不仅没有修复,且大部分肾小球结构被破坏,细胞空泡变性加重和间质出现大量淤血和蛋白沉淀物,表明格列本脲对糖尿病小鼠的肾脏没有修复作用。
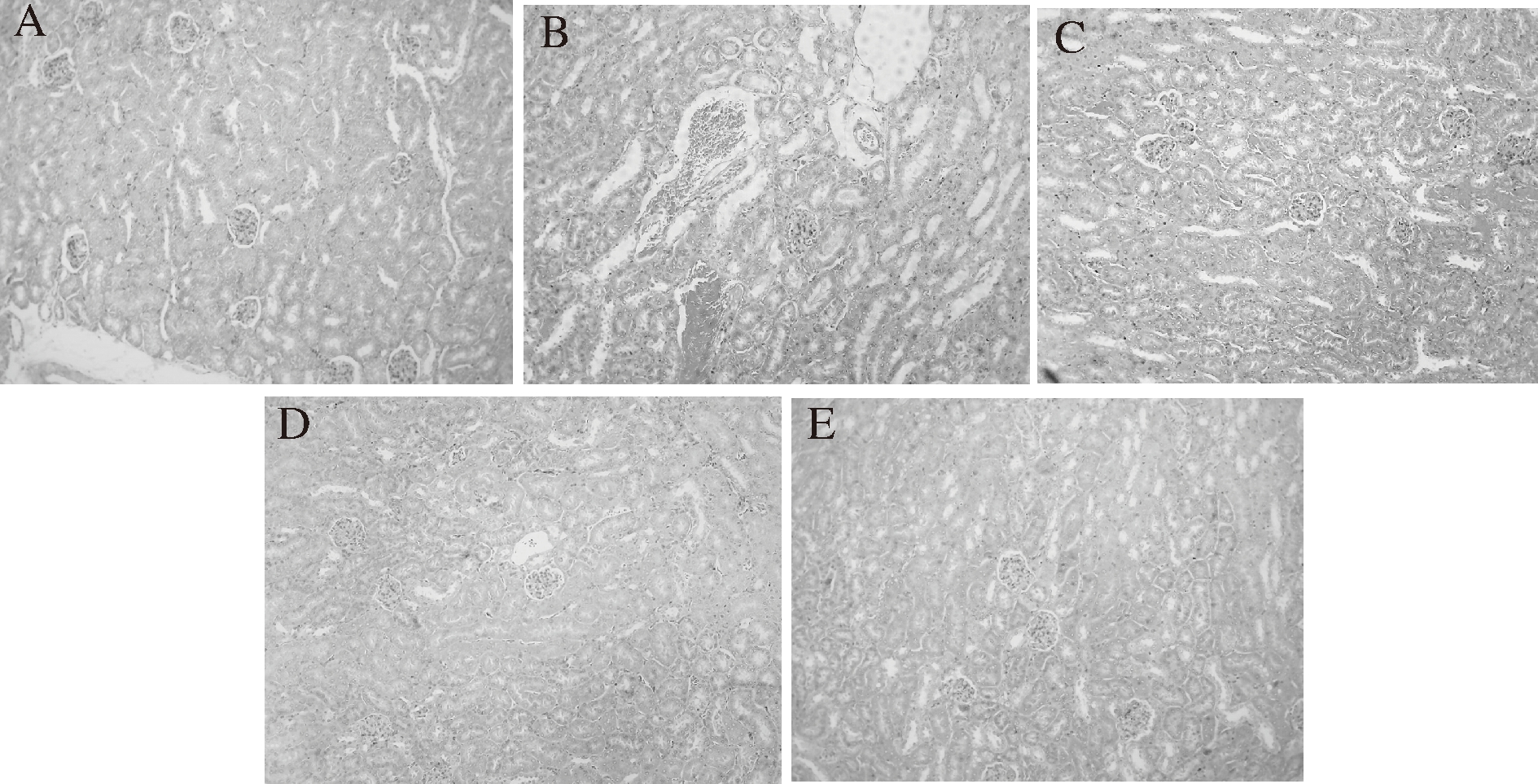
A-组Ⅰ(对照);B-组Ⅱ(阳性对照);C-组Ⅲ(阴性对照);
D-组Ⅳ(糖尿病+LLEs);E-组Ⅴ(糖尿病+LLFEs)
图4 木姜叶柯提取物对糖尿病小鼠肾脏组织的病理学影响(×100)
Fig.4 Effects of LLEs treatment on kidney damage in
STZ-induced diabetic mice
2.3.3 木姜叶柯提取物对糖尿病小鼠肝脏组织的病理学影响
如图5-C所示,经STZ诱导的糖尿病小鼠(组Ⅲ)肝脏组织病理学变化表现为肝细胞索状结构部分消失,细胞排列紊乱,细胞核变形,部分肝细胞存在脂肪性变性,肝中央静脉扩张并且周围存在大量炎症细胞侵润。服用LLEs和LLFEs治疗30 d后,与组Ⅲ(图5-C)相比,糖尿病小鼠肝细胞组织结构基本恢复正常,肝细胞索状结构清晰,肝细胞以中央静脉为中心呈放射状排列,中央静脉扩张减弱且炎症消失(图5-D和5-E)。表明LLEs和LLFEs均对糖尿病小鼠的肝脏组织有明显的修复作用和保护功效。值得注意的是,与组Ⅳ相比,组Ⅴ糖尿病小鼠的肝脏组织中央静脉扩展减弱更明显,表明LLFEs对小鼠肝组织的保护作用更明显。由图5-B可知,服用格列本脲的糖尿病小鼠(组Ⅱ)的肝脏组织损伤不但未得到修复,且肝脏细胞排列紊乱加剧,索状结构完全消失,出现纤维组织增生,表明格列本脲对糖尿病小鼠的肝脏没有修复作用。
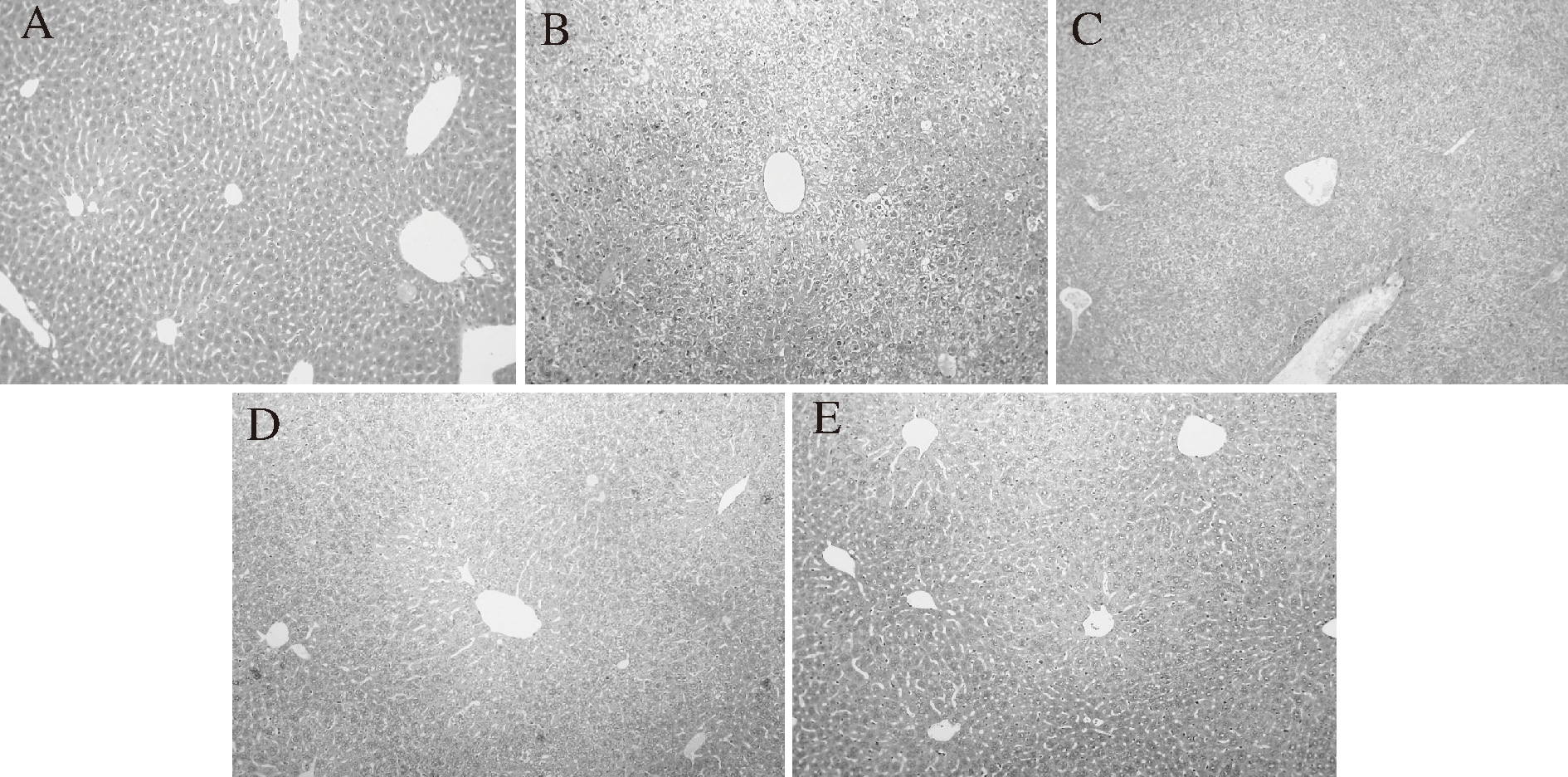
A-组Ⅰ(对照);B-组Ⅱ(阳性对照);C-组Ⅲ(阴性对照);
D-组Ⅳ(糖尿病+LLEs);E-组Ⅴ(糖尿病+LLFEs)
图5 木姜叶柯提取物对糖尿病小鼠肝脏组织的病理学影响(×100)
Fig.5 Effects of LLEs treatment on liver damage in
STZ-induced diabetic mice
3 结论
本研究通过制备木姜叶柯全发酵茶并测定其主要活性成分,其中,总多酚和总黄酮的含量分别降低26.36%和23.29%,主要甜味物质三叶苷和根皮苷的含量分别降低10.24%和39.37%,主要涩味物质儿茶素类化合物的含量降低61.38%。表明制备木姜叶柯全发酵茶可有效降低木姜叶柯的涩味,并保留其甜味物质。同时,采用乙醇回流提取法提取木姜叶柯及其全发酵茶的二氢查耳酮,主要为三叶苷和根皮苷,并对其降血糖活性进行研究。发现木姜叶柯提取物对STZ诱导的糖尿病小鼠均表现出降血糖、降血脂、改善抗氧化状态、减轻胰腺、肾脏和肝脏损伤的作用,且木姜叶柯全发酵茶提取物表现出更好的效果。本研究结果可为木姜叶柯在发酵茶饮的加工以及木姜叶柯多酚和黄酮在天然功能性食品中的应用提供理论依据和技术参考。
[1] 中科院植物研究所. 中国高等植物图鉴[M]. 北京: 科学出版社, 1972: 434.
[2] 董华强. 多穗柯黄酮提取分离、活性研究及其根皮苷分子修饰[D]. 广州:华南理工大学, 2007.
[3] SUN Y S, LI W, LIU Z B. Preparative isolation, quantification and antioxidant activity of dihydrochalcones from Sweet Tea (Lithocarpus polystachyus Rehd.)[J]. Journal of Chromatography B, 2015, 1 002: 372-378.
[4] 雷鸣, 徐应淑, 徐凡, 等. 多穗石柯化学成分及药理作用研究进展[J]. 中药药理与临床, 2017, 33(6): 176-180.
[5] CHEN Z H, ZHANG R J, WU J, et al. New dihydrochalcone glycosides from Lithocarpus litseifolius and the phenomenon of C-H→C-D exchange observed in NMR spectra of phenolic components[J]. Journal of Asian Natural Products Research, 2009, 11(6): 508-513.
[6] 马琮鉴, 高健美, 孔浩, 等. 根皮苷药理作用研究进展[J]. 医药导报, 2020, 39(3): 360-364.
[7] 王慧莹. 多穗柯根皮苷的提取纯化研究[D]. 长沙:中南大学, 2014.
[8] CHENG Y B, LIU F J, WANG C H, et al. Bioactive triterpenoids from the leaves and twigs of Lithocarpus litseifolius and L. corneus[J]. Planta Medica, 2018, 84(1): 49-58.
[9] HOU S Z, CHEN S X, HUANG S, et al. The hypoglycemic activity of Lithocarpus polystachyus Rehd. leaves in the experimental hyperglycemic rats[J]. Journal of Ethnopharmacology, 2011, 138(1): 142-149.
[10] HOU S Z, XU S J, JIANG D X, et al. Effect of the flavonoid fraction of Lithocarpus polystachyus Rehd. on spontaneously hypertensive and normotensive rats[J]. Journal of Ethnopharmacology, 2012, 143(2): 441-447.
[11] 国家市场监督管理总局,中国国家标准化管理委员会.GB/T 8313—2018 茶叶中茶多酚和儿茶素类含量的检测方法[S]. 北京: 中国标准出版社, 2018.
[12] 中华人民共和国质量监督检验检疫总局.SN/T 4592—2016 进出口食品中总黄酮的测定[S]. 北京: 中国标准出版社, 2016.
[13] CHEN Y, YIN L Z, ZHAO L, et al. Optimization of the ultrasound-assisted extraction of antioxidant phloridzin from Lithocarpus polystachyus Rehd. using response surface methodology[J]. Journal of Separation Science, 2017, 40(22): 4 329-4 337.
[14] LIANG J, CHEN S X, HUANG S, et al. Evaluation of toxicity studies of flavonoid fraction of Lithocarpus polystachyus Rehd in rodents[J]. Regulatory Toxicology and Pharmacology, 2017, 88: 283-290.
[15] ZHANG L, LIU Y X, KE Y, et al. Antidiabetic activity of polysaccharides from Suillellus luridus in streptozotocin-induced diabetic mice[J]. International Journal of Biological Macromolecules, 2018, 119: 134-140.
[16] 张亚洲, 王涛, 朱晶晶, 等. 木姜叶柯中根皮苷与三叶苷含量测定研究[J]. 中国药业, 2018, 27(18): 5-8.
[17] 李胜华, 伍贤进, 牛友芽. HPLC测定多穗柯中二氢查耳酮含量研究[J]. 食品科技, 2010, 35(6): 281-283.
[18] 鲁亚奇, 罗寒燕, 王丽霞, 等. 甘草炒制过程中主要成分的含量变化及转化规律分析[J]. 中国实验方剂学杂志, 2020, 26(10): 100-106.
[19] 方骏婷. 祁门红茶加工过程中主要化学成分分析[D]. 合肥:安徽农业大学, 2016.
[20] AMOS A F, MCCAETY D J, ZIMMENT P. The rising global burden of diabetes and its complications: Estimates and projections to the year 2010[J]. Diabetic Medicine, 1997, 14(5): 14-85.
[21] RAIKUMAR L, SRINIVASAN N, BALASUBRAMANIAN K, et al. Increased degradation of dermal collagen in diabetic rats[J]. Indian Journal of Experimental Biology, 1991, 29(11): 1 081-1 083.
[22] PARI L, LATHA M. Antidiabetic effect of Scoparia dulcis: Effect on lipid peroxidation in streptozotocin diabetes[J]. General Physiology and Biophysics, 2005, 24(1): 13-26.
[23] ZHOU C J, HUANG S, LIU J Q, et al. Sweet tea leaves extract improves leptin resistance in diet-induced obese rats[J]. Journal of Ethnopharmacology, 2013, 145(1): 386-392.
[24] DINDA B, DINDA M, ROY A, et al. Chapter Five-Dietary plant flavonoids in prevention of obesity and diabetes[J]. Advances in Protein Chemistry and Structural Biology, 2020, 120: 159-235.
[25] ASMAT U, ABAD K, ISMAIL K. Diabetes mellitus and oxidative stress—A concise review[J]. Jouranl of the Sudi Pharmaceutical Society, 2016, 24(5): 547-553.
[26] ELIZA J, DAISY P, LGNACIMUTHU S. Antioxidant activity of costunolide and eremanthin isolated from Costus speciosus (Koen ex. Retz) Sm[J]. Chemico-Biological Interactions, 2010, 188(3): 467-472.
[27] LIU Y T, YOU Y X, LI Y W, et al. The characterization, selenylation and antidiabetic activity of mycelial polysaccharides from Catathelasma ventricosum[J]. Carbohydrate Polymers, 2017, 174: 72-81.
[28] 单思聪, 孙爽. 超临界萃取多穗柯黄酮及其抗运动氧化功能研究[J]. 食品研究与开发, 2016, 37(20): 67-70.
[29] CARDOSO R R,NETO R O,DALMEIDA C T, et al. Kombuchas from green and black teas have different phenolic profile, which impacts their antioxidant capacities, antibacterial and antiproliferative activities[J]. Food Research International, 2020, 128:108 782.
[30] YU J, CUI P J, ZENG W L, et al. Protective effect of selenium-polysaccharides from the mycelia of Coprinus comatuson alloxan-induced oxidative stress in mice[J]. Food Chemistry, 2009, 117(1): 42-47.
[31] WANG L, ZHANG Y, XU M C, et al. Anti-diabetic activity of Vaccinium bracteatum Thunb.leaves′ polysaccharide in STZ-induced diabetic mice[J]. International Journal of Biological Macromolecules, 2013, 61: 317-321.