近年来,有关生物大分子与小分子相互作用的研究报道越来越多,特别是关于蛋白质(包括酶)和DNA与活性小分子相互作用的研究逐渐成熟[1-3]。但是关于多糖与活性小分子相互作用的研究内容却不多。阿拉伯半乳聚糖(arabinogalactan, AG)是阿拉伯糖和半乳糖组成的中性多糖,在医药、食品、化妆品中应用广泛。美国食品药品管理局已经批准AG可以作为食品添加剂使用。AG的吸水性很强,添加到食品中可以形成一种胶凝体,增加食品的体积,改善食品的软度和口感[4]。阿魏酸(ferulic acid, FA)是酚酸的一种,广泛存在于植物中,是阿魏、当归、川芎、升麻等中药材的有效成分,在医药、化妆品、保健品、食品中有着广泛的应用[5-7]。由于FA不稳定,它的许多应用都会被限制,通常,FA与多糖结合后可以形成更加稳定、更具有靶向活性的复合物,常见于植物细胞壁、烘焙食品、啤酒加工等[8-9]。目前,还未见有AG与FA结合特性研究的文献报道。本文旨在研究AG与FA结合特性,为该复合物在食品、药品等方面应用提供一定的理论基础。
1 材料与方法
1.1 试剂与仪器
阿魏酸(纯度99%),湖北远成药业有限公司;阿拉伯半乳聚糖(纯度>98%),上海伊卡生物技术有限公司;无水乙醇、甲醇(分析纯),成都科龙化工试剂厂;甲酸、Na2HPO4、NaH2PO4、NaHCO3、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(分析纯),重庆川东化工有限公司;CP214型电子天平,上海奥豪斯仪器有限公司;DELTA320-S型PH计,深圳富哲仪器有限公司;RE-52A型旋转蒸发器,上海亚荣生化仪器厂;T-18型分散机(配S10N 5G型分散头),德国IKA公司;UV-2450型紫外可见分光光度计,日本Shimadzu公司;傅立叶变换红外光谱仪,日本Shimadzu公司;HJ-6A型多头磁力搅拌器,金坛市科析仪器有限公司;XH-B型漩涡混合器,上海达洛科学仪器有限公司;KS-080型超声波清洗机,深圳市洁康洗净电器有限公司;LGJ-18S型冷冻干燥机,北京松源华兴科技发展有限公司;MD34型透析袋,北京索莱宝科技有限公司;SHZ-D(Ⅲ)型循环水式真空泵,巩义市英峪予华仪器厂。
1.2 检测方法
1.2.1 FA含量测定
首先采用紫外扫描分析法,于200~400 nm波长内对FA的甲醇溶液进行扫描,以确定FA的特征吸收波长。精确称取2.5 mg FA标品,用甲醇溶解并定容至25 mL,制成100 μg/mL的母液,再分别取该溶液0.5、1.0、1.5、2.0、3.0、4.0 mL,分别定容至25 mL,摇匀。制成的标准溶液质量浓度为2、4、6、8、12、16 μg/mL。采用高效液相色谱(high performance liquid chromatography,HPLC)法检测FA的含量[6],流动相:A相: 0.3%(体积分数)甲酸水溶液;B相:0.3%(体积分数)甲酸甲醇溶液,A相与B相体积比为60∶40,流速为0.8 mL/min,进样量为10 μL,检测波长322 nm,出峰时间8.1 min。将配制好的梯度FA甲醇溶液按照上述方法测量,记录所得的峰面积,以FA浓度为横坐标,峰面积为纵坐标绘制标准曲线。计算得到阿魏酸标准曲线的回归方程为Y=77.276X-13.512,R2=0.999 1,式中X为FA浓度,Y为峰面积。
1.3 试验设计
1.3.1 平衡透析试验
取长约10 cm的透析袋,用前进行常规处理,取6 mL质量浓度为0.5 mg/mL的AG溶液和2 mL质量浓度为0.5 mg/mL的FA溶液,放入透析袋中,封好透析袋,将透析袋放入盛有100 mL磷酸缓冲液的烧杯中,将烧杯放在磁力搅拌器上搅拌,每隔1 h用紫外分光光度计测1次透析外液中FA的吸光度,直至吸光度不变时达到透析平衡,以确定吸附时间。
1.3.2 单因素试验
考察单因素有缓冲液pH、温度和FA浓度。选取的点分别为缓冲液pH:3、4、5、6、7;温度:20、30、40、50、60 ℃;FA质量浓度:1、5、9、13、17 mg/mL。分别将盛有6 mL 0.5 mg/mL AG和2 mL不同浓度的FA溶液的透析袋放入盛有 100 mL不同pH浓度为0.5 mol/L的PBS缓冲液中,透析温度为20~60 ℃,透析平衡后透析袋外液过0.45 μm滤膜后经HPLC测定游离FA含量。每个点进行3次平行实验,根据FA的标准曲线计算AG对FA的吸附量(Qe,μg/mg)。
1.3.3 Box-Behnken设计试验
在单因素试验的基础上,进行Box-Behnken设计试验。选取温度、pH和FA浓度3个因素为自变量(X),各分3个水平,共15个实验点,可以分为两类,一类是析因点,自变量取值在X1、X2、X3所构成的三维顶点,共有12个析因点;另一类是零点,为区域的中心点,零点实验重复3次,用以评估试验的误差。以AG对FA的吸附量(Qe)为响应值(Y),运用Design-Expert 8.0软件设计响应面实验并对实验结果进行回归分析,通过响应面分析对试验条件进行优化,Box-Behnken设计试验因素水平取值及编码表见表1。
表1 Box-Behnken设计试验因素和水平
Table 1 The factors and levels of Box-Behnken design

水平变量代码-101X1FA质量浓度/(mg·mL-1)51015X2pH34.55X3温度/℃204060
1.3.4 AG - FA复合物的制备
取60 mL质量浓度为0.5 mg/mL的AG溶液和20 mL质量浓度为0.5 mg/mL的FA溶液于透析袋中,将透析袋放入盛有100 mL的磷酸缓冲液的烧杯中透析一定时间,透析平衡时取出透析袋,流水透析24 h,去除大部分杂质,再用蒸馏水透析,每2~3 h更换1次蒸馏水,去除小分子杂质。将透析袋内液取出,旋转蒸发后大大降低透析液的体积,冷冻干燥,制成样品,密封后置于干燥器中保存。
1.3.5 AG-FA复合物结构表征
(1)紫外分光光谱分析
分别把FA、AG、复合物、物理混合物配成质量浓度同为1 mg/mL的溶液,然后用紫外分光光度计在200~350 nm的波长下扫描得到紫外图谱。
(2)傅里叶变换红外光谱分析
分别精确称取2 mg样品,样品分别为FA、AG、复合物、FA和AG质量比为1∶4的物理混合物,其中物理混合物为采用漩涡混合器处理1 min制得。样品与干燥的KBr以质量比1∶50的比例混合在玛瑙研钵研磨成均匀细粉,采用专用的压片设备,制备成薄片[10]。然后分别用傅立叶变换红外光谱仪对样品进行红外扫描。
(3)扫描电子显微镜分析
扫描电镜法是用导电双面胶将样品粉末固定在金属样品平台上,在真空中喷涂铂金后,置于扫描电子显微镜中以 3 kV 电子束观察,拍摄有代表性的样品颗粒的形貌照片[11]。样品分别是AG、复合物和物理混合物,拍摄的照片放大倍数是500和2 000倍放大倍数。
2 结果与分析
2.1 单因素试验结果
2.1.1 平衡透析实验时间的确定
以透析外液中游离FA的吸光值为纵坐标,吸附时间为横坐标,做出AG对FA的吸附曲线,如图1所示,随着时间的增大,游离FA的浓度逐渐增大,当达到5 h时,FA浓度不再增大,表明AG对FA的吸附在5 h时达到最大。故以下实验采用5 h的吸附时间。
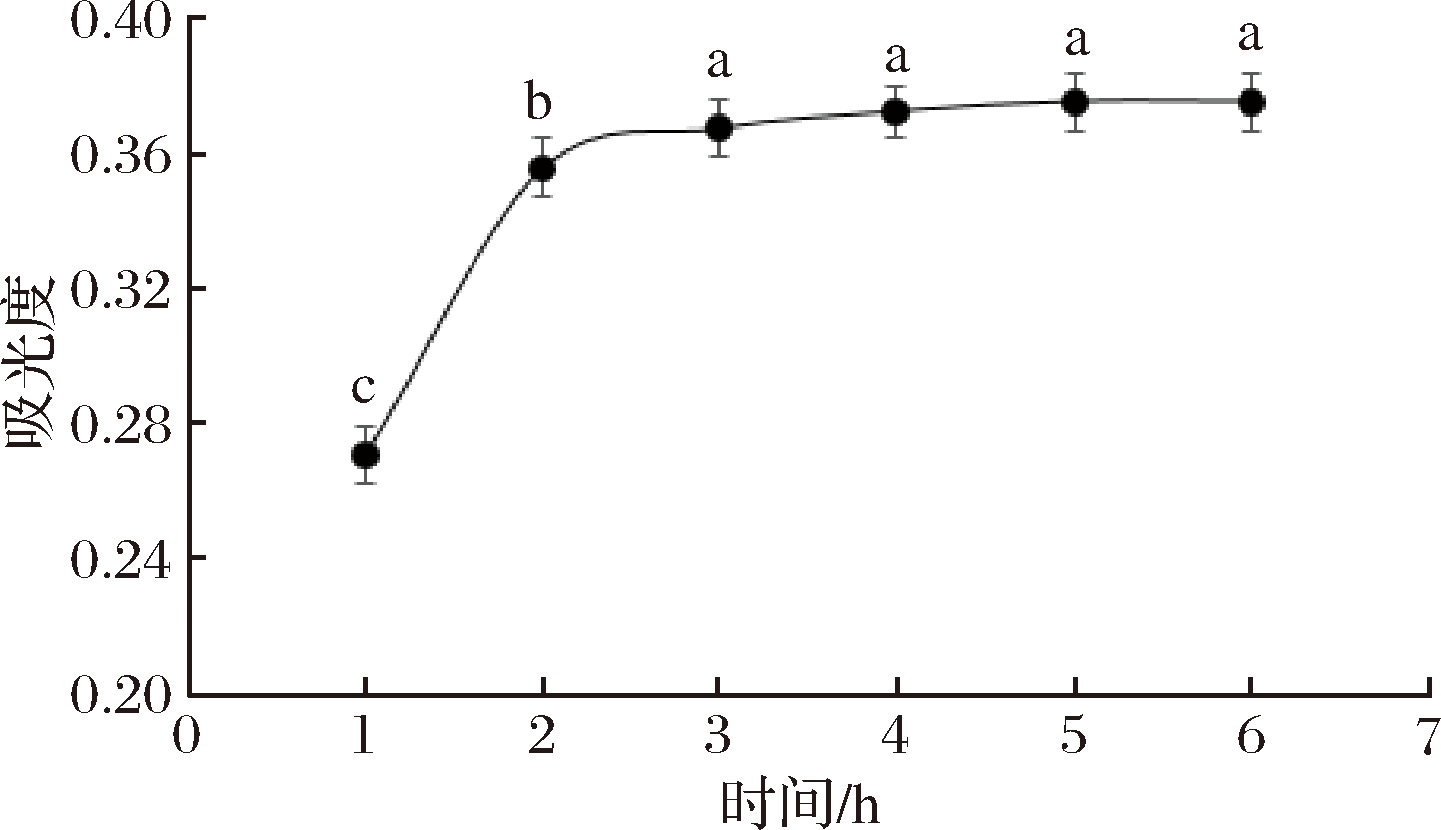
图1 时间对透析外液中游离FA浓度的影响
Fig.1 Effect of time on the concentration of
free FA in dialysate
注:标注不同字母表示差异显著(P<0.05)(下同)
2.1.2 pH对吸附量的影响
pH是影响吸附过程的重要影响因素之一。它与吸附剂表面的吸附机制有关,并且反映了吸附剂与吸附之间理化作用的本质[12]。本实验中FA质量浓度设定为0.5 mg/mL,温度为25 ℃,pH为3~7,试验结果如图2所示。随着pH增大,AG对FA的吸附量显著增大,当pH为5时,达到最大吸附量,为81.62 μg/mg。当pH再增大时,吸附量则减小。吸附量随透析外液pH波动的现象可能是由于阿魏酸是弱有机酸,在水溶液中易受溶液pH值影响而发生变性、异构化、产生沉淀等。
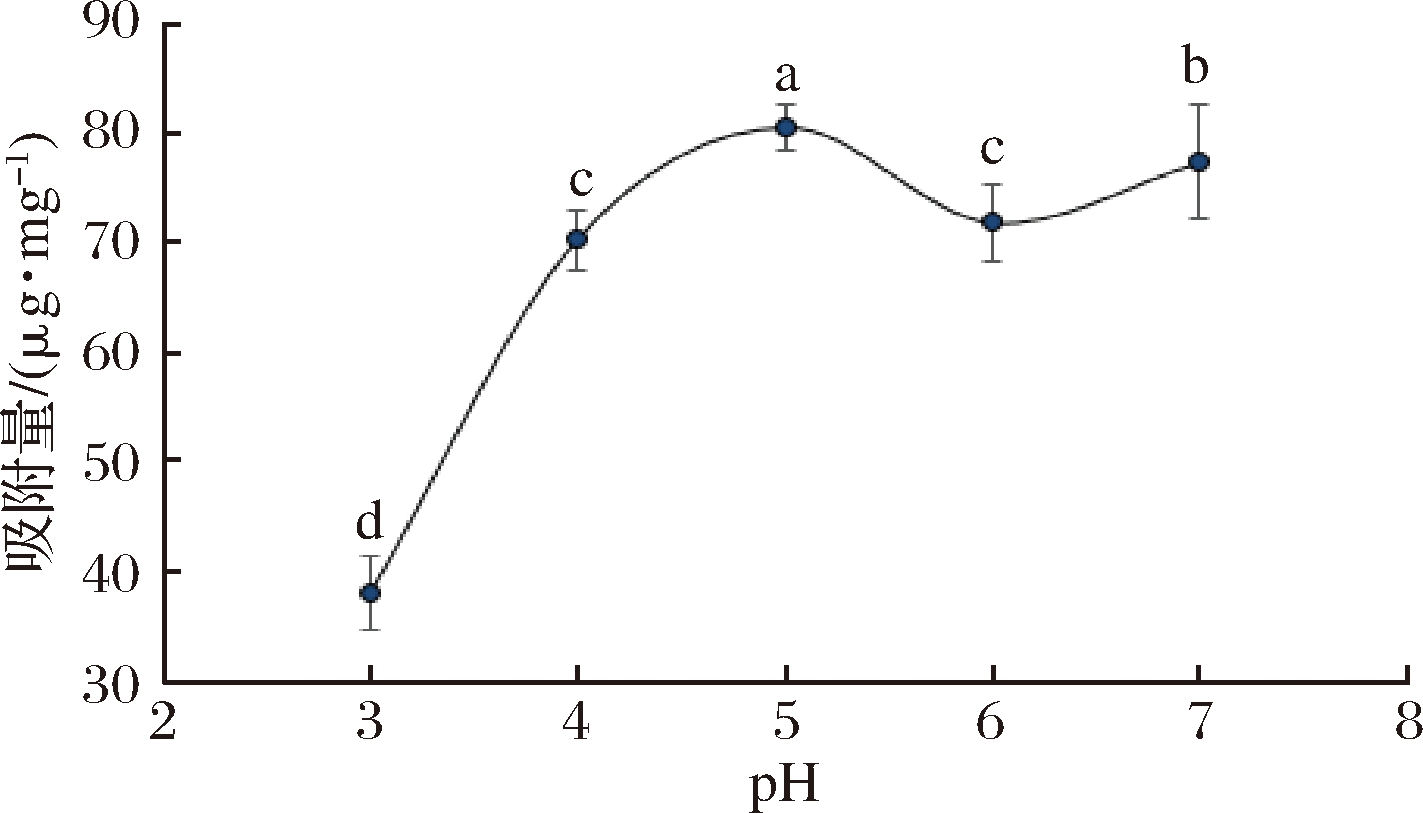
图2 透析外液pH对吸附量的影响
Fig.2 Effect of pH of dialysate on the adsorption
capacity of FA on AG
2.1.3 温度对吸附量的影响
根据pH对吸附量的影响结果,将缓冲液的pH设定为5,FA质量浓度为0.5 mg/mL,温度设定为20~70 ℃。图3表明了不同温度对AG对FA吸附的影响结果。由图3可知,当温度<50 ℃时,吸附量随着温度变化趋势不明显,呈现先增大后减小再增大的趋势,吸附量都在125.60 μg/mg(40 ℃)左右。KAMMERER等[13]也报道了类似的趋势,他们认为温度(25、50 ℃)并没有显著影响颜料的结合能力。随着温度继续升高,对FA的吸附量显著降低,60 ℃时的吸附量为80.12 μg/mg。鉴于以上情况,最终选取40 ℃ 进行下一步实验。
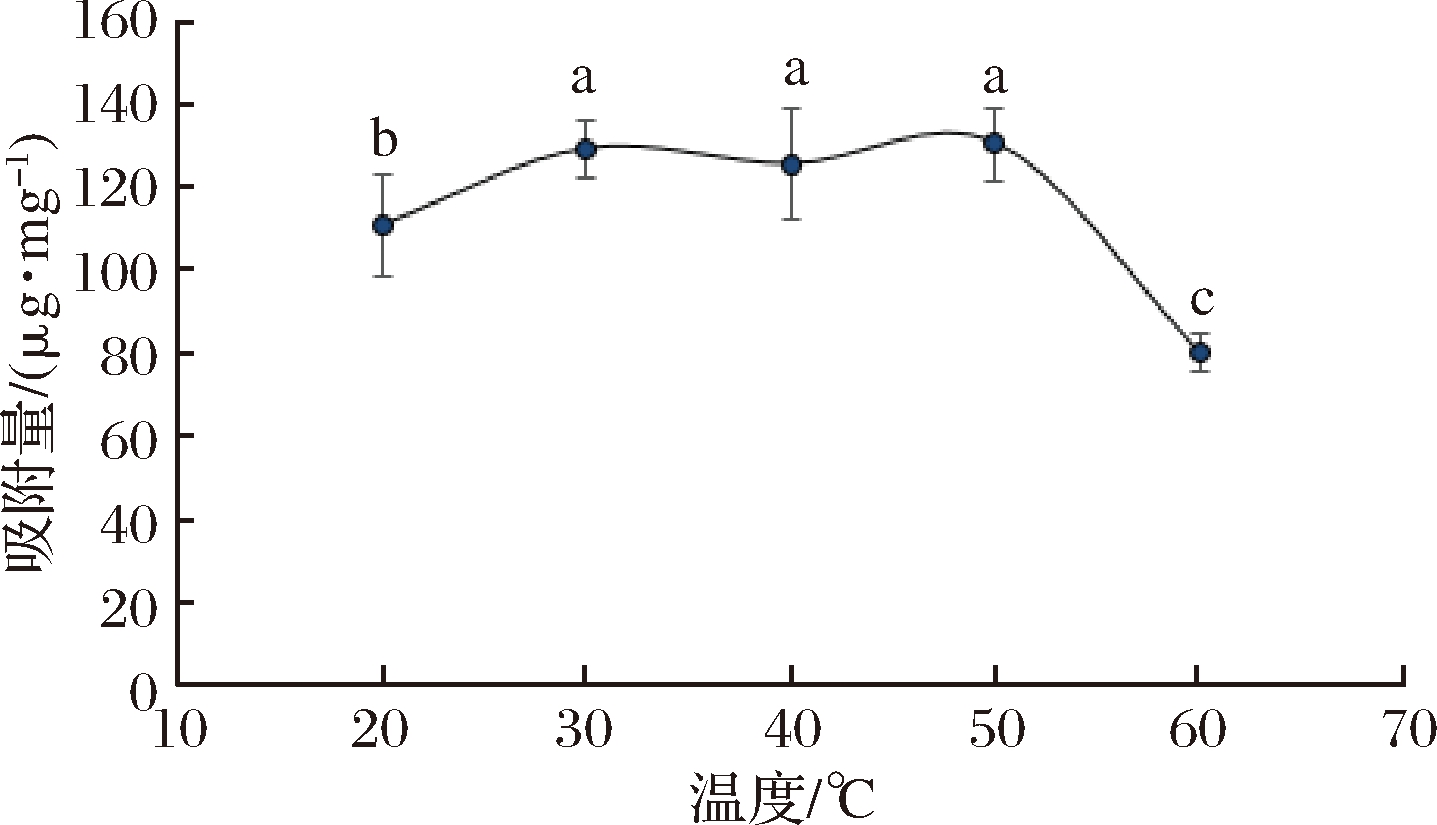
图3 不同温度对吸附量的影响
Fig.3 Effect of temperature on the adsorption
capacity of FA on AG
2.1.4 FA浓度对吸附量的影响
吸附质浓度对吸附过程影响很大,通常都用作影响吸附量的重要因素之一[14]。由图4可知,当温度和缓冲液pH保持不变时,随着FA浓度的增大,吸附量增加。低质量浓度(<5 mg/mL)时吸附量增加幅度较小,高质量浓度(>5 mg/mL)时吸附量陡增,当FA质量浓度增加到17 mg/mL时,吸附量达到极大值,且此时再增大FA浓度,透析时则容易出现结晶现象。结果表明FA浓度显著影响AG吸附FA的效果。
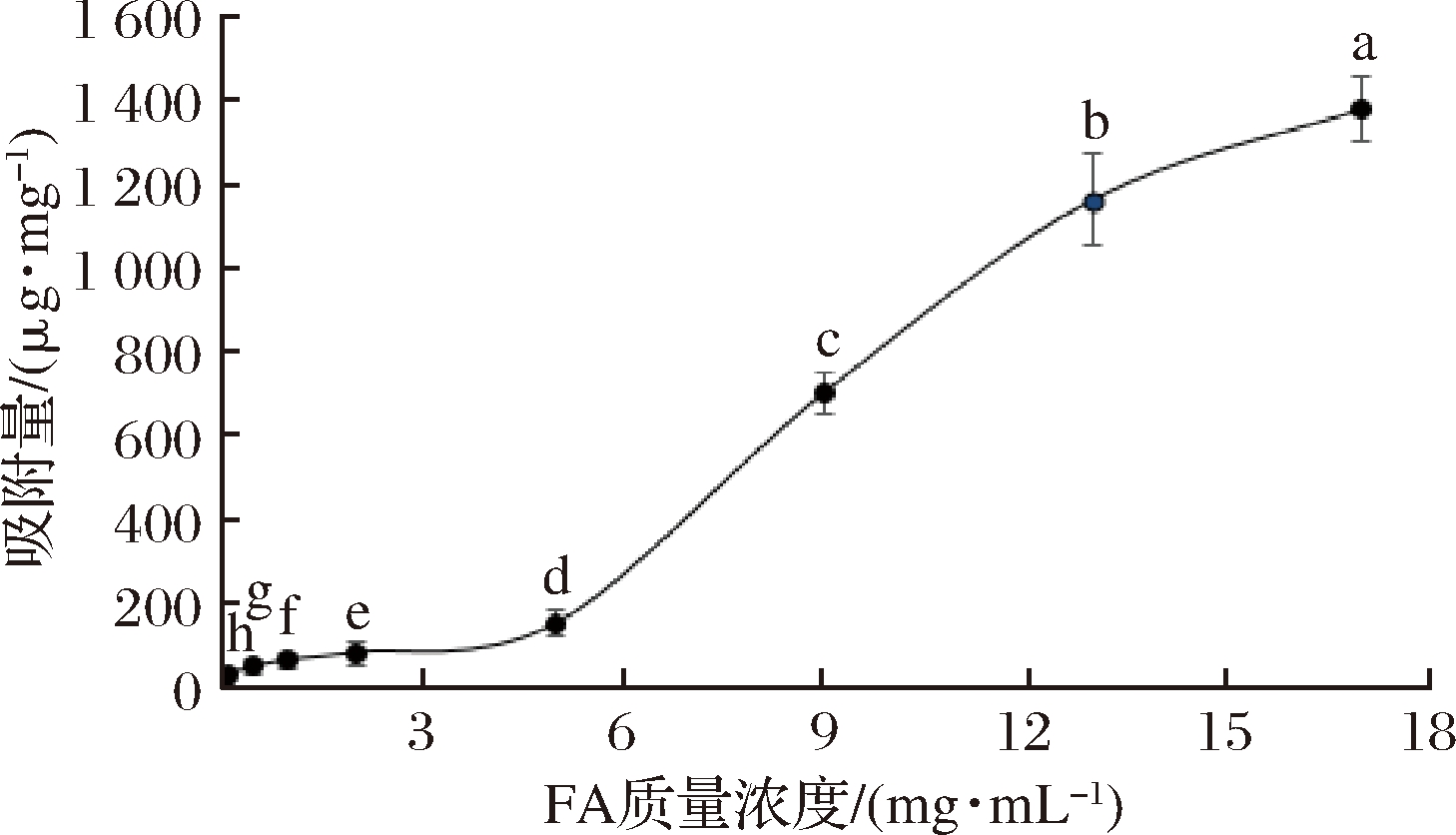
图4 FA浓度对吸附量的影响
Fig.4 Effect of the concentration of FA on the
adsorption capacity of FA on AG
2.2 响应面优化分析
以吸附量为响应值(Y),采用Design-Expert 8.0 软件进行响应面回归拟合分析,得到如表2所示的Box-Behnken试验设计方案。拟合得到的理化因素与吸附量间的模型公式为:
Y=-2 125.682 50+45.427 75X1+978.290 83X2+19.829 25X3-1.898 33X1X2-1.005 45X1X3-5.340 67X2X3+2.602 ![]()
式中:X1、X2和X3分别为FA质量浓度(mg/mL)、缓冲液pH和温度(℃)。
表2 Box-Behnken试验设计结果
Table 2 The results of central composite design

试验号X1X2X3实测吸附量/(μg·mg-1)预测吸附量/(μg·mg-1)10-1-1463.08606.3120-11440.70509.293-101411.75446.3141-10970.27861.605-1-10449.07345.92601-1968.48899.897011305.22161.998110703.11806.26910-11 385.531 350.9710101692.34723.4211-110238.86374.5312-10-1702.76662.6813000691.32713.9214000776.18713.9215000674.26713.92
对响应面模型进行方差分析,结果见表3,模型达到显著水平(P<0.05),失拟项不显著(P>0.05),失拟值和纯误差值小,R2=0.913 3,说明方程与实际情况拟合得较好,实验误差小,因此可以用该方程代替实验真实点对实验结果进行分析。方差分析还表明,一次项中有显著影响因素,而二次项所有因素影响都不显著,表明各个试验因素对响应值的影响是简单的线性关系。其中FA浓度和温度对吸附量有极显著的影响,而pH对其影响则并不明显。根据方差分析表中单因素的F值可看出,影响AG吸附FA的因素影响效果按大小排序依次为FA质量浓度(X1)>温度(X3)>pH(X2)。
表3 方差分析结果
Table 3 Analysis of variance
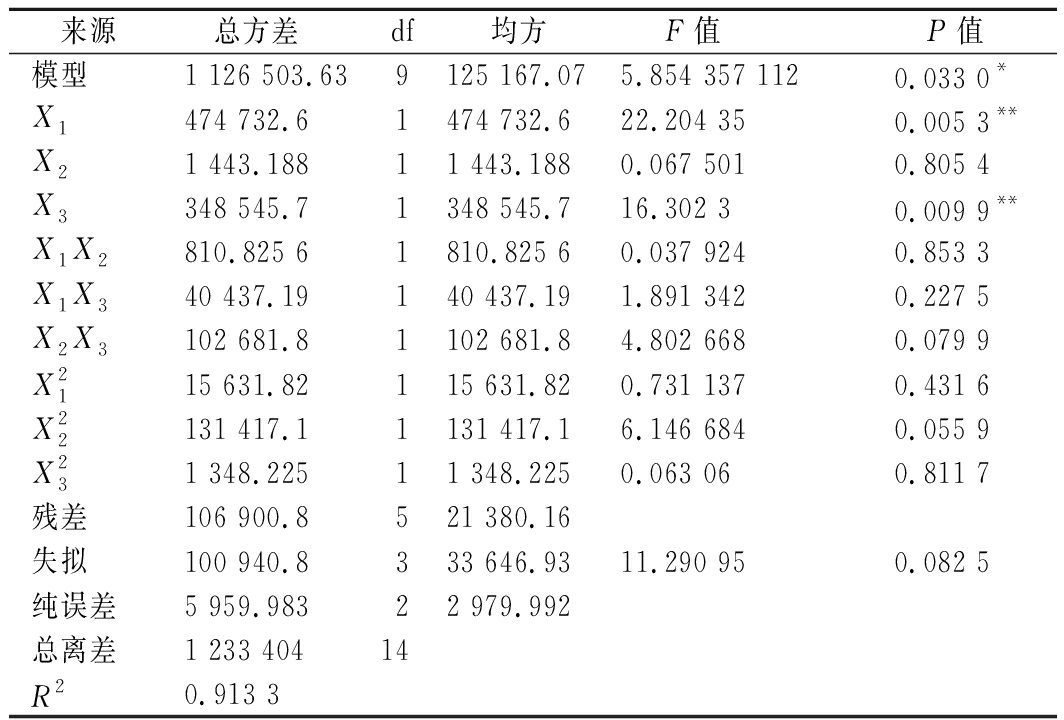
来源 总方差 df均方 F值 P值模型1 126 503.639125 167.075.854 357 1120.033 0*X1474 732.61474 732.622.204 350.005 3**X21 443.18811 443.1880.067 5010.805 4X3348 545.71348 545.716.302 30.009 9**X1X2810.825 61810.825 60.037 9240.853 3X1X340 437.19140 437.191.891 3420.227 5X2X3102 681.81102 681.84.802 6680.079 9X2115 631.82115 631.820.731 1370.431 6X22131 417.11131 417.16.146 6840.055 9X231 348.22511 348.2250.063 060.811 7残差106 900.8521 380.16失拟100 940.8333 646.9311.290 950.082 5纯误差5 959.98322 979.992总离差1 233 40414R20.913 3
注:*显著(P<0.05);**极显著(P<0.01)
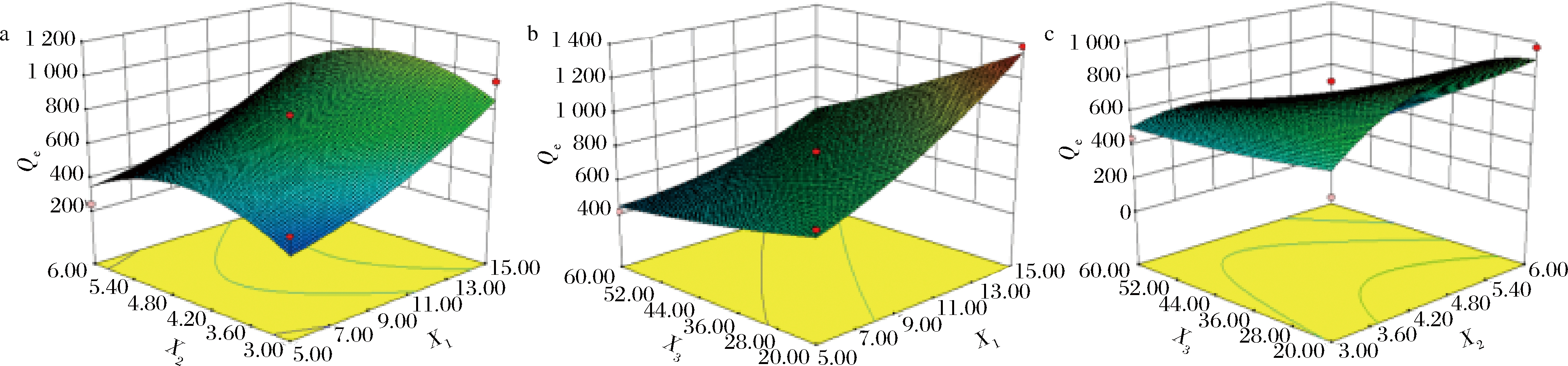
a-FA质量浓度 (X1)和pH(X2)及其相互作用;b-温度(X3)和FA质量浓度(X1)及其相互作用;c-温度(X3)和pH(X2)及其相互作用
图5 FA浓度、pH、温度及其相互作用对AG对FA的吸附能力影响
Fig.5 The infuence of FA concentration,pH,temperature and their Interaction
图5-a、图5-b、图5-c分别表示FA质量浓度、pH和温度及其相互作用对AG对FA的吸附能力影响的响应面。可以看出FA浓度、pH和温度间的交互作用不显著,其中FA浓度对吸附量的影响最为显著。根据Design Expert 8.0软件最终拟合出的最优吸附条件为FA质量浓度15 mg/mL,pH 5.03,温度20 ℃,计算出的理论吸附量是1 374.25 μg/mg。在优化后工艺的条件下进行3次验证实验,得到实际吸附量为1 370.17 μg/mg,与模型理论预测值较为接近,说明预测模型比较可靠。
2.3 样品结构表征
2.3.1 紫外图谱分析
由图6可知,FA溶液的图谱中有3个大的吸收峰,215.5 nm(λ1,芳香环的双键吸收,π-π* 跃迁产生),289.5 nm和312 nm(λ2,λ3含n电子的不饱和基团的吸收,n-π* 跃迁产生)[15],但是与复合物的图谱对比,复合物的这几个吸收峰都没有,虽然AG和复合物在190~350 nm处没有明显的吸收峰,但是它们浓度相同时吸光度不同,复合物与物理混合物的图谱也明显不同,所以初步判断AG与FA形成了复合物。
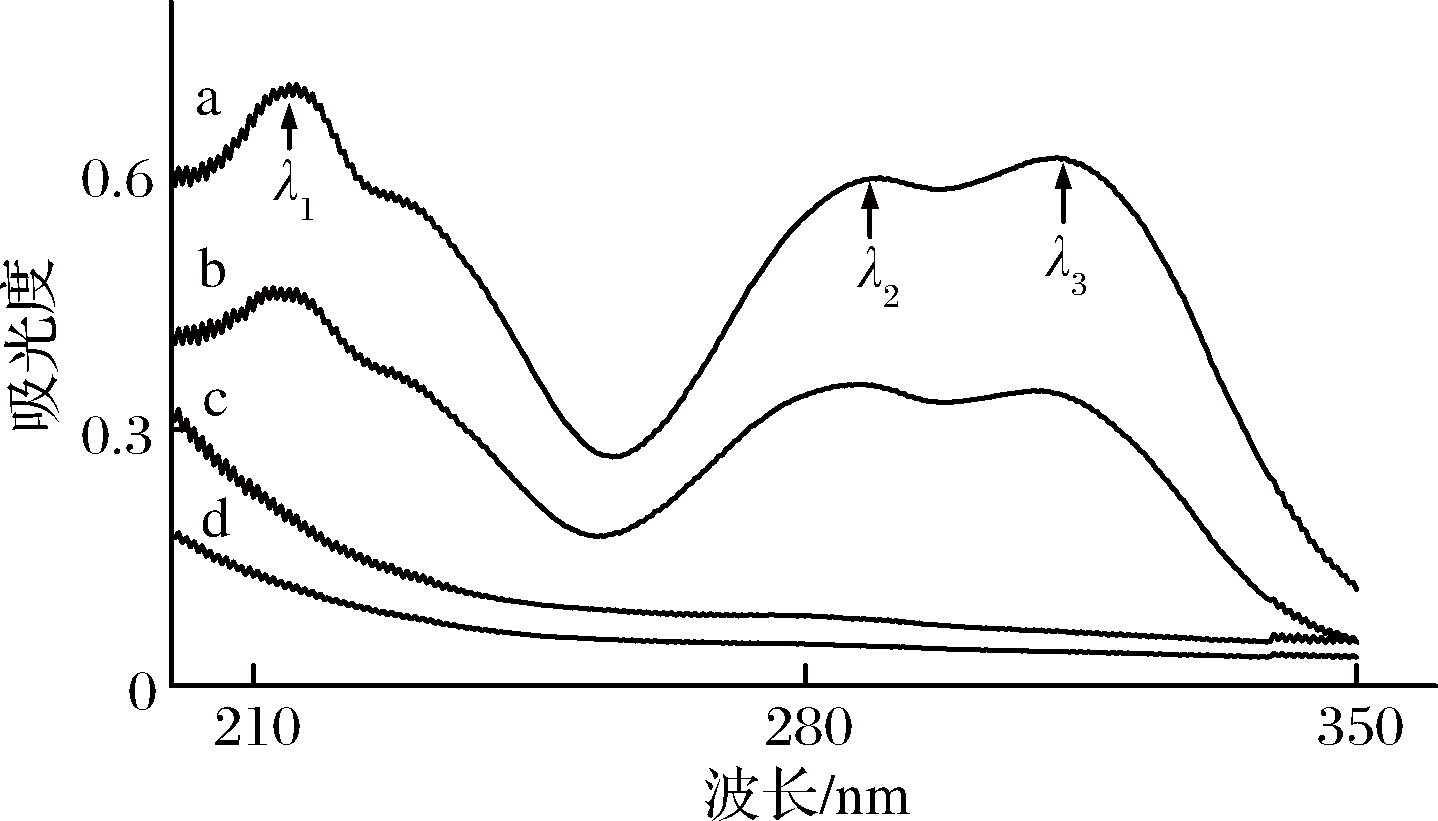
a-FA;b-物理混合物;c-AG;d-复合物
图6 紫外光谱图
Fig.6 Ultraviolet spectrogram of samples
注:λ1=215.5 nm, λ2 =289.5 nm, λ3=312 nm
2.3.2 傅里叶变换红外光谱分析
如图7所示,AG在3 400 cm-1左右的宽峰是O—H的伸缩振动,是多糖的特征吸收峰[16],2 924 cm-1 处的峰是—CH2的对称伸缩振动峰。图7中的c为FA的FT-IR图谱,与黄自知等[17]的报道完全吻合。比较图7的b和d可见,AG、FA的化学复合物与其物理混合物的FT-IR图谱有明显差异。图7中的d中物理混合物的图谱保留了FA的特征吸收峰,而图7中的b中复合物的很多FA的特征吸收峰消失,推测是由于AG对FA的非共价吸附作用所致。类似的结果在ZHANG等[5]关于菜籽果胶类多糖与阿魏酸非共价相互作用的研究中有报道。
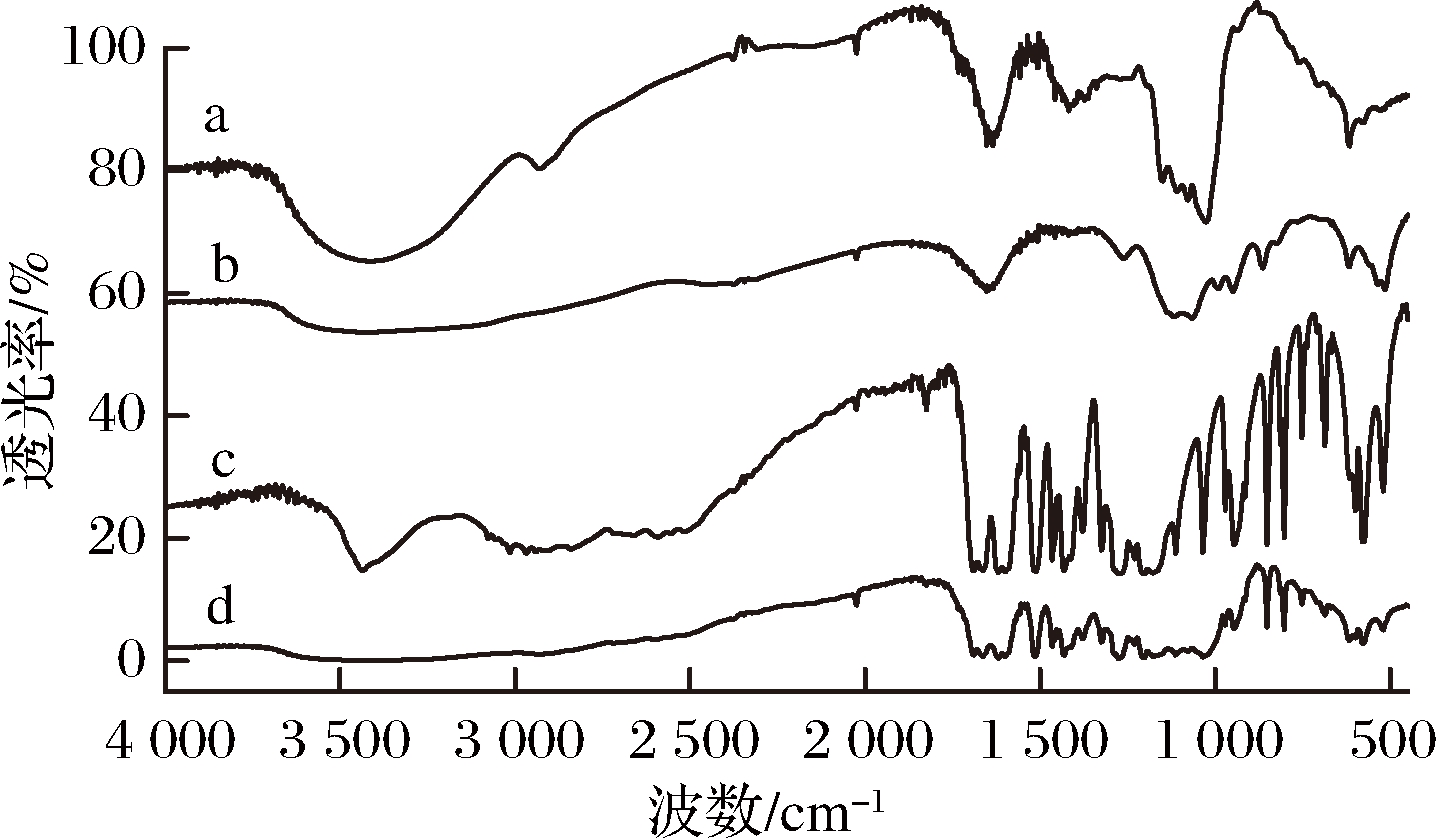
a-AG;b-复合物;c-FA;d- 物理混合物
图7 红外光谱图
Fig.7 FT-IR spectrogram of samples
2.4 扫描电子显微镜结果分析
由图8明显可以看出未结合FA的AG颗粒表面比较光滑且体积较大,物理混合物中FA晶体与AG呈分离状态,FA与AG之间未结合;而AG与FA复合物表面粗糙,FA晶体嵌入AG内,结合比较紧密,未见有游离状态的FA晶体,且复合物的颗粒较结合之前的AG小,表明AG与FA结合形成了新物质,形貌特征发生了变化。

a-AG(放大500倍);b-AG(放大2 000倍);c-复合物(放大500倍);
d-复合物(放大2 000倍);e-物理混合物(放大500倍);
f-物理混合物(放大2 000倍)
图8 样品的扫描电子显微镜图
Fig.8 Scanning electron microscope of samples
3 结论
(1)通过平衡透析实验对影响AG吸附FA效果在单因素实验的基础上进行Box-Benhnken 设计并进行响应面分析,得到各因素对吸附影响效果的大小顺序为FA质量浓度>pH>温度,优化出AG吸附FA的条件:FA质量浓度15 mg/mL、pH 5.03、温度20 ℃。在此条件下,AG吸附FA的实际值为1 370.17 μg/mg。
(2)紫外和红外扫描图表明AG与FA产生了结合作用,生成了新的复合物。扫描电子显微镜扫描图显示,与各单体、物理混合物相比,AG-FA的形貌特征发生了改变。
(3)本研究证实AG与FA结合产生了新物质,但两者之间结合的分子间作用力,复合物的高级结构和溶液性质还需进一步研究。
[1] ZHANG H, YU D, SUN J, et al. Interaction of milk whey protein with common phenolic acids[J]. Journal of Molecular Structure, 2014,1 058: 228-233.
[2] MAJKA J , SPECK C . Analysis of protein-dna interactions using surface plasmon resonance[J]. Advances in Biochemical Engineering/Biotechnology, 2007, 104:13-36.
[3] 梁彦秋, 臧树良, 赵雪. 邻苯二酚与牛血清白蛋白的相互作用[J]. 化学研究与应用, 2009, 21(2): 155-158.
[4] 黄桂东, 钟先锋. 阿拉伯半乳聚糖的研究进展[J]. 食品与机械, 2006,22(4):141-144.
[5] ZHANG D, ZHU J, YE F, et al. Non-covalent interaction between ferulic acid and arabinan-richpectic polysaccharide from rapeseed meal[J]. International Journal of Biological Macromolecules, 2017, 103: 307-315.
[6] ZHU J, HENG Y, ZHANG D, et al. Synthesis and characterization of enzymatically cross-linked feruloylamylopectin for curcumin encapsulation[J]. International Journal of Biological Macromolecules, 2016, 85: 126-132.
[7] WEN Y, YE F, ZHU J, et al. Corn starch ferulates with antioxidant properties prepared by N,N′-carbonyldiimidazole-mediated grafting procedure[J]. Food Chemistry, 2016, 208: 1-9.
[8] MATHEW S, ABRAHAM T E. Ferulic acid: an antioxidant found naturally in plant cell walls and feruloyl esterases involved in its release and their applications[J]. Critical Reviews in Biotechnology, 2004,24(2-3): 59-83.
[9] SIEW C K, WILLIAMS P A . Role of protein and ferulic acid in the emulsification properties of sugar beet pectin[J]. Journal of Agricultural and Food Chemistry, 2008, 56(11): 4 164-4 171.
[10] 张赛金,李文权,邓永智,等. 海洋微藻多糖的红外光谱分析初探[J]. 厦门大学学报:自然科学版, 2005(S1): 212-214.
[11] BERG L V D, ROSENBERG Y, BOEKEL M A J S V, et al. Microstructural features of composite whey protein/polysaccharide gels characterized at different length scales[J]. Food Hydrocolloids, 2009, 23(5): 1 288-1 298.
[12] DU N, CAO S W, YU Y Y. Research on the adsorption property of supported ionic liquids for ferulic acid, caffeic acid and salicylic acid[J]. Journal of Chromatography B, 2011, 879(19):1 697-1 703.
[13] KAMMERER D, KLJUSURIC J G, CARLE R, et al. Recovery of anthocyanins from grape pomace extracts (Vitis vinifera L. cv. Cabernet Mitos) using a polymeric adsorber resin[J]. European Food Research and Technology, 2005, 220(3-4): 431-437.
[14] AYAR A, GÜRSAL S, GÜRTEN A A, et al. On the removal of some phenolic compounds from aqueous solutions by using a sporopollenin-based ligand-exchange fixed bed-isotherm analysis[J]. Desalination, 2008, 219(13): 160-170.
[15] 常建华,董绮功. 波谱原理及解析[M]. 第三版.北京:科学出版社, 2019.
[16] ZHOU X, SUN P, BUCHELI P, et al. FT-IR methodology for quality control of arabinogalactan protein (AGP) extracted from green tea (Camellia sinensis)[J]. Journal of Agricultural and Food Chemistry, 2009, 57(12): 5 121-5 128.
[17] 黄自知,孙汉洲,孙丽,等. 阿魏酸分子结构和振动光谱的理论研究[J]. 分子科学学报, 2012, 28(2): 123-128.