米香型白酒作为我国基础香型白酒之一,感官特点为“蜜香清雅、入口柔绵、落口爽洌、回味怡畅”[1],主要呈现为乳酸乙酯、β-苯乙醇以及乙酸乙酯的复合蜜香,吸引了众多的爱好者。然而,米香型白酒酿造原料与微生物体系单一,使得酒体干净之余又风味不足,层次不够丰富饱满,给部分人一种饮之寡淡的感觉,这也是小曲酒一直以来在白酒市场中难以定位高端产品的原因之一。因此,如何增加米香型白酒的良好风味,成了相关企业的难点。
产香酵母泛指一类在生长代谢过程中可生成以酯类为代表的多种香味成分或其前体物质的酵母菌,又叫做产酯酵母或生香酵母[2-3]。近年来因其产香的特殊生理学性质而被广泛应用于食品发酵相关领域,包括烟草香料、酱醋酿造、传统面食、果酒酱发酵、白酒酿造等风味导向型产业[4-8],起到丰富香气,改善感官品质的作用,具备提升酒体感官品质的潜力。但单一种类的产酯酵母会代谢产生其特有的呈香物质,酿造过程中若只是添加单一产酯能力强的酵母,发酵产物中特定组分的浓度会增加,大大超出其风味阈值,从而破坏整体的良好感官,使白酒中出现明显的“香蕉水味”“酸臭味”等不良气味。因此对于产酯酵母的选择应该多样化,并对其相互作用进行研究,探索接种的最佳比例及方式,使得最终的发酵产品风味协调,层次丰富。同时产香酵母与小曲酿造微生物之间的相互作用常具有菌株差异性,也会受到发酵条件的影响,因此结合酿造工艺针对其发酵特性与菌株间相互作用的研究亟待开展。
以筛选得到并鉴定后的异常维克汉逊酵母、扣囊复膜酵母、克鲁维毕赤酵母、酿酒酵母4株菌作为供试菌株,在探索其生长周期、抗逆性以及发酵特性的基础上,研究了酵母间相互作用对菌体生长和关键代谢产物的影响。一方面对酵母相互作用的机理研究以及发酵动力学的进一步深入有着参考作用,另一方面使得企业生产时能准确把控整个发酵环节,解决风味的技术问题,对相关工艺的调整起着巨大的作用,这不仅能对米香型白酒生产的智能化建设提供技术支持,促进酿酒企业的发展,对整个白酒行业健康持续地发展也有着积极的意义。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株
酿酒酵母(Saccharomyces cerevisiae,SC)、克鲁维毕赤酵母(Pichia kudriazevii,PK)、异常维克汉逊酵母(Wickerhamomyces anomalus,WA)、扣囊复膜酵母(Saccharomycopsis fibuligera,SF),以上菌株均为实验室筛选鉴定得到并进行保藏的菌种。
1.1.2 培养基
酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD)(g/L):酵母膏10、蛋白胨20,葡萄糖20,琼脂2(液体培养基不加琼脂),加入纯水溶解后121 ℃下高压蒸汽灭菌20 min。
马铃薯葡萄糖琼脂培养基(Potato dextrose agar medium,PDA)(g/L):马铃薯200,葡萄糖20。马铃薯滤汁加入葡萄糖,补足水溶解后调节pH为4.5,于121 ℃下高压蒸汽灭菌20 min。
米曲汁培养基:参照毛宜详等[9]和黄慧芬[10]的方法制备。
豆芽汁培养基、麦芽汁培养基:参照陈小龙等[11]的方法制备;
麸皮浸汁培养基:参照李国生等[12]的方法制备。
1.2 仪器与设备
UV-2600紫外、可见光分光光度计,日本岛津公司;LRH-150生化培养箱,上海一恒科技有限公司;DK-98-2电热恒温水浴锅,上海虔钧科学仪器有限公司;SHA-C水浴恒温摇床,上海金鹏分析仪器有限公司;HZQ-C气浴恒温摇床,常州恒隆仪器有限公司;WZ103手持式糖度仪,浙江托普云农科技股份有限公司;FE28pH计,METTLER TOLEDO;YXQ-LS-75G全自动数显高压灭菌器,上海博迅医疗生物仪器股份有限公司;SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;BM1000生物显微镜,江南永新光学仪器有限公司;5804R台式高速冷冻离心机,艾本德中国有限公司;Vortex genie2旋涡振荡器,Scientific Industries。
1.3 实验方法
1.3.1 形态学观察
参照吴小霞[13]的方法进行形态学观察。
1.3.2 生长曲线测定
参照李宇辉等[14]的方法采取比浊法测定各菌株的生长曲线。
1.3.3 抗逆性研究
1.3.3.1 耐酸性
将4种菌株进行活化后,参照滕超等[15]的方法,把YPD液体培养基的pH用HCl和NaOH分别调节为2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5,将酵母种子液以5%的接种量接种至培养基中,于30 ℃ 培养48 h后进行测定。
1.3.3.2 耐热性
以5%接种量接种酵母活化液至三角瓶中,设置培养温度分别为20、24、28、32、36、40、44、48、52 ℃,培养48 h后,利用比浊法在600 nm处测定吸光值,以培养温度为横坐标,吸光值为纵坐标,绘制曲线,得到菌株在不同温度下的生长情况。
1.3.3.3 乙醇耐受性
用无水乙醇调节YPD液体培养基的乙醇体积分数分别为0(即不加乙醇)、3%、6%、9%、12%、15%、18%、21%,按5%接种量接种酵母活化液,于30 ℃培养48 h后,在600 nm处测定吸光值后绘制曲线,得到菌株的最高乙醇耐受浓度,对其乙醇耐受性进行评价。
1.3.3.4 糖耐受性
用葡萄糖调节YPD液体培养基的糖体积分数分别为15%、20%、25%、30%、35%、40%、45%、50%、55%,按5%接种量接种酵母活化液,于30 ℃培养48 h 后,在600 nm处测定吸光值后绘制曲线,得到菌株的最高糖耐受浓度,对其高糖耐受性进行评价。
1.3.4 发酵特性研究
1.3.4.1 总酸总酯测定
参考卢亭等[16]的方法进行测定。
1.3.4.2 发酵液乙醇浓度测定
按GB 5009.225—2016[17]中酒精度的方法进行测定。
1.3.5 菌株相互作用研究
1.3.5.1 共培养对各菌株活菌数量的影响
大部分研究证明酿酒酵母对产香酵母有抑制作用,为排除菌株差异性,考察了两者间的的相互作用。将酿酒酵母与3株产香酵母分别组合为SC-PK、SC-WA、SC-SF 3个组,分别按1×106 CFU/mL的接种量共接种至米曲汁培养基内,于30 ℃培养箱混合培养48 h后,参考HO等[18]与白梦洋等[19]的方法对共培养组中WA、SF、PK、SC 4株酵母进行平板计数。同时分别进行纯培养后计数作为对照。
同时,为研究产香酵母间的相互作用,将PK、WA、SF 3株产香酵母两两组合,用一种菌的发酵上清液对另外1种菌进行培养,研究其相互作用。取各菌株种子活化液,按1×106 CFU/mL的接种量接种至米曲汁培养基中,在150 r/min的30 ℃气浴摇床中培养24 h后,以8 000 r/min转速离心5 min取其上清液,并在超净工作台中过0.25 μm有机滤膜,备用;以组合中的一种产香酵母的发酵上清液作为培养液,按1×106 CFU/mL的接种量接种另外1株产香酵母,于30 ℃培养箱中培养48 h后,利用YPD琼脂培养基进行平板计数。同时,用糖度与发酵上清液相同的米曲汁培养基在相同培养条件下做单菌对照培养。
1.3.5.2 接种比例对共培养代谢产物的影响
活化各菌株,参照ZHA 等[20]的接种量将WA、SF、PK种子液分别以3种不同的比例(106∶106∶105CFU/mL、105∶106∶106 CFU/mL、106∶106∶106 CFU/mL)接种至米曲汁培养基中,于30 ℃下培养72 h,在第24、36、48、60、72 h取样,并过0.25 μm有机滤膜,参照标准DBS52/ 021—2016[21]中的方法测定乙醇、β-苯乙醇、乳酸乙酯、乙酸乙酯含量。同时在相同培养条件下进行单菌纯培养作为对照培养并做定量分析。
在共培体系中加入SC,将SC、WA、SF、PK的种子活化液以3种不同的比例(105∶106∶106∶106 CFU/mL、106∶ 106∶106∶106 CFU/mL、107∶106∶106∶106 CFU/mL)接种至米曲汁中,于30 ℃下培养72 h,在第24、36、48、60、72 h取样测定4种关键物质含量。同时做对照培养处理:将3株产香酵母按106∶106∶106 CFU/mL的比例进行接种,在相同培养条件下进行对照培养并做定量分析。
1.3.5.3 接种顺序对共培养代谢产物的影响
为研究制种过程中酿酒酵母与产香酵母接种顺序对混合发酵过程中关键代谢产物的影响规律,固定产香酵母的接种比例与接种方式为106∶106∶106CFU/mL,同时接种。待3株产香酵母接种完毕的第0(即同时接种)、8、12、16、20、24 h后按接种比例为106CFU/mL接种酿酒酵母,再共发酵72 h,利用气相色谱分析代谢产物含量。
2 结果与分析
2.1 菌株形态学
2.1.1 菌株菌落形态
记录各菌株单菌落基本形态,结果见表1。酿酒酵母与异常维克汉逊酵母形态相似,均为直径1~2 mm的凸起状半圆球;克鲁维毕赤酵母为4~5 mm的中间凸起状圆形菌落,扣囊复膜酵母为直径5~7 mm的均匀凸起状同心圆菌落且不易挑起,表面的假菌丝能轻松刮下,但内部呈现出果肉状的菌体,与红曲霉菌较为相似,具有一定硬度。各菌株菌落见图1。
表1 菌株的基本菌落形态
Table 1 The basic colony morphology of the yeast strains

菌株形状颜色透明度边缘整齐度光滑度菌落硬度酿酒酵母菌落凸起,圆形乳白色不透明边缘整齐表面光滑不反光,无璞膜菌落易挑起克鲁维毕赤酵母四周扁平中间凸起,圆形乳白色不透明边缘整齐表面光滑不反光,无璞膜菌落易挑起异常维克汉逊酵母菌落凸起,圆形乳白色不透明边缘整齐表面光滑不反光,无璞膜菌落易挑起扣囊复膜酵母菌落凸起,圆形白色 不透明边缘呈锯齿状表面有绒毛状假菌丝 菌落不易挑起
2.1.2 菌株细胞形态镜检图
菌株细胞形态及镜检图如图1所示。
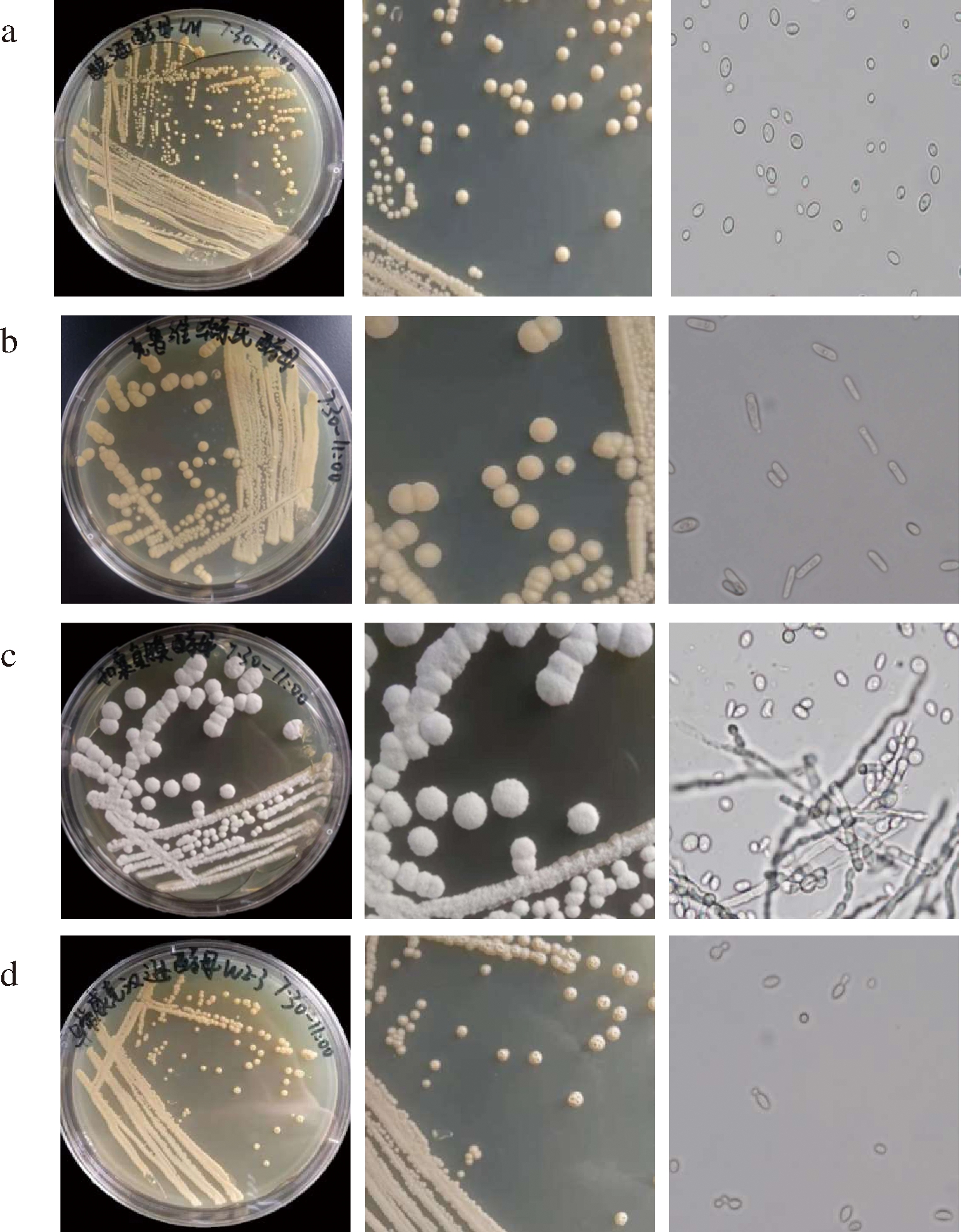
a-酿酒酵母(Saccharomyces cerevisiae);b-克鲁维毕赤酵母
(Pichia kudriazevii);c-扣囊复膜酵母(Sacharomyyees fibuligera);
d-异常维克汉逊酵母(Wickerhamomyces anomalus)
图1 菌株的菌落及细胞形态
Fig.1 The colony and cell morphology of the yeast strains
注:细胞形态图为光学显微镜1 000倍放大镜检图
2.2 菌株生长曲线
由图2可知,4株酵母的生长周期差异明显,0~4 h均处于生长延滞期,进入对数生长期后,各菌株迅速增殖,由于生长速度的不一致,菌体浓度、营养物质与生长因子的消耗速度也有所不同,生长限制到来的时间存在一定差异,在第24 h后,酿酒酵母与扣囊复膜酵母结束对数生长,率先进入稳定期,生长趋于平缓;第28 h后异常维克汉逊酵母也随之进入稳定期,而克鲁维毕赤酵母的生长速度则相对较缓,在第32 h后也进入了稳定期。

图2 酵母菌株的生长曲线
Fig.2 The growth curve of the yeast strains
对数生长期的菌体活力最强,此阶段微生物利用营养物质不断增殖,生长条件适宜的情况下,基本不会出现死亡细胞,因此菌株接种时应选择对数生长期增殖活力较强的细胞。而稳定期则是微生物累积代谢产物的阶段,通过不同方法延长稳定期有利于目标产物的生成,提高生物转化率。
2.3 菌株抗逆性
实际工业酿酒过程中,会出现不利于菌株正常生长发酵的环境胁迫,如超过适宜生长范围的高温、高酸,浓缪发酵下的高渗透压胁迫,以及代谢物累积过程中的高浓度乙醇,均会对酵母的发酵活力与增殖能力产生极大的损害,从而反向抑制发酵过程。因此,针对酵母在各种胁迫下的抗逆性进行了研究,考察了酵母的酿造潜力。
由图3可知,酿酒酵母与产香酵母在44 ℃仍能增殖,但继续提升培养温度至48 ℃,所有酵母均难以生长。能保证正常发酵的生长温度则具有一定差异性,其中酿酒酵母与异常维克汉逊酵母的最适生长温度为28 ℃,40 ℃之后则出现明显的生长受限;扣囊复膜酵母最适生长温度为32 ℃,40 ℃之后生长开始受到明显抑制,菌体增殖较少;而克鲁维毕赤酵母在升温培养的过程中,表现出了较高的热敏感性,最适生长温度为32 ℃,继续升温其生长开始受限,但其耐热性能却是4株酵母中最好的。这可能是发酵液中存在热保护性的物质,从而增加了酵母的耐热性,如糖可以作为热保护剂使酵母的耐热性能得到一定程度的提高[22]。
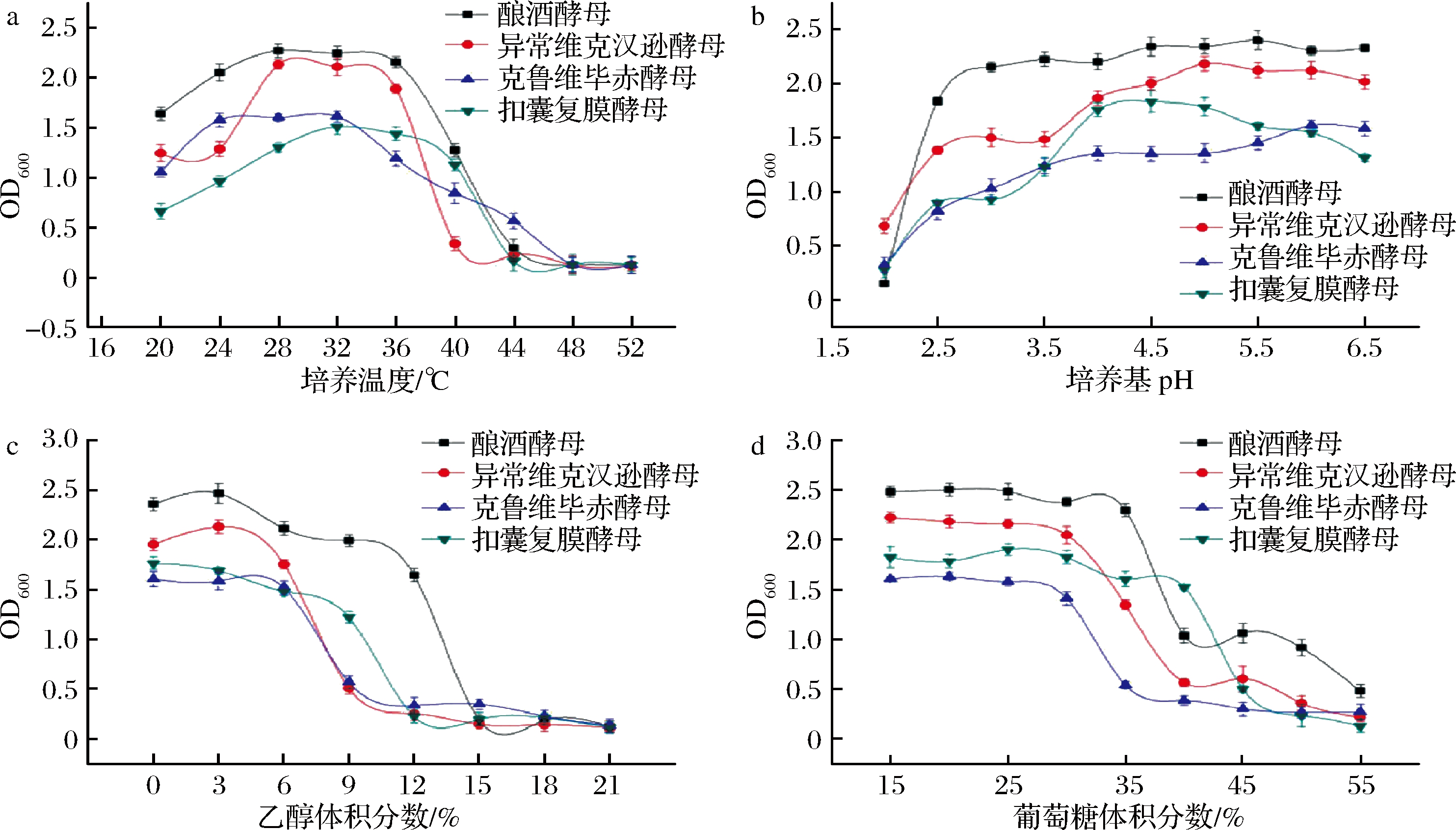
a-培养温度;b-培养基pH;c-乙醇体积分数;d-葡萄糖体积分数
图3 酵母的抗逆性测定
Fig.3 Determination on stress resistance of yeast strains
同时,4株酵母均具备良好的耐酸能力,其中异常维克汉逊酵母最适生长pH为5.0,能耐受的最低pH为2.0,耐酸性最强,其余3株酵母的最适生长pH分别为5.5、4.5、6.0,且能耐受的最低pH均为2.5。
在乙醇耐受性方面,酿酒酵母最高,在12%仍能良好生长,15%时能长但严重受抑制;扣囊复膜酵母次之,在9%能良好生长,12%能长但严重受抑制;毕赤酵母和异常维克汉逊酵母最弱,在6%能良好生长,9%能长但严重受抑制;4株酵母在乙醇体积分数达到18%后基本停止生长,其中低浓度(3%)能促进酿酒酵母与汉逊酵母生长。虽然高浓度的乙醇会通过抑制葡萄糖和氨基酸的转运,以及丙酮酸激酶和己糖激酶等关键的糖酵解酶的变性,并增加膜的通透性使酵母丧失正常的生理功能[23],但低浓度的乙醇反而对酵母生长具有促进作用,相关机理有待进一步研究。
此外,4株酵母菌也具备良好的糖耐受能力,其中扣囊复膜酵母高糖耐受性最佳,在40%糖体积分数下能良好生长,45%时受到较大生长抑制;酿酒酵母、异常维克汉逊酵母均在35%糖体积分数下能良好生长,40%时受到较大生长抑制;而毕赤酵母最弱,在30%糖体积分数下能良好生长,40%时受到较大生长抑制。高渗透压胁迫下,酵母菌会发生应激反应以调节细胞内物质与酶活力来适应不良环境[24],这对浓缪发酵具有极大意义。但暴露在极端的渗透压环境下,微生物细胞内的水分缺失,细胞发生收缩,结构受到严重破坏,从而停滞生长[25]。
2.4 菌株发酵特性
酿酒酵母与产香酵母均具备一定产酸酯和乙醇的能力,为了在之后的制曲过程中对菌株进行合理的搭配,对4株酵母产酸酯、乙醇等特性进行了研究,通过模拟米香型白酒发酵,在米曲汁培养基中接种各菌株种子液,考察了其发酵特性。
由图4可知,产乙醇的能力由强到弱依次排序为酿酒酵母、克鲁维毕赤酵母、异常维克汉逊酵母、扣囊复膜酵母,4株酵母经接种后发酵72 h,发酵液中的乙醇体积分数分别为8.0%、5.6%、3.4%、2.2%,除了酿酒酵母外,其余3株产香酵母也具备一定产酒能力;产酸的能力排序为扣囊复膜酵母>毕赤酵母>汉逊酵母>酿酒酵母,分别为3.57、2.96、1.95、1.50 g/L;产酯能力为毕赤酵母>汉逊酵母>扣囊复膜酵母>酿酒酵母,分别为3.09、2.78、2.54、0.38 g/L。

图4 酵母发酵特性的测定
Fig.4 Determination on fermentative characteristic of yeast strains
发酵体系中,一定含量的酸酯对于风味有积极的作用,加入产香酵母能显著增强发酵液中的酯含量,4株酵母中酿酒酵母具备优秀的发酵能力,其余3株产香酵母在拥有一定发酵产酒能力的同时,产酯能力可观,共发酵过程中能起到明显的增香效果。
2.5 菌株相互作用
2.5.1 酿酒酵母与产香酵母共培养对菌体生长的影响
将酿酒酵母分别与其余酵母混合培养,研究两者间相互的生长影响。由图5-a可知,3株产香酵母在与酿酒酵母共培后,体系中的活菌数量显著性下降,酿酒酵母对异常维克汉逊酵母、克鲁维毕赤酵母、扣囊复膜酵母的生长均有不同程度的抑制作用。而从图5-b中则可看出,在异常维克汉逊酵母影响下,酿酒酵母数量轻微降低;而扣囊复膜酵母与克鲁维毕赤酵母轻微促进了酿酒酵母的生长。但总体差异不具备统计学意义,可认为3株产香酵母对酿酒酵母的生长没有显著影响。
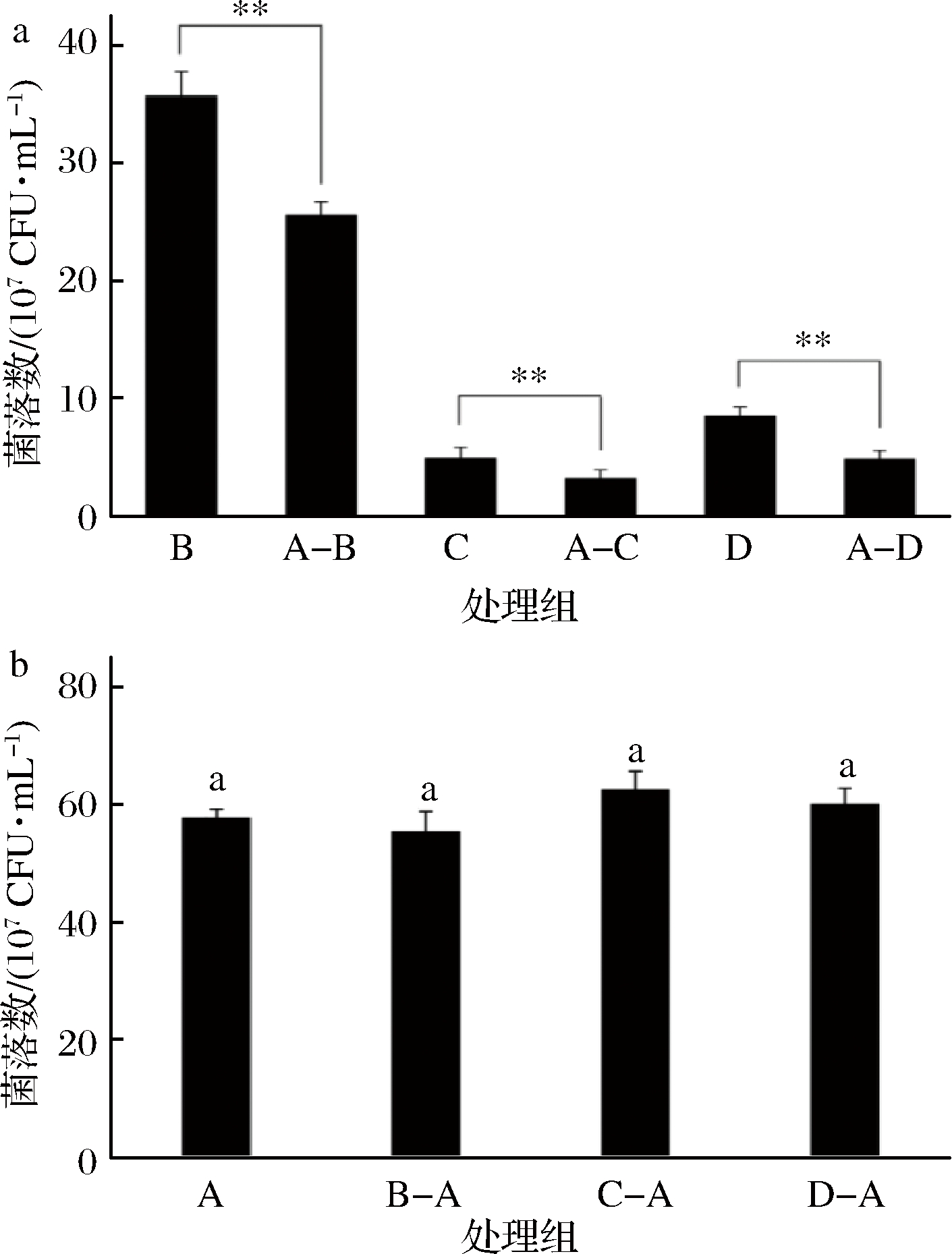
a-酿酒酵母对产香酵母生长的影响;b-产香酵母对酿酒酵母
生长的影响
图5 酿酒酵母与产香酵母相互作用对活菌数的影响
Fig.5 Effect of the interaction between
saccharomyces cerevisiae and the aroma-producing
yeast on the number of viable colony
注:**表示酿酒酵母对产香酵母的生长影响显著(P<0.05);
不同小写字母表示产香酵母对酿酒酵母的生长影响显著(P<0.05);
A、B、C、D分别表示酿酒酵母、异常维克汉逊酵母、扣囊复膜酵母、克鲁维
毕赤酵母纯培养活菌数;“A-B”表示A与B共培养后共发酵体系中B的
活菌数,A-C、A-D、B-A、C-A、D-A同理
酿酒酵母对于产香酵母的抑制作用已有很多报道,通常认为是前者的代谢产物造成了后者生长的不利条件,包括产酸与乙醇,同时高密度的细胞也对产香酵母的增殖造成了消极影响[26],但两者的相互作用也有微生物种系的差异性[27]。本实验共培养研究结果显然与这类研究相符,因此酿酒酵母可能会造成共培养体系中产香酵母的早衰。而产香酵母对于酿酒酵母在活菌数量上的影响没有显著的表现,这可能与酿酒酵母良好的乙醇耐受性有关,同时也与产香酵母的生长速度以及产乙醇的能力相关。与其余2株产香酵母相比,异常维克汉逊酵母对数期的生长速度较快,且到达稳定期后菌体浓度与酿酒酵母相差不大,可能是通过细胞间的接触对酿酒酵母产生了轻微的抑制作用,但由于酿酒酵母是前期生长的优势菌株且具备优秀的抗逆性,因此这种影响非常小。同时有研究认为,非酿酒酵母在与酿酒酵母共培养的前期能促进后者的糖与氮代谢[28],对其生长有利,这可能也是扣囊复膜酵母与毕赤酵母轻微促进酿酒酵母菌体数量增加的原因,但作用同样非常有限。
2.5.2 产香酵母间的共培养对菌体生长的影响
产香酵母种类众多且生理特性相似,当多种产香酵母作为主要功能性微生物共存于一个发酵体系中时,对其共培生长规律的探索必不可少。为研究3株酵母两两之间的共培养情况,利用菌株的单菌发酵上清作为培养液。由图6-a、图6-c可知,异常维克汉逊酵母与扣囊复膜酵母相互间的生长并无太大影响,扣囊复膜酵母与克鲁维毕赤酵母间的生长也没有显著性的抑制或促进作用。而由图6-b 可知,用克鲁维毕赤酵母的发酵上清液对异常维克汉逊酵母进行培养,显著抑制了后者的增殖;而克鲁维毕赤酵母对于异常维克汉逊酵母则无明显影响。
从两两组合的培养结果来看,3株产香酵母中,只有克鲁维毕赤酵母对于异常维克汉逊酵母的生长有显著的抑制作用。利用上清进行培养消除掉了因生长速度与周期不同带来的细胞接触抑制的可能性,而从发酵特性来看,毕赤酵母产酸与乙醇的能力均比汉逊酵母强,因此培养环境中酸胁迫与乙醇胁迫是导致后者活菌数量下降的可能原因,而对比异常维克汉逊酵母与扣囊复膜酵母的培养组合可以发现,产酸能力比克鲁维毕赤酵母强的扣囊复膜酵母同样造成了一个酸胁迫的环境,但对异常维克汉逊酵母并无明显抑制作用,因此推测乙醇是降低异常维克汉逊酵母菌体数量的主要因素。而其余菌株间的影响均不明显,这也体现了菌株的相互作用具有种系的差异,作用机制深入有待进一步研究。
2.5.3 接种比例对共培养代谢产物的影响
2.5.3.1 不同接种比例对产香酵母共培养代谢产物的影响
酿酒酵母对其余3株产香酵母具有明显的抑制性作用,而产香酵母间除了克鲁维毕赤酵母会一定程度抑制异常维克汉逊酵母生长之外,其余菌株均无明显负面影响。因此先对产香酵母间的共培养接种比例进行研究,探索不同接种比例下产香酵母代谢产物的变化规律。
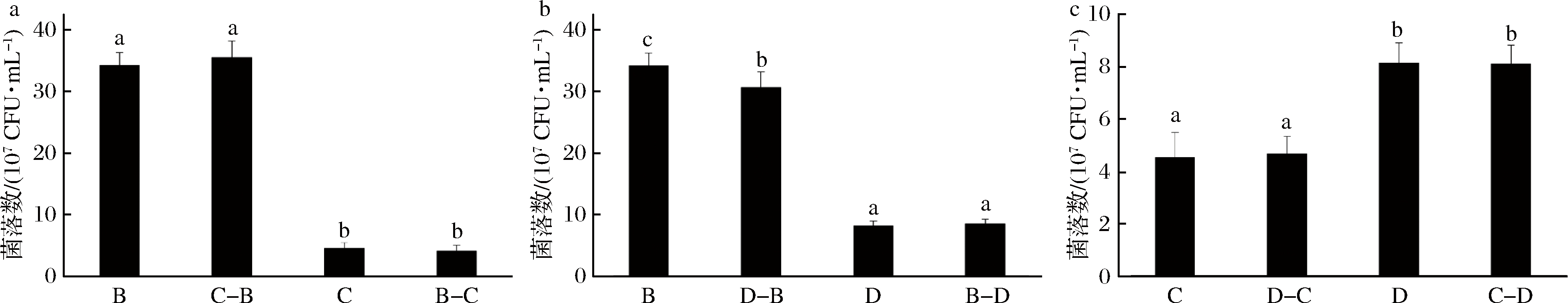
a-异常维克汉逊酵母与扣囊复膜酵母的相互影响;b-异常维克汉逊酵母与克鲁维毕赤酵母的相互影响;
c-扣囊复膜酵母与克鲁维毕赤酵母的相互影响
图6 产香酵母间相互作用对活菌数的影响
Fig.6 Effect of the interaction in the aroma-producing yeast on the number of viable colony
注:不同小写字母表示活菌数量有显著性差异(P<0.05);B、C、D分别表示异常维克汉逊酵母、扣囊复膜酵母、克鲁维毕赤酵母纯培养活菌数;
“B-C”表示以B的上清液培养C后C的活菌数,B-D、C-D同理
结合供试菌株的发酵特性并参考了已有的研究基础[20],以单菌发酵作为对照,并将异常维克汉逊酵母、扣囊复膜酵母、克鲁维毕赤酵母的种子活化液分别以3种不同的比例(106∶106∶105、105∶106∶106、106∶106∶106CFU/mL)接种至米曲汁培养基中进行发酵,结果如图7所示。

a-β-苯乙醇;b-乳酸乙酸;c-乙酸乙醇;d-乙醇
图7 不同接种比例下产香酵母共培养代谢产物的测定
Fig.7 Changes of metabolites in co-culture of the aroma-producing yeast under different inoculation ratio
注:B、C、D分别为异常维克汉逊酵母、扣囊复膜酵母、克鲁维毕赤酵母;B∶ C∶ D-105∶ 106∶ 106表示B、C、D 3株酵母的共培养接种比例分别为
105、106、106CFU/mL,其他标示同理
随着发酵时间增加,发酵液中各种风味物质的含量逐渐上升。在图7-d中,培养至60 h后,不同比例混合接种的发酵液中乙醇含量均有提高。但继续培养至72 h,各比例发酵组中乙醇均有不同程度的下降,此时接种比例为106∶106∶106CFU/mL的发酵组中乙醇质量浓度最高,达到44 773.23 mg/L。由图7-a、图7-c可知,发酵启动24 h后,不同比例的混菌发酵液中乙酸乙酯、β-苯乙醇的含量均所有提高,其中106∶106∶106CFU/mL发酵组的结果最佳,培养至72 h,分别为4 818.57、372.70 mg/L。在发酵过程中乙酸乙酯含量逐渐升高而后趋于平缓,但β-苯乙醇表现为先升后降的趋势。而乳酸乙酯的含量则有所不同,如图7-b所示,扣囊复膜酵母单菌发酵产乳酸乙酯的能力在前48 h内最强,随着发酵时间延长至72 h,105∶106∶106 CFU/mL 发酵组与106∶106∶106CFU/mL发酵组中的乳酸乙酯含量才高过扣囊复膜酵母,此时最优的发酵组比例是106∶106∶106CFU/mL,乳酸乙酯质量浓度为865.71 mg/L。综上,产香酵母不同比例的混合培养中,当接种量为106∶106∶106CFU/mL时,发酵液中乙醇、β-苯乙醇、乳酸乙酯、乙酸乙酯含量较高。
乳酸乙酯、乙酸乙酯、β-苯乙醇是米香型白酒香气与风格形成的主要物质。其中β-苯乙醇等醇类物质除了本身呈香之外,同时还是生成其他香气成分如乙酸苯乙酯的前体物,这可能也是发酵过程中其含量先增后降的一个原因。此外从乳酸乙酯的生成情况来看,扣囊复膜酵母的单菌发酵在前48 h内的产量较高,后期趋于平缓至稳定,而混菌发酵中虽然前期的产量较低,但一直保持稳定的升高。酵母的生长是代谢产物积累的必要前提,对比单菌发酵结果来看,产香酵母共培养也可能发生接触性抑制从而使得扣囊复膜酵母的生长放缓,因此前期乳酸乙酯的含量反而在单菌发酵液中较高。从单菌发酵的结果来看,克鲁维毕赤酵母的乙酸乙酯产量比其余两株菌要高,因此加大其接种的比例会一定程度上提高乙酸乙酯含量。3株产香酵母以106∶106∶106 CFU/mL的接种量进行共培养,对比各菌株的纯培养结果来看,各关键物质的含量均有所提高,这与白梦洋等[29]的研究结果有相似之处。
2.5.3.2 不同接种比例对酿酒酵母与产香酵母共培养代谢产物的影响
为进一步研究添加酿酒酵母与产香酵母共培后风味物质的变化情况,在产香酵母共培的研究基础上,固定产香酵母的接种比例为106∶106∶106 CFU/mL,探索不同的酿酒酵母的接种比例对共培代谢物的影响,结果如下。

a-β-苯乙醇;b-乳酸乙酯;c-乙酸乙酯;d-乙醇
图8 不同接种比例下酿酒酵母与产香酵母共培养代谢产物的变化规律
Fig.8 Changes of metabolites in co-culture of Saccharomyces cerevisiae and the aroma-producing yeast under different inoculation ratio
注:A、B、C、D分别为酿酒酵母、异常维克汉逊酵母、扣囊覆膜酵母、克鲁维毕赤酵母;A∶ B∶ C∶ D-105∶106∶ 106∶ 106表示A、B、C、D 4株酵母的
共培养接种比例分别为105、106、106、106CFU/mL,其他标示同理
由图8可知,对比产香酵母的混合发酵,添加酿酒酵母与产香酵母混合发酵至72 h后,发酵液中β-苯乙醇、乙醇等醇类物质的含量明显提高,但乳酸乙酯、乙酸乙酯等酯类物质的含量有不同程度的降低。在图7-d中,酿酒酵母以3种不同的比例接种到共发酵体系中,都能显著增加乙醇的含量,以其中106∶106∶106∶106、107∶106∶106∶106CFU/mL 2种接种比例较好,乙醇质量浓度分别为62 194.41、63 145.38 mg/L;β-苯乙醇的生成也具有相似的规律,如图8-a所示,其含量在106∶106∶106∶106 CFU/mL的混合接种比例中最佳,发酵72 h后达到767.75 mg/L。由图8-b、图8-c可知,在产酯方面,酿酒酵母的产酯量很低,与对照组相比,酿酒酵母的接种还降低了发酵体系中乳酸乙酯与乙酸乙酯的含量。其中106∶106∶106∶106CFU/mL接种的发酵组中乳酸乙酯相对较多,质量浓度为764.30 mg/L;同时从乙酸乙酯的生成情况来看,105∶106∶106∶106CFU/mL与106∶106∶106∶106CFU/mL 2种比例下的乙酸乙酯质量浓度较高,分别为3 918.91、3 643.93 mg/L。综合考虑发酵体系中风味物质的多样性与含量,选择106∶106∶106∶106CFU/mL作为酿酒酵母与产香酵母混合发酵的接种比例,最有利于4种关键代谢产物的产生。
从单菌发酵的结果来看,酿酒酵母是高级醇与乙醇的主要产生菌,通常认为β-苯乙醇等高级醇类物质是酵母在酒精发酵过程中通过埃利希途径产生[30],适宜浓度下具有芳香气味,对酒体的风味起着积极的作用[31]。因此酿酒酵母接种比例增大,这2种物质的含量也随之升高。但酿酒酵母与产香酵母共培养,对于酯类物质的产生起到了负面的作用,可能是因为酿酒酵母的生长抑制了产香酵母的生长,从而减少了酯类代谢物质的生成,这与菌株相互作用的研究规律相符。
2.5.4 接种顺序对共培养代谢产物的影响
考虑到接种酿酒酵母与产香酵母混合培养对共发酵体系代谢产物中的酯类物质的产生具有一定的抑制作用,因此在接种产香酵母后的0、8、12、16、20、24 h接种酿酒酵母,研究不同接种顺序下代谢产物的变化规律,找出最适合酿酒酵母的接种方式。结果如图9所示。
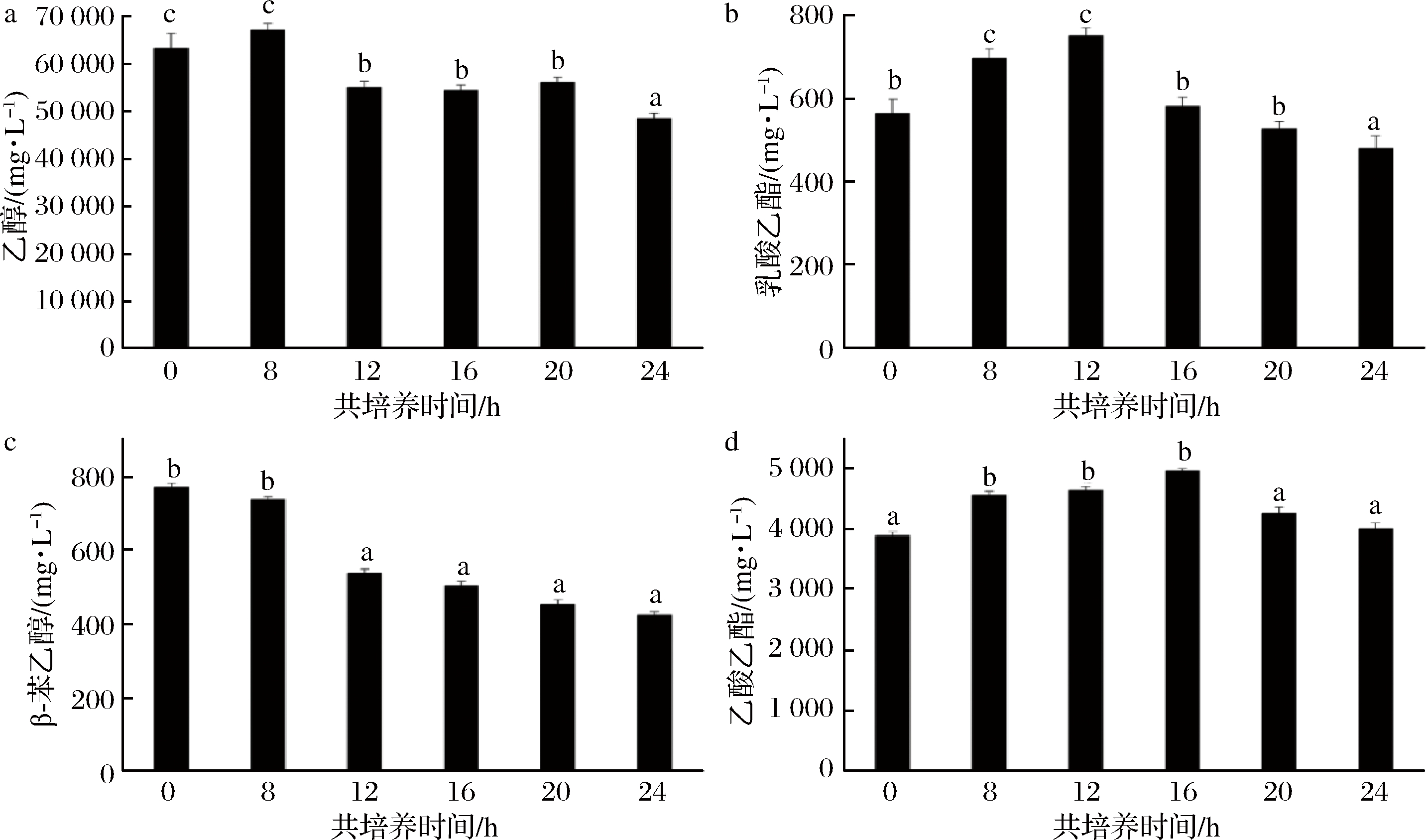
a-乙醇;b-乳酸乙酯;c-β-苯乙醇;d-乙酸乙酯
图9 不同接种顺序下酿酒酵母与产香酵母共培养代谢产物的变化规律
Fig.9 Changes of metabolites in co-culture of Saccharomyces cerevisiae and the aroma-producing yeast under different inoculation sequence
注:图中各组中不同的小写字母表示含量具有显著性差异(P<0.05)
不同接种顺序对于共发酵影响较大,如图9-a所示,随着酿酒酵母的接种时间被延后,乙醇产量呈现先升后降的趋势,在第8 h出现最大值67 242.68 mg/L;乳酸乙酯也具有一样的趋势,在第12 h有最大值753.34 mg/L;而β-苯乙醇则相反,其含量随着酿酒酵母接种时间的延后而降低;乙酸乙酯则是先升高后降低,在第16 h有最大值4 951.73 mg/L。
酿酒酵母与产香酵母的接种顺序对于4种主要的代谢产物都具有显著影响,在接种产香酵母后的8 h接种酿酒酵母,测得发酵液中乙醇、乙酸乙酯、乳酸乙酯的含量均有所提升,但β-苯乙醇含量稍微降低。这可能和酵母的生长以及发酵特性有关。3株产香酵母具有一定的产酒能力,但总体的生长受到乙醇的抑制,接种产香酵母培养一段时间后,菌株开始进入对数生长期,这一方面对酯类物质的产生具有促进作用,另一方面由于其本身也产乙醇,因此乙醇含量也有所提高,而β-苯乙醇的含量虽有所降低,但与同时接种相比并无明显差异。ESCRUBANO-VIANA等[32]的研究也发现了同样的规律,认为顺序接种对于酿酒过程中的香气具有明显的改善作用,但也具备菌株差异性。因此在混合培养时,选择在接种产香酵母后的8 h接种酿酒酵母,对于呈香物质的累积具有积极意义。
3 结论
以酿酒酵母、异常维克汉逊酵母、扣囊复膜酵母、克鲁维毕赤酵母4株菌为供试菌株,从菌株形态、生长周期、抗逆性以及发酵特性等酿造相关的生理特性进行了研究,并探索了菌株间相互作用对菌体生长与代谢的影响。
结果表明,4株菌都具备良好抗逆性;均可耐受44 ℃;PK、SF、SC均可耐受pH 2.5,WA可耐受pH 2.0;同时,PK、SF、WA均可耐受9%乙醇,而SC可耐受12%乙醇;此外,PK、SF、SC、WA可耐受的糖体积分数分别为30%、40%、35%、35%。此外在发酵特性方面,产酸能力最强的是SF,3.57 g/L;产酯能力最强的是PK,3.09 g/L;产乙醇能力最强的是SC,发酵液中乙醇体积分数为8.0%。
共培养结果表明,酿酒酵母对于其余3株产香酵母的生长均有抑制作用,而产香酵母对于酿酒酵母的生长则没有明显的影响。在异常维克汉逊酵母与克鲁维毕赤酵母的组合中,后者的代谢产物显著抑制了前者的生长,而异常维克汉逊酵母并无明显抑制克鲁维毕赤酵母生长的现象,其余的菌株组合中均未出现显著的抑制或者促进作用。同时,共培养时产香酵母的最优接种比例为106∶106∶106CFU/mL,酿酒酵母最优接种比例为106CFU/mL,在接种产香酵母8 h后进行酿酒酵母的接种,共培养发酵液中风味物质的含量最优,对于米香型白酒的香气有积极的作用。
[1] 崔维东, 李勇, 张晓梅. 米香型白酒-苯乙醇蒸馏曲线[J]. 酿酒, 2008, 35(6): 99.
[2] 张会娟, 张首玉, 邱聪, 等. 一株产酯酵母的鉴定及发酵性能研究[J]. 河南工业大学学报(自然科学版), 2015, 36(2): 23-27.
[3] 王益姝. 生香酵母及其面团发酵过程与面包香气特征研究[D]. 无锡: 江南大学, 2016.
[4] 王充. 热醇化和产香酵母发酵对烟草薄片浓缩液品质的影响及应用研究[D]. 郑州: 郑州轻工业学院, 2018.
[5] 邹谋勇, 朱新贵, 刘丹, 等. 产2-苯乙醇酵母的鉴定及其在酱油发酵中的应用[J]. 食品科学, 2019, 40(6): 217-222.
[6] 王益姝, 钱超, 黄卫宁, 等. 梅兰春酒醅中生香酵母的分离鉴定及其发酵面包香气成分分析[J]. 食品与发酵工业, 2016, 42(9): 45-51.
[7] 申光辉, 冯孟, 张志清, 等. 生香酵母发酵桑葚低糖复合果酱工艺优化及风味、抗氧化活性变化分析[J]. 江苏农业学报, 2018, 34(3): 669-678.
[8] 罗小叶, 邱树毅, 陆安谋, 等. 酱香大曲产香酵母的分离及鉴定[J]. 食品与发酵工业, 2016, 42(12): 26-31.
[9] 毛宜祥, 郑翠萍. 怎样制好米曲汁培养基[J]. 上海调味品, 1990(1):31.
[10] 黄慧芬. 米香型白酒酿造产香酵母的筛选鉴定及其产酯规律研究[D]. 长沙: 中南林业科技大学, 2018.
[11] 陈小龙, 王远山, 郑裕国, 等. 腺苷蛋氨酸发酵条件及发酵培养基的优化[J]. 中国生物工程杂志, 2004, 24(11): 64-68.
[12] 李国生, 曲玲, 任海霞, 等. 野生灵芝组织分离研究初报[J]. 山东农业科学, 2008(4): 45-46.
[13] 吴小霞. 乳酸菌对老面馒头品质的影响及其淀粉消化特性研究[D]. 长沙: 中南林业科技大学, 2019.
[14] 李宇辉, 郭安民, 刘成江, 等. 伊犁牧区传统发酵乳制品中产香酵母菌的分离及香气成分分析[J]. 食品与发酵工业, 2016, 42(11): 179-184.
[15] 滕超, 曲玲玉, 师雨梦, 等. 传统面食发酵剂中酵母菌的筛选及性能研究[J]. 中国食品学报, 2017, 17(11): 74-81.
[16] 卢亭, 何计龙, 夏慧丽, 等. 水浴静置皂化法测定白酒中的总酯[J]. 食品研究与开发, 2016, 37(23): 154-156.
[17] 中华人民共和国国家卫生和计划生育委员会. GB 5009.225—2016 食品安全国家标准 酒中乙醇浓度的测定[S]. 北京: 中国标准出版社, 2016.
[18] HO V T T, ZHAO J, FLEET G. Yeasts are essential for cocoa bean fermentation[J]. International Journal of Food Microbiology, 2014, 174:72-87.
[19] 白梦洋, 吴祖芳, 李若云, 等. 混合培养条件下酿酒酵母菌与毕赤酵母菌的相互影响[J]. 食品科学, 2017, 38(12): 9-14.
[20] ZHA M S, SUN B G, WU Y P, et al. Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Wickerhamomyces anomalus for Chinese Baijiu making[J]. Journal of Bioscience and Bioengineering, 2018, 126(2): 189-195.
[21] 贵州省卫生和计划生育委员会. DBS52/ 021—2016 食品安全地方标准 白酒中甲醇、高级醇类和酯类的同时测定 气相色谱法 [S]. 贵州: 中国标准出版社, 2016.
[22] ZHENG F L,ZHANG W W, SUI Y A, et al. Sugar protectants improve the thermos tolerance and biocontrol efficacy of the biocontrol yeast, Candida oleophila[J]. Frontiers in Microbiology, 2019, 10: 1-8.
[23] UDOM N, CHANSONGKROW P, CHAROENSAWAN V, et al. Coordination of the cell wall integrity and high-osmolarity glycerol pathways in response to ethanol stress in Saccharomyces cerevisiae[J]. Applied and Environmental Microbiology, 2019, 85(15): e00551-19.
[24] 毕新煜, 刘功良, 姜弘佳, 等. 酵母菌高糖耐受机制的研究进展[J]. 中国酿造, 2017, 36(10): 1-4.
[25] MAGER W H, SIDERIUS M. Novel insights into the osmotic stress response of yeast[J]. FEMS Yeast Research, 2002, 2(3): 251-257.
[26] 曾朝珍, 康三江, 张霁红, 等. 混菌发酵体系中异常汉逊酵母生长抑制机制研究[J]. 中国农业科技导报, 2019, 21(3): 48-53.
[27] WANG C X, MAS A, ESTEVE-ZARZOSO B. The interaction between Saccharomyces cerevisiae and non-Saccharomyces yeast during alcoholic fermentation is species and strain specific[J]. Frontiers in Microbiology, 2016, 7: 1-11.
[28] CURIEL J A, MORALES P, GONZALEZ R, et al. Different non-Saccharomyces yeast species stimulate nutrient consumption in S. cerevisiae mixed cultures[J]. Frontiers in Microbiology, 2017, 8: 502.
[29] 白梦洋, 吴祖芳, 李若云, 等. 果酒酵母菌多菌种混合培养的生长规律及挥发性风味物质的差异性分析[J]. 中国食品学报, 2019, 19(5): 214-221.
[30] HAZELWOOD L A, DARAN J-M, MARIS A J A V, et al. The Ehrlich pathway for fusel alcohol production: A century of research on Saccharomyces cerevisiae metabolism[J]. Applied & Environmental Microbiology, 2008, 74(8): 2 259-2 266.
[31] GONZ LEZ B, V
LEZ B, V ZQUEZ J, MORCILLO-PARRA M á, et al. The production of aromatic alcohols in non-Saccharomyces wine yeast is modulated by nutrient availability[J]. Food Microbiology, 2018, 74: 64-74.
ZQUEZ J, MORCILLO-PARRA M á, et al. The production of aromatic alcohols in non-Saccharomyces wine yeast is modulated by nutrient availability[J]. Food Microbiology, 2018, 74: 64-74.
[32] ESCRIBANO-VIANA R, GONZ LEZ-ARENZANA L, PORTU J, et al. Wine aroma evolution throughout alcoholic fermentation sequentially inoculated with non-Saccharomyces/Saccharomyces yeasts[J]. Food Research International,2018, 112: 17-24.
LEZ-ARENZANA L, PORTU J, et al. Wine aroma evolution throughout alcoholic fermentation sequentially inoculated with non-Saccharomyces/Saccharomyces yeasts[J]. Food Research International,2018, 112: 17-24.