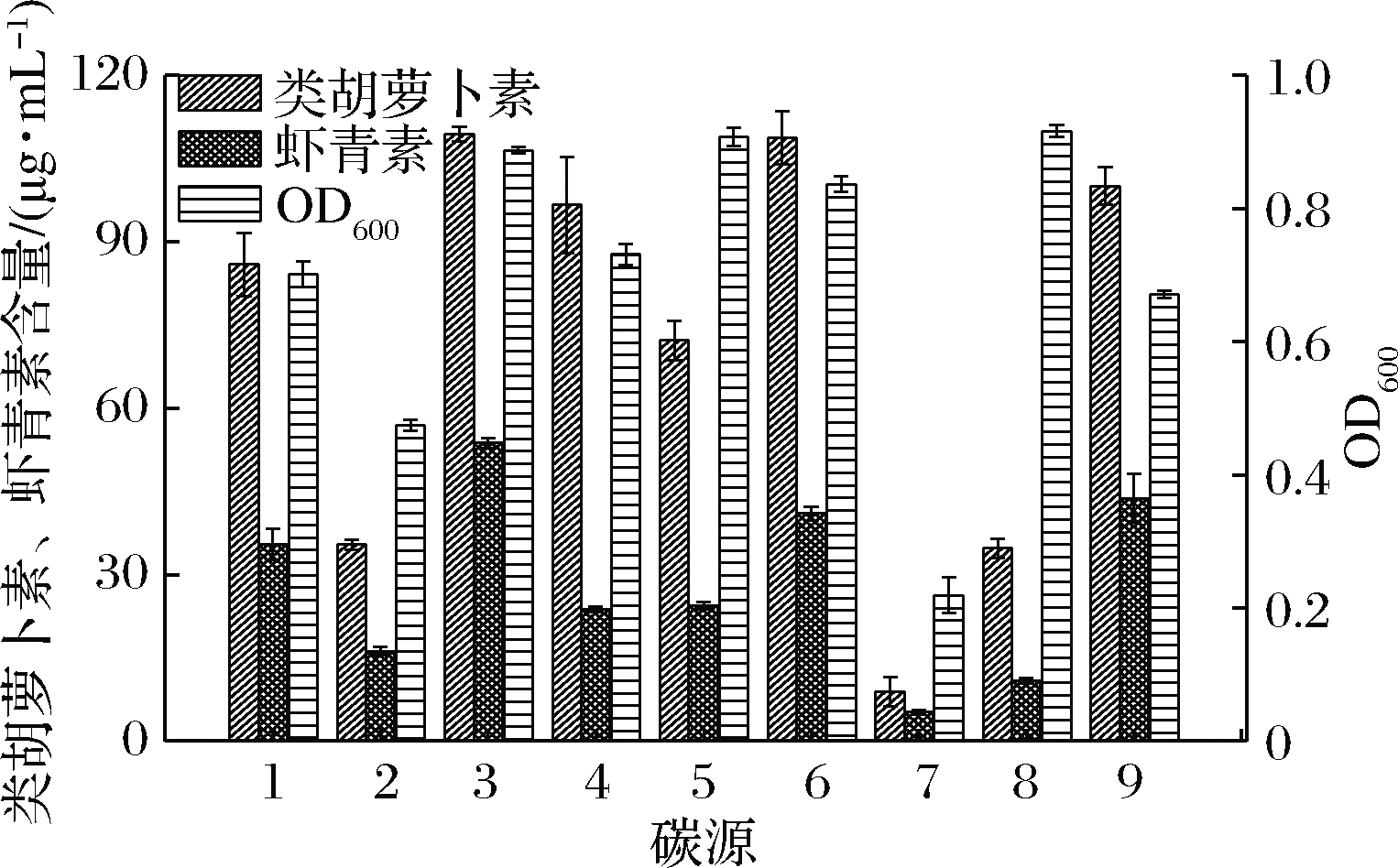
1-甘油;2-可溶性淀粉;3-麦芽糊精;4-蔗糖;5-葡糖糖;6-麦芽糖浆;
7-乳糖;8-糖蜜;9-淀粉水解液
图1 不同碳源对法夫酵母生长及虾青素合成的影响
Fig.1 Effects of different carbon sources on the growth of
P.rhodozyma and the production of astaxanthin
虾青素 (astaxanthin),3,3′-二羟基-β, β′-胡萝卜素-4,4′-二酮,属于酮式类胡萝卜素,因其分子结构中紫罗酮环的3和3′位置各含一个手性 (或不对称) 中心,故可形成3种对映异构体,即3S-3′S、3R-3′S和3R-3′R (也称为左旋、内消旋和右旋)[1]。化学合成虾青素为上述3种异构体的混合物。
法夫酵母 (Phaffia rhodozyma) 作为虾青素的重要来源,其抽提物被证明具有安全性[2],美国食品药品监督管理局于2010年增补其用作动物饲料添加剂,亦于2013年进入中国农业部《饲料添加剂品种目录》。基于虾青素卓越的提高免疫、抵抗衰老和增加活力的功能,在美容、医药和养殖等领域呈现日益旺盛的市场需求和广阔前景。受制于法夫酵母发酵生产虾青素存在培养温度低、产量低、碳源消耗大和耗氧水平高等问题,商业化进程受到严重阻碍,因此,学术界和产业界围绕基因组特性[3]、菌株筛选[4-5]、代谢改造[6-7]、培养基优化[8-9]、促进因子筛选[10-12]、环境胁迫[13-16]和发酵过程控制[12, 17-18]等方面进行了全面研究。在法夫酵母发酵工艺方面,针对碳源的研究已相当广泛。AN等[19]用含尿素和NaH2PO4的糖蜜作原料,在100 L中试规模发酵罐上最大生物量为36 g/L,类胡萝卜素产量为40 mg/L;NGHIEM等[20]研究了5株法夫酵母对含葡萄糖、木糖和阿拉伯糖的玉米纤维水解糖的利用,发现利用阿拉伯糖时虾青素产量最高,而高浓度的葡萄糖会抑制其他2种糖的利用;PAN等[21]在固定氮源浓度的条件下应用蛋白质组学方法研究了C/N对法夫酵母细胞生长和虾青素积累的影响,得出虾青素的产量与C/N呈负相关,随C/N的增大而降低,比较蛋白组学研究则表明上述不同C/N条件下,涉及碳水化合物代谢和胡萝卜素生成代谢的途径发生较大变化;MIAO等[22]也报道了高糖浓度通过胡萝卜素合成基因全局性调节因子creA,诱导胡萝卜素合成基因crtE、pbs和ast的表达受到抑制。
基于上述法夫酵母发酵生产虾青素过程中碳源占比高,碳源种类和浓度对菌体生理特性和虾青素产量影响大的认识,本研究对实验室保藏的1株具有商业化生产前景的法夫酵母进行碳源种类、组合对虾青素产量和虾青素占类胡萝卜素比例的影响进行考察,确定了碳源控制工艺,并在10 m3发酵罐上进行中试放大,为本菌株商业化生产提供技术支撑。
1.1.1 菌株
Phaffia rhodozyma XC3015由上海来益生物药物研究开发中心有限责任公司赠送,保藏于浙江医药股份有限公司新昌制药厂生物药物实验中心。
1.1.2 试剂
蛋白胨、麦芽抽提物,英国OXOID公司;葡萄糖,西王药业股份有限公司;麦芽糊精,山东西王糖业有限公司;糖蜜,济南昌英达化工有限公司;乳酸,安徽丰原生物化学股份有限公司;(NH4)2SO4、KH2PO4、MgSO4·7H2O,江苏紫东食品有限公司;酵母抽提物FM902,安琪酵母股份有限公司;麦芽糖浆,诸城市润生淀粉有限公司;玉米淀粉,诸城兴贸玉米开发有限公司;泡敌,江山宇轩科技有限公司;虾青素标样,Sigma-Aldrich (中国) 公司;α-淀粉酶,北京奥博星生物技术有限责任公司;其他试剂均为国药集团化学试剂有限公司。
固体培养基:YM培养基,成分参考文献[23],加入20 g/L琼脂。
种子培养基:YM培养基。
发酵培养基 (g/L):碳源 20.0、(NH4)2SO4 3.0、KH2PO41.0、MgSO4·7H2O 0.5、CaCl2·2H2O 0.1、酵母抽提物 1.0、乳酸 5.0、泡敌 0.1。碳源指葡萄糖、麦芽糊精、可溶性淀粉、甘油、蔗糖、麦芽糖浆、乳糖、糖蜜和玉米淀粉水解液中的一种或其组合。
发酵罐补糖培养基 (g/L):70 L发酵罐为葡萄糖或/和麦芽糊精 400 (补糖培养基葡萄糖与麦芽糊精比例同基础料葡萄糖与麦芽糊精比例,具体根据实验设计);10 m3发酵罐为葡萄糖 175、麦芽糊精 175、糖蜜 50。
种子、发酵培养基消前用2 mol/L NaOH溶液调pH值6.0。所有培养基碳源、氮源分消,灭菌条件为121 ℃,30 min。
电子天平 (MS12001L/01型),瑞士梅特勒-托利多公司;高效液相色谱仪 (1200型),美国安捷伦科技有限公司;摇床 (Inno a 5000型)、离心机 (MiniSpin型),Eppendorf公司;紫外可见分光 (U -2600A型),尤尼柯 (上海) 仪器有限公司;小试种子罐 (BIOTECH-30 JS型),上海保兴生物设备工程有限公司;小试发酵罐 (LiFlus SP-70L型),Biotron公司;中试种子罐 (1 000 L型)、中试发酵罐 (10 m3型),江苏远方迪威尔设备科技有限公司。
1.4.1 培养方法
平板培养:取冷冻甘油保藏液进行平板划线,于20.5 ℃条件下培养5~7 d,长出较大菌落。
种子瓶培养:用接种环蘸取3~5个颜色较红、菌落较大的单菌落,接种于种子培养基 (10 mL/50 mL试管),于20.5℃、200 r/min条件下振荡培养48 h。取2.5 mL上述试管培养液二次接种于种子培养基 (22.5 mL/250 mL三角瓶),于20.5℃、200 r/min条件下振荡培养36 h,获得成熟种子瓶培养液。
发酵瓶培养:取二级成熟种子瓶培养液,按10%(体积分数)的比例接种于发酵培养基 (45 mL/500 mL三角瓶),于20.5℃、200 r/min条件下振荡培养120 h。
30 L种子罐培养:取二级成熟种子瓶培养液,按1.0%(体积分数)的比例接种于种子培养基 (20 L/30 L种子罐),于温度 (20.5±0.2) ℃、搅拌转速350 r/min、通气比1.5 m3/(m3·min)、罐压0.06 MPa条件下培养40 h。
70 L发酵罐培养:将成熟种子罐培养液按10%(体积分数)的比例移种于发酵罐 (30 L/70 L发酵罐),培养温度(20.5±0.2)℃、通气比0.6~1.5 m3/(m3·min)、罐压0.06 MPa,全程用25%~28%氨水控制pH值为5.00±0.02,搅拌转速与溶氧联动,关联值为40%。发酵过程中,当碳源质量浓度低于10 g/L时补加40%的碳源,维持碳源质量浓度为5~15 g/L之间。定期取样测定菌体浓度、碳源浓度、类胡萝卜素和虾青素产量。
1 m3种子罐培养:1 m3种子罐0.5 m3计料,搅拌转速200 r/min、通气比1 m3/(m3·min),其他条件同30 L种子罐培养。
10 m3发酵罐培养:10 m3发酵罐3.6 m3计料,起始搅拌转速80 r/min,通气比0.3~1.5 m3/(m3·min),当溶氧低于20%时每次提高搅拌转速10~20 r/min,控制溶氧水平在20%~60%,其他条件同70 L发酵罐培养。
1.4.2 测定方法
类胡萝卜素检测:采用分光光度法,参考文献[24]。
虾青素高效液相色谱法测定:参考文献[25]。
菌体浓度检测:对发酵液进行适当稀释,测定波长600 nm处吸光度,根据光密度与细胞干重 (g/L) 的比值为(2.50±0.10),确定细胞干重[23]。
总糖/还原糖检测:按照菲林试剂法测定[26]。
1.4.3 淀粉水解液的制备
制备40%玉米淀粉浆,调pH值至6.20~6.40,加入0.2% CaCl2 (按原料质量计算),然后将α-淀粉酶加入淀粉浆中(用酶量6~8 U/g),200 r/min搅拌,加热至85~90 ℃,液化30 min。
试验均平行重复3次,试验数据均以平均值±标准差形式表示,采用Origin Pro 8.5软件进行数据处理、绘制试验结果图。
以工业发酵常用的葡萄糖、麦芽糊精、可溶性淀粉、甘油、蔗糖、麦芽糖浆、乳糖、糖蜜和玉米淀粉水解液作为碳源,在上述碳源质量浓度均为20 g/L的条件下,考察大宗碳源对法夫酵母细胞生长、虾青素及类胡萝卜素合成的影响,结果如图1所示。

1-甘油;2-可溶性淀粉;3-麦芽糊精;4-蔗糖;5-葡糖糖;6-麦芽糖浆;
7-乳糖;8-糖蜜;9-淀粉水解液
图1 不同碳源对法夫酵母生长及虾青素合成的影响
Fig.1 Effects of different carbon sources on the growth of
P.rhodozyma and the production of astaxanthin
由图1可知,不同碳源对法夫酵母细胞生长有显著影响。考察的9种大宗碳源中,糖蜜、葡萄糖、麦芽糊精和麦芽糖浆更有利于法夫酵母细胞的生长。比较法夫酵母类胡萝卜素的合成能力,所考察碳源按麦芽糊精、麦芽糖浆、淀粉水解液、蔗糖、甘油、葡萄糖、可溶性淀粉、糖蜜和乳糖的顺序依次降低。由于不同碳源条件下虾青素占类胡萝卜素比例不同,因此虾青素产量不完全与类胡萝卜素含量成正比。虾青素产量最高的碳源分别为麦芽糊精、淀粉水解液、麦芽糖浆,分别为 (53.7±0.9)、(43.7±4.3)、(41.0±1.2) μg/mL,较葡萄糖作碳源时的 (24.4±0.7) μg/mL分别提高120.0%、79.1%、68.0%。虽然,乳糖作碳源时虾青素产量较低,但虾青素占类胡萝卜素比例最高,达到58.9%,而麦芽糊精、可溶性淀粉和淀粉水解液次之,最低的为蔗糖,虾青素占类胡萝卜素比例仅为24.6%。
基于上述不同碳源影响法夫酵母细胞生长、虾青素合成和虾青素占类胡萝卜素比例的认识,较优虾青素占类胡萝卜素比例前提下的虾青素产量提升是产品收率提高的重要保证,因此,进一步考察了有利于细胞生长的碳源组合 (葡萄糖和糖蜜)和虾青素占类胡萝卜素比例提高的2类碳源组合的影响。参考相关报道[27]和单因素试验,选取糖蜜质量浓度为5 g/L,依次与有利于虾青素占类胡萝卜素比例提高的碳源 (均为15 g/L) 组合,对应地,选取葡萄质量糖浓度亦为5 g/L,依次与有利于虾青素占类胡萝卜素比例提高的碳源 (均为15 g/L) 组合,进行发酵瓶实验,结果如图2所示。
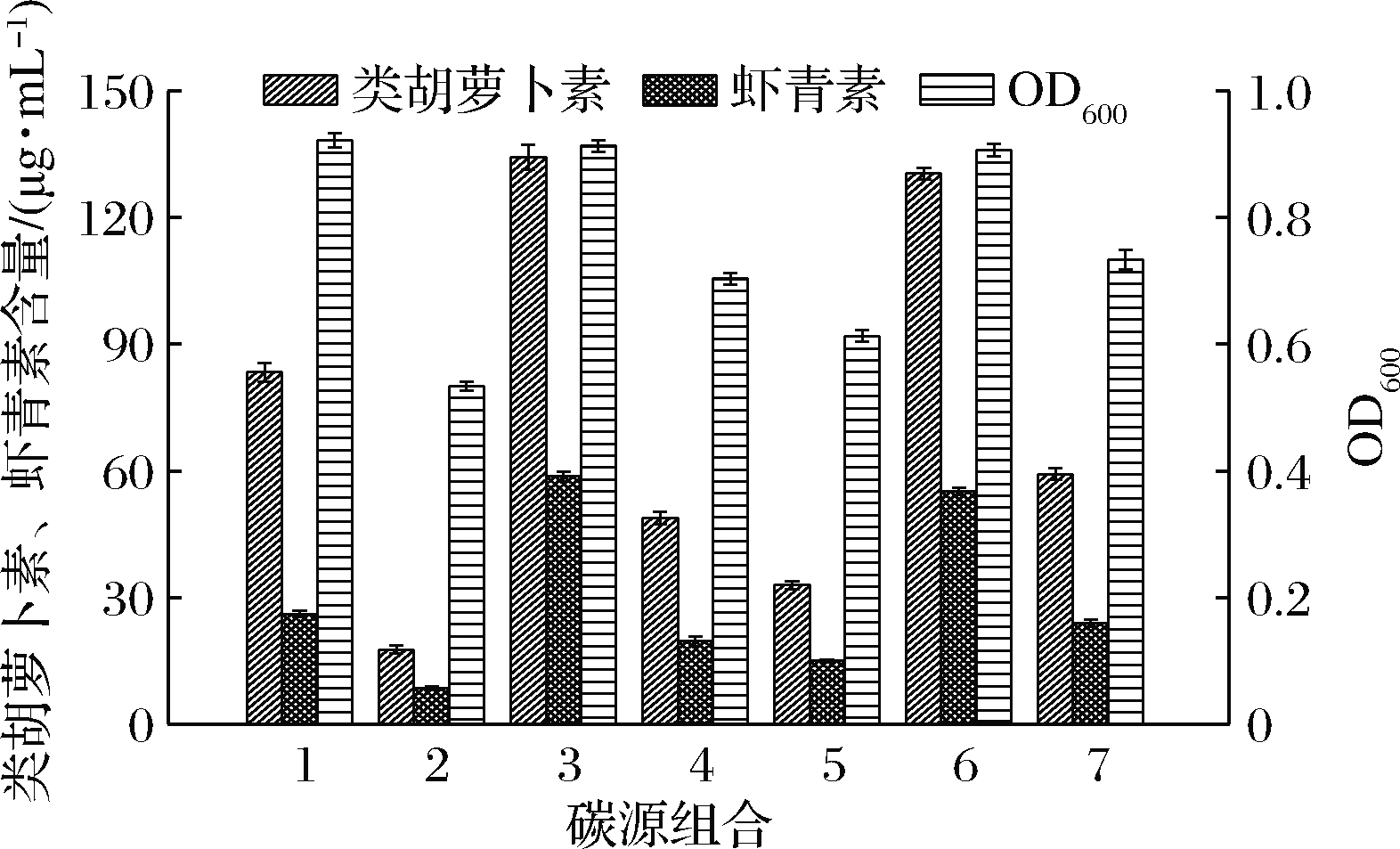
1-糖蜜+葡萄糖;2-糖蜜+乳糖;3-糖蜜+麦芽糊精;4-糖蜜+
可溶性淀粉;5-葡萄糖+乳糖;6-葡萄糖+
麦芽糊精;7-葡萄糖+可溶性淀粉
图2 不同碳源组合对法夫酵母生长及虾青素合成的影响
Fig.2 Effects of different combinations of carbon sources on the
growth of P.rhodozyma and the production of astaxanthin
糖蜜与葡萄糖、乳糖、麦芽糊精或可溶性淀粉组合时,菌体浓度均有不同程度的提高,且虾青素产量分别为 (26.1±0.8)、(8.5±0.4)、(58.7±1.2)、(19.6±1.2) μg/mL,较后四者单独作碳源时分别提高6.7%、62.4%、9.2%、20.7%,类胡萝卜素产量则分别为 (83.3±2.2)、(17.6±1.0)、(134.3±3.0)、(48.7±1.5) μg/mL,分别提高15.4%、98.2%、22.8%、37.7%。虽然,糖蜜可以促进菌体生长及虾青素、类胡萝卜素的合成,但虾青素占类胡萝卜素的比例较葡萄糖、乳糖、麦芽糊精或可溶性淀粉单独作碳源时降低,与糖蜜组合时该比例分别为31.3%、48.2%、43.7%、40.2%。葡萄糖与乳糖、麦芽糊精或可溶性淀粉组合时,虾青素产量分别为 (15.0±0.3)、(55.1±0.8)、(23.9±0.9) μg/mL,较后三者单独作碳源时分别提高186.0%、2.5%、47.0%,类胡萝卜素产量则分别为 (32.9±1.0)、(130.5±1.4)、(59.2±1.4) μg/mL,分别提高269.6%、19.3%、67.3%。葡萄糖与乳糖、麦芽糊精或可溶性淀粉组合,生长及生产特性表现出所组合糖的综合特性,其虾青素占类胡萝卜素比例分别为45.6%、42.2%、40.3%。因此,所考察组合中麦芽糊精与糖蜜或葡萄糖的组合产量最高,且虾青素占类胡萝卜素比例达到40%以上。
虽然,糖蜜或葡萄糖与麦芽糊精为较佳的碳源组合,但受制于三角瓶在环境参数控制 (如溶氧水平与pH值)、补料流加控制 (如碳源和氨水) 等方面存在不足,进而引起发酵罐及三角瓶规模菌体生长及产物合成特性具有较大的差异,因此有必要在发酵小试罐上考察混合碳源补加工艺。设置发酵基础料中糖蜜质量浓度均为5 g/L,葡萄糖或/和麦芽糊精总质量浓度为15 g/L,考察不同比例葡萄糖和麦芽糊精在70 L发酵罐上的影响,结果如表1所示。
表1 70 L发酵罐上葡萄糖与麦芽糊精比例对法夫酵母生产虾青素的影响
Table 1 Effects of glucose to maltodextrin ratio on the production of astaxanthin by P.rhodozyma in 70 L fermenter
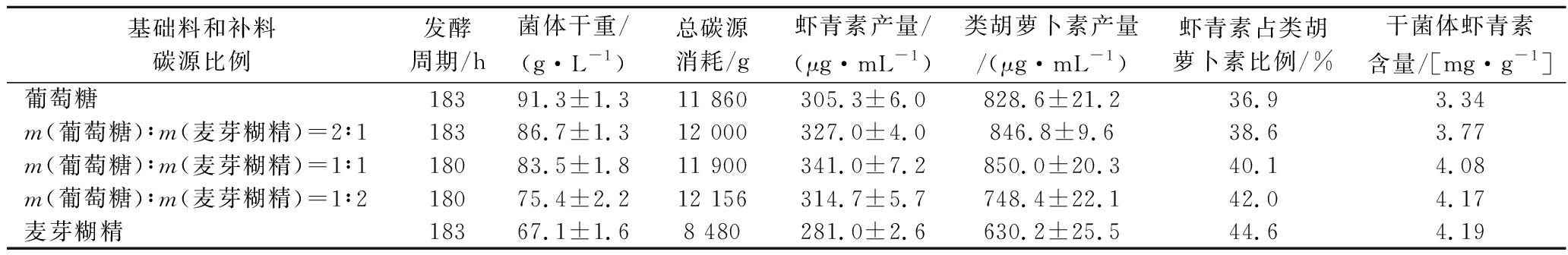
基础料和补料碳源比例发酵周期/h菌体干重/(g·L-1)总碳源消耗/g虾青素产量/(μg·mL-1)类胡萝卜素产量/(μg·mL-1)虾青素占类胡萝卜素比例/%干菌体虾青素含量/[mg·g-1]葡萄糖18391.3±1.311 860305.3±6.0828.6±21.236.93.34m(葡萄糖)∶m(麦芽糊精)=2∶118386.7±1.312 000327.0±4.0846.8±9.638.63.77m(葡萄糖)∶m(麦芽糊精)=1∶118083.5±1.811 900341.0±7.2850.0±20.340.14.08m(葡萄糖)∶m(麦芽糊精)=1∶218075.4±2.212 156314.7±5.7748.4±22.142.04.17麦芽糊精18367.1±1.68 480281.0±2.6630.2±25.544.64.19
由表1可知,在所有的碳源中,葡萄糖比例越高,有利于菌体生长。碳源的种类与比例影响虾青素占类胡萝卜素比例,其值与葡萄糖含量成负相关,且以麦芽糊精单独作碳源时达到最高,为44.6%。当在所考察组合中葡萄糖和麦芽糊精比例为1∶1时,虾青素和类胡萝卜素产量最高,分别为(341.0±7.2)、(850.0±20.3) μg/mL,葡萄糖或麦芽糊精比例过高时,均不利于虾青素生产或细胞增殖。
在70 L小试发酵罐确定最适葡萄糖与麦芽糊精比例的基础上,进一步开展中试10 m3发酵罐的工艺验证和放大研究。在生产实践中,通常较大体积的发酵罐具有更高的溶氧供给水平,换言之,能够保证较高的菌体浓度生长需求,因此在补糖培养基中加入50 g/L糖蜜促进生长。10 m3发酵罐中试放大实验结果如表2和图3所示。
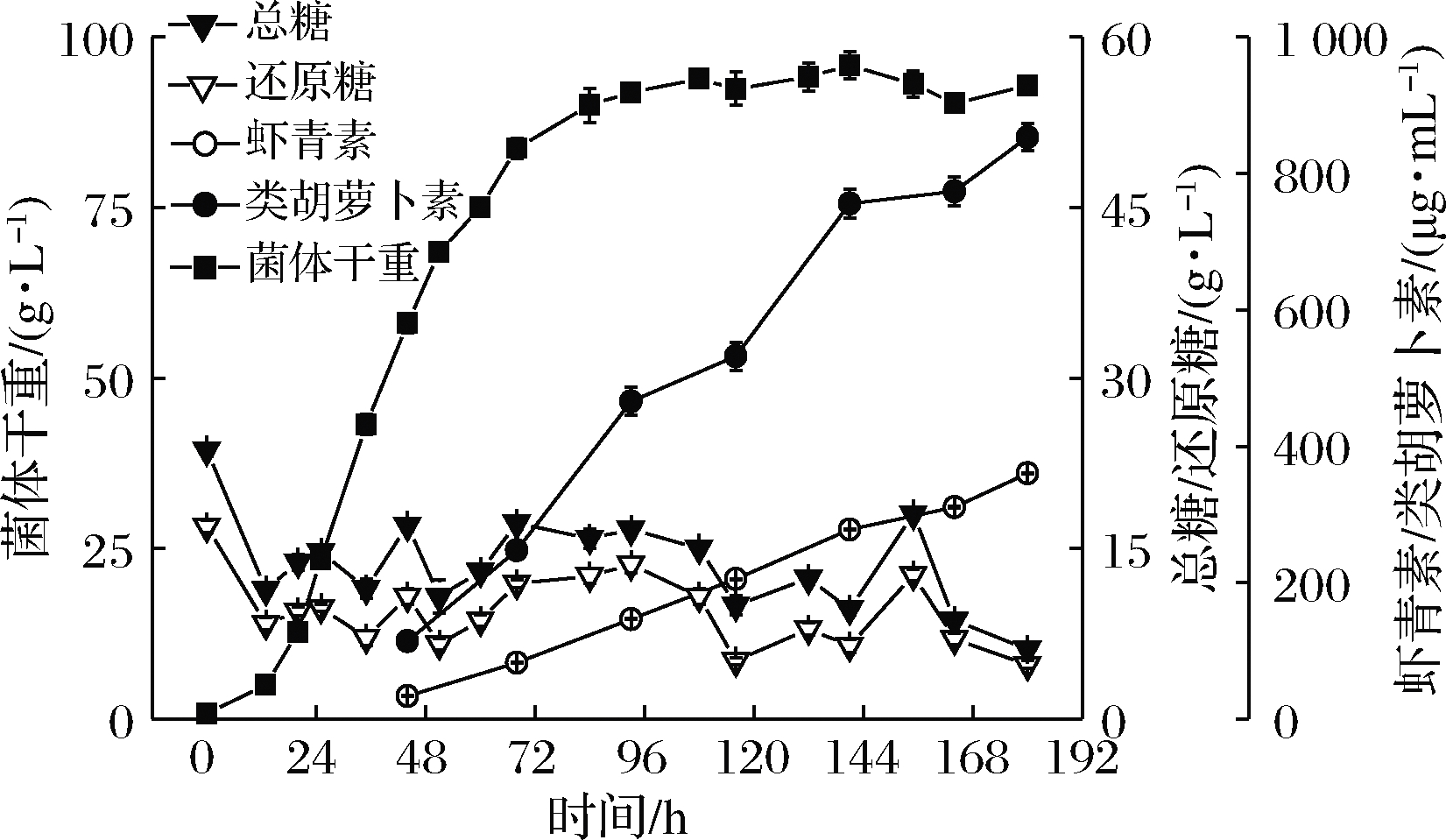
图3 10 m3发酵罐中试放大实验结果
Fig.3 Results of pilot scale-up in 10 m3 fermenter
表2 10 m3发酵罐中试放大实验结果
Table 2 Results of pilot scale-up in 10 m3 fermenter

发酵罐发酵周期/h菌体干重/(g·L-1)总碳源消耗/kg虾青素产量/(μg·mL-1)类胡萝卜素产量/(μg·mL-1)虾青素占类胡萝卜素比例/%干菌体虾青素含量/[mg·g-1]10 m3 发酵罐18092.9±1.12 384360.3±0.8853.2±20.242.23.88
10 m3发酵罐工艺放大结果表明,法夫酵母发酵生产虾青素的过程属于部分生长偶联型,对数生长期为13~68 h,虾青素合成期为44 h之后,经过180 h的培养,细胞干重、虾青素和类胡萝卜素分别达到 (92.9±1.1) g/L、(360.3±0.8) μg/mL和 (853.2±20.2) μg/mL,与70 L小试发酵罐相比,分别提高11.2%、5.65%和0.35%,虾青素占类胡萝卜素比例以及干菌体虾青素含量也分别达到42.2%和3.88 mg/(g细胞干重)。
虽然,法夫酵母在工业化生产虾青素方面显示出巨大的商业吸引力,但其发酵过程中呈现的克勒勃屈利效应 (Crabtree effect)[28]和高糖对胡萝卜素合成基因的抑制作用[22]提示碳源浓度尤其是葡萄糖浓度对虾青素发酵的重要性。同时,不同碳源在分子构成、碳链长短、微量成分等方面不尽相同,造成以菌体生长速率、虾青素产量和比例等为主要参数的发酵技术指标存在较大差异。朱明军等[29]报道糖蜜有利于法夫酵母生长,木糖有利于虾青素积累,采用木糖和糖蜜的混合碳源虾青素产量达到1.9 mg/L。朱晓立等[27]进行了不同配比的糖蜜和淀粉糖混合碳源对法夫酵母生物量和虾青素产量的影响,确定最佳比例为糖蜜占总糖的40%,此时生物量为8.61 g/L,虾青素产量为7 338 μg/L。AN等[19]认为甜菜糖蜜中Na和P是限制性营养物质,以尿素和NaH2PO4强化糖蜜营养构成,中试规模类胡萝卜素产量为40 mg/L。上述关于碳源种类和浓度的相关研究存在如下缺陷:1) 所考察碳源单价过高,用于商业生产不具成本优势,如木糖单价是麦芽糊精和葡萄糖的7~8倍;2) 局限于从发酵层次的产量提高出发,未充分考虑虾青素占类胡萝卜素比例及其工艺控制;3) 菌株产量低,以停留在三角摇瓶水平为主,离商业化生产甚远。
本研究在保证虾青素占类胡萝卜素比例较优的前提下进行碳源组合以提升虾青素产量,所考察的碳源市场价集中在3~6元/kg,且大量可得。通过摇瓶水平筛选,发现含低分子、短碳链的糖蜜、葡萄糖、麦芽糊精和麦芽糖浆有利于细胞增殖,长碳链的可溶性淀粉以及乳糖、淀粉水解液、甘油和蔗糖对细胞生长效果相对稍差。从虾青素占类胡萝卜素的比例分析,以单糖或二糖为主要成分的碳源,如糖蜜、蔗糖、葡萄糖和麦芽糖浆,虾青素占类胡萝卜素比例较低,而具有较高聚合度的麦芽糊精、可溶性淀粉和淀粉水解液以及细胞代谢较差的乳糖,虾青素占类胡萝卜素比例较高。碳源组合中引入葡萄糖或糖蜜虽然会导致虾青素占类胡萝卜素比例的下降,但在一定的糖蜜浓度下,通过控制较佳的葡萄糖和麦芽糊精比例,仍能实现高虾青素比例、高生产强度和高菌体干重统一的目标。中试试验中,在补糖培养基中加强有利于菌体生长的糖蜜比例,可充分发挥中试罐提供更强供氧水平的优势,能进一步提升菌体干重和虾青素产量。
本研究明确了法夫酵母可用于工业化生产的碳源种类、组合和比例,实现小试及中试规模虾青素产量与比例的提高,具有商业化运用价值。目前,围绕法夫酵母发酵控制,倾向于低糖发酵、两阶段补料控制[21-23],因此后续除了对发酵培养基配方、环境因子进行控制外,更多地需要在补料方式、碳源控制水平进行优化,降低碳溢流,从而进一步提升高产菌株产量。
[1] AMBATI R R,PHANG S M,RA I S,et al.Astaxanthin:Sources,extraction,stability,biological acti ities and its commercial applications-a re iew[J]. Marine Drugs,2014,12(1):128-152.
[2] TAGO Y,FUJII T,WADA J,et al.Genotoxicity and subacute toxicity studies of a new astaxanthin-containing Phaffia rhodozyma extract[J]. Journal of Toxicological Sciences,2014,39(3):373-382.
[3] BELLORA N,MOLINÉ M,DA ID-PALMA M,et al.Comparati e genomics pro ides new insights into the di ersity,physiology,and sexuality of the only industrially exploited tremellomycete:Phaffia rhodozyma[J].BMC Genomics,2016,17(1):901.
[4] UKIBE K,KATSURAGI T,TANA Y,et al.Efficient screening for astaxanthin-o erproducing mutants of the yeast Xanthophyllomyces dendrorhous by flow cytometry[J]. FEMS Microbiology Letters,2008,286(2):241-248.
[5] 胡向东,潘玲燕,章祺,等.复合诱变选育高产虾青素的红法夫酵母菌株[J].食品与发酵工业,2014,40(10):58-62;68.
[6] ERDOES J C,SANDMANN G, ISSER H,et al.Metabolic engineering of the carotenoid biosynthetic pathway in the yeast Xanthophyllomyces dendrorhous (Phaffia rhodozyma)[J].Applied and En ironmental Microbiology,2003,69(7):3 728-3 738.
[7] YAMAMOTO K,HARA K Y,MORITA T,et al.Enhancement of astaxanthin production in Xanthophyllomyces dendrorhous by efficient method for the complete deletion of genes[J]. Microbial Cell Factories,2016,15(1):155.
[8] 谢虹,周元元,胡卫成,等.法夫酵母高产虾青素的选育及发酵条件的优化[J].中国生物工程杂志,2006,26(12):68-74.
[9] 王立梅,杜似娟,郑丽雪,等.响应面法优化高产虾青素菌株的发酵条件[J].食品科学,2009,30(21):312-315.
[10] 刘春利,沈宁燕,倪辉,等.乙醇对法夫酵母发酵合成虾青素的影响[J].食品与发酵工业,2018,44(3):1-7.
[11] 沈宁燕,肖安风,蔡慧农,等.乳酸钠促进法夫酵母虾青素合成代谢流作用分析[J].微生物学通报,2015,42(4):634-645.
[12] WANG B B,PAN X S,JIA J,et al.Strategy and regulatory mechanisms of glutamate feeding to enhance astaxanthin yield in Xanthophyllomyces dendrorhous[J].Enzyme and Microbical Technology,2019,125:45-52.
[13] MART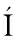 NEZ-CARDENAS A,CH
NEZ-CARDENAS A,CH EZ-CABRERA C, ASQUEZ-BAHENA J M,et al.A common mechanism explains the induction of aerobic fermentation and adapti e antioxidant response in Phaffia rhodozyma[J]. Microbial Cell Factories,2018,17(1):53.
EZ-CABRERA C, ASQUEZ-BAHENA J M,et al.A common mechanism explains the induction of aerobic fermentation and adapti e antioxidant response in Phaffia rhodozyma[J]. Microbial Cell Factories,2018,17(1):53.
[14] SCHROEDER W A,JOHNSO N E A. Singlet oxygen and peroxyl radicals regulate carotenoid biosynthesis in Phaffia rhodozyma[J]. Journal of Biological Chemistry,1995,270(31):18 374-18 379.
[15] WANG W J,YU L J. Effects of oxygen supply on growth and carotenoids accumulation by Xanthophyllomyces dendrorhous[J]. Zeitschrift Fur Naturforschung C-A Journal of Biosciences,2009,64(11-12):853-858.
[16] ZHANG J,LI Q R,ZHANG M H,et al. Enhancement of carotenoid biosynthesis in Phaffia rhodozyma PR106 under stress conditions[J]. Bioscience Biotechnology and Biochemistry,2019,83(12):2 375-2 385.
[17] 肖安风,倪辉,李利君,等.法夫酵母产虾青素的反复分批及反复分批补料发酵[J].生物工程学报,2011,27(4):598-605.
[18] 倪辉,洪清林,肖安风,等.一株法夫酵母虾青素高产菌株的生产性能[J].生物工程学报,2011,27(7):1 065-1 075.
[19] AN G H,JANG B G,CHO M H.Culti ation of the carotenoid-hyperproducing mutant 2A2N of the red yeast Xanthophyllomyces dendrorhous (Phaffia rhodozyma) with molasses[J]. Journal of Bioscience and Bioengineering,2001,92(2):121-125.
[20] NGHIEM N P,MONTANTI J,JOHNSTON D.Production of astaxanthin from corn fiber as a alue-added co-product of fuel ethanol fermentation[J]. Applied Biochemistry and Biotechnology,2009,154(1-3):48-58.
[21] PAN X S,WANG B B,GERKEN H G,et al.Proteomic analysis of astaxanthin biosynthesis in Xanthophyllomyces dendrorhous in response to low carbon le els[J]. Bioprocess and Biosystems Engineering,2017,40(7):1 091-1 100.
[22] MIAO L L,CHI S,WU M R,et al. Deregulation of phytoene-β-carotene synthase results in derepression of astaxanthin synthesis at high glucose concentration in Phaffia rhodozyma astaxanthin-o erproducing strain MK19[J].BMC Microbiology,2019,19(1):133.
[23] YAMANE Y,HIGASHIDA K,NAKASHIMADA Y,et al.Influence of oxygen and glucose on primary metabolism and astaxanthin production by Phaffia rhodozyma in batch and fed-batch cultures:Kinetic and stoichiometric analysis[J]. Applied and En ironmental Microbiology,1997,63(11):4 471-4 478.
[24] C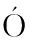 RDO A P,ALCA
RDO A P,ALCA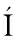 NO J,BRA O N,et al.Regulation of carotenogenesis in the red yeast Xanthophyllomyces dendrorhous:The role of the transcriptional co-repressor complex Cyc8-Tup1 in ol ed in catabolic repression[J]. Microbial Cell Factories,2016,15(1):193.
NO J,BRA O N,et al.Regulation of carotenogenesis in the red yeast Xanthophyllomyces dendrorhous:The role of the transcriptional co-repressor complex Cyc8-Tup1 in ol ed in catabolic repression[J]. Microbial Cell Factories,2016,15(1):193.
[25] 陈晋明,王世平,陈敏.反相高效液相色谱法检测虾青素[J].化学分析计量,2006,15(2):27-29.
[26] WEI L X,YUN Z L,QING S Z,et al.A selecti e con ersion of sulfides to sulfoxides in 3-fluorophenol[J].Synthetic Communications,2004,34(2):231-237.
[27] 朱晓立,裘晖,邓毛程,等.红发夫酵母生产虾青素的培养基优化[J]. 食品与发酵工业,2008,34(2):61-64.
[28] REYNDERS M,RAWLINGS D,HARRISON T L.Demonstration of the Crabtree effect in Phaffia rhodozyma during continuous and fed-batch culti ation[J].Biotechnology Letters,1997,19(6):549-552.
[29] 朱明军,浦跃武,吴海珍,等.不同碳源及其浓度对红发夫酵母培养的影响[J].华南理工大学学报(自然科学版),2002,30(4):77-80.