小白菜茎叶可食,青翠嫩绿、鲜美爽口,富含维生素和矿物质[1]。此外,小白菜以其通肠利胃、抗癌排毒、润肤抗老的功效深受消费者青睐,素有“菜中之王”的美誉。但小白菜作为一种绿叶蔬菜,采后极易褪绿黄化,常温下仅能维持鲜绿状态1~2 d[2],严重影响消费者的购买和食用欲望,也极大增加了商家损耗。
目前小白菜的护色保鲜技术主要有植物精油处理[3]、气调储藏[4]和1-甲基环丙烯处理[5],然而受成本、实用性、安全性及可操作性等因素影响,这些技术的应用具有一定局限性。乙醇已在食品行业中普遍使用,其安全性被美国食品和药物管理局认可,乙醇熏蒸处理的优势是安全、经济、操作简便和处理时间短[6-7],该技术已被成功应用于园艺产品如西兰花[8]、荷兰豆[9]、红薯尖[10]等的护绿保鲜。课题组前期研究发现,50 μL/L乙醇熏蒸处理可诱导超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性,通过提升抗氧化酶活性来保持红薯尖的良好感官和较高的叶绿素含量[10]。陶炜煜[11]发现6 mL/kg乙醇处理可以提高鲜切西兰花过氧化物酶(peroxidase,POD)、CAT和SOD活性,提高酶促系统的抗氧化能力,从而抑制西兰花的呼吸强度和乙烯释放,达到较好的保绿效果。李丹等[12]用0.25、0.5和1 mL/L的乙醇处理西兰花,发现乙醇处理通过延缓黄酮含量和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力的下降来维持机体的抗氧化能力,从而维持西兰花的品质。宋卤哲等[6]发现500 μL/L乙醇熏蒸可提升抗氧化酶CAT活性和抗氧化物质总酚、类黄酮的含量,从而降低猕猴桃叶绿素分解速率。不少研究表明,叶绿素降解与活性氧代谢相关,活性氧清除能力过低会使得活性氧蓄积,从而加速细胞膜脂过氧化,引发膜损伤,加速叶绿素的降解[13-15]。前人研究乙醇护绿机理多集中于抗氧化水平方面,对绿叶蔬菜活性氧产生能力、清除能力与膜损伤对黄化褪绿的影响的研究未形成体系。而且,乙醇熏蒸是否对小白菜有护绿作用尚不明确。本文以小白菜为实验对象,对其进行不同浓度乙醇处理,探究乙醇对采后小白菜体内活性氧、活性氧清除系统、膜系统及小白菜色泽的影响,从活性氧方面系统的阐述乙醇护绿机理,考察不同浓度乙醇对小白菜护绿效果的差异,确定合适的乙醇剂量,为解决小白菜采后易黄化褪绿的问题提供依据。
新鲜小白菜购于重庆市北碚菜市场,品种为重庆小水白,于2020年1月4日上午5点左右采摘,7点前运送至实验室。拣选标准:叶片和茎部完整,叶片直挺、嫩绿、有光泽,无枯黄叶、腐烂叶。
聚乙烯袋,30 cm×40 cm,厚度30 μm,石家庄诚胜塑业;泡沫箱,外尺寸40 cm×30.5 cm×20 cm,壁厚2.4 cm,成都国亨泡沫制品;95%乙醇(分析纯),成都市科龙试剂厂;纱布,重庆北碚实验用品超市。
RXZ-800B型智能人工气候箱,宁波东南仪器有限公司;U -2450PC型紫外可见分光光度计,日本岛津公司;UltraScan® PRO型测色仪,美国HunterLab公司;DDS-307A型电导率仪,上海雷磁公司;H1650R型台式高速冷冻离心机,湖南湘仪公司。
前期实验表明每个泡沫箱内装350 g小白菜为宜。实验共设4组,熏蒸浓度分别为0(CK)、500、750、1 000 μL/L(乙醇溶液体积/泡沫箱体积)。将拣选好的小白菜放入泡沫箱,将叠放的4层纱布粘在箱盖内部中央,分别取一定体积的乙醇(体积分数95%)均匀地滴在纱布上,迅速封箱,于25 ℃室温熏蒸3 h。开箱后置于通风处30 min,再将小白菜装入聚乙烯袋,每袋(100±5) g,每组3个平行,在袋上贴好标签后封口。包装好的小白菜放入气候箱,20 ℃左右、相对湿度55%~65%条件下贮藏6 d,未对灯光进行设置,直接参考日光,每天测定指标。
1.4.1 色差L*、a*、b*值
参考王羽等[16]的方法,用测色仪测定小白菜的L*、a*、b*值。L*反映明度,a*值反映红绿偏向,b*反映黄蓝偏向。每个平行随机取3棵小白菜,每棵小白菜取最外叶测定5个点,分别为主叶脉顶部1点,两侧区域各2点,最后结果取平均值。
1.4.2 叶绿素含量
参照徐芬芬等[17]的方法,用乙醇丙酮[ (乙醇)∶ (丙醇)=1∶1]浸提法测定,叶绿素含量按公式(1)计算:
叶绿素含量/(mg·g-1)=20.29×A645+8.05×A663
(1)
式中:A645、A663分别为645、663 nm波长处的吸光度。
1.4.3 相对电导率
参照程曦等[18]的方法进行测定,以%表示。
1.4.4 丙二醛(malondialdehyde,MDA)含量
采用硫代巴比妥酸法,参考肖婷等[10]的方法,单位为μmol/g。
1.4.5 抗坏血酸(ascorbic acid,ASA)含量
采用碘酸钾滴定法[19]测定,单位为mg/100 g。
1.4.6 POD、CAT、SOD、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性测定
采用分光光度计法[20-22]测定,单位为U/g。
1.4.7 还原型谷胱甘肽(reduced glutathione,GSH)含量
参照QIAN等[23]的方法用分光光度计测定,GSH和二硫代硝基苯甲酸反应生成的2-硝基-5-巯基苯甲酸在波长412 nm处具有最大光吸收。标准曲线方程为n(GSH)=80.837 9×A412+1.990 7,R2=0.998 6。根据样品管反应混合液与空白对照管显色液吸光度值的差值,从标准曲线上查出相应的GSH物质的量(n),每克小白菜叶片中的GSH物质的量即为GSH含量,单位为μmol/g。
1.4.8 超氧阴离子自由基![]() 产生速率
产生速率
参照YAN等[24]方法利用羟胺氧化法测定,![]() 与羟胺反应生成的
与羟胺反应生成的![]() 与对氨基苯磺酸和α-萘胺反应,生成物在波长530 nm有吸收高峰。标准曲线方程为
与对氨基苯磺酸和α-萘胺反应,生成物在波长530 nm有吸收高峰。标准曲线方程为![]() 根据样品管显色液与对照管显色液吸光度值的差值,从标准曲线上查出相应的
根据样品管显色液与对照管显色液吸光度值的差值,从标准曲线上查出相应的![]() 物质的量
物质的量![]() 产生速率单位为nmol/(min·g)。
产生速率单位为nmol/(min·g)。
采用Excel 2010处理数据;SPSS 22统计分析;显著性分析采用最低显著性差异法,P>0.05表示差异性不显著,0.01<P<0.05表示差异性显著,P<0.01表示差异性极显著;制图使用Origin 2017。
SOD通过催化![]() 迅速歧化为H2O2和O2来解除
迅速歧化为H2O2和O2来解除![]() 的毒害[19]。有研究表明,SOD在清除机体内
的毒害[19]。有研究表明,SOD在清除机体内![]() 方面起到90%以上的作用[25]。如图1所示,小白菜SOD活性随着贮藏时间的延长呈上升趋势,黄仁华[26]认为这是机体自身的保护调节机制。小白菜SOD活性在1 d内大幅上升,可能是因为
方面起到90%以上的作用[25]。如图1所示,小白菜SOD活性随着贮藏时间的延长呈上升趋势,黄仁华[26]认为这是机体自身的保护调节机制。小白菜SOD活性在1 d内大幅上升,可能是因为![]() 初始值较高(图7),机体亟需增强SOD活性来清除积累的
初始值较高(图7),机体亟需增强SOD活性来清除积累的![]() 在贮藏1~2 d时,不同于CK组的上升趋势,3个乙醇处理组的SOD活性均有所下降,其中500、1 000 μL/L组SOD活性下降较多;2 d后,各乙醇组逐渐回升。1 000 μL/L组在1~4 d的SOD活性均低于CK组,第2 天时极显著(P<0.01)低于CK组。整个贮藏期间,750 μL/L组都能有效诱导SOD活性的提高,到贮藏结束时,750 μL/L组SOD活性达2.79 U/g,显著高于500 μL/L组的2.56 U/g和1 000 μL/L组的2.53 U/g (P<0.05),极显著高于CK组的2.41 U/g(P<0.01)。适宜浓度的乙醇处理可通过诱导小白菜体内的SOD基因表达来提高SOD活性[27],浓度较低其诱导能力也稍弱,而过高浓度(1 000 μL/L)乙醇易进入机体内部,致使机体产生更多氧化性的自由基或基团,削弱SOD的清除能力[28]。
在贮藏1~2 d时,不同于CK组的上升趋势,3个乙醇处理组的SOD活性均有所下降,其中500、1 000 μL/L组SOD活性下降较多;2 d后,各乙醇组逐渐回升。1 000 μL/L组在1~4 d的SOD活性均低于CK组,第2 天时极显著(P<0.01)低于CK组。整个贮藏期间,750 μL/L组都能有效诱导SOD活性的提高,到贮藏结束时,750 μL/L组SOD活性达2.79 U/g,显著高于500 μL/L组的2.56 U/g和1 000 μL/L组的2.53 U/g (P<0.05),极显著高于CK组的2.41 U/g(P<0.01)。适宜浓度的乙醇处理可通过诱导小白菜体内的SOD基因表达来提高SOD活性[27],浓度较低其诱导能力也稍弱,而过高浓度(1 000 μL/L)乙醇易进入机体内部,致使机体产生更多氧化性的自由基或基团,削弱SOD的清除能力[28]。

图1 乙醇熏蒸对小白菜SOD活性的影响
Fig.1 Effects of ethanol fumigation on SOD acti ity of pakchoi
CAT的作用是将H2O2还原为O2和H2O,以防止活性更强的·OH的形成[29]。由图2可知,CK组贮藏期间CAT活性始终低于初始值,且全程显著低于乙醇处理组(P<0.05),可见乙醇熏蒸能有效增强小白菜CAT活性。前3 d,各乙醇处理组CAT活性没有显著性差异(P>0.05),第4天开始,1 000 μL/L组诱导CAT活性的能力有所下降,显著低于其他处理组(P<0.05)。小白菜CAT活性在第4天出现峰值,推测是前3 d各组CAT清除H2O2的能力不强,SOD清除![]() 后产生的H2O2逐渐积累,在第4天胁迫机体CAT活性大幅上升以维持氧化与抗氧化之间的平衡。500 μL/L组在第4天 CAT活性达最大值18.225 U/g,极显著高于CK组和1 000 μL/L组(P<0.01)。到贮藏结束时,750 μL/L组CAT活性最高,500 μL/L组稍弱,两组并未形成显著性差异(P>0.05),但均极显著高于CK组和1000 μL/L组(P<0.01)。
后产生的H2O2逐渐积累,在第4天胁迫机体CAT活性大幅上升以维持氧化与抗氧化之间的平衡。500 μL/L组在第4天 CAT活性达最大值18.225 U/g,极显著高于CK组和1 000 μL/L组(P<0.01)。到贮藏结束时,750 μL/L组CAT活性最高,500 μL/L组稍弱,两组并未形成显著性差异(P>0.05),但均极显著高于CK组和1000 μL/L组(P<0.01)。

图2 乙醇熏蒸对小白菜CAT活性的影响
Fig.2 Effects of ethanol fumigation on CAT acti ity of pakchoi
APX以抗坏血酸为电子供体,催化其与H2O2反应,以氧化抗坏血酸为代价分解![]() 如图3所示,贮藏期间,各组APX活性整体呈现下降趋势。贮藏至第1天时,750 μL/L组下降幅度最小,仅下降6.67%,而CK组APX活性已经下降了50.16%,两组间差异极显著(P<0.01)。贮藏前3 d各组APX活性下降较迅速,而到贮藏后期,各组APX活性变化已经很平缓。500、750 μL/L组在整个贮藏期间APX活性始终高于CK组,其中第1、6天差异显著(P<0.05);1 000 μL/L组APX活性在贮藏中期低于CK组,但未形成显著性差异(P>0.05)。到贮藏结束时,750 μL/L组APX活性值最高达2.25 U/g,显著高于500和1000 μL/L组(P<0.05),极显著高于CK组(P<0.01)。适宜浓度的乙醇处理促进
如图3所示,贮藏期间,各组APX活性整体呈现下降趋势。贮藏至第1天时,750 μL/L组下降幅度最小,仅下降6.67%,而CK组APX活性已经下降了50.16%,两组间差异极显著(P<0.01)。贮藏前3 d各组APX活性下降较迅速,而到贮藏后期,各组APX活性变化已经很平缓。500、750 μL/L组在整个贮藏期间APX活性始终高于CK组,其中第1、6天差异显著(P<0.05);1 000 μL/L组APX活性在贮藏中期低于CK组,但未形成显著性差异(P>0.05)。到贮藏结束时,750 μL/L组APX活性值最高达2.25 U/g,显著高于500和1000 μL/L组(P<0.05),极显著高于CK组(P<0.01)。适宜浓度的乙醇处理促进![]() 歧化为H2O2(图1),相应的,适宜浓度的乙醇通过诱导APX活性的提升来促进H2O2的分解,有效消除自由基毒害,高剂量乙醇对APX活性的影响与对SOD活性的影响一致。
歧化为H2O2(图1),相应的,适宜浓度的乙醇通过诱导APX活性的提升来促进H2O2的分解,有效消除自由基毒害,高剂量乙醇对APX活性的影响与对SOD活性的影响一致。
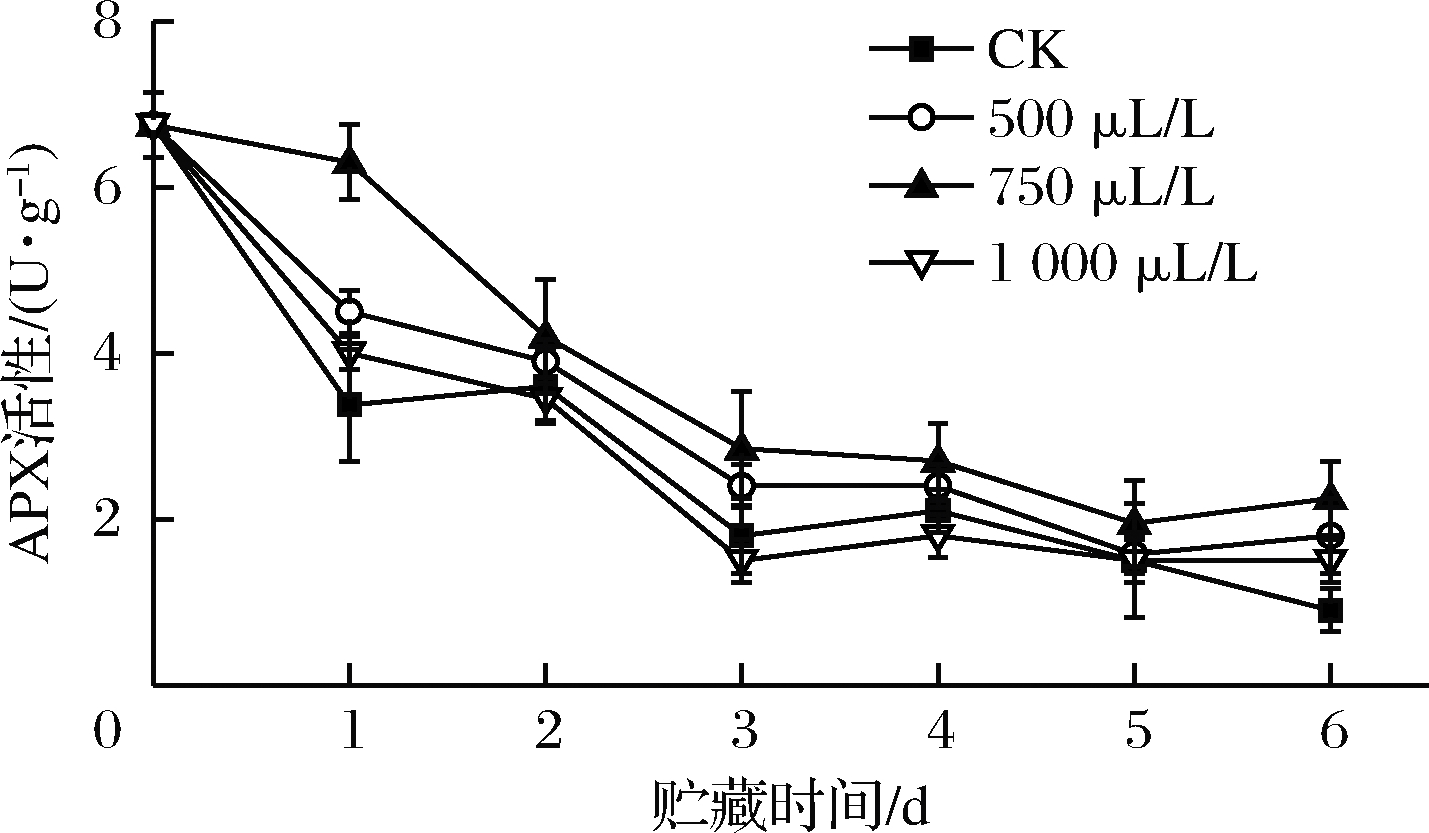
图3 乙醇熏蒸对小白菜APX活性的影响
Fig.3 Effects of ethanol fumigation on APX acti ity of pakchoi
POD、CAT和APX都是清除H2O2的酶[31]。如图4所示,0~4 d,POD活性不断攀升,这可能是因为贮藏前期CAT活性上升缓慢(图2)且APX活性一直降低(图3),两者清除底物H2O2的能力有限,故机体需增强POD活性来清除H2O2。贮藏4~5 d,POD活性迅速下降,这一现象与CAT活性的变化相似,推测机体内出现了反馈抑制[32]。5~6 d,POD活性回升,也许是机体内启动了ASA-GSH循环,减轻了POD清除H2O2的负担[19]。500、750 μL/L组诱导POD活性全程高于其他2组。750 μL/L组在第3、4、6天与CK组差异极显著(P<0.01);500 μL/L组在第3、4天与CK组差异显著(P<0.05),第6天差异极显著(P<0.01);1 000 μL/L组全程与CK组未形成显著性差异(P>0.05),且第2天时POD活性低于CK组。可见,500和750 μL/L组均能有效诱导POD活性的提高,750 μL/L组提升程度更高。

图4 乙醇熏蒸对小白菜POD活性的影响
Fig.4 Effects of ethanol fumigation on POD acti ity of pakchoi
小白菜富含ASA,ASA既可直接清除![]() 等活性氧,也可作为APX清除H2O2的电子供体间接清除活性氧,提高细胞抗氧化系统的还原势[19,33]。如图5所示,0~1 d,各组ASA含量呈下降趋势,CK组下降幅度最小,且显著高于1 000 μL/L组(P<0.05),极显著高于500和750 μL/L组(P<0.01)。这可能是贮藏前期乙醇处理组SOD清除
等活性氧,也可作为APX清除H2O2的电子供体间接清除活性氧,提高细胞抗氧化系统的还原势[19,33]。如图5所示,0~1 d,各组ASA含量呈下降趋势,CK组下降幅度最小,且显著高于1 000 μL/L组(P<0.05),极显著高于500和750 μL/L组(P<0.01)。这可能是贮藏前期乙醇处理组SOD清除![]() 的效率较高(图1),使H2O2积累,机体启动ASA-GSH循环还原H2O2的同时ASA自身被氧化[34],APX活性的增强(图3)也加速了这一过程。贮藏中期(1~4 d),各组ASA含量不降反增,但始终未超过初始值,推测是被氧化的脱氢抗坏血酸通过ASA-GSH循环被还原成ASA[35]。4~6 d,各组ASA含量迅速下降,此时小白菜衰老程度严重,几乎无法再实现ASA的还原再生,ASA随着贮藏时间的延长不断流失。从各组ASA回升达到的最高值以及贮藏后期的下降程度来看,750 μL/L组在延缓ASA下降上效果最好。
的效率较高(图1),使H2O2积累,机体启动ASA-GSH循环还原H2O2的同时ASA自身被氧化[34],APX活性的增强(图3)也加速了这一过程。贮藏中期(1~4 d),各组ASA含量不降反增,但始终未超过初始值,推测是被氧化的脱氢抗坏血酸通过ASA-GSH循环被还原成ASA[35]。4~6 d,各组ASA含量迅速下降,此时小白菜衰老程度严重,几乎无法再实现ASA的还原再生,ASA随着贮藏时间的延长不断流失。从各组ASA回升达到的最高值以及贮藏后期的下降程度来看,750 μL/L组在延缓ASA下降上效果最好。
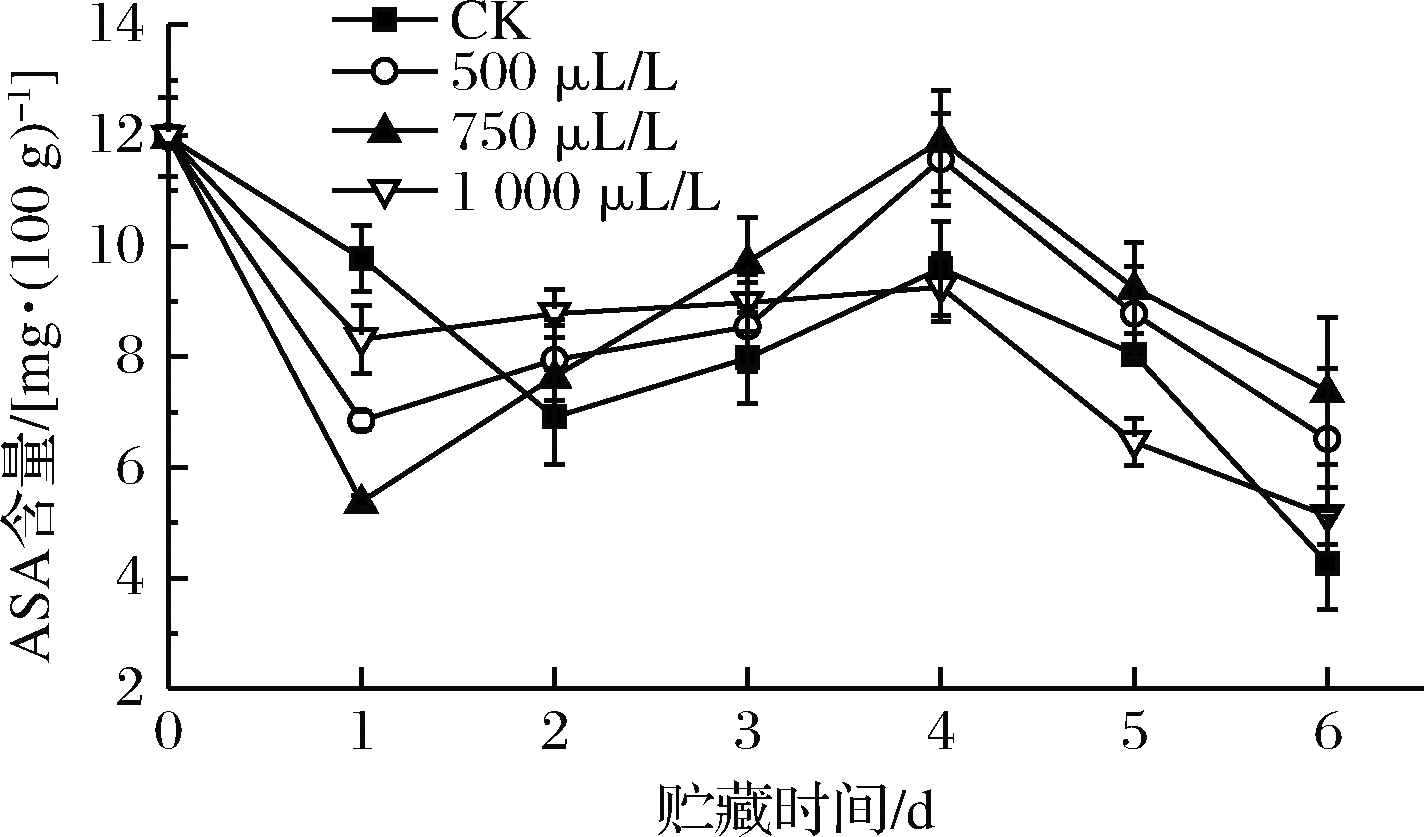
图5 乙醇熏蒸对小白菜ASA含量的影响
Fig.5 Effects of ethanol fumigation on ASA content of pakchoi
GSH是细胞体内关键的非酶性抗氧化物质,能参与缓冲机体内的氧化还原反应,对抗活性氧对机体的伤害[36]。如图6所示,GSH含量呈波动下降趋势。0~1 d和4~5 d各组GSH含量上升,推测是此段贮藏期间外部环境不利于小白菜贮藏,小白菜由此作出应激反应[37]。1~4 d各组呈下降趋势,结合ASA含量的变化趋势(图5),推测此阶段GSH以自身氧化为代价促进ASA的还原再生[19]。750 μL/L组在第1天时GSH含量显著高于CK组(P<0.05),第2、3天极显著高于其他3组(P<0.01),750 μL/L组在维持较高的GSH含量上效果最佳。

图6 乙醇熏蒸对小白菜GSH含量的影响
Fig.6 Effects of ethanol fumigation on GSH content of pakchoi
如图7所示,贮藏期间![]() 产生速率不断升高。
产生速率不断升高。![]() 初始值高达481.18 nmol/(min·g),可见采摘小白菜时的机械切割诱导
初始值高达481.18 nmol/(min·g),可见采摘小白菜时的机械切割诱导![]() 大量产生[38]。
大量产生[38]。

图7 乙醇熏蒸对小白菜![]() 产生速率的影响
产生速率的影响
Fig.7 Effects of ethanol fumigation on superoxide anion
radical production rate of pakchoi
总体来看,500和750 μL/L组增长趋势较为平缓,而CK组和1 000 μL/L组增长趋势更为陡峭。并非乙醇处理组都能有效地抑制![]() 产生速率,1 000 μL/L组自第3 天起
产生速率,1 000 μL/L组自第3 天起![]() 产生速率高于CK组,差异显著(P<0.05),这可能是因为高浓度乙醇胁迫下,活性氧清除酶活性下降(图1~图4),抗氧化物质的消耗加快(图5~图6),导致
产生速率高于CK组,差异显著(P<0.05),这可能是因为高浓度乙醇胁迫下,活性氧清除酶活性下降(图1~图4),抗氧化物质的消耗加快(图5~图6),导致![]() 不能被及时清除而积累在机体内部。750 μL/L组始终保持
不能被及时清除而积累在机体内部。750 μL/L组始终保持![]() 产生速率最低值,且自第2天起与500 μL/L组差异显著(P<0.05),与其他2组差异极显著(P<0.01),这可能是因为该浓度乙醇处理能有效地诱导抗氧化酶活性的提高,同时延缓抗氧化物质降解的速率,从而使机体内活性氧清除能力提升,达到及时有效地清除
产生速率最低值,且自第2天起与500 μL/L组差异显著(P<0.05),与其他2组差异极显著(P<0.01),这可能是因为该浓度乙醇处理能有效地诱导抗氧化酶活性的提高,同时延缓抗氧化物质降解的速率,从而使机体内活性氧清除能力提升,达到及时有效地清除![]() 的效果[39]。贮藏结束时,各组
的效果[39]。贮藏结束时,各组![]() 产生速率相对于初始值分别增长了78.25%(CK组)、29.97%(500 μL/L组)、21.85%(750 μL/L组)、85.23%(1000 μL/L组)。
产生速率相对于初始值分别增长了78.25%(CK组)、29.97%(500 μL/L组)、21.85%(750 μL/L组)、85.23%(1000 μL/L组)。
MDA含量可表征脂质过氧化程度。如图8所示,各组MDA含量持续上升,说明活性氧积累导致细胞膜脂过氧化程度日益严重。除了第5天,1 000 μL/L组贮藏期间MDA含量均高于CK组,且第1、4天差异显著(P<0.05),第3天差异极显著(P<0.01),这是因为诱发膜脂过氧化是![]() 损伤生物体的机理之一[32],高浓度乙醇提升了
损伤生物体的机理之一[32],高浓度乙醇提升了![]() 产生速率(图7),进一步加重膜脂过氧化。500和750 μL/L组均能有效地减缓MDA含量的上升,贮藏前期两者差异并不显著(P>0.05),4~6 d,750 μL/L组显著低于500 μL/L组(P<0.05)。这是因为750 μL/L组在活性氧清除能力的提升及机体内部氧化—抗氧化平衡的维持上效果最佳,因此活性氧对细胞质膜的攻击程度最小,膜脂过氧化程度最弱,而500 μL/L组由于浓度较小,虽然未加重膜脂过氧化,但抑制膜脂过氧化的效果稍弱。贮藏末期,750 μL/L乙醇熏蒸处理MDA含量最低,仅为CK组的83.11%。
产生速率(图7),进一步加重膜脂过氧化。500和750 μL/L组均能有效地减缓MDA含量的上升,贮藏前期两者差异并不显著(P>0.05),4~6 d,750 μL/L组显著低于500 μL/L组(P<0.05)。这是因为750 μL/L组在活性氧清除能力的提升及机体内部氧化—抗氧化平衡的维持上效果最佳,因此活性氧对细胞质膜的攻击程度最小,膜脂过氧化程度最弱,而500 μL/L组由于浓度较小,虽然未加重膜脂过氧化,但抑制膜脂过氧化的效果稍弱。贮藏末期,750 μL/L乙醇熏蒸处理MDA含量最低,仅为CK组的83.11%。

图8 乙醇熏蒸对小白菜MDA含量的影响
Fig.8 Effects of ethanol fumigation on MDA content of pakchoi
相对电导率表征细胞膜结构的破坏程度[18],储存期间,细胞逐渐衰老,膜通透性逐渐增大。1 000 μL/L组相对电导率在贮藏初期上升幅度最大,在第1、3天显著高于CK组(P<0.05),第2、6天极显著高于CK组(P<0.01),可能是乙醇浓度过高加速了膜破裂[40],加剧离子泄露。第2天开始,CK组增长幅度大幅增加,3~4 d时其相对电导率值仅稍低于1 000 μL/L组,第5天时已经高于1000 μL/L组。0~2 d,750 μL/L组与CK组、500 μL/L组未形成显著性差异(P>0.05);3~6 d,750 μL/L组相对电导率极显著低于CK组和500 μL/L组(P<0.01)。这可能是因为750 μL/L组能够最有效地抑制膜脂过氧化,从而减弱细胞膜的破坏程度。
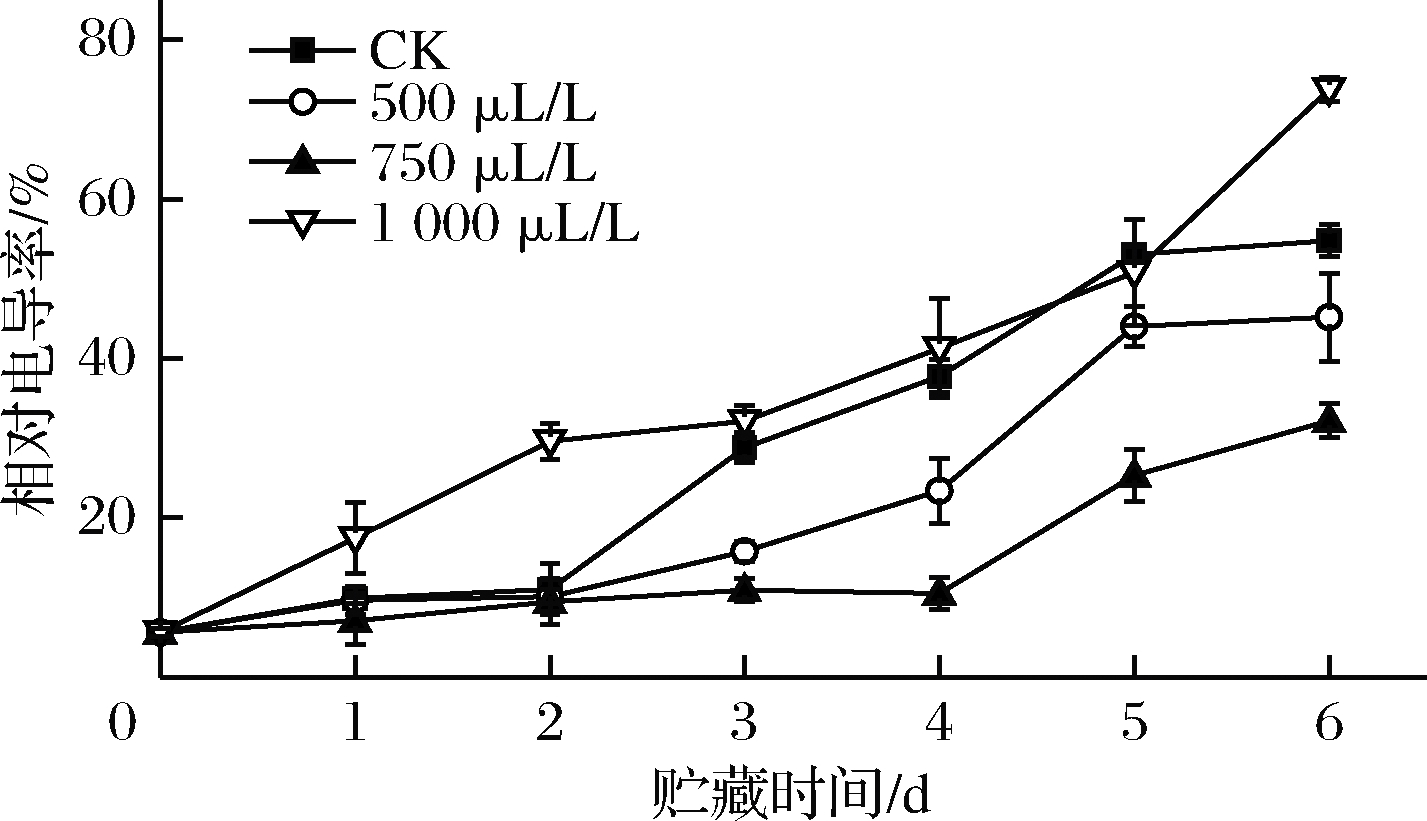
图9 乙醇熏蒸对小白菜相对电导率的影响
Fig.9 Effects of ethanol fumigation on relati e
conducti ity of pakchoi
如图10所示,随着储存时间的延长,小白菜逐渐衰老,体内的叶绿素逐渐降解,各组叶绿素含量逐渐减少。500和750 μL/L组下降趋势较平缓,CK组和1 000 μL/L组下降较迅速。1~3 d,CK组尚未与500、750 μL/L组形成显著性差异(P<0.05);4~6 d,CK组叶绿素含量极显著低于500和750 μL/L组(P<0.01)。1 000 μL/L组叶绿素含量始终为最低值,且0~2 d与CK组差异显著(P<0.05),4~6 d差异极显著(P<0.01)。到贮藏结束时,750 μL/L组叶绿素含量为29.54 mg/g,分别为其他3组的288.48%(CK组)、144.59%(500 μL/L组)和556.31%(1 000 μL/L组),差异极显著(P<0.01)。适宜浓度乙醇熏蒸条件下,小白菜细胞质膜稳定性的有效维持使得位于不同空间的叶绿素降解酶和叶绿素难以接触[15],叶绿素降解难度增加,小白菜保持更高的叶绿素含量;而高剂量乙醇加剧膜损伤,促进叶绿素降解。

图10 乙醇熏蒸对小白菜叶绿素含量的影响
Fig.10 Effects of ethanol fumigation on chlorophyll
content of pakchoi
如图11所示,贮藏期间小白菜L*、a*、b*值均呈现上升趋势。L*值反映明度,L*值呈现上升趋势表示小白菜在贮藏过程中逐渐变亮,500和750 μL/L组的L*值上升趋势较缓慢。a*值反映色泽的红绿偏向,a*为负值表示颜色偏向为绿色,负值越小,小白菜越鲜绿,a*值越接近零,小白菜色泽越偏离绿色。贮藏前期各组a*值差异尚不显著(P>0.05)。第2天起,1 000 μL/L组a*值迅猛增加,贮藏中期显著(P<0.05)高于其他3组,第4天时a*值已达-2.9。500和750 μL/L组整个贮藏期间a*值变化较小,750 μL/L组在贮藏前期、中期更能维持较低a*值,贮藏后期500 μL/L组更能延缓小白菜褪绿速率。贮藏结束时,500 μL/L组a*值为-6.40,750 μL/L组为-5.41,显著低于CK组和1 000 μL/L组(P<0.05)。b*值反映小白菜的黄蓝偏向,b*值为正值说明颜色偏向为黄色,正值越大小白菜越黄。图11-c显示CK组和1 000 μL/L组的b*值增长迅速,第2天后与其他2组形成显著差异(P<0.05),说明这2组小白菜变黄速率快,乙醇浓度较低的2组可以抑制b*值的上升,延缓小白菜黄化速率。综上,500和750 μL/L组可很好的抑制L*、a*、b*值的上升,更好的延缓小白菜黄化褪绿速率。

a-L*值; b-a*值; c-b*值
图11 乙醇熏蒸对小白菜色差值的影响
Fig.11 Effects of ethanol fumigation on color indexes of pakchoi
叶绿素降解与活性氧代谢失调密切相关[13]。采后小白菜在衰老过程中,由于电子传递链失衡导致电子泄漏给氧,使得活性氧的产生逐渐增加,活性氧代谢平衡被打破,蓄积的活性氧自由基攻击细胞膜,使得膜脂过氧化程度加剧,膜透性增大,叶绿素降解酶所在的叶绿体被膜和叶绿素所在的类囊体膜通透性增大,位于不同空间的叶绿素降解酶和叶绿素相互接触,加速了叶绿素的降解,小白菜逐渐黄化褪![]() 是大多数活性氧的前体,参与氧化链反应的增殖,可衍生为H2O2、1O2、·OH等各类活性氧[41],本文用
是大多数活性氧的前体,参与氧化链反应的增殖,可衍生为H2O2、1O2、·OH等各类活性氧[41],本文用![]() 产生速率来表征活性氧的产生水平;MDA含量和相对电导率可用来表征细胞质膜的损伤程度[42];叶绿素含量和L*、a*、b*值可体现小白菜的鲜绿状态。本研究中,
产生速率来表征活性氧的产生水平;MDA含量和相对电导率可用来表征细胞质膜的损伤程度[42];叶绿素含量和L*、a*、b*值可体现小白菜的鲜绿状态。本研究中,![]() 产生速率不断增长(图7),机体内的活性氧处于高水平、不稳定、不平衡的状态,积累的活性氧攻击细胞膜,加速了膜脂过氧化,细胞质膜透性增大,MDA含量和相对电导率不断增加(图8~图9),叶绿素不断降解(图10),L*、a*、b*值逐渐增加(图11),小白菜逐渐失去鲜绿状态。这与许凤[43]在西兰花黄化方面的研究相似。
产生速率不断增长(图7),机体内的活性氧处于高水平、不稳定、不平衡的状态,积累的活性氧攻击细胞膜,加速了膜脂过氧化,细胞质膜透性增大,MDA含量和相对电导率不断增加(图8~图9),叶绿素不断降解(图10),L*、a*、b*值逐渐增加(图11),小白菜逐渐失去鲜绿状态。这与许凤[43]在西兰花黄化方面的研究相似。
适宜的乙醇熏蒸处理能诱导机体针对活性氧引发的氧胁迫作出相应的应对措施。果蔬体内存在着由抗氧化酶和抗氧化物质组成的活性氧防御系统[44]。抗氧化酶包含有SOD、CAT、POD和APX等酶类,它们相互协调来减轻机体的氧化损伤,是清除活性氧的主力军[45];抗氧化物质也具有防御活性氧的功能,包含有ASA、GSH等物质[46-47]。在活性氧清除过程中,这两大系统相互配合,共同清除机体中积累的活性氧,维持机体内氧化与抗氧化之间的平衡。乙醇调控活性氧代谢的途径如下:首先,乙醇通过诱导抗氧化酶活性的提升,抑制抗氧化物质含量的减少,从而提高机体的活性氧清除效率;紧接着,活性氧清除能力的提升使得蓄积的活性氧逐渐被清除,从而减缓活性氧的产生速率,逐渐达到活性氧产生——清除平衡。本研究中500、750 μL/L的乙醇熏蒸处理诱导了抗氧化酶SOD、CAT、POD和APX活性的提高,延缓了抗氧化物质ASA和GSH含量的下降,从酶和非酶两方面提升了活性氧的清除能力,使得![]() 产生速率的增势放缓。
产生速率的增势放缓。
本研究发现,小白菜贮藏期间CAT活性、APX活性、ASA含量和GSH含量的下降,加速了![]() 产生,活性氧积累诱导机体产生应激反应,反之诱导了抗氧化酶CAT、APX、SOD、POD活性的提升并减少了抗氧化物质ASA、GSH的消耗,促进机体清除自由基。这与王慧倩[39]研究青花菜抗氧化活性时的结果一致。
产生,活性氧积累诱导机体产生应激反应,反之诱导了抗氧化酶CAT、APX、SOD、POD活性的提升并减少了抗氧化物质ASA、GSH的消耗,促进机体清除自由基。这与王慧倩[39]研究青花菜抗氧化活性时的结果一致。
并非所有的乙醇熏蒸浓度均对小白菜有护绿效果,本研究中,1 000 μL/L乙醇熏蒸处理由于浓度过高,对小白菜的破坏能力超出其自身修复能力,不利于小白菜的采后护绿。1 000 μL/L乙醇不利于贮藏中期SOD、CAT活性和GSH含量的维持,贮藏后期ASA含量下降趋势快于对照组,活性氧代谢平衡被打破,难以维持较低的MDA含量和相对电导率,引发了膜损伤,最终加速了叶绿素的降解,难以保持鲜绿状态。
综上所述,500、750 μL/L的乙醇处理通过提升活性氧清除酶活力,维持较高的抗氧化物质含量,从而提高机体内部的活性氧清除能力,抑制活性氧的产生速率,维持活性氧产生——清除平衡,进而减弱膜损伤,在整个贮藏期间保持较高的叶绿素含量和较低的L*、a*、b*值,达到护绿效果,以750 μL/L组效果最佳。而1 000 μL/L组在贮藏中期诱导SOD和APX活性的能力不如对照组,其![]() 产生速率、MDA含量和相对电导率在第3天时更是显著高于对照组(P<0.05),到贮藏结束时其叶绿素含量仅为对照组的51.84%,差异极显著(P<0.01),由此看来,过高浓度的乙醇处理会减弱活性氧清除能力,导致活性氧积累,加剧细胞膜的氧化损伤,反而加速了叶绿素的降解。
产生速率、MDA含量和相对电导率在第3天时更是显著高于对照组(P<0.05),到贮藏结束时其叶绿素含量仅为对照组的51.84%,差异极显著(P<0.01),由此看来,过高浓度的乙醇处理会减弱活性氧清除能力,导致活性氧积累,加剧细胞膜的氧化损伤,反而加速了叶绿素的降解。
[1] 罗本钒. 小白菜遗传多样性分析及优良性状鉴定与利用[D].武汉:华中农业大学, 2015.
[2] 乔勇进, 张辉,唐坚,等.采后小白菜叶绿体色素含量变化及其叶绿素降解动力学的研究[J].食品安全质量检测学报,2013,4(6):1 692-1 698.
[3] 赵昕, 吴子龙,王鑫昕,等.橘皮精油对小白菜保鲜效果的影响[J].食品科技,2017,42(11):45-49.
[4] 高春霞,乔勇进,甄凤元,等.气调贮藏对小白菜品质及生理生化特性的影响[J].食品与发酵科技,2017,53(1):1-5;73.
[5] 高升. 1-MCP处理对小白菜采后生理特性及品质的影响研究[D].浙江:浙江农林大学,2013.
[6] 宋卤哲, 胡文忠,姜爱丽,等.乙醇熏蒸处理对中华猕猴桃生理代谢及贮藏品质的影响[J].食品工业科技,2019,40(23):266-271.
[7] 巴良杰, 马立志,余磊,等.乙醇熏蒸结合乙烯吸附剂对蓝莓保鲜效果的影响[J].包装工程,2019,40(19):66-72.
[8] XU F,CHEN X,JIN P,et al.Effect of ethanol treatment on quality and antioxidant acti ity in posthar est broccoli florets[J].European Food Research & Technology,2012,235(5):793-800.
[9] 邢皓. 荷兰豆采后品质劣变规律及调控技术研究[D].海口:海南大学,2015.
[10] 肖婷, 陈东秀,罗鸿,等.乙醇熏蒸对红薯尖冷藏期间品质的影响[J].食品与发酵工业,2019,45(15):209-217.
[11] 陶炜煜. 乙醇及抗菌膜在最小加工西兰花保鲜上的应用[D].北京:北京林业大学,2006.
[12] 李丹, 陈宇航,岳凤丽,等.不同体积分数乙醇熏蒸对电商物流西兰花保鲜效果的影响[J].食品工业,2019,40(8):59-63.
[13] 王敏. SOD1模型化合物调控干旱胁迫下水稻细胞的抗氧化活性[D].武汉:华中师范大学,2011.
[14] TAKESHI S,NORIAKI K,KIYOSHI S.Breakdown of photosynthetic pigments and lipids in spinach lea es with ozone fumigation:Role of acti e oxygens[J].Physiologia Plantarum,2006,59(1):28-34.
[15] ICENTINI F,RTENSTEINER S,SCHELLENBERG M,et al.Chlorophyll breakdown in senescent lea es identification of the biochemical lesion in a stay-green genotype of Festuca pratensis Huds.[J].New Phytologist,1995,129(2):247-252.
[16] 王羽, 云雪艳,李见森,等.PA/PE复合膜对鲜切莴笋保鲜效果的影响[J].食品科学,2015,36(24):343-347.
[17] 徐芬芬, 叶利民,徐卫红,等.小白菜叶绿素含量的测定方法比较[J].北方园艺,2010(23):32-34.
[18] 程曦. 控温包装在莴笋尖常温物流过程中的保鲜机理及优化研究[D].重庆:西南大学,2017.
[19] 曹建康, 姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.
[20] 王学奎. 植物生理生化实验原理和技术[M].北京:高等教育出版社,2006.
[21] 李合生. 植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[22] 赵世杰, 苍晶.植物生理学试验指导[M].北京:中国农业出版社,2015.
[23] QIAN M,LI X,SHEN Z,et al.Adapti e copper tolerance in Elsholtzia haichowensis in ol es production of Cu-induced thiol peptides[J].Plant Growth Regulation,2005,47(1):65-73.
[24] YAN B,DAI Q,LIU X,et al.Flooding-induced membrane damage,lipid oxidation and acti ated oxygen generation in corn lea es[J].Plant and Soil,1996,179(2):261-268.
[25] 林文洁, 陈丽晖.植物体中的自由基[J].海南大学学报(自然科学版),1998,16(4):370-375.
[26] 黄仁华. 甜橙果实抗氧化特性及水杨酸对其影响的研究[D].武汉:华中农业大学,2007.
[27] 姬亚茹, 周福慧,姜爱丽,等.乙醇熏蒸处理对采后蓝莓果实品质的影响[J].包装工程,2018,39(13):85-92.
[28] 项翠琴, 陈自强,傅慰祖.乙醇对大鼠神经行为及相关酶的影响[J].环境与职业医学,2002(5):293-295.
[29] 赵昱瑄, 张敏,姜雪,等.短时热处理对低温逆境下黄瓜不同部位的冷害及活性氧代谢影响[J].食品与发酵工业,2020,46(7):180-187.
[30] ZHANG R,GUO X,ZHANG Y,et al.Influence of modified atmosphere treatment on post-har est reacti e oxygen metabolism of pomegranate peels[J].Natural Product Research,2020,34(5):740-744.
[31] CHEN C,HU W,ZHANG R,et al.Effects of hydrogen sulfide on the surface whitening and physiological responses of fresh-cut carrots[J].Journal of the Science of Food and Agriculture,2018,98(12):4 726-4 732.
[32] 张昂, 郑瑜琬,陈腾,等.葡萄休眠解除过程中冬芽组织活性氧与抗氧化系统的变化特征[J].西北植物学报,2012,32(10):2 075-2 081.
[33] DA EY M W,MONTAGU M,INZE D,et al.Plant L-ascorbic acid:chemistry,function,metabolism,bioa ailability and effects of processing[J].Journal of the Science of Food and Agriculture,2000,80(7):825-860.
[34] 于延文. 乙烯和ABA通过ABI4调控抗坏血酸生物合成和活性氧积累的分子基础[D].北京:中国农业科学院,2018.
[35] SHAN C,ZHOU Y,LIU M.Nitric oxide participates in the regulation of the ascorbate-glutathione cycle by exogenous jasmonic acid in the lea es of wheat seedlings under drought stress[J].Protoplasma,2015,252(5):1 397-1 405.
[36] ABED S, ALENTINA M,MICHA ,et al.Response of the culti ated tomato and its wild salt-tolerant relati e Lycopersicon pennellii to salt-dependent oxidati e stress:The root antioxidati e system[J].Physiologia Plantarum,2001,112(4):487-494.
[37] 罗娅, 汤浩茹,张勇.低温胁迫对草莓叶片SOD和AsA-GSH循环酶系统的影响[J].园艺学报,2007,34(6):1 405-1 410.
[38] 赵宇瑛. 黄瓜磷脂酶D和抗氧化系统对采后机械损伤胁迫的响应[D].杭州:浙江大学,2011.
[39] 王慧倩. 乙醇预处理对鲜切西兰花品质和抗氧化活性影响[D].南京:南京农业大学,2014.
[40] 周奕含, 孙扬,李晨曦,等.胚乳裂纹对玉米种子萌发过程中保护酶活性的影响[J].玉米科学,2014,22(2):93-97.
[41] TURRENS J F.Mitochondrial formation of reacti e oxygen species[J].The Journal of physiology,2003,552(2):335-344.
[42] 许婷婷, 张婷婷,姚文思,等.热处理对低温胁迫下黄瓜活性氧代谢和膜脂组分的影响[J].核农学报,2020,34(1):85-93.
[43] 许凤. 采后处理对延缓青花菜衰老的作用及其机理研究[D].南京:南京农业大学,2012.
[44] 庞强强, 周曼,孙晓东,等.菜心耐热性评价及酶促抗氧化系统对高温胁迫的响应[J].浙江农业学报,2020,32(1):72-79.
[45] 王新坤,刘超,杨清梅,等.日喀则市青稞全籽粒抗氧化品质研究[J].核农学报,2020,34(1):120-130.
[46] 温银元, 郭平毅,尹美强,等.扑草净对远志幼苗根系活力及氧化胁迫的影响[J].生态学报,2012,32(8):2 506-2 514.
[47] 刘慧英, 朱祝军,吕国华.低温胁迫对嫁接西瓜耐冷性和活性氧清除系统的影响[J].应用生态学报,2004,15(4):659-662.