ATP生物荧光增幅法在微生物检测中的可行性研究─应用于化妆品领域
翟磊1,葛媛媛1,洪海军2,刘吉泉3,李婷1,沈颖2,林雅芳4,蔡俊松3,刘骥5,刘瑞娜1,王旭3,姚粟1*
1(中国食品发酵工业研究院有限公司,北京,100015)2(联合利华(中国)有限公司,上海,200335) 3 (Procter & Gamble International Operations,新加坡,138547) 4(北京宝洁技术有限公司,北京,101312)5(查士利华微生物应用技术(上海)有限公司,上海,201708)
摘 要 为探究ATP生物荧光增幅法在化妆品微生物检测中应用的可行性,开展了富集培养基促生长能力测试和产品适用性试验。收集了与化妆品原料及其生产环境相关的47株代表性菌株,在富集培养基MTAT中生长良好,ATP生物荧光增幅检测结果均为阳性。分别选取了清洁类、护理类、美容修饰类中6种化妆品,接种6株《中国药典》(2020版)参考菌株,进行了产品适用性试验。样品影响测试结果表明:培养基空白的信号值在167~285 RLU, 6种产品的本底信号值在87~199 RLU,远低于3倍培养基空白信号值的要求;ATP回收率在73.8%~106.8%,均高于25%的推荐值,符合检测方法的要求。接菌试验结果表明,供试样品的检测结果均为阳性,化妆品的抑菌作用可被有效消除。因此,ATP生物荧光增幅法具有在化妆品及相关领域开展微生物快速筛选与检测的良好应用前景。
关键词 ATP生物荧光增幅法;化妆品;微生物检测;促生长能力
DOI:10.13995/j.cnki.11-1802/ts.025092
引用格式:翟磊,葛媛媛,洪海军,等.ATP生物荧光增幅法在微生物检测中的可行性研究─应用于化妆品领域[J].食品与发酵工业,2020,46(21):201-206.ZHAI Lei,GE Yuanyuan,HONG Haijun,et al.Feasibility study on the amplified ATP bioluminescence assay in microbial detection: A case study in cosmetics[J].Food and Fermentation Industries,2020,46(21):201-206.
Feasibility study on the amplified ATP bioluminescence assay in microbial detection: A case study in cosmetics
ZHAI Lei1,GE Yuanyuan1,HONG Haijun2,LIU Jiquan3,LI Ting1,SHEN Ying2, LIN Yangfang4,CAI Junsong3,LIU Ji5,LIU Ruina1,WANG Xu3,YAO Su1*
1(China National Research Institute of Food & Fermentation Industries Co., Ltd., Beijing 100015, China) 2(Unile er (China) Limited, Shanghai 200335, China)3(Procter & Gamble International Operations, 138547, Singapore) 4(Procter & Gamble Technologies (Beijing) Ltd., Beijing 101312, China) 5(Charles Ri er Microbial Solutions (Shanghai) Company Limited, Shanghai 201708, China)
ABSTRACT To explore the feasibility of amplified ATP bioluminescence method for microbial detection in cosmetics, growth promotion test of an enrichment medium and product suitability test were carried out. Forty-se en representati e strains rele ant to raw materials and production en ironment of cosmetics were collected and tested. They all grew well in the enrichment medium, and the detection results of amplified ATP bioluminescence were all positi e. Subsequently, six kinds of cosmetics from cleanser, care cosmetics and makeup categories were selected and inoculated with six reference strains recommended by Chinese Pharmacopoeia (2020) for product suitability test. Results of sample effect test showed that the signal alue of medium blank was between 167-285 RLU, while the background signal alue of 6 products was between 87-199 RLU, which was far below the requirement of 3-fold of medium blank signal alue. ATP reco ery ranged from 73.8% to 106.8%, both higher than the recommended alue of 25%, which met the requirements of the detection method. Results of spiking test showed that all the samples tested were positi e, pro ing efficient elimination of antimicrobial effect of cosmetics. Therefore, amplified ATP bioluminescence assay has a promising application prospect in the rapid screening and detection of microorganisms in cosmetics and related fields.
Key words amplified ATP bioluminescence method; cosmetics; microbial detection; growth promotion test
第一作者:博士,高级工程师(姚粟教授级高级工程师为通讯作者,E-mail:milly@china-cicc.org)
收稿日期:2020-07-18,改回日期:2020-07-24
近年来,我国化妆品质量显著提升,据不完全统计,2015年至今我国化妆品市场抽检合格率平均达到95%以上,但不合格产品中的微生物污染问题仍然存在并被社会重点关注[1-4]。《化妆品安全技术规范》[5](2015年版)(以下简称《规范》)将菌落总数、霉菌和酵母菌纳入常规检验项目,检测方法为平板计数法,该方法检验周期较长、使用人工计数,效率较低,目前已无法完全适应化妆品行业产能扩大、流通加速的迅猛发展需求[6]。当前微生物快速检验新兴技术不断涌现[7-10],新方法开发、验证、适用性评价及标准化应用成为微生物安全控制领域的研究热点并取得显著进展[11-14]。各国药典和国际组织陆续颁布并不断完善替代方法验证相关指南。借鉴国内外食品和制药等微生物检验领域的成功运用经验,对我国化妆品微生物检验方法开展系统性研究[15],将有力推动化妆品微生物检测效率和过程控制水平提升,并在保障产品安全和消费者权益方面发挥重要作用。
本课题组前期基于ATP生物荧光技术[16-19]建立了一套适用于微生物快速检测的ATP生物荧光增幅法,具有检测速度快,准确度高的特点,可在48 h内实现样品中细菌、霉菌和酵母菌的定性检验。该方法利用微生物体内的腺苷酸激酶AK,催化添加的二磷酸腺苷ADP转换为三磷酸腺苷ATP,短时间内实现ATP增幅;通过添加荧光素酶和荧光素,将ATP高能键在断裂过程中产生的能量转化为生物荧光信号,通过计算生物荧光信号强度判断样品中是否含有微生物。为评价ATP生物荧光增幅法在化妆品微生物检测中应用的可行性,本研究收集了与化妆品原料及其生产环境相关的47株代表性菌株,进行了富集培养基MTAT的促生长能力测试;选取了清洁类、护理类、美容修饰类6种化妆品,通过样品影响测试和接菌试验来评价化妆品产品的适用性,探究ATP生物荧光增幅法在化妆品及相关领域开展微生物快速筛选与检测的应用前景。
1 仪器与材料
1.1 试验仪器
Celsis® Ad ance II 光度计,Charles Ri er Laboratories;恒温振荡摇床THZ-98AB,上海一恒科学仪器有限公司;往复式摇床,EBERBACH;恒温培养箱GHP-9270,上海一恒科学仪器有限公司;生物安全柜AC2-4S1,ESCO。
1.2 试验菌株
通过文献调研,结合微生物分类学特征和生长特性,本研究收集了与化妆品原料及其生产环境相关的47种细菌、霉菌和酵母菌代表菌株,用于促生长能力测试和产品适用性试验,具体菌株信息见表1。
1.3 试验样品
根据化妆品分类标准[20],选取了清洁类、护理类、美容修饰类6种化妆品,包括洗发水、沐浴液、护发素、定型水、面霜和面膜,每种产品选取3个不同生产批次。
1.4 试验试剂
改良TAT(MTAT)培养基:TAT肉汤 22.50 g/L,硫代硫酸钠 0.50 g/L、组氨酸 0.10 g/L、蛋白胨 7.50 g/L、葡萄糖 15.00 g/L、氯化钠 0.85 g/L、卵磷脂1.43 g/L和吐温80 39.00 g/L,pH 值调至7.0±0.1;ATP生物荧光增幅法试剂,Charles Ri er Laboratories Celsis® AMPiScreenTM;消泡剂,J.T.Baker® Antifoam B®Silicone Emulsion;0.5 mm玻璃珠,BioSpec Product。
2 实验方法
2.1 促生长能力测试
将试验收集的细菌和酵母菌制备成10~100 CFU/10 mL的菌悬液,霉菌制备10~100 CFU/10 mL的孢子悬液,接种到90 mL富集培养基MTAT,置于(30±2) ℃摇床,200 r/min,振荡培养24~48 h。在24或48 h取样,使用ATP生物荧光增幅法对富集培养物进行上机检测,若样品为霉菌,则需使用玻璃珠破壁处理30 min后再上机检测。同时,将细菌富集培养物接种于卵磷脂吐温80-营养琼脂培养基,置于(36±1) ℃培养箱,培养(48±2) h;酵母菌和霉菌富集培养物接种于虎红培养基,置于(28±2) ℃培养箱,培养5 d,确认接种物是否有微生物生长。
表1 促生长能力测试结果
Table 1 Growth promotion test results

序号菌株比值(样品RLU/培养基空白RLU)检测结果培养确认序号菌株比值(样品RLU/培养基空白RLU)检测结果培养确认1白色念珠菌(Candida albicans)CICC 1965649 351P1*+2*2酿酒酵母(Saccharomyces cere isiae)CICC 1001649 351P+3拜耳接合酵母(Zygosaccharomyces bailli)CICC 1281103*P+4异常威克汉姆酵母(Pichia anomala)CICC 19667 525P+5胶红酵母(Rhodotorula mucilaginosa)CICC 3170043P+6黑曲霉(Aspergillus niger)CICC 248767P+7聚多曲霉(Aspergillus sydowii)CICC 40930143*P+8巴西曲霉(Aspergillus brasiliensis)CICC 246359P+9产黄青霉(Penicillium chrysogenum)CICC 4065421P+10扩展青霉(Penicillium expansum)CICC 40658124P+11桔青霉(Penicillium citrinum)CICC 41727 (=FC 24773)9P+12绳状青霉(Penicillium funiculosum)CICC 40279123*P+13平滑正青霉(Eupenicillium le itum)CICC 4108649P+14宛氏拟青霉(Paecilomyces ariotii)CICC 4025163*P+15草酸青霉(Penicillium oxalicum)CICC 4009441P+16树脂枝孢霉(Cladosporium resinae)CICC 41706 (=NBRC 31709)63*P+17小孢根霉(Rhizopus microsporus)CICC 31462 941P+18烟曲霉(Aspergillus fumigatus)CICC 4102256P+19迟缓芽胞杆菌 (Bacillus lentus)CICC 10365135P + 20大肠埃希氏菌(Escherichia coli)CICC 10389689 655P+21弗氏柠檬酸杆菌(Citrobacter freundii)CICC 104045 309P+22阴沟肠杆菌(Enterobacter cloacae)CICC 21539689 655P+23日勾维多细菌源菌(Pluralibacter gergo iae)CICC 24132689 655P+24铜绿假单胞菌(Pseudomonas aeruginosa)CICC 10419689 655P+25荧光假单胞菌(Pseudomonas fluorescence)CICC 21620689 655P+26恶臭假单胞菌(Pseudomonas putida)CICC 216248 948P+27洋葱伯克霍尔德氏菌(Burkholderia cepacia)CICC 219268 138P+28肺炎克雷伯氏菌(Klebsiella pneumoniae)CICC 1087016 739P+29产酸克雷伯氏菌(Klebsiella oxytoca)CICC 21518689 655P+30嗜麦芽糖寡养单胞菌(Stenotrophomonas maltophilia)CICC 22935689 655P+31小肠结肠炎耶尔森氏菌(Yersinia enterocolitica)CMCC 5225217 892P+32粘质沙雷氏菌(Serratia marcescens)CICC 10355689 656P+33肠沙门氏菌(Salmonella cholerasuis)CICC 2149314 758P+34肠沙门氏菌(Salmonella typhimurium)CICC 1042013 989P+35金黄色葡萄球菌(Staphylococcus aureus)CICC 10384641 026P+36沃氏葡萄球菌(Staphylococcus warneri)CICC 23992689 655P+37枯草芽胞杆菌(Bacillus subtilis)CICC 10275641026P+38蜡样芽胞杆菌(Bacillus cereus)CICC 10352641026P+39表皮葡萄球菌(Staphylococcus epidermidis)CICC 10436689 655P+40藤黄微球菌(Micrococcus luteus)CICC 102698P+41鸡肠球菌(Enterococcus gallinarum)CICC 2424016 305P+42粪肠球菌(Enterococcus faecalis)CICC 10396689 655P+43屎肠球菌(Enterococcus faecium)CICC 216052 051P+44嗜根考克氏菌(Kocuria rhizophila)CICC 10276307P+45单增李斯特氏菌(Listeria monocytogenes)FC 11262689 655P+46酿脓链球菌(Streptococcus pyogenes)CICC 10356497P+47黄曲霉(Aspergillus fla us)CICC 4163027P+
注: 1*,P表示阳性结果,即样品RLU值与培养基空白RLU值的比值大于3; 2*,+表示在卵磷脂吐温80-营养琼脂培养基或虎红培养基生长良好;3*,表示菌株培养48 h后的检测结果,其他菌株均为培养24 h后的检测结果
促生长能力测试通过的标准为,试验收集的47株微生物菌株均能在富集培养基MTAT中生长良好,且ATP生物荧光增幅法检测结果均为阳性。若促生长能力测试不能通过上述标准,需要对富集培养基的配方和培养条件进行优化。
2.2 产品适用性试验
产品适用性试验包括样品影响测试和接菌试验。化妆品产品在应用ATP生物荧光增幅法检测前,应先进行产品适用性试验来确定ATP生物荧光增幅法是否适用于待检产品。本研究选择大肠埃希氏菌(Escherichia coli)CICC 10389、铜绿假单胞菌(Pseudomonas aeruginosa)CICC 10419、金黄色葡萄球菌(Staphylococcus aureus)CICC 10384、枯草芽胞杆菌(Bacillus subtilis)CICC 10275、白色念珠菌(Candida albicans)CICC 1965和黑曲霉(Aspergillus niger)CICC 2487用于产品适用性试验研究。
2.2.1 样品影响测试
样品影响测试的目的是确保化妆品中的配方成分不会影响ATP生物荧光增幅法检测,每种产品检测3个不同生产批次。操作步骤为:将10~100 CFU试验菌株接种于10 mL富集培养基MTAT中制备菌悬液 (黑曲霉制备孢子悬液),同时将等量的菌液涂布于卵磷脂吐温-80营养琼脂培养基或虎红培养基上确认实际接种量。称取10 g产品,加至90 mL富集培养基MTAT中,充分振荡混匀,取10 mL 1∶10稀释液加到90 mL富集培养基MTAT制备成产品样品,同时将不接菌的富集培养基MTAT作为培养基空白。将上述制备的菌悬液、产品样品和培养基空白置于(30±2) ℃摇床,200 r/min,振荡培养48 h。取样,对富集培养后的产品样品进行上机检测,并使用平板培养方法确认产品中是否含有微生物;取900 μL培养基加入100 μL ATP标品,制备成ATP对照;取900 μL培养基空白加入100 μL富集培养物的100倍稀释液,制备成微生物对照;取900 μL产品样品加入100 μL ATP阳性对照标品,制备为ATP样品;取900 μL产品样品加入100 μL富集培养物的100倍稀释液,制备成微生物样品。将上述制备的样品和对照进行ATP生物荧光增幅法检测,同时取100 μL涂布于卵磷脂吐温80-营养琼脂培养基或虎红培养基上确认相应样品中是否含有微生物。样品影响测试结果的通过标准见表2。
表2 样品影响测试通过标准
Table 2 Success criteria for sample effect tests

编号项目标准A培养基空白<1 000 RLUBATP对照>3 倍培养基空白RLU微生物对照>3 倍培养基空白RLUC产品样品<3 倍培养基空白RLUDATP样品>3 倍培养基空白RLU微生物样品>3 倍培养基空白RLU产品ATP回收率/%>25(推荐值)
2.2.2 接菌试验
接菌试验主要用于确认加入样品中的防腐剂能否被富集培养基有效中和,每种产品检测3个不同生产批次。操作步骤为:称取10 g产品,加入90 mL富集培养基MTAT,充分振荡混匀,取10 mL 1∶10稀释液加到90 mL富集培养基MTAT制备成产品样品,同时将不接菌的富集培养基MTAT作为培养基空白。将试验菌株制备成10~100 CFU/100 μL的菌悬液(黑曲霉制备孢子悬液)备用,同时取100 μL涂布于卵磷脂吐温80-营养琼脂培养基或虎红培养基上以确认实际接种量。接种100 μL菌悬液或孢子悬液于产品样品中制备成微生物样品,同时接种100 μL菌悬液或孢子悬液于培养基空白中制备成微生物对照;将制备的产品样品、培养基空白、微生物样品和微生物对照置于(30±2) ℃摇床,200 r/min振荡培养48 h。对富集培养后的样品进行ATP生物荧光增幅法检测,若样品为霉菌,则需使用玻璃珠破壁处理30 min后再上机检测。同时取100 μL富集液涂布于卵磷脂吐温80-营养琼脂培养基或虎红培养基上确认样品中是否含有微生物。接菌试验通过的标准为,微生物样品和微生物对照的检测结果为阳性,未接菌的产品样品检测结果应为阴性。
3 结果与分析
3.1 促生长能力测试
促生长能力测试结果见表1。本研究收集的47株微生物菌株在富集培养基MTAT中生长良好,ATP生物荧光增幅检测结果均为阳性,并且在卵磷脂吐温80-营养琼脂培养基或虎红培养基上生长良好,表明富集培养基MTAT的促生长能力测试符合要求。
促生长能力测试主要考察MTAT培养基对菌株的富集培养能力,试验菌株的选择尤为关键。本研究结合微生物分类学特征和生长特性,选取与化妆品原料与生产环境相关的47种细菌、酵母和霉菌代表菌株,用于考察MTAT培养基的富集能力。从微生物分类特征上看,选取的菌株包括28株细菌(15株革兰氏阴性细菌和13株革兰氏阳性细菌),5株酵母菌和14株霉菌,具有良好的代表性。从生理特性上看,既有生长速度快的代表菌株,又有对营养苛求、生长较为缓慢的代表菌种,如聚多曲霉(Aspergillus sydowii)CICC 40930,绳状青霉(Penicillium funiculosum)CICC 40279,宛氏拟青霉(Paecilomyces ariotii)CICC 4025,拜耳接合酵母(Zygosaccharomyces bailli)CICC 1281和树脂枝孢霉(Cladosporium resinae)CICC 41706,在富集培养基MTAT中培养48 h后,ATP生物荧光增幅检测结果才为阳性。这5株真菌是生长缓慢的菌株的代表,为今后研究中生长缓慢代表菌株的选择提供了重要的依据。
3.2 产品适用性试验
3.2.1 样品影响测试
样品影响测试主要测试化妆品产品的本底信号值,确保化妆品配方成分不会影响ATP生物荧光增幅法的检测。检测结果见表3,培养基空白的信号值在167~285 RLU,远低于检测方法规定的 1 000 RLU,表明富集培养基MTAT本底信号符合要求。产品样品的信号值在87~199 RLU,也远低于3倍培养基空白信号值的要求,并且通过涂布平板确认化妆品样品中未见微生物污染。此外,ATP对照、微生物对照、ATP样品和微生物样品的信号值均大于3 倍培养基空白的信号值,并且测试产品中ATP回收率在73.8%~106.8%,高于25%的标准推荐值,表明本研究选取的6种产品均通过样品影响测试。
3.2.2 接菌试验
接菌试验主要是证明化妆品中的抑菌作用能否被富集培养基有效中和,检测结果见表4。培养基空白的信号值在145~178 RLU,远低于检测方法规定的1 000 RLU,产品样品的信号值在86~198 RLU,检测结果为阴性,并且涂布平板确认化妆品样品中未见微生物污染。而接种试验菌悬液的微生物对照和微生物样品,ATP生物荧光增幅法检测结果均为阳性,并且通过平板确认微生物对照和微生物样品中微生物生长良好,表明本研究选取的6种产品均通过接菌试验。
综合样品影响测试和接菌试验的检测结果,ATP生物荧光增幅法适用于本研究所选洗发水、沐浴液、护发素、定型水、面霜和面膜中微生物的快速筛选与检测,为后续该方法进行方法验证和方法适用性研究奠定了基础。
表3 样品影响测试结果
Table 3 Sample effect test results
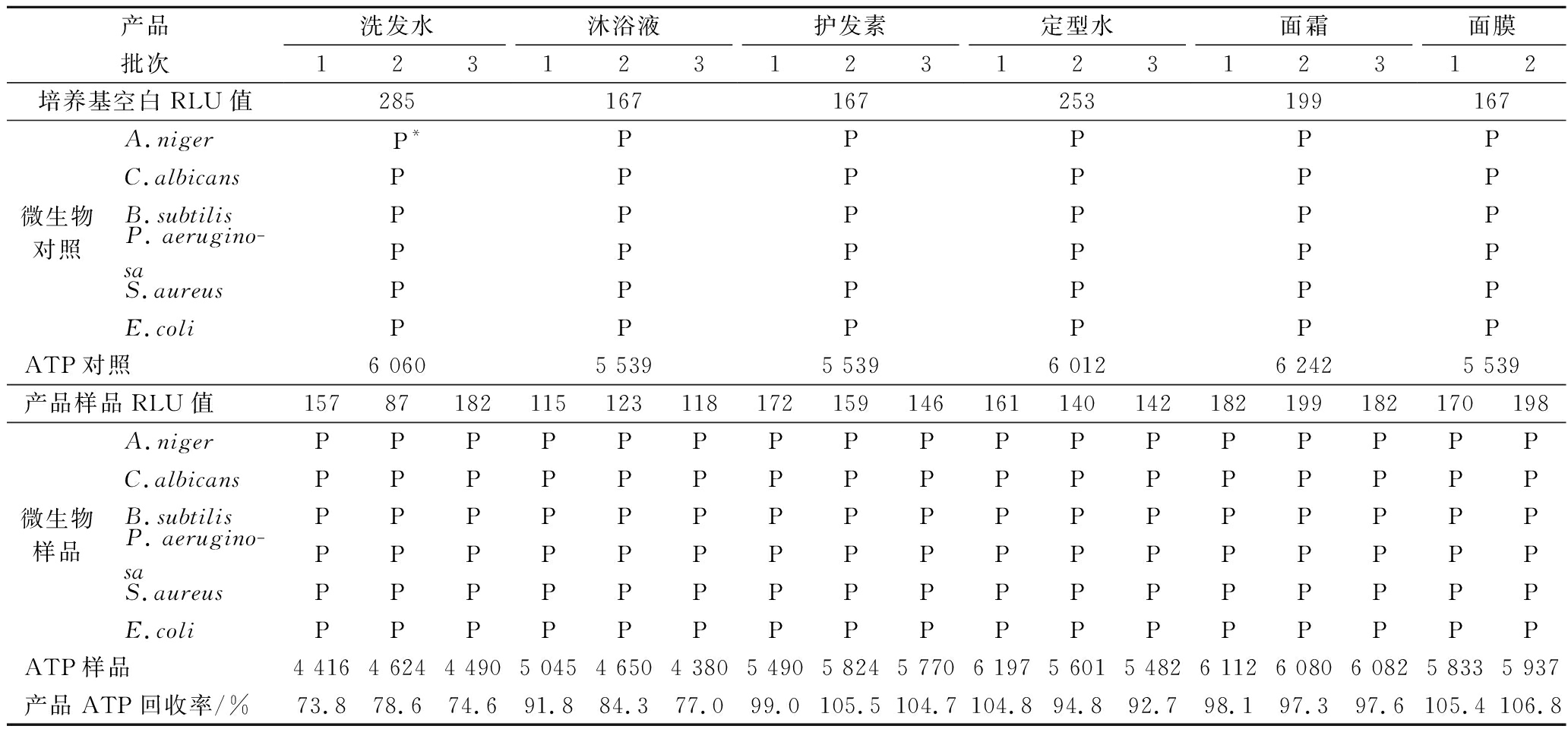
产品洗发水沐浴液护发素定型水面霜面膜批次123123123123123123培养基空白RLU值285167167253199167微生物对照A.niger P*PPPPPC.albicansPPPPPPB.subtilisPPPPPPP.aerugino-saPPPPPPS.aureusPPPPPPE.coliPPPPPPATP对照6 0605 5395 5396 0126 2425 539产品样品RLU值15787182115123118172159146161140142182199182170198166微生物样品A.nigerPPPPPPPPPPPPPPPPPPC.albicansPPPPPPPPPPPPPPPPPPB.subtilisPPPPPPPPPPPPPPPPPPP.aerugino-saPPPPPPPPPPPPPPPPPPS.aureusPPPPPPPPPPPPPPPPPPE.coliPPPPPPPPPPPPPPPPPPATP样品4 4164 6244 4905 0454 6504 3805 4905 8245 7706 1975 6015 4826 1126 0806 0825 8335 9375 818产品ATP回收率/%73.878.674.691.884.377.099.0105.5104.7104.894.892.798.197.397.6105.4106.8105.2
注:*表示阳性结果,即样品RLU值与培养基空白RLU值的比值大于3(下同)
表4 接菌试验结果
Table 4 Spiking test results

产品洗发水沐浴液护发素定型水面霜面膜批次123123123123123123培养基空白RLU值145178178145145178微生物对照A.niger P*PPPPPC.albicansPPPPPPB.subtilisPPPPPPP.aerugino-saPPPPPPS.aureusPPPPPPE.coliPPPPPP产品样品RLU值908687115123118172159146161140142150128154170198166微生物样品A.nigerPPPPPPPPPPPPPPPPPPC.albicansPPPPPPPPPPPPPPPPPPB.subtilisPPPPPPPPPPPPPPPPPPP.aerugino-saPPPPPPPPPPPPPPPPPPS.aureusPPPPPPPPPPPPPPPPPPE.coliPPPPPPPPPPPPPPPPPP
4 结论
本研究收集的与化妆品原料及其生产环境相关的47株代表性菌株,在富集培养基MTAT中生长良好,均通过了促生长能力测试;选取的清洁类、护理类、美容修饰类中6种化妆品均符合样品影响测试和接菌试验检测方法的要求。因此,ATP生物荧光增幅法具有在化妆品及相关领域开展微生物快速筛选与检测的良好应用前景。
参考文献
[1] 李青彬,赵晓军,王香,等.化妆品微生物污染状况及其分析[J].中国卫生检验杂志,2006,16(2):245-247.
[2] 谢小保,欧阳友生,陈仪本,等.化妆品微生物污染状况研究[J].中国卫生检验杂志,2005,15(9):1 105-1 105.
[3] 郑萍,陈西平.化妆品微生物污染情况调查[J].中国卫生检验杂志,2009,19(10):2 405-2 406.
[4] 郑萍,陈西平.化妆品的微生物污染问题及防腐效能评价方法[J].中国卫生检验杂志,2007,17(11):2 122-2 124.
[5] 化妆品安全技术规范(2015年版)[S].北京:国家食品药品监督管理总局,2015.
[6] 文霞,杨秀茳,谢小保.化妆品微生物检测技术的研究进展[J].日用化学工业,2015,45(2):110-114.
[7] 陈倩,陈昭斌.微生物快速检验方法新进展[J].中国卫生检验杂志,2016,26(7):1 061-1 064.
[8] 郝良玉,曲晗,李志萍,等.微流控技术在病原微生物检测中的应用[J].检验医学与临床,2018,15(21):3 299-3 302.
[9] 杜美红,赵瑞雪,李静雯.基质辅助激光解吸电离飞行时间质谱分析技术在微生物检测与鉴定中的应用[J].食品安全质量检测学报,2017,8(2):457-461.
[10] 董金颖,张阳,刘皓,等.拉曼光谱技术在病原微生物快速检测中的应用与展望[J].中华检验医学杂志,2018(1):5-8.
[11] ISO 16140-2,Microbiology of the Food Chain-Method alidation Part 2:Protocol for the alidation of Alternati e (Proprietary) Methods Against a Reference Method[S].International Organization for Standardization,2016.
[12] AOAC INTERNATIONAL Methods Committee Guidelines for alidation of Qualitati e and Quantitati e Food[S].Association of Official Analytical Chemists,2002.
[13] 《中国药典》[M].2020版.北京:国家食品药品监督管理总局,2020.
[14] 郑小玲,王银环,陈君豪,等.药品微生物检验替代方法国内外研究进展[J].药物分析杂志,2020,40(4):577-582.
[15] 白飞荣,葛媛媛,蔡俊松,等.化妆品中霉菌和酵母菌检验MSDA方法的验证研究[J].日用化学品科学,2019,42(6):40-47.
[16] SCOTT SPAETH,QUYNH TRAN,ZHIYUN LIU.E aluation of an ATP-bioluminescence rapid microbial screening method for in-process biologics[J].PDA Journal of Pharmaceutical Science and Technology,2018,72(6):574-583.
[17] 魏树源,杨京生,陈晓琦,等.三磷酸腺苷生物发光快速微生物检测法在疫苗中间无菌试验中的应用[J].中国生物制品学杂志,2010,23(10):1 120-1 124.
[18] LIEBERS ,BACHMANN D,FRANKE G,et al.Determination of ATP-acti ity as a useful tool for monitoring microbial load in aqueous humidifier samples[J].International Journal of Hygiene and En ironmental Health,2015,218:246-253.
[19] 路福平,闫青松.化妆品产品微生物快速检测-ATP快速荧光法[J].中国洗涤用品工业,2004(5):35-36
[20] GB/T 18670—2017化妆品分类[S].北京:中国标准出版社,2017.



