基于特征肽段的液相色谱质谱联用技术对核桃、杏仁露进行掺假鉴别
张淑霞1, 田亚1, 邢荣花2,刘胜男3, 王向军1*, 张守杰1
1(郑州海关技术中心,河南 郑州,450002)2(安阳海关,河南 安阳,455000)3(三门峡海关技术中心,河南 三门峡,472000)
摘 要 建立液相色谱串联质谱法测定核桃、杏仁、大豆和花生中的蛋白成分,并定量检测核桃露和杏仁露中常见外源成分大豆和花生的含量。样品经蛋白质提取,胰蛋白酶酶解后,采用高效液相色谱-四极杆/静电场轨道阱高分辨质谱 (high performance liquid chromatography coupled with quadrupole-exacti e mass spectrometry,HPLC-Q-Exacti e-MS)检测,数据经Proteome Disco erer软件与Uniprot蛋白数据库对比分析,筛选出各物种的特征肽段,然后利用高效液相色谱-三重四极杆质谱(high performance liquid chromatography coupled with triple quadrupole tandem mass spectrometry,HPLC-QQQ-MS)对核桃、杏仁、大豆和花生的特征多肽进行验证和多反应监测(multiple reaction monitoring, MRM)定量测定。经验证,鉴别方法有良好的专属性和高灵敏度,核桃露和杏仁露中核桃、杏仁、大豆和花生的最低检出限分别为16.3、7.7、1.3和6.8 mg/kg。该方法准确、灵敏,可有效分析植物蛋白饮料中各类蛋白质的来源,对食品植物源性成分的鉴定具有重要意义。
关键词 液相色谱串联质谱;特征肽段;植物蛋白饮料;掺假测定;外源成分
DOI:10.13995/j.cnki.11-1802/ts.024604
引用格式:张淑霞, 田亚, 邢荣花,等.基于特征肽段的液相色谱质谱联用技术对核桃、杏仁露进行掺假鉴别[J].食品与发酵工业,2020,46(21):215-222.ZHANG Shuxia,TIAN Ya,XING Ronghua, et al. Identification the adulteration of walnut and almond drink based on marker peptides with liquid chromatography mass spectrometry[J].Food and Fermentation Industries,2020,46(21):215-222.
Identification the adulteration of walnut and almond drink based on marker peptides with liquid chromatography mass spectrometry
ZHANG Shuxia1,TIAN Ya1,XING Ronghua2,LIU Shengnan3, WANG Xiangjun1*,ZHANG Shoujie1
1(Zhengzhou Customs Technical Center, Zhengzhou 450002, China)2(Anyang Customs, Anyang 455000, China) 3(Sanmenxia Customs Technical Center, Sanmenxia 472000, China)
ABSTRACT A liquid chromatography-mass spectrometry method was established for the identification of proteins from walnuts, almonds, soybeans and peanuts, and quantitati e detection of common exogenous ingredients such as soybean and peanut in walnut drink and almond drink. The samples were determined by ultra performance liquid chromatography-quadrupole/electrostatic field orbitrap high resolution mass spectrometry (HPLC-Q-Exacti e-MS) after protein extraction and tryptic digestion. The peptide markers of each species were obtained by data analysis with Proteome Disco erer software and Uniprot protein database, and then the erification and multiple reaction monitoring (MRM) of the marker peptides of walnut, almond, soybean and peanut were performed quantitati ely using high performance liquid chromatography-triple quadrupole mass spectrometry (HPLC-QQQ-MS). The results were erified and the identification method had good specificity and high sensiti ity. The limit of detection of walnut, almond, soybean and peanut in walnut and almond drink were 16.3 mg/kg, 7.7 mg/kg,1.3 mg/kg and 6.8 mg/kg respecti ely. This method is accurate and sensiti e, and can effecti ely analyze the origin of proteins in plant protein be erages. And this method is important for identification of plant-deri ed ingredients in food.
Key words liquid chromatography-tandem mass spectrometry; marker peptides; egetable protein be erages; adulteration detection; exogenous ingredients
第一作者:硕士,高级工程师(王向军工程师为通讯作者,E-mail:wxjciq@sina.com)
基金项目:海关总署科技计划项目(2017IK283;2017IK284)
收稿日期:2020-05-31,改回日期:2020-06-17
近年来,植物蛋白饮料已成为饮料市场的主流产品,越来越受消费者喜爱[1-2],随着消费人群的快速增长,不法商贩为了追求经济利益,以次充好,掺杂掺假,如在核桃、杏仁露饮品中掺入价格较为低廉的大豆、花生成分[3],这种商业欺诈行为不仅扰乱市场秩序,还侵犯了消费者的合法权益。因此,建立准确、可靠的植物蛋白饮料掺假的鉴定方法具有重要的现实意义。目前,植物蛋白饮料的掺假鉴别方法主要有酶联免疫分析(enzyme linked immuno sorbent assay,ELISA)、聚合酶链式反应(polymerase chain reaction,PCR)和液相色谱质谱联用技术。其中,ELISA技术的抗原抗体具有专一性,无法同时检测几种特异物种,且热加工工艺易导致蛋白质沉淀和抗原决定簇的破坏,影响检测结果的准确性[4-5];PCR技术可实现多目标物同时检测,是目前鉴定食品掺假成分的常用方法[6-9],但是其检测物DNA在高度加工过程中容易降解,且存在非特异性扩增引起DNA污染而导致假阳性结果的基质干扰问题[10-12];液相色谱质谱联用技术主要检测蛋白质或不同物种的特征多肽,稳定性强、灵敏度高,可以实现多物种的同时测定,并且能够避免复杂基质干扰及假阳性判别的问题。
随着靶向蛋白质组学的发展,基于液相色谱串联质谱技术的物种特征肽段检测已逐渐成为食品掺假鉴别和外源性成分鉴定的主要方法[13-15]。古淑青等[16]采用液质联用技术,鉴别出了羊肉、鸭肉、鸡肉和猪肉4种肉类的生物标志性肽段,并建立了羊肉中掺入鸭肉、鸡肉和猪肉的定量检测方法。BÖNICK等[17]利用液相色谱串联质谱技术,对面包中的小麦、斯佩耳特小麦和黑麦的真实性进行了检测。GU等[18]利用基于特征肽段的液相色谱质谱联用技术,测定了巧克力中大豆、花生、杏仁、核桃、榛子等过敏源成分的含量。但是基于特征肽段的液质联用技术定量测定核桃露和杏仁露中大豆、花生成分的研究还未见报道。
本文主要采用高效液相色谱-四级杆/静电场轨道阱高分辨质谱(high performance liquid chromatography coupled with quadrupole-exacti e mass spectrometr,HPLC-Q/Exactice-MS)和高效液相色谱-三重四级杆质谱(high performance liquid chromatography coupled with triple quadrupole tandem mass spectrometry,HPLC-QQQ-MS)相结合,筛选出核桃、杏仁、大豆和花生的特征肽段,并建立以特征肽段为检测对象的核桃露和杏仁露掺假鉴别测定方法,为打击植物蛋白饮料掺假行为、保证食品安全,提供有力的技术支撑。
1 材料与方法
1.1 主要仪器与设备
液相色谱-四极杆/静电场轨道阱质谱(HPLC-Q-Exacti e配Ultimate 3000液相色谱)、酶标仪,美国Thermo Fisher公司;液相色谱-三重四级杆质谱仪(Agilent 6470A配Agilent 1290 Infinity Ⅱ液相色谱),美国Agilent公司;5427 R台式高速冷冻离心机,德国Eppendorf公司;高温干燥箱,上海精宏实验设备有限公司;CF15RXII离心机,日本Hitachi公司;Y905制浆机,九阳股份有限公司;XS205天平,瑞士Mettler-Toledo公司;10 kDa超滤离心管,德国赛多利斯公司。
1.2 试剂与材料
测序级胰蛋白酶、二硫代苏糖醇(dithiothreitol,DTT),生化级,美国Promega公司;碘乙酰胺(iodoacetamide,IAA),生化级,美国Sigma公司;乙腈、甲酸、乙酸,均为色谱纯,美国Thermo Fishe公司;Brad-ford蛋白定量试剂盒,北京索莱宝科技有限公司;NH4HCO3、尿素为分析纯;所有实验用水由Milli-Q超纯水系统制备,美国Millipore公司。
核桃、杏仁、大豆、花生均购于当地农贸市场,4个品牌共6个批次的核桃露、杏仁露和核桃杏仁露样品购于当地大型超市。核桃露、杏仁露样品制备:称取去壳核桃仁、杏仁各7.000 g,加入240 mL 95 ℃热水,用打浆机将其打碎,过200目筛,均质,杀菌备用。混合果露样品制备:按以上制浆方法制备核桃大豆露、核桃花生露、杏仁大豆露及杏仁花生露,以核桃大豆露为例,大豆质量占坚果总质量(7.000 g)的10%、30%和50%。
1.3 实验方法
1.3.1 蛋白质提取
称取10 g样品,加入30 mL预冷乙腈混匀,于-20 ℃放置2 h,10 000 r/min离心5 min,弃去上清液,向沉淀中加入5 mL蛋白提取液(8 mol/L尿素,50 mmol/L NH4HCO3),垂直振荡30 min,溶解蛋白沉淀,10 000 r/min离心5 min, 上清液通过0.22 μm聚醚砜滤膜,一式3份,用Bradford试剂盒测定其蛋白质浓度。
对照样品核桃、杏仁、大豆、花生于40 ℃鼓风干燥箱内干燥24 h,用粉碎机进行细粉碎。称取1 g粉粹样品加入10 mL正己烷振荡3 min,10 000 r/min离心3 min,弃去上清液,重复1次,去除脂肪。加入10 mL蛋白提取液(8 mol/L尿素,50 mmol/L NH4HCO3),步骤同上。
1.3.2 蛋白质酶解
取200 μL上清液转移至1.5 mL离心管中,加入2 μL 1 mol/L的DTT溶液,60 ℃下反应1 h,冷却至室温后加入10 μL 1 mol/L的IAA溶液,常温下避光反应30 min。采用10 kDa超滤离心管在13 200 r/min下离心超滤15 min,并用200 μL 50 mmol/L NH4HCO3溶液置换3次,弃去下层溶液,加入200 μL 50 mmol/L NH4HCO3溶液复溶膜上层蛋白,按酶和底物质量比1∶50加入胰蛋白酶溶液混匀,于37 ℃酶解16 h,加入2 μL甲酸终止反应,13 200 r/min离心10 min,下层获得蛋白多肽样品溶液,上机测定。
1.3.3 HPLC-Q/Exacti e-MS条件
色谱条件:PAK C18 MGIII色谱柱(2.0 mm×150 mm,3 μm);柱温45 ℃;流动相A为0.1%(体积分数)甲酸-水溶液;流动相B为0.1%(体积分数)甲酸-乙腈。梯度洗脱程序:0~1 min,10% B;1~17 min,10% B~35% B;17~19 min,35% B~90% B;19~21 min,90% B~10% B;21~25.5 min,10% B。流速0.3 mL/min;进样体积10 μL。
质谱条件:喷雾电压3 500 ;毛细管温度320 ℃;离子源加热温度250 ℃;鞘气流量30 Arb,辅助气流量10 Arb;质谱扫描模式Full MS-ddMS2(TopN);全扫描分辨率70 000 FWHM;AGC target 3e6;进样时间100 ms;二级扫描分辨率 17 500 FWHM;AGC target 2e5;进样时间110 ms;碰撞能量30 e 。
1.3.4 HPLC-QQQ-MS条件
色谱条件:同1.3.3。
质谱条件:ESI源,采用正离子模式;毛细管电压4 000 ,喷嘴电压1 000 ,干燥气温度350 ℃,干燥器流速9 L/min,鞘气温度350 ℃,鞘气流速11 L/min,雾化器压力30 psi。
2 结果与分析
2.1 高分辨质谱特异肽段的筛选
特征肽段指某一个蛋白质所特有的能够将其与其他蛋白质特异性区分的肽段序列。特征肽段的筛选应遵循以下原则[19-20]:以7~20个氨基酸长度的肽为宜;不含错切或漏切的酶切位点;避免出现天冬氨酸的水解、甲硫氨酸的氧化和谷氨酰胺的脱酰胺等不稳定肽段;选择具有稳定的物理化学性质,有响应较强的碎片离子,进行定性定量分析时,有较好的灵敏度和峰形的肽段。本实验采用HPLC-Q-Exacti e Full MS-ddMS2(TopN)模式分析胰蛋白酶酶解后的核桃、杏仁、大豆、花生多肽样品,数据经Proteome Disco erer软件和Uniprot蛋白数据库对比分析,通过比较这4个物种鉴定的蛋白质和肽段列表,找到每个物种独有的多肽信息,如表1所示。研究发现杏仁的GNLDF QPPR、 FSNDIL AALNTPR、大豆的EAFG NMQI R、LITLAIP NKPGR和TISSEDKPFNLR及花生的RPFYSNAPQEIFIQQGR因含有KR,KP,RP不适合做定量分析,为保证鉴定结果的重现性和灵敏度,在定量方法中未选择其作为鉴定物种来源的特征肽段。
表1 核桃、杏仁、大豆和花生的特征肽段
Table 1 Marker peptides of walnut, almond,
soybean and peanut

物种蛋白质名称Uniprot 登录号肽段序列杏仁Pru 1A0A5E4FFS0QETIALSSSQQRQQEQLQQERISTLNSHNLPILRYNRQETIALSSSQQR核桃Jug r 1Q9SEW4FFDQQEQRATLTL SQETRDFLAGQNNIINQLERJug r 2A0A2I4EX90GEEMEEM QSARQQQQQGLR大豆Glycinin G1A0A0R0KKD6 LI PQNF AARSQSDNFEY SFK FDGELQEGRGlycinin G5P02858LSAEFGSLRISTLNSLTLPALRβ-conglycinin alpha'-subunitA0A445ISA2QQQEEQPLE RDSYNLQSGDALR花生Ara h 3/4A0A444YLX0FNLAGNHEQEFLRSPDIYNPQAGSLKAH Q DSNGDRTANELNLLILRAra h 1N1NG13NNPFYFPSRGTGNLEL A RSFNLDEGHALRAra h 3N1NKA3TANDLNLLILR
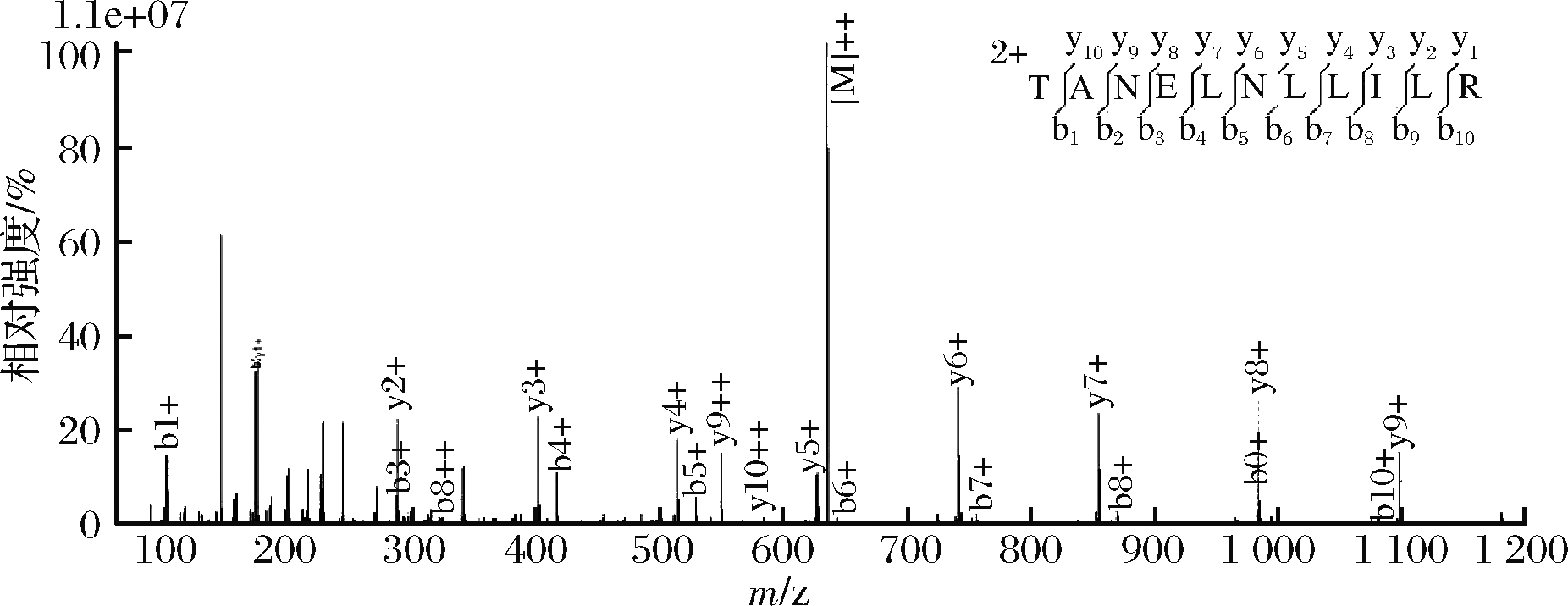
二级质谱用于鉴定特征肽段的碎片离子,用来考察特征肽段碎片离子的检测结果与理论推测的吻合性,多肽在电喷雾电离中主要产生N端碎片离子(b离子)和C端碎片离子(y离子)。以花生Ara h 3/4蛋白的特征肽段TANELNLLILR(m/z 628.4)为例,如图1所示,图中灰色和浅灰色谱线分别代表理论b离子和y离子的碎片峰,黑色谱线代表实验获得的离子碎片峰,可以看出实验获得的谱图和预测的碎裂模式匹配度很高,20个b、y碎片离子均得到鉴定。
2.2 三重四级杆质谱多反应监测(multiple reaction monitoring,MRM)模式分析
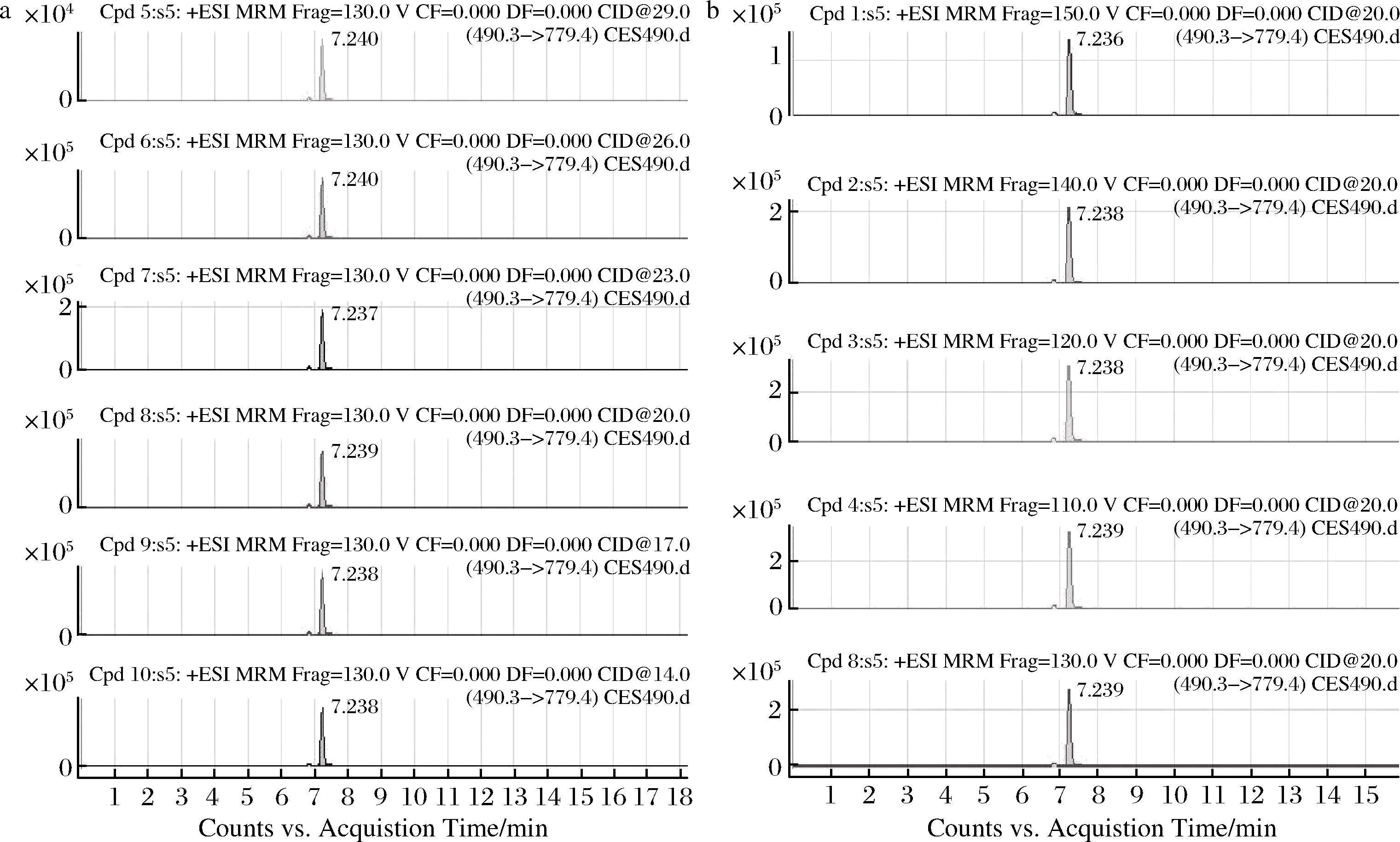
利用Skyline软件在HPLC-QQQ-MS平台上构建了特征肽段的MRM方法,优化碰撞能量(collision energy,CE)和碎裂电压(fragmentor),提高各特征肽段的响应强度。图2为对大豆特征肽段LSAEFGSLR的490.3(2+)→779.4(+)离子通路施加不同fragmentor值和CE值得到的相应强度,可见当fragmentor为130 时,肽段响应强度最高。如此,针对每个离子对优化出了最佳的CE值和fragmentor值,生成最终的Dynamic MRM定量方法,MRM方法中各物种特征肽段离子对信息见表2,各物种特征肽段的提取离子色谱图见图3。
2.3 特异肽段的验证
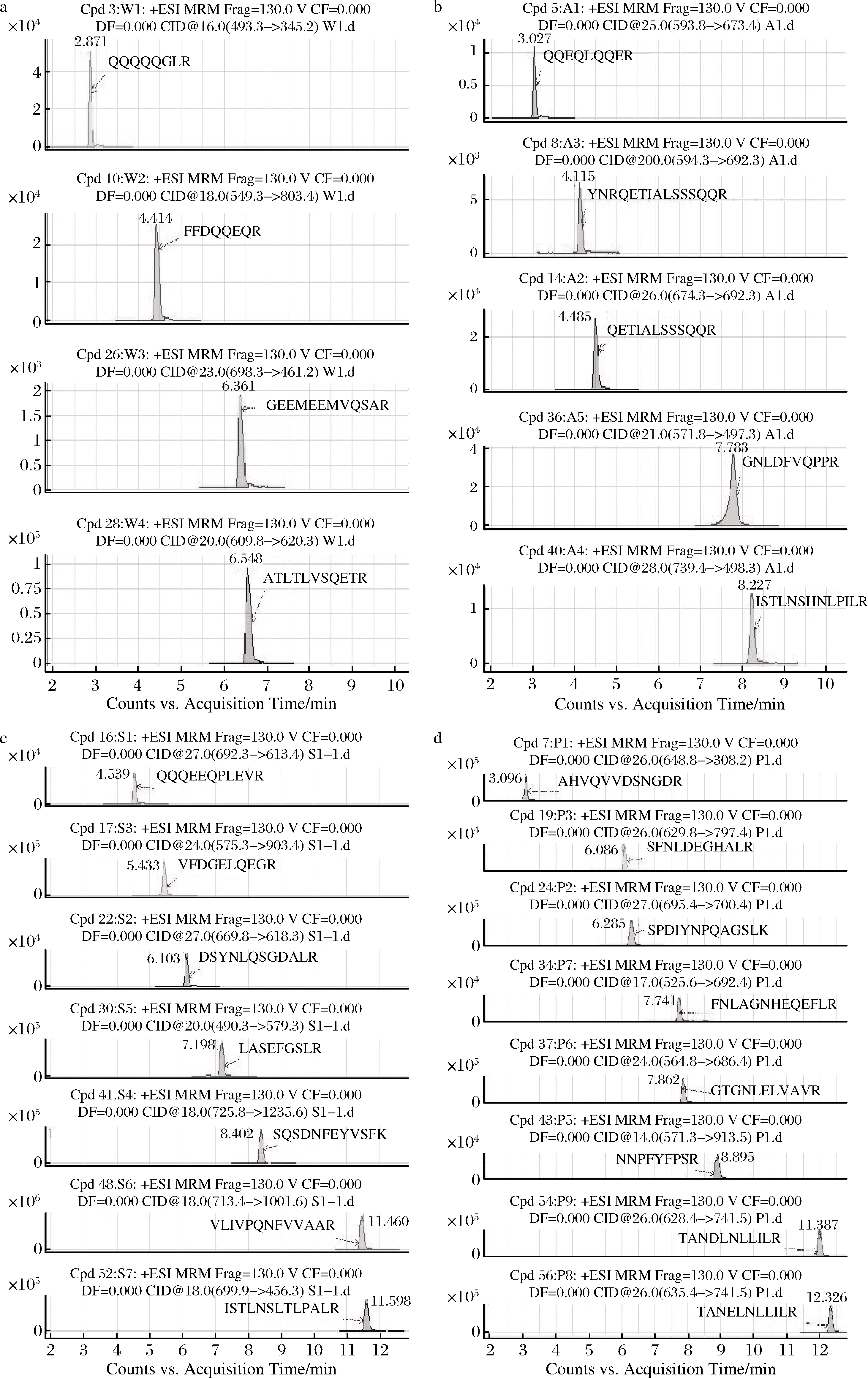
采用排除法验证所选肽段的特异性,以大豆为例,将核桃、杏仁、花生特征肽段的MRM方法合并形成一个新的MRM方法,用该方法检测大豆样品,实验结果如图4-a所示,大豆样品采集到的色谱质谱图中没有出现其他3个物种的特征肽段峰,出现个别肽段的单个离子对色谱峰的保留时间和对应肽段不相同,非目标肽段。采用相同方法验证了花生、核桃和大豆样品,结果如图4-b、图4-c、图4-d所示,未出现保留时间和2个离子对符合的情况。由此可知,本方法筛选出的核桃、杏仁、大豆和花生特征肽段间不存在相互干扰,确保了方法的专属性。
2.4 方法学验证
大豆、花生为核桃露和杏仁露中最常见的掺假成分,采用本方法对核桃露和杏仁露中掺入大豆和花生进行了定量检测,即考察了核桃露中大豆和花生、杏仁露中大豆和花生的检出限、回收率等性能参数。分别选择响应较高的3个肽段进行方法学考察。
2.4.1 线性关系和检测限考察
取系列标准溶液进样,以峰面积为纵坐标,各特征肽段浓度为横坐标,绘制标准曲线,结果表明各肽段组分在0.002 5~5 mg/mL线性关系良好。用核桃露和杏仁露酶解后的多肽混合溶液逐级稀释大豆和花生酶解后的多肽混合溶液,同时用水逐级稀释核桃露和杏仁露的酶解多肽溶液,按照方法进样检测,以信噪比为3计算各特征肽段的检出限,并根据各物种的蛋白质浓度计算各特征肽段对应的大豆、花生在核桃和杏仁露中的检出限,和核桃、杏仁成分在水溶液中的检出限,结果如表3所示。
表2 核桃、杏仁、大豆、花生的特征肽段及MRM参数
Table 2 Marker peptides and MRM parameters in walnut,almond,soybean and peanut

物种肽段保留时间/min保留时间允许偏差/min母离子(m/z)(电荷)定量离子(m/z)碎裂电压/ 碰撞能量/e 碰撞池加速电压/ 解离位置杏仁花生大豆核桃QQEQLQQERISTLNSHNLPILRYNRQETIA-LSSSQQRQETIALSSSQQRGNLDF QPPRTANDLNLLILRSPDIYNP-QAGSLKTANELNLLILRAH Q D-SNGDRNNPFYFPSRSFNLDEGHALRGTGNLEL A RTANDLNLLILRLSAEFGSLR FDGELQEGRFNLAGNHE-QEFLR LI PQNF AARSQSDNFEY SFKDSYNLQSGDALRQQQEEQPLE RQQQQQGLRATLTL SQETRGEEMEEMk- QSARFFDQQEQRDFLAGQNN-IINQLER3.022593.8(+2) 673.4*130254y53.022593.8(+2)930.5130254y78.332739.4(+2)725.5130284y68.332739.4(+2) 498.3*130284y44.092594.3 (+3) 692.3*130204y64.092594.3 (+3)605.3130204y54.532674.3(+2)876.5130264y84.532674.3(+2) 692.3*130264y67.862571.8(+2) 497.3*130214y47.862571.8(+2)858.5130214y712.062628.4(+2)1 083.7 130264y912.062628.4(+2)741.5*130264y67.772525.6(+3)821.4130174y67.772525.6 (+3)692.4*130174y56.302695.4(+2)977.5 130274y96.302695.4(+2)700.4*130274y712.392635.4(+2)854.6 130264y712.392635.4(+2)741.5*130264y63.052648.8(+2)1 088.5 130264y103.052648.8(+2)308.2*130264b38.912571.3(+2)913.5*130144y78.912571.3(+2)669.3 130244y56.102629.8(+2)797.4*130264y76.102629.8(+2)682.4 130264y67.892564.8(+2)686.4*130244y67.892564.8(+2)557.4 130244y511.792699.9(+2)670.4 130284y611.792699.9(+2)456.3*130184y47.272490.3(+2)779.4*130234y77.272490.3(+2)579.3 130204y55.482575.3(+2)903.4*130244y85.482575.3(+2)788.4 130244y711.642713.4(+2)1 001.6* 130184y911.642713.4(+2)326.2 130184b38.482725.8(+2)1 235.6* 130284y108.482725.8(+2)381.2 130184y36.162669.8(+2)746.4 130174y76.162669.8(+2)618.3*130274y64.592692.3(+2)870.5 130274y74.592692.3(+2)613.4*130274y52.872493.3(+2)729.4 130214y62.872493.3(+2)345.2*130164y36.422698.3(+2)949.4 130234y86.422698.3(+2)461.2*130234y46.642609.8(+2)719.4 130204y66.642609.8(+2)620.3*130204y54.462549.3(+2)803.4*130184y64.462549.3(+2)688.3 130184y511.482873.0(+2)999.6 130334y811.482873.0(+2)659.3*130284y5
注:*代表差异显著,P<0.05
2.4.2 方法的准确度和精密度
为了考察方法的准确性,即方法测定值与真实值之间的差异。按照1.2中的制浆方法制作含有大豆、花生的核桃露和杏仁露,按照前处理方法进行提取,上机测定饮料样品中的大豆、花生成分含量,验证该方法的准确度和精密度由。表4可知,除了花生的特征肽段AH Q DSNGDR在核桃露中的回收率为123.5%外,其他花生特征肽段的回收率均在71%~106%之间,且3次测定的RSD值均<16%(n=3),大豆特征肽段的回收率均在69%~115%之间,3次测定的RSD值均<15%(n=3),说明该方法有良好的抗干扰能力,能够实现核桃露和杏仁露中大豆、花生成分的检测。
表3 核桃、杏仁、大豆、花生特征肽段的线性关系、
线性方程、相关系数(r2)和检出限
Table 3 Linear range, linear equations, correlation
coefficients(r2) and LODs of the marker peptides of
walnut, almond, soybean and peanut
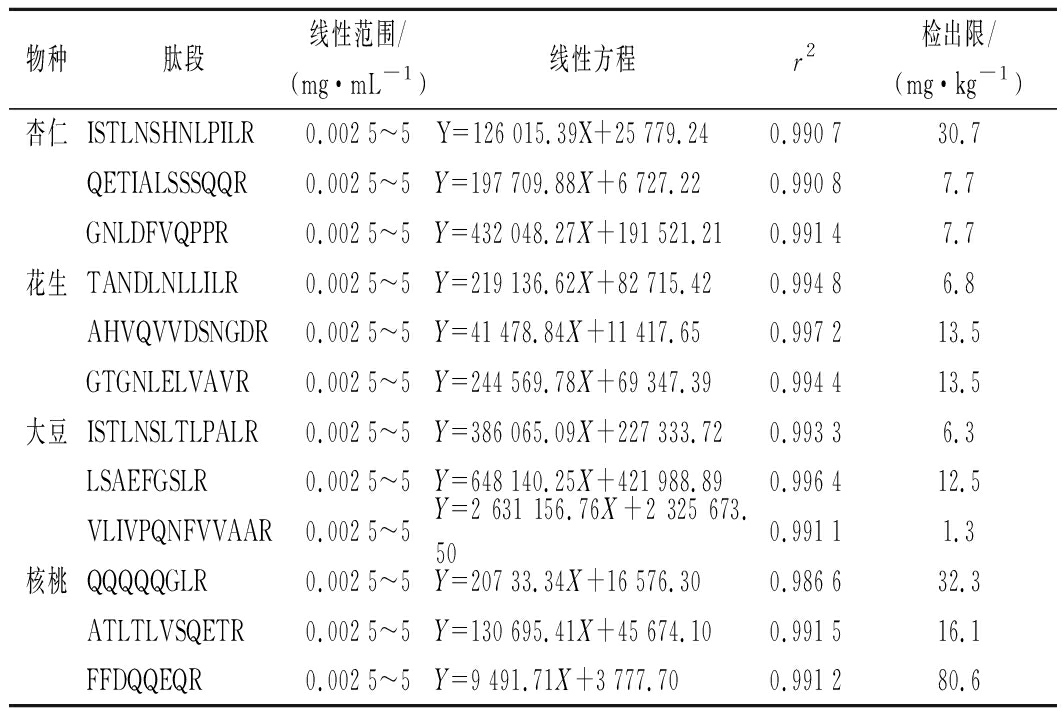
物种肽段线性范围/(mg·mL-1)线性方程r2检出限/(mg·kg-1)杏仁ISTLNSHNLPILR0.002 5~5Y=126 015.39X+25 779.240.990 730.7QETIALSSSQQR0.002 5~5Y=197 709.88X+6 727.220.990 87.7GNLDF QPPR0.002 5~5Y=432 048.27X+191 521.210.991 47.7花生TANDLNLLILR0.002 5~5Y=219 136.62X+82 715.420.994 86.8AH Q DSNGDR0.002 5~5Y=41 478.84X+11 417.650.997 213.5GTGNLEL A R0.002 5~5Y=244 569.78X+69 347.390.994 413.5大豆ISTLNSLTLPALR0.002 5~5Y=386 065.09X+227 333.720.993 36.3LSAEFGSLR0.002 5~5Y=648 140.25X+421 988.890.996 412.5 LI PQNF AAR0.002 5~5Y=2 631 156.76X+2 325 673.500.991 11.3核桃QQQQQGLR0.002 5~5Y=207 33.34X+16 576.300.986 632.3ATLTL SQETR0.002 5~5Y=130 695.41X+45 674.100.991 516.1FFDQQEQR0.002 5~5Y=9 491.71X+3 777.700.991 280.6
2.4.3 实际样品检测
以所建立的方法对市场上购买的4个品牌6个核桃露、杏仁露和核桃杏仁露样品进行检测,6个样品中均检出大豆和花生成分,其中1个核桃杏仁露复合蛋白饮料样品中只检测到了杏仁成分,未检出核桃成分,可能是核桃投料过少,低于目前检出限。
表4 大豆和花生6 个特征肽段的回收率和精密度
Table 4 Reco eries and RSDs of the six marker
peptides of soybean and peanut
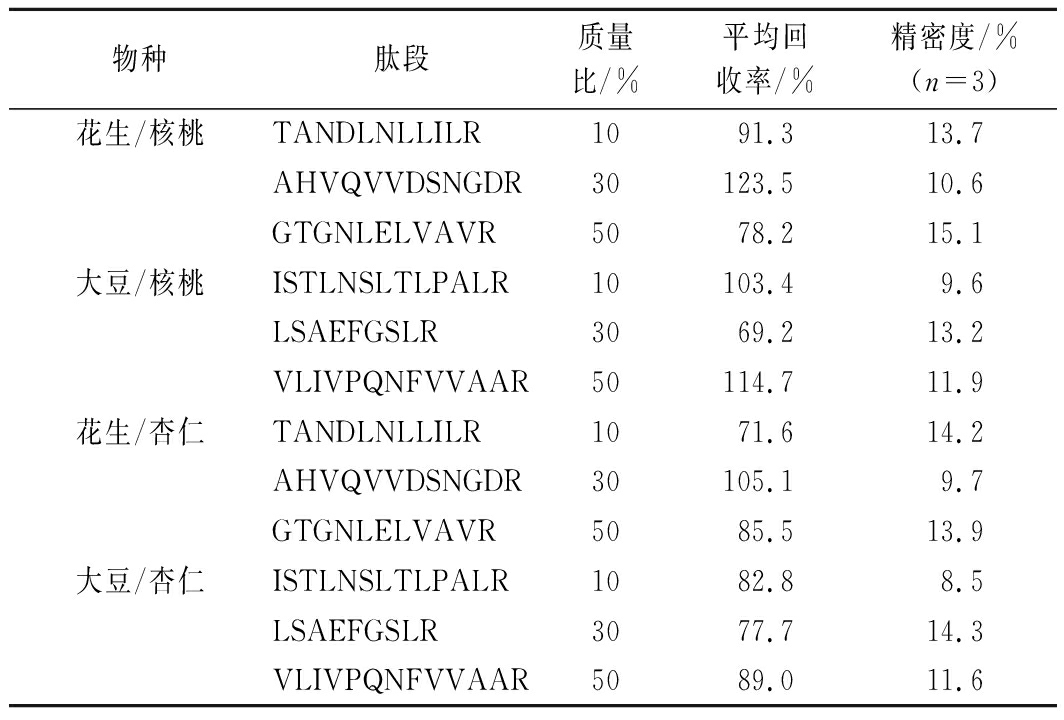
物种肽段质量比/%平均回收率/%精密度/%(n=3)花生/核桃TANDLNLLILR1091.313.7AH Q DSNGDR30123.510.6GTGNLEL A R5078.215.1大豆/核桃ISTLNSLTLPALR10103.49.6LSAEFGSLR3069.213.2 LI PQNF AAR50114.711.9花生/杏仁TANDLNLLILR1071.614.2AH Q DSNGDR30105.19.7GTGNLEL A R5085.513.9大豆/杏仁ISTLNSLTLPALR1082.88.5LSAEFGSLR3077.714.3 LI PQNF AAR5089.011.6
3 结论
本研究采用HPLC-Q-Exacti e-MS和HPLC-QQQ-MS相结合,筛选出了核桃、杏仁、大豆和花生的特征肽段,并建立了以特征肽段为检测对象的核桃露和杏仁露中植物源性成分的测定方法,该方法有较高的灵敏度和专属性,可以同时测定多种植物源性成分,由于氨基酸序列在加工过程中比核酸序列更容易保存,因此利用液相色谱串联质谱鉴别多肽在植物蛋白饮料掺假检测中具有较大的技术优势和重要的现实意义。
参考文献
[1] 高艳华,王联结.国内外食品蛋白质发展概况[J].食品研究与开发,2003,24(5):58-60.
[2] 陈贵堂,赵霖.植物蛋白的营养生理功能及开发利用[J].食品工业科技,2004,25(9):137-140.
[3] 丁清龙,曾晓琮,周露,等.广东省植物源性饮料掺假情况摸底调查[J].食品安全质量检测学报,2018,9(12):2 953-2 957.
[4] 水小溪,蔡乐,赵宝华.ELISA技术在食品安全检测中的应用[J].生命科学仪器,2008,6(10):51-53.
[5] 张世伟,赖心田,王石峰,等.基于免疫分析的杏仁蛋白饮料中杏仁蛋白质定量方法研究[J].河南农业科学,2016,45(4):145-149.
[6] GIRISH P S,ANJANEYULU A S R, ISWAS K N,et al.Meat species identification by polymerase chain reaction-restriction fragment length polymorphism(PCR-RFLP)of mitochondrial 12S rRNA gene[J].Meat Science,2005,70(1):107-112.
[7] CAL O J H,OSTA R,ZARAGOZA P.Quantitati e PCR detection of pork in raw and heated ground beef and paté[J].Journal of Agricultural and Food Chemistry,2002,50(19):5 265-2 567.
[8] ALI M E,HASHIM U,MUSTAFA S,et al.Analysis of pork adulteration in commercial meatballs targeting porcine-specific mitochondrial cytochrome b gene by TaqMan probe real-time polymerase chain reaction[J].Meat Science,2012,91(4):454-459.
[9] 杨硕,李诗瑶,王鸣秋,等.市售椰子汁(植物蛋白饮料)中椰子、大豆、花生源性成分鉴定的分子生物学方法[J].基因组学与应用生物学,2018,37(10):4 511-4 517.
[10] 郭楠楠,张岩,李永波,等.微滴式数字PCR定量检测杏仁露中杏仁、花生源性成分的分析研究[J].食品科学,2019,40(14):346-351.
[11] 刘津,刘二龙,谢力,等.数字聚合酶链式反应技术在食品安全检测领域的研究应用进展[J].食品科学,2016,37(17):275-280.
[12] HINDSON C M,CHE ILLET J R,BRIGGS H A,et al.Absolute quantification by droplet digital PCR ersus analog real-time PCR[J].Nature Methods,2013,10(10):1 003.
[13] 许岩,任皓威,周广运,等.液相色谱质谱联用技术在植物蛋白及多肽研究中的应用[J].食品工业科技,2017,38(17):310-318.
[14] HEICK J,FISCHER M,POPPING B,First screening method for the simultaneous detection of se en allergens by liquid chromatography mass spectrometry[J].Journal of Chromatography A,2011,1218(7):938-943.
[15] RAUNIYAR N.Parallel reaction monitoring:A targeted experiment performed using high resolution and high mass accuracy mass spectrometry[J].Molecular Sciences,2015,16:28 566-28 581.
[16] 古淑青,詹丽娜,赵超敏,等.基于液相色谱-串联质谱法的肉类特征肽段鉴别及掺假测定[J].色谱,2018,36(12):1 269-1 278.
[17] BÖNICK J,HUSCHEK G,RAWEL H M,Determination of wheat,rye and spelt authenticity in bread by targeted peptide biomarkers[J].Journal of Food Composition and Analysis,2017,58(5):82-91.
[18] GU S Q,CHEN N N,ZHOU Y,et al.A rapid solid-phase extraction combined with liquid chromatography-tandem mass spectrometry for simultaneous screening of multiple allergents in chocolates[J].Food Control,2018,84:89-96.
[19] 刘銮雄,李意,阳洪波,等.液相色谱串联质谱法鉴定虾中外源性成分[J].食品工业,2019,40(8):281-284.
[20] 阳洪波,王韦达,李意,等.基于特征肽段的液相色谱-质谱技术鉴定胶原蛋白的物种来源[J].分析测试学报,2018,37(11):1 279-1 286.