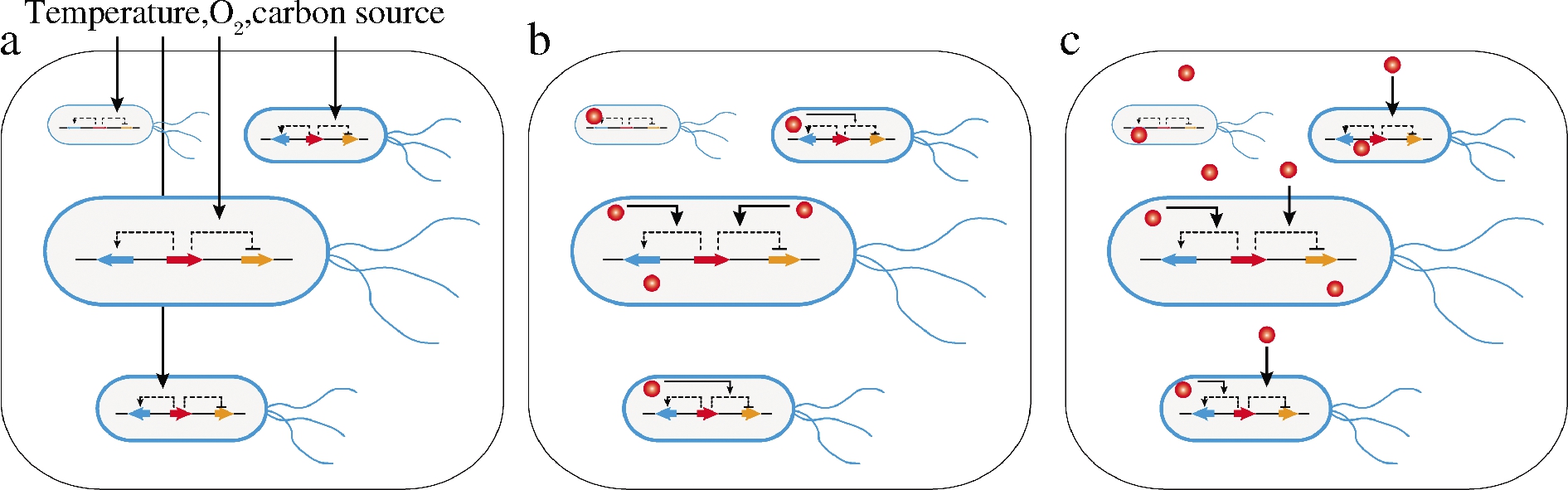
a-发酵环境响应的动态调控策略;b-胞内产物响应的动态调控策略;
c-胞外产物响应的动态调控策略
图1 时空水平的动态调控响应机制
Fig.1 The mechanisms of dynamic regulation
in spatiotemporal le el
近年来,随着合成生物技术、代谢工程和系统生物学的快速发展与交叉融合,微生物发酵合成高附加值化学品得到了长足的进步[1-2]。在此过程中,构建高效的细胞工厂始终是研究的核心。细胞工厂的传统改造策略主要包括:过表达途径基因、敲除或抑制产物降解途径和竞争性代谢途径、蛋白质工程改造限速酶和定向进化强化菌株生产性能等[3-4]。这些改造策略的核心思想是最大化的引导细胞内的物质和能量流向产物合成方向,同时强化产物合成途径的代谢通量。经过上述改造策略已经实现了多类重要化合物的高效合成,例如黄酮类化合物[5-6]、脂肪酸[7-8]、萜类化合物[9-11]、生物燃料[12-14]、聚合物单体化合物[15-16]等。然而,随着底物消耗、副产物积累和产物合成,发酵过程中的环境始终处于不断变化的过程中,这导致基因表达水平不能随时与环境变化相适应,因此仅仅通过简单的静态代谢工程改造难以使细胞适应复杂多变的发酵环境[17]。此外,发酵系统中每个单细胞的生长状态都不相同,通过统一调节发酵条件(pH、温度和碳源等)或者添加诱导剂(异丙基-β-D-硫代半糖苷等)的方式改变基因表达水平并不能使每一个细胞都处于最佳的生长和生产状态[18]。发酵系统中不同位置的细胞所处环境也不尽相同,这进一步增加了调控的难度。因此,发酵过程中环境变化具有瞬时的空间和时间特性。综上,为实现目标化合物的高效合成,急需建立一种可在时间和空间水平上针对特定细胞所处的生理生化环境进行精准控制的调控手段。
为在发酵过程中实现时空水平的精准调控,研究者们设计了大量的生物传感器用于实时定量监测细胞内外环境的变化,同时根据监测信号实时动态的调控代谢网络[19-20]。这些动态调控网络设计的一般思路是以可响应细胞内外环境变化的生物传感器控制关键基因,传感器根据检测到的信号变化强化或抑制基因表达,从而达到代谢流量调控的目标[17-21]。
本文根据发酵过程中代谢调控的时空尺度不同,将动态调控策略分为环境响应型、胞内产物响应型和胞外产物响应型(图1)。

a-发酵环境响应的动态调控策略;b-胞内产物响应的动态调控策略;
c-胞外产物响应的动态调控策略
图1 时空水平的动态调控响应机制
Fig.1 The mechanisms of dynamic regulation
in spatiotemporal le el
环境响应型动态调控针对整个发酵系统中所有细胞进行集体调控(图1-a);胞内产物响应型动态调控基于每个单细胞自身生理生化状态而进行自我调控(图1-b);胞外产物响应型动态调控的特点是代谢物可分泌出细胞并同时被其他单细胞摄取,这将会造成不同单细胞在空间尺度上的信号干扰(图1-c)。
本文通过对比当前国内外的相关研究,深入分析不同动态调控策略的优缺点,为更广泛的代谢工程和发酵工程应用提供理论参考。
温度是发酵过程中的重要参数,不仅与能量消耗息息相关,同时也显著影响着细胞生长、酶的催化活性和产物的稳定性。因此,通过温度来调控微生物生长与代谢是发酵过程控制的重要手段。对整个发酵体系进行加热或冷却会影响体系中所有细胞的代谢过程,这种动态调控策略忽略了微观层面上每个单细胞的性能差异性,目标是针对发酵体系中所有细胞集体的动态调控。目前,应用最为广泛的温敏型生物传感器包括CI857阻遏蛋白介导的高温激活传感器以及CI434-te S阻遏蛋白突变体(TFts)介导的低温激活传感器[22-23]。其中CI857在温度高于37 ℃时失去活性而无法与结合位点结合,进而开启目标基因表达;当温度低于30 ℃时,CI857阻遏目标基因表达。而TFts在温度低于30 ℃时失去活性而无法与结合位点结合,进而开启目标基因表达;当温度高于37 ℃时,TFts阻遏目标基因表达。基于这些调控机制,SUN等[24]构建了一个乙醇生产菌株Escherichai coli B0013-2021 HPA,该菌株的生长繁殖过程仅以木糖、半乳糖和阿拉伯糖为碳源,而乙醇合成过程仅以葡糖糖为碳源。在该工程菌株中,敲除了乙醇的竞争性代谢途径基因(pta-ackA、ldhA和pflB),同时突变了葡萄糖的摄取和氧化的必需基因(glk、ptsG和manZ)。在此基础上以受CI857调控的启动子pR/pL调控ptsG表达,从而达到葡萄糖消耗受温度控制的目的。在低温条件下大肠杆菌B0013-2021HPA利用木糖、半乳糖和阿拉伯糖生长,随后温度升高到37 ℃后开始利用葡萄糖合成乙醇。经过12 h发酵,乙醇产量比无动态调控菌株提高1.4倍,达到4.06 g/(L·h)。与高温激活的生物传感器相比,低温激活的生物传感器鲜有报道和应用。最近,ZHENG等[22]在低温传感器的设计和应用上获得了突破性进展。在这项研究工作中,作者首先通过定向进化获得了受高温激活的阻遏蛋白TFts、受低温激活的蛋白酶TEts和Mycoplasma florum Lon蛋白酶(mf-Lon)。经过巧妙组合,构建了如图2所示的动态调控系统。在不同种大肠杆菌中,该系统均具有良好的功能,是目前已知低温诱导生物传感器中动态范围最广、本地表达最低和对信号响应速度最快的传感器。此外,应用该传感器控制ftsZ和mreB的表达可实现大肠杆菌形态的动态控制。

图2 低温诱导型生物传感器工作机制
Fig.2 The mechanisms of low temperature induced biosensor
注:当温度低于30 ℃时TFts失去活性,无法阻遏TEts、TetR和
目标蛋白GOI的表达,此时TEts特异性的降解TFts蛋白从而
进一步强化GOI的表达。当温度高于37 ℃时TFts阻遏TEts、
TetR和目标蛋白GOI的表达,因此mf-Lon得以表达并特异性
降解渗漏表达的GOI蛋白。钝箭头代表抑制作用。
影响发酵过程的另一重要因素是pH,尤其是以有机酸为目标产物的发酵生产。与温度响应的动态调控相同,pH响应的动态调控策略也属于针对发酵体系中所有细胞的集体动态调控。原因在于pH的变化是全局性质的改变,当调节发酵体系pH时,所有细胞不可避免的会处于相同的pH条件。目前应用较为广泛的pH响应启动子或调控蛋白主要包括来自黑曲霉的Pgas启动子[25]、来自酿酒酵母的![]() 来自动物细胞的TDAG8蛋白[27]。YIN等[25]利用Pgas启动子控制衣康酸合成相关基因表达,在黑曲霉中发酵获得了4.92 g/L的产量。然而,Pgas启动子对pH的响应机制尚未有明确研究,因此限制了其用于更为复杂和灵敏的代谢网络设计。为了探索pH诱导型启动子的响应机制,并构建新型生物传感器,RAJKUMAR等[26]组合了一系列受低pH诱导的转录因子及其结合位点,如Rap1p (GAACACCCATACATC)、Swi5p (TGCTGGt)、Swi4p (aCGCGAAA)、Azf1p (aAAAAGAAA)、Msn2p/Msn4p (aAGGGG)、Rlm1p (tCTATWWWTAg)、Crz1p (GTGGCTG)、Haa1p (GNNMRGGG)和Nrg1p (GGACCCt)。研究发现,Rap1p、Swi5p和Swi4p显著影响启动子受低pH诱导的强度,其中Rap1p同时与启动子本底表达水平密切相关。基于此,构建了一系列性能优越的低pH诱导启动子,包括YGP1 2—YGP1 7和CCW14 1—CCW14 7等。随后RAJKUMAR等利用所构建启动子(YGP1 7、CCW14 4、CCW14 5和CCW14 6)调控乳酸脱氢酶基因(ldhL)表达,发现这些启动子控制下的乳酸产量达到2.9~7.9 g/L,而TEF1pr控制下的重组菌仅有0.72 g/L的乳酸产量。除此之外,AUSL
来自动物细胞的TDAG8蛋白[27]。YIN等[25]利用Pgas启动子控制衣康酸合成相关基因表达,在黑曲霉中发酵获得了4.92 g/L的产量。然而,Pgas启动子对pH的响应机制尚未有明确研究,因此限制了其用于更为复杂和灵敏的代谢网络设计。为了探索pH诱导型启动子的响应机制,并构建新型生物传感器,RAJKUMAR等[26]组合了一系列受低pH诱导的转录因子及其结合位点,如Rap1p (GAACACCCATACATC)、Swi5p (TGCTGGt)、Swi4p (aCGCGAAA)、Azf1p (aAAAAGAAA)、Msn2p/Msn4p (aAGGGG)、Rlm1p (tCTATWWWTAg)、Crz1p (GTGGCTG)、Haa1p (GNNMRGGG)和Nrg1p (GGACCCt)。研究发现,Rap1p、Swi5p和Swi4p显著影响启动子受低pH诱导的强度,其中Rap1p同时与启动子本底表达水平密切相关。基于此,构建了一系列性能优越的低pH诱导启动子,包括YGP1 2—YGP1 7和CCW14 1—CCW14 7等。随后RAJKUMAR等利用所构建启动子(YGP1 7、CCW14 4、CCW14 5和CCW14 6)调控乳酸脱氢酶基因(ldhL)表达,发现这些启动子控制下的乳酸产量达到2.9~7.9 g/L,而TEF1pr控制下的重组菌仅有0.72 g/L的乳酸产量。除此之外,AUSL NDER等[27]利用来源于人类的受H+激活的细胞表面受体蛋白TDAG8和G蛋白,调节锚定在细胞膜上的腺苷环化酶(adenylate cyclase,AC)活性,从而控制ATP转化为cAMP的速率。随后,cAMP激活蛋白酶A的调控亚基,该亚基转移到细胞核中后可通过磷酸化激活cAMP响应原件结合蛋白1(cAMP-response element binding protein 1,CREB1),受激活的CREB1可结合到目标启动子PCRE,从而启动目标基因表达(图3)。SHEN等[17]详细介绍了其他基于环境因素的动态调控策略,如光诱导、溶氧诱导和碳源诱导的动态调控策略。这些基于环境因素的动态调控策略具有与温度和pH响应的动态调控策略相同的时空调控性质。
NDER等[27]利用来源于人类的受H+激活的细胞表面受体蛋白TDAG8和G蛋白,调节锚定在细胞膜上的腺苷环化酶(adenylate cyclase,AC)活性,从而控制ATP转化为cAMP的速率。随后,cAMP激活蛋白酶A的调控亚基,该亚基转移到细胞核中后可通过磷酸化激活cAMP响应原件结合蛋白1(cAMP-response element binding protein 1,CREB1),受激活的CREB1可结合到目标启动子PCRE,从而启动目标基因表达(图3)。SHEN等[17]详细介绍了其他基于环境因素的动态调控策略,如光诱导、溶氧诱导和碳源诱导的动态调控策略。这些基于环境因素的动态调控策略具有与温度和pH响应的动态调控策略相同的时空调控性质。
综上所述,无论是基于物理环境(如温度)还是化学环境(如pH)的动态调控策略都属于针对发酵系统全局的动态调控。这些策略更加关注环境因素在时间水平上的波动,而忽略了每个单细胞在空间水平上的不同需求。因为发酵系统是一个混合体系,在发酵过程中的任意时间段都存在着大量不同生长时期的细胞、基因表达水平不同的细胞、代谢负担不同的细胞和生产性能不同的细胞[18],因此仅仅根据环境因素的时间水平对发酵系统所有细胞进行整体的动态调控并不能满足每个单细胞在空间水平上的需求。

图3 基于TDAG8的pH响应生物传感器工作机制
Fig.3 The mechanisms of TDAG8 dependent
pH-responsi e biosensor
为了同时满足发酵系统中不同性能的单细胞在时间和空间水平上的不同需求,急需建立一种基于单细胞自身的独特状态进行自我调节的动态调控策略。胞内代谢物仅存在于细胞内部,因此能体现每个单细胞独特的生理状态。基于这些特性,胞内代谢物响应的动态调控策略可同时实现对单细胞的时间和空间水平上的调控。
辅酶A(coenzyme A,CoA)及其硫酯化合物是胞内典型的代谢中间产物,与胞内能量供应和物质循环息息相关[1]。近年来,研究者们建立了多种基于胞内丙二酰-CoA和酯酰-CoA含量变化的动态调控策略[28]。其中最为经典的设计是XU等[29]的乙酰-CoA/丙二酰-CoA振荡器和ZHANG等[30]的脂肪酸/酯酰-CoA动态调控系统。基于丙二酰-CoA的动态调控策略主要依赖于受丙二酰-CoA调控的阻遏蛋白FapR和1个17 bp长度的结合位点fapO。当胞内丙二酰-CoA含量增加后可与FapR结合形成FapR-丙二酰-CoA复合体,该复合体无法识别fapO,从而无法形成阻遏作用,目标蛋白得以表达[31]。相反,当胞内丙二酰-CoA不足时无法形成FapR-丙二酰-CoA复合体,FapR得以与fapO结合进而阻遏目标基因表达。为了构建1个动态调控装置用以实时平衡脂肪酸合成时乙酰-CoA和丙二酰-CoA含量,XU等[29]筛选得到了1个受FapR激活的启动子Pgap,将该启动子与受FapR阻遏的启动子T7-fapO结合,构建得到了乙酰-CoA/丙二酰-CoA振荡器(图4-a)。当胞内丙二酰-CoA含量不足时该振荡器激活Pgap表达并阻遏T7-fapO表达,从而分别强化乙酰-CoA转化为丙二酰-CoA和抑制丙二酰-CoA转化为脂肪酸;当胞内丙二酰-CoA含量过高时该振荡器阻遏Pgap表达并激活T7-fapO表达,从而分别抑制乙酰-CoA转化为丙二酰-CoA和强化丙二酰-CoA转化为脂肪酸(图4-b)。为了构建1个平衡脂肪酸合成与酯酰-CoA积累的动态调控系统,ZHANG等[30]首先设计了一个可高效响应胞内酯酰-CoA含量的生物传感器(图4-c)。该传感器包括酯酰-CoA响应的阻遏蛋白(FadR)和基于FadR结合位点构建的启动子组成。当胞内酯酰-CoA不足时FadR与识别位点结合并阻遏目标基因表达;相反,当胞内酯酰-CoA含量过高时与FadR结合形成FadR-酯酰-CoA复合体,从而离开结合位点同时激活目标基因表达。应用该动态调控系统调控丙酮酸脱羧酶(pdc)、醇脱氢酶(adhB)、酯酰-CoA合酶(fadD)和蜡酯合酶(atfA)的表达,最终获得了1.5 g/L的生物柴油产量(图4-c)。
总之,胞内代谢产物响应的生物传感器由于可专一性的实时监测单细胞水平的代谢变化,为单细胞水平的动态调控提供了新的思路。然而,在发酵过程中大多数代谢产物或中间产物往往可以不同程度地分泌到细胞外,这将会导致细胞间的信号交叉,从而不同程度地影响在单细胞水平上生物传感器对自身信号的监测准确度。
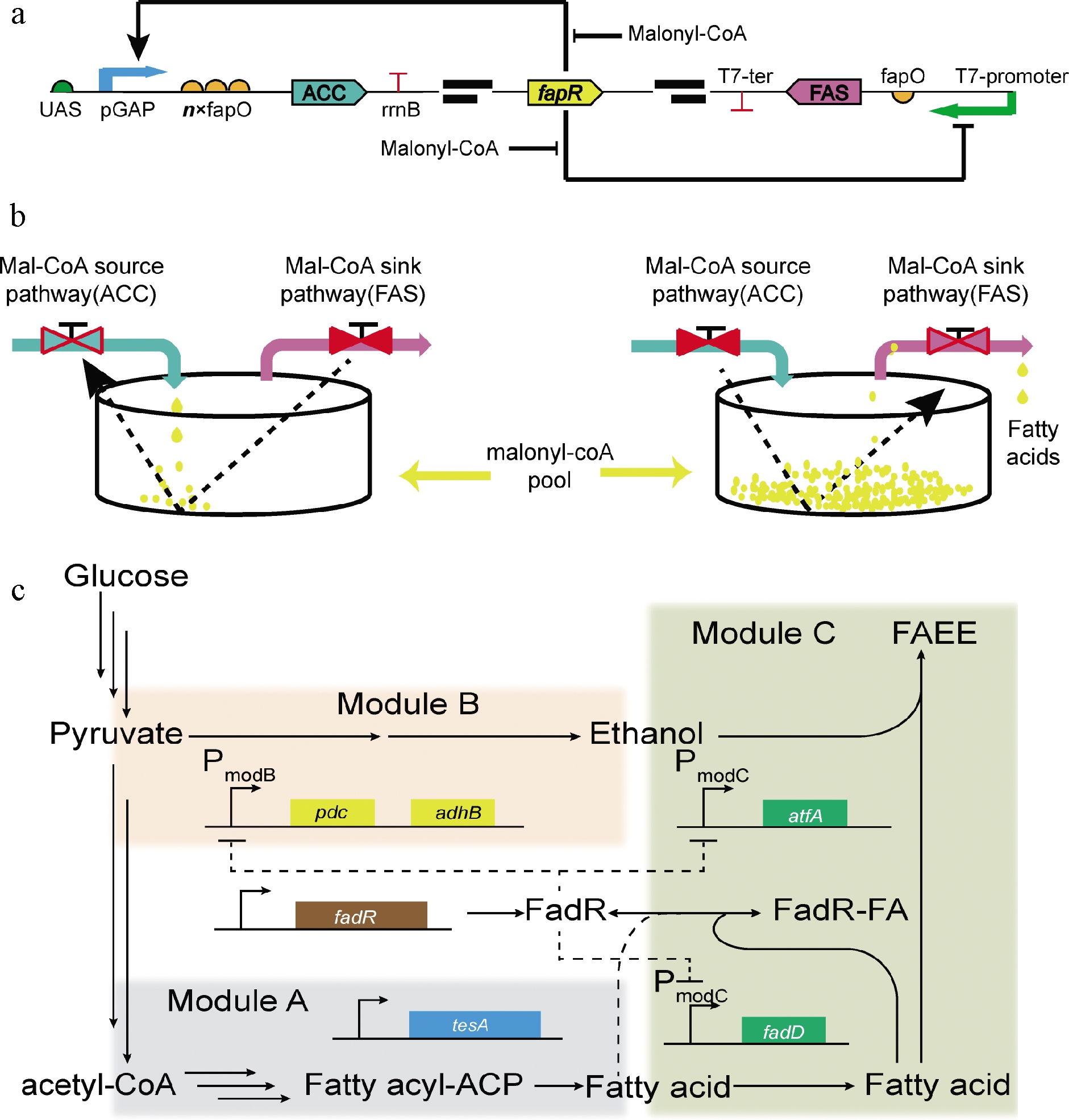
a-丙二酰-CoA振荡器工作机制,箭头和钝箭头分别代表激活和
抑制作用;b-丙二酰-CoA振荡器工作示意图,当丙二酰-CoA
不足时启动ACC表达,当丙二酰-CoA充足时启动FAS表达;
c-基于酯酰-CoA的动态调控策略,模块A、B和C分别
代表脂肪酸、乙醇和生物柴油(FAEE)的合成途径
图4 基于酯酰-CoA生物传感器的动态调控策略
Fig.4 Acyl-CoA biosensor based dynamic regulation strategies
由于微生物膜系统的丰富载体和多种转运模式并存,大多数代谢物都可部分穿透细胞膜而分泌到胞外或进入其他细胞。这种广泛存在的细胞间物质交换对单细胞动态调控的精准性造成了干扰。尽管如此,基于这种可部分跨膜转运的代谢产物的动态调控策略依然备受关注,并且取得了良好的效果[32-34]。其中,基于氨基酸响应生物传感器的动态调控在近年来的研究较为广泛。TyrR是芳香族氨基酸合成途径的调控蛋白,常常作为芳香族类化合物合成代谢网络动态调控的中枢。其调控机制是当无苯丙氨酸或酪氨酸时TyrR形成2个二聚体结合于启动子PtyrP或ParoF上游并激活下游基因表达;然而,当存在苯丙氨酸或酪氨酸时,TyrR与苯丙氨酸或酪氨酸形成TyrR-苯丙氨酸或TyrR-酪氨酸复合体,该复合体可相互结合形成六聚体并分别弯曲启动子PtyrP或ParoF结构,从而达到阻遏下游基因表达的效果[35]。基于TyrR的调控原理,CHOU等[35]设计了1个菌株表型进化的反馈调控系统(feedback-regulated e olution of phenotype,FREP),该系统以TyrR传感器为基础调控大肠杆菌突变子(mutD5)表达水平,从而实现菌株快速进化的目标。具体而言,ParoF启动子控制mutD5的表达,当菌株酪氨酸产量增加时会抑制mutD5的表达,进而降低突变发生的频率;相反,当菌株酪氨酸产量较低时mutD5表达水平增加,进一步强化了该菌株的突变率,直至获得高产酪氨酸菌株为止。此外,WU等[36]通过启动子工程改造获得了梯度强度PtyrP启动子,该启动子收到苯丙氨酸诱导。利用所构建的PtyrP启动子调控表达芳香族氨基酸合成途径的关键酶——莽草酸激酶异构酶(AroK),成功构建了可动态响应苯丙氨酸的动态调控菌株xllp3,获得了61.3 g/L的苯丙氨酸,且产量和产率相比较未动态调控的菌株分别提高了1.36和1.22倍。
氨基酸可通过跨膜蛋白的主动运输作用或自由扩散作用进出细胞,因此其在细胞内外的浓度分布主要取决于浓度差以及转运蛋白活性[37-38]。一般而言,当诱导物在胞内的含量远高于胞外含量时,不同单细胞之间的信号干扰较小。这是因为不同单细胞所分泌的诱导物难以通过自由扩散进入其他细胞,而经过主动运输进入后也会因为胞内已存在的大量诱导物而降低了这种信号干扰的程度。因此,部分分泌型代谢物响应的动态调控根据胞内外诱导物浓度差的不同将会产生不同的调控效果。
有些代谢物主要通过自由运输或主动运输的外排作用分泌到细胞外,因此会形成胞内代谢物含量等于或低于胞外代谢物含量的现象[39-40]。本文将这种代谢物定义为“外排型代谢物”。这种代谢物的动态调控策略往往无法进行精准的空间水平动态调控,因为胞外代谢物含量高于或等于胞内,导致不同单细胞受到环境中代谢物的诱导作用相同,容易形成整个发酵系统所有单细胞的“集体调控”现象。微生物培养过程中的群体响应现象就是由该动态调控策略所控制的自然现象。据报道,细菌群体响应的信号分子N-高丝氨酸内酯(acyl-homoserine lactone,AHL)主要通过自由扩散和主动运输作用进出细胞,细胞内外的AHL含量基本相同[41-42],这是群体响应的信号传导基础。群体响应分为2种调控模式,一种是来自Pantoea stewartia的EsaI-EsaR系统,该系统中EsaI催化合成AHL,AHL抑制EsaR对PesaS启动子的激活作用;另一种是来自ibrio fischeri的LuxI-LuxR系统,该系统中LuxI催化合成AHL,AHL与LuxR结合形成复合体进而激活PluxI下游基因的表达[17]。已有研究主要应用群体响应效应动态调控目标化合物合成途径,从而达到平衡细胞生长和产物合成的目标[33]。具体而言,当菌体刚开始生长时菌体浓度较低,群体响应效应较弱,目标产物合成途径关闭;当菌体浓度达到设定阈值后启动群体响应效应,从而启动目标产物合成[43-45]。近年来PRATHER课题组在群体响应的设计和应用中取得了较好成果[33,46-48]。例如,应用EsaI-EsaR系统调控柚皮素合成途径(酪氨酸解氨酶和4-香豆酸:CoA连接酶),同时LuxI-LuxR系统调控CRISPR/dCas抑制系统实现在生产阶段抑制脂肪酸合成的目标(图5)。最终DINH等[46]建立了一个群体响应的双动态调控系统,显著提高了柚皮素的生物合成效率,此外该系统对水杨酸的生物合成同样具有显著效果。

Module A-柚皮素合成模块;Module B-丙二酰-CoA消耗抑制模块
图5 基于群体响应效应的动态调控策略强化柚皮素合成
Fig.5 Quorum sensing based dynamic regulation strategy to
impro e the biosynthesis of naringenin
目前存在多种时空水平的动态调控策略,且在发酵过程中展现出优越的实时调控性能。将这些动态调控策略按照时空调控尺度不同分为环境响应型、胞内代谢物响应型和胞外代谢物响应型动态调控策略。其中环境响应型动态调控策略主要以全体细胞的“集体调控”为主,在此基础上实时监测环境变化,并动态调节代谢途径;胞内代谢物响应型动态调控策略主要以单细胞的“个体调控”为主,在此基础上实时监测单细胞自身的生理生化环境变化,并动态调节代谢途径;胞外代谢物响应型动态调控策略是一种处于“集体调控”与“个体调控”之间的过渡性策略,当胞内代谢物含量远高于胞外时则偏向于“个体调控”,当胞内代谢物含量等于或低于胞外含量时则偏向于“集体调控”。这些动态调控策略各有优缺点,胞内代谢产物响应型动态调控策略虽然可以实现单细胞水平调控,但是由于仅有少数代谢物仅存在于胞内,导致很多产物合成中无法应用此策略。因此,未来应用多种动态调控策略相结合的方式,构建更加灵敏、适应复杂环境的动态调控网络将可能成为重要研究方向[46-51]。
此外,由于多数代谢物可分泌到胞外,并被其他细胞摄取,引起了不同单细胞之间的信号干扰。建立微观尺度的单细胞发酵技术,实现单细胞的独立发酵至关重要。作为一种可能的解决方案,结合微流控技术的微液滴发酵技术有效隔绝了单细胞之间的相互干扰,有望实现更加精准的发酵调控[52-53]。另一方面,虽然成千上万的化合物实现了微生物法合成,但是其跨膜转运模式以及胞内外分布状态依然报道较少,这不利于时空水平的动态调控研究。因此,未来通过蛋白质工程手段调控代谢物在胞内外的分布将有助于动态调控的精准控制,促进发酵工程合成更多高附加值化合物。
[1] ZHOU S,HAO T,XU S,et al.Coenzyme A thioester-mediated carbon chain elongation as a paintbrush to draw colorful chemical compounds[J].Biotechnology Ad ances,2020,43:107 575.
[2] CRA ENS A,PAYNE J,SMOLKE C D.Synthetic biology strategies for microbial biosynthesis of plant natural products[J].Nature Communications,2019,10(1):2 142.
[3] LIAN J,MISHRA S,ZHAO H.Recent ad ances in metabolic engineering of Saccharomyces cere isiae:New tools and their applications[J].Metabolic Engineering,2018,50:85-108.
[4] LIN J L,WAGNER J M,ALPER H S.Enabling tools for high-throughput detection of metabolites:Metabolic engineering and directed e olution applications[J].Biotechnology Ad ances,2017,35(8):950-970.
[5] PANDEY R P,PARAJULI P,KOFFAS M A G,et al.Microbial production of natural and non-natural fla onoids:Pathway engineering,directed e olution and systems/synthetic biology[J].Biotechnology Ad ances,2016,34(5):634-662.
[6] ZHA J,WU X,GONG G,et al.Pathway enzyme engineering for fla onoid production in recombinant microbes[J].Metabolic Engineering Communications,2019,9:e00104.
[7] DIAO J J,SONG X Y,GUO T H,et al.Cellular engineering strategies toward sustainable omega-3 long chain polyunsaturated fatty acids production:State of the art and perspecti es[J].Biotechnology Ad ances,2020,40:107497.
[8] ZHANG L S,LIANG S,ZONG M H,et al.Microbial synthesis of functional odd-chain fatty acids:A re iew[J].World Journal of Microbiology & Biotechnology,2020,36(3):35.
[9] LIU N,LIU B,WANG G Y,et al.Lycopene production from glucose,fatty acid and waste cooking oil by metabolically engineered Escherichia coli[J].Biochemical Engineering Journal,2020,155:107 488.
[10] MA Y R,WANG K F,WANG W J,et al.Ad ances in the metabolic engineering of Yarrowia lipolytica for the production of terpenoids[J].Bioresource Technology,2019,281:449-456.
[11] ZHANG C,HONG K.Production of terpenoids by synthetic biology approaches[J].Frontiers in Bioengineering and Biotechnology,2020,8:347.
[12] CHOI K R,JIAO S,LEE S Y.Metabolic engineering strategies toward production of biofuels[J].Current Opinion in Chemical Biology,2020,59:1-14.
[13] PENG L,FU D,CHU H,et al.Biofuel production from microalgae:A re iew[J].En ironmental Chemistry Letters,2020,18(2):285-297.
[14] SHANMUGAM S,NGO H H,WU Y R.Ad anced CRISPR/Cas-based genome editing tools for microbial biofuels production:A re iew[J].Renewable Energy,2020,149:1 107-1 119.
[15] ZHAO M,HUANG D,ZHANG X,et al.Metabolic engineering of Escherichia coli for producing adipic acid through the re erse adipate-degradation pathway[J].Metabolic Engineering,2018,47:254-262.
[16] ZHAO M,LI G,DENG Y.Engineering Escherichia coli for glutarate production as the C5 platform backbone[J].Applied and En ironmental Microbiology,2018,84(16):e00 814-818.
[17] SHEN X L,WANG J,LI C Y,et al.Dynamic gene expression engineering as a tool in pathway engineering[J].Current Opinion in Biotechnology,2019,59:122-129.
[18] XIAO Y,BOWEN C H,LIU D,et al.Exploiting nongenetic cell-to-cell ariation for enhanced biosynthesis[J].Nature Chemical Biology,2016,12(5):339.
[19] LIU Y,ZHUANG Y,DING D,et al.Biosensor-based e olution and elucidation of a biosynthetic pathway in Escherichia coli[J].ACS Synthetic Biology,2017,6:837-848.
[20] WANG Q Z,TANG S Y,YANG S.Genetic biosensors for small-molecule products:Design and applications in high-throughput screening[J].Frontiers of Chemical Science and Engineering,2017,11(1):15-26.
[21] MIN B E,HWANG H G,LIM H G,et al.Optimization of industrial microorganisms:Recent ad ances in synthetic dynamic regulators[J].Journal of Industrial Microbiology & Biotechnology,2017,44(1):89-98.
[22] ZHENG Y,MENG F,ZHU Z,et al.A tight cold-inducible switch built by coupling thermosensiti e transcriptional and proteolytic regulatory parts[J].Nucleic Acids Research,2019,47(21):e137.
[23] HARDER B J,BETTENBROCK K,KLAMT S.Temperature-dependent dynamic control of the TCA cycle increases olumetric producti ity of itaconic acid production by Escherichia coli[J].Biotechnology and Bioengineering,2018,115(1):156-164.
[24] SUN J,TIAN K,WANG J,et al.Impro ed ethanol producti ity from lignocellulosic hydrolysates by Escherichia coli with regulated glucose utilization[J].Microbial Cell Factories,2018,17(1):66.
[25] YIN X,SHIN H D,LI J,et al.Pgas,a low-pH-induced promoter,as a tool for dynamic control of gene expression for metabolic engineering of Aspergillus niger[J].Applied and En ironmental Microbiology,2017,83(6):e03 222-16.
[26] RAJKUMAR A S,LIU G,DA ID B,et al.Engineering of synthetic,stress-responsi e yeast promoters[J].Nucleic Acids Research,2016,44(17):e136.
[27] AUSL NDER D,AUSL NDER S,CHARPIN-EL HAMRI G,et al.A synthetic multifunctional mammalian pH sensor and CO2 transgene-control de ice[J].Molecular Cell,2014,55(3):397-408.
[28] JOHNSON A O,GONZALEZ- ILLANUE A M,WONG L,et al.Design and application of genetically-encoded malonyl-CoA biosensors for metabolic engineering of microbial cell factories[J].Metabolic Engineering,2017,44:253-264.
[29] XU P,LI L Y,ZHANG F M,et al.Impro ing fatty acids production by engineering dynamic pathway regulation and metabolic control[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111(31):11 299-11 304.
[30] ZHANG F Z,CAROTHERS J M,KEASLING J D.Design of a dynamic sensor-regulator system for production of chemicals and fuels deri ed from fatty acids[J].Nature Biotechnology,2012,30(4):354-359.
[31] XU P,WANG W Y,LI L Y,et al.Design and kinetic analysis of a hybrid promoter-regulator system for malonyl-CoA sensing in Escherichia coli[J].ACS Chemical Biology,2014,9(2):451-458.
[32] LIU D,MANNAN A A,HAN Y,et al.Dynamic metabolic control:Towards precision engineering of metabolism[J].Journal of Industrial Microbiology & Biotechnology,2018,45(7):535-543.
[33] DINH C ,PRATHER K L J.Layered and multi-input autonomous dynamic control strategies for metabolic engineering[J].Current Opinion in Biotechnology,2020,65:156-162.
[34] LIU D,E ANS T,ZHANG F.Applications and ad ances of metabolite biosensors for metabolic engineering[J].Metabolic Engineering,2015,31:35-43.
[35] CHOU H H,KEASLING J D.Programming adapti e control to e ol e increased metabolite production[J].Nature Communication,2013,4:2595.
[36] WU J,LIU Y F,ZHAO S,et al.Application of dynamic regulation to increase L-phenylalanine production in Escherichia coli[J].Journal of Microbiology and Biotechnology,2019,29(6):923-932.
[37] KR MER R.Systems and mechanisms of amino acid uptake and excretion in prokaryotes[J].Archi es of Microbiology,1994,162(1):1-13.
[38] HALPERN Y S.Genetics of amino acid transport in bacteria[J].Annual Re iew of Genetics,1974,8(1):103-133.
[39] YAZAKI K.Transporters of secondary metabolites[J].Current Opinion in Plant Biology,2005,8(3):301-307.
[40] BURNS B P,MENDZ G L.‘Metabolite Transport’,in Helicobacter pylori:Physiology and genetics[M].Washington (DC):ASM Press,2001.
[41] MINAGAWA S,INAMI H,KATO T,et al.RND type efflux pump system MexAB-OprM of pseudomonas aeruginosa selects bacterial languages,3-oxo-acyl-homoserine lactones,for cell-to-cell communication[J].BMC Microbiology,2012,12:70.
[42] PEARSON J P, AN DELDEN C,IGLEWSKI B H.Acti e efflux and diffusion are in ol ed in transport of Pseudomonas aeruginosa cell-to-cell signals[J].Journal of Bacteriology,1999,181(4):1 203-1 210.
[43] PRESCOTT R D,DECHO A W.Flexibility and adaptability of quorum sensing in nature[J].Trends in Microbiology,2020,28(6):436-444.
[44] SCHUSTER M,SEXTON D J,DIGGLE S P,et al.Acyl-homoserine lactone quorum sensing:From e olution to application[J].Annual Re iew of Microbiology,2013,67(1):43-63.
[45] KIM E M,MIN WOO H,TIAN T,et al.Autonomous control of metabolic state by a quorum sensing (QS)-mediated regulator for bisabolene production in engineered E.coli[J].Metabolic Engineering,2017,44:325-336.
[46] DINH C ,PRATHER K L.De elopment of an autonomous and bifunctional quorum-sensing circuit for metabolic flux control in engineered Escherichia coli[J].Proceedings of the National Academy of Sciences of the United States of America,2019,116(51):25 562-25 568.
[47] YANG Y,LIN Y,WANG J,et al.Sensor-regulator and RNAi based bifunctional dynamic control network for engineered microbial synthesis[J].Nature Communications,2018,9(1):3 043.
[48] LO T M,CHNG S H,TEO W S,et al.A two-layer gene circuit for decoupling cell growth from metabolite production[J].Cell Systems,2016,3(2):133-143.
[49] MOSER F,BORUJENI A E,GHODASARA A N,et al.Dynamic control of endogenous metabolism with combinatorial logic circuits[J].Molecular Systems Biology,2018,14(11):e8605.
[50] GUPTA A,REIZMAN I M,REISCH C R,et al.Dynamic regulation of metabolic flux in engineered bacteria using a pathway-independent quorum-sensing circuit[J].Nature Biotechnology,2017,35(3):273-279.
[51] DOONG S J,GUPTA A,PRATHER K L.Layered dynamic regulation for impro ing metabolic pathway producti ity in Escherichia coli[J].Proceedings of the National Academy of Sciences of the United States of America,2018,115(12):2 964-2 969.
[52] KAMINSKI T S,SCHELER O,GARSTECKI P.Droplet microfluidics for microbiology:Techniques,applications and challenges[J].Lab on a Chip,2016,16(12):2 168-2 187.
[53] BOWMAN E K,ALPER H S.Microdroplet-assisted screening of biomolecule production for metabolic engineering applications[J].Trends in Biotechnology,2020,38(7):701-714.