不同益生元对植物乳杆菌生长的影响
陈韫慧1,2,方思璇1,陈佳琪1,郭振新1,胡宇超1,艾连中1,2,王光强1,2*
1(上海理工大学 医疗器械与食品学院,上海,200093)2(上海食品微生物工程技术研究中心,上海,200093)
摘 要 研究不同益生元对植物乳杆菌在不同培养条件下的促增殖作用。选用5株生理特性不同的植物乳杆菌为研究对象,利用Bioscreen检测它们的生长情况,进一步通过Baranyi模型拟合曲线,从而得到最大比生长速率和迟滞期。结果表明:在MRS培养基下,添加5种不同的益生元对植物乳杆菌无明显促增殖作用;在以益生元替代葡萄糖作为碳源的MRS培养基中,植物乳杆菌对不同的益生元具有选择偏好性,且具有菌株特异性;在模拟肠道体系下,与对照相比,益生元能明显促进所有植物乳杆菌的增长,其中低聚果糖与低聚半乳糖最优。实验结论显示,模拟肠道体系可以作为最精确和快速的益生元筛选体系。
关键词 益生元;植物乳杆菌;碳源
DOI:10.13995/j.cnki.11-1802/ts.024440
引用格式:陈韫慧,方思璇,陈佳琪,等.不同益生元对植物乳杆菌生长的影响[J].食品与发酵工业,2020,46(21):28-33.CHEN Yunhui,FANG Sixuan,CHEN Jiaqi,et al.Effects of different prebiotics on the growth of Lactobacillus plantarum[J].Food and Fermentation Industries,2020,46(21):28-33.
Effects of different prebiotics on the growth of Lactobacillus plantarum
CHEN Yunhui1,2,FANG Sixuan1,CHEN Jiaqi1,GUO Zhenxin1,HU Yuchao1, AI Lianzhong1,2,WANG Guangqiang1,2*
1(School of Medical Instrument and Food Engineering, Uni ersity of Shanghai for Science and Technology, Shanghai 200093,China) 2(Shanghai Engineering Research Center of Food Microbiology, Shanghai 200093, China)
ABSTRACT To study the effects of different prebiotics on the proliferation of Lactobacillus plantarum in different culture conditions, fi e strains of L. plantarum with different physiological characteristics were used as the research objects. The growth was detected with Bioscreen, and the maximum specific growth rate and lag period were obtained by Baranyi models. The results showed that, in MRS medium, adding fi e different prebiotics had no significant effect on the proliferation of L. plantarum; in MRS medium with prebiotics instead of glucose as carbon source, L. plantarum had preference for different prebiotics, and has strain specificity; in the simulated intestinal system, prebiotics can significantly promote the growth of all L. plantarum, among which fructo-oligosaccharide and galacto-oligosaccharide were the best. The simulated intestinal system was pro ed to be a precise and fast system for prebiotics screening.
Key words prebiotics;Lactobacillus plantarum;carbon source
第一作者:硕士研究生(王光强副教授为通讯作者,E-mail:1015wanggq@163.com)
基金项目:国家重点研发计划项目(2018YFD0501600); 上海市科技兴农项目(2019-02-08-00-07-F01152); 大学生创新创业训练计划项目
收稿日期:2020-05-13,改回日期:2020-06-05
益生元是一类不被宿主消化吸收却能够选择性地促进体内有益菌的代谢和增殖,从而改善宿主健康的有机物质,目前常用的是功能性低聚糖,即由2~10个单糖分子所组成的寡糖类物质。益生元具有非消化的特性,但益生元可以被肠道菌群发酵,促进肠道益生菌的新陈代谢和繁殖[1-2]。益生元被分解代谢,通过产酸使肠道内pH值下降,减少机体内的毒素水平,提高机体的抗病性[3]。研究发现,益生元还能增强机体的免疫功能,调节脂肪、蛋白质、矿物质的代谢吸收,改善肠道的微环境系统[4]。虽然益生元十分重要,但目前益生元的筛选仍然比较混乱[3,5-6]。有的是直接在培养基中添加不同益生元后进行筛选,有的则是利用益生元代替培养基中的葡萄糖当作碳源。但到目前为止还没有对这些方法进行比较,对不同培养条件下益生元对益生菌生长的影响还未知,而且这些结果是否与体外模拟肠道环境下的结果一致也需进一步的研究。另外,由于益生菌具有菌株差异性,不同菌株含有的糖类代谢基因完全不同,导致了益生元对不同益生菌的影响是不同的[7]。由于菌株之间的差异性很大,而且同一个糖类代谢酶可能可以作用于不同的寡糖类益生元,因此目前靶向筛选益生菌仍然是一个难题[3]。
本文分别在MRS培养基中添加益生元、以益生元替代MRS中的葡萄糖以及在体外模拟肠道中添加益生元为培养基,研究不同益生元对5株生理特性不同的植物乳杆菌生长的影响,提供参考依据。
1 材料与方法
1.1 材料与设备
供试菌株:植物乳杆菌AR113、AR509、AR237、AR514、AR117,由本实验室提供。
益生元:低聚果糖(fructooligosaccharides,FOS)纯度≥95%、低聚木糖(xylooligosaccharides,XOS)纯度≥95%、低聚半乳糖(galactooligosaccharides,GOS)纯度≥70%、低聚异麦芽糖(isomaltooligosaccharide,IMO)纯度≥90%、菊粉(Inulin)纯度≥90%,由上海源叶生物科技有限公司生产。
设备:Bioscreen C 全自动生长曲线分析仪,芬兰 Bioscreen;HPX-9162MBE 型电热恒温培养箱,上海沪粤明科学仪器有限公司;湘仪L500台式低速自动平衡离心机,湖南湘仪实验室仪器开发有限公司;SW-CJ-2FD 超净工作台,上海续畅实业有限公司;高压蒸汽灭菌锅,日本 Hirayama。
1.2 培养基配制
MRS培养基:蛋白胨10 g、酵母提取物5 g、牛肉浸粉10 g、葡萄糖20 g、K2HPO4 2 g、CH3COONa·3H2O 5 g、柠檬酸三铵2 g、MgSO4·7H2O 0.1 g、MnSO4·4H2O 0.05 g、吐温-80 1 mL,定溶于1 L去离子水中,115 ℃灭菌20 min。
1.3 菌株纯化
从-80 ℃冰箱中取出5株菌株,于MRS固体培养基上划线后于厌氧培养箱培养48 h,重复3次后涂片,染色,镜检,然后用甘油保藏法保存备用。
1.4 实验方法
1.4.1 添加益生元时植物乳杆菌生长曲线的测定
从-20 ℃冰箱中取出待试菌株,将5株菌株活化12 h后,以1%的接种量接种于MRS培养基中,分别添加20 g/L的FOS、XOS、GOS、IMO和Inulin,添加的益生元均经过0.22 μm水相过滤器过滤,对照组不添加益生元。每组取200 μL 菌液放置于全自动生长曲线分析仪的培养板中,37 ℃培养48 h,以未接菌的培养基为参比溶液,每组3个平行,测定间隔为0.5 h。
1.4.2 益生元充当碳源时植物乳杆菌生长曲线的测定
配制不含葡萄糖的MRS基础培养基,以20 g/L的FOS、XOS、GOS、IMO和Inulin替换葡萄糖作为碳源,接种量为1%,对照组加入20 g/L葡萄糖,益生元与葡萄糖溶液都经0.22 μm水相过滤器过滤。每组取200 μL 菌液放置于全自动生长曲线分析仪的培养板中,37 ℃培养48 h,以未接菌的培养基为参比溶液,每组3个平行,测定间隔为0.5 h。
1.4.3 体外模拟小鼠肠道
由于肠道微生物所受影响因素很多,为了尽可能地控制饮食、环境等因素对肠道微生物的影响,也为了方便增加可重复性,依据文献,采集统一喂养小鼠所排泄的粪便[8]。另一方面,随着菌株特异性标记技术的成熟,后续进一步通过小鼠模型验证体外所筛选益生元对特定益生菌的影响,从而确认此方法的可靠性。当然待小鼠实验被证实完全可信后还需要增加人体相关实验,证实有效后进而推广产业化应用。
本实验的具体操作如下:配制6 g/L的小鼠粪便溶液,均质后于高压灭菌锅121 ℃灭菌15 min。将活化12 h后的菌液以9 600 r/min离心1 min,倒去培养基,菌体洗涤后将1%菌液接种于小鼠粪便液体培养基中,加入20 g/L胰蛋白胨充当氮源,10 g/L益生元充当碳源(其分组如表1所示),对照组不添加胰蛋白胨与益生元,益生元与胰蛋白胨溶液都经0.22 μm水相过滤器过滤。每组取200 μL菌液放置于全自动生长曲线分析仪的培养板中37 ℃培养48 h,以未接菌的培养基为参比溶液,每组3个平行测定OD600,测定间隔为0.5 h。
表1 实验分组
Table 1 Test group

菌株配料A配料BAR11310 g/L FOS+20 g/L 胰蛋白胨10 g/L GOS+20 g/L 胰蛋白胨AR11710 g/L FOS+20 g/L 胰蛋白胨10 g/L GOS+20 g/L 胰蛋白胨AR23710 g/L FOS+20 g/L 胰蛋白胨10 g/L Inulin+20 g/L 胰蛋白胨AR50910 g/L FOS+20 g/L 胰蛋白胨10 g/L GOS+20 g/L 胰蛋白胨AR51410 g/L FOS+20 g/L 胰蛋白胨10 g/L Inulin+20 g/L 胰蛋白胨
2 结果与分析
2.1 不同益生元对植物乳杆菌生长的促增殖作用
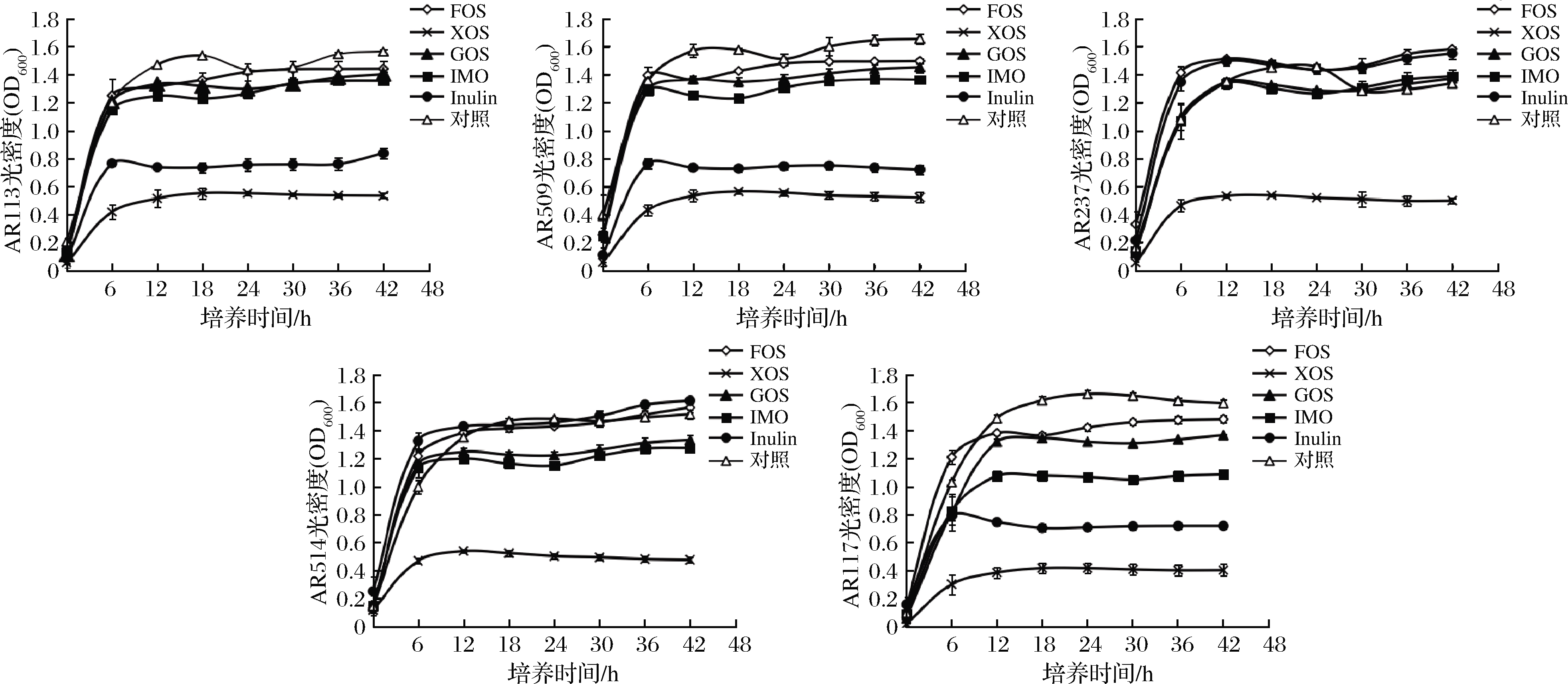
按照1.4.1小节所述方法添加相应益生元,利用Bioscreen测得各株植物乳杆菌的生长曲线如图1所示。以OD600的最大值作为植物乳杆菌菌株的生长情况的代表量,将各组进行单因素方差分析,分析数据见表2和表3。由表2可知,与对照组相比,菌株的各益生元组的最大比生长速率均无显著的增长迹象。由表3可知,除AR117的IMO组外,菌株在各益生元组的最大生物量与对照组相比无显著的增长迹象。在一些组别中,添加益生元甚至显著抑制了菌株的生长,如AR509、AR237的FOS组、XOS组、GOS组、Inulin组以及AR117的GOS组、Inulin组(P<0.05)。总体上添加益生元也不能促进它们的生长(P>0.05)。
目前大部分研究是在培养基中直接添加益生元,然后研究添加益生元后活性或者功能特性的变化[10-11],部分研究把益生元添加到基础培养基中[12],但基础培养基十分复杂,不适合大规模的筛选。但直接把益生元添加到MRS培养基中并不能促进菌株的生长,反而还可能抑制植物乳杆菌的生长。这可能的原因是葡萄糖效应,当益生元与葡萄糖同时存在时,菌株优先利用葡萄糖作为碳源,产生了分解代谢物阻遏效应[13-14],但具体原因需要进一步的研究。因此有葡萄糖存在的情况下,直接添加益生元可能并不适合用作益生元的筛选。


菌株最大比生长速率/(OD600·h-1)对照FOSXOSGOSIMOInulinAR1130.144±0.002a0.132±0.007bc0.131±0.001bc0.136±0.002b0.137±0.001b0.129±0.004cAR5090.146±0.002a0.136±0.001c0.142±0.003b0.143±0.001ab0.141±0.003b0.132±0.002dAR2370.116±0.002a0.108±0.001d0.111±0.002bc0.111±0.001bc0.108±0.002cd0.113±0.001bAR5140.122±0.007a0.114±0.002bc0.109±0.002c0.117±0.003ab0.122±0.001a0.112±0.003bcAR1170.126±0.005a0.122±0.001ab0.121±0.002b0.120±0.001b0.122±0.001ab0.120±0.002b
注:同一行不同小写字母表示在P<0.05水平下差异显著(下同)
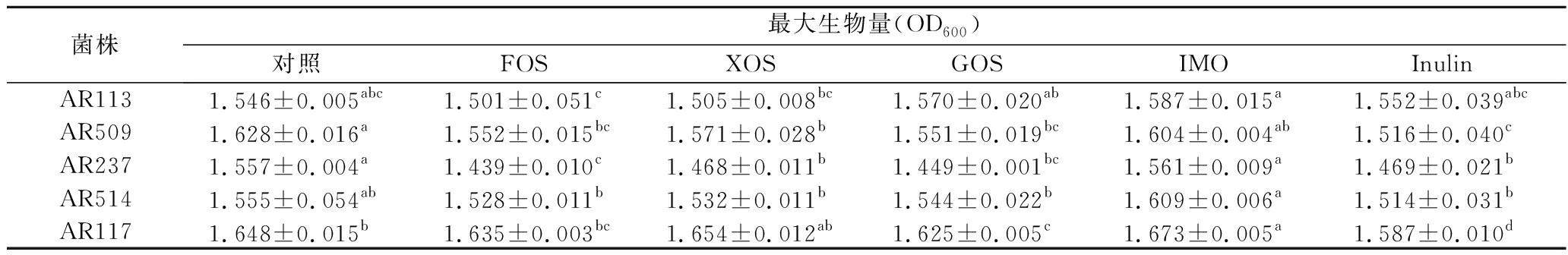
菌株最大生物量(OD600)对照FOSXOSGOSIMOInulinAR1131.546±0.005abc1.501±0.051c1.505±0.008bc1.570±0.020ab1.587±0.015a1.552±0.039abcAR5091.628±0.016a1.552±0.015bc1.571±0.028b1.551±0.019bc1.604±0.004ab1.516±0.040cAR2371.557±0.004a1.439±0.010c1.468±0.011b1.449±0.001bc1.561±0.009a1.469±0.021bAR5141.555±0.054ab1.528±0.011b1.532±0.011b1.544±0.022b1.609±0.006a1.514±0.031bAR1171.648±0.015b1.635±0.003bc1.654±0.012ab1.625±0.005c1.673±0.005a1.587±0.010d
2.2 植物乳杆菌在不同益生元作为碳源的培养基中的生长状况
由于葡萄糖的存在影响了益生元的选择,因此根据1.4.2的方法,用不同益生元替换MRS培养基中的葡萄糖,测得各株植物乳杆菌的生长曲线如图2所示。由图2、表4可知, AR113, AR509和AR117对益生元的利用情况相似,其增殖效果为:FOS、GOS最优,IMO次之,Inulin与XOS较差;益生元对AR237的增殖效果为:FOS、Inulin最优, IMO、GOS次之,XOS较差;益生元对AR514的增值效果为:Inulin>FOS> GOS>IMO>XOS。植物乳杆菌对不同的碳源具有选择偏好性,且不同植物乳杆菌菌株具有菌株特异性,这与SHARMA等[15]的研究基本一致。总体上,FOS、GOS和Inulin对植物乳杆菌的增殖效果较好,而XOS的效果最差,XOS不适合用作植物乳杆菌的碳源。

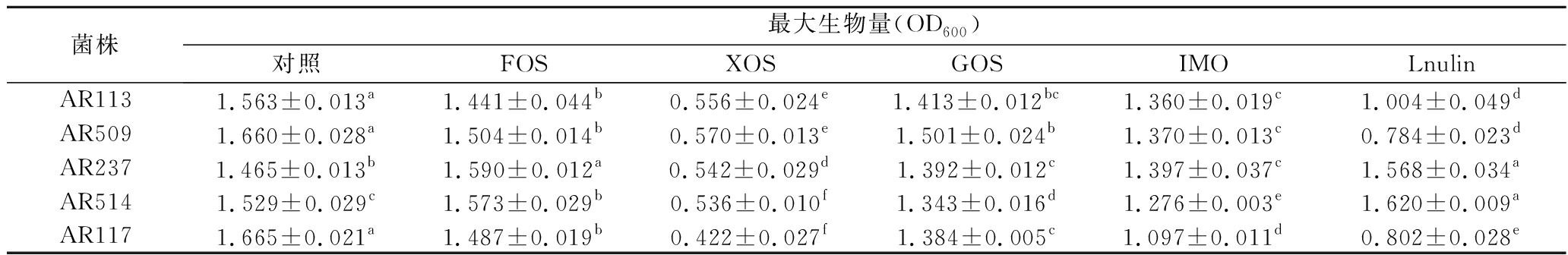
菌株最大生物量(OD600)对照FOSXOSGOSIMOLnulinAR1131.563±0.013a1.441±0.044b0.556±0.024e1.413±0.012bc1.360±0.019c1.004±0.049dAR5091.660±0.028a1.504±0.014b0.570±0.013e1.501±0.024b1.370±0.013c0.784±0.023dAR2371.465±0.013b1.590±0.012a0.542±0.029d1.392±0.012c1.397±0.037c1.568±0.034aAR5141.529±0.029c1.573±0.029b0.536±0.010f1.343±0.016d1.276±0.003e1.620±0.009aAR1171.665±0.021a1.487±0.019b0.422±0.027f1.384±0.005c1.097±0.011d0.802±0.028e
根据各植物乳杆菌的最大比生长速率分析各菌株在不同益生元作为发酵底物时的活力,由表5可知,除XOS组,AR117中的GOS组、IMO组,AR237中的IMO组外,其余各组与对照组相比,最大比生长速率显著提高(P<0.05)。其中,FOS、GOS与Inulin作为发酵底物时,菌株最大比生长速率提高幅度较大。这与上文中益生元增殖效果的分析相符合。

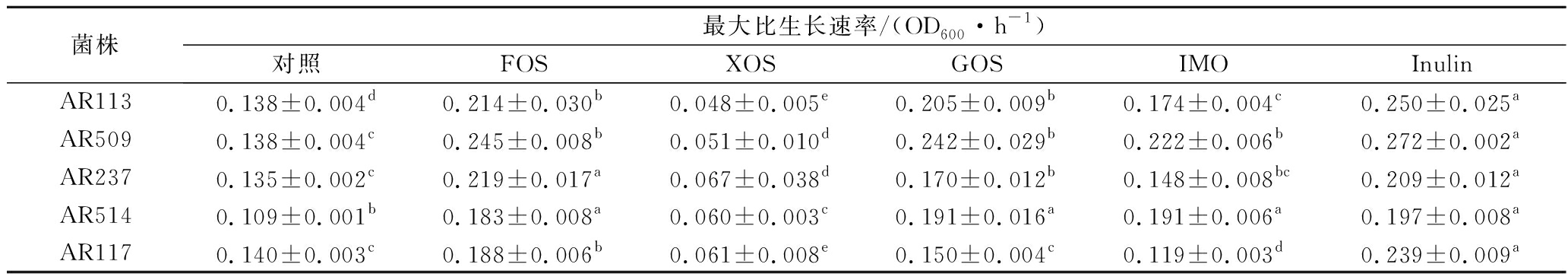
菌株最大比生长速率/(OD600·h-1)对照FOSXOSGOSIMOInulinAR1130.138±0.004d0.214±0.030b0.048±0.005e0.205±0.009b0.174±0.004c0.250±0.025aAR5090.138±0.004c0.245±0.008b0.051±0.010d0.242±0.029b0.222±0.006b0.272±0.002aAR2370.135±0.002c0.219±0.017a0.067±0.038d0.170±0.012b0.148±0.008bc0.209±0.012aAR5140.109±0.001b0.183±0.008a0.060±0.003c0.191±0.016a0.191±0.006a0.197±0.008aAR1170.140±0.003c0.188±0.006b0.061±0.008e0.150±0.004c0.119±0.003d0.239±0.009a
2.3 体外模拟小鼠肠道中植物乳杆菌对不同益生元的利用情况
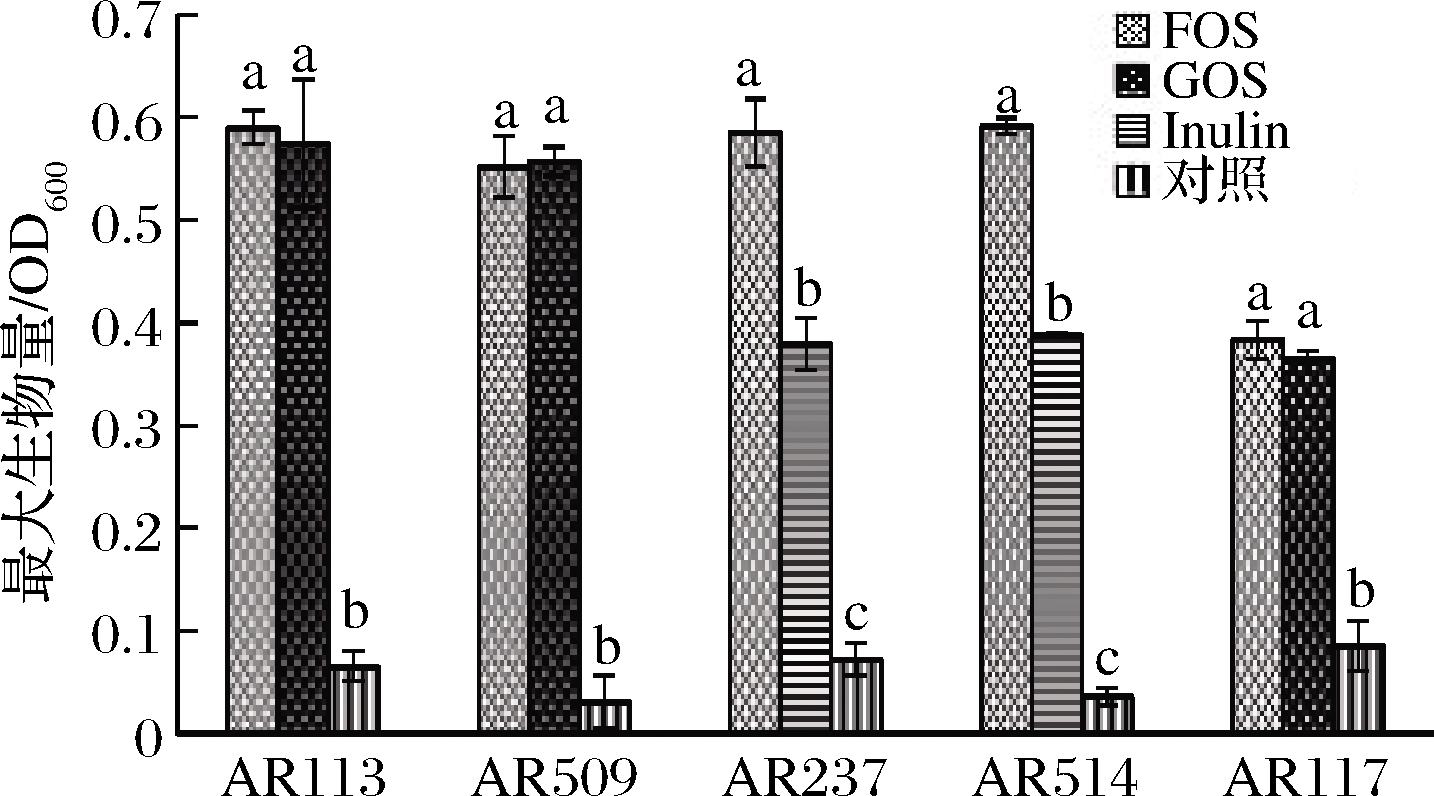
粪便是胃肠道代谢系统的生理产物,可以间接反映肠道代谢情况。李俊等[16]通过代谢物总离子图分析得知,小鼠粪便中含有多种小分子代谢物,如氨基酸类、脂肪酸、糖类、有机酸等。因此以灭菌小鼠粪便为培养基模拟小鼠肠道是可行的。与人工合成的其他培养基相比,小鼠粪便本身当作培养基更能反应小鼠肠道的环境[17]。为了验证体外筛选的益生元能否在模拟小鼠肠道促进益生菌的生长,测得各株植物乳杆菌的生长曲线如图3所示。
可能由于营养成分的缺乏,5株植物乳杆菌在只含粪便培养基的对照组中均无明显的生长现象。最近研究发现,氮源是限制肠道微生物生长的关键因素[18-19]。加入筛选的益生元与氮源后则出现了明显的生长现象(图3)。这表明植物乳杆菌在模拟肠道中可以利用FOS、GOS、Inulin这类益生元,促进自身的生长繁殖。通过比较植物乳杆菌的最大生长量可知,3株菌株AR113、AR509、AR117 对GOS与FOS的利用效率无显著性差异,2株菌株AR514与AR237 中FOS的利用效率显著高于Inulin(P<0.05),Inulin在此模拟环境中不能很好地被植物乳杆菌利用,这说明在不同环境下植物乳杆菌利用益生元的种类不同,这可能是由于利用益生元相关的基因大部分是诱导表达的相关[20-21],但具体原因还需要进一步的研究。
根据1.4.3小节的方法测得数据,通过软件拟合后得到表6结果。由表6可知,除AR117以及AR113的GOS组外,各组的最大比生长速率均无显著性差异,AR117与各组相比生长速率下降显著(P<0.05)。比较各组植物乳杆菌生长的迟滞期可知,各植物乳杆菌的迟滞期差异较大,其中AR117的GOS组迟滞期最长,AR237的Inulin组迟滞期最短。这说明益生元对不同植物乳杆菌的影响具有菌株特异性。
表6 模拟肠道环境中各植物乳杆菌的迟滞期与
最大比生长速率
Table 6 Lag period and maximum specific growth rate of L. plantarum in simulated intestinal en ironment  ±SD)
±SD)
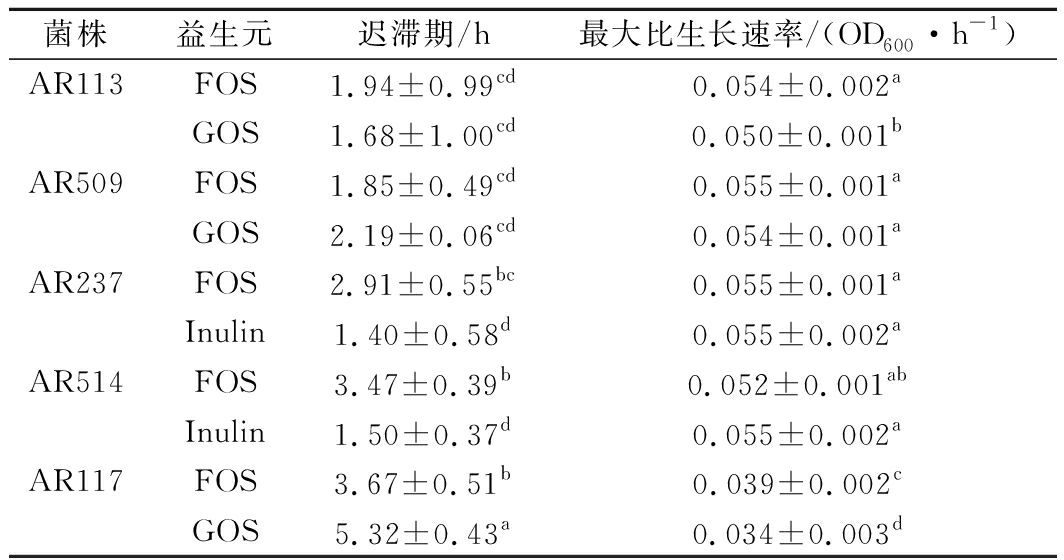
菌株益生元迟滞期/h最大比生长速率/(OD600·h-1)AR113FOS1.94±0.99cd0.054±0.002aGOS1.68±1.00cd0.050±0.001bAR509FOS1.85±0.49cd0.055±0.001aGOS2.19±0.06cd0.054±0.001aAR237FOS2.91±0.55bc0.055±0.001aInulin1.40±0.58d0.055±0.002aAR514FOS3.47±0.39b0.052±0.001abInulin1.50±0.37d0.055±0.002aAR117FOS3.67±0.51b0.039±0.002cGOS5.32±0.43a0.034±0.003d
注:同一列不同小写字母表示在P<0.05水平下差异显著
3 结论
在MRS培养下,添加5种质量浓度为20 g/L的益生元对植物乳杆菌无明显促增殖作用,因此并不能用此方法筛选益生元。在以益生元替代葡萄糖作为碳源的MRS培养基中,植物乳杆菌对不同的益生元具有选择偏好性,且具有菌株特异性。综合5株植物乳杆菌在此培养条件下的生长状况,低聚果糖、低聚半乳糖、菊粉这3种益生元促增殖效果较好,此方法基本上能与模拟肠道的培养体系一致,但存在一定的误差,比如菊粉在模拟肠道环境下不能很好地促进植物乳杆菌生长。在以灭菌小鼠粪便与胰蛋白胨复合为基础培养条件的模拟肠道体系下,与对照相比,益生元能明显促进所有植物乳杆菌的增长,其中低聚果糖与低聚半乳糖的促增殖效果更为优异,这是一个更加方便可靠的方法,可以用作益生元的筛选。
参考文献
[1] 郭晔, 邢志凯,李蒙,等. 植物益生元对肠道菌群的调节及对机体糖代谢吸收的影响[J]. 农产品加工,2020(6):52-57.
[2] 徐海燕, 张和平. 益生菌、益生元的研究进展[J]. 中华炎性肠病杂志,2019(3):213-216.
[3] 吴少辉, 魏远安,吴嘉仪,等. 益生元精准化研究进展[J]. 食品科学,2018,39(9):333-340.
[4] ROBERFROID M,GIBSON G R,HOYLES L,et al.Prebiotic effects:Metabolic and health benefits[J]. British Journal of Nutrition,2010,104(S2):S1-S63.
[5] 张鹏宇, 张美萍,麻开香,等. 几种常用益生元不同配伍对三株益生菌体外生长的调节作用[J]. 中国微生态学杂志,2019,31(1):21-24.
[6] RUIZ-HERRERO T,FAI T G,MAHADE AN L. Dynamics of growth and form in prebiotic esicles[J]. Physical Re iew Letters,2019,123(3).DOI:10.1103/PhysRe Lett.123.038102.
[7] AL-SHERAJI S H,ISMAIL A,MANAP M Y,et al.Prebiotics as functional foods:A re iew[J]. Journal of Functional Foods,2013,5(4):1 542-1 553.
[8] PHAM T,MOHAJERI M H. The application of in itro human intestinal models on the screening and de elopment of pre-and probiotics[J]. Beneficial Microbes,2018,9(5):725-742.
[9] 刘璐, 邢少华,张健,等. 基于Baranyi模型的波动温度下鲐鱼微生物生长动力学模型[J].食品科学,2015,36(5):89-92.
[10] 刘秀清, 刘璐,李晓东. 不同益生元对发酵乳中鼠李糖乳杆菌活性的影响研究[J]. 现代农业科技,2016(20):262-263.
[11] 牛春华, 赵玉娟,张健,等. 益生元低聚糖对发酵乳杆菌CH4的促生长作用[J]. 吉林农业科学,2015(2):107-111.
[12] 提盼盼. Akkermansia muciniphila益生元的体外筛选及体内作用效果评价[D].天津:天津科技大学,2018.
[13] MAGASANIK B. Catabolite repression[J]. Cold Spring Harbor Symposia on Quantitati e Biology,1961,26(26):249-256.
[14] 吴艳, 顾阳,任聪,等. 微生物分解代谢物控制蛋白CcpA的研究进展[J]. 生命科学,2011,23(9):882-890.
[15] SHARMA S,KANWAR S S. Effect of prebiotics on growth beha ior of Lactobacillus plantarum and their impact on adherence of strict anaerobic pathogens to intestinal cell lines[J]. Journal of Food Safety,2018,38.DOI:10.111/jfs.12384..
[16] 李俊, 王军,万艳,等.基于GC/TOF-MS技术对流感感染小鼠粪便代谢组学的研究[J].畜牧与兽医,2019,51(4):115-120.
[17] FU Y,CHEN K,ZHANG J,et al. E aluation of the effects of four media on human intestinal microbiota culture in itro[J]. AMB Express,2019,9:69.
[18] REESE A T, PEREIRA F C,SCHINTLMEISTER A, et al. Microbial nitrogen limitation in the mammalian large intestine[J]. Nature Microbiology,2018,3:1 441-1 450.
[19] HOLMES A,CHEW Y,COLAKOGLU F,et al. Diet-microbiome interactions in health are controlled by intestinal nitrogen source constraints[J]. Cell Metabolism,2017,25(1):140-151.
[20] GOH Y J,KLAENHAMMER T R. Genetic mechanisms of prebiotic oligosaccharide metabolism in probiotic microbes[J]. Annual Re iew of Food Science & Technology,2015,6:137-56.
[21] ENTURA M,TURRONI F,SINDEREN D . Probiogenomics as a tool to obtain genetic insights into adaptation of probiotic bacteria to the human gut[J]. Bioengineered Bugs,2012,3(2):73-79.