图1 糖原磷酸化酶催化反应示意图
Fig.1 The reactions illustrated are of glycogen phosphorylase
糖苷磷酸化酶催化多糖或寡糖非还原末端的糖基部分与无机磷酸盐缩合,形成糖基磷酸(图1)。磷酸化酶这一术语最早出现于1938年,CORID等[1]将其描述为产生葡萄糖1-磷酸的一种因子。这些酶遵循“底物名称+磷酸化酶”的命名规则,其EC号的通用格式为2.4.x.x,例如蔗糖磷酸化酶,其底物为蔗糖,EC号为2.4.1.7。磷酸化酶在酶的历史上占有重要地位,CARL和GERTY由于发现了糖原磷酸化酶获得了1947年的诺贝尔生理学奖,EDMOND和EDWIN[2]因鉴定了肌肉糖原磷酸化酶的磷酸化作用而获得1992年的诺贝尔医学奖。
图1 糖原磷酸化酶催化反应示意图
Fig.1 The reactions illustrated are of glycogen phosphorylase
糖苷磷酸化酶(glycoside phosphorylase,GP)与糖苷转移酶(glycosyltransferase,GT)、糖苷水解酶(glycoside hydrolase,GH)是可以使糖苷键形成与断裂的3种主要酶。与糖苷水解酶相比,糖苷磷酸化酶产物的代谢结合不需要ATP,同时由于其催化的反应可逆,可以逆向反应合成一些寡糖。与合成酶——糖苷转移酶相比,糖苷磷酸化酶不需要断开高能的糖基-核苷酸键(磷酸二酯键),且底物成本低,使得磷酸化酶在工业方面的研究更加广泛。
传统的磷酸化酶酶活力测定方法为高效液相色谱法(HPLC),其缺点是需要昂贵的设备以及特殊的色谱柱。现在人们通常使用基于磷酸盐比色法的酶活力测定方法,磷酸盐比色法是基于磷酸盐和钼酸盐与还原剂或染料形成的有色络合物,该方法使得磷酸化酶的酶活力测定更加简便经济。近年来磷酸盐比色法的研究与应用还在不断深入,测量方法也日渐成熟。1999年ELIZABETH等[3]比较了5种基于磷钼酸盐络合物的磷酸盐比色法,发现抗坏血酸还原法具有颜色稳定和低背景值的优势。2004年GAWRONSKI等[4]将磷酸盐一抗坏血酸比色法用于测定谷氨酰胺合成酶的活性测定,检测的线性范围从不足5 nmol/L扩大到100 nmol/L。2010年,GROE E等[5]对GAWRONSKI等的方法进行改良后用于糖苷磷酸化酶筛选,改良后检测的线性范围达到3 mmol/L。此外,除磷酸盐比色法之外还可以通过特定的试剂盒检测底物消耗或产物生成来定义磷酸化酶活性。
按照底物的不同可以将磷酸化酶分为3大类,二糖磷酸化酶、寡糖磷酸化酶以及多糖磷酸化酶。由于在磷酸化酶家族中主要为二糖磷酸化酶,本综述仅对二糖磷酸化酶进行讨论。关于其他磷酸化酶可以参考其他综述[6-9]。
根据糖基供体和所得的糖基磷酸的异头碳构型是否一致,可以将二糖磷酸化酶分为保留型和翻转型[10]。保留型的二糖磷酸化酶不会改变底物和磷酸化产物之间的异头碳构型,即α-糖苷底物被转化为α-糖基磷酸,β-糖苷底物被转化为β-糖基磷酸。保留型二糖磷酸化酶分布在GH和GT家族中。其中蔗糖磷酸化酶为GH13家族,最早在1942年被SCHWARZ等[11]发现。来自Bifidobacterium adolescentis的蔗糖磷酸化酶的晶体结构以及定点突变等的研究表明,其利用双置换机制催化蔗糖转化为α-D-葡萄糖1-磷酸和D-果糖[12]。1988年KITAMOTO等[13]在真菌Flammulina elutipes中发现海藻糖磷酸化酶,海藻糖磷酸化酶(保留型)为GT4家族,利用直接亲和置换机制催化海藻糖形成α-D-葡萄糖1-磷酸和D-葡萄糖(表1)。
表1 保留型二糖磷酸化酶分类
Table 1 Classification of retaining disaccharide
phosphorylases

家族EC名称底物产物GH132.4.1.7蔗糖磷酸化酶α-D-Glc-1,2-D-Fruα-D-Glc 1-P+D-FruGT42.4.1.231海藻糖磷酸化酶α-D-Glc-1,1-α-D-Glcα-D-Glc 1-P+D-Glc
翻转型的二糖磷酸化酶能够改变磷酸化产物的异头碳构型,即α-糖苷底物被转化为β-糖基磷酸,或β-糖苷底物被转化为α-糖基磷酸。翻转型二糖磷酸化酶全部存在于GH家族中,即GH65、GH94、GH112和GH130。与保留型二糖磷酸化酶相比,翻转型二糖磷酸化酶家族庞大,4个家族多达13个酶。
GH65家族中的二糖磷酸化酶作用于α-葡萄糖苷,除异麦芽糖之外的所有通过α-糖苷键连接的二糖均可以被相应的翻转型二糖磷酸化酶磷酸化产生β-D-葡萄糖1-磷酸。其中产生β-D-葡萄糖1-磷酸和D-葡萄糖的酶包括麦芽糖磷酸化酶、曲二糖磷酸化酶、黑曲霉糖磷酸化酶和海藻糖磷酸化酶(翻转型)(表2)。麦芽糖磷酸化酶首先在Neisseria meningitidis被发现[14],但编码其蛋白的基因则首先从Lactobacillus sanfranciscensis中被克隆[15]。海藻糖磷酸化酶(翻转型)最早发现于原生动物Euglena gracilis中[16],其基因则首先从Thermoanaerobacter brockii中被克隆[17]。曲二糖磷酸化酶从T. brockii被鉴定[18]与克隆[19]。黑曲霉糖磷酸化酶于2012年在Clostridium phytofermentans被NIHIRA等[20]发现,黑曲霉糖磷酸化酶与其他相关酶耦联后通过多酶级联反应可以从麦芽糖、蔗糖、淀粉中生产黑曲霉糖[21]。作用于二糖并归类于该家族的另一个磷酸化酶是α-D-葡萄糖基-1,3-L-鼠李糖磷酸化酶,NIHIRA等[22]在C.phytofermentans中发现该酶,并发现其具有严格的区域选择性,在逆向反应中仅利用L-鼠李糖作为受体。
GH94家族中的二糖磷酸化酶除N,N’-二乙酰基壳二糖磷酸化酶之外均在β-葡萄糖苷构型的底物上有活性,N,N’-二乙酰基壳二糖磷酸化酶催化产物为乙酰基-D-葡萄糖胺和乙酰基-D-葡糖胺1-磷酸,其他2种酶催化产物则均为D-葡萄糖1-磷酸和D-葡萄糖。其中纤维二糖磷酸化酶最为著名,1955年首先在Clostridium thermocellum中发现[23],并最先从Clostridium stercorarium中克隆[24]。昆布二糖磷酸化酶最早发现于E.gracilis中[25],从Paenibacillus sp.中鉴定出活性[26]并随后在Acholeplasma laidlawii中克隆了其基因[27]。N,N’-二乙酰基壳二糖磷酸化酶是作用于N-乙酰基-β-氨基葡萄糖苷的一种酶,在ibrio furnissii中发现[28],该酶被认为与几丁质的代谢有关[7]。
GH112家族是作用于β-半乳糖苷生成α-D-半乳糖1-磷酸的磷酸化酶家族。目前只包括β-D-半乳糖基-1,3-N-乙酰基己糖胺磷酸化酶和β-D-半乳糖基-1,4-L-鼠李糖磷酸化酶两种二糖磷酸化酶。β-D-半乳糖基-1,3-N-乙酰基己糖胺磷酸化酶首先在Bifidobacterium bifidum的无细胞提取物中被鉴定[29],其基因则最先从Bifidobacterium longum中被克隆[30]。2009年在C. phytofermentans的基因组中发现了β-D-半乳糖基-1,4-L-鼠李糖磷酸化酶[31],随后NAKAJIMA等人对该酶进行了性质鉴定,发现其不仅能磷酸化β-D-半乳糖基-1,4-L-鼠李糖,并且还显示出对次要底物β-D-半乳糖基-1,3-D-葡萄糖的活性[32]。
GH130家族的二糖磷酸化酶作用于β-甘露糖苷,可产生α-D-甘露糖1-磷酸。该家族包括3个二糖磷酸化酶,分别是β-1,2-甘露二糖磷酸化酶、β-D-甘露糖基-D-葡萄糖磷酸化酶和β-D-甘露糖基-1,4-N-乙酰氨基葡萄糖磷酸化酶。2014年CHIKU等[33]从Thermoanaerobacter sp.中鉴定出β-1,2-甘露二糖磷酸化酶,随后TSUDA等[34]对来源于Listeria innocua的β-1,2-甘露二糖磷酸化酶进行了表征。从Bacteroides fragilis中发现编码β-D-甘露糖基-D-葡萄糖磷酸化酶的基因,并确定该酶催化的反应为:β-D-甘露糖基-1,4-D-葡萄糖+Pi→α-D-甘露糖1-磷酸+D-葡萄糖[35]。2013年NIHIRA等[36]在Bacteroides thetaiotaomicron中鉴定出β-D-甘露糖基-1,4-N-乙酰氨基葡萄糖磷酸化酶,并指出其催化β-D-甘露糖基-1,4-N-乙酰基-D-葡萄糖胺转化为α-D-甘露糖1-磷酸和N-乙酰基-D-葡萄糖胺。
表2 翻转型二糖磷酸化酶分类
Table 2 Classification of in erting disaccharide phosphorylases

家族EC名称底物产物GH652.4.1.64海藻糖磷酸化酶α-D-Glc-1,1-α-D-Glcβ-D-Glc 1-P+D-Glc2.4.1.230曲二糖磷酸化酶α-D-Glc-1,2-D-Glcβ-D-Glc 1-P+D-Glc2.4.1.279黑曲霉糖磷酸化酶α-D-Glc-1,3-D-Glcβ-D-Glc 1-P+D-Glc2.4.1.8麦芽糖磷酸化酶α-D-Glc-1,4-D-Glcβ-D-Glc 1-P+D-Glc2.4.1.282α-D-葡萄糖基-1,3-L-鼠李糖磷酸化酶α-D-Glc-1,3-L-Rhaβ-D-Glc-1-P+L-RhaGH942.4.1.31昆布二糖磷酸化酶β-D-Glcp-1,3-D-Glcpα-D-Glc 1-P+D-Glc2.4.1.20纤维二糖磷酸化酶β-D-Glc-1,4-D-Glcα-D-Glc 1-P+D-Glc2.4.1.280N,N’-二乙酰基壳二糖磷酸化酶β-D-GlcNAc-1,4-D-GlcNAcα-D-GlcNAc 1-P+D-Glc-NAcGH1122.4.1.211β-D-半乳糖基-1,3-D-乙酰基己糖胺磷酸化酶β-D-Gal-1,3-D-GlcNAcα-D-Gal 1-P+D-GlcNAc2.4.1.247β-D-半乳糖基-1,4-L-鼠李糖磷酸化酶β-D-Gal-1,4-L-Rhaα-D-Gal 1-P+L-RhaGH1302.4.1.339β-1,2-甘露二糖磷酸化酶β-D-Man-1,2-D-Manα-D-Man 1-P+D-Man2.4.1.281β-D-甘露糖基-D-葡萄糖磷酸化酶β-D-Man-1,4-D-Glcα-D-Man 1-P+D-Glc2.4.1.320β-D-甘露糖基-1,4-N-乙酰氨基葡萄糖磷酸化酶β-D-Man-1,4-D-GlcNAcα-D-Man 1-P+D-GlcNAc
1985年MURAO等[37]通过偶联海藻糖磷酸化酶和麦芽糖磷酸化酶从麦芽糖合成海藻糖,首先麦芽糖磷酸化酶催化麦芽糖生成β-葡萄糖1-磷酸和葡萄糖,然后海藻糖磷酸化酶以β-葡萄糖1-磷酸和葡萄糖为底物合成海藻糖,这是首次报道通过结合两种磷酸化酶方式来制备海藻糖。AERTS等[38]详细研究了蔗糖磷酸化酶的受体特性,表明该酶具有广泛的受体特异性。此后,基于这种结合2种或多种酶的方式以及二糖磷酸化酶宽松的受体偏好性,许多研究小组对生产稀有糖或寡糖展开研究。MORIMOTO等[39]通过使用葡萄糖1-磷酸作为糖基供体和8种酮己糖作为受体,利用来自Leuconostoc mesenteroides的蔗糖磷酸化酶合成了8种相应的D-葡萄糖基-酮己糖,其中D-葡萄糖基-阿洛酮糖产率最高。ICHIKAWA等[40]采用一锅法从蔗糖合成N-乙酰氨基乳糖。WILDBERGER等[41]利用蔗糖磷酸化酶将蔗糖转化为葡萄糖1-磷酸后,将葡萄糖1-磷酸分别与D-甘露糖、D-半乳糖、D-乙酰氨基葡萄糖、D-葡萄糖胺、L-岩藻糖、D-木糖、D-阿拉伯糖、L-阿拉伯糖作为共同底物通过α-葡萄糖1-磷酸酶(EC 3.1.3.10)生产8种相应的糖1-磷酸。
综上所述,我们可以总结出一种合成寡糖或高附加值产物的普遍策略,即使用二糖磷酸化酶作为葡萄糖1-磷酸的原位生成器,然后将其作为其他磷酸化酶或其他酶元件所催化反应的底物。
目前已经有很多基于上述策略利用二糖磷酸化酶进行生物催化合成高价值化学品的应用研究。例如纤维二糖磷酸化酶与纤维二糖水解酶(EC 3.2.1.91)、内切葡聚糖酶(EC 3.2.1.4)以及α-葡聚糖磷酸化酶(EC 2.4.1.1)共同作用从纤维素合成直链淀粉(图2)[42]。纤维二糖磷酸化酶与纤维糊精磷酸化酶(EC 2.4.1.49)、聚磷酸葡萄糖激酶(EC 2.7.1.63)、葡萄糖磷酸变位酶(EC 5.4.2.2)、肌醇1-磷酸合成酶(EC
5.5.1.4)、肌醇单磷酸酶(EC 3.1.3.25)进行级联反应催化纤维糊精合成肌醇(图3)[43]。蔗糖磷酸化酶与磷酸葡萄糖变位酶、肌醇1-磷酸合成酶、肌醇单磷酸酶将蔗糖转化为肌醇与果糖(图4)[44]。昆布二糖磷酸化酶和异淀粉酶(EC 3.2.1.68)、α-葡聚糖磷酸化酶、4-葡聚糖转移酶(EC 2.4.1.25)构成多酶催化途径从麦芽糊精和葡萄糖合成昆布二糖(图5)[45]。
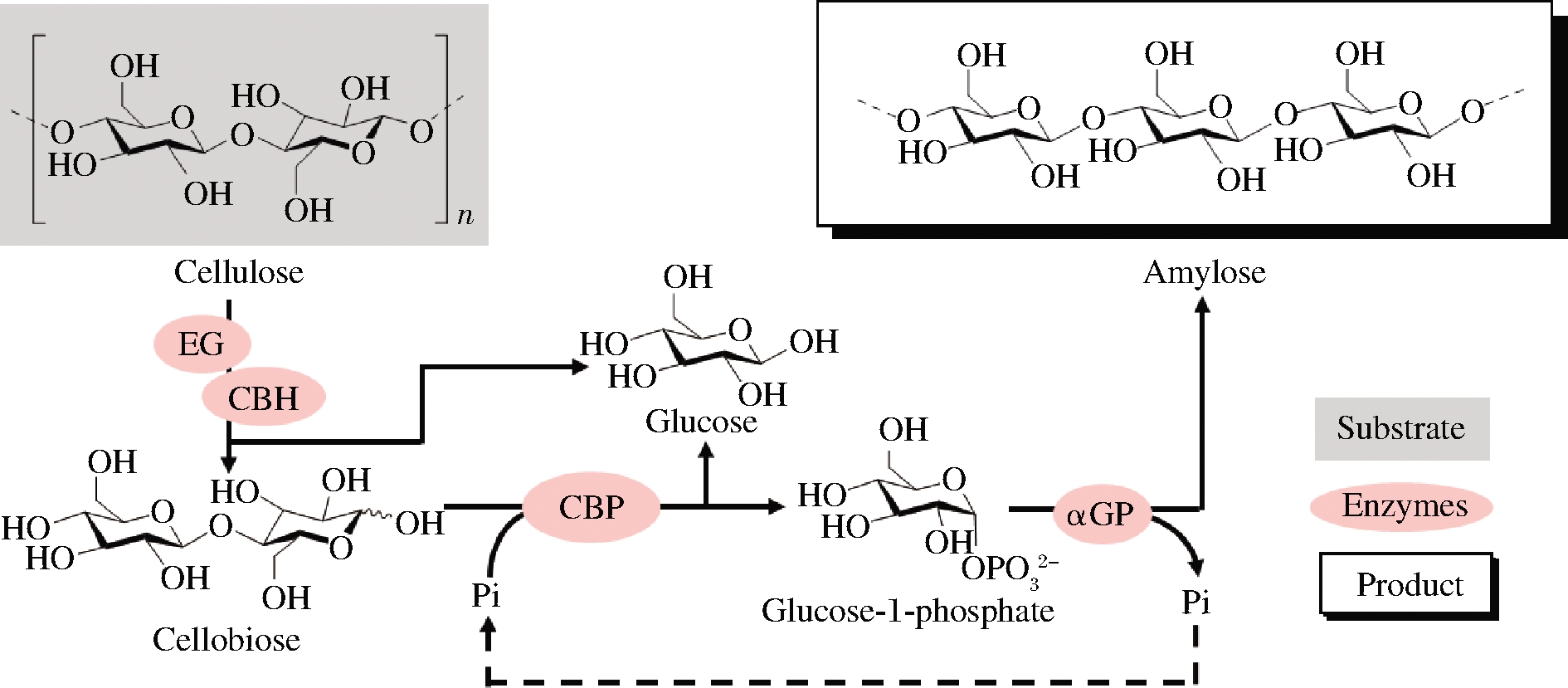
EG-内切葡聚糖酶(endoglucanases);CBH-纤维二糖水解酶
(cellobiohydrolase);CBP-纤维二糖磷酸化酶(cellobiose phosphorylase);
αGP-α-葡聚糖磷酸化酶(α-glucan phosphorylase)
图2 纤维二糖磷酸化酶参与纤维素合成直链淀粉
Fig.2 Cellobiose phosphorylase participates in synthesis
of amylose from cellulose
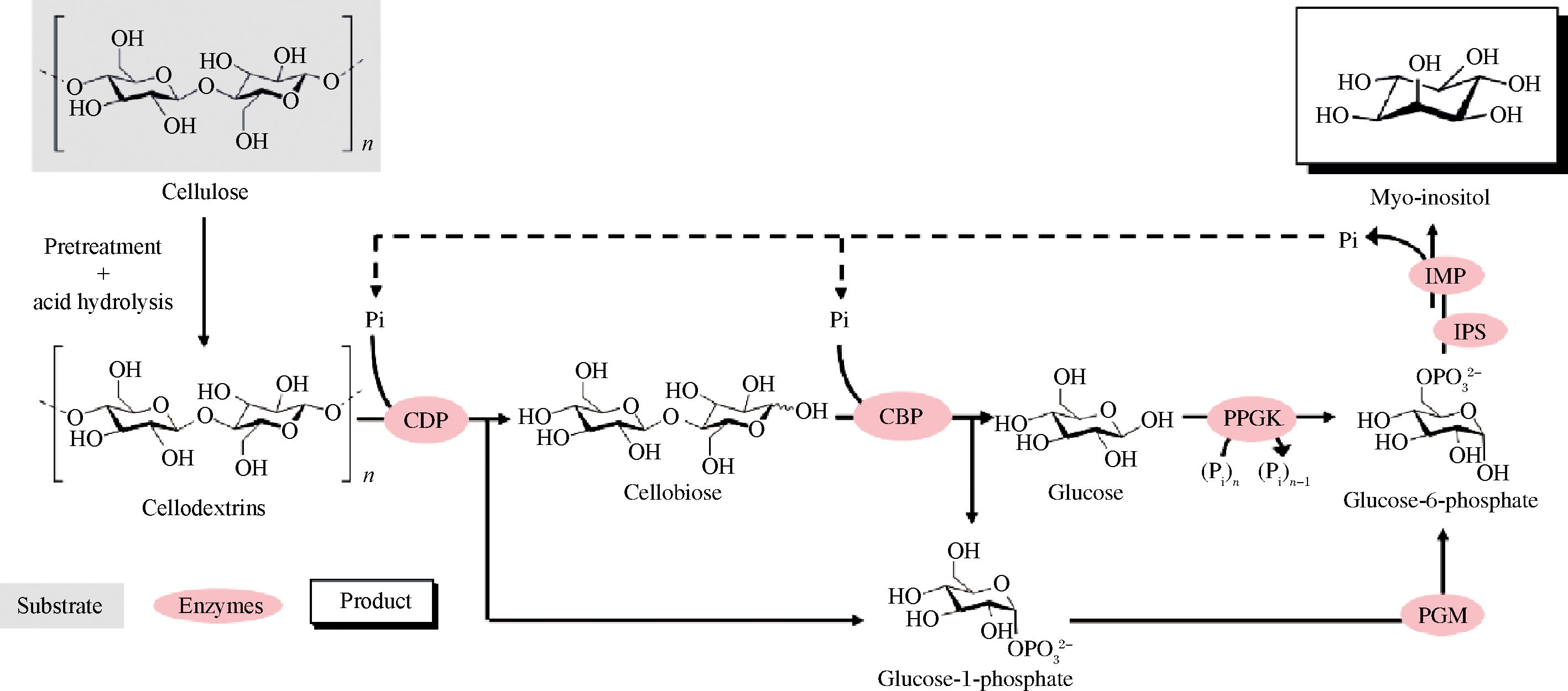
CDP-纤维糊精磷酸化酶(cellodextrin phosphorylase);CBP-纤维二糖磷酸化酶(cellobiose phosphorylase);PPGK-聚磷酸葡萄糖激酶(polyphosphate glucokinase);
PGM-葡萄糖磷酸变位酶(phosphoglucomutase);IPS-肌醇1-磷酸合成酶(inositol 1-phosphate synthase);IMP-肌醇单磷酸酶(inositol monophosphatase)
图3 纤维二糖磷酸化酶参与纤维糊精合成肌醇
Fig.3 Cellobiose phosphorylase participates in synthesis of myo-inositol from cellodextrins

SP-蔗糖磷酸化酶(sucrose phosphorylase);PGM-葡萄糖磷酸变位酶(phosphoglucomutase);
IPS-肌醇1-磷酸合成酶(inositol 1-phosphate synthase);IMP-肌醇单磷酸酶(inositol monophosphatase)
图4 蔗糖磷酸化酶参与蔗糖合成肌醇
Fig.4 Sucrose phosphorylase participates in synthesis of myo-inositol from sucrose
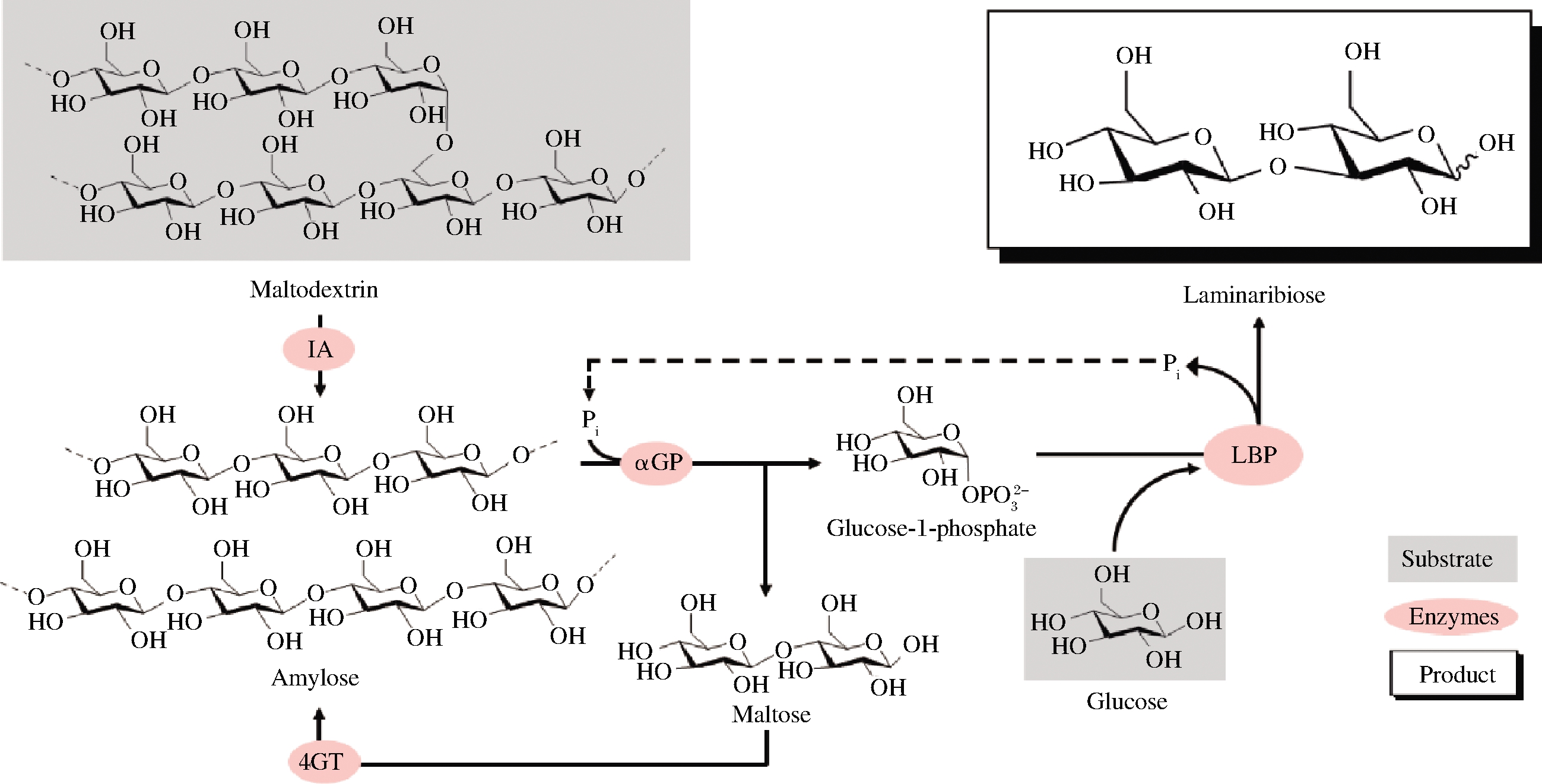
IA-异淀粉酶(isoamylase);4GT-4-葡聚糖转移酶(4-α-glucanotransferase);αGP-
α-葡聚糖磷酸化酶(α-glucan phosphorylase);LBP-昆布二糖磷酸化酶(laminaribiose phosphorylase)
图5 昆布二糖磷酸化酶参与麦芽糊精和葡萄糖合成昆布二糖
Fig.5 Laminaribiose phosphorylase participates in synthesis of laminaribiose from maltodextrin and glucose
自第二次工业革命以来,人类对不可再生资源的消耗导致化石燃料逐渐枯竭,有限的不可再生资源迫使人类开始开发各种可持续绿色能源,如太阳能、风能、水能等等。其中氢能被认为是最具潜力的绿色能源,未来氢能源有望替代化石能源成为工业化生产中最好的燃料。目前氢气的生产主要来源于天然气,还有一少部分来源于电解水和太阳能分解水,然而这两种技术由于其成本昂贵、生产效率低等问题并不适合实际社会应用。为了减少对化石燃料的依赖,使氢能源可持续生产,近年来科学家们开发了一种新的产氢技术,而二糖磷酸化酶在这其中扮演了重要角色。2009年,YE等[46]通过将纤维二糖磷酸化酶与12个酶耦联构建了一个体外合成氢气途径,成功利用纤维二糖产氢(图6)。在该途径中,首先纤维二糖磷酸化酶将纤维二糖转化为葡萄糖1-磷酸,其次葡萄糖磷酸变位酶催化葡萄糖-1-磷酸产生葡萄糖6-磷酸,然后两种脱氢酶——葡萄糖6-磷酸脱氢酶和6-磷酸葡糖酸脱氢酶催化NADPH和核酮糖5-磷酸的生成,同时磷酸戊糖途径的8个酶催化核酮糖5-磷酸再生葡萄糖6-磷酸,最后氢化酶催化NADPH产生氢气。2014年,MYUNG等[47]设计了由15种酶组成的体外合成酶促途径,以蔗糖为底物利用蔗糖磷酸化酶将其转化为下游反应的底物——葡萄糖1-磷酸和果糖(图7),并通过分批补料的方法使氢气最终的产率达到9.74 mmol/(L·h)。
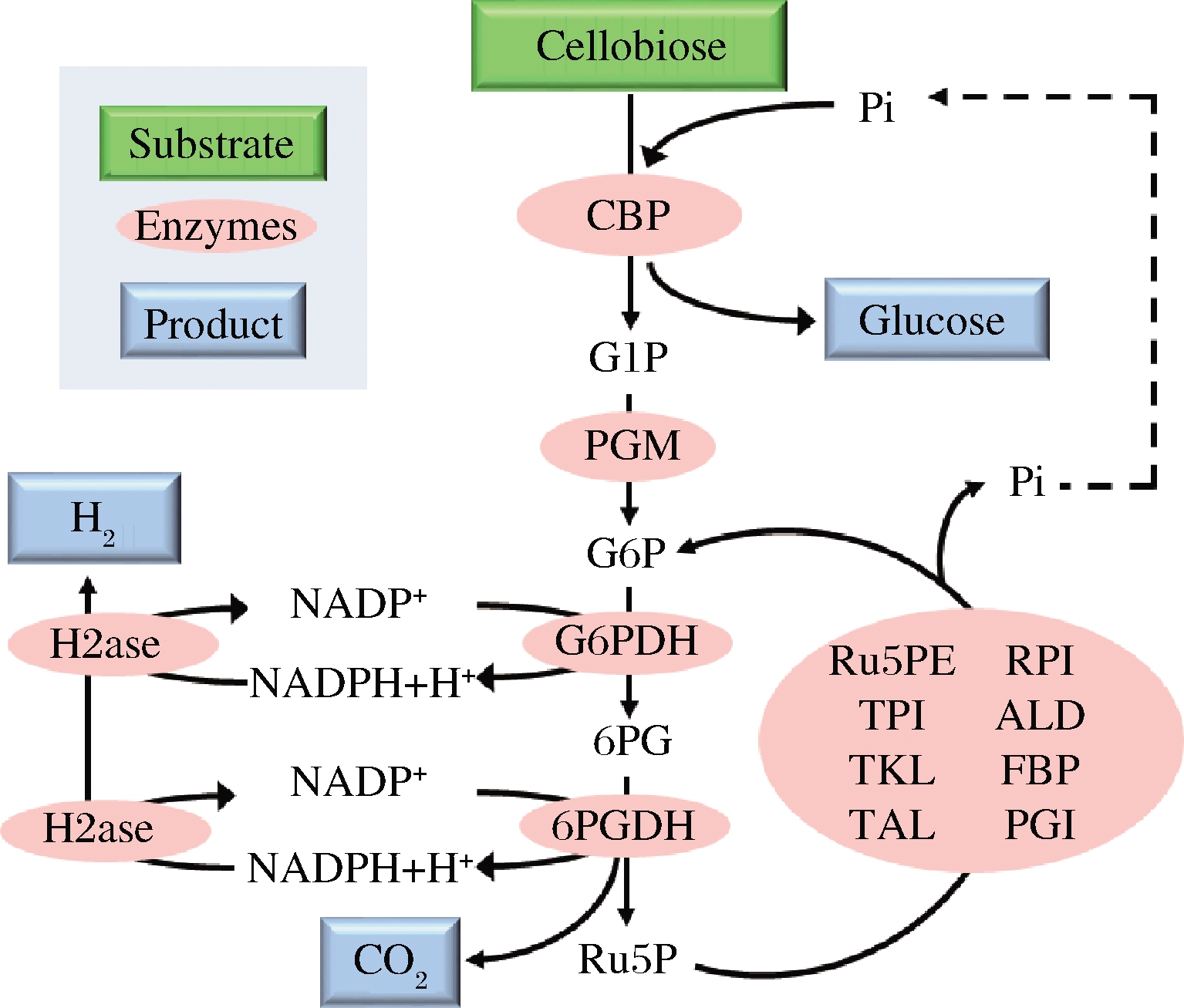
CBP-纤维二糖磷酸化酶(cellobiose phosphorylase);PGM-葡萄糖磷酸变位酶(phosphoglucomutase);G6PDH-葡萄糖6-磷酸脱氢酶(glucose 6-phosphate dehydrogenase);6PGDH-6-磷酸葡糖酸脱氢酶(6-phosphogluconate dehydrogenase);Ru5PE-核酮糖5-磷酸3-差向异构酶(ribulose 5-phosphate epimerase);RPI-核糖5-磷酸异构酶(phosphoribose isomerase);TKL-转酮醇酶(transketolase);TAL-转醛醇酶(transaldolase);TPI-丙糖磷酸异构酶(triose phosphate isomerase);ALD-果糖二磷酸醛缩酶(aldolase);FBP-果糖二磷酸酶(fructose-1,6-bisphosphatase);PGI-磷酸葡萄糖异构酶(phosphoglucose isomerase);H2ase-氢化酶(hydrogenase);G1P-葡萄糖1-磷酸(glucose 1-phosphate);G6P-葡萄糖6-磷酸(glucose 6-phosphate);6PG-葡萄糖6-磷酸内酯(6-phosphogluconate);Ru5P-核酮糖5-磷
酸(ribulose 5-phosphate)
图6 纤维二糖磷酸化酶参与纤维二糖产氢气
Fig.6 Cellobiose phosphorylase participates in production
of hydrogen from cellobiose
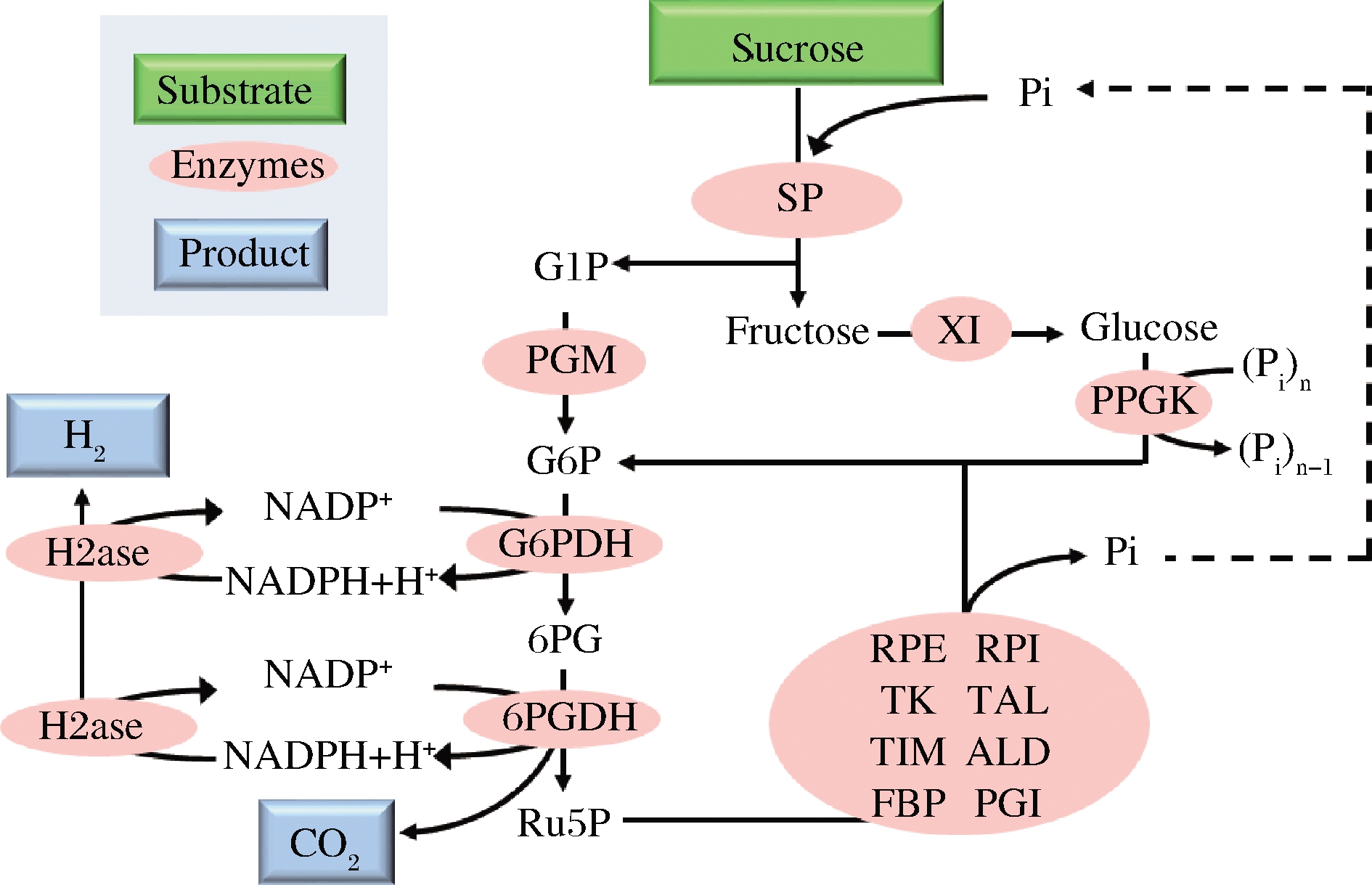
SP-蔗糖磷酸化酶(sucrose phosphorylase);PGM-葡萄糖磷酸变位酶(phosphoglucomutase);XI-木糖异构酶(xylose isomerase);PPGK-聚磷酸葡萄糖激酶(polyphosphate glucokinase);G6PDH-葡萄糖6-磷酸脱氢酶(glucose 6-phosphate dehydrogenase);6PGDH-6-磷酸葡糖酸脱氢酶(6-phosphogluconate dehydrogenase);RPE-核酮糖5-磷酸3-差向异构酶(ribulose 5-phosphate epimerase);RPI-核糖5-磷酸异构酶(phosphoribose isomerase);TK-转酮醇酶(transketolase);TAL-转醛醇酶(transaldolase);TIM-丙糖磷酸异构酶(triose phosphate isomerase);ALD-果糖二磷酸醛缩酶(aldolase);FBP-果糖二磷酸酶(fructose-1,6-bisphosphatase);PGI-磷酸葡萄糖异构酶(phosphoglucose isomerase);H2ase-氢化酶(hydrogenase);G1P-葡萄糖1-磷酸(glucose 1-phosphate); G6P-葡萄糖6-磷酸(glucose 6-phosphate);6PG-葡萄糖6-磷酸内酯(6-phosphogluconate);Ru5P-
核酮糖5-磷酸(ribulose 5-phosphate)
图7 蔗糖磷酸化酶参与蔗糖产氢气
Fig.7 Sucrose phosphorylase participates in production of
hydrogen by oxidation of sucrose
除氢能之外,最近利用糖作为燃料的酶燃料电池作为下一代环保型电池受到了人们极大的关注。酶燃料电池是一种以酶为催化剂,将生物能和化学能转化为电能的装置[48],具有安全、清洁、可再生的特点。2017年,ZHU等[49]设计了一种体外15酶合成途径,该途径可以共同利用酶燃料电池阳极室中的蔗糖、葡萄糖和果糖,其中蔗糖磷酸化酶参与了该途径的第一步反应(图8)。这项实验成果表明二糖磷酸化酶有助于开发多种以糖类物质为动力的酶燃料电池,未来更多的二糖磷酸化酶将为今后提取混合糖燃料中存储的巨大能量提供可行性解决方案。
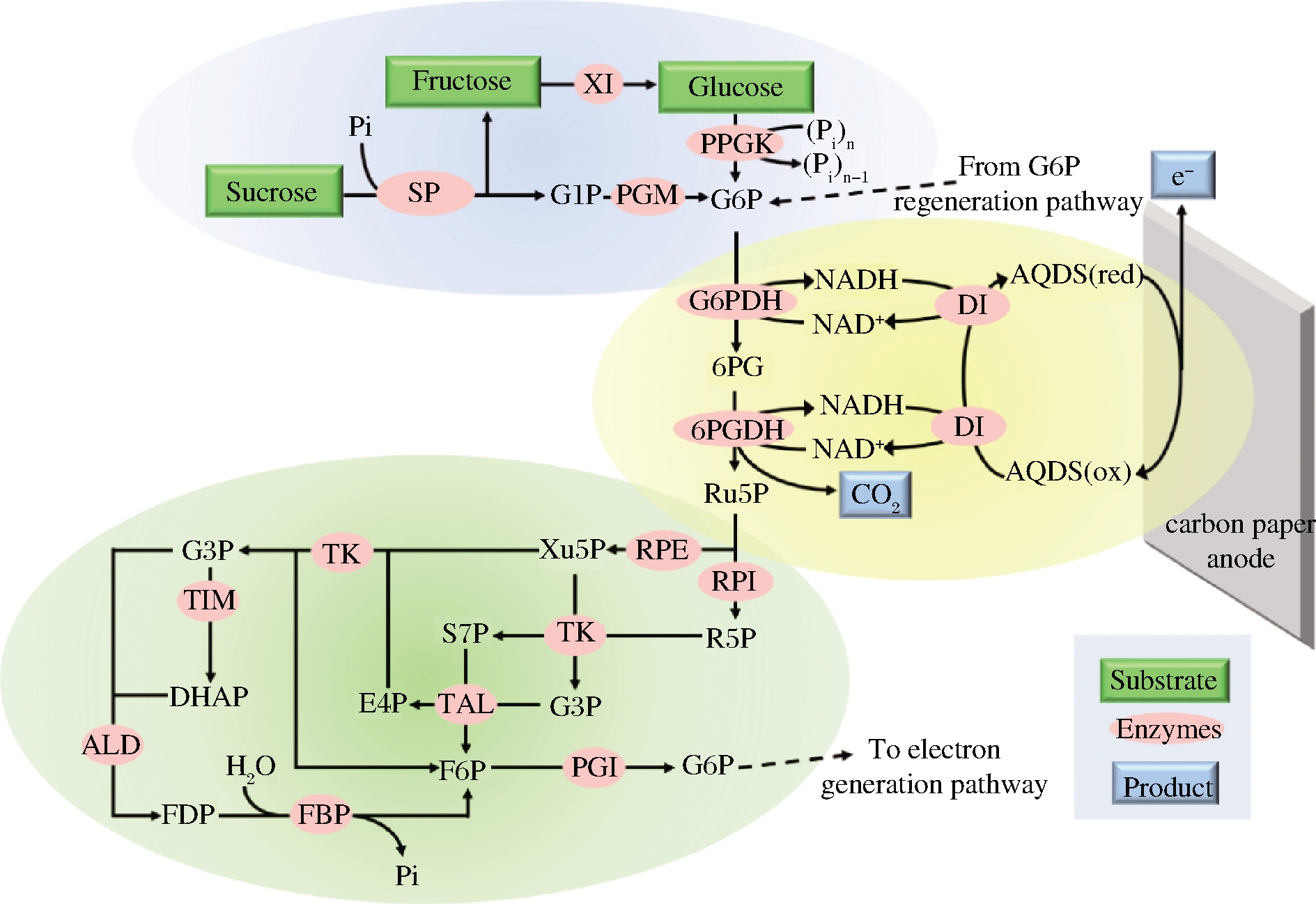
SP-蔗糖磷酸化酶(sucrose phosphorylase);PGM-葡萄糖磷酸变位酶(phosphoglucomutase);XI-木糖异构酶(xylose isomerase);PPGK-聚磷酸葡萄糖激酶(polyphosphate glucokinase);G6PDH-葡萄糖6-磷酸脱氢酶(glucose 6-phosphate dehydrogenase);6PGDH-6-磷酸葡糖酸脱氢酶(6-phosphogluconate dehydrogenase);DI-黄递酶(diaphorase);RPE-核酮糖5-磷酸3-差向异构酶(ribulose 5-phosphate epimerase);RPI-核糖5-磷酸异构酶(phosphoribose isomerase);TK-转酮醇酶(transketolase);TAL-转醛醇酶(transaldolase);TIM-丙糖磷酸异构酶(triose phosphate isomerase);ALD-果糖二磷酸醛缩酶(aldolase);FBP-果糖二磷酸酶(fructose-1,6-bisphosphatase);PGI-磷酸葡萄糖异构酶(phosphoglucose isomerase);G1P-葡萄糖1-磷酸(glucose 1-phosphate); G6P-葡萄糖6-磷酸(glucose 6-phosphate);6PG-葡萄糖6-磷酸内酯(6-phosphogluconate);Ru5P-核酮糖5-磷酸(ribulose 5-phosphate);R5P-核糖5-磷酸(ribose 5-phosphate);Xu5P-木酮糖5-磷酸(xylulose 5-phosphate);G3P-甘油醛3-磷酸(glyceraldehyde 3-phosphate);S7P-景天庚酮糖7-磷酸(sedoheptulose 7-phosphate);E4P-丁糖4-磷酸(erythrose 4-phosphate);DHAP-二羟基丙酮3-磷酸(dihydroxyacetone 3-phosphate);F6P-果糖6-磷酸(fructose 6-phosphate);FDP-果糖1,6-二磷酸(fructose 1,6-
bisphosphate)
图8 蔗糖磷酸化酶参与蔗糖产电
Fig.8 Sucrose phosphorylase participates in generation
bioelectricity by oxidation sucrose
尽管二糖磷酸化酶已经在体外合成生物学应用中取得了重大进展,然而要实现大规模生物制造仍存在一些距离。目前我们仍然不清楚为何该磷酸化过程主要作用于己糖而似乎并不存在于戊糖中,因此二糖磷酸化酶仅鉴定了14种受体底物,这严重限制了二糖磷酸化酶的广泛应用。另外很多二糖磷酸化酶的稳定性达不到工业化操作的条件。因此通过基因挖掘筛选新型二糖磷酸化酶或对现有二糖磷酸化酶进行蛋白质工程改造,扩大二糖磷酸化酶的底物谱和热稳定性,可以提高二糖磷酸化酶在体外合成生物学中的应用范围。酶的成本是也是体外生物合成平台商业化的关键因素,可以通过重组蛋白表达、密码子优化、高密度发酵等方式提高酶的表达水平和降低酶的生产成本,在此基础上,通过酶固定化方式可以实现对二糖磷酸化酶的回收利用,从而进一步降低酶的成本。
尽管二糖磷酸化酶仅仅是浩瀚酶库中的一小部分,但近年来被公认为在体外生物合成系统中是有价值的酶促工具。目前所有的二糖磷酸化酶均分布在GH和GT家族中,共6个家族15种酶,其受体底物共14种,供体特异性比较狭窄,仅局限于D-葡萄糖1-磷酸、D-半乳糖1-磷酸和D-甘露糖1-磷酸,所以二糖磷酸化酶在体外合成生物学中面临底物谱狭窄的问题,加上热稳定性和生产成本等问题,大大限制了二糖磷酸化酶在体外合成生物学中的工业化应用。然而随着现代基因组测序技术和宏基因组技术的高速发展以及酶改造手段的开发,会有越来越多具有新功能的二糖磷酸化酶被发掘。通过具有新功能的二糖磷酸化酶的蛋白质结构和新功能之间关系的研究,对此类酶的认知将会更加深入,这将有助于二糖磷酸化酶在体外生物合成中的应用更加广泛且有效。
[1] CORI G,COLOWICK S,CORI C.The formation of glucose-1-phosphoric acid in extracts of mammalian tissues and of yeast[J].Journal of Biological Chemistry,1938,123(2):375-380.
[2] FISCHER E H.Cellular regulation by protein phosphorylation[J].Biochemical and Biophysical Research Communications,2013,430(2):865-867.
[3] COGAN E B,BIRRELL G B,GRIFFITH O H.A robotics-based automated assay for inorganic and organic phosphates[J].Analytical Biochemistry,1999,271(1):29-35.
[4] GAWRONSKI J,BENSON D.Microtiter assay for glutamine synthetase biosynthetic acti ity using inorganic phosphate detection[J].Analytical Biochemistry,2004,327(1):114-118.
[5] DE GROE E M R M,TRAN G H, AN HOOREBEKE A,et al.De elopment and application of a screening assay for glycoside phosphorylases[J].Analytical Biochemistry,2010,401(1):162-167.
[6] PUCHART .Glycoside phosphorylases:Structure,catalytic properties and biotechnological potential[J].Biotechnology Ad ances,2015,33(2):261-276.
[7] KITAOKA M.Di ersity of phosphorylases in glycoside hydrolase families[J].Applied Microbiology and Biotechnology,2015,99(20):8 377-8 390.
[8] O’NEILL E C,FIELD R A.Enzymatic synthesis using glycoside phosphorylases[J].Carbohydrate Research,2015,403:23-37.
[9] GIULIA P,SAKONWAN K,EESHAN K,et al.Glycan phosphorylases in multi-enzyme synthetic processes[J].Protein & Peptide Letters,2017,24(8):696-709.
[10] LAIRSON L,WITHERS S.Mechanistic analogies amongst carbohydrate modifying enzymes[J].Chemical Communications (Cambridge,England),2004,36(11):2 243-2 248.
[11] KAGAN B O,LATKER S N,Zfasman E M.Phosphorolysis of sucrose by the cultures of Leuconoctoc mesenteroides[J].Biokhimiya,1942,7:93-108.
[12] LULEY C,NIDETZKY B.Carbohydrate synthesis by disaccharide phosphorylases:Reactions,catalytic mechanisms and application in the glycosciences[J].Biotechnology Journal,2010,5(12):1 324-1 338.
[13] KITAMOTO Y,AKASHI H,TANAKA H,et al.α-Glucose-1-phosphate formation by a no el trehalose phosphorylase from Flammulina elutipes[J].Federation of European Microbiological Societies Microbiology Letters,1988,55(2):147-150.
[14] FITTING C,DOUDOROFF M.Phosphorolysis of maltose by enzyme preparation from Neisseria meningitidis[J].The Journal of Biological Chemistry,1952,199(1):153-163.
[15] EHRMANN M A, OGEL R F.Maltose metabolism of Lactobacillus sanfranciscensis:cloning and heterologous expression of the key enzymes,maltose phosphorylase and phosphoglucomutase[J].Federation of European Microbiological Societies Microbiology Letters,1998,169(1):81-86.
[16] MARÉCHAL L R,BELOCOPITOW E.Metabolism of trehalose in euglena gracilis.I.Partial purification and some properties of trehalose phosphorylase[J].Journal of Biological Chemistry,1972,247(10):3 223-3 228.
[17] MARUTA K,MUKAI K,YAMASHITA H,et al.Gene encoding a trehalose phosphorylase from Thermoanaerobacter brockii ATCC 35047[J].Bioscience,Biotechnology,and Biochemistry,2002,66(9):1 976-1 980.
[18] CHAEN H,YAMAMOTO T,NISHIMOTO T,et al.Purification and characterization of a no el phosphorylase,kojibiose phosphorylase,from Thermoanaerobium brockii[J].Journal of Applied Glycoscience,1999,46(4):423-429.
[19] YAMAMOTO T,MARUTA K,MUKAI K,et al.Cloning and sequencing of kojibiose phosphorylase gene from Thermoanaerobacter brockii ATCC35047[J].Journal of Bioscience and Bioengineering,2004,98(2):99-106.
[20] NIHIRA T,NAKAI H,CHIKU K,et al.Disco ery of nigerose phosphorylase from Clostridium phytofermentans[J].Applied Microbiology and Biotechnology,2012,93(4):1 513-1 522.
[21] NIHIRA T,MIYAJIMA F,CHIKU K,et al.One pot enzymatic production of nigerose from common sugar resources employing nigerose phosphorylase[J].Journal of Applied Glycoscience,2014,61(3):75-80.
[22] NIHIRA T,NAKAI H,KITAOKA M.3-O-α-d-Glucopyranosyl-l-rhamnose phosphorylase from Clostridium phytofermentans[J].Carbohydrate Research,2012,350:94-97.
[23] SIH C,McBee R H.A cellobiose phosphorylase in Clostridium thermocellum[J].Proceedings of the Montana Academy of Sciences,1955,15:21-22.
[24] REICHENBECHER M,LOTTSPEICH F,BRONNENMEIER K.Purification and properties of a cellobiose phosphorylase (CepA) and a cellodextrin phosphorylase (CepB) from the cellulolytic Thermophile clostridium stercorarium[J].European Journal of Biochemistry,1997,247(1):262-267.
[25] GOLDEMBERG S H,MARÉCHAL L R,De Souza B C.β-1,3-Oligoglucan:Orthophosphate glucosyltransferase from Euglena gracilis[J].Journal of Biological Chemistry,1966,241(1):45-50.
[26] KITAOKA M,MATSUOKA Y,MORI K,et al.Characterization of a bacterial laminaribiose phosphorylase[J].Bioscience,Biotechnology,and Biochemistry,2012,76(2):343-348.
[27] NIHIRA T,SAITO Y,KITAOKA M,et al.Characterization of a laminaribiose phosphorylase from Acholeplasma laidlawii PG-8A and production of 1,3-β-d-glucosyl disaccharides[J].Carbohydrate Research,2012,361:49-54.
[28] PARK J K,KEYHANI N O,Roseman S.Chitin catabolism in the marine bacterium ibrio furnissii.identification,molecular cloning,and characterization of a N,N’-diacetylchitobiose phosphorylase[J].Journal of Biological Chemistry,2000,275(42):33 077-33 083.
[29] DERENSY-DRON D,KRZEWINSKI F,BRASSART C,et al.β-1,3-galactosyl-N-acetylhexosamine phosphorylase from Bifidobacterium bifidum DSM 20082:Characterization,partial purification and relation to mucin degradation[J].Biotechnology and Applied Biochemistry,1999,29(1):3-10.
[30] KITAOKA M,TIAN J,NISHIMOTO M.No el putati e galactose operon in ol ing lacto-N-biose phosphorylase in Bifidobacterium longum[J].Applied and En ironmental Microbiology,2005,71(6):3 158-3 162.
[31] NAKAJIMA M,NISHIMOTO M,KITAOKA M.Characterization of three beta-galactoside phosphorylases from Clostridium phytofermentans:Disco ery of d-galactosyl-beta1->4-l-rhamnose phosphorylase[J].The Journal of Biological Chemistry,2009,284(29):19 220-19 227.
[32] NAKAJIMA M,NISHIMOTO M,KITAOKA M.Characterization of d-galactosyl-β-1→4-l-rhamnose phosphorylase from Opitutus terrae[J].Enzyme and Microbial Technology,2010,46(3):315-319.
[33] CHIKU K,NIHIRA T,SUZUKI E,et al.Disco ery of two β-1,2-mannoside phosphorylases showing different chain-length specificities from Thermoanaerobacter sp.X-514[J].Public Library of Science One,2014,9(12):e11488.
[34] TSUDA T,NIHIRA T,CHIKU K,et al.Characterization and crystal structure determination of β-1,2-mannobiose phosphorylase from Listeria innocua[J].Federation of European Biochemical Societies Letters,2015,589(24):3 816-3 821.
[35] SENOURA T,ITO S,TAGUCHI H,et al.New microbial mannan catabolic pathway that in ol es a no el mannosylglucose phosphorylase[J].Biochemical and Biophysical Research Communications,2011,408(4):701-706.
[36] NIHIRA T,SUZUKI E,KITAOKA M,et al.Disco ery of β-1,4-D-mannosyl-N-acetyl-D-glucosamine phosphorylase in ol ed in the metabolism of N-glycans[J].The Journal of Biological Chemistry,2013,288(38):27 366-27 374.
[37] MURAO S,NAGANO H,OGURA S,et al.Enzymatic synthesis of trehalose from maltose[J].Agricultural and Biological Chemistry,1985,49(7):2 113-2 118.
[38] AERTS D, ERHAEGHE T,ROMAN B,et al.Transglucosylation potential of six sucrose phosphorylases toward different classes of acceptors[J].Carbohydrate Research,2011,346(13):1 860-1 867.
[39] MORIMOTO K,YOSHIHARA A,FURUMOTO T,et al.Production and application of a rare disaccharide using sucrose phosphorylase from Leuconostoc mesenteroides[J].Journal of Bioscience and Bioengineering,2014,119(6):652-656.
[40] ICHIKAWA M,SCHNAAR R L,ICHIKAWA Y.Application of sucrose phosphorylase reaction in one-pot enzymatic galactosylation:Sca enger of phosphate and generation of glucose 1-phosphate in situ[J].Tetrahedron Letters,1995,36(48):8 731-8 732.
[41] WILDBERGER P,PFEIFFER M,BRECKER L,et al.Diastereoselecti e synthesis of glycosyl phosphates by using a phosphorylase-phosphatase combination catalyst[J].Angewandte Chemie International Edition in English,2015,54(52):15 867-15 871.
[42] You C,Chen H,Myung S,et al.Enzymatic transformation of nonfood biomass to starch[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(18):7 182-7 187.
[43] MENG D,WEI X,ZHANG Y-H P J,et al.Stoichiometric con ersion of cellulosic biomass by in itro synthetic enzymatic biosystems for biomanufacturing[J].American Chemical Society Catalysis,2018,8(10):9 550-9 559.
[44] ZHONG C,YOU C,WEI P,et al.Thermal cycling cascade biocatalysis of myo-inositol synthesis from sucrose[J].American Chemical Society Catalysis,2017,7(9):5 992-5 999.
[45] SUN S,WEI X,YOU C.The construction of an in itro synthetic enzymatic biosystem that facilitates laminaribiose biosynthesis from maltodextrin and glucose[J].Biotechnology Journal,2019,14(4):1 800 493.
[46] YE X,WANG Y,HOPKINS R C,et al.Spontaneous high-yield production of hydrogen from cellulosic materials and water catalyzed by enzyme cocktails[J].Chem Sus Chem,2009,2(2):149-152.
[47] MYUNG S,ROLLIN J,YOU C,et al.In itro metabolic engineering of hydrogen production at theoretical yield from sucrose[J].Metabolic Engineering,2014,24:70-77.
[48] 庞海丽. 直接醇类燃料电池和酶生物燃料电池电极研究[D].长沙:湖南大学,2011.
[49] ZHU Z,MA C,ZHANG Y H P.Co-utilization of mixed sugars in an enzymatic fuel cell based on an in itro enzymatic pathway[J].Electrochimica Acta,2017,263:184-191.