图1 多序列比对及二级结构预测
Fig.1 Multi-sequence alignment and secondary structure prediction
昆布多糖是一类存在于海洋藻类中的聚糖,基本结构包括以β-1,3-糖苷键连接的葡萄糖作为主链,在结构内部还含有β-1,6-糖苷键。作为一类与纤维素等多糖结构类似的自然资源,昆布多糖在生物燃料行业中也可作为发酵底物而发挥重要的作用[1-2]。据报道,褐藻中的昆布多糖可被细菌昆布多糖酶水解从而进行乙醇生产[3]。昆布多糖酶(EC 3.2.1.6),又称β-1,3-葡聚糖酶,是能够催化β-D-葡聚糖中1,3-糖苷键和1,4-糖苷键断裂的一类糖苷水解酶(glycoside hydrolases,GH)。在细菌中,昆布多糖酶包括外切β-1,3-葡聚糖酶(EC 3.2.1.58)和内切β-1,3-葡聚糖酶(EC 3.2.1.39),都可将昆布多糖及其结构类似的多糖水解为单糖或寡糖[4]。据CAZy数据库统计,昆布多糖酶分布于GH3、GH5、GH16、GH17、GH55、GH64、GH81、GH128、GH152、GH157和GH158家族;GH16家族的内切β-1,3-葡聚糖酶所占比例最大[5]。
有研究人员以大肠杆菌(Escherichia coli)为宿主对昆布多糖酶进行表达,如FLamA和FLamB[6]、Mzl86[7]和GFA[8]等。这些酶在E. coli中表达水平较低,最适温度基本处于45~55 ℃,且热稳定性和pH耐受能力一般,难以满足工业化应用需求。因此,开发不同来源的昆布多糖酶并选择更适合的表达系统具有重要的意义。研究表明,嗜盐微生物及其相关基因在工业应用中具有巨大的潜力[9-11]。嗜盐红色盐杆菌Rhodohalobacter barkolensis sp. 15182T是从盐湖中分离的一种新型嗜盐非运动型细菌,其最适生长盐质量浓度为20~30 mg/mL[12]。UniProt[13]数据库显示,该菌基因组中含有丰富的GH基因,包括GH16家族的昆布多糖酶基因。因此,开发R. barkolensis来源的昆布多糖酶用于高盐环境中昆布多糖等多糖的降解具有潜在的应用价值。毕赤酵母(Pichia pastoris)作为真核生物表达系统,不仅能对重组蛋白进行必要的修饰加工、分泌表达调控和高密度发酵,而且自身蛋白分泌较少,更有利于后续的分离纯化等操作[14]。本文采用毕赤酵母GS115为表达宿主对来源于R. barkolensis的昆布多糖酶RbLam16进行基因克隆和表达,然后对RbLam16进行表征和生产条件优化,以期为昆布多糖酶在生物质资源化中的应用提供理论基础。
1.1.1 菌株和质粒
E.coli DH5α及质粒pPIC9K由旭冠生物科技有限公司提供,毕赤酵母GS115由实验室保存。
1.1.2 试剂
Phanta® Max Super-Fidelity DNA Polymerase, azyme(南京)公司;Sac I,NEB(北京)有限公司;质粒DNA小量抽提试剂盒、PCR清洁试剂盒及DNA凝胶回收试剂盒,Axygen(杭州)有限公司;氨苄青霉素、遗传霉素G418、蛋白Marker、核酸染料,上海生工;BCA蛋白含量检测试剂盒,凯基生物;昆布多糖,百灵威;其他试剂均为国产分析纯。
1.1.3 培养基
LB(Luria-Bertani)培养基(g/L):酵母提取物 5,蛋白胨 10,NaCl 10,pH 7.0,固体培养基添加20g/L琼脂粉。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基(g/L):酵母提取物 10,蛋白胨 20,葡萄糖 20,固体培养基添加20g/L琼脂粉。
MD(minimal dextrase)培养基(g/L):酵母无氨基氮源(yeast nitrogen base,YNB)13.4,葡萄糖 20,固体培养基添加20g/L琼脂粉。待培养基温度降至60℃以下,补加终浓度为400 μg/L的生物素溶液。
基本培养基(minimal medium,MM)(g/L):YNB 13.4,固体培养基添加20g/L琼脂粉。使用前补加终浓度为400 μg/L的生物素溶液,以0.5%(体积分数)的比例补加甲醇。
缓冲型最小甘油复合(buffered minimal glycerol-complex,BMGY)培养基(g/L):酵母提取物 10,蛋白胨 20,YNB 13.4,KH2PO4-K2HPO4缓冲液(pH 6.0)10%(体积分数),丙三醇1%(体积分数)。使用前补加终浓度为400 μg/L的生物素溶液。
缓冲型甲醇复合(buffered methanol-complex,BMMY)培养基(g/L):酵母提取物 10,蛋白胨 20,YNB 13.4,KH2PO4-K2HPO4缓冲液(pH 6.0)10%(体积分数)。使用前补加终浓度为400 μg/L的生物素溶液。
1.1.4 主要仪器
TAd anced 96/96G PCR仪,德国Analytikjena;Bio-Rad琼脂糖凝胶电泳仪、GelDoc凝胶成像系统、Bio-Rad电穿孔仪、Bio-ScaleTM 镍柱及蛋白纯化仪,美国Bio-Rad公司;NanoDrop One/OneC微量核酸蛋白浓度测定仪,美国Thermo公司;ThermoMIXER C恒温混匀仪,德国Eppendorf公司。
1.2.1 序列分析
昆布多糖酶RbLam16的氨基酸序列(GenBank ID:PKD44866.1)从NCBI数据库中获得;使用SignalP 4.1[15](http://www.cbs.dtu.dk/ser ices/SignalP-4.1/)预测信号肽;蛋白分子量和等电点(pI)使用ProtParam[16](https://web.expasy.org/protparam/)工具;蛋白亲疏水性使用ProtScale[16](https://web.expasy.org/protscale/)进行分析;氨基酸多序列比对以及蛋白二级结构预测分别使用Clustal Omega[17](https://www.ebi.ac.uk/Tools/msa/clustalo/)和ESPript 3.0[18](http://espript.ibcp.fr/ESPript/ESPript)。
1.2.2 基因克隆及重组表达
根据毕赤酵母密码子偏好性对RbLam16基因序列进行优化,目的基因大小为798 bp,G+C含量为48%。优化后的RbLam16基因于3′端加入6个His-Tag序列,并在5′和3′端分别加入EcoR Ⅰ和Not Ⅰ酶切位点,由上海旭冠生物公司合成、构建表达质粒pPIC9K/rblam16,并转入E. coli DH5α中。
将含有pPIC9K/rblam16的E. coli DH5α经含有氨苄的LB培养基培养后,使用试剂盒提取质粒并纯化。纯化产物经Sac I进行线性化,电泳验证并胶回收线性化产物。
将线性pPIC9K/rblam16电转化毕赤酵母GS115感受态细胞中,在MD平板培养基培养3~5 d(30 ℃)。挑取单菌落转接至含不同G418质量浓度(0.25、0.5和1.0 mg/mL)的YPD平板培养基,30 ℃培养3~5 d,挑取G418最高质量浓度平板上的单菌落进行PCR验证,引物为α-Factor(5′-TACTATTGCCAGCATTGCTGC-3′)和3′AOX(5′-GCAAATGGCATTCTGACATCC-3′)。
挑取阳性转化子接种至25 mL BMGY培养基中,30 ℃、150 r/min培养至菌体OD600为2~6;离心(4 ℃、5 000 r/min,5 min)收集菌体,转接至35 mL BMMY培养基中,继续培养96 h,每24 h添加1%(体积分数)纯甲醇诱导RbLam16表达。同时,每24 h取样离心(4 ℃、8 000 r/min,10 min)进行SDS-PAGE分析。发酵结束后,对发酵液进行离心、Bio-ScaleTM镍柱纯化以及SDS-PAGE分析。蛋白浓度使用BCA试剂盒进行测定。
1.2.3 酶活力测定
采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[19]测定RbLam16的酶活力。将150 μL 10 mg/mL昆布多糖溶液溶于50 mmol/L Tris-HCl缓冲液,pH 7.0)在55 ℃预热10 min,加入纯化后的酶液50 μL。55 ℃、500 r/min反应2.5 min;立即加入200 μL DNS溶液,混匀后于沸水中加热10 min,冷却后在560 nm测定吸光值;根据葡萄糖标准曲线计算还原糖的量。酶活力单位定义:在55 ℃、pH 7.0条件下,每分钟生成1 μmol葡萄糖所需的酶量定义为1个酶活力单位(U)。
1.2.4 酶学性质研究
1.2.4.1 RbLam16最适反应温度及pH
为测定RbLam16的最适反应温度,设定35、45、55、65、75、85和95 ℃ 7组反应温度。按照1.2.3小节中酶活力测定方法分别测定上述条件下的酶活力。为测定RbLam16的最适反应pH,分别用100 mmol/L柠檬酸-柠檬酸钠缓冲液(pH 3.0~6.5)、50 mmol/L Tris-HCl缓冲液(pH 6.5~8.5)和50 mmol/L甘氨酸-氢氧化钠缓冲液(pH 8.5~10.5)配制不同pH的昆布多糖溶液。按照1.2.3小节中酶活力测定方法在最适温度下测定各组酶活力。
1.2.4.2 RbLam16热稳定性及pH稳定性
将酶液分别在45、55、65 ℃保温30 min,每5 min取样在最适反应条件下测定残余酶活力,将未保温的酶液活力设为100%,考察RbLam16的热稳定性。将酶液分别在4 ℃不同pH缓冲液(pH 6.0、6.5、7.0、7.5)存放24 h,每12 h在最适反应条件下测定残余酶活力,以未做处理的酶液活力为100%,考察RbLam16的pH稳定性。
1.2.4.3 金属离子和化学试剂对酶活力的影响
为考察金属离子和化学试剂对酶活力的影响,向反应体系中加入终浓度为5 mmol/L的MnCl2、KCl、CoCl2、NiCl2、NaCl、CaCl2、MgSO4、ZnSO4·7H2O、FeSO4·7H2O、CuSO4·5H2O、(NH4)2SO4、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)和乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),在最适反应条件下测定各组酶活力;以不加金属离子或化学试剂的反应酶活力作为100%。
1.2.5 发酵条件优化
为研究培养基初始pH、培养温度、甲醇添加比例和发酵时间对GS115/pPIC9K/rblam16生长以及产酶的影响,分别将BMGY培养基培养的菌体离心后转接至不同pH(4、5、6和7)的BMMY培养基中,在不同的发酵温度(26、28、30和32 ℃)、150 r/min发酵,每24 h以不同的体积比例(0.5%、1.0%、1.5%及2.0%)添加甲醇。发酵结束后,将发酵液离心(4 ℃、8 000 r/min,10 min),上清液经0.22 μm微孔滤膜过滤后作为粗酶液进行酶活力测定;菌体干燥后测定生物量。
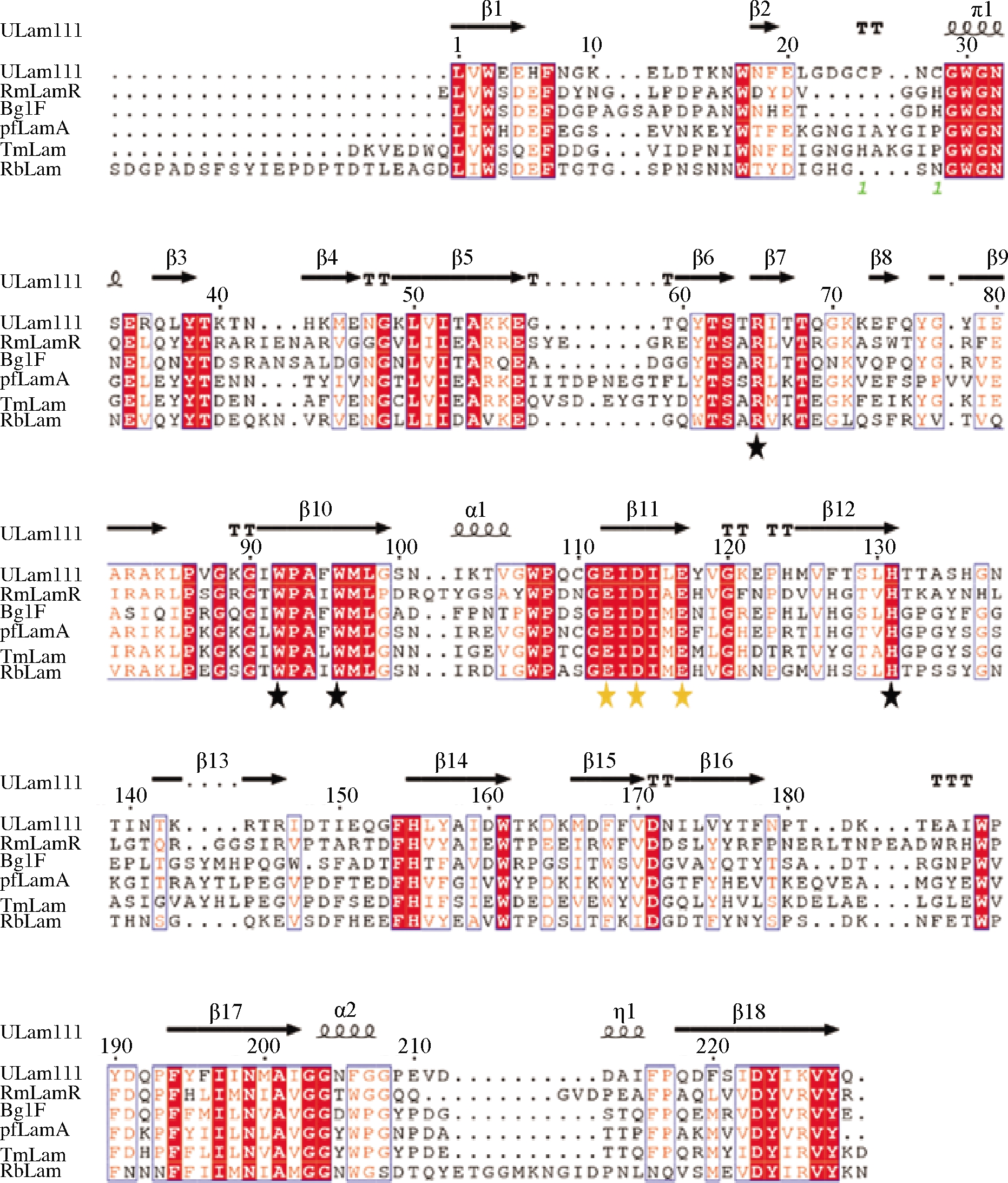
来源于R. barkolensis的昆布多糖酶RbLam16一级序列包含285个氨基酸残基,在N端1-21位存在信号肽(MFNFHPIILSLLMALSLTSCA)。成熟RbLam16的分子质量为29.62 kDa,pI为4.43。蛋白平均亲水性系数为-0.657 1,预测为亲水蛋白。RbLam16的序列与同家族的ULam111[4]序列相似性为42%,与RmLamR[20]、BglF[21]、pfLamA[22]和TmLam[23]相似性分别为41%、39%、42%和39%。以ULam111(PDB ID:5 WUT_A)为模板对RbLam16进行二级结构预测,如图1所示。

图1 多序列比对及二级结构预测
Fig.1 Multi-sequence alignment and secondary structure prediction
RbLam16二级结构包括2个α螺旋和18个β片层,具有GH16家族典型的“β-jelly roll”结构;存在Arg89、Trp116、Trp120和His154等4个保守氨基酸残基(黑色星号标记)以及Glu136、Asp138和Glu141等3个催化残基(橙色星号标记)。
将质粒pPIC9K/rblam16线性化处理后,电转至GS115感受态细胞中,单菌落通过PCR进行验证,结果如图2所示。重组菌通过甲醇诱导分泌表达目的蛋白,粗酶液经纯化后进行SDS-PAGE分析,结果如图3所示。
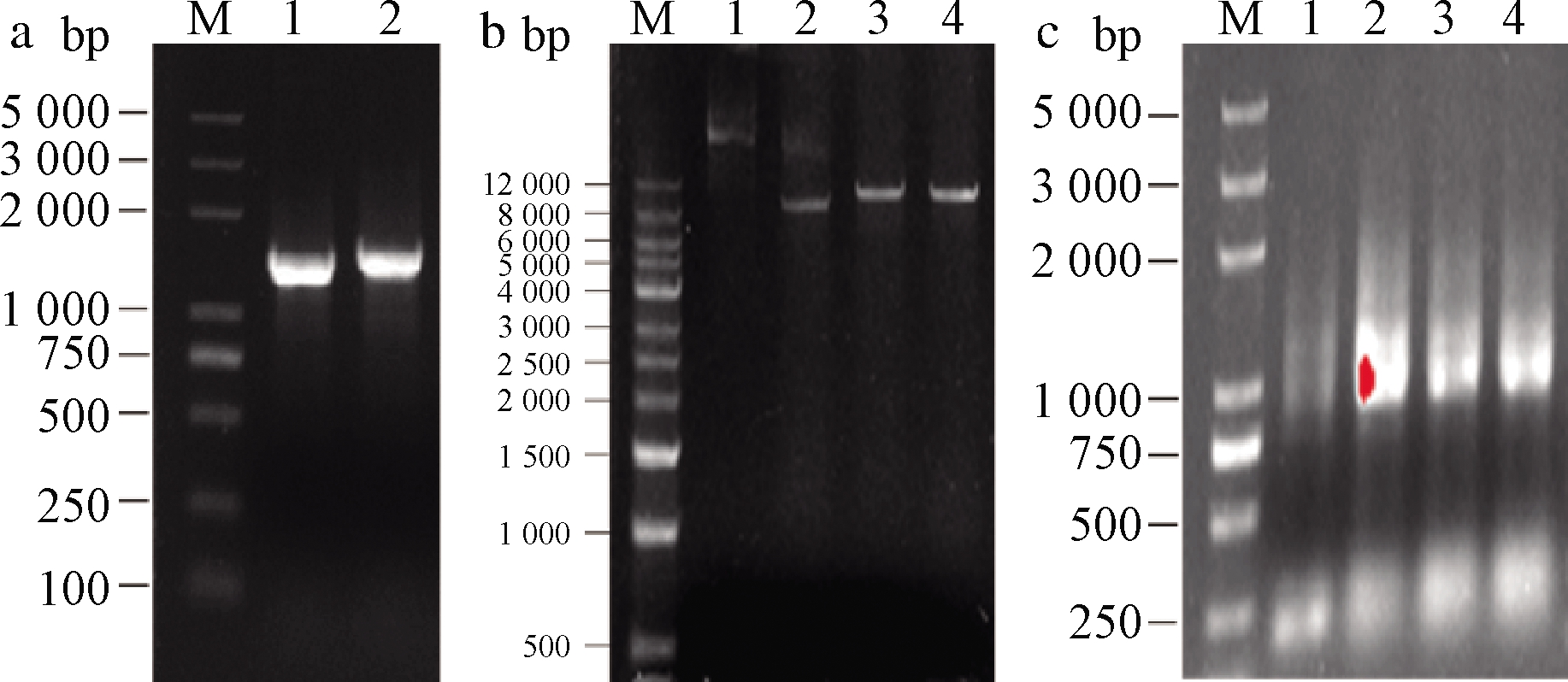
a-重组质粒pPIC9K/rblam16:M-DL5000 DNA marker,1、2-PCR产
物(1.2 kbp);b-重组质粒Sac I单酶切线性化:M-1 kb DNA Ladder
marker,1-环状质粒对照,2、3、4-线性化产物(10 kbp);c-GS115/
pPIC9K/rblam16阳性转化子筛选:M-DL5000 DNA marker,
1、2、3-菌落PCR产物(1.0 kbp)
图2 核酸琼脂糖凝胶电泳
Fig.2 Nucleic acid agarose gel electrophoresis

a-发酵上清液SDS-PAGE:M-蛋白Marker,1、2、3、4分别为
24、48、72、96 h发酵上清液;b-纯酶液SDS-PAGE:
M-蛋白Marker,1-纯化产物(30 kDa)
图3 RbLam16的SDS-PAGE分析
Fig.3 SDS-PAGE analysis of the RbLam16
2.3.1 RbLam16最适反应温度及pH
如图4-a所示,RbLam16的最适反应温度为55 ℃,此时酶活力为155.32 U/mg。当温度高于55 ℃时,酶活力开始下降,而在95 ℃时仍有69.19 U/mg的酶活力,表明该酶对高温有一定的耐受力。与已报道的昆布多糖酶GFA[8](来源于Formosa algae,最适温度45 ℃)、LA-Lam[24](来源于Pseudoalteromonas,最适温度45 ℃)、LamC27[25](来源于Corallococcus sp.,最适温度45 ℃)和Mz186[7](来源于Mesofla ibacter zeaxanthinifaciens,最适温度50 ℃)相比,RbLam16的最适反应温度更高。如图4-b所示,RbLam16最适反应pH为7.0,且在pH 4.5~10.5范围内酶活力均大于100 U/mg,说明该酶的活性范围较广,在偏碱性的环境下仍能发挥催化作用。RbLam16与同家族的LamC27[25]最适反应pH相当,说明2种酶更偏向在中性环境下发挥作用。
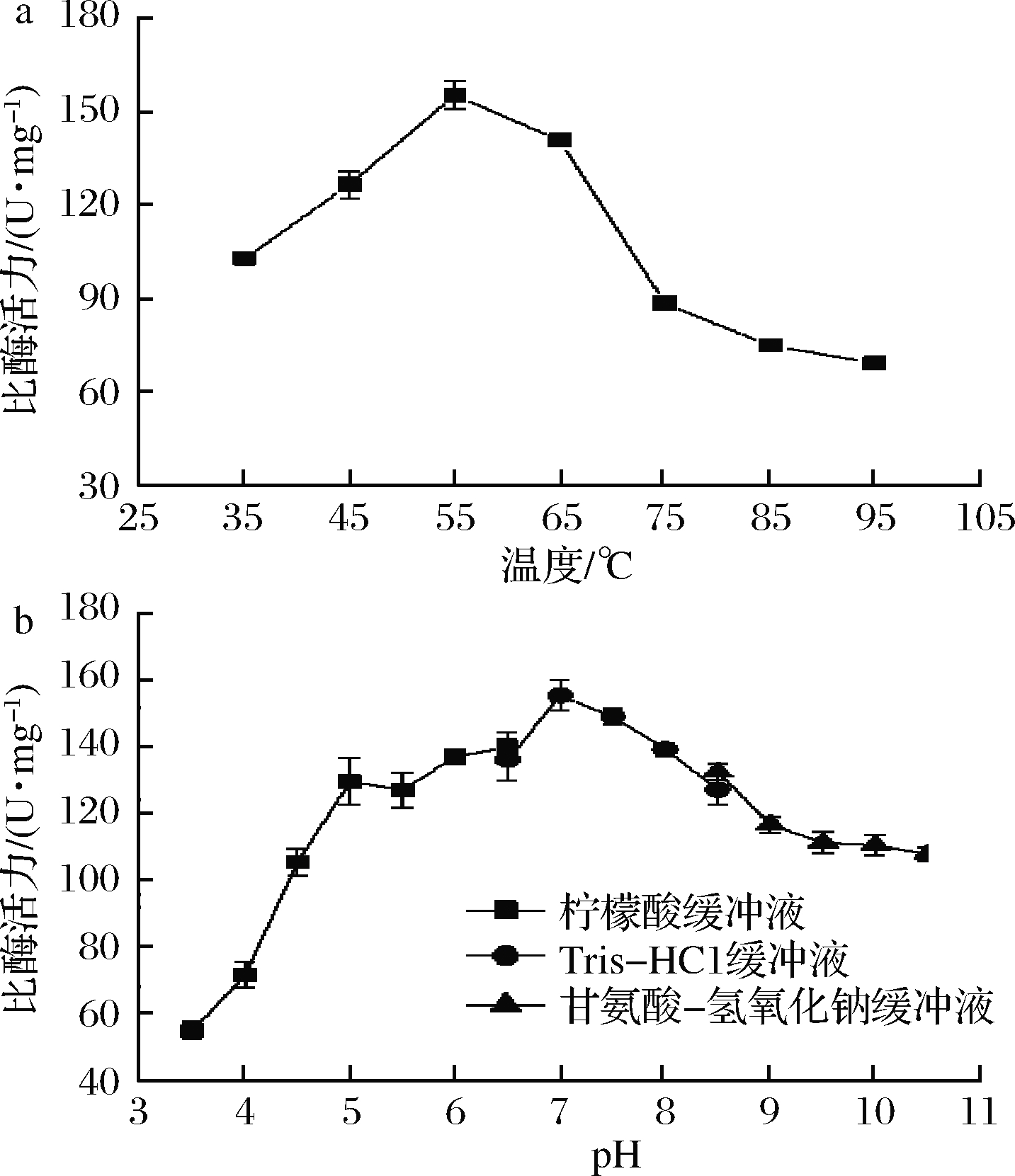
a-温度对酶活力的影响; b-pH对酶活力的影响
图4 温度及pH对RbLam16活力的影响
Fig.4 The effect of temperature and pH on the
acti ity of the RbLam16
2.3.2 RbLam16热稳定性及pH稳定性
如图5-a所示,在45 ℃下RbLam16的热稳定性最好,30 min后仍保留初始酶活力的88%左右;其次,在最适温度55 ℃时也有较好的热稳定性,30 min后剩余酶活60%以上;而在65 ℃时的热稳定较差,30 min后酶活力只有40%左右。与GFA[8](其在45 ℃下保存20 min酶活力仅剩余50%,在55 ℃保存10 min后已无活性)相比,RbLam16的热稳定更高。
如图5-b所示,RbLam16在pH 7.5时稳定性最好,24 h保存后仍残余93%的酶活力;而在pH 6.0时稳定性较差,24 h仅剩余67%左右的酶活力;在pH 6.5和pH 7.5时保存24 h,残余酶活力均为初始酶活力的72%左右。有研究发现,GH50家族的PaBglu50A[26]在pH 4.0~8.0范围时保存30 min后稳定性较好,后期可以进一步研究RbLam16在酸性环境下的稳定性。
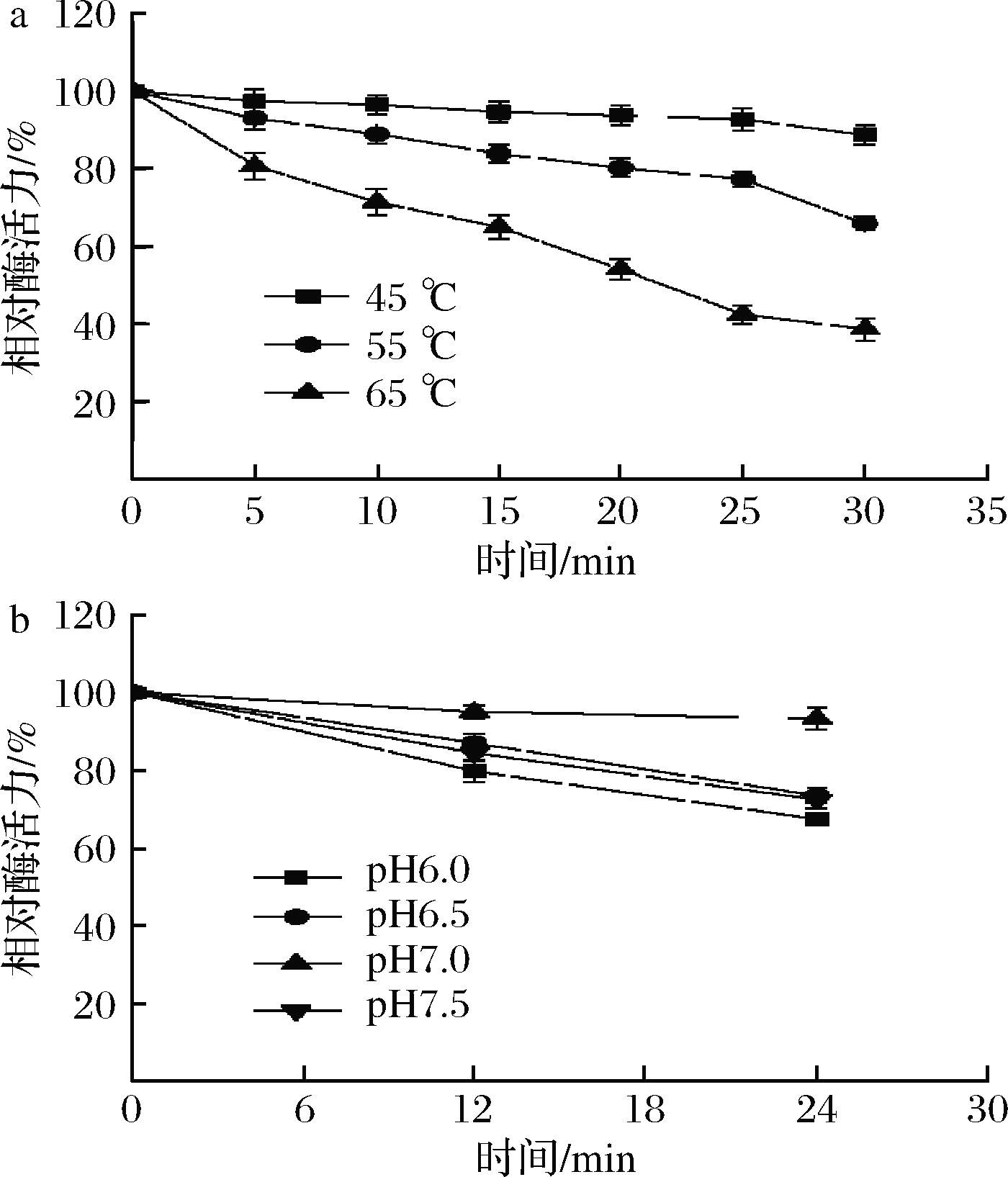
a-RbLam16的热稳定性; b-RbLam16的pH稳定性
图5 温度及pH对RbLam16稳定性的影响
Fig.5 The effects of temperature and pH on the stability of RbLam16
2.3.3 金属离子和化学试剂对酶活力的影响
由表1可知,Mn2+和Co2+对RbLam16酶活均有促进作用,酶活分别提高到122.96%和112.63%;Na+和Fe2+对RbLam16有轻微的抑制作用;而Cu2+、EDTA和SDS对RbLam16有较强的抑制作用,相对酶活分别为59.98%、51.75%和38.88%;其他试剂对RbLam16也有一定的抑制作用,酶活力均为对照的85%左右。
表1 金属离子和化学试剂对RbLam16酶活力的影响
Table 1 Effects of metal ions and chemicals on the acti ity of RbLam16
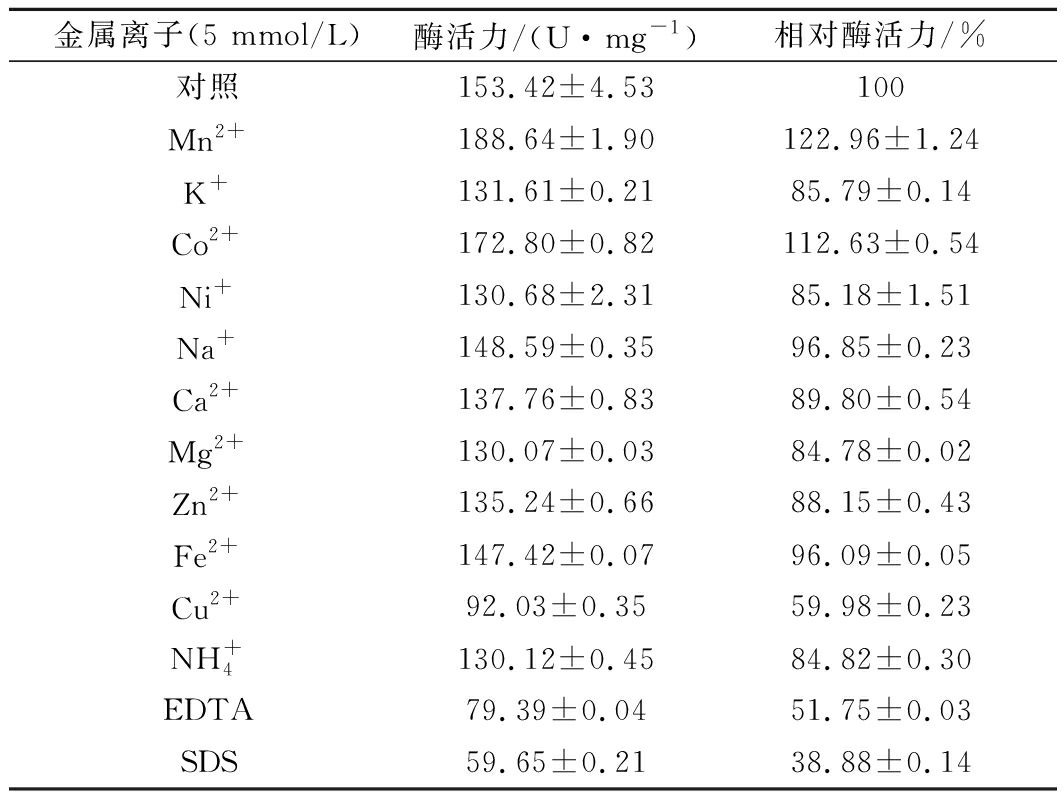
金属离子(5 mmol/L)酶活力/(U·mg-1)相对酶活力/%对照153.42±4.53100Mn2+188.64±1.90122.96±1.24K+131.61±0.2185.79±0.14Co2+172.80±0.82112.63±0.54Ni+130.68±2.3185.18±1.51Na+148.59±0.3596.85±0.23Ca2+137.76±0.8389.80±0.54Mg2+130.07±0.0384.78±0.02Zn2+135.24±0.6688.15±0.43Fe2+147.42±0.0796.09±0.05Cu2+92.03±0.3559.98±0.23NH+4130.12±0.4584.82±0.30EDTA79.39±0.0451.75±0.03SDS59.65±0.2138.88±0.14
据报道,Mn2+对昆布多糖酶Mz186[7]和LamC27[25]也具有促进作用,可能它们的蛋白结构存在某种相似性,从而产生相似的作用效果。
2.4.1 培养基初始pH对菌体生长和产酶的影响
研究表明,不同pH环境对酵母细胞生长及蛋白分泌表达产生重要影响,过酸或过碱均会抑制菌体生长甚至导致菌体死亡[27]。如图6-a所示,GS115/pPIC9K/rblam16的生物量在pH 6.0时达到高。在pH 4.0~6.0时,酶活力由12.51 U/mL提高至16.88 U/mL;而在pH 7.0时,酶活力开始降低。综合考虑,确定发酵培养基的最适初始pH为6.0。
2.4.2 培养温度对菌体生长和产酶的影响
在不同的培养温度下,细胞的生长和代谢均会发生变化,直接或间接影响蛋白的分泌表达[27]。如图6-b所示,在不同温度下,生物量和酶活力呈现相似的变化趋势,当生物量达到最大时,酶活力也最高;反之亦然。在28 ℃时,两者达到最高水平,分别为31.95 g/L和19.52 U/mL。因此,发酵的最适温度为28 ℃。
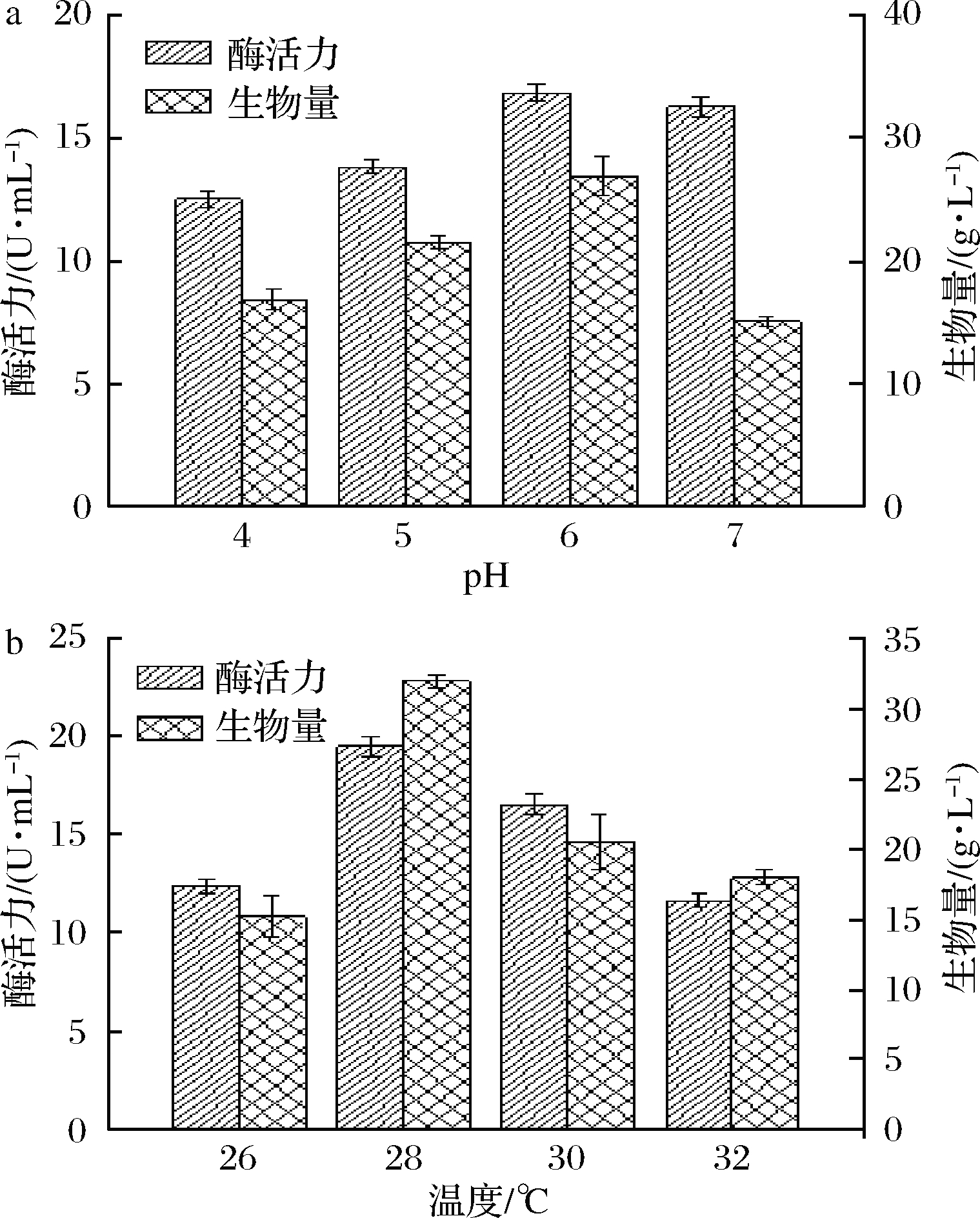
a-pH对菌株生长及产酶的影响;b-温度对菌株生长及产酶的影响
图6 发酵液初始pH和发酵温度对重组GS115/pPIC9K/rblam16生长及产酶的影响
Fig.6 The effects of initial pH and fermentation temperature on the growth and enzyme production of recombinant GS115/pPIC9K/rblam16
2.4.3 甲醇添加比例对菌体生长和产酶的影响
毕赤酵母是甲醇营养型酵母,可利用甲醇可作为诱导剂促进重组酶的分泌表达[14]。由图7-a可知,在0.5%~1.5%范围内,提高甲醇添加比例,生物量和酶活力也相应的增加,在甲醇添加比例为1.5%时,两者达到最高,分别为27.5 g/L和21.84 U/mL;而过高的添加量(2%)对重组菌产生毒性作用。因此,最适甲醇添加比例为1.5%。
2.4.4 发酵时长对菌体生长和产酶的影响
由图7-b可知,随着发酵的进行(24~120 h),生物量和酶活力逐渐增加,在120 h时均达到最高值,分别为27.73 g/L和27.42 U/mL。而当发酵延长至144 h时,生物量和酶活力均有所下降。因此,最适发酵时间为120 h。
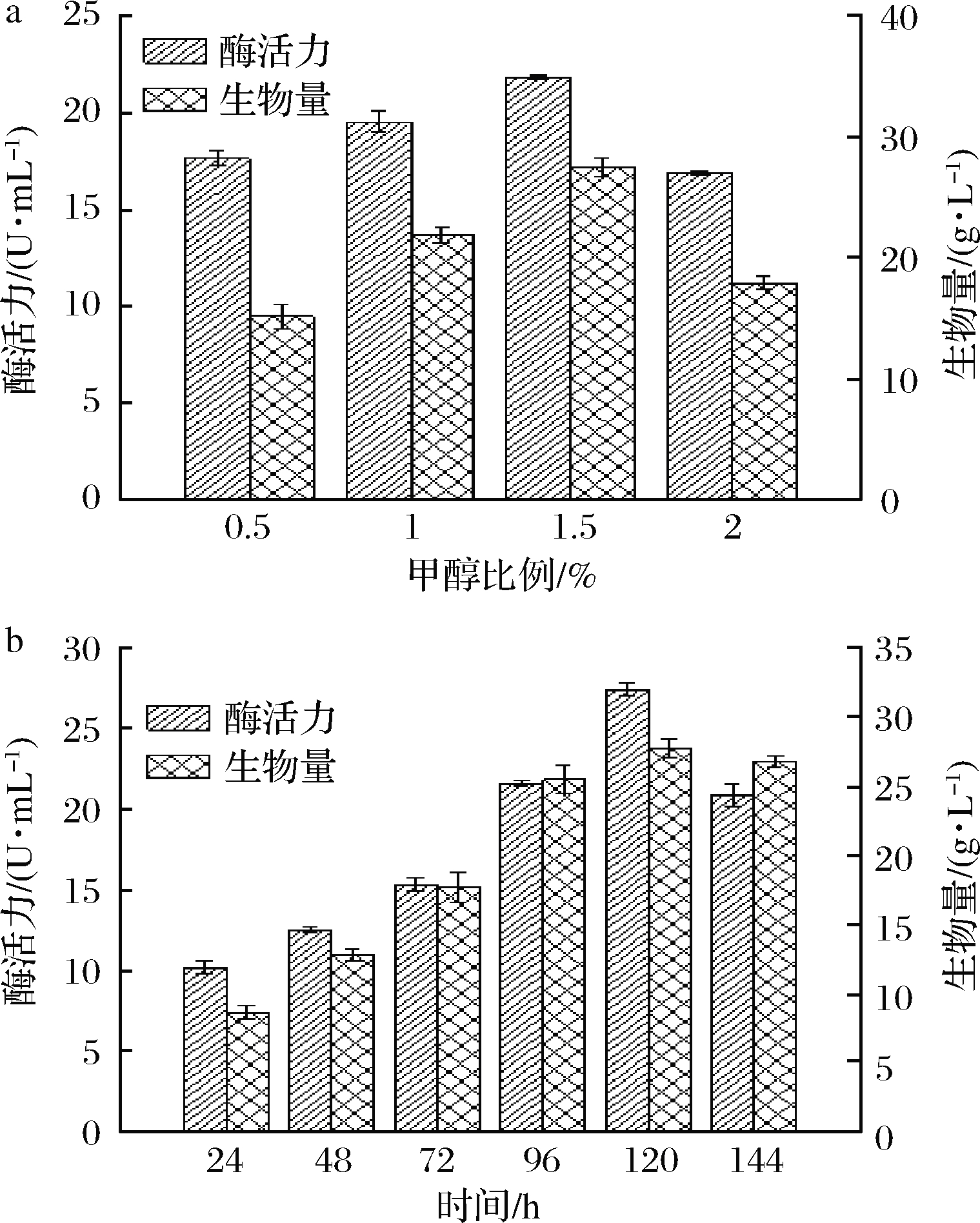
a-甲醇添加量对菌株生长及产酶的影响;
b-发酵时间对菌株生长及产酶的影响
图7 甲醇添加比例和发酵时间对重组GS115/pPIC9K/
rblam16生长及产酶的影响
Fig.7 The effects of methanol addition ratio and fermentation
time on the growth and enzyme production of recombinant
GS115/pPIC9K/rblam16
本研究将来源于R. barkolensis的昆布多糖酶RbLam16的基因通过整合到毕赤酵母GS115基因组中实现分泌表达。RbLam16属于GH16家族,该酶最适反应温度和pH分别为55 ℃和7.0。相较于已报道的其他同类酶,RbLam16在45~65 ℃和pH 6.0~7.5范围内热稳定性和酸碱耐受能力更为出色。因此,该酶在能源开发、食品等领域具有更大的应用价值。
通过发酵条件优化,确定了GS115/pPIC9K/rblam16的最适培养基pH为6.0、温度为28 ℃、甲醇添加比例为1.5%(体积分数)以及发酵时间为120 h;在该条件下,酶活力达到27.42 U/mL,比初始值提高26.42%。
为进一步提高昆布多糖酶RbLam16的活性及稳定性并深入了解其催化机理,后期可对RbLam16蛋白结构进行预测;在此基础上通过半理性设计对其进行分子改造。此外,后期可在发酵罐水平通过高密度发酵方式进一步提高重组菌的产酶能力。在应用方面,可以选择合适的固定化载体对RbLam16进行固定化,进一步开发昆布多糖酶的应用潜力。
[1] TAKEDA H,YONEYAMA F,KAWAI S,et al.Bioethanol production from marine biomass alginate by metabolically engineered bacteria[J].Energy & En ironmental Science,2011,4(7):2 575-2 581.
[2] MOTONE K,TAKAGI T,SASAKI Y,et al.Direct ethanol fermentation of the algal storage polysaccharide laminarin with an optimized combination of engineered yeasts[J].Journal of Biotechnology,2016,231:129-135.
[3] PEREZ C M T,PAJARES I G,ALCANTARA A,et al.Bacterial laminarinase for application in ethanol production from brown algae Sargassum sp.using halotolerant yeast[J].Biofuel Research Journal,2018,5(1):792-797.
[4] QIN H M,MIYAKAWA T,INOUE A,et al.Laminarinase from Fla obacterium sp.re eals the structural basis of thermostability and substrate specificity[J].Scientific Reports,2017,7(1):11 425.
[5] LOMBARD ,GOLACONDA RAMULU H,DRULA E,et al.The carbohydrate-acti e enzymes database (CAZy) in 2013[J].Nucleic Acids Research,2014,42(D1):D490-D495.
[6] BURKHARDT C,SCH FERS C,CLAREN J,et al.Comparati e analysis and biochemical characterization of two endo-β-1,3-glucanases from the thermophilic bacterium Fer idobacterium sp.[J].Catalysts,2019,9(10):830-845.
FERS C,CLAREN J,et al.Comparati e analysis and biochemical characterization of two endo-β-1,3-glucanases from the thermophilic bacterium Fer idobacterium sp.[J].Catalysts,2019,9(10):830-845.
[7] LEE Y,LEE J H,SHIM W B,et al.Molecular cloning,o er-expression and enzymatic characterization of an endo-acting β-1,3-glucanase from marine bacterium Mesofla ibacter zeaxanthinifaciens S86 in Escherichia coli[J].Ocean Science Journal,2014,49(4):425-432.
[8] KUSAYKIN M I,BELIK A A,KO ALCHUK S N,et al.A new recombinant endo-1,3-β-D-glucanase from the marine bacterium Formosa algae KMM 3553:Enzyme characteristics and transglycosylation products analysis[J].World Journal of Microbiology and Biotechnology,2017,33(2):40.
[9] 王伟伟,唐鸿志,许平.嗜盐菌耐盐机制相关基因的研究进展[J].微生物学通报,2015,42(3):550-558.
[10] ALMEIDA E,DIAS T ,FERRAZ G,et al.Culturable bacteria from two Portuguese salterns:Di ersity and bioacti e potential[J].Antonie an Leeuwenhoek,2020,113(4):459-475.
[11] THOMAS F,HEHEMANN J H,REBUFFET E,et al.En ironmental and gut Bacteroidetes:The food connection[J].Frontiers in Microbiology,2011,2:93.
[12] HAN S B,YU Y H,JU Z,et al.Rhodohalobacter barkolensis sp.no .,isolated from a saline lake and emended description of the genus Rhodohalobacter[J].International Journal of Systematic and E olutionary Microbiology,2018,68(6):1 949-1 954.
[13] CONSORTIUM T U.Uniprot:A worldwide hub of protein knowledge[J].Nucleic Acids Research,2018,47(D1):D506-D515.
[14] 朱泰承,李寅.毕赤酵母表达系统发展概况及趋势[J].生物工程学报,2015,31(6):929-938.
[15] PETERSEN T N,BRUNAK S, ON HEIJNE G,et al.SignaIP 4.0:Discriminating signal peptides from transmembrane regions[J].Nature Methods,2011,8(10):785-786.
[16] WILKINS M R,GASTEIGER E,BAIROCH A,et al.Protein identification and analysis tools in the ExPASy ser er[J].Methods in Molecular Biology,1999,112(112):531-552.
[17] MADEIRA F,PARK Y M,LEE J,et al.The EMBL-EBI search and sequence analysis tools APIs in 2019[J].Nucleic Acids Research,2019,47(W1):W636-W641.
[18] ROBERT X,GOUET P.Deciphering key features in protein structures with the new ENDscript ser er[J].Nucleic Acids Research,2014,42(W1):W320-W324.
[19] MILLER L G.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Chemistry,1959,31(3):426-428.
[20] BLEICHER L,PRATES E T,GOMES T C,et al.Molecular basis of the thermostability and thermophilicity of laminarinases:X-ray structure of the hyperthermostable laminarinase from Rhodothermus marinus and molecular dynamics simulations[J].The Journal of Physical Chemistry B,2011,115(24):7 940-7 949.
[21] FIBRIANSAH G,MASUDA S,KOIZUMI N,et al.The 1.3 Å crystal structure of a no el endo-β-1,3-glucanase of glycoside hydrolase family 16 from alkaliphilic Nocardiopsis sp.strain F96[J].Proteins,2007,69(3):683-690.
[22] ILARI A,FIORILLO A,ANGELACCIO S,et al.Crystal structure of a family 16 endoglucanase from the hyperthermophile Pyrococcus furiosus-structural basis of substrate recognition[J].FEBS Journal,2009,276(4):1 048-1 058.
[23] JENG W Y,WANG N C,LIN C T,et al.Crystal structures of the laminarinase catalytic domain from Thermotoga maritima MSB8 in complex with inhibitors:Essential residues forβ-1,3- and β-1,4-glucan selection[J].Journal of Biological Chemistry,2011,286(52):45 030-45 040.
[24] MITSUYA D,SUGIYAMA T,ZHANG S,et al.Enzymatic properties and the gene structure of a cold-adapted laminarinase from Pseudoalteromonas species LA[J].Journal of Bioscience and Bioengineering,2018,126(2):169-175.
[25] ZHOU J,CHEN J,LI Z,et al.Enzymatic properties of a multi-specific β-(1,3)-glucanase from Corallococcus sp.EGB and its potential antifungal applications[J].Protein Expression and Purification,2019,164:105 481.
[26] YI P,YAN Q,JIANG Z,et al.A first glycoside hydrolase family 50 endo-β-1,3-D-glucanase from Pseudomonas aeruginosa[J].Enzyme and Microbial Technology,2018,108:34-41.
[27] 丁健,罗洪镇,史仲平.典型工业发酵过程环境变化下的细胞自适应行为与系统优化[J].生物工程学报,2019,35(10):1 986-2 002.