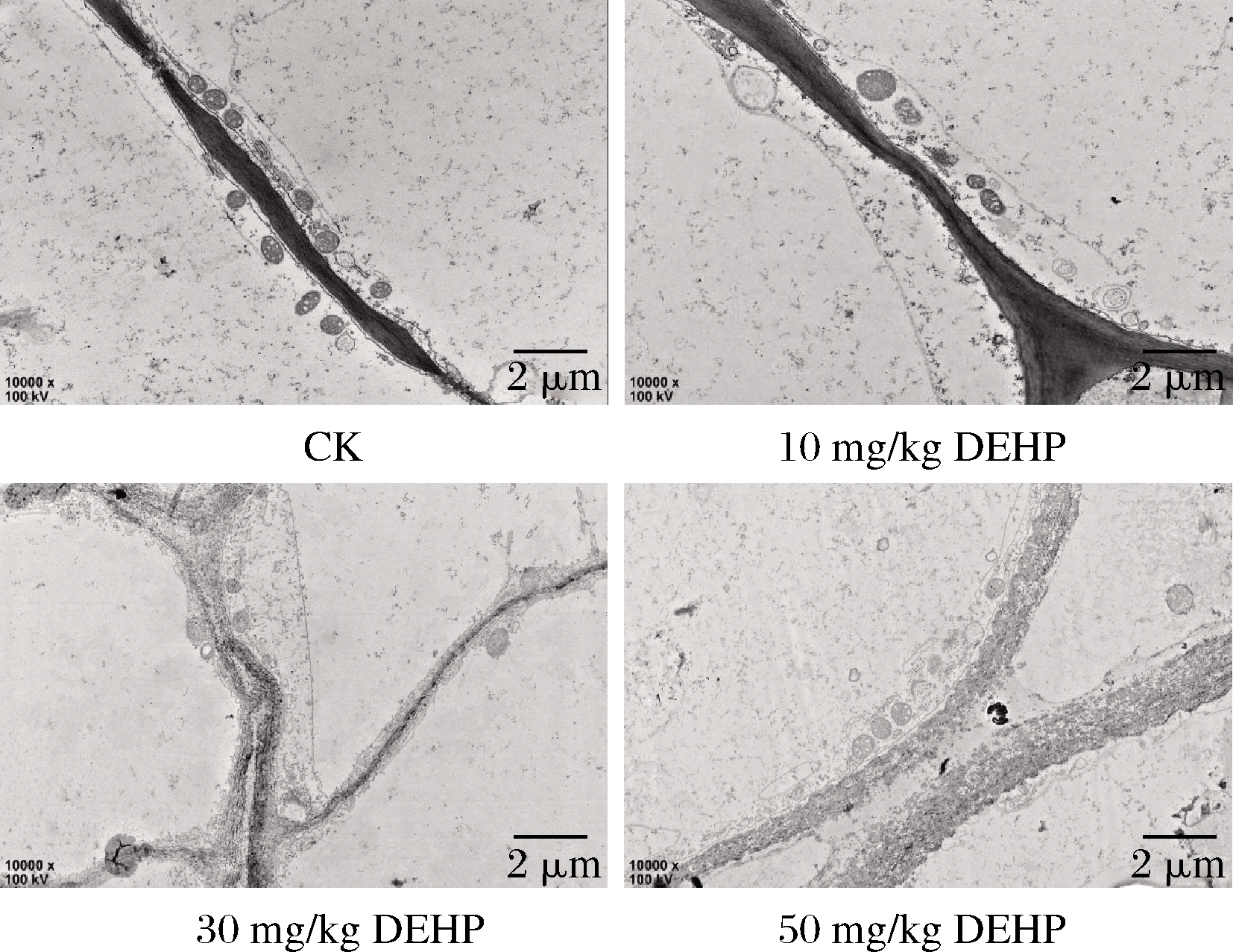
图1 DEHP对萝卜根部细胞壁超微结构的影响
Fig.1 Effect of DEHP on cell wall ultrastructure of radish
萝卜(Raphanus sati us L.)为十字花科萝卜属作物,是我国重要的大众化蔬菜,其肉质根富含植物蛋白、维生素C、膳食纤维和多种微量元素,具有很高的食用和药用价值。2017年我国萝卜种植面积达130万hm2,总产量达4501万t[1]。地膜因其保温保墒、抑制杂草等功能,在萝卜种植中被广泛使用,2015年我国地膜用量145.5万t,覆盖面积1831.8万hm2[2],邻苯二甲酸酯类化合物(phthalic acid easters,PAEs)作为增塑剂被添加到塑料中,由于在环境中具有性质稳定,半衰期长,生物蓄积毒性较强等特性[3],美国国家环保局已将邻苯二甲酸二(2-乙基)己酯(diethylhexyl phthalate,DEHP)、邻苯二甲酸二丁酯(di-n-butyl ortho-phthalate ,DBP)、邻苯二甲酸丁基苄基酯(benzyl-n-butyl ortho-phthalate ,BBP)、邻苯二甲酸二甲酯(dimethyl ortho-phthalate ,DMP) 、邻苯二甲酸正二辛酯(di-n-octyl ortho-phthalate ,DnOP)、邻苯二甲酸二乙酯(dicthyl ortho-phthalate ,DEP) 6种 PAEs 列为优先控制的有毒污染物[4-5]。DEHP作为一种常见的PAEs,在农业土壤中的浓度高于其他种类的 PAEs,有研究表明广州、深圳蔬菜基地土壤中6种PAEs的总含量为3.00~45.67 mg/kg,其中DEHP含量为1.86~25.12 mg/kg[6];山东省青岛市花生、棉花基地土壤DEHP含量最高达20.69 mg/kg[7];山东省莱州市农田土壤中6种PAEs的总含量为4.63~15.59 mg/kg,DEHP含量为12.46~35.77 mg/kg[8],显著高于美国密西西比三角洲、丹麦和荷兰等欧美国家和地区[9]。DEHP通过土壤进入农作物中,杨延杰等[10]研究发现,不同浓度的DEHP对萝卜种子萌发和幼苗根系生长呈现低促进高抑制的机制。CHANG等[11]研究发现DEHP浓度的增加会影响蚕豆植物的DNA多态性,并对蚕豆苗造成可诱导急性氧化损伤并产生遗传毒性作用。近年来,PAEs在土壤中的含量和成分[12-14]、在土壤-蔬菜中的迁移[15]、分配[16]、富集[17]、对蔬菜生长的影响[18-19]等方面研究较多,而对于植物对PAEs的耐逆相关功能基因组学研究较少,二代高通量测序方法-转录组测序(RNA sequencing,RNA-Seq)技术因其精准度高、成本低,成为探索植物体响应不同胁迫的基因网络分析的理想工具[20],本研究利用RNA-Seq技术,对DEHP污染后的萝卜块根进行转录组测序,分析萝卜块根的差异表达基因和代谢通路,探究萝卜响应DEHP胁迫的分子机制。
供试种子,青岛蓉睦善良种有限公司“九斤王”;供试土壤,重庆市潼南区前进村绿色蔬菜基地。
1.2.1 盆栽试验
分别称取DEHP 50、150和250 mg,溶于丙酮(分析纯),再加入5 kg原始土壤中拌匀,即制得3个污染浓度的土壤DEHP-l(10 mg/kg)、DEHP-m(30 mg/kg)和 DEHP-h(50 mg/kg),在阴凉通风处放置24 h,以去离子水调至最大田间持水量的70%,并将其置于温室内平衡15 d,于2019年4月3日播种,2019年6月8日收获,全生育期为69 d。
1.2.2 透射电镜观察
将萝卜根部组织样品切成0.1 mm3的小块,快速放入质量分数4%的戊二醛中固定,抽真空使样品下沉,4 ℃下固定24 h,利用0.1 mol/L磷酸缓冲液冲洗3次,用质量分数1%锇酸固定4 h,经乙醇梯度脱水后用Epon812环氧树脂包埋,超薄切片机切片,经醋酸双氧铀-梓檬酸铅双重染色后在透射电镜下观察、拍照。
1.2.3 RNA 的提取和Read文库制备
采用Omega Plant RNA kit 试剂盒法提取萝卜块根中的RNA,将经不同DEHP浓度处理的萝卜样品的总 RNA送广州基迪奥生物科技有限公司进行Illumina HiSeqTM测序工作。
1.2.4 测序数据处理
将原始下机数据过滤后获得的reads比对到参考基因组上,利用Cufflinks组装得到已知的转录本与新的转录本,并对得到的基因进行表达量分析与统计,分析差异表达基因(differentially expressed genes, DEGs)和功能富集途径。
1.2.5 样本间差异表达基因筛选
使用edgeR软件对其进行DEGs分析,筛选出不同处理样品之间的DEGs,并对其显著性水平(P<0.05)进行分析,将未受污染的萝卜作为对照组(CK),计算出不同浓度DEHP污染下的上调基因数(Log2ratio>2)和下调基因数(Log2ratio<2)。上调基因表明在DEHP胁迫下基因表达量大于对照组,或某些不表达的基因在DEHP胁迫下开始表达,说明这部分基因多与DEHP胁迫的耐性有关。下调基因表明在DEHP胁迫下基因表达量小于对照组,说明DEHP胁迫对植物的系统造成了伤害,使得活性下降,表达量降低,大多与生理功能相关。
1.2.6 基因本体(Gene Ontology,GO)功能注释与分析
以 P≤0.05 为阈值,将筛选到的DEGs利用GO seq软件 [21]进行GO富集分析,满足此条件的GO term 为显著富集的GO term,并以此来确定差异表达基因所行使的主要生物学功能。本试验通过研究DEGs在 GO中的分布状况,了解不同浓度DEHP污染处理下各萝卜样本在基因功能层面上的差异。
1.2.7 Pathway途径分析
利用R语言软件,筛选条件以Q值≤0.05 为阈值,满足此条件为在DEGs中显著富集的pathway,并在京都基因与基因组百科全书数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)中进行注释[22-23],通过KEGG 代谢途径显著性富集分析来确定DEGs参与的相关信号转导和生化代谢途径。
利用Excel 2013进行数据处理、统计分析和绘图,利用 t-检验分析各污染浓度萝卜的差异显著性。
细胞壁作为植物的特有结构,有维持细胞形状、运输物质和传递信息的作用,也是外界物质进入细胞内部的第一屏障[24],由图1可知,对照组中的萝卜细胞壁界限清晰,整齐平滑,厚薄均匀;在10 mg/kg DEHP处理下萝卜细胞壁变厚;在30 mg/kg DEHP处理下萝卜细胞壁继续加厚,厚薄不均,并出现质壁分离的现象,细胞膜和细胞壁之间有深色颗粒沉淀物;在50 mg/kg DEHP处理下萝卜细胞壁变形严重,有断裂的现象,质壁分离现象加重,并在细胞膜和细胞壁之间有更多的深色颗粒沉积物。

图1 DEHP对萝卜根部细胞壁超微结构的影响
Fig.1 Effect of DEHP on cell wall ultrastructure of radish
由图2可知,对照组中的萝卜线粒体结构清晰,呈圆形或椭圆形,双层被膜和内部嵴结构完整;在10 mg/kg DEHP处理下萝卜线粒体数量减少,体膜结构变化不大;在30 mg/kg DEHP处理下萝卜线粒体数量进一步减少,出现空泡化,内部嵴的数量变少,嵴突变得模糊;在50 mg/kg DEHP处理下萝卜线粒体损伤更加严重,内部嵴断裂,线粒体变模糊解体。线粒体结构的损伤将会影响植物体三羧酸循环,使细胞呼吸减弱,抑制信号传递,还会影响各种酶的活动。
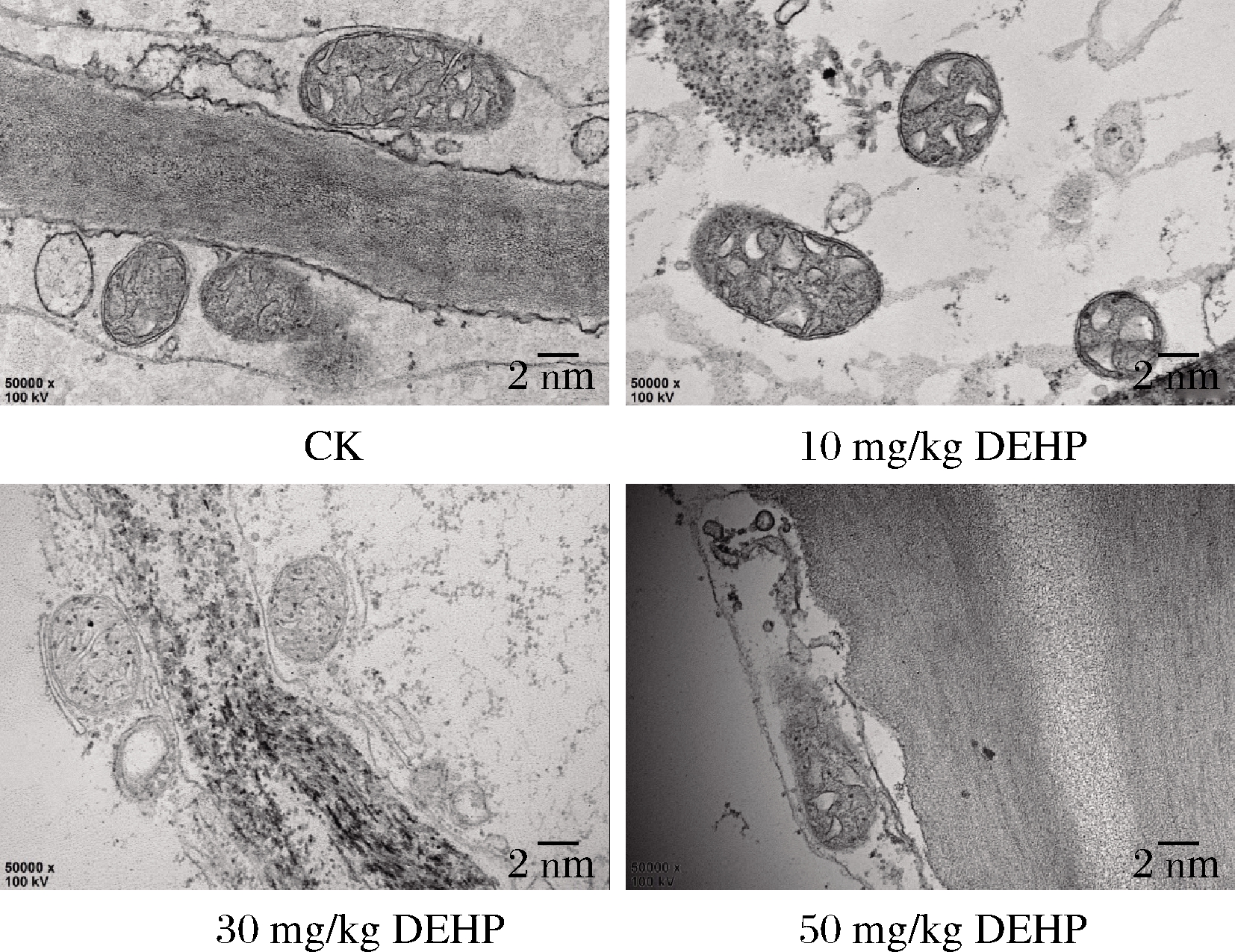
图2 DEHP对萝卜根部细胞线粒体超微结构的影响
Fig.2 Effect of DEHP on mitochondria ultrastructure of radish
2.2.1 转录组数据质量评估
信息分析前对下机数据进行质控与过滤,由表1可知,通过对样品的转录组测序,分别获得50 071 200、52 707 576、47 261 670和48 651 920条Clean Reads,经过整理和筛选分析,得到HQ Clean Reads,分别为49 143 966、51 612 986、46 319 318和47 567 124条,各样本的HQ Clean Reads均有所下降,相对于Clean Reads,筛选后的HQ Clean Reads占98.15%、97.92%、98.01%和97.77%。4个样品的Q20均大于98%,Q30均大于95%,测得序列的GC含量占47%以上,说明转录组测序质量较高,可以进行下一步的数据整理和分析。
表1 数据信息统计表
Table 1 Statistics of RNA-Seq
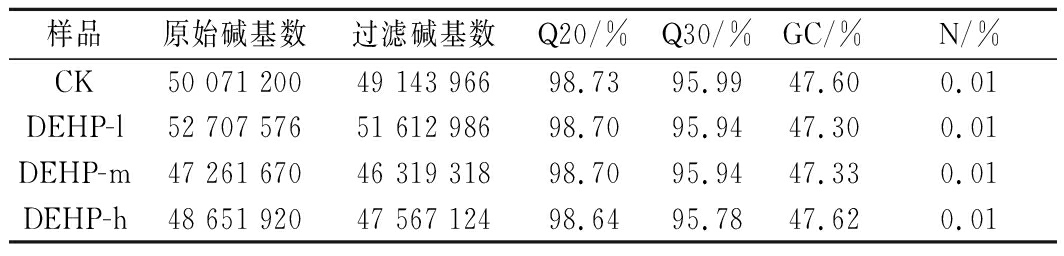
样品原始碱基数过滤碱基数Q20/%Q30/%GC/%N/%CK50 071 20049 143 96698.7395.9947.600.01DEHP-l52 707 57651 612 98698.7095.9447.300.01DEHP-m47 261 67046 319 31898.7095.9447.330.01DEHP-h48 651 92047 567 12498.6495.7847.620.01
2.2.2 差异表达基因分析
以P<0.05为筛选条件筛选差异表达基因后作火山图,由图3可知:红色点代表上调基因,绿色点代表下调基因,黑点代表非差异基因。在10 mg/kg处理下,与CK相比,产生9 885个差异表达基因,其中上调差异表达基因5 993个,下调差异表达基因3 892个;在30 mg/kg处理下,相比CK产生9 385个差异表达基因,其中上调差异表达基因6 346个,下调表达基因3 039个,上调基因数量大于下调基因数量;在50 mg/kg处理下,相比CK产生11 880个显著差异表达基因,其中上调差异表达基因7 336个,下调差异基因4 544个。3个浓度污染下的上调基因数量均大于下调基因数量。

a-10 mg/kg处理;b-30 mg/kg处理;c-50 mg/kg处理
图3 差异表达基因火山图
Fig.3 Differential expressed gene olcano map
通过维恩图(图4)分析,在5 101个差异重叠基因中,有4 858个差异基因表达趋势一致,243个差异基因表达趋势不一致,不一致的基因中CK s DEHP-l上调基因86个, CK s DEHP-m上调基因129个, CK s DEHP-h上调基因153个。随着污染浓度的加大,越来越多的下调基因变为上调,说明萝卜为适应或抵抗DEHP胁迫,让更多基因参与到应答反应中。CK s DEHP-l中上调的86个基因主要是与蛋白激酶、脱氢酶、调节蛋白、转录蛋白、结合蛋白、过氧化物酶、谷胱甘肽等相关的基因[25-29],这些基因的上调表达都与萝卜块根的抗性相关,说明其可以抵御一定的DEHP胁迫,但随着污染浓度的增加,86个基因在CK s DEHP-m中有8个基因变为下调,在CK s DEHP-h有83个基因变为下调,说明随着污染浓度的增加,DEHP胁迫会对萝卜造成严重伤害,也说明了萝卜对DEHP的抵御是有限度的。
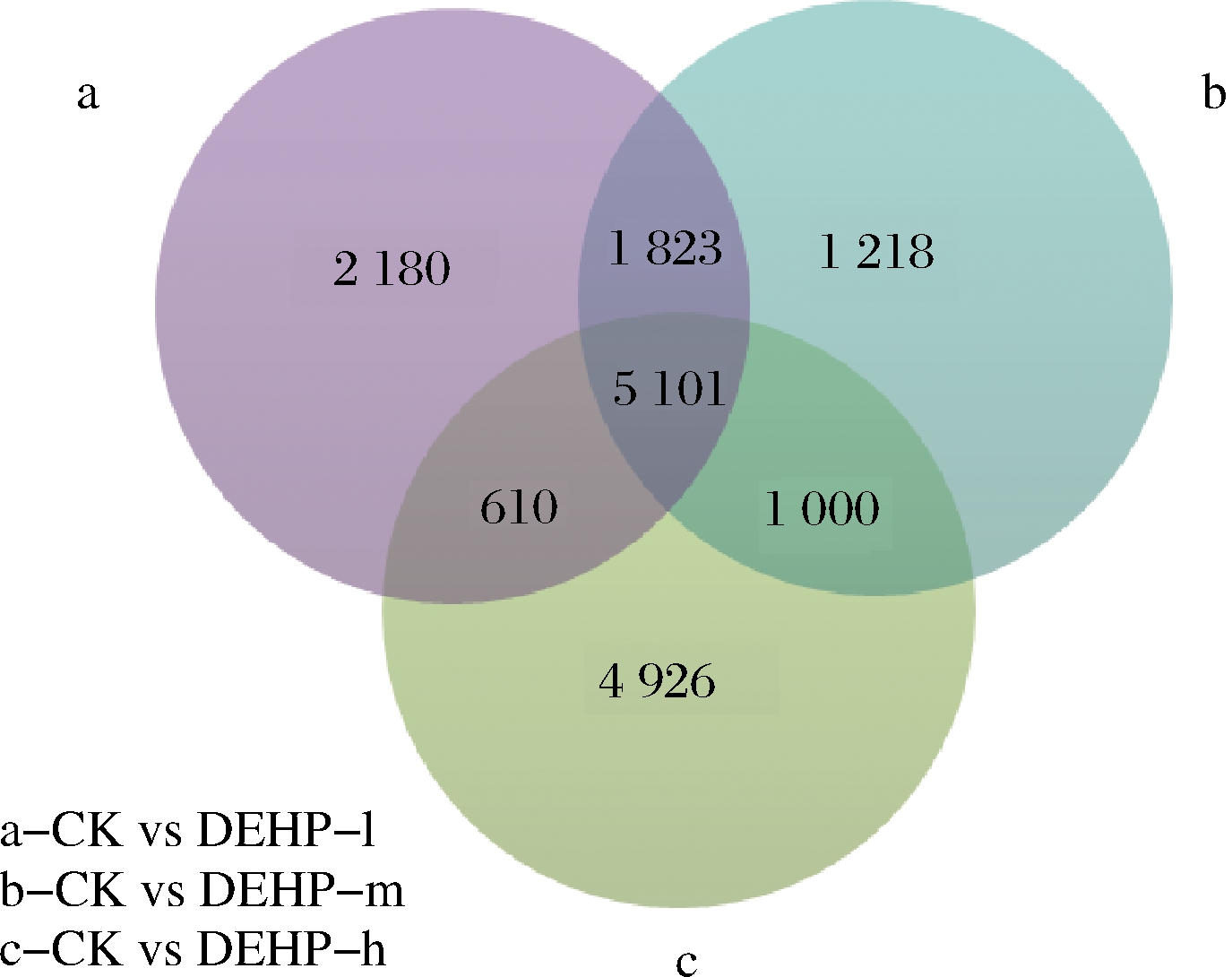
图4 差异表达基因维恩图
Fig.4 Differential expressed gene enn diagram
2.2.3 差异表达基因的GO富集分析
研究发现,与空白组相比,3个DEHP污染浓度处理后分别有2 280、2 126和2 030个DEGs被GO注释到生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)3个大类别,由图5可知,在富集最显著的前40个GO term中,集中在生物进程的GO term有17个,集中在细胞组分的GO term有12个,集中在分子功能的GO term有11个。其中细胞过程、代谢过程、单有机体过程和刺激响应是生物过程大类中最主要富集的通路,细胞成分、细胞区域和细胞器是细胞组分大类中最主要富集的通路,催化活性和结合是分子功能大类中最主要富集的通路。
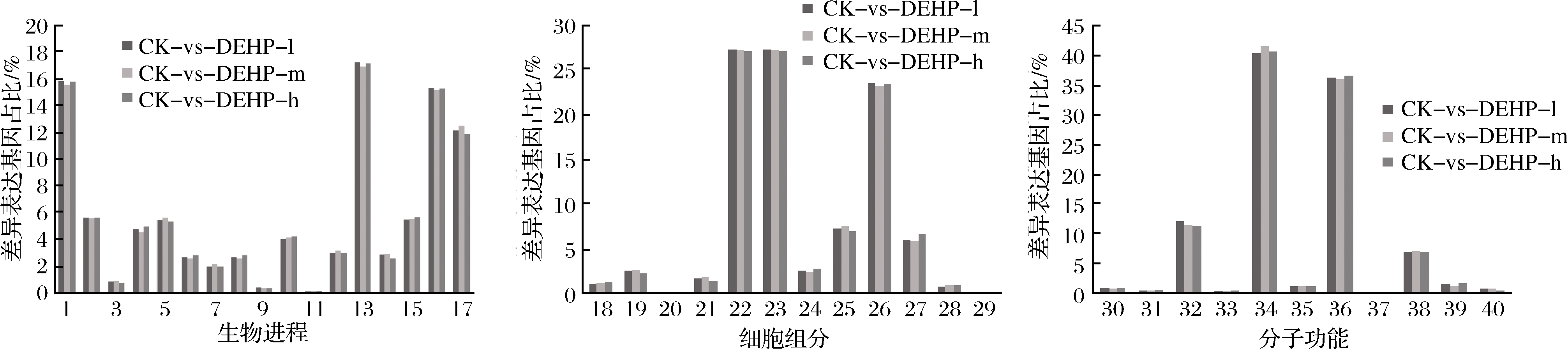
1-代谢过程;2-定位;3-生长;4-细胞成分组织或生物发生;5-生物调控;6-繁殖;7-免疫系统过程;8-生殖过程;9-节律过程;10-多细胞组织过程;11-生物粘附;12-多生物过程;13-细胞过程;14-信号系统15-发展过程;16-单有机体过程;17-刺激响应;18-膜封闭腔;19-细胞连接;20-细胞外基质;21-膜部件;22-细胞成分;23-细胞区域;24-高分子络合物;25-膜;26-细胞器;27-细胞器部分;28-细胞外区;29-细胞外基质成分;30-信号传感器活动;31-抗氧化活性;32-核酸结合转录因子活性;33-转录因子活性,蛋白质结合;34-催化活性;35-结构分子活性;36-结合;37-电子载流子活性;38-转运活性;39-分子功能调节剂;40-分子换能器活性
图5 DEHP污染下萝卜差异表达基因的GO功能分类
Fig.5 Gene Ontology functional classification of differentially expressed genes after DEHP treatment
由表2可知,将KEGG数据库作为参考,与空白对照组相比,10 mg/kg污染浓度下有2 133个DEGs注释到KEGG数据库中的129个分类代谢途径,显著富集的有20个通路(P<0.05);30 mg/kg污染浓度下有1 991个DEGs注释到KEGG 数据库中的130个分类代谢途径,显著富集的有22个通路(P<0.05);50 mg/kg污染浓度下有2 641个DEGs注释到 KEGG 数据库中的130个分类代谢途径,显著富集的有20个通路(P<0.05)。
其中ko00270、ko00591、ko00592、ko00400、ko00260等通路包含的差异基因较多,这些通路主要涉及半胱氨酸与蛋氨酸代谢、亚油酸、α-亚麻酸代谢、苯丙氨酸、酪氨酸和色氨酸的生物合成和甘氨酸、丝氨酸和苏氨酸代谢等过程。
通过KEGG注释,分别有61、61、78条unigenes被注释到代谢所在的半胱氨酸与蛋氨酸代谢的KEGG通路,其中支链氨基酸转氨酶(2.6.1.42)、精胺合成酶(2.5.1.16)、1-氨基环丙烷-1-羧酸合成酶(4.4.1.14)和蛋氨酸γ裂解酶(4.4.1.11)在各污染处理组中均上调;丙氨酸-乙醛酸转氨酶(2.6.1.44)在10和30 mg/kg处理下,表达基因有上调,在50 mg/kg处理下表达基因有上调/下调的趋势;胞嘧啶-5-甲基转移酶(2.1.1.37)和硫代硫酸盐/3-巯基丙酮酸硫转移酶(2.8.1.2)在各污染处理组中均下调。其中精胺合成酶(spermine synthase,SPMS)、丙氨酸乙醛酸转氨酶与抵御外部环境胁迫相关[30-31],胞嘧啶-5-甲基转移酶与植物生长发育相关[32]。
光呼吸是光合作用的补充反应,当受到外界胁迫时,植物会通过光呼吸消耗体内的乙醛酸,降低对细胞的伤害,提高植物抗病性和抗逆性[33-34]。光呼吸代谢时,转氨酶作为氨基酸代谢中重要的催化剂促成乙醛酸的转氨反应,有研究表明丙氨酸-乙醛酸转氨酶(alanine-glyoxylate transaminase,GAT)定位于线粒体中,与乙醛酸代谢途径相关并参与了光呼吸途径,小麦在低温、脱落酸、干旱和高盐处理下GAT的表达量均随胁迫的加大呈抛物线变化[35]。本试验中随着DEHP污染浓度的增加,萝卜块根上调GAT来加大光呼吸作用,抵御DEHP胁迫,但当浓度增加到50 mg/kg时,线粒体受到严重损伤甚至解体,导致GAT下降,影响萝卜耐受性,这与透射电镜中观察到线粒体的变化一致。
多胺(polyamines,PAs)作为一种低分子量脂肪族的含氮碱广泛存在于生物体中,有研究表明植物中的多胺作为可溶性物质、核苷酸和细胞膜的保护物质、活性氧清除剂等来参与细胞的抗逆过程,抵御外部环境胁迫[6,37]。SPMS在多胺合成后期将腐胺催化合成精胺,WI等[38]研究发现多胺含量的增加可以提高马铃薯耐非生物胁迫的能力,TANOU等[39]研究发现在盐胁迫下柑桔通过上调PAs表达量改变其氧化状态。本试验中在DEHP胁迫下萝卜中SPMS表达量增加,且中高浓度污染下参与基因多于低浓度污染,表明萝卜可通过调节多胺含量提高逆境抗性。
DNA甲基化是生物基因组中普遍的共价修饰方式,参与了基因的表达调控、胚胎发育、细胞分化、基因组印迹、X染色体失活等,甲基化水平不足将会影响植物生长发育,胞嘧啶-5-甲基转移酶(DNA (cytosine-5)-methyltransferase,5-MeC METI)可以识别特异DNA碱基序列并催化其进行甲基化修饰。大量研究表明,在温度、化学试剂、金属等胁迫下会引起植物DNA甲基化状态和程度的变化[40-42],FINNEGAN等[43]在烟草中转入甲基转移酶反义基因MET1,发现其DNA甲基化水平下降,进而影响植株开花时间、生殖能力和花叶形态。本试验中发现各污染组DEHP胁迫下5-MeC METI表达量均下调,使得DNA甲基化水平下降,同时METI表达量的下调会间接影响纤维素合成酶的表达进而导致纤维素合成下降[44],在透射电镜观察中,萝卜块根细胞壁随污染浓度的增加而变形甚至断裂,降低了细胞抵御外界胁迫的能力。
表2 DEHP差异表达基因的 KEGG 富集分析
Table 2 KEGG enrichment analysis of differentially expressed genes under DEHP pollution

KEGG 代谢通路ID差异基因数基因总数PCK- s-DEHP-l苯丙氨酸代谢ko0036032870.000188亚油酸ko0059111190.000297苯丙氨酸、酪氨酸和色氨酸的生物合成ko00400371090.000402类黄酮生物合成ko0094120500.00087芳香族化合物的降解ko012209160.00143甘氨酸、丝氨酸和苏氨酸代谢ko00260461560.002657苯丙素生物合成ko00940903460.003173烟酸和烟酰胺代谢ko0076018490.004656乙醚脂质代谢ko0056519540.006347α-亚麻酸代谢ko0059225800.010786类胡萝卜素生物合成ko0090620610.012303泛醌和其他萜类醌的生物合成ko0013027890.012557不饱和脂肪酸的生物合成ko0104026870.017196二苯乙烯、二芳基庚烷和姜辣素的生物合成ko00945341220.021257其他聚糖降解ko0051113370.022313卟啉与叶绿素代谢ko0086026910.030066氮代谢ko0091024840.036118半胱氨酸和蛋氨酸代谢ko00270612470.037386丙氨酸、天冬氨酸和谷氨酸代谢ko00250321200.044403昼夜节律-植物ko0471225900.045186CK- s-DEHP-m苯丙素生物合成ko00940953462.70E-05硫代葡萄糖苷生物合成ko0096614290.000266托烷、哌啶和吡啶生物碱的生物合成ko0096026720.000335亚油酸ko0059110190.00087谷胱甘肽代谢ko00480521880.001414苯丙氨酸、酪氨酸和色氨酸的生物合成ko00400331090.002106类胡萝卜素生物合成ko0090621610.002411氰胺酸代谢ko00460381360.004832半乳糖代谢ko00052341190.005107烟酸和烟酰胺代谢ko0076017490.0055212-氧代甲酸代谢ko01210461740.006518半胱氨酸和蛋氨酸代谢ko00270612470.009757倍半萜和三萜类生物合成ko0090916480.010688苯丙氨酸代谢ko0036025870.013851α-亚麻酸代谢ko0059223800.017647甘氨酸、丝氨酸和苏氨酸代谢ko00260391560.028013C5支链二元酸代谢ko006609250.030655氮代谢ko0091023840.030837淀粉和蔗糖代谢ko00500994480.032281酪氨酸代谢ko0035023870.044821不饱和脂肪酸的生物合成ko0104023870.044821异喹啉生物碱生物合成ko0095016560.045437
续表2
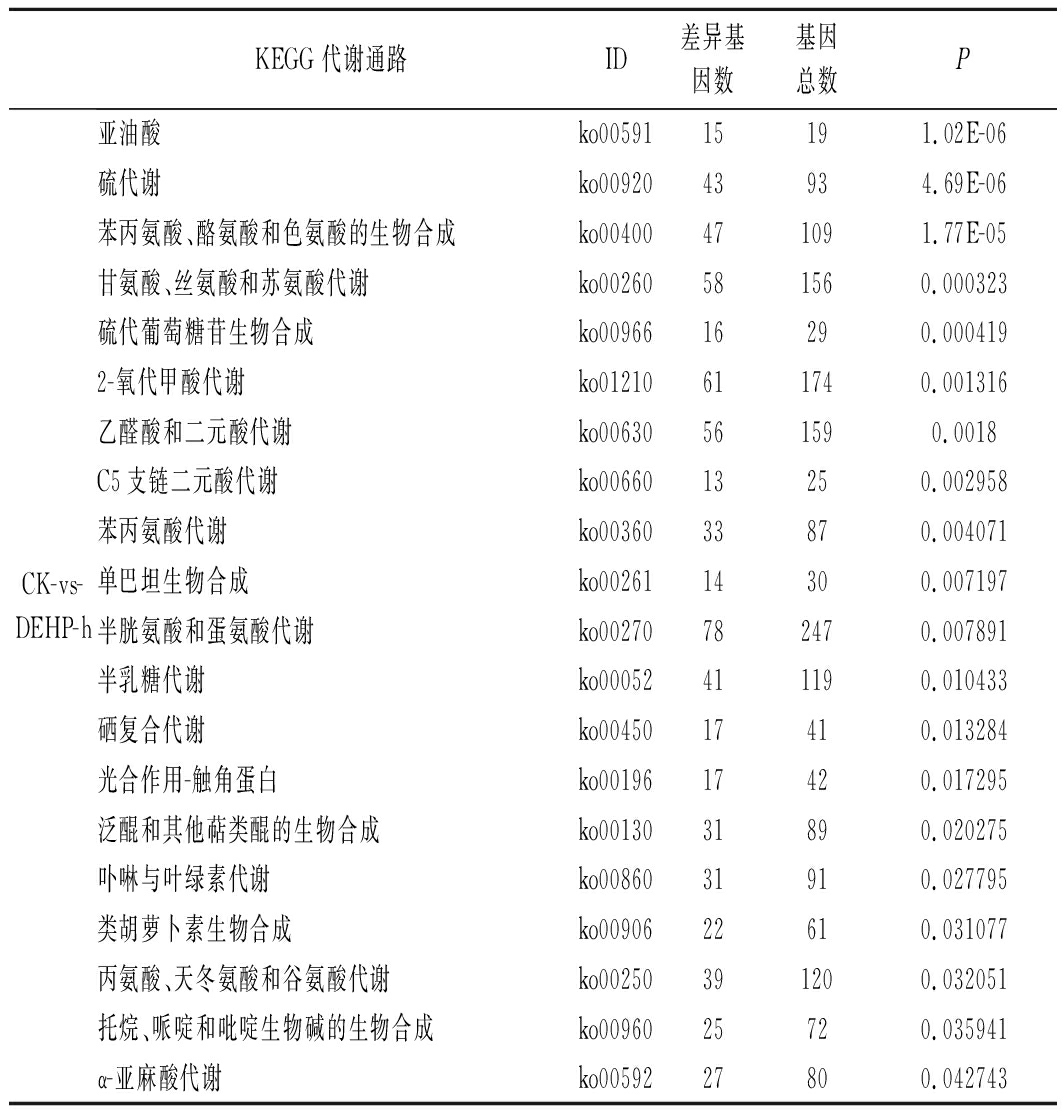
KEGG 代谢通路ID差异基因数基因总数PCK- s-DEHP-h亚油酸ko0059115191.02E-06硫代谢ko0092043934.69E-06苯丙氨酸、酪氨酸和色氨酸的生物合成ko00400471091.77E-05甘氨酸、丝氨酸和苏氨酸代谢ko00260581560.000323硫代葡萄糖苷生物合成ko0096616290.0004192-氧代甲酸代谢ko01210611740.001316乙醛酸和二元酸代谢ko00630561590.0018C5支链二元酸代谢ko0066013250.002958苯丙氨酸代谢ko0036033870.004071单巴坦生物合成ko0026114300.007197半胱氨酸和蛋氨酸代谢ko00270782470.007891半乳糖代谢ko00052411190.010433硒复合代谢ko0045017410.013284光合作用-触角蛋白ko0019617420.017295泛醌和其他萜类醌的生物合成ko0013031890.020275卟啉与叶绿素代谢ko0086031910.027795类胡萝卜素生物合成ko0090622610.031077丙氨酸、天冬氨酸和谷氨酸代谢ko00250391200.032051托烷、哌啶和吡啶生物碱的生物合成ko0096025720.035941α-亚麻酸代谢ko0059227800.042743
通过KEGG注释,各DEHP污染处理组分别有25、23、27条unigenes被注释到代谢所在的α-亚麻酸代谢的KEGG通路,脂氢过氧化物裂解酶(HPL1)表达基因在各污染处理组中均下调;乙酰辅酶A酰基转移酶(2.3.1.16)在10和30 mg/kg处理下,表达基因均有上调/下调的趋势,在50 mg/kg处理下表达基因全部变为上调;12-氧-植物二烯酸还原酶(1.3.1.42)在10 mg/kg处理下表达基因上调,在30和50 mg/kg处理下,表达基因有上调/下调的趋势。其中脂氢过氧化物裂解酶、乙酰辅酶A酰基转移酶和12-氧-植物二烯酸还原酶均与萝卜生长发育和品质有关。
植物在脂氧化过程中通过脂氢过氧化物裂解酶(hydroperoxide lyase,HPL)催化脂氧合酶(lipoxygenase,LOX)的反应产物脂氢过氧化物(HPOD或HPOT)裂解生成短链醛和含氧酸[45],HPL裂解产物不仅可以挥发出植物特殊的芬芳气味,还参与植物抗病虫、抗伤害和抗逆的防御响应。有研究表明HPL的催化反应与脂类代谢系统密切相关,其活性会被脂类物质的抗氧化剂所抑制,同时HPL活性基团中的Fe3+还能与脂氢过氧化物作用形成烷氧基和铁羟络合物,说明金属螯合剂也能抑制其催化活性[46]。在DEHP的胁迫下,萝卜中脂代谢活动加强,抑制了HPL活性,导致其基因表达下调,同时降低了特异气味形成,影响萝卜质量。
乙酰辅酶A酰基转移酶(acetyl-CoA C-acetyltransferase,AACT)是甲羟戊酸(me alonate,M A)合成的重要酶类,通过催化蛋白质的酰基化和去酰基化来修饰植物蛋白质,调节蛋白质生物活性和基因表达,调控植物的生长发育及主要活性成分的合成[47]。本试验中AACT表达量的变化说明DEHP胁迫诱发了萝卜的防御反应,与低中浓度相比,高浓度处理后AACT表达量增加,加快了M A的合成,并通过M A来抵御DEHP胁迫。
茉莉酸类化合物是植物体内产生的天然植物激素,包括茉莉酸、茉莉酸甲酯及茉莉酸衍生物[48],在植物受到外界胁迫时作为信号分子调控下游相关基因的表达水平,宋云等[49]研究发现茉莉酸不仅可以调控植物生长发育,还在植物受到机械伤害、病虫害等胁迫下作出防御响应。12-氧-植物二烯酸还原酶(12-oxophytodienoic acid reductase,OPR)是茉莉酸生物合成(十八烷碳烯酸代谢途径)的正调控因子,有研究表明植物中的OPR在各种生物和非生物胁迫下具有特异性表达模式,小麦在受盐胁迫时OPR1基因(TaOPR1)上调表达以响应各种刺激因子,而OPR2基因(TaOPR2)则因高盐处理表达受到抑制[50]。香蕉中12-氧-植物二烯酸还原酶(MaOPR)在乙烯、枯萎病胁迫下表达上调以响应胁迫,特别在茎和果实中表达量较高[51]。本试验中发现萝卜的OPR在低浓度污染时表达基因上调,说明萝卜通过激活茉莉酸信号抵御外来胁迫,但随着污染浓度增加,OPR的部分表达基因变为下调,也说明萝卜抵御胁迫的能力是有限度的。
通过KEGG注释,各DEHP污染处理组分别有11、10、15条unigenes被注释到代谢所在的亚油酸的KEGG通路,各DEHP污染处理组中,LOX(1.13.11.12)在10 mg/kg处理下,表达基因下调,30和50 mg/kg处理下,表达基因有上调/下调的趋势。在各处理组的分泌型磷脂酶A2(3.1.1.4)表达基因均上调,亚油酸9S脂氧合酶(1.13.11.58)表达基因均有上调/下调的趋势。其中LOX、分泌型磷脂酶A2均与抵御外部环境胁迫相关。
LOX能催化植物体内酚基甘油酯产生脂肪酸衍生物,是植物脂肪酸氧化的一条重要途径,一般在逆境条件下启动,与植物种子的萌发与老化、生长发育进程、抗逆境胁迫和特有风味物质的产生密切相关[52]。植物发生超敏(hypersensiti e response,HR)反应时,细胞膜崩裂、电解质渗漏、细胞降解,细胞膜系统的破坏可能主要源于膜脂的过氧化反应,LOX是植物体内膜脂过氧化反应中的重要酶类,其在催化不饱和脂肪酸生成氢过氧化物脂肪酸的同时,产生大量的活性氧,后者参与细胞膜脂的过氧化,破坏细胞膜,导致细胞坏死。有研究表明,用放线菌酮抑制LOX的诱导后,也抑制了HR反应。同时,LOX还能催化植物防卫反应信号分子的合成,通过脂氧合酶途径合成的茉莉酸甲酯、茉莉酸酮酸和7-异茉莉酸都可激活植物的防卫基因[53]。在DEHP的污染下,各处理组的LOX均有下调,表明萝卜通过降低LOX来应对DEHP的胁迫,但中高污染浓度下LOX部分上调,产生活性氧,导致萝卜防卫基因下调和细胞膜破损,所以随着污染浓度增加,萝卜块根细胞壁开始变形甚至断裂,并出现质壁分离。
磷脂酶A2(phospholipase A2,PLA2)作为一类能水解磷脂甘油C-2酯键生成游离脂肪酸以及溶血磷脂的酶类广泛存在于植物组织中,在细胞磷脂消化、新陈代谢、信号转导以及宿主防御等生理过程中起重要作用。有研究表明PLA2表达调节与伤害[54]和病原侵染[55]时的信号传导有关; CHAPMAN[56]研究发现,植物PLA2会在受伤或逆境时被激活,且表达量显著增加;YOUNG等[57]发现在水稻黄单胞菌胁迫下,体内磷脂代谢活动加强,PLA2活性的积累还可以迅速增加植物体内茉莉酸含量,对DEHP胁迫作出防御响应,但PLA2的活化也会导致质膜的破坏,这与透射电镜观测结果一致。
本研究以萝卜为研究对象,探究了不同浓度DEHP污染下萝卜与空白组的亚显微结构和转录组的差异。亚显微结构研究表明,DEHP胁迫会破坏萝卜块根细胞的结构,导致细胞壁加厚变形、部分断裂,线粒体嵴数减少,内部嵴断裂变模糊甚至解体,且污染浓度越大,破坏越严重。应答转录组分析研究表明,通过过转录组测序,分别获得9 885、9 385和11 880条显著差异表达基因,且上调基因数量均大于下调基因数量。通过GO数据注释发现,差异表达基因在GO中参与最多的生物过程是细胞过程、代谢过程、单有机体过程和刺激响应,参与最多的细胞组分是细胞成分、细胞区域和细胞器,参与最多的分子功能是催化活性和结合。KEGG富集分析得出,3组不同污染浓度下共同富集最多的主要通路是苯丙氨酸代谢、亚油酸、α-亚麻酸代谢、苯丙氨酸、酪氨酸和色氨酸的生物合成、甘氨酸、丝氨酸和苏氨酸代谢、苯丙酸生物合成、类胡萝卜素生物合成、半胱氨酸与蛋氨酸代谢。通过比较空白组和DEHP胁迫组的差异基因发现半胱氨酸与蛋氨酸代谢、亚油酸、α-亚麻酸代谢的差异基因富集比例较高,说明萝卜在DEHP胁迫下通过这些通路来表达应激反应,值得进一步研究相关基因的应激机制。半胱氨酸与蛋氨酸代谢途径中的GAT、PAs和5-MeC METI,油酸代谢途径中的LOX和PLA2,α-亚麻酸代谢途径中的HPL、AACT和OPR均对DEHP胁迫表现出抗性,说明显著差异基因对萝卜的非生物胁迫的响应具有重要意义。
[1] 包崇来,汪精磊,胡天华,等.我国萝卜产业发展现状与育种方向探讨[J].浙江农业科学,2019,60(5):707-710.
[2] 国家统计局农村社会经济调查司.中国农村统计年鉴[M].北京:中国统计出版社,2016.
[3] DU J B,TANG Y L,LONG Z W,et al.Theoretical calculation of spectra of dibutyl phthalate and dioctyl phthalate[J].Russian Journal of Physical Chemistry A,2014,88(5):81-822.
[4] WANG J L,YE Y C,WU W Z.Comparison of di-n-methyl phthalate biodegradation by freeandimmobilized microbial cells[J].Biomedical and En ironmental Sciences,2003,16(2):126-132.
[5] YANG G C,HUANG S C,JEN Y S,et al.Remediation of Phthalates in ri er sediment by integrated enhanced bioremediation and electrokinetic process[J].Chemosphere,2015,150:576-585.
[6] 蔡全英,莫测辉,李云辉,等.广州、深圳地区蔬菜生产基地土壤中邻苯二甲酸酯(PAEs)研究[J].生态学报,2005,25(2):283-288.
[7] 王丽霞.保护地邻苯二甲酸酯污染的研究[D].泰安:山东农业大学,2007.
[8] 张海光,孙国帅,孙磊,等.典型覆膜作物土壤中邻苯二甲酸酯污染的初步研究[J].中国环境监测,2013,29(4):60-63.
[9] 王凯荣,崔明明,史衍玺.农业土壤中邻苯二甲酸酯污染研究进展[J].应用生态学报,2013,24(9):2 699-2 708.
[10] 杨延杰,林多.邻苯二甲酸对蔬菜种子萌发和幼苗生长及根系形态的影响[J].北方园艺,2013,13:9-11.
[11] CHANG Q,GAO N N,ZHENG Y D,et al.Effects of di-(2-ethylhexyl) phthalate on root tips of icia faba seedings// 3rd International Conference on Bioinformatics and Biomedical Engineering[C].Beijin:IEEE Press,2009:1-3.
[12] 杨国义,张天彬,高淑涛,等.广东省典型区域农业土壤中邻苯二甲酸酯含量的分布特征[J].应用生态学报,2007,18(10): 2 308-2 312.
[13] ZENG F,CUI K,XIE Z,et al.Distribution of phthalate esters in urbansoils of subtropical city,Guangzhou,China[J].Journal of Hazardous Materials,2009,164(2/3):1 171-1 178.
[14] 杨婷,何明靖,杨志豪,等.邻苯二甲酸酯在三峡库区消落带非淹水期土壤中污染特征及健康风险[J].环境科学,2017,38 (10):4 187-4 193.
[15] MO C H,CAI Q Y,TANG S R,et al.Polycyclic aromatic hydrocarbons(PAHs) and phthalic acid esters (PAEs) in egetables from ninefarms of the pearl ri er delta,south China[J].Contamination and Toxicology,2009,56 (2):181-189.
[16] 崔明明,王凯荣,王琳琳,等.山东省花生主产区土壤和花生籽粒中邻苯二甲酸酯的分布特征[J].应用生态学报,2013,24(12): 3 523-3 530.
[17] DONG H G,LIU T,HAN Z Q,et al.Determining time limits of continuous film mulchingand examining residual effects on cotton yield and soill properties[J].Journal of En ironmental Biology,2015,36(3):677.
[18] 杨延杰 王晓伟 赵康,等.邻苯二甲酸对萝卜种子萌发、幼苗叶片膜脂过氧化及渗透调节物质的影响[J].生态学报,2013,33(19):6 074-6 080.
[19] WANG J,CHEN G,CHRISTIE P,et al.Occurrence and risk assessment of phthalateesters (PAEs) in egetables and soils of suburban plastic film greenhouses[J].Science of the Total En ironment,2015,523:129-137.
[20] WANG Z,GERSTEIN M,SNYDER M.RNA-Seq:A re olutionary tool for transcriptomics[J].Nature Re iews Genetics,2009,10(1):57-63.
[21] AN LOON C D.The effect of water stress on potato growth,de elopment,and yield[J].American Journal of Potato Research,1981,58(1):51-69
[22] 秦军红.马铃薯对水分的响应及膜下滴灌技术增产机制的研究[D].呼和浩特:内蒙古农业大学,2013.
[23] KANEHISA M,ARAKI M,GOTO S,et al.KEGG for linking genomes to life and the en ironment[J].Nucleic Acids Research,2008,36:480-484.
[24] SHOWALTER A M.Structure and function of plant cell wall proteins[J].Plant Cell,1993,5(1):9-23.
[25] 裴丽丽,郭玉华,徐兆师,等.植物逆境胁迫相关蛋白激酶的研究进展[J].西北植物学报,2012,32(5):1 052-1 061.
[26] 黄国存,田波.高等植物中的谷氨酸脱氢酶及其生理作用[J].植物学通报,2001,18(4):396-401.
[27] GURAMRIT S,GABRIEL P,GENE W Y,The clothes make the mRNA:Past and present trends in mRNP fashion[J].Annual Re iew of Biochemistry,2015,84:325-354.
[28] SUN X,JONES W T,RIKKERINK E H.GRAS proteins:The ersatile roles of intrinsically disordered proteins in plant signalling[J].The Biochemical Journal,2012,442(1):1-12.
[29] ROXAS P,LODHI S A,GARRETT D K,et al.Stress tolerance in transgenic tobacco seedlings that o erexpress[J].Plant Cell Physiol,2000,41(11):1 229-1 234.
[30] SHI J,FU Z Y,PENG T,et al.Spermine pretreatment confers dehydration tolerance of citrus in itro plants ia modulation of antioxidati e capacity and stomatal response[J].Tree Physiology,2010,30(7):914-922.
[31] 金怡,刘合芹,汪得凯,等.植物光呼吸分子机制研究进展[J].中国农学通报,2011,27(3):233.
[32] FINNEGAN E,KO AC K.Plant DNA methyltransferases[J].Plant Molecular Biology,2000,43(2-3):189-201.
[33] LORIMER G.An early arabidopsis demonstration.Resol ing a few issues concerning photorespiration[J].Plant Physiology,2001,125(1):21.
[34] ERSLUES P E,KIM Y S,ZHU J K.Altered ABA,proline and hydrogen peroxide in an Arabidopsis glutamate:Glyoxylate aminotransferase mutant[J].Plant Molecular Biology,2007,64(1-2):205-217.
[35] 吴凡,徐德芳,宋少帅,等.小麦丙氨酸-乙醛酸转氨酶基因(TaADGT2)的克隆/生物信息学预测及表达分析[J].麦类生物学报,2019,3(8):895-902.
[36] MARTIN T J.Metabolism and function of poly amines in plants:Recent de elopment (new approaches)[J].Plant Growth Regulation,2001.34(1):135-148.
[37] ESPASANDIN F D, MAIALE S J,CALZADILLA P,et al.Transcriptional regulation of 9-cis-epoxycarotenoid dioxygenase (NCED) gene by putrescine accumulation positi ely modulates ABA synthesis and drought tolerance in Lotus tenuis plants[J].Plant Physiology and Biochemistry,2014,16(1):29-35.
[38] WI S J,KIM W T,PARK K Y.O erexpression of carnation S-adenosylmethionine decarboxylase gene generates a broad-spectrum tolerance to abiotic stresses in transgenic tobacco plants[J].Plant Cell Reports,2006,25(10):1 111-1 121.
[39] TANOU G,ZIOGAS ,BELGHAZI M,et al.Polyamines reprogram oxidati e and nitrosati e status and the proteome of citrus plants exposed to salinity stress[J].Plant Cell & En ironment,2013,37(4):846-885.
[40] NAYDENO M,BAE ,APOSTOLO A E,et al.High-temperature effect on genes engaged in DNA methylation and affected by DNA methylation in Arabidopsis[J].Plant Physiol Biochem,2015,87:102-108.
[41] DING H,GAO J,QIN C,et al.The dynamics of DNA methylation in maize roots under Pb stress[J].Int J Mol Sci,2014,15(12):23 537-23 554.
[42] YI H,LI L.DNA methylation changes in response to sulfur dioxide stress in Arabidopsis plants[J].Procedia En ironmental Sciences,2013,18:37-42.
[43] FINNEGAN E J,PEACOCK W J,DENNIS E.DNA methylation,a key regulation of plant de elopment and other processes[J].Curr Opion Genet De ,2000,10:217-223.
[44] ENDLER A,KESTEN C,SCHNEIDER R,et al.A mechanism for sustained cellulose synthesis during salt stress[J].Cell,2015,162(6):1 353-1 364.
[45] CROFT K P C,JUTTNER F,SLUSARENKO A J. olatile product of the lipoxygenase pathway e ol ed from Phaseolus ulgaris(L.) lea es inoculated with Pseudomonas syringae p phaseolicol[J].Plant Physiol,1993,101:13-24.
[46] NOORDERMEER M A,DIJKEN A J H ,SMEEKENS S C M,et al.Characterization of three cloned and expressed 13-hydroperoxide lyase isoenzymes from alfalfa with unusual N-terminal sequences and different enzyme kinetics[J].FEBS Lett,2000,267:2 473-2 482.
[47] 王延莉,曹阳,梁祎凡,等.乙酰辅酶 A 酰基转移酶 1 基因研究进展[J].中国畜牧,2019,55(10):42-46.
[48] 蒋科技,皮妍,侯嵘,等.植物内源茉莉酸类物质的生物合成途径及其生物学意义[J].植物学报,2010,45(2):137-148.
[49] 宋云,李林宜,卓凤萍,等.茉莉酸信号传导在植物抗逆性方面研究进展[J].中国农业科技导报,2015,17(2):17-24.
[50] DONG W, WANG M, XU F, et al.Wheat oxophytodienoate reductase gene TaOPR1 confers salinity tolerance ia enhancement of abscisic acid signaling and reacti e oxygen species sca enging[J].Plant Physiology,2013,161(3):1 217-1 228.
[51] 许奕, 徐碧玉,宋顺,等.香蕉茉莉酸合成关键酶基因 MaOPR 的克隆和表达分析[J].园艺学报,2013,2:237-246.
[52] 田英,刘廷旭,赵彩平,等.桃脂氧合酶基因的原核表达分析[J].西北植物学报,2011,3(3):499-503.
[53] HU T,ZENG H,HU Z,et al.O erexpression of the tomato 13-lipoxygenase gene tomloxD increases generation of endogenous jasmonic acid and resistance to cladosporium ful umand high temperature[J].Plant Molecular Biology Reporter,2013,31(5):1 141-1 149.
[54] SCHERERG F E,ARNOLD B.Inhibitors of animal phospholipase A2 enzymes are selecti e inhibitors of auxin-de-pendent growth:implications of for auxin-induced signal transduction[J].Planta,1997,202:462-469.
[55] CHANDRA S,HEINSTEIN P F,LOW P S.Acti ation of phospholipase A by plant defense elicitors[J].Plant Physiol,1996,110:979-986.
[56] CHAPMAN K D.Phospholipase acti ity during plant growth and de elopment and in response to en ironmental stress.Trends[J].Plant Sci,1998,3:131-140.
[57] YOUNG S,WANG X,LEACH J E.Changes in the plasma membrane distribution of rice phospholipase D during resistant interaction with Xanthomonas oryzae p [J].Plant Cell,1996,8:1 079-1 090.