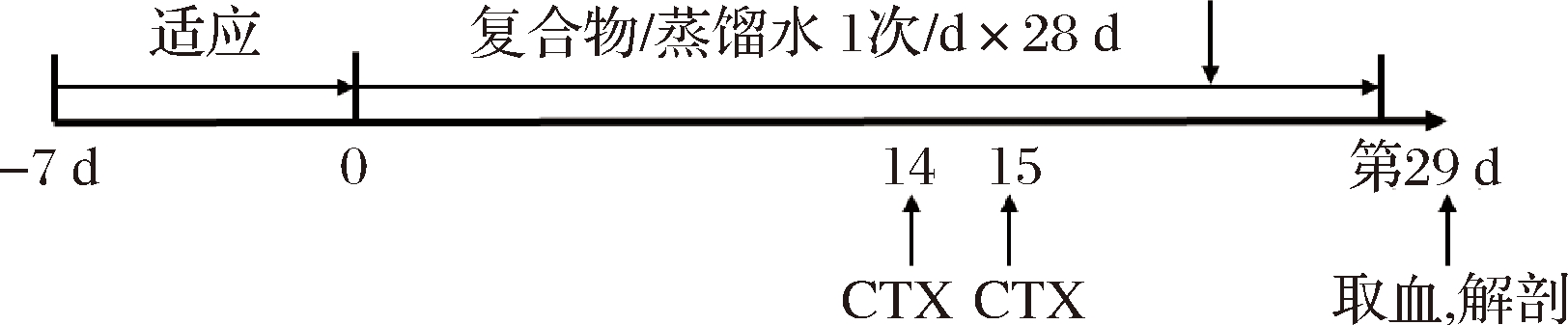
图1 实验日程计划
Fig.1 Experimental protocol
人体的免疫器官从出生开始发育,至青春期基本完善。人体的免疫系统由免疫器官、免疫细胞和免疫分子组成,与成人相比,儿童免疫系统有以下发育特点[1]:(1)非特异性免疫的屏障功能低下;(2)单核细胞因缺乏辅助因子,其趋化、吞噬、产生细胞因子和抗原提呈能力低下;(3)胸腺在发育过程中逐渐增大,到青春期才发育成熟,此过程中易发生细胞免疫缺陷[2-3]; (4)分泌免疫球蛋白G(immunoglobulin G,IgG)和免疫球蛋白A(immunoglobulin A,IgA)的B细胞数量分别在2岁和5岁时达到成人水平。上述特点均可造成幼儿免疫力低下。
锌是人体中含量仅次于铁的第二大微量金属元素,是蛋白质结构和功能的重要组成部分,是涵盖6大类(水解酶、转移酶、氧化还原酶、连接酶、裂解酶和异构酶)近2 000个酶的催化组件[4]。更重要的是,锌指转录因子能够激活下游基因转录,而锌对于维持锌指蛋白的结构至关重要[5]。因此,锌是RNA转录、细胞生长代谢等生理过程中必不可少的营养元素。据估计,全球缺锌的患病率为17%~20%,其中绝大多数发生在非洲和亚洲的发展中国家[6-7]。缺锌会导致免疫系统功能低下,表现为胸腺萎缩,淋巴细胞数量减少和淋巴细胞应答障碍[8]。因此在儿童生长过程中,锌对于免疫系统的发育是至关重要的。
微量元素在免疫反应的每个阶段都发挥着重要的协同作用,充足的剂量对维持屏障功能以及免疫细胞的正常功能至关重要。早在1753年就有文献记载,补充含丰富VC的柑橘水果的男性坏血病患者康复率较普通饮食患者有显著增高[9]。之后陆续有研究发现VC还可以促进免疫细胞分化和增殖[10-12],增强自然杀伤细胞(natural killer cell,NK)活性和趋化性[11,13-14],增强巨噬细胞的吞噬作用。此外VC还具有抑制活性氧生成,调节细胞因子分泌,清除坏死的中性粒细胞等多种提高免疫的功效[12]。然而,支持免疫功能所必需的每日VC起效量普遍高于目前推荐的膳食摄入标准,诸如有研究表明10~18岁的男性VC的摄入量往往达不到免疫系统发育要求[15],因此通过营养补充剂摄取充足的微量元素是促进免疫系统发育的有效途径。综上所述锌和VC单独摄取均有助于增强免疫功能。然而,对于儿童发育期间的免疫力低下问题,有关锌与VC复合作用的研究还较为匮乏。
环磷酰胺是化疗中常用的烷基化剂,具有骨髓抑制和细胞毒性,并且可以通过使辅助性T细胞1(thelper-1 cell,Th1)/辅助性T细胞2(thelper-2 cell,Th2)发生细胞偏倚,诱导免疫抑制[16-17]。还有研究表明,环磷酰胺可以通过抑制T细胞的增殖,降低Th1细胞分泌细胞因子(TNF-α、IFN-γ、IL-2、IL-12)和Th2细胞分泌细胞因子(IL-4、IL-6、IL-10)水平,诱导免疫抑制[18-19]。此外,环磷酰胺还可降低免疫球蛋白(IgA、IgM、IgG)及血清血红蛋白水平,导致脾脏和胸腺的损伤。
因此,本研究为了开发可作为功能食品成分的潜在免疫增强剂,基于幼龄小鼠,以环磷酰胺诱导免疫抑制动物模型,研究锌与VC复合配方在缓解免疫抑制功能方面的机制。
1.1.1 实验动物
BALB/c小鼠,3周龄,体重(13.13±2.0) g,由广东省医学实验动物中心提供,实验动物生产许可证号SCXK(粤)2013—0002,实验动物质量合格证号No.44007200058796。动物实验环境:广东省中医药工程技术研究院SPF级动物实验室,设施使用许可证号SYXK(粤)2015—0059。饲养条件为12 h/12 h明暗节律、温度22 ℃、相对湿度55%、换气次数16 次/h,小鼠自由摄食、饮水。
1.1.2 材料及试剂
VC(含量≥99%)和柠檬酸锌(锌含量≥31.5%)复合配方由仙乐健康科技股份有限公司提供。
ELISA试剂盒,天津安诺瑞康生物技术有限公司,抗体,Affymetrix Inc.公司。
JJ3000动物电子秤,G&G公司;Class II Type B2型生物安全柜,新加坡Esco公司;Cellometer Mini型自动细胞计数仪,美国Nexcelom公司;BSA224S型电子分析天平,德国Sartorius公司;5424型小型高速离心机,德国EPPendorf公司;Milli Q Plus型超级纯水仪,美国MilliPore公司;3111型CO2细胞培养箱、702型超低温冰箱、Varioskan Flash型全波长多功能酶标仪,美国Thermo公司;Cytomics FC500MPL型流式细胞仪,美国Beckman Coulter公司。
1.2.1 模型建立与分组
3周龄BALB/c小鼠36只,适应1周后随机分为空白组(control)、模型组(CTX)、复合配方组(CTX+complex),每组各12只,雌雄各半。饲养期间,小鼠自由进食、饮水。复合配方组按柠檬酸锌(以锌计)5.3 mg/(kg·d)、VC 50.5 mg/(kg·d)混合而成。复合配方组小鼠按照20 mL/(kg·d)的体积进行灌胃,空白组和模型组以等体积蒸馏水进行灌胃,每日灌胃1次,实验周期为28 d。在给药的第14天,模型组及复合配方组小鼠进行环磷酰胺[40 mg/(kg·d)]腹腔注射,连续注射2 d。在第29天,用戊巴比妥钠(50 mg/kg)麻醉后采血,采血后,在麻醉状态下颈椎脱臼法处死,摘取脏器组织(图1)。

图1 实验日程计划
Fig.1 Experimental protocol
1.2.2 取材
一部分全血在4 ℃ 7 500 r/min离心15 min,收集上清液用于检测血清IL-2、IL-4、TNF-α及IFN-γ含量,剩余全血在24 h内检测淋巴细胞数。
取血完毕后,完整解剖摘取胸腺、肝脏、脾脏,去除脂肪和筋膜组织后称重,并清点派氏结数量。取出靠近十二指肠段的空肠约5 cm,刮取肠黏膜内容物,溶于磷酸缓冲盐溶液(phosphate buffer saline,PBS)中,所得溶液用于分泌型免疫球蛋白A(secretory immunglobulin,SIgA)含量的测定。根据公式(1)~公式(3)计算胸腺系数、肝脏系数、脾脏系数:
胸腺系数![]()
(1)
肝脏系数![]()
(2)
脾脏系数![]()
(3)
1.2.3 脾脏细胞悬液制备方法
无菌取脾,置于盛有适量无菌Hank′s液的小平皿中,并在脾上面放置一块纱布,用大号注射器内芯轻轻将脾磨碎,制成单个细胞悬液。经200目筛网过滤,用Hank′s液洗2次,每次离心10 min(1 000 r/min)。弃上清将细胞浆弹起,加入0.5 mL灭菌水20 s,裂解红细胞后再加入0.5 mL 2倍Hank′s液及8 mL Hank′s液,1 000 r/min,离心10 min,然后将细胞悬浮于2 mL的完全培养液中,用全自动细胞计数仪计数脾细胞数量。
1.2.4 脾脏淋巴细胞检测
将脾脏淋巴细胞稀释至1×107 个/mL,取100 μL加入流式管中。在流式管中再加入CD3+、CD4+和CD8+单克隆抗体各2 μL,旋涡混匀,于4 ℃避光染色后,用PBS洗涤2次,弃去上清,再用PBS重悬细胞,使用流式细胞仪进行检测,检测结果用FlowJo软件进行分析。
1.2.5 NK细胞活性测定方法
取靶细胞(YAC-1细胞)和效应细胞(脾脏细胞)各100 μL(效靶体积比50∶1),加入U型96孔培养板中;靶细胞自然释放孔加靶细胞和培养液各100 μL,靶细胞最大释放孔加靶细胞和1%(体积分数)NP40或2.5%(体积分数)Triton各100 μL;上述各项均设3个复孔,于37 ℃、5%(体积分数)CO2培养箱中培养4 h,然后将96孔培养板以1 500 r/min离心5 min,每孔吸取上清100 μL置平底96孔培养板中,同时加入LDH基质液100 μL,反应3 min,每孔加入1 mol/L的HCl 30 μL,在酶标仪490 nm处测定光密度值(OD)。
NK细胞活性计算如公式(4)所示:
NK细胞活性![]()
(4)
1.2.6 溶血空斑数检测方法
参照《保健食品检验与评价技术规范》中方法取小鼠脾细胞进行溶血空斑试验[17]。
1.2.7 外周血淋巴细胞
全血在24 h内用全血细胞分析仪检测淋巴细胞数。
1.2.8 外周血细胞因子及SIgA检测
血清和肠黏膜内容物溶液采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA) 测定。按照说明书取适量血清(无需稀释)和肠黏膜内容物溶液按说明书要求用量依次加入ELISA微孔板中。将微孔板置于37 ℃保温箱中孵育60 min后弃去孔中液体并反复冲洗5次,充分拍打弃尽孔中残液。分别向孔中依次加入TMB Ⅰ和TMB Ⅱ各50 μL,室温下避光反应20 min,加入终止液50 μL,充分混匀,终止反应。使用酶标仪在450 nm下读取各孔吸光度。
使用SPSS 20.0软件进行数据分析,采用单因素方差分析进行差异分析,判断出方差齐性时采用Bonferroni分析,方差不齐时采用Dunnett T3分析。统计结果均以均数±标准差(mean±SD)表示。当P<0.05时,说明数据具有统计学差异。
如表1所示,小鼠体重、肝脏质量、肝脏系数各组间无显著差异。模型组对比空白组,小鼠的脾脏质量有减轻趋势;脾脏系数显著降低;复合配方组有缓解脾脏系数降低的趋势,与空白组和模型组比较均无显著差异。模型组胸腺质量和胸腺系数较空白组均显著降低,复合配方组显著缓解了环磷酰胺造成胸腺质量及胸腺系数降低。以上结果表示锌加VC复合配方部分缓解了环磷酰胺造成的免疫器官萎缩。
表1 锌加VC复合配方对小鼠体重及免疫器官重量的影响
Table 1 The effect of zinc and VC compound formula on body weight and viscera coefficient in immature mice

体重/g肝脏质量/g脾脏质量/g胸腺质量/g肝脏系数脾脏系数胸腺系数control25.44±3.10.97±0.140.10±0.020.07±0.023.81±0.370.40±0.080.28±0.05CTX23.87±2.40.98±0.150.07±0.010.04±0.01*4.12±0.560.30±0.04*0.15±0.04*CTX+complex23.33±2.90.91±0.140.08±0.020.07±0.01#3.88±0.280.36±0.070.29±0.07#
注:n=12/组; *, Control vs CTX, P<0.05;#, CTX vs CTX+Complex, P<0.05
如图2所示,与空白组相比,模型组外周血中的Th1细胞因子IL-2、TNF-α、IFN-γ,Th2细胞因子IL-4在外周血中的含量均显著降低;与模型组相比,复合配方组中IL-2和TNF-α的含量显著升高,IFN-γ含量呈上升趋势;而复合配方组外周血中IL-4的含量,与空白组相比显著降低,和模型组相比无显著差异(图2-d)。
以上结果表明锌加VC复合配方抑制了环磷酰胺造成的Th1细胞因子分泌障碍,对Th2不起效果。

a-IL-2;b-TNF-d;c-IFN-γ;d-IL-4
图2 锌加VC复合配方对外周血细胞因子含量的影响
Fig.2 The effect of zinc and VC compound formula on cytokines content in immature mice serum
注:n=12/组; *, P<0.05; **, P<0.01; ***,P<0.001(下同)
如图3-a所示,标记脾脏T细胞数量的CD3+比例在模型组显著降低,但由于复合配方的摄入得到显著恢复。标记辅助性T细胞的CD3+、CD4+、CD8-比例,对比空白组,模型组显著降低;对比模型组,复合配方组显著升高(图3-b)。标记细胞毒性T细胞的CD3+、CD4-、CD8+比例,对比空白组,模型组有降低趋势但无显著差异;复合配方组对比空白组和模型组未见显著差异(图3-c)。
以上结果表明锌加VC复合配方通过抑制辅助性T细胞的减少,缓解了环磷酰胺诱导的脾脏T细胞减少。
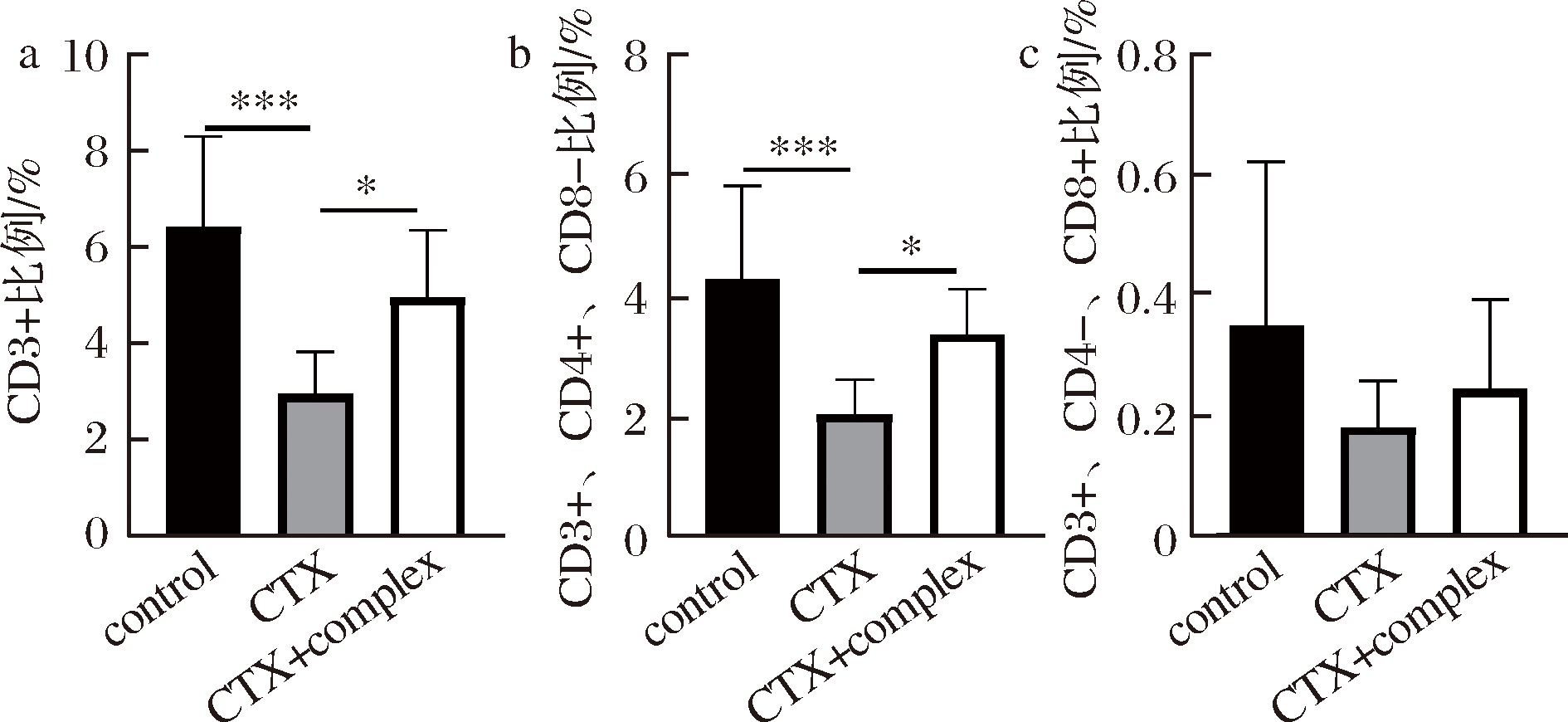
a-CD3+比例;b-CD3+、CD4+、CD8-比例;c-CD3+、CD4-、CD8+比例
图3 锌加VC复合配方对脾脏T细胞含量的影响
Fig.3 The effect of zinc and VC compound formula on T cells content in immature mice spleen
如图4所示,与空白组比较,复合配方组和模型组的脾脏NK细胞的活性显著下降,且复合配方组和模型组之间无显著性差异。
以上结果表明锌加VC复合配方未能有效逆转环磷酰胺诱导的NK细胞活性降低。
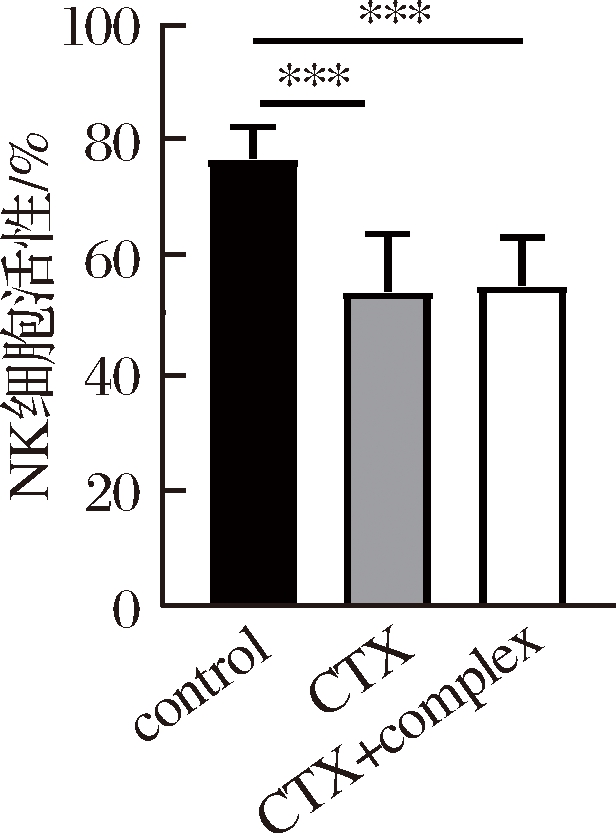
图4 锌加VC复合配方对幼龄小鼠脾脏NK
细胞活性的影响
Fig.4 The effect of zinc and VC compound formula on NK cells activity in immature mice spleen
肠道中B细胞重要的生发中心派氏结的数量如图5-a所示,对比空白组,模型组显著减少;对比模型组,复合配方组显著增多。表明B细胞功能的溶血空斑数于模型组显著降低,由于复合配方的摄入显著回升(图5-b)。维持肠道黏膜稳态的重要物质SIgA同样在模型组显著降低,但由于复合配方的摄入得到部分回升(图5-c)。
以上结果表明锌加VC复合配方有效抑制了环磷酰胺造成的肠道B细胞功能障碍。
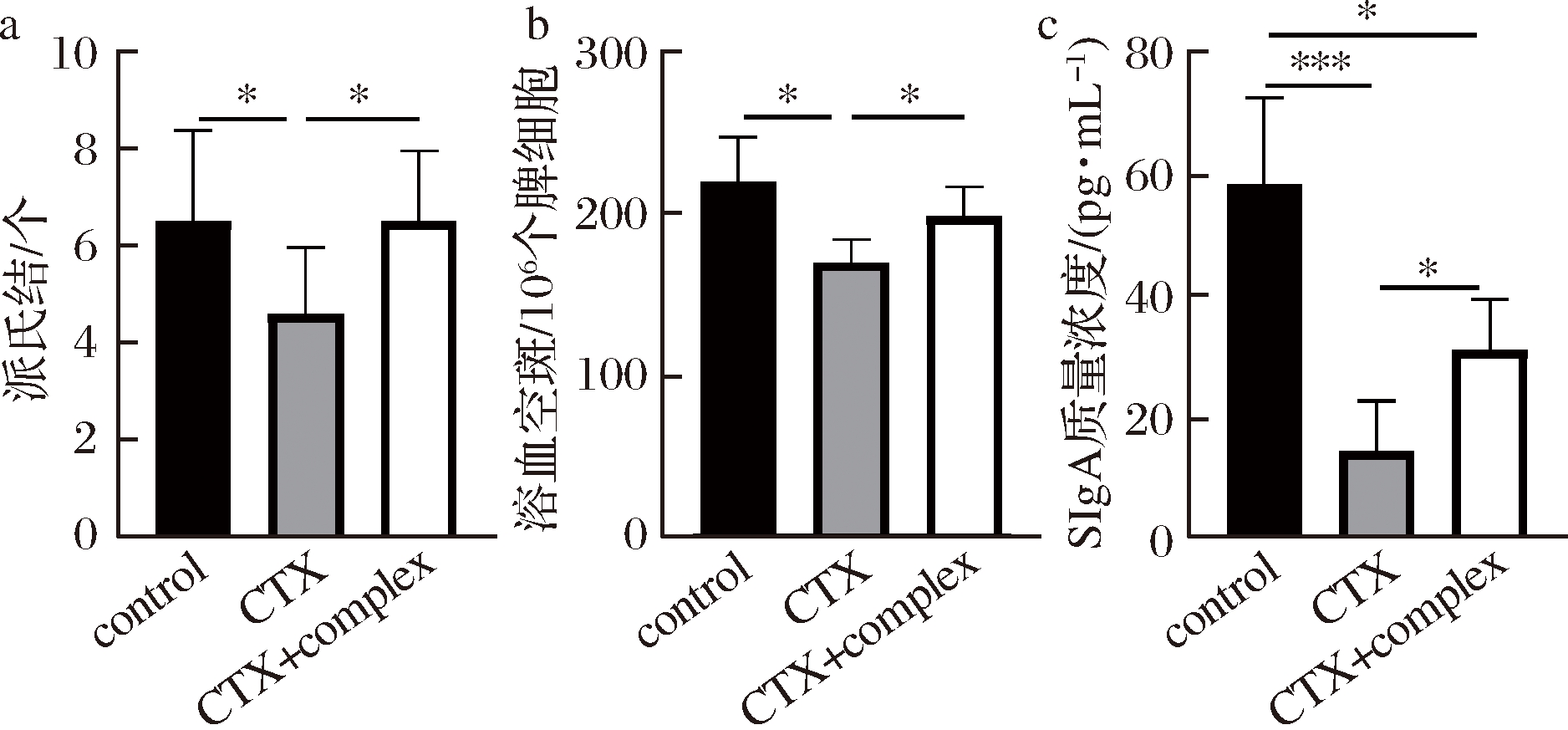
图5 锌加VC复合配方对肠道B细胞功能的影响
Fig.5 The effect of zinc and VC compound formula on B cells function in immature mice intestine
外周血淋巴细胞增殖如图6所示,对比空白组,模型组和复合配方组显著降低,且模型组和复合配方组未见显著差异。
以上结果表明锌加VC复合配方未能逆转环磷酰胺诱导的外周血淋巴细胞增殖障碍。

图6 锌加VC复合配方对淋巴细胞增殖的影响
Fig.6 The effect of zinc and VC compound formula on proliferation ability of lymphocytes in immature mice serum
锌和VC在自然界中分布广泛,工业生产成熟、成本低廉,并且二者功能繁多,因此作为营养补充剂的重要功效成分被广泛应用。然而,将锌与VC联用以抵抗儿童青少年发育期间的免疫力低下,目前还未发现相关研究。本研究首次发现锌加VC复合配方具有逆转环磷酰胺诱导的幼龄小鼠免疫力低下的作用。
环磷酰胺是一种广泛应用于各种癌症治疗的临床化疗药物,也是一种免疫抑制的诱导剂,可以通过破坏脾脏和胸腺功能来诱导免疫抑制。胸腺是T细胞分化场所,胚胎时期开始形成,出生后完成分化,于青春期达到活动高峰,之后开始萎缩,因此青春期是胸腺发育,建立T细胞库的重要时期。本研究结果显示锌加VC复合配方显著逆转了环磷酰胺诱导的幼龄小鼠胸腺萎缩。T细胞分化成熟后经循环系统分布至外周免疫器官。其中Th1和Th2细胞分泌的不同类型的细胞因子是决定细胞功能的重要因素。Th1细胞分泌IL-2、TNF-α和IFN-γ,参与细胞免疫应答[20-21]。IFN-γ是一种天然免疫介质,通过激活单核/巨噬细胞促进主要组织相容性复合配方分子的表达[22-23]。IL-2由活化的T淋巴细胞产生,可诱导未成熟T细胞的生长、增殖和分化为效应T细胞[24]。TNF-α由T细胞、B细胞、NK细胞和巨噬细胞产生,通过抑制细菌感染和抑制急性应激来调节炎症和宿主防御[25]。我们的研究结果发现外周血中Th1分泌的细胞因子IL-2、TNF-α、IFN-γ含量也由于锌加VC复合配方的摄入恢复至接近正常水平。然而由Th2细胞分泌的细胞因子IL-4并未由于摄入复合配方而得到恢复。Th1和Th2细胞均是由前体细胞Th0极化而来,Th0细胞受某一种亚群极化受细胞因子、抗原种类及浓度、抗原呈递细胞(antigen-presenting cells,APC)类型等多种因素的影响[26]。有文献报道,锌可以通过上调Th1细胞分泌细胞因子,增强Th1细胞应答,并促进Th0向Th1极化[11]。还有研究表明IFN-γ可以活化巨噬细胞为专职APC,当巨噬细胞为专职APC时,会促进Th0向Th1极化。与此同时IFN-γ还可以通过抑制IL-4的表达,抑制Th0向Th2极化[27]。因此我们推测有可能是由于复合配方介导IFN-γ促进了Th0向Th1的极化,并抑制了IL-4的分泌。当IL-2、IFN-γ细胞因子上调时会加速抗原向T细胞呈递,激活CD4+T细胞。与此相对应,本研究的结果证明了锌加VC复合配方通过逆转环磷酰胺诱导的脾脏中CD3+T细胞和CD4+T细胞比例的减少,使脾脏辅助型T细胞数量显著回升。因此,我们推测锌加VC复合配方通过促进Th1细胞的免疫应答,逆转环磷酰胺诱导的免疫抑制。
除了辅助型T细胞以外,细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)和NK细胞是存在于脾脏中参与早期免疫应答的2种主要淋巴细胞,CTL细胞和NK细胞被细胞因子和趋化因子激活,在调节肿瘤生长和转移以及消除病毒[28]中发挥核心作用。我们的实验结果显示锌加VC复合配方对缓解环磷酰胺造成的脾脏CTL细胞数量减少和NK细胞活性降低均无显著的影响。有研究报道人体在摄取500 mg/d VC的条件下会有效提升体内CTL细胞数量和NK细胞活性[29],在我们的实验中,每只小鼠每天摄入VC的含量为50 mg/kg,相当于人类250 mg/d,因此我们推测CTL细胞数量及NK细胞活性的恢复有可能依赖于VC的摄取量。
肠道黏膜免疫系统是一个结构独立、功能复杂的免疫网络。派式结是肠道B细胞的生发中心,聚集了大量的活化B细胞,涵盖了人体近80%的浆母细胞和浆细胞,生成大量的SIgA[30]。IgA是人体内含量最多的免疫球蛋白,有着中和毒素、细菌或病毒,补体活化的作用。近年来,大量研究报道,天然提取物可通过促进IgA、IgM和IgG的产生来增强体液免疫[31]。我们的结果表明,锌和VC复合配方可以提高环磷酰胺诱导的免疫抑制小鼠B细胞的活性,同时提升肠道SIgA含量。这一结果表明锌和VC复合配方在增强体液免疫应答中发挥了作用。
成熟血细胞如白细胞、红细胞和血小板是由造血干细胞产生的,这些造血干细胞具有多能性和自我再生能力。有研究表明环磷酰胺降低了白细胞、中性粒细胞数量,杀伤增殖期的淋巴细胞,减少循环系统中的淋巴细胞数目。本研究结果发现,环磷酰胺治疗降低了外周血中淋巴细胞的增殖,与之前报道一致[32]。但锌加VC复合配方摄入后淋巴细胞的增殖能力并未得到显著恢复。在今后的实验规划中,我们将检测外周血中红细胞、白细胞、血小板、中性粒细胞数量以及骨髓红细胞、中性粒细胞、巨核细胞的数量,以明确此锌加VC复合配方是否对环磷酰胺诱导的骨髓抑制有影响。
综上所述,我们的结果初步验证了锌加VC复合配方通过促进Th1细胞的免疫应答和提升肠道B细胞功能,增强体液免疫应答逆转由环磷酰胺诱导的免疫抑制(图7)。
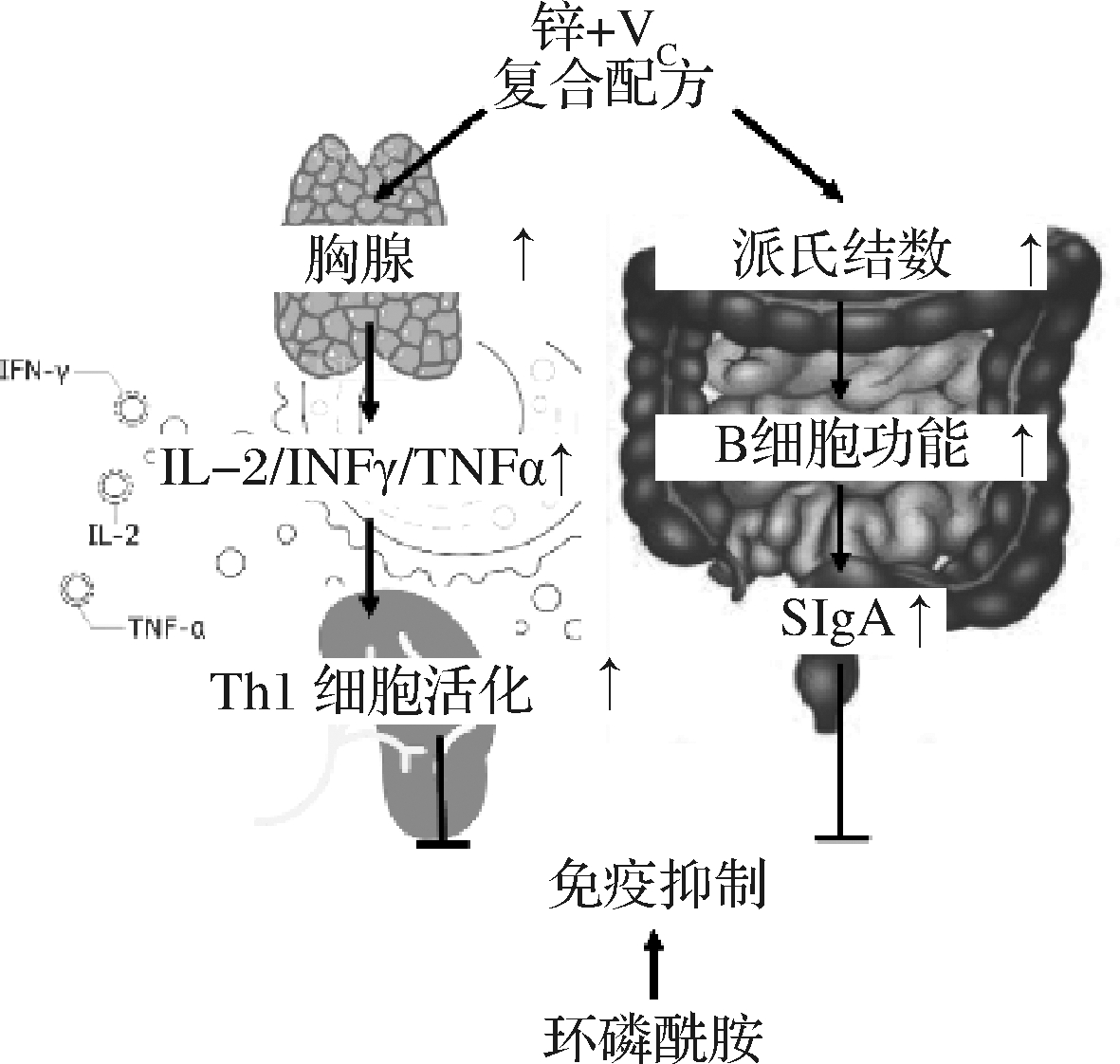
图7 锌加VC复合配方逆转环磷酰胺诱导的免疫抑制示意图
Fig.7 The schematic of reversion of cyclophosphamide-induced immunosuppression by zinc and VC compound formula
提升儿童免疫力,综合强化儿童及青少年的身体健康素质一直是为社会所聚焦的公共卫生问题。上海交通大学医学院儿童医学中心童世庐团队对2 143例新冠肺炎患儿进行统计研究,结果表明中度患者占38.8%,儿童重症和危重症的病例为5.9%。除了疫情的影响,许多难民儿童也长期面临着生活卫生条件差、营养不良、传染性疾病、疫苗接种活动推迟等一系列灾难性健康影响。因此开发一种价格低廉,可以大规模生产的营养补充剂以提高儿童的基础免疫力可以在一定程度上缓解社会医疗压力,为儿童的健康提供保障。因此为开发切实有效的可以提高免疫力的营养补充剂提供充分的理论依据,对于实现全球性健康是至关重要的。
[1] HOLSAPPLE M P, PAUSTENBACH D J, CHARNLEY G, et al. Symposium summary: Children′s health risk—what′s so special about the developing immune system? [J]. Toxicology & Applied Pharmacology, 2004, 199(1):61-70.
[2] 曹雪涛, 医学免疫学[M]. 7版. 北京:人民卫生出版社,2018:16.
[3] GHIA C J, NAIK M, VED J, et al. Age and the immune system[J]. The Journal of the Association of Physicians of India, 2015,63(4):17-18.
[4] ANDREINI C, BERTINI I. A bioinformatics view of zinc enzymes[J]. Journal of Inorganic Biochemistry, 2012,111:150-156.
[5] LAMBERT S A, JOLMA A, CAMPITELLI L F, et al. The human transcription factors[J]. Cell, 2018,175(2):598-599.
[6] WESSELLS K R, BROWN K H. Estimating the global prevalence of zinc deficiency: Results based on zinc availability in national food supplies and the prevalence of stunting[J]. Plos One,2012,7(11): e50 568.
[7] KUMSSA D B, JOY E J M, ANDER E L, et al. Dietary calcium and zinc deficiency risks are decreasing but remain prevalent[J]. Scientific Reports, 2015,5:10 974.
[8] SHANKAR A H, PRASAD A S. Zinc and immune function: The biological basis of altered resistance to infection[J]. The American Journal of Clinical Nutrition,1998,68(2):447-463.
[9] BARTHOLOMEW M. James lind′s treatise of the scurvy(1753) [J]. Postgraduate Medical Journal. 2002,78:695-696.
[10] MAGGINI S, PIERRE A, CALDER P C. Immune function and micronutrient requirements change over the life course[J]. Nutrients,2018,10(10):1 531.
[11] HARYANTO B, SUKSMASARI T, WINTERGERST E, et al. Multivitamin supplementation supports immune function and ameliorates conditions triggered by reduced air quality[J]. Vitamins & Minerals,2015,4:1-15.
[12] CARR A C, MAGGINI S. Vitamin C and immune function[J]. Nutrients. 2017,9(11):1 211.
[13] MAGGINI S, BEVERIDGE S, SORBARA P J P, et al. Feeding the immune system: The role of micronutrients in restoring resistance to infections[J]. CAB Reviews,2008,3:1-21.
[14] WU D, LEWIS E D, PAE M, et al. Nutritional modulation of immune function: Analysis of evidence, mechanisms, and clinical relevance[J]. Frontiers in Immunology. 2019,9:3 160.
[15] ELMADFA I, MEYER A, NOWAK V, et al. European nutrition and health report[M]. Karger Medical and Scientific Publishers, 2009, 62:1-405.
[16] PASS G J, CARRIE D, BOYLAN M, et al. Role of hepatic cytochrome p450 s in the pharmacokinetics and toxicity of cyclophosphamide: Studies with the hepatic cytochrome p450 reductase null mouse[J]. Cancer Research. 2005,65(10):4 211-4 217.
[17] 中华人民共和国卫生部. 保健食品检验和技术规范(2003年版)[M]. 北京:中华人民共和国卫生部,2003,700-704.
[18] TRIPATHI D N, JENA G B. Intervention of astaxanthin against cyclophosphamide-induced oxidative stress and DNA damage: A study in mice[J]. Chemico-biological Interactions, 2009,180(3):398-406.
[19] ZHOU Y L, CHEN X Y, YI R K, et al. Immunomodulatory effect of tremella polysaccharides against cyclophosphamide-induced immunosuppression in mice[J]. Molecules,2018,23(2):239.
[20] YU Q, NIE S P, WANG J Q, et al. Chemoprotective effects of Ganoderma atrum polysaccharide in cyclophosphamide-induced mice[J]. International Journal of Biological Macromolecules, 2014,64:395-401.
[21] MCALEER J P, VELLA A T. Understanding how lipopolysaccharide impacts CD4 T-cell immunity[J]. Critical Reviews in Immunology, 2008,28(4):281-299.
[22] CONNOR T J, BREWER C, KELLY J P, et al. Acute stress suppresses pro-inflammatory cytokines TNF-alpha and IL-1 beta independent of a catecholamine-driven increase in IL-10 production[J]. Journal of Neuroimmunology, 2005,159(1-2):119-128.
[23] KAIKO G E, HORVAT J C, BEAGLEY K W, et al. Immunological decision-making: How does the immune system decide to mount a helper T-cell response[J]. Immunology, 2008,123(3):326-338.
[24] SCHRODER K, HERTZOG P J, RAVASI T, et al. Interferon-gamma: An overview of signals, mechanisms and functions[J]. Journal of Leukocyte Biology, 2004,75(2):163-189.
[25] GIAI C, GONZALEZ C, LEDO C, et al. Shedding of tumor necrosis factor receptor 1 induced by protein a decreases tumor necrosis factor alpha availability and inflammation during systemic Staphylococcus aureus infection[J]. Infection and Immunity, 2013,81(11):4 200-4 207.
[26] SPELLBERG B, EDWARDS J E. Type 1/Type 2 immunity in infectious diseases[J]. Clinical Infectious Diseases, 2001, 32:76-102.
[27] LIU Y J. Dendritic cell subsets and lineages, and their functions in innate and adaptive immunity[J]. Cell, 2001, 106:259-262.
[28] KOS F J, ENGLEMAN E G. Immune regulation: A critical link between NK cells and CTLs[J]. Immunology Today, 1996, 17(4):174-176.
[29] EMIL W P, KENNETH O, TOBIAS I, et al. Effect of vitamin supplementation on cytokine response and on muscle damage after strenuous exercise[J]. American Journal of Physiology-Cell Physiology. 2001, 280(6):570-575.
[30] ZHANG P, TEY S K, KOYAMA M, et al. Induced regulatory T cells promote tolerance when stabilized by rapamycin and IL-2 in vivo[J]. The Journal of Immunology, 2013,191(10):5 291-5 303.
[31] SCHROEDER H W, CAVACINI L. Structure and function of immunoglobulins[J]. Journal of Allergy and Clinical Immunology,2010,125(2):41-52.
[32] DAVIS L, KUTTAN G. Effect of Withania somnifera on cytokine production in normal and cyclophosphamide treated mice[J]. Immunopharmacology and Immunotoxicology,1999,21(4):695-703.