我国甘薯资源丰富,种植面积和产量均位居世界第一[1]。甘薯运输以常温物流为主,然而常温条件下甘薯极易发芽[2],且品质破坏较大。商家只有在上货架前先进行手工剪芽处理再销售,浪费了大量人工及时间成本。甘薯块根生长的芽由不定芽原基发育而成,是幼芽的基础组织,起源于薯块的中柱鞘或韧皮部的薄壁细胞,通过分裂发育成为芽的生长点,再长大成为幼芽,且发生位置无规律[3],甘薯一旦离开低温环境,芽原基分生组织将利用其他组织中的营养物质,继续进行一定程度的生长和发育,进而造成甘薯本身品质下降如出现凹痕、商品性大打折扣等,缩短甘薯寿命[4]。
目前应用较为广泛的抑芽技术有3-氯氨基甲酸异丙基酯(chlorpropham,CIPC)和辐照技术。CIPC作为马铃薯抑芽剂在许多国家得到应用[5],但研究表明CIPC会分解成苯胺类衍生物,对人体有毒甚至是致癌作用[6]。辐照技术作为一种安全的抑芽技术,被美国食品药物管理局允许使用,然而在我国由于需要到指定地点处理,操作不便,较难推广使用。因此,研究一种安全有效且便于我国推广使用的甘薯抑芽技术就显得十分必要。
热处理作为一种物理保鲜技术,已在多种果蔬上广泛应用,目前热处理抑芽机理尚不清楚,推测有可能是高温破坏了薯块的中柱鞘或韧皮部的薄壁细胞从而实现甘薯抑芽。有研究表明长期高温胁迫对抗氧化系统产生不利影响,尤其是抗氧化酶会降低活性甚至失活,导致 H2O2含量增加、脂质过氧化及蛋白氧化,氧化胁迫加剧均会引起细胞的死亡[7]。乙烯是一种简单的不饱和烃,它是一种天然的植物生长调节剂,且成本低,安全性好,在马铃薯[8]、洋葱[9]等果蔬中的研究表明,乙烯能够抑制发芽,外源乙烯通过影响贮藏期间马铃薯块茎糖代谢途径中酸性转化酶、蔗糖合成酶、蔗糖磷酸合成酶等多种酶的活性影响块茎的生长发育进程, 从而影响马铃薯的休眠与发芽[10]。目前热处理以及外源乙烯技术在甘薯抑芽方面及品质控制方面的研究较为匮乏,而这两项技术具有绿色安全且便于在我国推广应用的优点。目前对甘薯抑芽方面的研究较少,且主要针对的是15 ℃左右的贮藏环节,对常温物流中甘薯发芽的文献极少。本文研究热处理和外源乙烯对常温物流的甘薯抑芽及品质控制的差异,为技术的推广应用提供科学依据。
从重庆市北碚天生农贸市场购得的同批新鲜甘薯,品种为“红心王”;标准邮政6号纸箱,尺寸为260 mm×150 mm×180 mm,结构为3层普通B瓦楞。
外源乙烯(乙烯利,有效成分20%),山东营养源食品科技有限公司;酒石酸钾钠、乙酸铅、Na2SO4、无水乙酸钠、聚乙二醇6000、邻苯二酚、亚铁氰化钾、2,6-二氯靛酚、抗坏血酸,成都市科龙化工试剂厂;乙酸乙酯,重庆川东化工集团有限公司;TritonX-100,重庆北碚化学试剂厂;蒽酮,国药集团化学试剂有限公司;其余试剂均为实验室常用试剂,所有试剂等级为分析纯。
CheckMate 3.0顶空气体分析仪,美国膜康;HWS人工气候箱,宁波东南仪器;H1650R高速冷冻离心机,湖南湘仪;UV-2450PC紫外可见分光光度计,日本岛津;DHG-9240A电热恒温鼓风干燥箱,上海-恒科学仪器;HH-2数显恒温水浴锅,常州澳华仪器。
挑选大小一致,无发芽,破皮少,两端完整的甘薯进行处理。将甘薯洗净后再用体积分数为75%的酒精擦拭表面,晾干后备用。根据实验室前期预实验结果,确定热处理和乙烯处理条件。将甘薯随机分成3组:(1)CK组:不作任何处理,自然晾干装箱;(2)热处理组:50 ℃热水浸泡20 min,流动常温水冲洗10 min冷却降温,自然晾干装箱;(3)乙烯处理组:自然晾干装箱时,在纸箱中放入一定量乙烯利,使乙烯质量浓度为1 g/L。每组3 000 g左右,设置3个重复。最后把包装后的甘薯放入人工气候箱中,模拟常温物流环境,在25 ℃、RH 85%~95%的条件下贮藏18 d。每隔2 d随机取样1次,测定各项指标。
1.4.1 腐烂率
甘薯的腐烂率等于腐烂甘薯的数量与甘薯总个数的百分比,每组甘薯总数为30个。
1.4.2 硬度
用GY-4型果实硬度计测定,探头直径为3.5 mm,垂直于待测甘薯表面,匀速将压头压入果实内10 mm,读取电子屏幕示数,即甘薯的硬度值,每组随机取3个甘薯,每组3个平行。测定记录甘薯赤道部位5个不同位置的硬度,计算平均值及标准差。
1.4.3 呼吸强度
参考程曦[11]的方法,并稍作修改。先用顶空气体分析仪测定空气中的CO2含量,每组随机取质量600 g左右的甘薯,每组3个平行,置于干燥皿中密封,在室温下静置1 h后,再用顶空气体分析仪测定干燥皿中的CO2含量,计算其呼吸强度。
1.4.4 可溶性糖
参考曹建康[12]的方法,并稍有改动。称取1.0 g甘薯鲜样,加入5 mL蒸馏水研磨成匀浆转至试管,再加10 mL水,封口于沸水中煮沸30 min,过滤,收集滤液并回收残渣,重复提取2次,最后过滤合并滤液定容于100 mL容量瓶。在试管中加入0.5 mL样品提取液、1.5 mL蒸馏水和0.5 mL蒽酮-乙酸乙酯试剂,最后加入5 mL浓H2SO4,摇匀后于沸水中保温1 min,待自然冷却后于630 nm处测定吸光度。
1.4.5 淀粉含量
称取5.0 g甘薯鲜样,按照GB 5009.9—2016《食品中淀粉的测定》测定甘薯淀粉含量。
1.4.6 感官评定
根据甘薯行业标准NY/T 2642—2014《甘薯等级规格》进行评定,对甘薯的新鲜度、表皮是否皱缩、发芽、有无霉斑等感官情况进行评估。
1.4.7 发芽率
发芽率计算如公式(1)所示:
发芽率![]()
(1)
1.4.8 抗坏血酸(VC)含量
称取1.0 g甘薯鲜样,按照GB 5009.86—2016《食品中抗坏血酸的测定》测定甘薯VC含量。
1.4.9 多酚氧化酶(polyphenol oxidase,PPO)活性
参考DONG等[13]方法,并稍作修改。称取1.0 g甘薯鲜样,置于预冷的研钵中,加入5.0 mL提取缓冲液,在冰浴条件下将其研磨成匀浆,于4 ℃、12 000 r/min离心30 min,收集上清液即为酶提取液。往试管中加入4.0 mL 0.05 mol/L、pH 5.5的乙酸-乙酸钠缓冲液和1.0 mL 0.05 mmol/L邻苯二酚溶液,最后加入100 μL酶提取液。记录在410 nm处的吸光度值变化,测定3 min,重复3次。1个PPO酶活性单位定义为引起每分钟吸光度变化0.01的量,用U表示。
1.4.10 过氧化物酶(peroxidase,POD)活性
参考DONG等[13]方法,并稍作修改。称取1.0 g甘薯鲜样,置于预冷的研钵中,加入5.0 mL提取缓冲液,在冰浴条件下将其研磨成匀浆,于4 ℃、12 000 r/min离心30 min,收集上清液即为酶提取液。往试管中加入3.0 mL 0.025 mol/L愈创木酚溶液和500 μL酶提取液,再加入200 μL 0.5 mol/L H2O2溶液,迅速混合反应。记录在470 nm处的吸光度值变化,测定3 min,重复3次。1个POD酶活性单位定义为引起每分钟吸光度变化0.01的量,用U表示。
采用Excel 2016进行数据整理,以SPSS 18采用单因素方差分析法进行显著性分析[14],显著水平为0.05,极显著水平0.01。用Origin 8.6制图。
微生物感染通常是甘薯采后腐烂的主要原因,通过适当的愈伤处理和贮藏可以降低甘薯的腐烂率。如图1所示,甘薯的腐烂率都逐渐增加。前3 d,各组甘薯均无腐烂。从第6天开始,CK组甘薯开始腐烂,并随着物流时间的延长腐烂率持续升高,在6~18 d一直显著高于处理组(P<0.05),这可能与甘薯呼吸强度升高后包装环境中出现凝结水,促进了微生物的繁殖有关。0~18 d,热处理组和乙烯处理组腐烂率无显著差异(P>0.05),尽管乙烯处理后甘薯呼吸强度增加,但是乙烯可能诱导了甘薯相关防御酶的活性,从而增强了甘薯的防御机制,保护甘薯不受侵染。梁元凯等[15]用252 mg/L乙烯处理黄瓜,得出乙烯能诱导几丁质酶活性升高从而抵抗真菌和细菌入侵的结论。但到第18天时,乙烯处理组和热处理组的腐烂率相差近5%。结果表明,乙烯处理对甘薯的防腐效果要优于热处理。
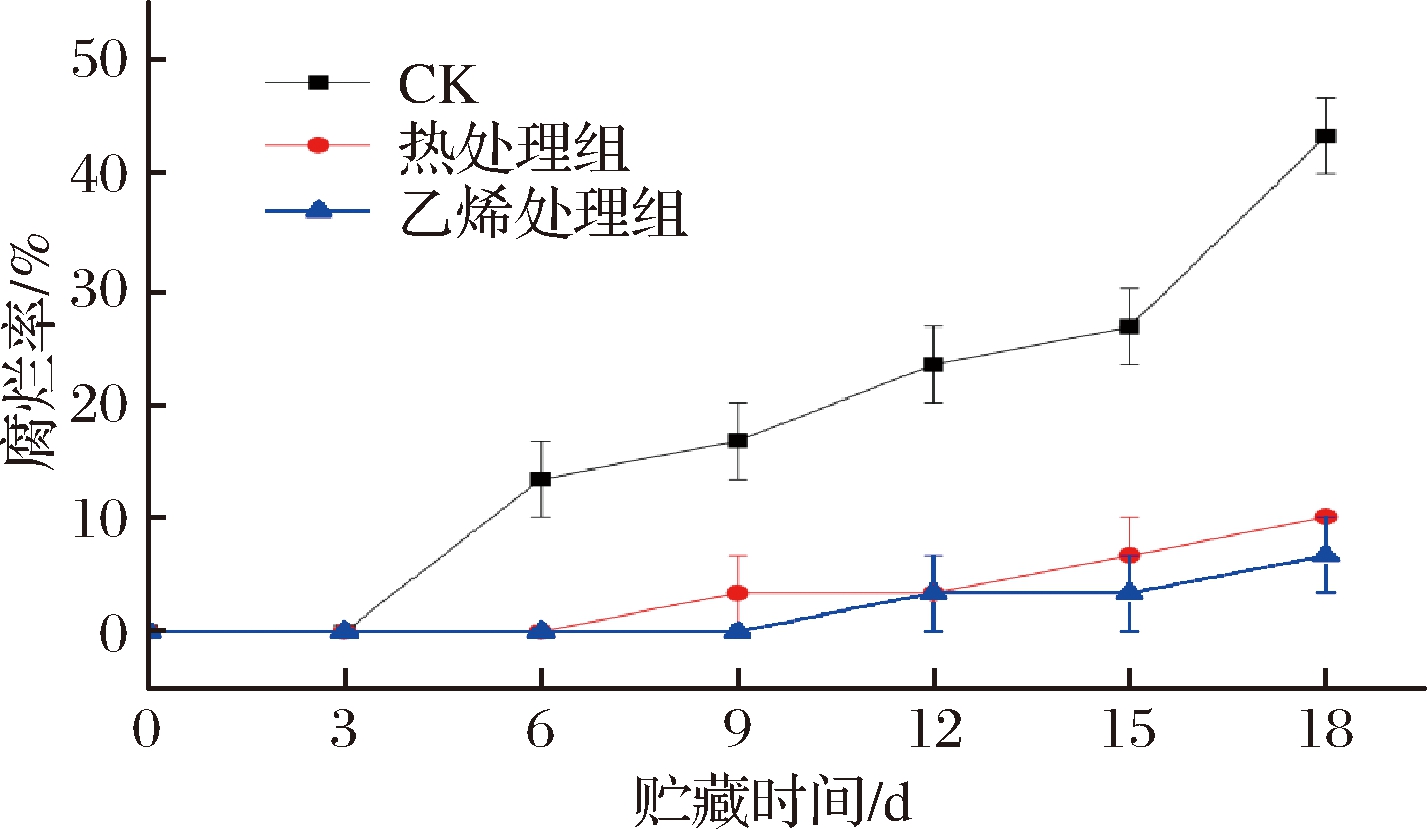
图1 乙烯处理、热处理对甘薯腐烂率的影响
Fig.1 Effect of ethylene treatment and heat treatment on the decay rate of sweet potato
如图2所示,各组甘薯硬度不断下降。热处理组硬度始终显著高于CK组和乙烯组(P<0.05)。0~3 d,热处理组呈上升趋势,而乙烯处理组与CK组均下降,这或许与热处理组甘薯呼吸强度较弱,生命活动旺盛程度不如其他2组有关。物流时间越长,乙烯处理组甘薯的硬度越低,显著低于CK组(P<0.05),这可能是由于乙烯处理组的呼吸速率一直处于较高水平,加速了甘薯成熟,激活了细胞壁降解酶活性,进而促进果胶的分解[16]。综上可知,乙烯处理加速了甘薯软化,相反热处理可以保持甘薯较高的硬度值。DOKE等[17]用500、750和1 000 mg/L的乙烯处理芒果,也得出乙烯降低硬度的结论,对香蕉[18]、杏[19]的处理也得出相似结论。
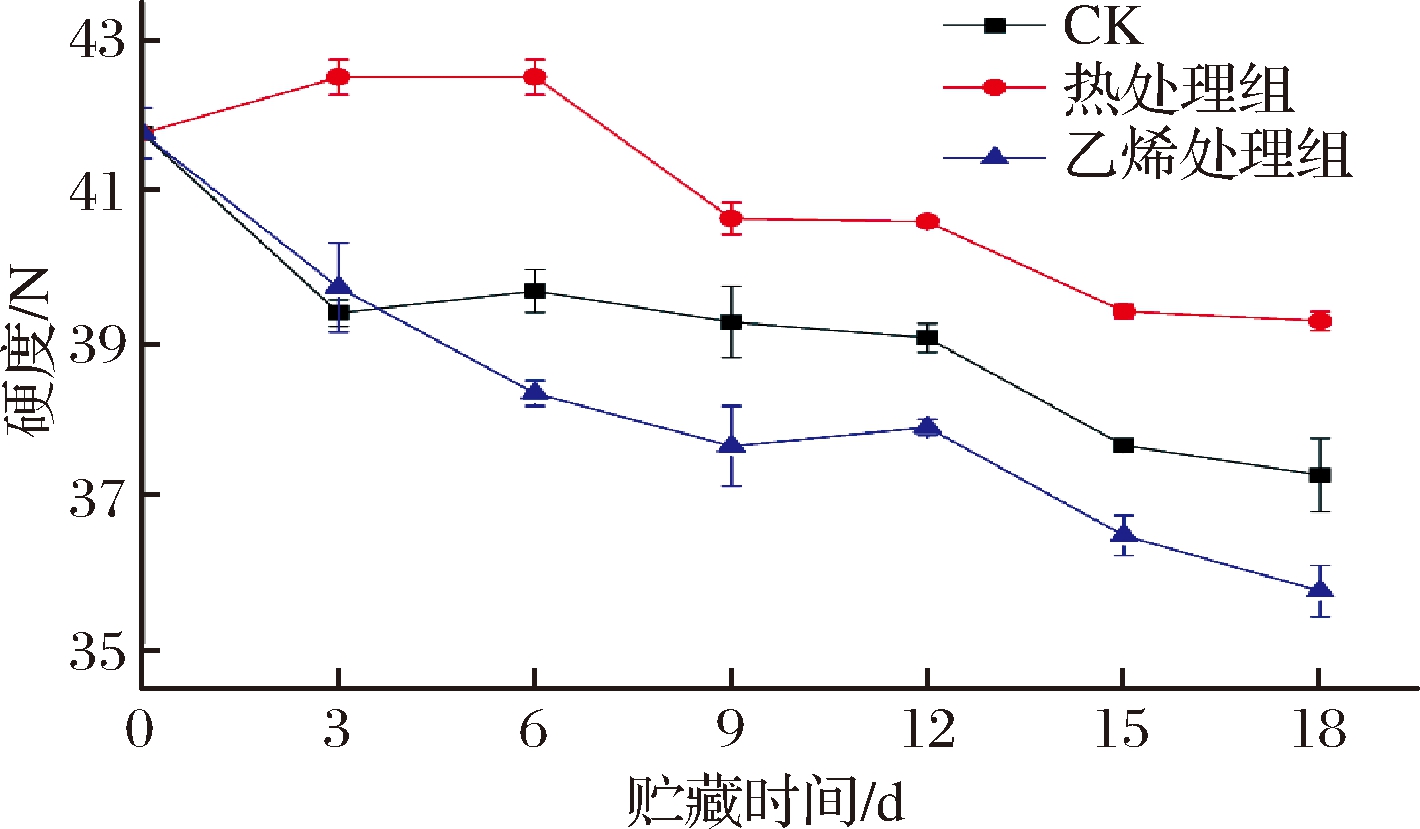
图2 乙烯处理、热处理对甘薯硬度的影响
Fig.2 Effect of ethylene treatment and heat treatment on hardness of sweet potato
由图3可知,各组甘薯呼吸强度呈先上升后下降的趋势。各组甘薯在第3天到达呼吸峰值,乙烯处理组极显著高于热处理组和CK组(P<0.01),分别是CK组和热处理的1.84倍、2.09倍,说明乙烯诱导了甘薯块根呼吸强度的增加,这可能与乙烯促进果蔬成熟有关[20]。而热处理减缓了甘薯呼吸速率的升高,整个物流过程中呼吸强度最低。MORGADO等[21]研究得出,使用非致死温度进行热处理会对果蔬产生适度的压力,导致新陈代谢的暂停,使呼吸速率降低。各组呼吸速率在3~18 d不断下降,在第9天时乙烯组下降至与CK组无显著差异(P>0.05),但2组依然显著高于热处理组(P<0.05)。在12~18 d三组呼吸速率趋于稳定,CK组与热处理组之间差异不显著(P>0.05)。综上可知,乙烯处理提升了甘薯的呼吸速率,热处理则抑制了甘薯呼吸强度的增加。
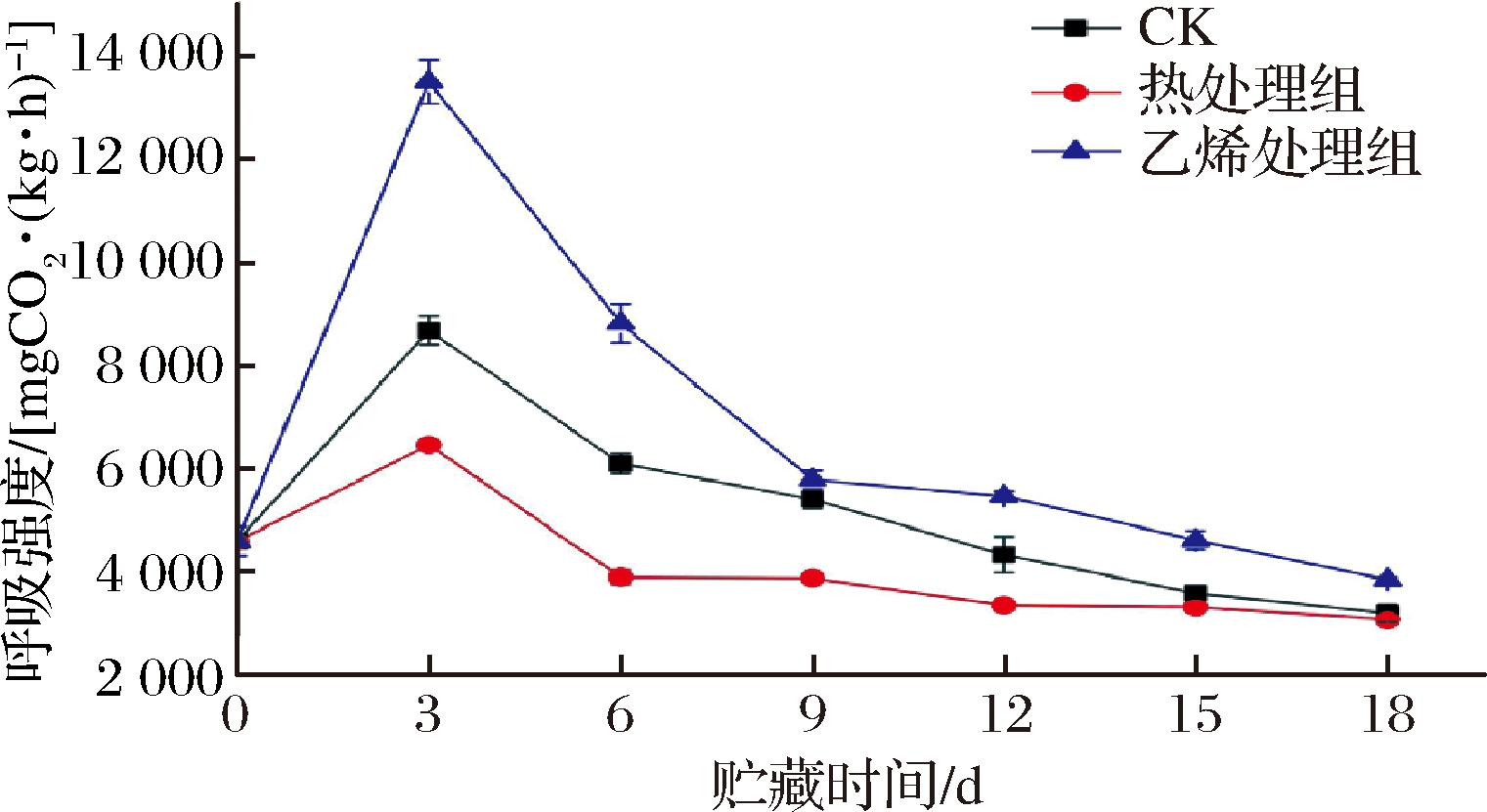
图3 乙烯处理、热处理对甘薯呼吸强度的影响
Fig.3 Effect of ethylene treatment and heat treatment on respiratory strength of sweet potato
可溶性糖是甘薯的食用品质之一,与其独特的风味紧密相关。如图4所示,CK组和乙烯处理组可溶性糖含量呈上升趋势,热处理组则先下降后上升。0~6 d,热处理组可溶性糖含量不断减少,蒋侬辉等[22]用50 ℃热水处理板栗也得出一致结论,并表明可溶性糖含量的增加与淀粉的水解都是由于淀粉酶活性增加产生的结果,热处理能够降低淀粉酶的活性。0~18 d,乙烯组的可溶性糖含量最高,其次为CK组,热处理组最低。到物流结束时,乙烯处理组可溶性糖含量高达13.16%,CK组为12.46%,热处理组仅为8.51%。乙烯处理后甘薯可溶性糖含量增加可能与其旺盛的呼吸作用消耗有关;刘少茹等[23]将甘薯置于17 ℃条件下贮藏,发现甘薯淀粉含量与可溶性糖含量呈负相关,与本研究结果相似。但是在本研究中的常温环境下,甘薯极易发芽,需要消耗内部营养物质,淀粉与糖类之间的转化关系还需深入探究,不能一概而论。总之,乙烯处理能够维持甘薯较高的可溶性糖含量,相反热处理则使可溶性糖含量处于较低水平。
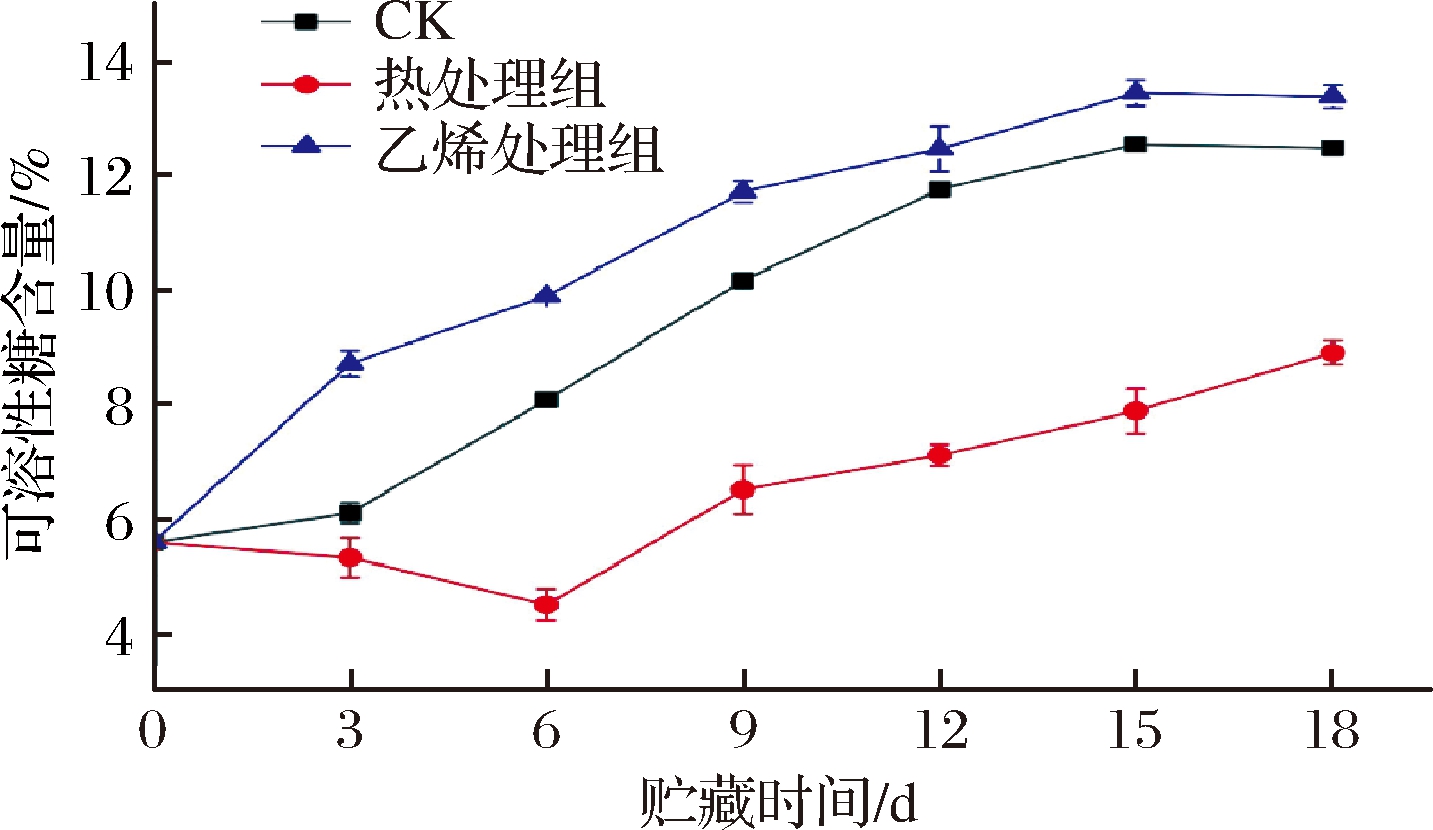
图4 乙烯处理、热处理对甘薯可溶性糖含量的影响
Fig.4 Effect of ethylene treatment and heat treatment on soluble sugar content of sweet potato
由于甘薯块根中淀粉含量高,甘薯可作为碳水化合物的主要来源。在甘薯收获后,光合作用的淀粉形成进程停止,块根组织开始依赖于自身的内部储备能量,因此,甘薯的淀粉含量对于其贮藏寿命是至关重要的。如图5所示,热处理组甘薯淀粉含量先上升后下降,而乙烯处理组和CK组呈下降趋势。热处理组淀粉含量在第6天达到物流期间最大值,随后开始减少。热处理组淀粉含量始终最高,从第6天开始与其余2组表现出极显著差异(P<0.01),这可能与热处理阻碍了淀粉的水解有关[24]。CK组和乙烯处理组的淀粉含量则随着物流的进行持续减少,CK组和乙烯处理组分别从初始值12.63 g/100g下降至10.43 g/100g、10.04 g/100g。据RAY等[25]报道,在甘薯采后贮藏期间淀粉含量普遍下降,这主要是因为甘薯呼吸作用和蒸腾作用共同进行。0~9 d,乙烯处理组淀粉含量显著低于CK组。由图5可看出CK组和乙烯处理组甘薯的呼吸速率偏高,淀粉作为呼吸作用基质,含量下降,且乙烯处理组低于CK组。结果表明,热处理组能够有效保持甘薯的淀粉含量,相反地,乙烯处理组加速了淀粉的消耗。
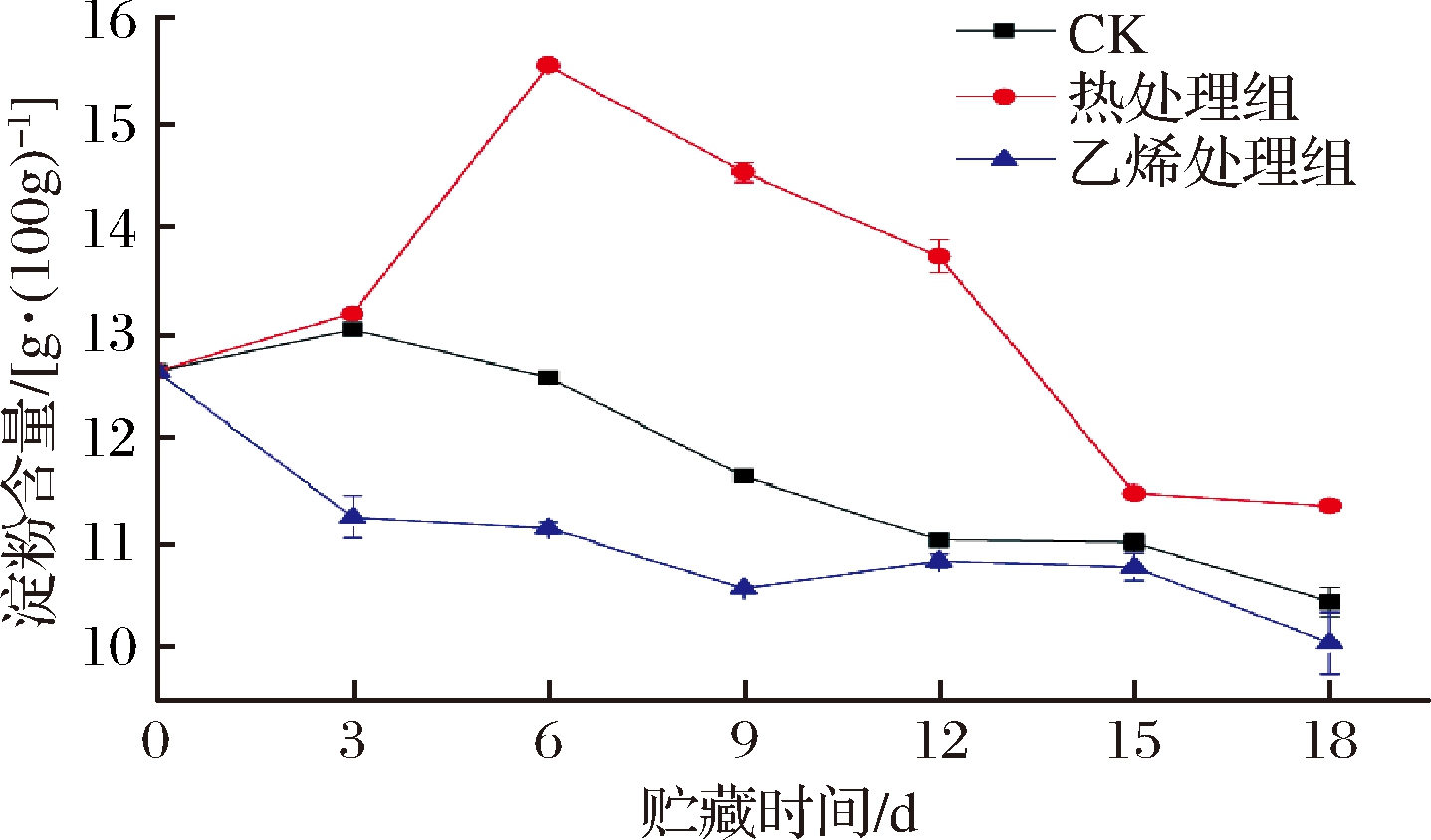
图5 乙烯处理、热处理对甘薯淀粉含量的影响
Fig.5 Effect of ethylene treatment and heat treatment on starch content of sweet potato
如图6所示,各组甘薯感官评分随着物流时间的增加不断下降。0~3 d,处理组评分显著高于CK组(P<0.05),这可能是由于物流前3 d CK组甘薯呼吸强度和蒸腾作用强,包装箱内出现凝结水,加之甘薯本身的破皮损伤,有助于微生物的繁殖,出现极少霉斑。第6天,各组甘薯均开始出现皱缩现象,3组之间评分差异不显著(P>0.05)。到第9天时,CK组甘薯出现发芽,感官评分下降加剧,并伴随着表皮皱缩,评分最高的乙烯组为7.30分,其次为热处理组6.47分,CK组最低5.30分,3组之间差异显著(P<0.05)。9 d后,热处理组甘薯皱缩情况越来越严重,这可能与热处理对甘薯表皮造成一定的损伤有关,失重率不断增加。CK组在第12天时失去商品性,热处理组在物流最后一天失去商品性,乙烯处理组在整个物流期间一直保持着较好的商品价值。综上可知,乙烯处理和热处理有助于甘薯商品性的保持,能够保持较高的感官评分,但乙烯处理维持甘薯商品性的时间更长。
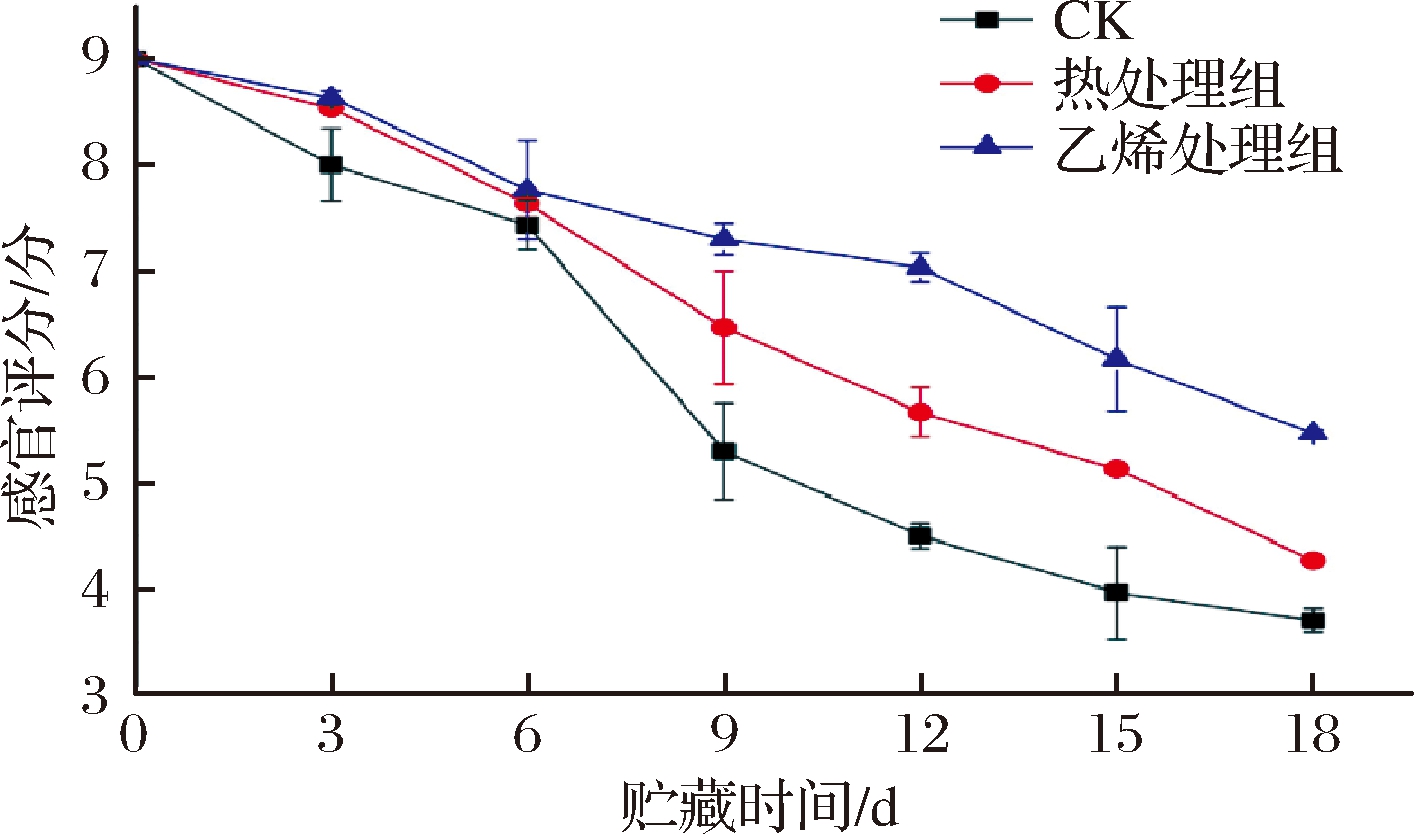
图6 乙烯处理、热处理对甘薯感官评分的影响
Fig.6 Effect of ethylene treatment and heat treatment on sensory score of sweet potato
甘薯来源于热带,当温度高于15 ℃时则刺激芽苗的生长[2],尤其是在高湿度的条件下。如图7所示,甘薯发芽率呈持续上升趋势。0~6 d,处理组均无甘薯发芽,而CK组第6天发芽率已经达到13.33%。第9天,热处理组开始有甘薯发芽,但发芽率显著低于CK组(P<0.05);此时,乙烯组甘薯仍没发芽。直到第12天,乙烯处理组甘薯开始萌芽,发芽率与热处理组之间差异不大(P>0.05),但两者都显著低于CK组(P<0.05),并将显著性差异延续到物流结束。物流结束时,CK组甘薯发芽率最高,高达53.33%,其次为热处理组,乙烯处理组最低。研究得出,乙烯处理和热处理都能抑制甘薯发芽,乙烯处理抑芽效果略好于热处理。
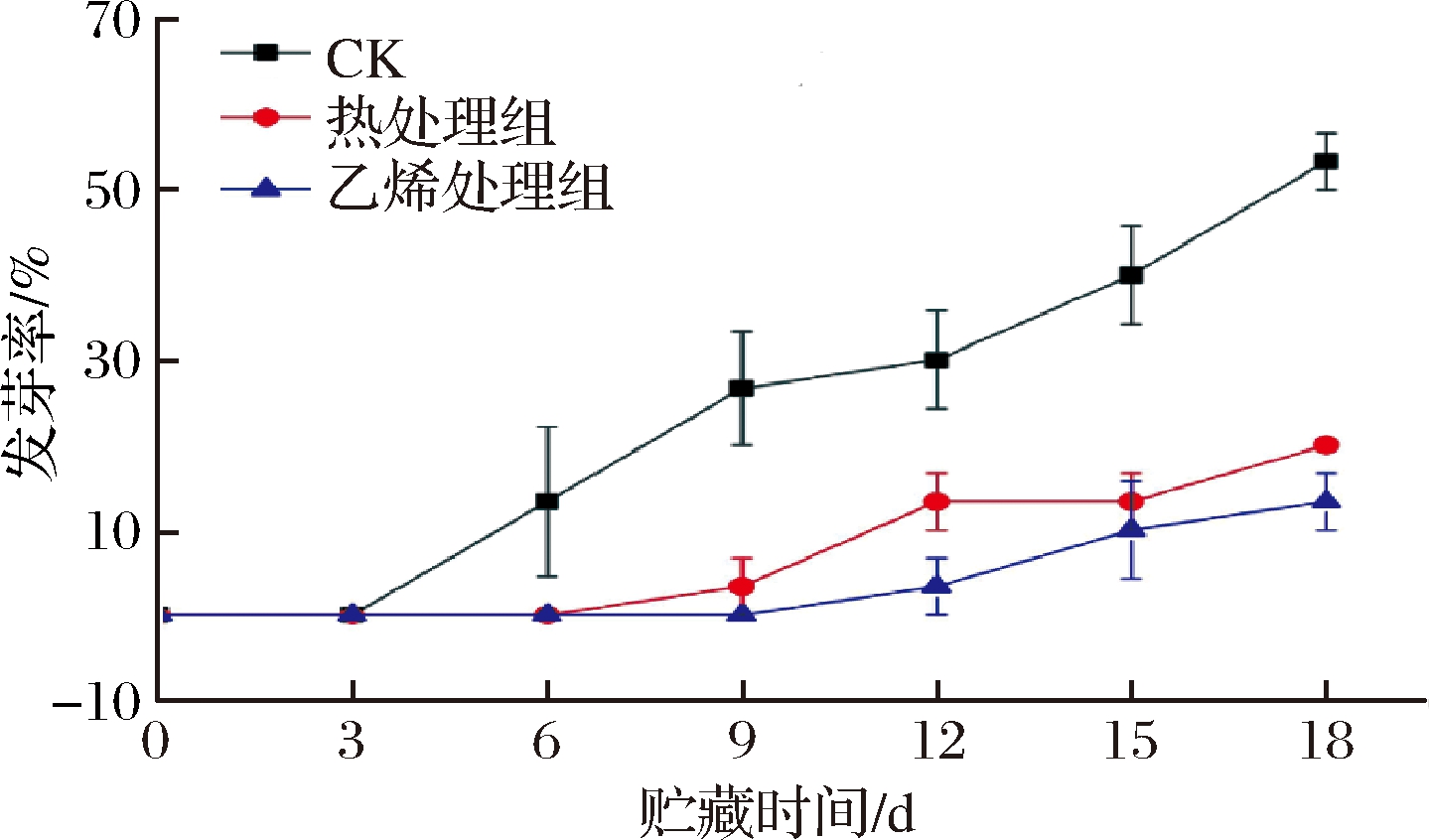
图7 乙烯处理、热处理对甘薯发芽率的影响
Fig.7 Effect of ethylene treatment and heat treatment on sprouting of sweet potato
甘薯是抗坏血酸的良好来源。如图8所示,各组甘薯的VC含量呈下降趋势。0~6 d,各组VC含量差异不显著(P>0.05)。第6天后,CK组VC含量大幅下降,开始显著低于2个处理组P<0.05),这可能与甘薯开始发芽有关。PETT等[26]在马铃薯的发芽研究中发现,一旦可见的芽苗开始生长,VC含量就迅速下降甚至消失。相比CK组,处理组VC含量下降缓慢,在9~18 d处理组VC含量显著高于CK组(P<0.05),其中在12~15 d热处理组又显著高于乙烯处理组(P<0.05),这与热处理组较低的呼吸强度密不可分;热处理组VC含量始终最高。XANTHAKIS等[27]表明,果蔬贮藏过程中抗坏血酸降解的主要原因可归结为酶促氧化反应,热处理可能通过降低抗坏血酸氧化酶活性,延缓VC含量的降低。RAFFO等[28]对辣椒进行热处理后,发现热处理后的辣椒VC含量更高。总而言之,热处理和乙烯处理均可以延缓甘薯VC含量的减少,但是热处理效果更佳。
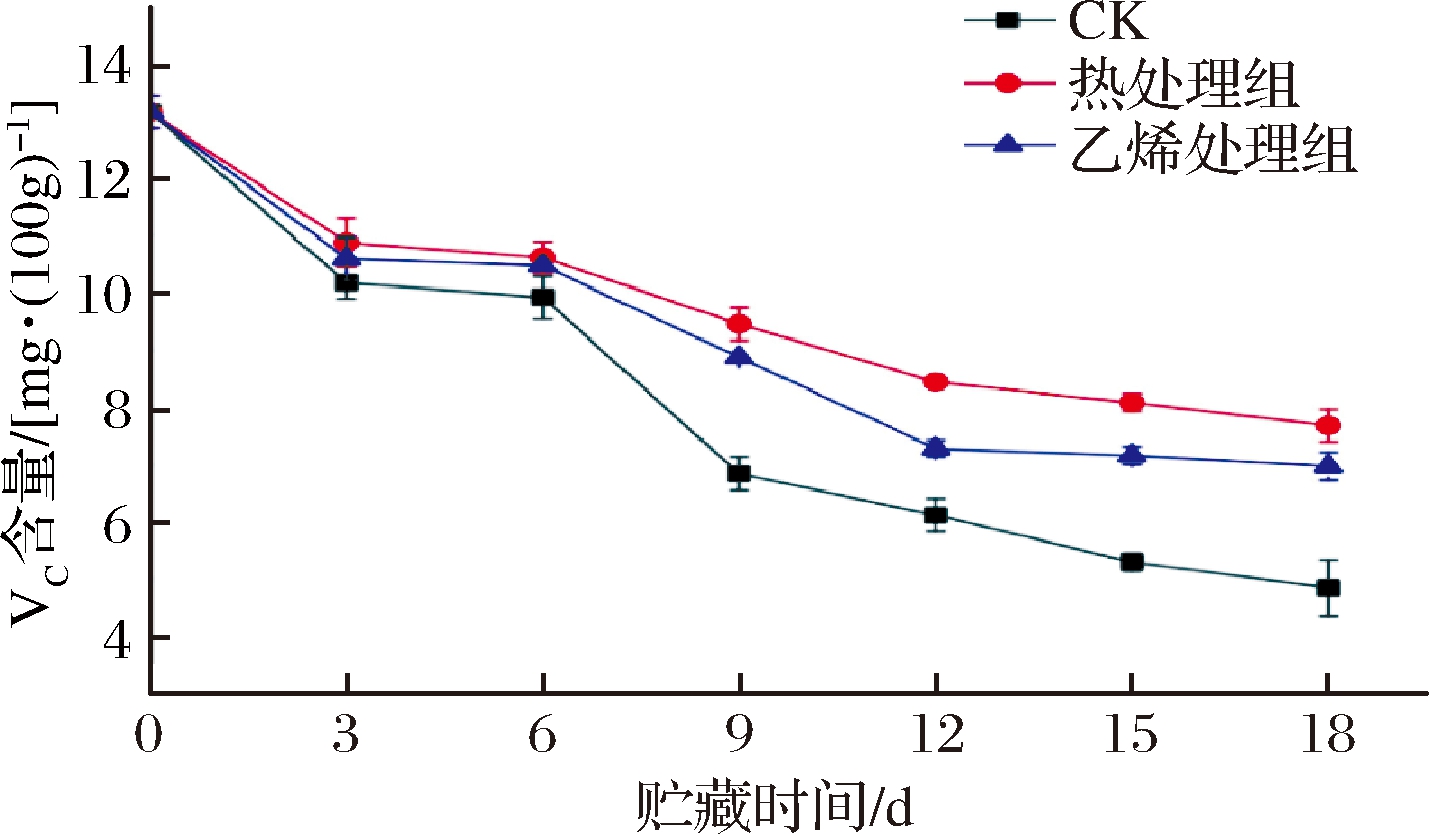
图8 乙烯处理、热处理对甘薯VC含量的影响
Fig.8 Effect of ethylene treatment and heat treatment on VC content of sweet potato
如图9所示,各组甘薯PPO活性都呈先上升后下降的趋势。0~6 d,各组PPO活性大幅增加。第6天时,处理组PPO活性达到物流期间最大值,显著高于CK组(P<0.05);尤其是乙烯处理组,PPO活性值分别是CK组和热处理组的3.87倍和2.62倍,极显著高于CK组和热处理组(P<0.01)。整个物流期间,乙烯处理组PPO活性一直显著高于其余2组(P<0.05),表明乙烯能够诱导甘薯PPO活性。而生鲜甘薯PPO活性强弱与木质层形成紧密相关,PPO可催化酚类物质合成木质素所需要的前体物质[29],如催化香豆酸转化成咖啡酸, 参与木质素的合成[30],其活性的提高有助于甘薯木质化,维持甘薯的硬度以及增强抗病性[31]。6~18 d,处理组PPO活性开始下降,但仍高于CK组。综上可知,2种处理方法中乙烯处理更能够提高甘薯PPO活性。这与EOLINI等[32]发现PPO编码基因的转录对抑制马铃薯发芽的碘蒸汽处理有响应,对块茎的抑芽过程伴随着PPO mRNA水平的短暂增加的现象符合。
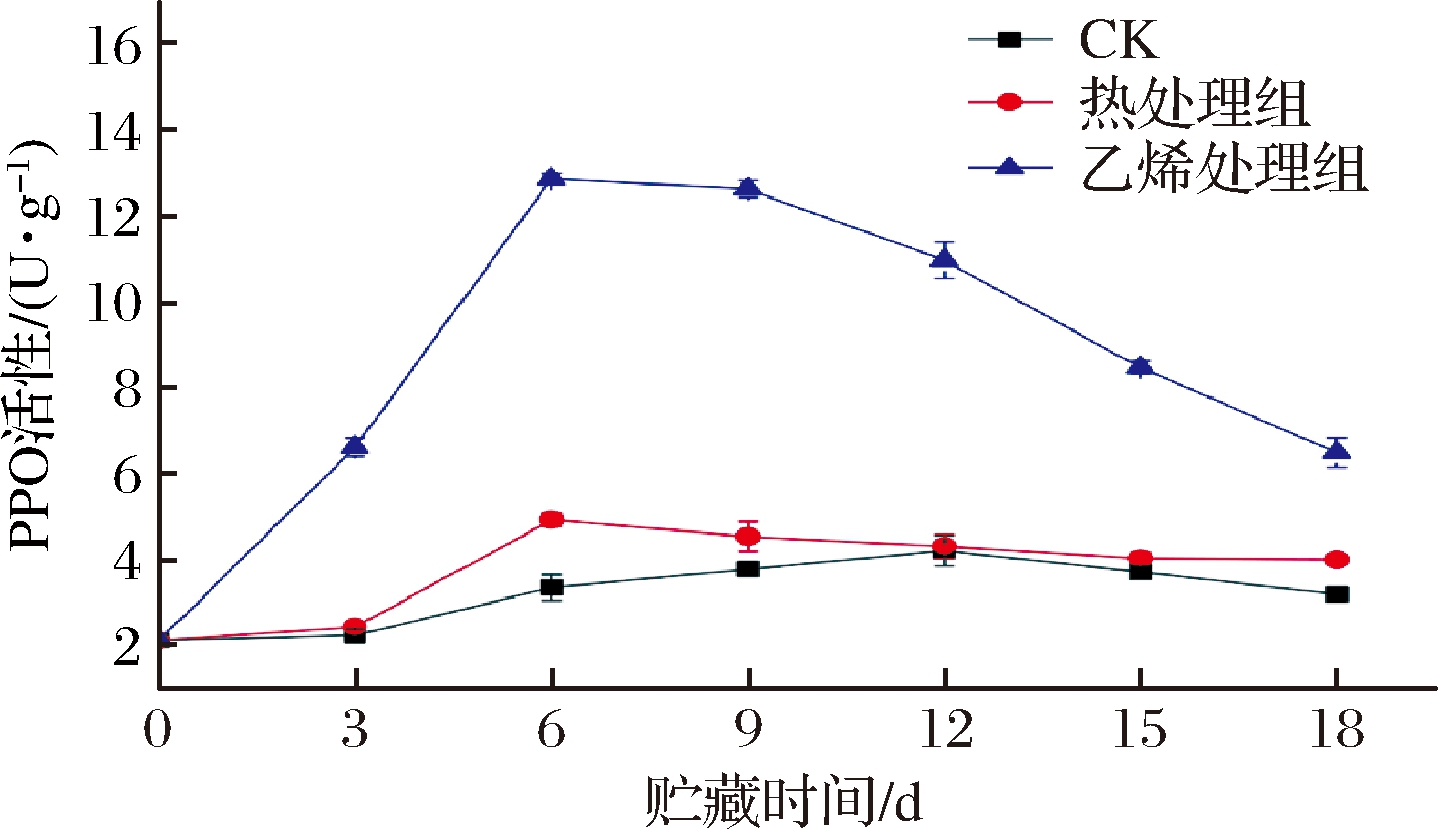
图9 乙烯处理、热处理对甘薯PPO活性的影响
Fig.9 Effect of ethylene treatment and heat treatment on PPO activity of sweet potato
如图10所示,各组甘薯POD活性呈上升趋势。乙烯处理组POD活性上升最快,在第3天就已高达25.93 U/g,极显著高于CK组和热处理组(P<0.01),并将显著性差异维持至物流结束。LUO等[33]研究表明木质素含量与POD活性呈正相关,罗程印等[34]则得出POD活性由于促进木质素的形成,与果蔬的抗病性表现出正相关关系,而乙烯处理可能通过促进甘薯POD活性的增加,在木质素生物合成的过程中POD催化H2O2的分解, 聚合木质素单体, 促进组织木质素的合成进而提高木质素含量以增强其抗病性[35]。0~15 d热处理组与CK组差异不大。15天后CK组POD活性开始降低,而热处理组POD活性还在提升,第18天时热处理组POD活性显著高于CK组(P<0.05)。有报道[36]称POD能够通过调节IAA激素水平来抑制发芽,或许甘薯中POD活性的提升有利于抑制其芽苗生长。总而言之,乙烯处理更能够增强甘薯POD活性。
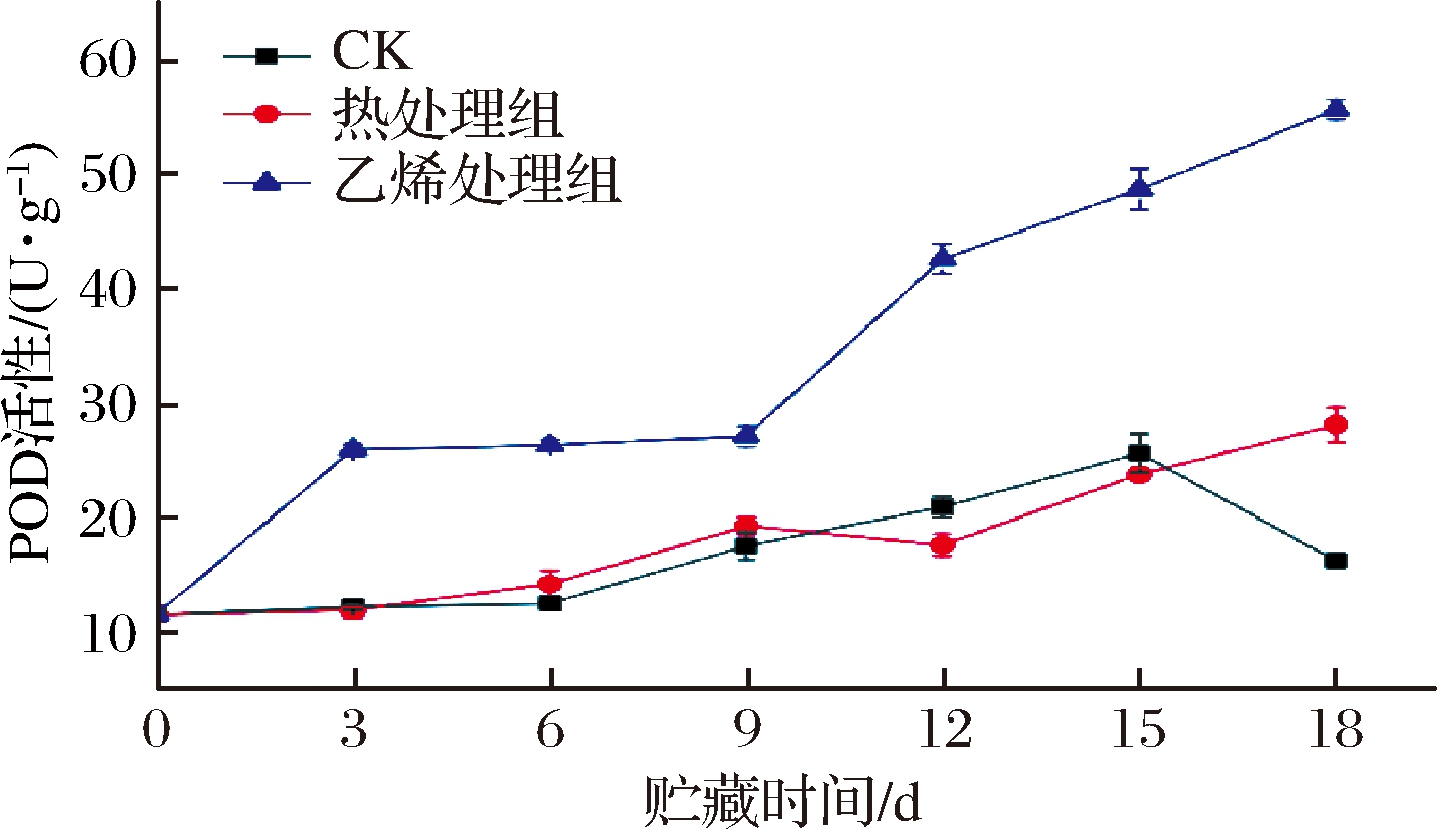
图10 乙烯处理、热处理对甘薯POD活性的影响
Fig.10 Effect of ethylene treatment and heat treatment on POD activity of sweet potato
甘薯在常温物流运输过程中常常会出现发芽等有损其商品价值的现象,本文分别通过50 ℃热水浸泡20 min和用1 g/L乙烯利处理甘薯2种方法对甘薯进行处理。结果表明在甘薯的常温物流过程中,热处理和乙烯处理均能有效抑制甘薯发芽,保持较低的发芽率,以上结果与SUTTLE[37]的研究结果基本一致,高于0.001 μL/L连续外源乙烯处理可以抑制块茎萌芽,且浓度越高抑制效果越明显,高于1 μL/L连续外源乙烯处理可完全抑制芽生长,同时也印证了SHEIBANI等[38]高温能抑制甘薯发芽的研究结果;2种处理均能诱导PPO、POD活性的提高,但乙烯处理组诱导幅度更大,更能增强甘薯的抗病性。与热处理组相比,乙烯处理组在抑芽效果、防止甘薯腐烂、提高甘薯中可溶性糖含量等方面效果更佳,这是因为乙烯可能诱导了甘薯相关防御酶的活性,从而增强了甘薯的防御机制能力;而热处理却降低了淀粉酶的活性从而抑制了淀粉的水解。高呼吸速率的乙烯组加快了甘薯的成熟,其内的降解酶、淀粉酶的活性升高,相比之下热处理对甘薯的硬度保持、减缓呼吸强度、增加淀粉以及VC含量上表现更优。
[1] 谢一芝,郭小丁,贾赵东,等.中国食用甘薯育种现状及展望[J].江苏农业学报,2018,34(6):1 419-1 424.
[2] 雷建军, 宋洪元. 根茎类蔬菜栽培新技术[M]. 成都:四川科学技术出版社, 2000: 109.
[3] 冒布厂, 徐军, 徐宗进. 优质甘薯高效栽培技术[M]. 南京:东南大学出版社, 2009: 14;65.
[4] 张超凡, 周虹, 黄艳岚, 等. 特色薯类高产高效栽培技术[M]. 长沙:中南大学出版社, 2012: 23;28.
[5] EZEKIEL R, SINGH B, KUMAR D, et al. Storage of potatoes at 10-12 C with CIPC treatment in commercial cold stores[J]. Potato J, 2005, 32: 211-212.
[6] PAUL V, PANDEY R, EZEKIEL R, et al. Potential of glyphosate as a sprout suppressant for potato (Solanum tuberosum L.) tubers during storage[J]. Indian Journal of Plant Physiology, 2014, 19(4): 293-305.
[7] 张彩霞.高温影响水稻韧皮部同化物转运及代谢的作用机制及调控[D].北京:中国农业科学院,2018.
[8] DANIELS-LAKE B J, PRANGE R K, NOWAK J, et al. Sprout development and processing quality changes in potato tubers stored under ethylene[J]. American Journal of Potato Research, 2005, 82(5): 389-397.
[9] BUFLER G. Exogenous ethylene inhibits sprout growth in onion bulbs[J]. Annals of Botany, 2008, 103(1): 23-28.
[10] 代红飞.外源乙烯对马铃薯抑芽机制的研究及加工品质的影响[D].济南:齐鲁工业大学,2016.
[11] 程曦. 控温包装在莴笋尖常温物流过程中的保鲜机理及优化研究[D].重庆:西南大学,2017.
[12] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007.
[13] DONG H, CHENG L, TAN J, et al. Effects of chitosan coating on quality and shelf life of peeled litchi fruit[J]. Journal of Food Engineering, 2004, 64(3):355-358.
[14] 谌小立, 黄先静, 杨旭芹, 等. 三种食用油对红酸汤烹调中全反式番茄红素含量影响研究[J]. 中国调味品, 2019, 44(3):97-100.
[15] 梁元凯, 陈鹏, 李玉红. 乙烯利诱导黄瓜叶片胞间隙几丁质酶累积的变化[J].西北农业学报,2012,21(1):141-145.
[16] 朱红, 李洪民, 张爱君,等. 甘薯贮藏期呼吸强度与主要品质的变化研究[J].中国农学通报,2010. 26 (7): 64-67.
[17] DOKE N D, DHEMRE J K, KHALATE S M. Role of ethylene on ripening of Kesar mango fruits[J]. IJCS, 2018, 6(2): 170-174.
[18] 郭斐.外源脱落酸和乙烯利处理对香蕉成熟的影响[D].晋中:山西农业大学,2016.
[19] FAN X, SHU C, ZHAO K, et al. Regulation of apricot ripening and softening process during shelf life by post-storage treatments of exogenous ethylene and 1-methylcyclopropene[J]. Scientia Horticulturae, 2018, 232:63-70.
[20] ZHANG J, CHENG D, WANG B, et al. Ethylene control technologies in extending postharvest shelf life of climacteric fruit[J]. Journal of Agricultural and Food Chemistry, 2017, 65(34): 7 308-7 319.
[21] MORGADO C M A, SALLANON H, MATTIUZ B H, et al. Heat treatment and active packaging to improve the storage of fresh-cut melons (Cucumis melo L.)[J]. Fruits, 2016, 71(1): 9-15.
[22] 蒋侬辉, 陈金印, 钟云.热处理对板栗果实生理及贮藏效果的影响[J].食品科学,2003,24(3):135-138.
[23] 刘少茹, 聂明建, 王丽虹, 等.甘薯贮藏过程中淀粉与可溶性糖的变化[J].安徽农业科学,2015,(25):274-276.
[24] ANWAR R, MALIK A U. Hot water treatment affects ripening quality and storage life of mango (Mangifera indica L.)[J]. Pakistan Journal of Agricultural Sciences, 2007, 44(2): 304-311.
[25] RAY R C, RAVI V. Post harvest spoilage of sweetpotato in tropics and control measures[J]. Critical Reviews in Food Science and Nutrition, 2005, 45(7-8): 623-644.
[26] PETT L B. Changes in the ascorbic acid and glutathione contents of stored and sprouting potatoes[J]. Biochemical Journal, 1936, 30(7): 1 228.
[27] XANTHAKIS E, GOGOU E, TAOUKIS P, et al. Effect of microwave assisted blanching on the ascorbic acid oxidase inactivation and vitamin C degradation in frozen mangoes[J]. Innovative Food Science & Emerging Technologies, 2018, 48: 248-257.
[28] RAFFO A, BAIAMONTE I, NARDO N,et al. Internal quality and antioxidants content of cold-stored red sweet peppers as affected by polyethylene bag packaging and hot water treatment[J]. European Food Research and Technology, 2007, 225(3-4):395-405.
[29] 朱秋萍, 郭春苗, 木巴热克·阿尤普,等.扁桃内果皮木质化过程中相关酶活性的变化[J].果树学报,2018,35(9):1 079-1 086.
[30] MILENA PETRICCIONE,MARIA SILVIA PASQUARIELLO,FRANCESCO MASTROBUONI,et al. Influence of a chitosan coating on the quality and nutraceutical traits of loquat fruit during postharvest life[J]. Scientia Horticulturae,2015,197:287-296.
[31] KIM Y H, PARK S C, JI C Y, et al. Diverse antioxidant enzyme levels in different sweetpotato root types during storage root formation[J]. Plant Growth Regulation, 2015, 75(1): 155-164.
[32] EOLINI F, HOCHKOEPPLER A, CREDI A, et al. Polyphenol oxidase expression in potato (Solanum tuberosum) tubers inhibited to sprouting by treatment with iodine atmosphere[J]. Phytochemistry, 2004, 65(15): 2 181-2 187.
[33] LUO Z, XU X, CAI Z,et al. Effects of ethylene and 1-methylcyclopropene (1-MCP) on lignification of postharvest bamboo shoot[J]. Food Chemistry, 2007, 105(2):521-527.
[34] 罗程印,李高阳,柏连阳,等.植物源活性成分诱导果蔬的抗病性研究[J].食品工业,2016,37(10):237-242.
[35] 贺立红,张进标,宾金华.苯丙氨酸解氨酶的研究进展[J].食品科技,2006(7):31-34.
[36] 杨晓玲,张建文,郭守华,等.水杨酸对马铃薯块茎发芽、酚含量及相关酶活性的影响[J].华北农学报,2002(S1):41-43.
[37] SUTTLE J C. Auxin-induced sprout growth inhibition: Role of endogenous ethylene[J]. American Journal of Potato Research, 2003, 80(5): 303.
[38] SHEIBANI E, KIM T J, WANG D S, et al. Optimization of hot water treatment for sprout and spoilage inhibition of cured sweet potato[J]. Journal of Food Processing and Preservation, 2014, 38(1): 493-498.