茯砖茶,又称茯茶、福砖,是我国特有的一种黑茶品种,从外观看呈长方砖形,色泽黑褐油润,花香浓郁纯正,因其药效类似土茯苓,故又得名“茯砖”[1]。茯砖茶内部长有大量金黄色颗粒物质,俗称为“金花”[2]。茯砖茶发花的本质就是利用温度、湿度等外部条件加快益生菌——冠突散囊菌的生长繁殖,同时抑制其他菌落的生长,形成金黄色闭囊壳——金花,这是茯砖茶独特品质形成的关键工序,也是其区别于其他黑茶制作的独特工序[3],使茯砖茶具有特有的菌落花香,使其滋味更加醇和清香[4-5]。
研究发现冠突散囊菌具有抗氧化[6-7]、抑菌[7-8]、降脂[9-10]、产酶[11-12]等活性,受到越来越多研究者的关注。SALAZAR等[13]的研究结果表明冠突散囊菌的次级代谢产物具有抑制细胞生长的作用,可能对抗肿瘤具有一定功效。李佳莲等[14]发现“金花菌”发酵液对细菌有较强的抑制作用且对一定的温度、紫外光和酸碱稳定。唐万达等[15]的研究结果表示,泾阳茯砖茶具有抗氧化酶活性且其与茶砖发花期产生的赤散囊菌有关。欧阳梅等[16]将“金花菌”接种到散茶中并测定发酵散茶的抗氧化活性,结果显示,发酵散茶的抗氧化活性较散茶有一定提高,表明“金花菌”具有抗氧化活性。先前对冠突散囊菌的研究,主要集中在对茶叶固态发酵风味形成的影响以及菌种与其他原料共同发酵的功能活性,对纯菌种发酵条件及活性研究较少,这也限制了基于冠突散囊菌的生产应用。
本文从茯砖茶中分离出1株优势菌株并进行纯化鉴定,以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基(DPPH·)清除率为指标,对其发酵条件进行优化,通过测定其对DPPH·和超氧阴离子自由基![]() 的清除率及还原能力研究其抗氧化活性,采用抑菌圈法对其抑菌活性进行初步研究。
的清除率及还原能力研究其抗氧化活性,采用抑菌圈法对其抑菌活性进行初步研究。
茯砖茶,由青岛农业大学中韩食品生物技术研究所提供;马铃薯,购于青岛大润发春阳路店。
大肠杆菌1.873 2(Escherichia coli)、肠沙门氏菌1.107 54(Salmonella enterica)、枯草芽孢杆菌1.425 5(Bacillus subtilis)、铜绿假单胞菌1.107 12(Pseudomonas aeruginosa)、金黄色葡萄球菌1.872 1(Staphylococcus aureus),由青岛农业大学中韩食品生物技术研究所提供。
马铃薯葡萄糖琼脂(patato dextrose agar,PDA),北京陆桥技术股份有限公司;马铃薯葡萄糖水(potato dextrose,PD),青岛高科园海博生物技术有限公司;DPPH·、三羟甲基氨基甲烷(Tris),美国Sigma公司;邻苯三酚,国药集团化学试剂有限公司;二硫苏糖醇(dithiothreitol,DTT),Solarbio公司;邻二氮菲、铁氰化钾,天津广成化学试剂有限公司;其余试剂均为分析纯。
DHP-9032电热恒温培养箱,中国龙口市先科仪器有限公司;IS-RDV3立式恒温振荡器,美国精骐有限公司;TGL-16M型高速台式冷冻离心机,湖南湘仪实验室仪器有限公司;YXQ-LS-SII高压灭菌锅,上海博讯实业有限公司;DU-800型紫外分光光度计,美国贝克曼公司;RE-6000旋转蒸发仪,上海亚荣仪器公司。
1.3.1 茯砖茶中冠突散囊菌的分离及鉴定
1.3.1.1 菌株的分离、纯化
无菌条件下,直接挑取茯砖茶上的金花闭囊壳,接种于PDA培养基上,30 ℃培养,待菌落生长成黄色时,用无菌接种环挑取适量菌体进行平板划线,多次划线直到菌株初步纯化。挑取平板上的金黄色单菌落,接种到PDA平板上,继续培养直至菌落生长成黄色,得到目标菌株。挑取适量目标菌株的黄色闭囊壳至装有100 mL无菌蒸馏水与玻璃珠的锥形瓶中,制成均匀的菌悬液,并进行10倍梯度稀释。取10-3~10-6稀释度的菌悬液200 μL分别涂布到PDA培养基上,30 ℃条件下静置培养3 d。选取长有单菌落的平板,得到的菌落即为目标单菌落,观察菌落形态,并用显微镜观察个体形态特征。
1.3.1.2 分离菌株的鉴定
将分离纯化后的菌株接种至PDA培养基上,生长3 d,从培养皿中刮取菌丝,采用十六烷基三甲基溴化铵(cetyltrimethylammonium ammonium bromide,CTAB)法提取真菌DNA,采用引物ITS1:5′-TCCGTAGGTGAACCTGCGC-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′。聚合酶链式反应(polymerase chain reation,PCR)扩增体系为:DNA模板1.0 μL;10×Buffer(含2.5 mmol/L Mg2+),5.0 μL;Taq聚合酶 1.0 μL;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(10 mmol/L),1.0 μL;ITS1引物1.5 μL;ITS4引物1.5 μL;ddH2O 39.0 μL;总体积50.0 μL。PCR反应参数:预变性,95 ℃,5 min;变性,95 ℃,30 s;退火,58 ℃,30 s;延伸,72 ℃,1 min;终延伸,72 ℃,7 min;35个循环。PCR产物经处理后送往上海生物工程股份有限公司进行测序。测序获得的ITS基因序列在NCBI数据库中使用Blast进行比对。
1.3.2 GT-1菌株发酵工艺优化
以GT-1菌株发酵液提取物对DPPH·的清除能力为指标,确定该菌株的最佳发酵工艺。
1.3.2.1 GT-1菌株发酵液提取物的制备
将分离的单菌落接种于PDA斜面培养基上,培养5~6 d,待斜面菌落由白色变为淡黄色再变为灰褐色后说明孢子成熟。用生理盐水冲洗斜面制备孢子悬液,使其孢子浓度为1×108 CFU/mL。取适量GT-1菌株孢子悬液接入灭菌后的PD中于恒温振荡培养箱中25 ℃,160 r/min培养9 d,得到GT-1菌株发酵液。
发酵液过滤菌丝体,旋转蒸发至原体积的1/10,加入3倍体积的无水乙醇,醇沉12 h后5 000 r/min离心10 min,取上清液旋蒸并冷冻干燥,得到GT-1菌株发酵液提取物。
1.3.2.2 GT-1菌株发酵液提取物清除DPPH·活性测定
将GT-1菌株发酵液提取物冻干粉配制成2.5 mg/mL的溶液,采用BOUGATEF等[17]的方法测定其对DPPH·的清除率。
1.3.2.3 GT-1菌株发酵条件单因素试验
(1)碳源对发酵液提取物DPPH·清除率的影响
在原有PD液体培养基的基础上,分别改变其中的碳源为蔗糖、麦芽糖、果糖、葡萄糖、乳糖,在40%装液量、2%接种量,160 r/min,25 ℃条件下发酵9 d,比较发酵液提取物清除DPPH·活性的差异。
(2)氮源对发酵液提取物DPPH·清除率的影响
在原有PD液体培养基的基础上,分别改变其中的氮源为NaNO3、NH4Cl、(NH4)2SO4、酵母膏、蛋白胨,在40%装液量、2%接种量,160 r/min,25 ℃条件下发酵9 d,比较发酵液提取物清除DPPH·活性的差异。
(3)发酵时间对发酵液提取物DPPH·清除率的影响
装液量40%、接种量3%,160 r/min,25 ℃,分别发酵3、6、9、12、15 d,比较不同发酵时间发酵液提取物清除DPPH·的活性。
(4)装液量对发酵液提取物DPPH·清除率的影响
分别以10%、20%、30%、40%、50%的装液量,3%的接种量条件接种,于160 r/min,25 ℃条件下培养9 d,比较发酵液提取物清除DPPH·活性的差异。
(5)接种量对发酵液提取物DPPH·清除率的影响
分别以0.5%、1.0%、1.5%、2.0%、2.5%的接种量,40%的装液量,于160 r/min,25 ℃条件下培养9 d,比较发酵液提取物清除DPPH·活性的差异。
1.3.2.4 GT-1菌株发酵条件正交优化
根据单因素试验结果,采用L9(33)正交试验,以发酵时间、装液量、接种量3个因素为影响因素,以清除DPPH·的能力为指标,对发酵工艺进行正交优化,因素水平见表1。
表1 L9(33)正交试验因素及水平
Table 1 Factors and levels in L9(33) orthogonal experiment design

水平因素发酵时间/d装液量/%接种量/%18101.829132.0310162.2
1.3.3 GT-1菌株发酵液提取物抗氧化活性研究
通过正交试验得到GT-1菌株的最佳发酵条件,研究此条件下发酵液提取物的抗氧化活性。
(1)GT-1菌株发酵液提取物对DPPH·清除能力的测定采用BOUGATEF等[17]的方法,由清除率曲线拟合回归曲线,并计算样品清除DPPH·的IC50值。
(2)GT-1菌株发酵液提取物对![]() 清除能力的测定采用邻苯三酚自氧化法[18],由清除率曲线拟合回归曲线,并计算样品清除
清除能力的测定采用邻苯三酚自氧化法[18],由清除率曲线拟合回归曲线,并计算样品清除![]() 的IC50值。
的IC50值。
(3)GT-1菌株发酵液提取物还原能力的测定采用铁氰化钾还原测定法[19]。
1.3.4 GT-1菌株发酵液提取物抑菌活性研究
将供试菌株活化后制备成菌浓度为106~108CFU/mL的菌悬液,以50 μg/mL青霉素为阳性对照,采用打孔法[20]对不同浓度发酵液提取物的抑菌活性进行研究。
2.1.1 菌株的分离纯化及形态特征
图1为分离菌株在PDA培养基平板中的菌落特征,可以看出菌株是边缘较为整齐的圆形菌落。培养初期,菌落为白色菌丝,3 d后菌落慢慢变为淡黄色。最终成熟后菌落的边缘为淡黄色,越往内部颜色越深,中心部位为褐色。菌落背面无脊无褶,呈深褐色。

图1 分离菌株菌落形态特征
Fig.1 Morphological characteristics of bacterial colonies
由图2可知,分离菌株菌落由菌丝体及子囊果构成,子囊果呈球形,这与已发现的散囊菌的菌丝体及子囊果的形态结构非常相似[21],内部具有许多小的子囊孢子和分生孢子,孢子外壁较粗糙,有刺状突起。
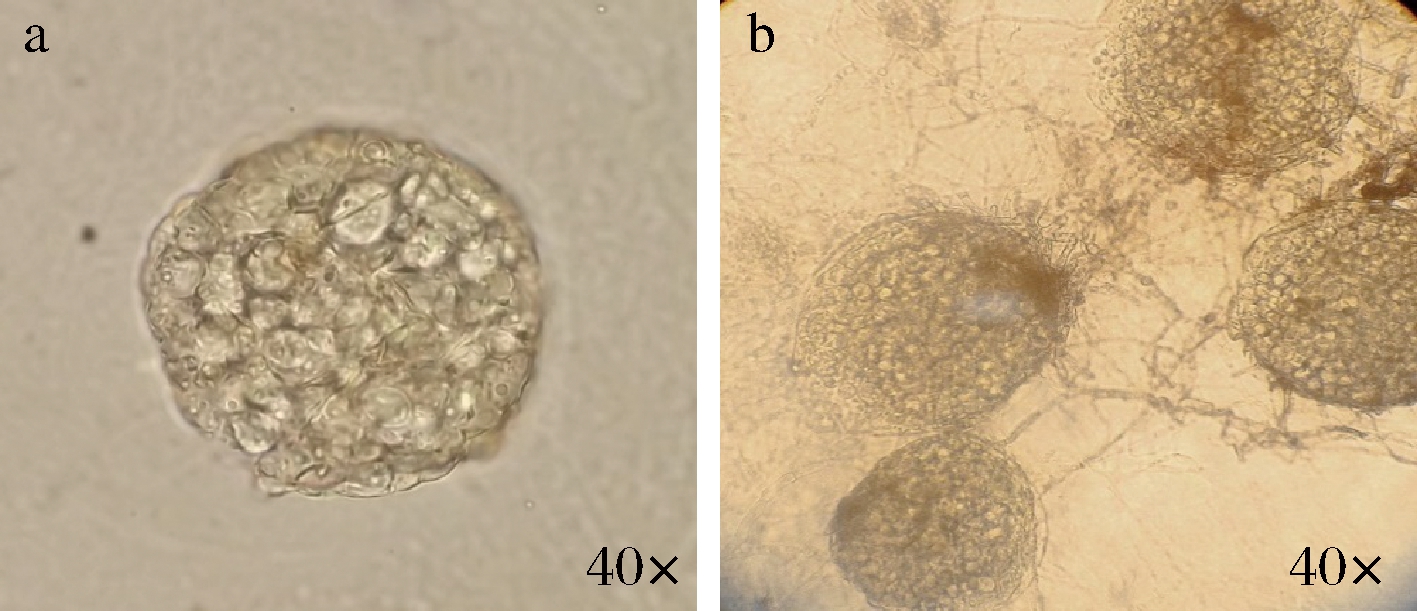
a-分离菌株子囊果;b-分离菌株菌丝体
图2 分离菌株菌丝体及子囊果
Fig.2 Mycelia and ascospores of isolated strains
2.1.2 菌株分子鉴定结果
经PCR扩增后菌株的ITS区序列电泳结果如图3所示。由电泳结果可知,扩增的菌株ITS区序列片段长度约为550 bp。经上海生工测序后的结果在NCBI数据库中进行Blast比对,比对结果表明该序列与数据库中Eurotium cristatum strain IT1824259(Sequence ID:KR812327.1)的相似度为99.57%,比对结果见图4。综合形态学和分子鉴定结果,鉴定该菌为冠突散囊菌,命名为Eurotiales sp.GT-1。
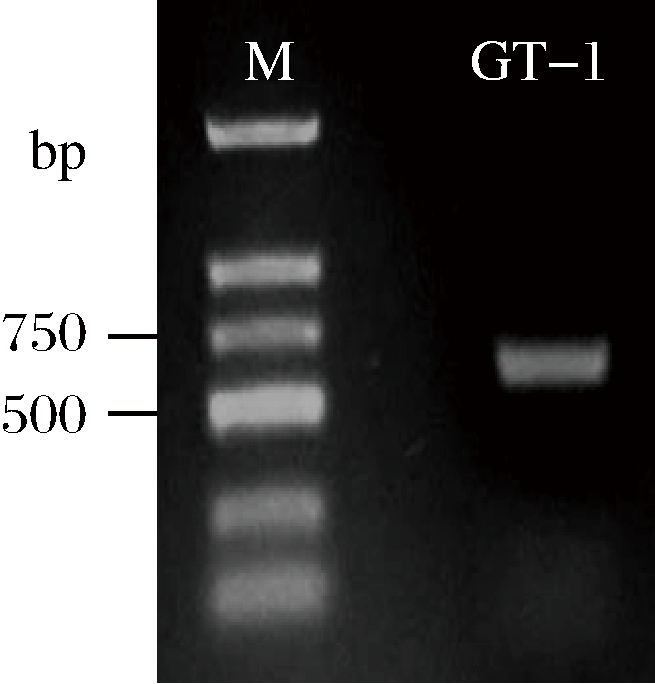
图3 ITS基因PCR扩增产物
Fig.3 PCR amplification product of ITS gene

图4 分离菌株Blast比对结果图
Fig.4 Result of Blast comparison of isolated strain
2.2.1 GT-1菌株发酵条件单因素试验结果
GT-1菌株发酵条件单因素试验结果如图5所示。由图5-a可知,当GT-1菌株发酵培养基中碳源为麦芽糖时,所得发酵液提取物对DPPH·清除率为93.1%,显著高于(P<0.05)其他组,故采用麦芽糖作为该菌株发酵的最佳碳源;由图5-b可知,当GT-1菌株发酵培养基中氮源为酵母膏时,所得发酵液提取物对DPPH·清除率为95.3%,显著高于(P<0.05)其他组,故采用酵母膏作为该菌株发酵的最佳氮源;由图5-c可知,当发酵时间为9 d时,所得发酵液提取物对DPPH·清除率为90.9%,显著高于(P<0.05)其他发酵时间;由图5-d可知,当装液量为10%时,所得发酵液提取物对DPPH·清除率为90.8%,显著高于(P<0.05)其他装液量;由图5-e可知,当接种量为2%时,所得发酵液提取物对DPPH·清除率为90%,显著高于(P<0.05)其他接种量。
2.2.2 GT-1菌株发酵条件正交实验结果
如表2所示,3个单因素中,对菌株发酵液提取物DPPH·清除率影响顺序为装液量>接种量>发酵时间,最佳发酵条件为发酵时间9 d、装液量13%、接种量2.2%。
表2 正交试验结果表
Table 2 Results of the orthogonal experiment
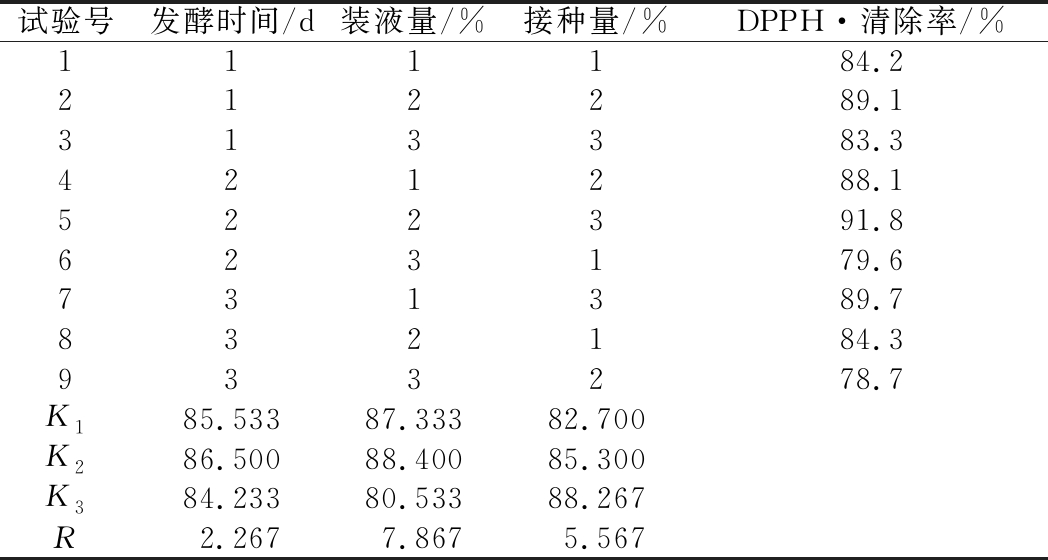
试验号发酵时间/d装液量/%接种量/%DPPH·清除率/%111184.2212289.1313383.3421288.1522391.8623179.6731389.7832184.3933278.7K185.53387.33382.700K286.50088.40085.300K384.23380.53388.267R2.2677.8675.567

a-碳源对发酵液提取物DPPH·清除率的影响;b-氮源对发酵液提取物DPPH·清除率的影响;c-发酵时间对发酵液提取物DPPH·清除率的影响;d-装液量对发酵液提取物DPPH·清除率的影响;e-接种量对发酵液提取物DPPH·清除率的影响
图5 单因素试验结果
Fig.5 The results of single factor experiment
注:图中不同小写字母代表差异显著,P<0.05(下同)
在上述最优条件下进行3次验证实验,得到GT-1菌株发酵液提取物对DPPH·的清除率达(93.9±1.12)%。
2.3.1 不同浓度GT-1菌株发酵液提取物对DPPH·的清除能力
如图6所示,发酵液提取物对DPPH·的清除率随着浓度增加而升高。当提取物的质量浓度为2.5 mg/mL时,其DPPH·清除率达到了93.9%,显著高于(P<0.05)其他浓度,其IC50值为0.78 mg/mL。由此可知,GT-1菌株发酵液提取物具有较好的清除DPPH·的活性,与颜正飞等[22]的结论一致。
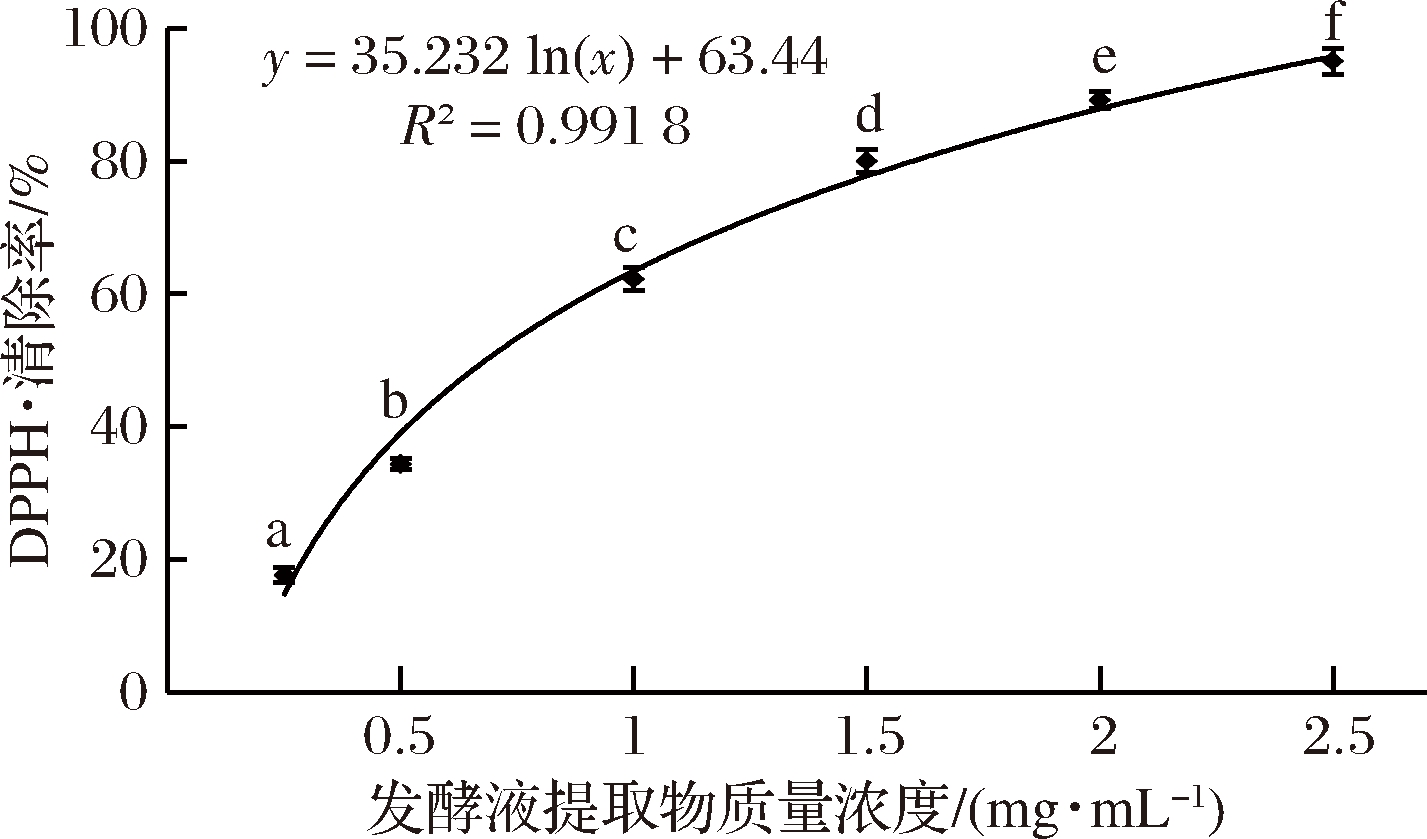
图6 发酵液提取物浓度对DPPH·清除率的影响
Fig.6 Effect of extract concentration of fermentation broth on DPPH free radical scavenging rate
2.3.2 不同浓度GT-1菌株发酵液提取物对![]() 的清除能力
的清除能力
如图7所示,发酵液提取物对![]() 的清除率随着浓度的增加而升高。当提取物质量浓度为50 mg/mL时,其对
的清除率随着浓度的增加而升高。当提取物质量浓度为50 mg/mL时,其对![]() 的清除率达到了95.0%,显著高于(P<0.05)其他浓度,其IC50值为10.70 mg/mL。
的清除率达到了95.0%,显著高于(P<0.05)其他浓度,其IC50值为10.70 mg/mL。
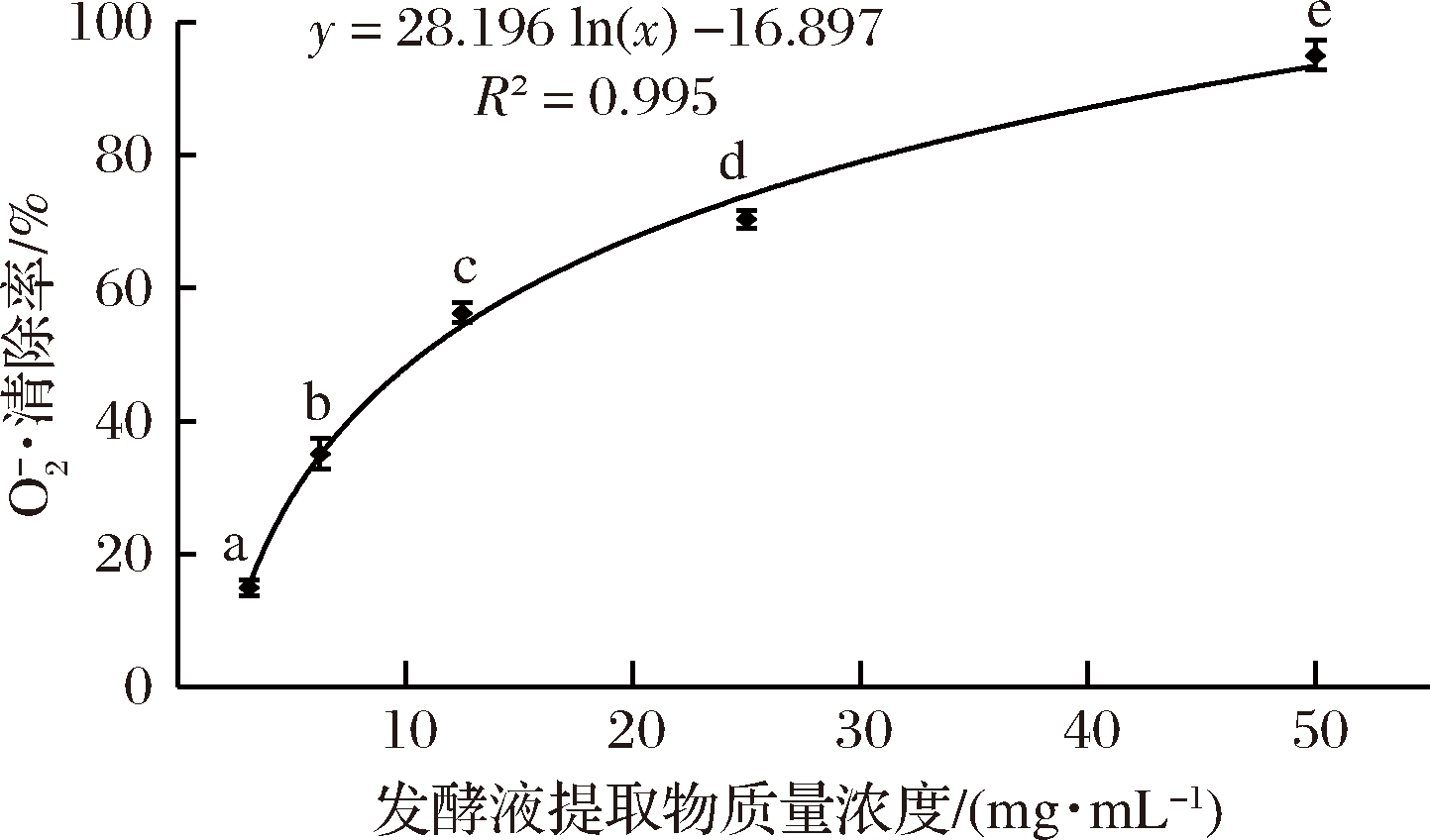
图7 发酵液提取物浓度对![]() 清除率的影响
清除率的影响
Fig.7 Effect of extract concentration of fermentation broth on ![]() free radical scavenging rate
free radical scavenging rate
2.3.3 不同浓度GT-1菌株发酵液提取物还原能力的测定
如图8所示,发酵液提取物具有很强的还原性,随提取物浓度增大还原力增强。当提取物质量浓度为3 mg/mL时,其还原力为0.98。
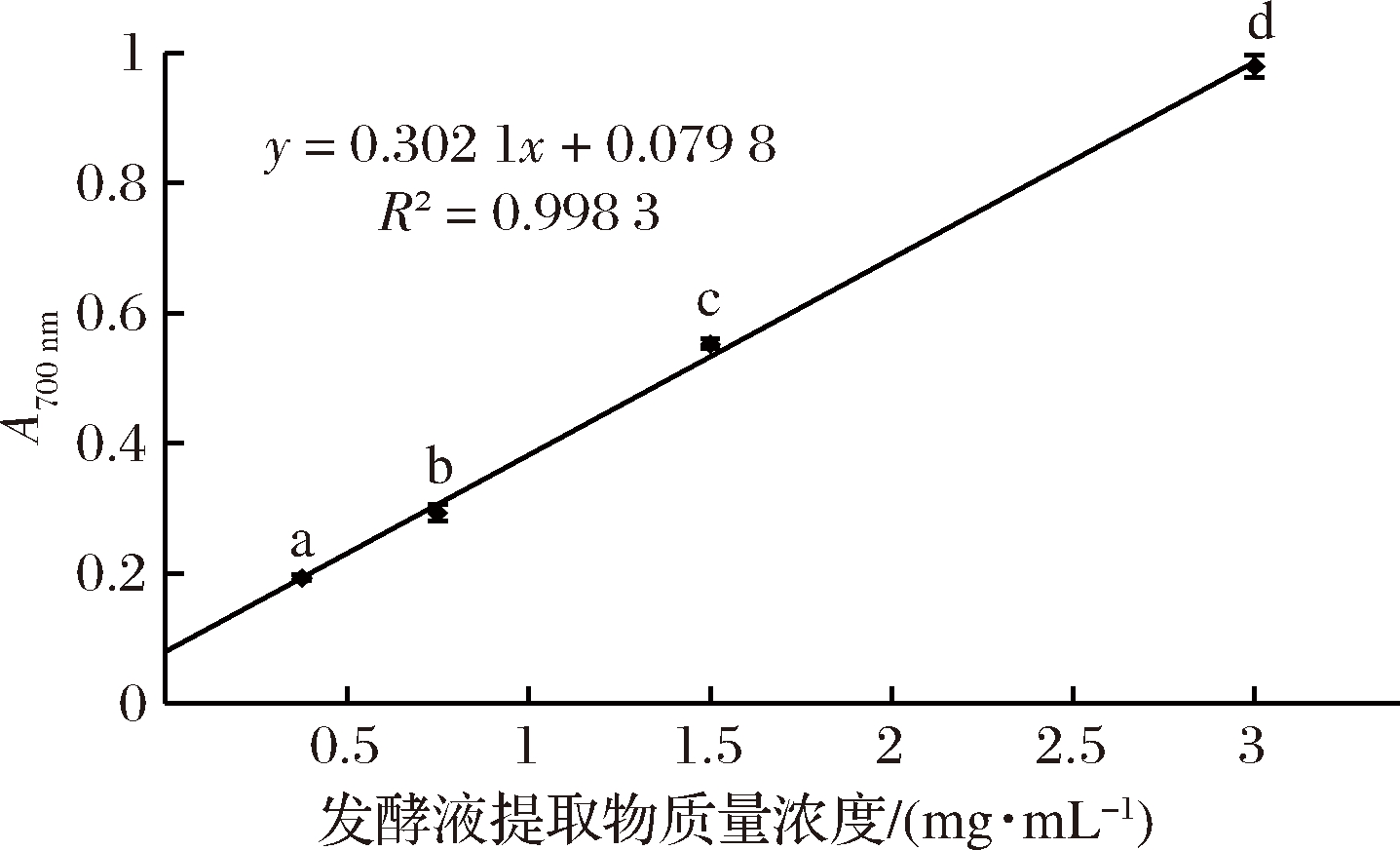
图8 发酵液提取物浓度对还原能力的影响
Fig.8 Effect of extract concentration of fermentation broth on reducing power
综上所述,GT-1菌株发酵液具有较好的抗氧化活性,这可能与其菌体孢子壁质地坚硬可抗腐蚀且自身具备一定自由基清除能力有关。另外,其在发酵过程中可能产生过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)和超氧化物歧化酶(superoxide dismutase,SOD)等具有抗氧化活性的酶类及苯甲醛类、多酚类代谢产物也是其具有较强的抗氧化活性的原因之一[7,15,22-24]。
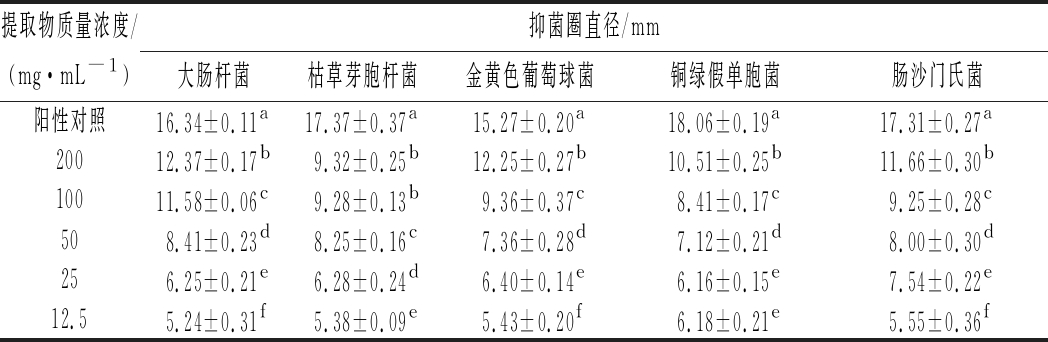
如表3所示,GT-1菌株发酵液提取物对大肠杆菌,枯草芽孢杆菌,金黄色葡萄球菌,铜绿假单胞菌及肠沙门氏菌均具有一定的抑菌效果,且随发酵液提取物浓度的增加而有显著性增强(P<0.05),这可能与其发酵液中含有大黄素蒽醌类、苯甲醛类、酚类和苯甲酸类这4种具有良好抑菌效果的化合物密切相关[7]。
表3 发酵液提取物浓度对抑菌活性的影响
Table 3 Effect of extract concentration of fermentation broth on antimicrobial activity
提取物质量浓度/(mg·mL-1)抑菌圈直径/mm大肠杆菌枯草芽胞杆菌金黄色葡萄球菌铜绿假单胞菌肠沙门氏菌阳性对照16.34±0.11a17.37±0.37a15.27±0.20a18.06±0.19a17.31±0.27a20012.37±0.17b9.32±0.25b12.25±0.27b10.51±0.25b11.66±0.30b10011.58±0.06c9.28±0.13b9.36±0.37c8.41±0.17c9.25±0.28c508.41±0.23d8.25±0.16c7.36±0.28d7.12±0.21d8.00±0.30d256.25±0.21e6.28±0.24d6.40±0.14e6.16±0.15e7.54±0.22e12.55.24±0.31f5.38±0.09e5.43±0.20f6.18±0.21e5.55±0.36f
注:同列中相同小写字母代表数值间差异不显著,不同小写字母代表数值间差异显著(P<0.05)
本研究从茯砖茶中分离获得1株优势真菌菌株,通过形态观察和ITS分子生物学鉴定,可以确定该菌株属于散囊菌属,命名为Eurotiales sp.GT-1。通过正交试验确定GT-1菌株最佳发酵工艺为以麦芽糖为碳源、酵母膏为氮源、发酵时间9 d、装液量13%、接种量2.2%,在此条件下发酵液提取物对DPPH·的清除率为93.9%。抗氧化实验结果表明,GT-1菌株发酵液提取物具有良好的抗氧化效果,对DPPH·以及![]() 的IC50值分别为0.78、10.70 mg/mL,当发酵液提取物质量浓度为3 mg/mL时,其还原力为0.98。通过抑菌圈法测定GT-1菌株发酵液提取物的抑菌效果,发现其对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌、肠沙门氏菌均有抑制作用,且抑制效果与浓度呈正相关。综上所述,Eurotiales sp.GT-1菌株发酵液提取物具有良好的抗氧化及抑菌效果,其作为一种优良的微生物制剂在食品、保健、医药等多个领域中具有可观的应用潜力。
的IC50值分别为0.78、10.70 mg/mL,当发酵液提取物质量浓度为3 mg/mL时,其还原力为0.98。通过抑菌圈法测定GT-1菌株发酵液提取物的抑菌效果,发现其对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌、肠沙门氏菌均有抑制作用,且抑制效果与浓度呈正相关。综上所述,Eurotiales sp.GT-1菌株发酵液提取物具有良好的抗氧化及抑菌效果,其作为一种优良的微生物制剂在食品、保健、医药等多个领域中具有可观的应用潜力。
[1] 李珍, 雷雨, 苏晓倩, 等. 茯砖茶加工及保健功能研究进展[J]. 中国食物与营养, 2010(1): 40-42.
[2] 刘凯利, 黄亚亚, 万斌, 等. 茯砖茶中金花菌菌落计数方法的优化[J]. 食品研究与开发, 2019, 40(3): 190-194.
[3] 黄浩, 郑红发, 赵熙, 等. 不同茶类发花茯茶中“金花”菌的分离、鉴定及产黄曲霉毒素分析[J]. 食品科学, 2017, 38(8): 49-55.
[4] XU A,WANG Y L,WEN J Y, et al. Fungal community associated with fermentation and storage of Fuzhuan brick-tea [J]. International Journal of Food Microbiology, 2011, 146(1): 14-22.
[5] 罗珍美. 茯砖茶的化学成分及其生物活性研究[D]. 合肥: 安徽农业大学, 2013.
[6] ZHOU S D, XIAO X, YAN F L, et al. On-line screening and identification of free radical scavenging compounds in Angelica dahurica fermented with Eurotium cristatum using an HPLC-PDA-Triple-TOF-MS/MS-ABTS system[J]. Food Chemistry, 2019,272: 670-678.
[7] 彭晓赟, 梁法亮, 李冬利, 等. 茯砖茶中冠突散囊菌的次级代谢产物及其生物活性研究[J]. 中草药, 2013, 44(14): 1 881-1 886.
[8] 陈云兰.茯砖茶“金花菌”的分类鉴定及其对茯砖茶品质的影响[D]. 南京: 南京农业大学, 2004.
[9] 黄彦, 石瑞, 苏二正. 冠突散囊菌的研究与应用进展[J]. 生物加工过程, 2017, 15(1): 49-56.
[10] 覃金球, 罗美玲, 张旋, 等. 冠突散囊菌医药价值研究进展[J]. 食品工业科技, 2018, 39(24): 336-339.
[11] 陈桂梅, 邓永亮, 黄亚亚, 等. 冠突散囊菌生长过程中几种胞外酶活性变化[J]. 茶叶科学, 2013, 33(4): 306-310.
[12] 杨抚林. 冠突散囊菌液体发酵工艺及其发酵液对消化酶活性影响的研究[D]. 长沙: 湖南农业大学, 2005.
[13] SALAZAR A, ALMEIDA A P, DETHOUP T, et al. The in vitro anticancer activity of the crude extract of the sponge-associated fungus Eurotium cristatum and its secondary metabolites[J]. Journal of Natural Pharmaceuticals, 2010, 1(1): 25-29.
[14] 李佳莲, 胡博涵, 赵勇彪, 等. 冠突散囊菌发酵液的抑菌作用[J]. 食品科学, 2011,32(11): 157-160.
[15] 唐万达, 黄振东, 杨琳, 等. 泾阳茯砖茶中“金花菌”的分离、鉴定及抗氧化酶活性[J]. 中国微生态学杂志, 2019, 31(1): 12-16.
[16] 欧阳梅, 熊昌云, 屠幼英, 等. 冠突散囊菌对茶叶品质成分及其抗氧化活性影响[J]. 菌物学报, 2011, 30(2): 343-348.
[17] BOUGATEF A, HAJJI M, BALTI R, et al. Antioxidant and free radical-scavenging activities of smooth hound (Mustelus mustelus) muscle protein hydrolysates obtained by gastrointestinal proteases [J]. Food Chemistry, 2009, 114(4): 1 198-1 205.
[18] 杨明琰, 张晓琦, 沈俭, 等. 超氧化物歧化酶两种邻苯三酚自氧化测定活力方法的比较[J]. 微生物学杂志, 2006, 26(3): 40-42.
[19] 贾建萍, 周彦钢, 鲁健章, 等. 三文鱼皮胶原肽的制备及其抗氧化活性的研究[J]. 中国食品学报, 2010, 10(4): 94-99.
[20] 姚永红, 秦娇, 张柏林, 等. 毛竹叶挥发油抑菌活性研究[J]. 食品工业科技, 2010, 31(1): 71-73.
[21] 王昕, 张宇翔, 任婷婷, 等. 茯砖茶中冠突散囊菌的分离鉴定及其在液态发酵中的应用[J]. 食品科学, 2019, 40(14): 172-178.
[22] 颜正飞, 郭健, 杨杨, 等. 分离自茯砖茶的真菌菌株MJAU EC021的鉴定及培养过程中生理特性[J]. 微生物学通报, 2016, 43(2): 310-321.
[23] 刘婷, 李颂, 张赓, 等. 冠突散囊菌和茯砖茶的健康功效[J]. 食品研究与开发, 2016, 37(5): 208-212.
[24] 吴凯为, 杨立娜, 朱力杰, 等. 冠突散囊菌在发酵茶中应用的研究进展[J]. 食品研究与开发, 2018, 39(1): 189-193.