
a-微池顶空萃取装置;b-微萃取组件;c-结构和实物
图1 微池顶空萃取装置图
Fig.1 Micro cell headspace extraction device
花椒属于芸香科灌木,是一种有较高食用和药用价值的植物资源[1]。我国的花椒资源十分丰富,主要产于四川、重庆、陕西、甘肃、山东等省[2-3]。花椒作为“八大调味品”之一,不仅具有独特的香麻味,还具有抗氧化、抗癌、降血脂、祛风除湿、麻醉、杀虫和抑菌等多种功效[4-8]。四川汉源主要有竹叶花椒(习称青花椒)、红花椒2种品种,在香气感官等方面具有很大的差异。竹叶花椒主要在未成熟时采收,果皮颜色为绿色,气香,味微甜而辛,比红花椒的醇类物质含量高2~3倍,主要是特征挥发性成分芳樟醇[9]。竹叶花椒含有丰富的生物碱、挥发油及酰胺类化合物等成分[10-11],具有重要的科学研究意义和经济价值。
花椒中含有多种挥发性风味成分,在挥发性成分研究中受到广泛关注[12-14]。蒲凤琳等[15]用水蒸气蒸馏法提取,气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)分析,从花椒中鉴定出37种挥发性风味成分。顶空分析的研究日益受到关注,孟佳敏等[16]通过顶空固相微萃取,经GC-MS分析从花椒中鉴定出42种挥发性风味成分;张玉霖等[17]同样采用顶空固相微萃取结合GC-MS方法对市售花椒油挥发性香气成分进行分析,共鉴定出47种挥发性风味成分。固相微萃取操作方便、无需溶剂、灵敏度高,但其萃取头成本较高,多次使用后可能出现萃取头交叉污染等问题[18-19]。单滴微萃取因其成本低、溶剂用量少、操作简便快速,应用广泛等优点受到关注,但存在萃取液滴体积小,悬挂稳定性差,易挥发,有机溶剂挥发损失过快的缺点,导致无法使用乙酸乙酯、正己烷等挥发性有机溶剂萃取[20-21]。
针对上述方法存在的问题,本文设计制作了一种新型微池顶空萃取装置,在此基础上建立一种以乙酸乙酯、正己烷为萃取剂的双溶剂微池顶空溶剂萃取方法,以实现竹叶花椒挥发性风味成分的溶剂顶空微萃取,并结合GC-MS对竹叶花椒挥发性风味成分进行分析,并与顶空固相微萃取进行了对照。以探究乙酸乙酯和正己烷为萃取剂的双溶剂微池顶空萃取方法的实际应用前景。
仪器:ISQ120839 THERMOFISHER(ISO)气-质联用仪,美国赛默飞世尔科技公司;CPA2014C348-32气相色谱仪,岛津企业管理有限公司;57328-U 50/30 μm (DVB/CAR/PDMS)固相微萃取SPME纤维头,美国Supelco公司;微量进样器(50.0 μL、10.0 μL),上海安亭科学仪器厂;20 mL钳口顶空瓶。
试剂:乙酸乙酯、正己烷,均为色谱纯;无水氯化钙,分析纯。
竹叶花椒干品(产自四川汉源地区),购于成都川味水浒之香料王食品店。
本文采用的微池顶空萃取装置如图1所示,该装置由钳口顶空瓶和微萃取池组件两部分组成,钳口顶空瓶包括瓶体及瓶盖两部分,瓶盖包括硅胶及四氟乙烯双层垫片,微萃取池组件包括圆底脱水微池、尖底萃取微池、吸盘和挂柱,萃取微池、脱水微池、挂柱和吸盘均为聚乙烯醇材料,挂柱下端分别与萃取微池、脱水微池黏接,挂柱上端与吸盘黏接,吸盘与顶空瓶盖下层四氟乙烯垫片吸合,垫片置于瓶盖,并与瓶口密闭钳合,将萃取微池、脱水微池探入顶空瓶上方。

a-微池顶空萃取装置;b-微萃取组件;c-结构和实物
图1 微池顶空萃取装置图
Fig.1 Micro cell headspace extraction device
1.3.1 双溶剂微池顶空萃取操作
使用时,称取1.0 g竹叶花椒样品于顶空瓶中,在脱水微池中预置入无水氯化钙等脱水剂,用微量进样针吸取适量萃取剂,针头刺破顶空瓶垫将乙酸乙酯、正己烷2种萃取剂分别注入不同萃取微池中,在50 ℃条件下萃取30 min[6],用进样针吸出萃取微池中的剩余萃取剂1.0 μL进行后续的气相色谱或气相色谱-质谱联用分析。
1.3.2 顶空固相微萃取
采用固相微萃取(solid-phase microextraction,SPME)纤维头和SPME纤维组件支架共同组装而成的固相微萃取装置,称取竹叶花椒样品1.0 g,50 ℃条件下萃取30 min,按照文献[17]顶空测试微萃取方法进行操作,进行后续GC-MS分析。
1.3.3 GC-MS分析
色谱条件:色谱柱:DB-WAX(30 m×0.25 m×0.25 μm)毛细管色谱柱;进样口温度260 ℃,检测器温度220 ℃;柱初温50 ℃,保持3 min,以15 ℃/min升到95 ℃持续1 min;以2 ℃/min升到110 ℃,保持1 min;以4 ℃/min升到170 ℃,保持1 min;再以15 ℃/min升到200 ℃,保持3 min保持;高纯氦气(纯度>99.999%);载气流速0.8 mL/min;分流比8∶1;进样量1.0 μL,溶剂延迟时间3 min。
质谱条件:电子轰击离子源;传输线温度280 ℃;离子源温度260 ℃;电子能量70 eV;质量扫描范围30~500 m/z。
1.3.4 挥发性风味成分的分析
竹叶花椒样品中各未知挥发性风味成分的定性通过计算机检索,利用仪器所配置的NIST 11谱库检索匹配,选取相似度(SI与RSI值均大于800时可予以选择),并结合保留时间及参考相关文献[15-17]所得。同时采用峰面积归一化法确定竹叶花椒中不同挥发性风味成分的相对含量,如公式(1)所示:
挥发性风味成分相对含量![]()
(1)
式中:A1为单组分挥发性风味成分的峰面积;A2为挥发性风味成分总峰面积。
本文提出一种以易挥发溶剂如乙酸乙酯和正己烷作为萃取剂的微池顶空萃取方法,首先制作了如图1所示的微池顶空萃取装置,通过尖底萃取微池中放置的挥发性溶剂对挥发性风味成分进行萃取。同时在微池顶空萃取池下方设置一圆底脱水微池以去除混于挥发性风味成分的水分。
微萃取池组件中的挂柱和吸盘材料均为聚乙烯醇,材料易得,以方便黏合。微池顶空萃取组件通过吸盘式结构,以便于与光滑的聚四氟乙烯垫片吸合。微池顶空萃取池设计为尖底结构,以方便进样针针头取样。采用如图1所示结构,其优势在于不仅不改变已有顶空瓶的基本结构,结构精小但方便制作,且已有的顶空瓶及进样系统,可以将近200.0 μL易挥发的萃取剂置于其中,避免了萃取剂悬挂稳定性差和有机萃取剂挥发损失过快等问题。
为了进一步研究,易挥发的萃取剂在微池顶空萃取装置中挥发稳定性的问题,通过溶剂顶空萃取在50 ℃条件下萃取30 min后,乙酸乙酯和正己烷等萃取剂初始体积与剩余体积关系如图2所示。
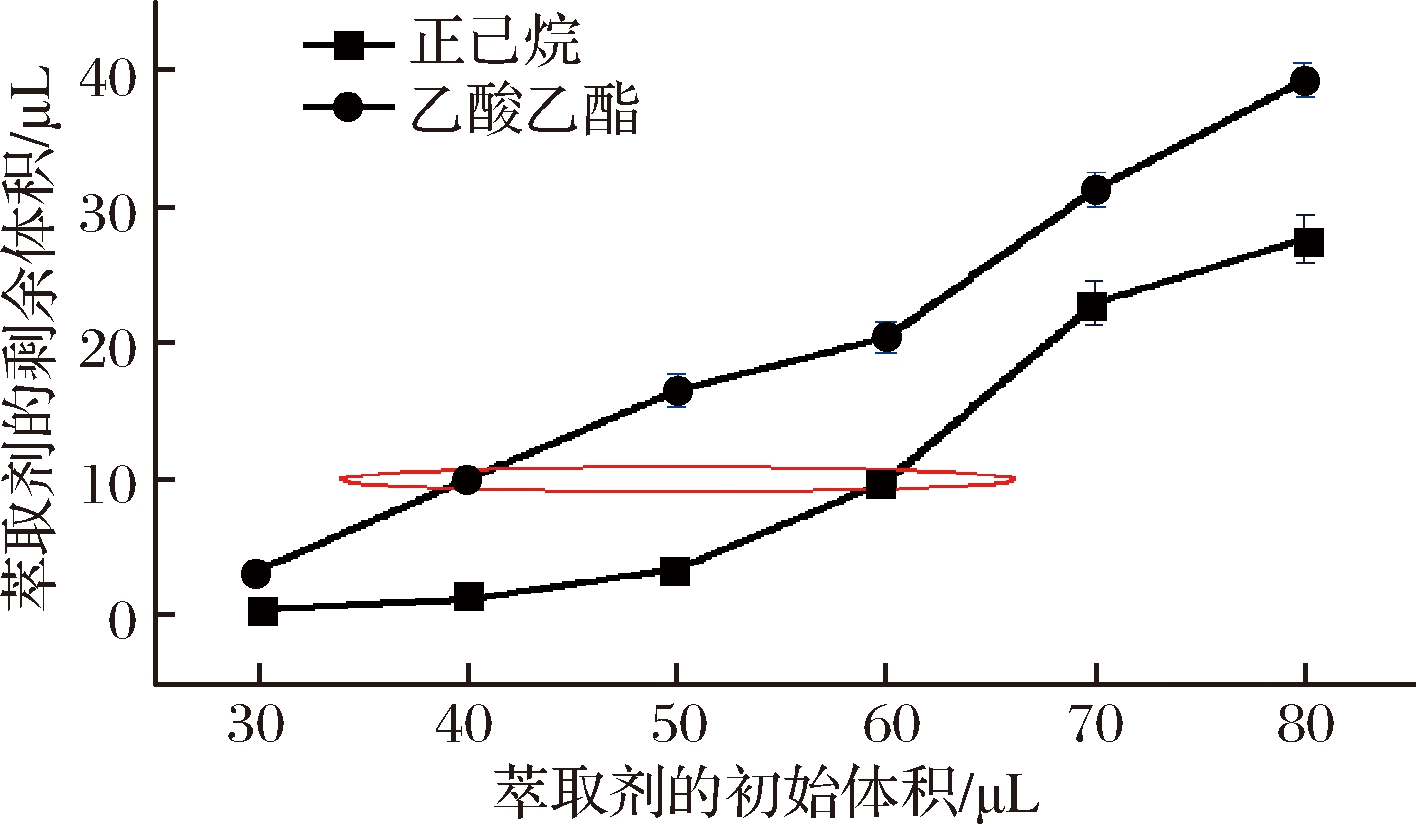
图2 微池顶空萃取装置中乙酸乙酯和正己烷的挥发稳定性
Fig.2 The stability problem of ethyl acetate and n-hexane in micro cell headspace extraction device
由图2可知,用乙酸乙酯和正己烷萃取剂萃取竹叶花椒中的挥发性成分时,乙酸乙酯的初始体积在35.0~60.0 μL时,近乎呈线性变化;正己烷的初始体积在50.0~70.0 μL时,正己烷萃取剂的剩余体积随初始体积的增加而增多。在30 min顶空萃取平衡时间内,萃取剂剩余量仍然保留有近10.0 μL,满足后续萃取物GC-MS分析,故选用乙酸乙酯、正己烷等萃取剂的初始体积分别为40.0、60.0 μL 进行后续实验分析。
本文采用微池顶空萃取装置(图1),结合GC-MS分析,研究了乙酸乙酯和正己烷2种萃取剂对竹叶花椒挥发性风味成分的萃取行为,并与顶空固相微萃取进行对照,图3-a、3-b和3-c分别是正己烷、乙酸乙酯和顶空固相微萃取物的GC-MS总离子流图。通过计算机检索,并用NIST 11谱库检索相互匹配进行定性分析,将相似度(SI与RSI值均大于800)的组分先进行选择,再结合保留时间及参考相关文献[15-17]对GC-MS检测结果进行鉴定,确定相应化合物的名称。各组分相对含量按峰面积归一化法计算公式[公式(1)]计算。将竹叶花椒中各类挥发性风味成分的数量和相对含量进行统计汇总,见表1。

a-正己烷;b-乙酸乙酯;c-顶空固相微萃取
图3 双溶剂微池顶空萃取物GC-MS总离子流图
Fig.3 The GC-MS total ion flow diagram of double solvent micro cell headspace extract
表1 正己烷和乙酸乙酯萃取物中的挥发性风味成分
Table 1 The main volatile flavor components in n-hexane and ethyl acetate extracts
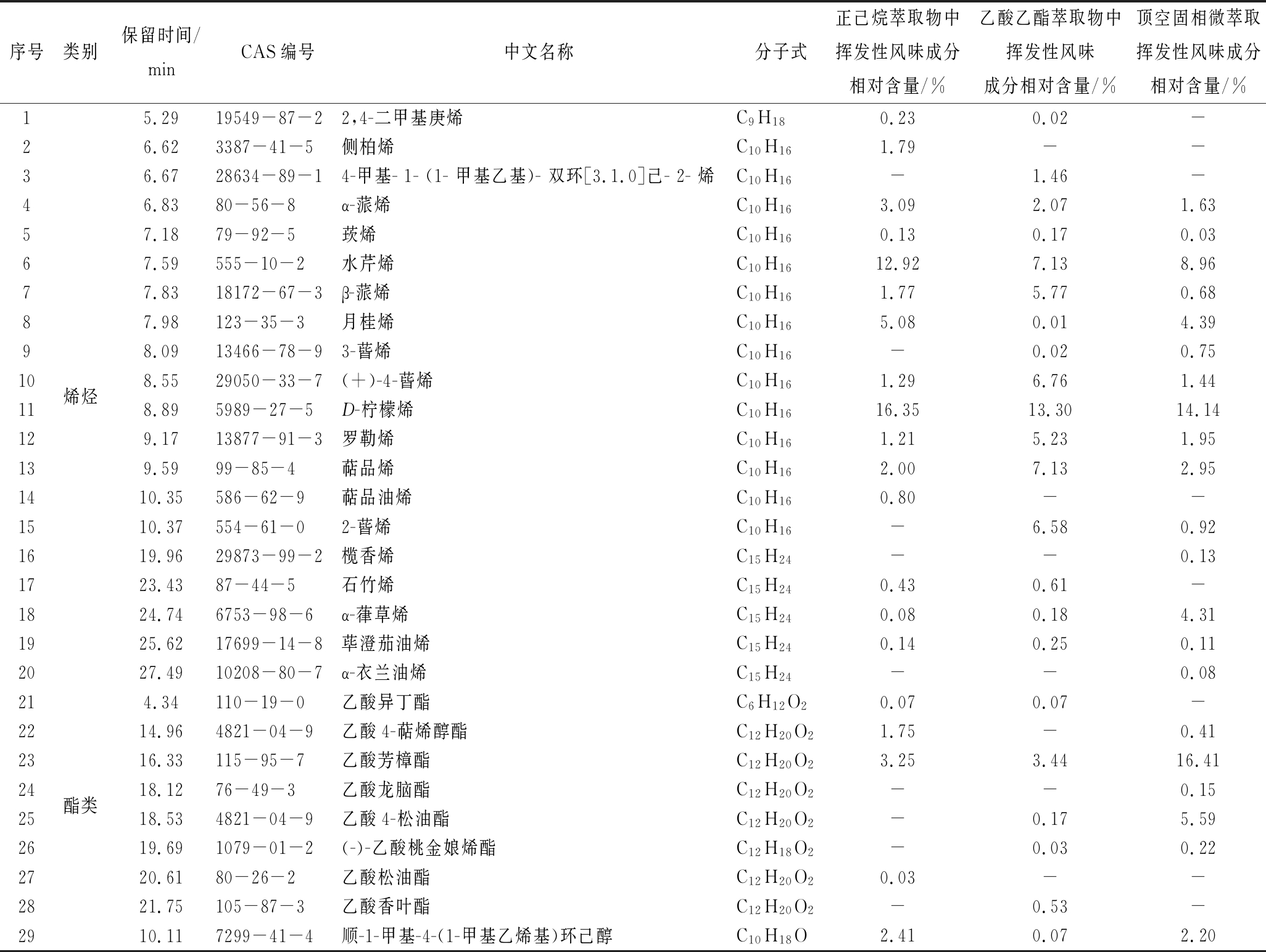
序号类别保留时间/minCAS编号中文名称分子式正己烷萃取物中挥发性风味成分相对含量/%乙酸乙酯萃取物中挥发性风味成分相对含量/%顶空固相微萃取挥发性风味成分相对含量/%15.2919549-87-22,4-二甲基庚烯C9H180.230.02-26.623387-41-5侧柏烯C10H161.79--36.6728634-89-14-甲基-1-(1-甲基乙基)-双环[3.1.0]己-2-烯C10H16-1.46-46.8380-56-8α-蒎烯C10H163.092.071.6357.1879-92-5莰烯C10H160.130.170.0367.59555-10-2水芹烯C10H1612.927.138.9677.8318172-67-3β-蒎烯C10H161.775.770.6887.98123-35-3月桂烯C10H165.080.014.3998.0913466-78-93-蒈烯C10H16-0.020.7510烯烃8.5529050-33-7(+)-4-蒈烯C10H161.296.761.44118.895989-27-5D-柠檬烯C10H1616.3513.3014.14129.1713877-91-3罗勒烯C10H161.215.231.95139.5999-85-4萜品烯C10H162.007.132.951410.35586-62-9萜品油烯C10H160.80--1510.37554-61-02-蒈烯C10H16-6.580.921619.9629873-99-2榄香烯C15H24--0.131723.4387-44-5石竹烯C15H240.430.61-1824.746753-98-6α-葎草烯C15H240.080.184.311925.6217699-14-8荜澄茄油烯C15H240.140.250.112027.4910208-80-7α-衣兰油烯C15H24--0.08214.34110-19-0乙酸异丁酯C6H12O20.070.07-2214.964821-04-9乙酸4-萜烯醇酯C12H20O21.75-0.412316.33115-95-7乙酸芳樟酯C12H20O23.253.4416.4124酯类18.1276-49-3乙酸龙脑酯C12H20O2--0.152518.534821-04-9乙酸4-松油酯C12H20O2-0.175.592619.691079-01-2(-)-乙酸桃金娘烯酯C12H18O2-0.030.222720.6180-26-2乙酸松油酯C12H20O20.03--2821.75105-87-3乙酸香叶酯C12H20O2-0.53-2910.117299-41-4顺-1-甲基-4-(1-甲基乙烯基)环己醇C10H18O2.410.072.20
续表1
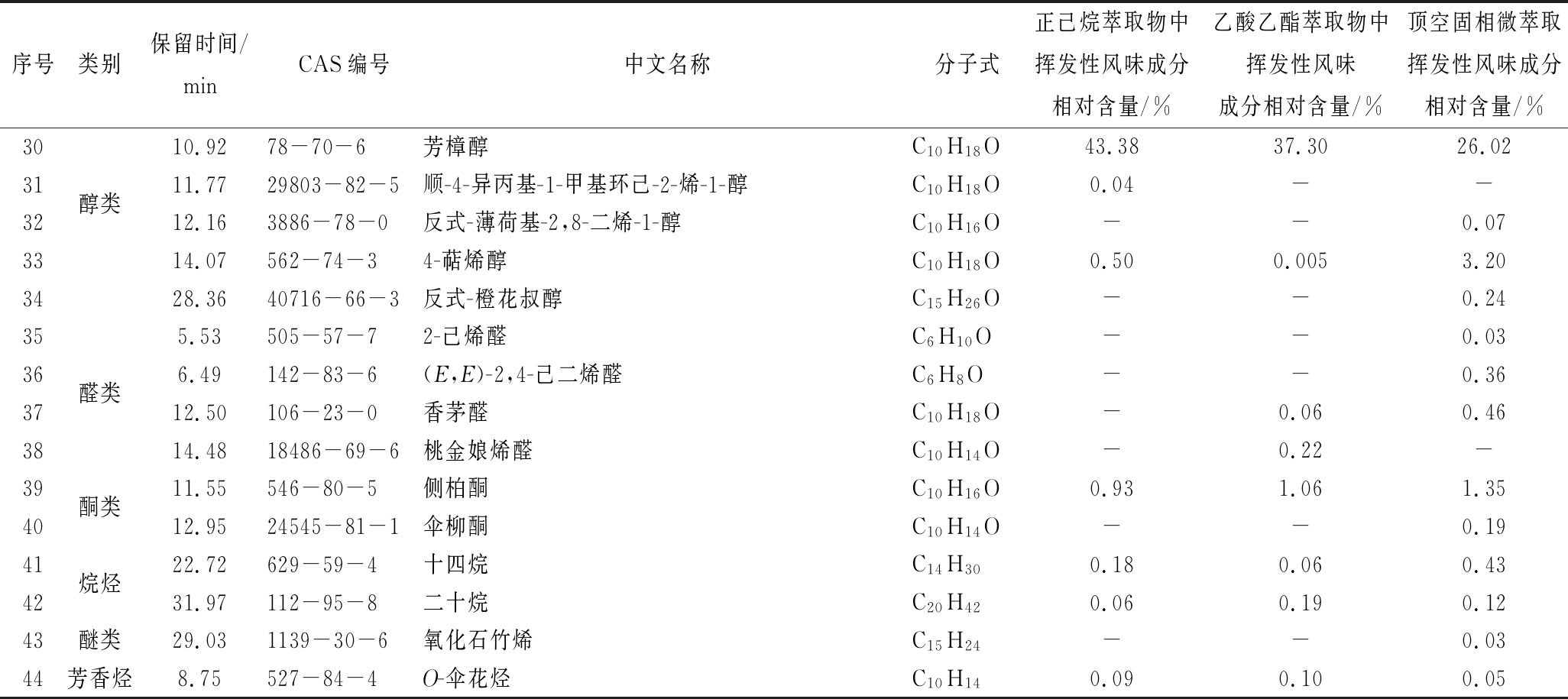
序号类别保留时间/minCAS编号中文名称分子式正己烷萃取物中挥发性风味成分相对含量/%乙酸乙酯萃取物中挥发性风味成分相对含量/%顶空固相微萃取挥发性风味成分相对含量/%3010.9278-70-6芳樟醇C10H18O43.3837.3026.0231醇类11.7729803-82-5顺-4-异丙基-1-甲基环己-2-烯-1-醇C10H18O0.04--3212.163886-78-0反式-薄荷基-2,8-二烯-1-醇C10H16O--0.073314.07562-74-34-萜烯醇C10H18O0.500.0053.203428.3640716-66-3反式-橙花叔醇C15H26O--0.24355.53505-57-72-己烯醛C6H10O--0.0336醛类6.49142-83-6(E,E)-2,4-己二烯醛C6H8O--0.363712.50106-23-0香茅醛C10H18O-0.060.463814.4818486-69-6桃金娘烯醛C10H14O-0.22-39酮类11.55546-80-5侧柏酮C10H16O0.931.061.354012.9524545-81-1伞柳酮C10H14O--0.1941烷烃22.72629-59-4十四烷C14H300.180.060.434231.97112-95-8二十烷C20H420.060.190.1243醚类29.031139-30-6氧化石竹烯C15H24--0.0344芳香烃8.75527-84-4O-伞花烃C10H140.090.100.05
注:“-”表示未检出
由表1可以看出,从正已烷和乙酸乙酯萃取物中分别鉴定出27种、30种挥发性风味成分,其中重合的有22种挥发性成分,不重合的有13种挥发性成分,共鉴定出35种,与顶空固相微萃取获得的34种相接近,可实现基于正己烷和乙酸乙酯等挥发溶剂的顶空溶剂萃取,且说明双溶剂微池顶空萃取中2种溶剂具有一定的萃取互补作用。
双溶剂微池顶空萃取获得竹叶花椒中的主要挥发性风味成分(出现在两相的成分,以含量高的为参考结果)芳樟醇的相对含量(43.38%)明显优于顶空固相微萃取(26.02%)。芳樟醇来源于天然产物,属于链状萜烯醇类,不仅有铃兰香气,香气柔和透发,还具有抗炎镇痛、抗焦虑、抗肿瘤、抗氧化、镇静催眠及其他多种香味成分和药理活性,芳樟醇及其衍生物在香化和日化工业上应用广泛[22-25]。
本文进一步对正己烷、乙酸乙酯萃取物中各类挥发性风味成分的数量和相对含量进行统计分析,利用Origin 2018作图软件绘制雷达区域分布图,各类挥发性风味成分的数量及相对含量统计结果见图4。
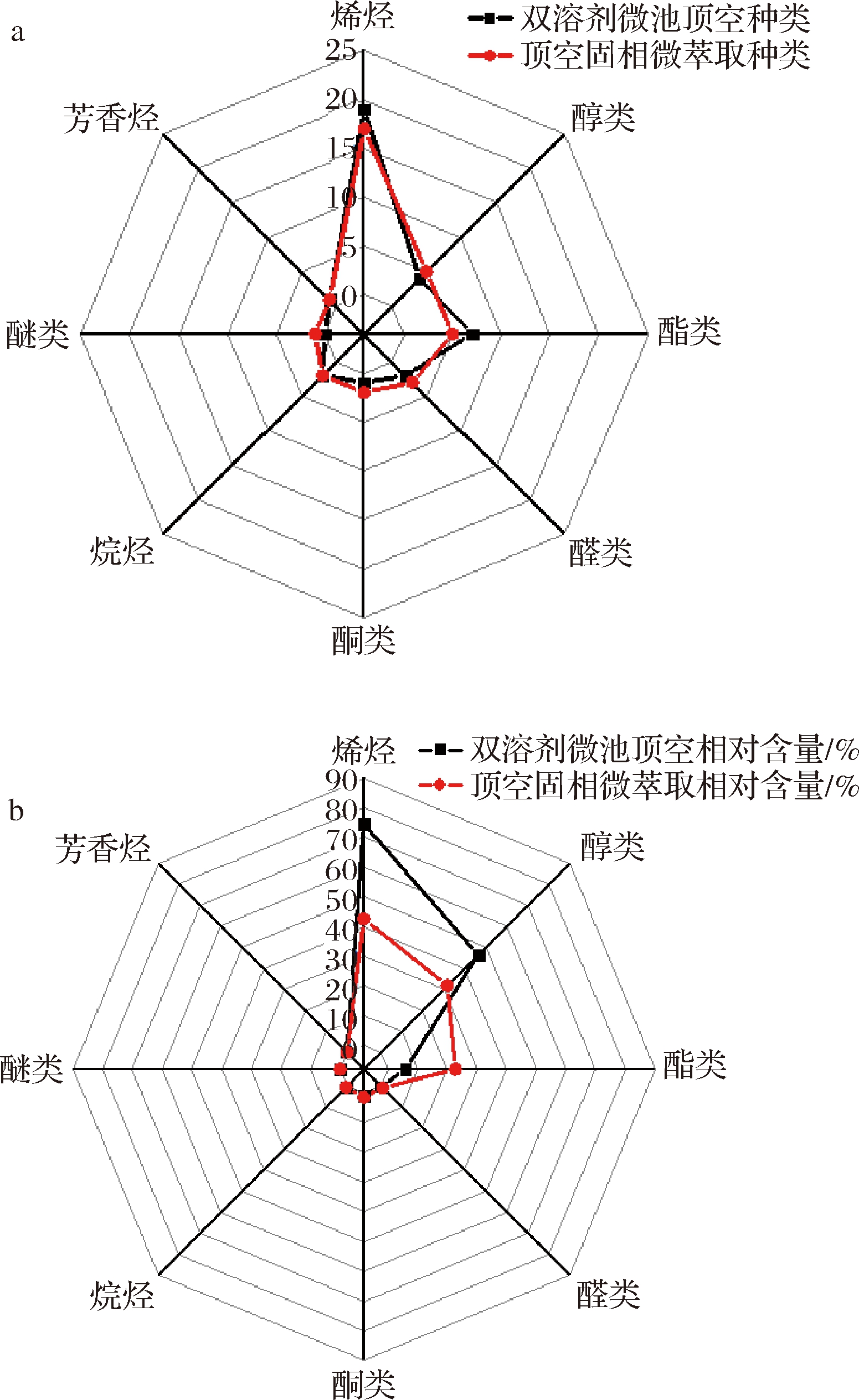
a-数量;b-相对含量
图4 各类挥发性风味成分的数量和相对含量统计
Fig.4 Quantity and relative content statistics for various volatile flavor components
由图4可以看出,变化较大的烯烃类化合物(双溶剂微池顶空萃取共鉴定出18种,相对含量为74.42%;优于顶空固相微萃取鉴定出的15种,相对含量为42.47%)是竹叶花椒各类挥发性风味成分中数量及相对含量最多的一类物质,其次是醇类、酯类,而醛类、酮类、烷烃类、醚类和芳香烃则变化差异不大。从图4-a各类挥发性风味成分数量的整体统计雷达区域分布图来看,双溶剂微池顶空萃取可达到与顶空固相微萃取相接近的效果,对于烯烃和酯类物质的萃取效果要比顶空固相微萃取的萃取效果更佳。而由图4-b各类挥发性风味成分的相对含量整体统计雷达区域分布图来看,双溶剂微池顶空萃取得到的挥发性风味成分相对含量所占总面积要大大优于顶空固相微萃取的结果。
本文针对乙酸乙酯、正己烷等挥发性萃取剂在萃取过程中不稳定、易挥发损失的特点,在已有顶空瓶的基础上设计了一种新型微池顶空萃取装置,装置不改变已有顶空瓶的基本结构,小巧但易于制作,解决了溶剂顶空萃取稳定性差的问题,实现了基于乙酸乙酯和正己烷等挥发溶剂的顶空萃取。在此基础上,建立了以不同极性的易挥发性溶剂乙酸乙酯和正己烷为萃取剂的双溶剂微池顶空萃取方法,利用GC-MS对竹叶花椒萃取物中挥发性风味成分进行了分析,操作简单、快速,获得挥发性风味成分数量上与顶空固相微萃取相接近,相对含量总体上优于顶空固相微萃取。本法灵敏度高,精密度好,相对于已有的顶空固相微萃取或单滴顶空微萃取法,分析成本大幅度降低,不仅明显改进了顶空过程中萃取剂的稳定性问题,而且结果表明,双溶剂微池顶空萃取中2种溶剂起到良好的互补萃取作用,简单、快速、在获得各类挥发性风味成分数量以及相对含量上的整体萃取效果要优于顶空固相微萃取法,为挥发性风味成分的顶空分析提供了一种新的思路。
[1] 张卫明, 肖正春. 中国辛香料植物资源开发与利用[M]. 南京:东南大学出版社, 2007.
[2] 罗凯, 朱琳, 阚建全, 等. 不同产地青花椒和红花椒挥发油的比较研究[J]. 食品工业科技, 2012, 33 (18): 103-106.
[3] 张怀予, 王军节, 陈园凡, 等. 水蒸气蒸馏法提取花椒精油及挥发性成分分析[J]. 食品与发酵工业, 2014,40(7): 166-172.
[4] LI W, ZHOU W, SHIM S H, et al. Chemical constituents of Zanthoxylum schinifolium (Rutaceae)[J]. Biochemical Systematics and Ecology, 2014, 55: 60-65.
[5] KIM K K, KIM T W, KANG Y H, et al. Lipid-lowering effects of Zanthoxylum schinifolium Siebold & Zucc. seed oil (ZSO) in hyperlipidemic rats and lipolytic effects in 3T3-L1 adipocytes[J]. Food Science and Biotechnology, 2016, 25 (5):1 427-1 436.
[6] 袁华伟, 尹礼国, 徐洲, 等. SPME/GC-MS联用分析六种香辛料挥发性成分[J]. 中国调味品, 2018, 43 (9): 151-159.
[7] LEE J H, CHANG K M, KIM G H. Composition and anti-inflammatory activities of Zanthoxylum schinifolium essential oil: Suppression of inducible nitric oxide synthase, cyclooxygenase-2, cytokines and cellular adhesion[J]. Journal of the Science of Food and Agriculture, 2009, 89 (10): 1 762-1 769.
[8] 吴蓉蓉, 田书璎, 陈勇, 等. 青花椒生物碱类化学成分及生物活性研究[J]. 中草药, 2019, 50 (6): 30-34.
[9] 余晓琴, 郑显义, 阚建全,等. 红花椒和青花椒主要品质特征指标值的评价[J]. 食品科学, 2009, 30 (15): 45-48.
[10] 陈蕾, 张锋伦, 孙达锋, 等. 青花椒生物活性及作用机制研究进展[J].中国野生植物资源, 2016, 35 (4): 43-47.
[11] 王宇, 巨勇, 王钊. 花椒属植物中生物活性成分研究近况[J]. 中草药, 2002, 33 (7): 666-670.
[12] 张敬文, 赵镭, 史波林, 等. 花椒果皮中化学成分的研究[J]. 华西药学杂志, 2016, 31 (2):109-112.
[13] 伍俊梅, 易宇文, 彭毅秦, 等. 茂县花椒叶化学成分及抗氧化活性研究[J]. 中国食品添加剂, 2018 (8): 61-69.
[14] 杨秀芳, 龙园园, 吴妍, 等. 花椒属植物活性成分的研究进展[J]. 食品科学, 2018, 39 (19): 310-319.
[15] 蒲凤琳, 孙伟峰, 车振明, 等. 水蒸气蒸馏结合GC-MS法分析比较四川汉源青、红花椒挥发性香气成分[J]. 中国调味品, 2017, 42 (1): 23-27.
[16] 孟佳敏, 邸江雪, 江汉美, 等. 花椒及花椒叶挥发性成分对比研究[J]. 中国调味品, 2018, 43 (4): 49-52;58.
[17] 张玉霖, 周亮, 陈莉, 等. 顶空固相微萃取结合GC-MS分析花椒油香气成分[J]. 食品研究与开发, 2019, 40 (1): 173-178.
[18] LV H P, ZHONG Q S, LIN Z, et al. Aroma characterisation of Pu-erh tea using headspace-solid phase microextraction combined with GC/MS and GC-olfactometry[J]. Food Chemistry, 2012, 130 (4): 1 074-1 081.
[19] PELLATI F, PRENCIPE F P, BENVENUTI S. Headspace solid-phase microextraction-gas chromatography-mass spectrometry characterization of propolis volatile compounds[J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 84: 103-111.
[20] 何小稳,蒋晔,刘彦. 离子液体顶空单滴微萃取分析中药中的高沸点挥发性成分[J]. 分析化学, 2010, 38 (5): 727-730.
[21] KAFIL Z, BABASHPOUR-ASL M, PIRYAEI M. Determination of essential oils composition of blanket-leaf (Stachys byzantina C. Koch.) by microwave assisted extraction coupled to headspace single-drop microextraction[J]. Natural Product Research, 2018,32(21):2 621-2 624.
[22] HUO M, CUI X, XUE J, et al. Anti-inflammatory effects of linalool in RAW 264. 7 macrophages and lipopolysac-charide-induced lung injury model[J]. Journal of Surgical Research, 2013, 180 (1): e47-e54.
[23] 孙宝国, 何坚. 香料化学与工艺学[M]. 北京: 化学工业出版社, 2004: 448-452.
[24] 姜冬梅, 朱源, 余江南, 等. 芳樟醇药理作用及制剂研究进展[J]. 中国中药杂志, 2015, 40 (18): 3 530-3 533.
[25] MIYASHITA M, SADZUKA Y. Effect of linalool as a component of Humulus lupulus on doxorubicin-induced antitumor activity[J]. Food and Chemical Toxicology, 2013, 53: 174-179.