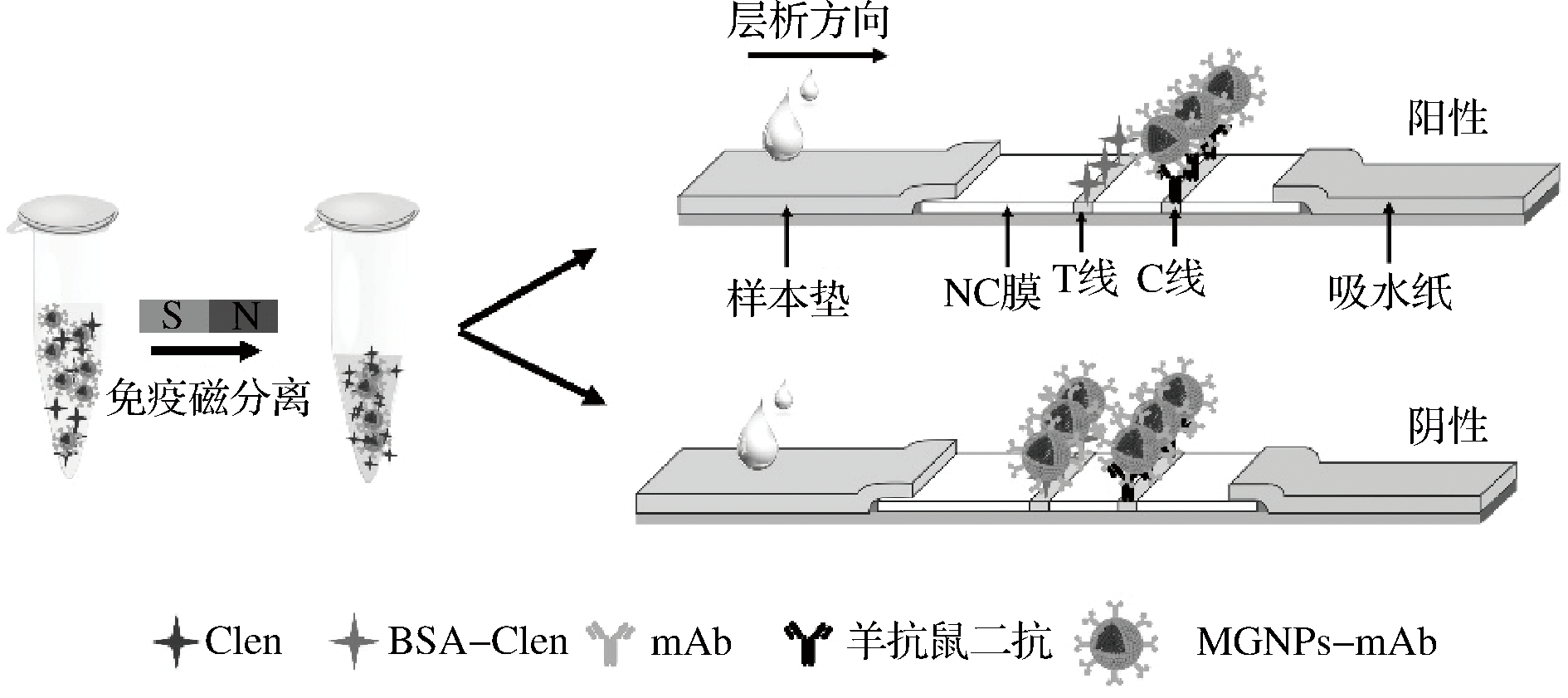
图1 MGNPs免疫层析试纸条定量检测Clen的流程和原理
Fig.1 The principle of quantitative detection of Clen by MGNPs-ICA
β-肾上腺素受体激动剂--盐酸克伦特罗(clenbuterol, Clen)因具有促进动物生长并提高瘦肉/脂肪比例的效果,曾在畜牧养殖业广泛滥用[1-3]。长期或大剂量摄入Clen残留的肉类产品会引起多种严重生理副作用,如肌肉疼痛、头晕、心动过速、神经质等,甚至死亡[4-6]。目前大部分国家和地区已禁止使用Clen作为动物促生长剂,但非法添加Clen来满足经济利益的食品安全事件仍层出不穷。
检测Clen常用的方法有高效液相色谱(high performance liquid chromatography, HPLC)[7-8]、液相色谱-质谱(liquid chromatography tandem mass spectrometry, LC-MS)[9-10]、酶联免疫吸附测定(enzyme-linked immunoabsorbent assay, ELISA)[11-12]以及免疫层析方法(immunochromatographic assay, ICA)[13-16]等。其中,ICA方法因具有操作简单、检测速度快、易于使用、和低成本等优势,被广泛应用于动物尿样中Clen残留检测。但是尿样中复杂基质,往往会干扰Clen检测的灵敏度及准确度。免疫磁分离技术(immunomagnetic separation, IMS)是借助抗原抗体的特异性反应和磁性纳米粒子的快速磁响应特性,可用于复杂基质样品中目标抗原的高效分离和富集,该方法可有效消除尿液的基质干扰,提高ICA方法的准确性[17-19]。然而传统的磁性纳米粒子因摩尔消光系数偏低,导致信号输出能力较差,限制了ICA方法的检测灵敏度。
金磁双功能纳米材料由于兼具磁性纳米粒子的磁分离、富集效应和胶体金的信号输出能力而受到广泛的关注[20-23]。但传统金磁双功能纳米材料主要是通过在磁性纳米粒子表面还原一层金壳或者在氧化铁表面偶联金纳米粒子制备获得,此类材料一般呈现“金包磁”核壳纳米结构。“金包磁”纳米材料因金壳层固有的磁屏蔽效应,会极大地降低磁性材料的饱和磁化强度,进而导致“金包磁”纳米材料磁响应性显著减弱[24-26]。为了克服以上问题,本研究通过乳液自组装法将油酸修饰的氧化铁纳米粒子(oleic acid-coated iron oxide nanoparticles, OC-IONPs)和油胺修饰的金纳米粒子(oleylamine-coated gold nanoparticles, OA-AuNPs)共封装在聚马来酸酐-alt-1-十八碳烯[poly(maleic anhydride-alt-1-octadecene),PMAO]中,形成具有“磁包金”核壳异质结构的新型MGNPs,并以此为新型标记探针,构建了准确检测猪尿中Clen的免疫层析试纸条新方法。
PMAO、HAuCl4·3H2O、油胺、油酸、FeCl3·6H2O, FeCl2·4H2O、十二烷基磺酸钠(sodium dodecyl sulfate,SDS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochoride,EDC]、牛血清白蛋白(bovine serum albumin,BSA),Sigma公司;Clen标准品、Clen单克隆抗体、羊抗鼠二抗、猪尿样品,中德无锡伯尔生物技术有限公司;硝酸纤维素膜(nitrocellulose,NC膜)、样品垫、吸水纸及聚氯乙烯(polyvinyl chloride,PVC)底板,美国Millipore公司;OA-AuNPs[27]和OC-IONPs[28]根据本实验室之前报道的方法合成;其他试剂均为分析纯。
XYZ3000型点膜仪、自动切条仪,金标生物科技公司;电热恒温鼓风干燥箱、紫外可见光分光光度计,上海福玛实验设备有限公司;JEOL JEM 2100型高分辨率透射电镜,日本电子株式会社;ZEN3700纳米粒度及电位分析仪,英国马尔文公司;振动样品磁强计,美国Micro Sense公司。
1.2.1 MGNPs的合成[29]
将5 mg PMAO、7 mg OA-AuNPs和3 mg OC-IONPs溶解于100 μL氯仿中,随后加入250 μL 5 mg/mL SDS溶液,接着混合溶液于超声波破碎仪超声乳化2 min (功率76.8 W,工作5 s,暂停10 s)。制备好的微乳液于60 ℃下挥发4 h,然后于13 500 r/min下离心15 min,弃上清液,沉淀复溶于1 mL超纯水中备用。
1.2.2 检测探针(MGNPs-mAb)的制备
采用EDC一步法合成检测探针。将0.1 mg MGNPs和10 μg Clen单抗加入到200 μL 磷酸盐缓冲液(0.01 mol/L,pH 7.4)中,混合溶液置于混匀仪反应30 min。随后每隔30 min加入10 μg EDC,重复3次。接着加入10 mg BSA和10 μg EDC继续反应30 min。最后,反应混合液于13 500 r/min离心15 min,弃上清液,沉淀溶解至50 μL复溶液,4 ℃保存待用。
1.2.3 MGNPs免疫层析试纸条的制备
将1 mg/mL Clen单抗和1 mg/mL羊抗鼠二抗分别喷涂于NC膜上作为试纸条的检测线(T线)和质控线(C线),处理后的NC膜于37 ℃干燥12 h。然后将NC膜、样本垫及吸水纸依次贴在PVC底板上,相互之间接触为2 mm,随后切割成3.9 mm宽的小条,置于卡壳中,干燥环境中保存备用。
1.2.4 MGNPs免疫层析试纸条定量检测Clen的流程和原理
如图1所示,将MGNPs-mAb检测探针添加至待检猪尿样品中,孵育5 min后,外加磁场下分离10 min,弃上清,随后加入70 μL PBS缓冲液将磁回收的MGNPs-mAb重新复溶,滴加至试纸条加样孔中。当猪尿样品中无Clen时,MGNPs-mAb检测探针与试纸条NC膜T线上BSA-Clen全抗原结合,产生红色条带;当猪尿样品中存在Clen时,MGNPs-mAb首先与Clen结合,从而使其不能与T线上BSA-Clen全抗原结合,不能产生红色条带。因此T线显色强度与待检猪尿样品中Clen浓度呈现负相关。而C线上喷涂羊抗鼠二抗,因此无论样品中有无Clen,MGNPs-mAb均能被C线捕获,产生红色条带。

图1 MGNPs免疫层析试纸条定量检测Clen的流程和原理
Fig.1 The principle of quantitative detection of Clen by MGNPs-ICA
1.2.5 试纸条免疫反应动力学分析
使用MGNPs试纸条检测4种不同Clen质量浓度(0、0.25、0.5、1 ng/mL)的加标猪尿样品,采用胶体金读卡仪记录其ODT/ODC值随免疫反应时间的变化规律。具体操作如下:将350 μL猪尿样品与2 μL检测探针室温孵育5 min,然后置于磁力架上磁回收10 min,弃上清,沉淀复溶于70 μL PBS缓冲液中,随后复溶液加至试纸条加样孔,胶体金读卡仪每隔30 s记录试纸条ODT/ODC值(T、C线吸光度比值),连续监测 30 min。每个浓度重复3次,以反应时间为横坐标,ODT/ODC值为纵坐标绘制免疫反应动力学曲线,确定试纸条的最佳读取时间。
1.2.6 MGNPs免疫层析试纸条定量检测猪尿中的Clen
将质量Clen标准品添加至阴性猪尿样品中,配制Clen终浓度为0~160 ng/mL的系列加标样品,按1.2.3步骤进行磁富集和试纸条检测,反应5 min后记录ODT/ODC值,每个浓度重复3次。定义0加标ODT/ODC值为B0,其他添加ODT/ODC值为B,以Clen浓度的对数值为横坐标,B/B0值为纵坐标,绘制Clen试纸条竞争抑制曲线,计算试纸条的半数抑制浓度(half-maxinal inhibitory concentration,IC50)、最低检测限(limit of detection,LOD)以及线性检测范围。
1.2.7 MGNPs免疫层析试纸条的性能评价
取与Clen结构相似的其他7种常见β-肾上腺素受体激动剂,即氯丁喘安(Tul)、喷布洛尔(Pen)、氯丙那林(Clo)、溴布特罗(Bro)、莱克多巴胺(Rac)、沙丁胺醇(Sal)和班布特罗(Bal),配成终浓度为100 ng/mL样本溶液,按1.2.4步骤采用Clen试纸条对上述溶液进行检测,重复测定3次,胶体金读卡仪测定试纸条ODT/ODC值。1 ng/mL Clen加标的样本溶液和Clen空白样本溶液分别作为阳性和阴性对照。
取Clen阴性猪尿样品,分别添加Clen至终质量浓度为0.313、0.625、1.25和2.5 ng/mL,采用与标准曲线构建同一批次试纸条进行检测,批内分析为同一天内重复测定4次,批间分析为连续测定3 d,批内批间分析每个浓度重复测定4次,计算Clen试纸条的批内批间加标回收率及相对标准偏差(relative standard deviation,RSD),评价试纸条的精密性和准确性。
取Clen阴性的混合猪尿样品,随机添加至Clen终浓度为0~80 ng/mL,制备25份Clen加标的阳性样本,同时采用MGNPs试纸条和商业化ELISA试剂盒对上述样本进行检测,每个浓度重复测定3次,然后对2种方法的检测结果进行比对分析,评价该方法的实用性和可靠性。
MGNPs采用乳液自组装法合成。透射电镜(transmission election microslopy,TEM)分析显示MGNPs呈现明显的“磁包金”核壳式结构,粒径约为165 nm(图2)。由于OA-AuNPs在TEM成像中较 OC-IONPs具有更高的对比度,因此核心部位的暗点为OA-AuNPs,壳层部位的亮点为OC-IONPs。图3-a显示了MGNPs的磁滞回线,结果显示MGNPs具有优异的超顺磁性,其饱和磁化强度为25.8 emu/g,约为初始OC-IONPs(41.5 emu/g)的62.2%,表明本研究所合成的MGNPs具有优异的磁学性能。其可能的原因是所形成的“磁包金”核壳结构有效规避了由OA-AuNPs带来的磁屏蔽效应。为了探究MGNPs对试纸条T 线OD值的影响,在相同摩尔浓度(30 pmol/L)下,将MGNPs和30 nm胶体金分别喷涂至NC膜T线,结果显示MGNPs的OD值达到200.8,较30 nm胶体金约高8倍(图3-b)。上述结果表明,使用MGNPs替代传统胶体金作为新型标记物有助于提高免疫层析试纸条的检测灵敏度。
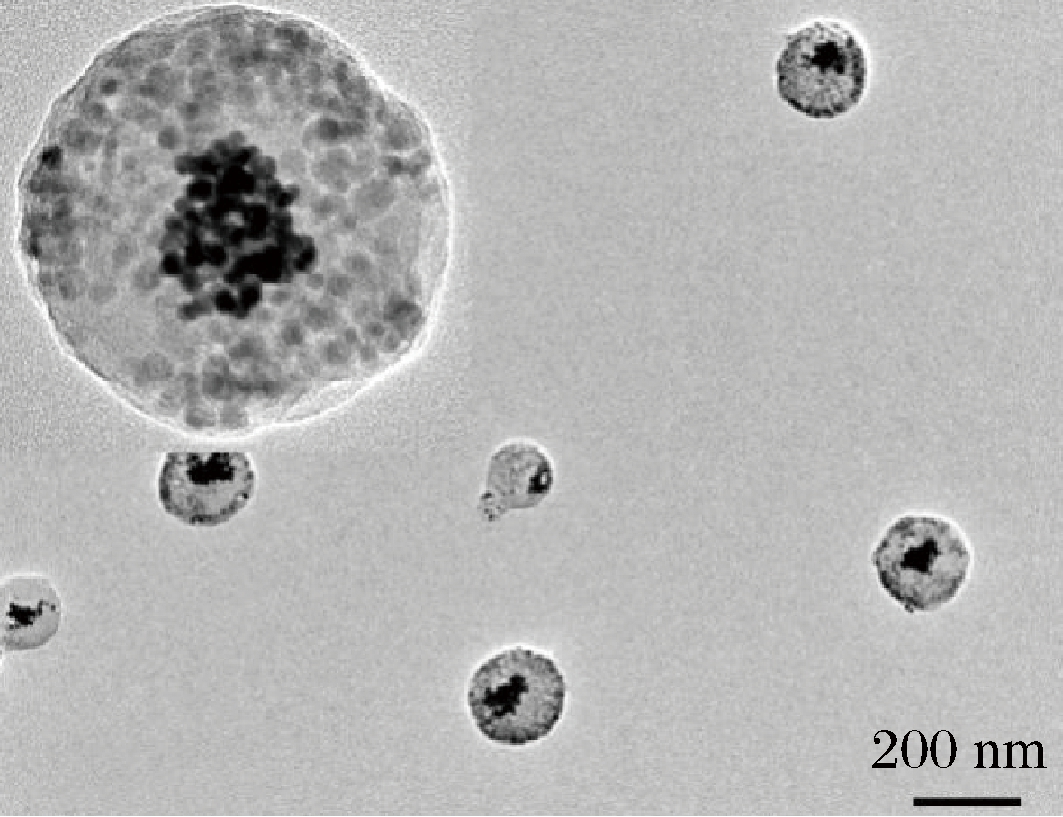
图2 MGNPs透射电镜
Fig.2 TEM image of MGNPs
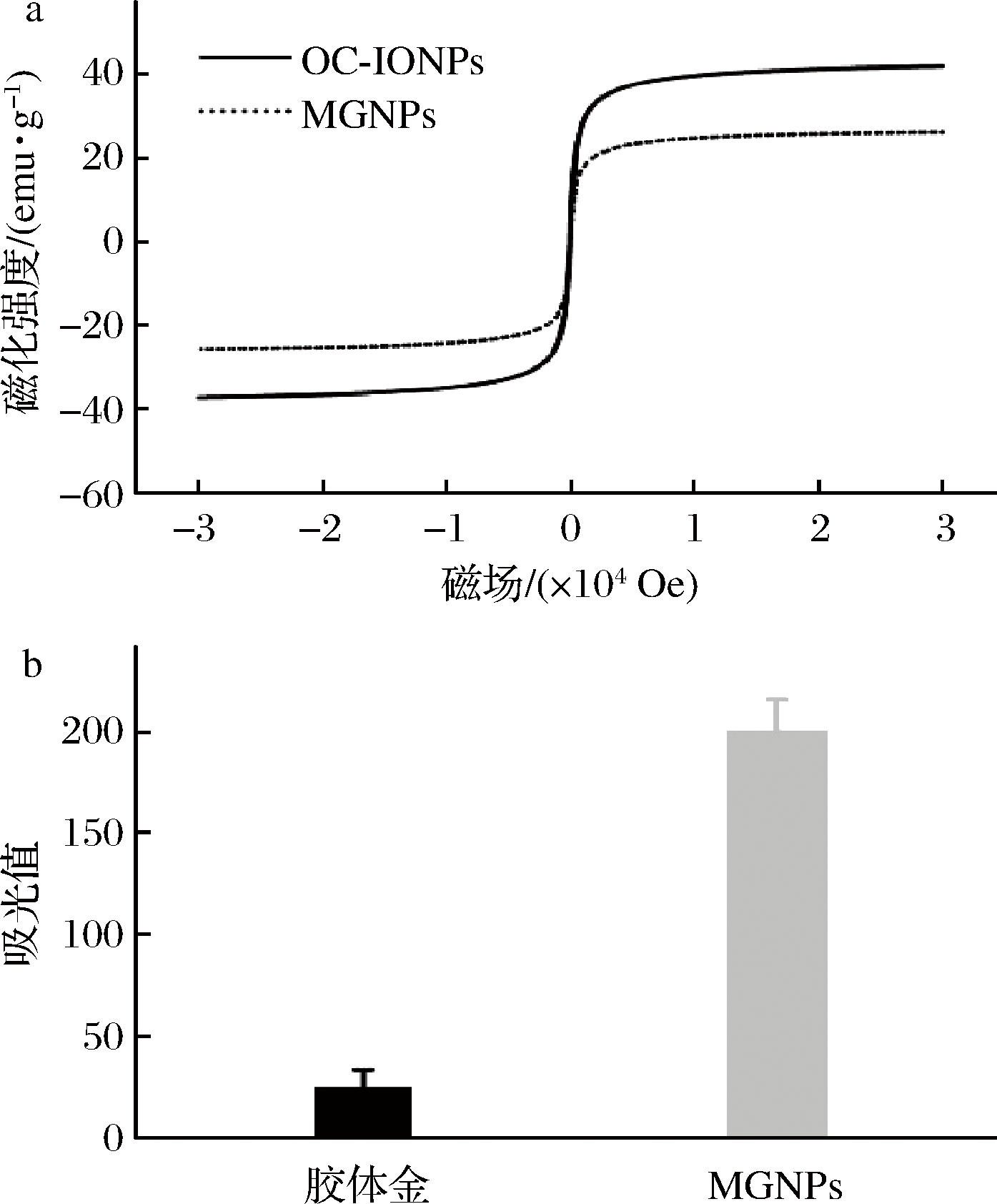
a-OC-IONPs 和 MGNPs 的磁滞回线;b-30 nm 胶体金和MGNPs在试纸条T线上的吸光值
图3 OC-IONPs和MGNPs磁学和光学性能的比较
Fig.3 A comparison of magnetic and optical performances of the OC-IONPs and MGNPs
由于Clen抗体为蛋白质,其生物活性受溶液pH影响较大。因此本研究首先探究了偶联pH对Clen抗体偶联效率以及对MGNPs-mAb的生物活性影响。图4结果表明,当溶液pH为7.5 时,试纸条T线的OD值最大,暗示MGNPs-mAb与相应抗原的结合活性最高。因此,pH 7.5被选择作为MGNPs与mAb偶联的最适反应pH。
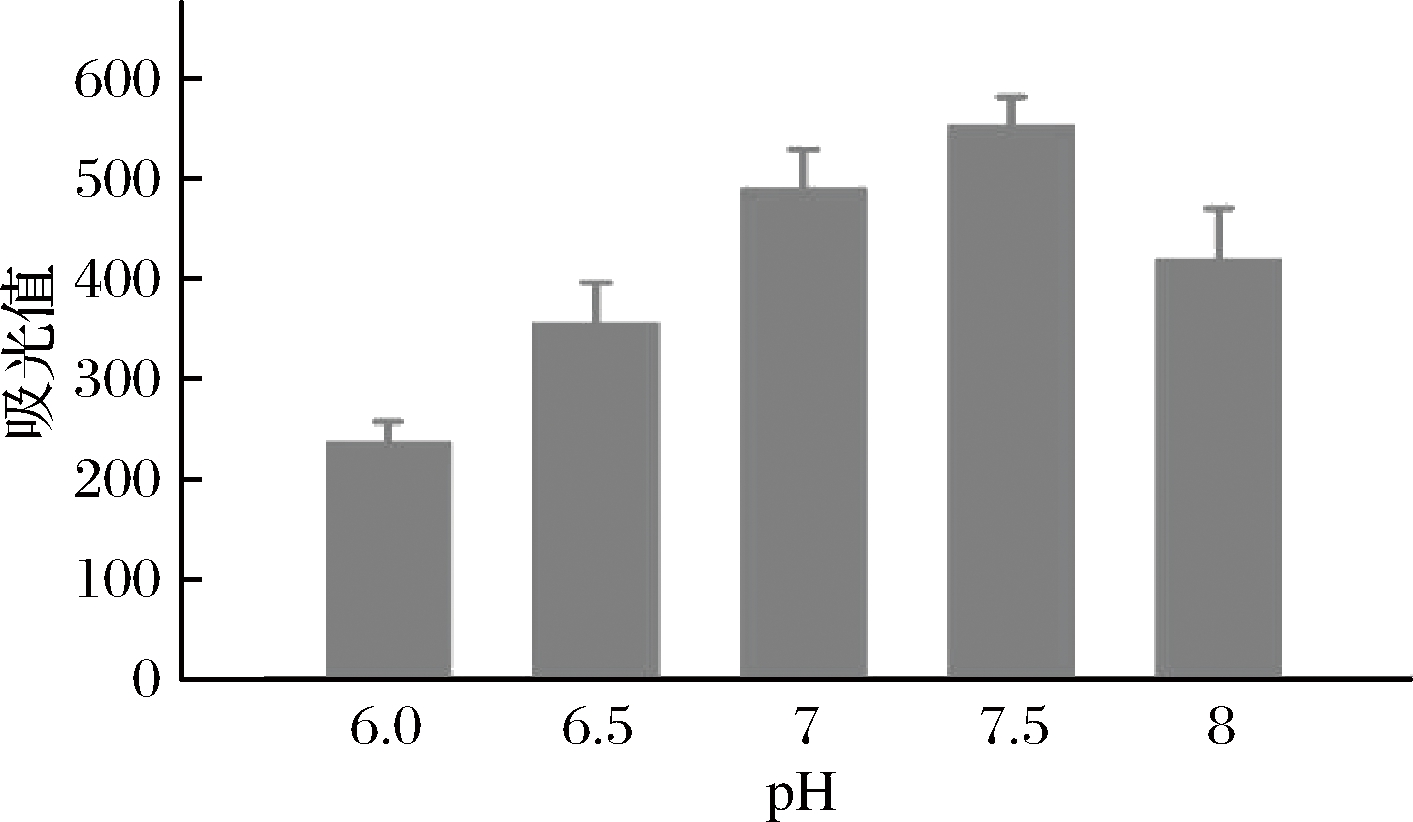
图4 溶液pH对检测探针偶联效率的影响(n=3)
Fig.4 Effect of solution pH on labeling efficiency of Clen antibodies on the surface of MGNPs (n=3)
以T线上喷涂的Clen-BSA浓度、MGNPs的抗体标记量以及MGNPs-mAb 检测探针用量为因素,设计3因素3水平L9(33)正交实验优化试纸条最佳工艺参数,实验结果如表1 所示。由表1可知,最佳工艺参数如下:T线上Clen-BSA喷涂质量浓度为2.0 mg/mL、Clen抗体标记量为100 μg/mg,每张试纸条MGNPs-mAb探针使用量为0.5 μL。在上述条件下,试纸条T和C线均呈现清晰的红色条带,相应的OD值分别为698.5±18.7和236.9±27.9。同时试纸条1.0 ng/mL Clen阳性添加的竞争抑制率最大,达56.7%。
MGNPs免疫层析试纸条T、C线显色过程是MGNPs-mAb检测探针与T线BSA-Clen抗原和C线二抗的免疫动力学反应过程。本研究通过记录不同Clen添加下ODT/ODC值与免疫反应时间的关系,构建免疫反应动力学曲线,实验结果如图5所示。由图5可知,试纸条反应5 min后,不同Clen加标浓度下ODT/ODC值均达到平衡,表明5 min的免疫反应时间足以实现可靠的Clen定量检测。
表1 正交实验优化MGNPs试纸条制备参数
Table 1 Optimize the preparation parameters of MGNPs-ICA
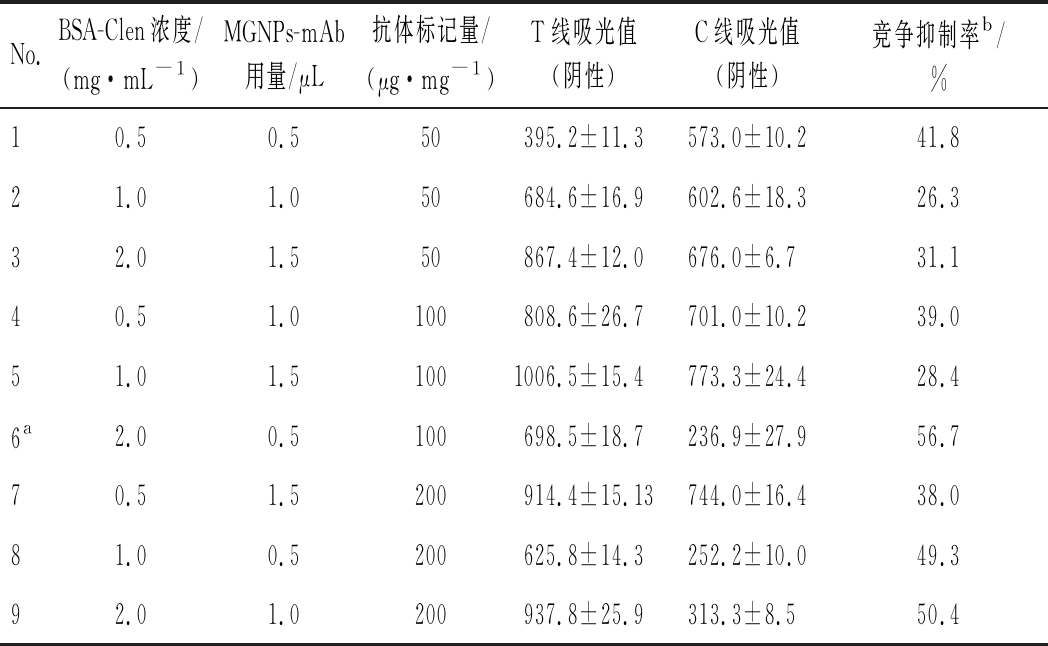
No.BSA-Clen浓度/(mg·mL-1)MGNPs-mAb用量/μL抗体标记量/(μg·mg-1)T线吸光值(阴性)C线吸光值(阴性)竞争抑制率b/%10.50.550395.2±11.3573.0±10.241.821.01.050684.6±16.9602.6±18.326.332.01.550867.4±12.0676.0±6.731.140.51.0100808.6±26.7701.0±10.239.051.01.51001006.5±15.4773.3±24.428.46a2.00.5100698.5±18.7236.9±27.956.770.51.5200914.4±15.13744.0±16.438.081.00.5200625.8±14.3252.2±10.049.392.01.0200937.8±25.9313.3±8.550.4
注:a最优实验条件组合,b1.0 ng/mL Clen阳性添加的竞争抑制率
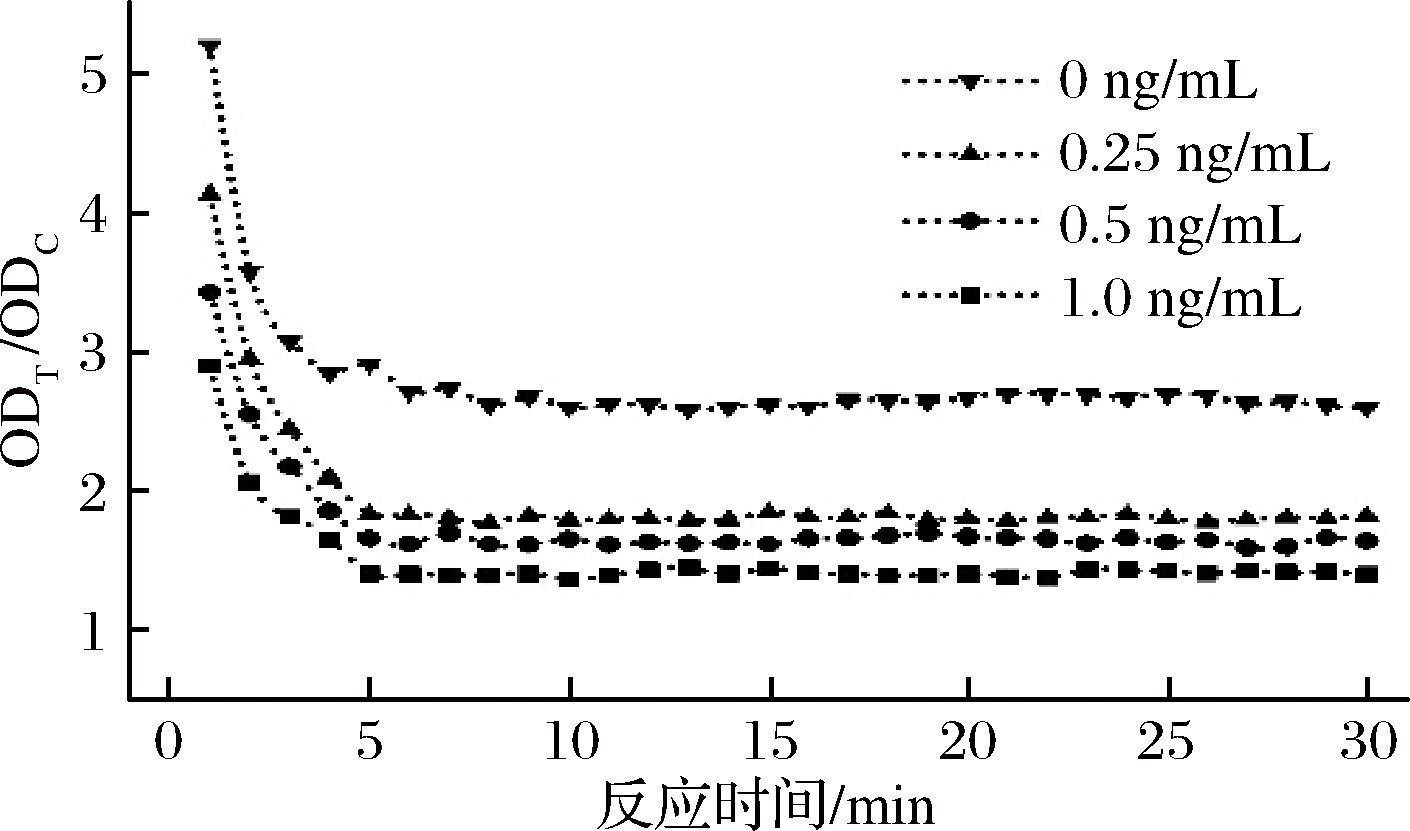
图5 MGNPs试纸条检测Clen的免疫动力学曲线
Fig.5 Immunoreaction dynamic analysis curves of MGNPs-ICA
在最佳条件下,采用本研究建立的MGNPs免疫层析试纸条检测系列Clen加标浓度的猪尿样本,以Clen浓度的对数值为横坐标,B/B0值为纵坐标,构建免疫层析试纸条的竞争抑制曲线,结果如图6所示。当猪尿中Clen浓度从0 ng/mL增加到160 ng/mL时,B/B0值逐渐降低,其中Clen浓度在0.078~40 ng/mL时,试纸条B/B0值与Clen浓度显示良好的线性关系,其回归方程表示:y=-0.12lnx+0.522 4(R2=0.984 5),其中y为B/B0,x是Clen的浓度。依据回归方程计算得该试纸条的IC50和LOD分别为1.225和0.041 ng/mL。其中,LOD定义为试纸条竞争抑制率为10%时的Clen浓度。以上结果表明,该方法可用于猪尿中Clen的高灵敏检测。

图6 MGNPs试纸条定量检测猪尿中Clen的标准曲线(n=3)
Fig.6 Calibration curve of quantitative detection of Clen in swine urine with MGNPs-ICA (n=3)
MGNPs免疫层析试纸条的特异性评价是通过使用本研究所建立的试纸条同时检测Clen(1 ng/mL)和其他7种常见β-肾上腺素受体激动剂(100 ng/mL)完成。此外阴性添加的0.01 mol/L PB缓冲液被用作为空白为对照,结果如图7所示。与空白对照相比,检测Clen时ODT/ODC值显著降低,而在检测其他7种β-肾上腺素受体激动剂时,ODT/ODC值变化可忽略不计,表明MGNPs试纸条对Clen具有良好的选择性,与其他常见β-肾上腺素受体激动剂无明显交叉反应。
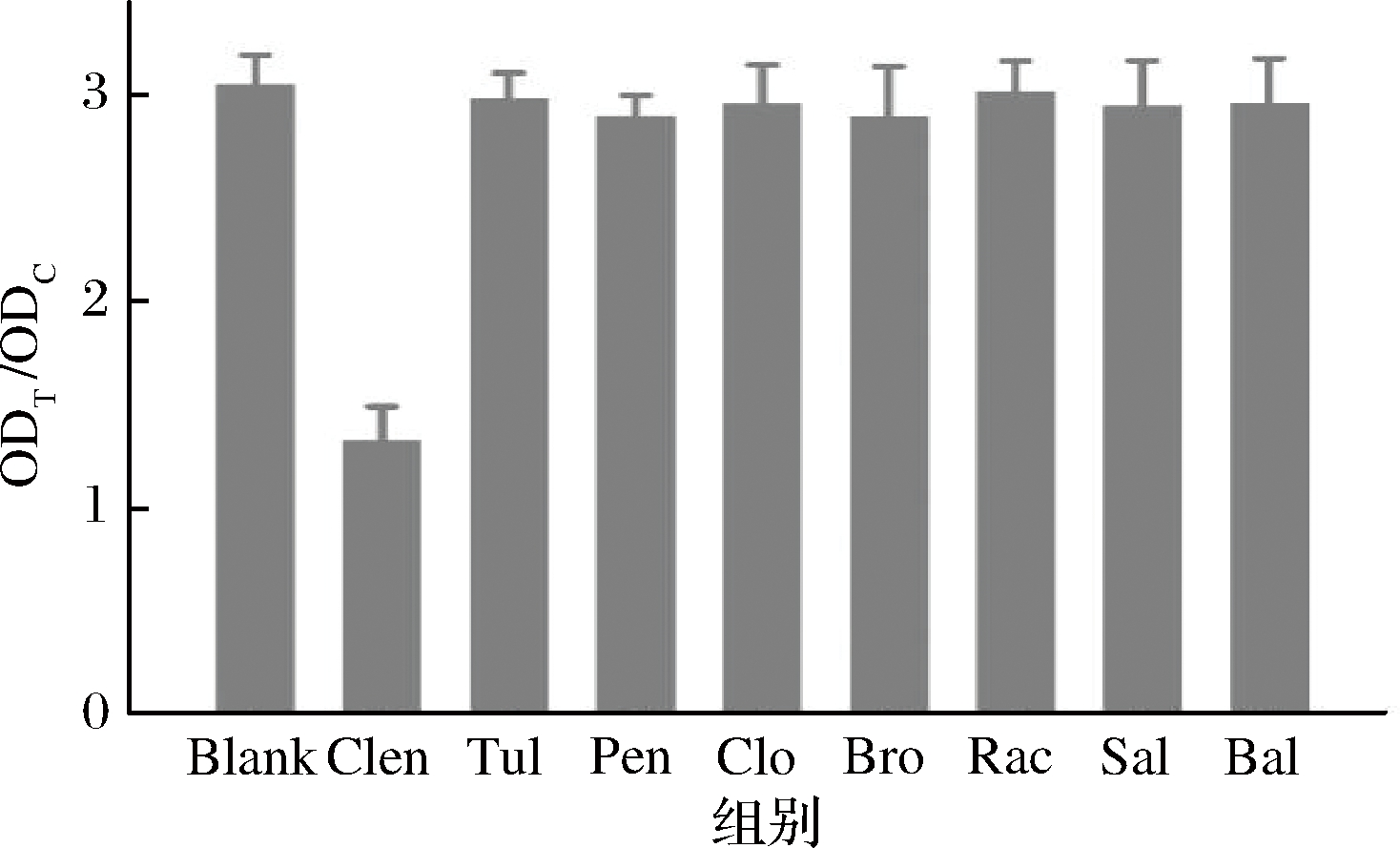
图7 MGNPs试纸条的特异性评价(n=3)
Fig.7 The specificity evaluation of MGNPs-ICA (n=3)
取Clen阴性的猪尿样品添加不同量的Clen标准品至Clen终浓度为0.313、0.625、1.25 和 2.5 ng/mL,随后采用MGNPs试纸条进行检测,每个浓度重复测定5次,计算加标回收率和相对标准偏差,评价该方法的准确性和精密度。结果如表2所示,MGNPs试纸条检测Clen阳性添加的批内和批间回收率为93.66%~114.80%,变异系数为4.28%~13.45%,表明MGNPs试纸条检测猪尿中Clen具有较高的准确度和精密度。
随机制备25份含不同Clen浓度的阳性添加猪尿样品,然后采用本研究所构建的MGNPs免疫层析试纸条和商业化Clen ELISA试剂盒同时对上述样品进行检测,依据相应的标准曲线分别计算Clen浓度,绘制相关性曲线,结果如图8所示。2种方法检测猪尿样品中Clen具有较好的一致性,其相关系数为0.968 5,表明MGNPs试纸条对实际样本中Clen的检测具有较好的实用性和可靠性。此外将该方法与现行农业行业标准方法(SB/T 10780—2012和DB22/T 1619—2011)比较,本研究方法的灵敏度高,特异性好,且操作简单、快捷。
表2 MGNPs试纸条准确性与精密度
Table 2 Accuracy and precision of MGNPs-ICA
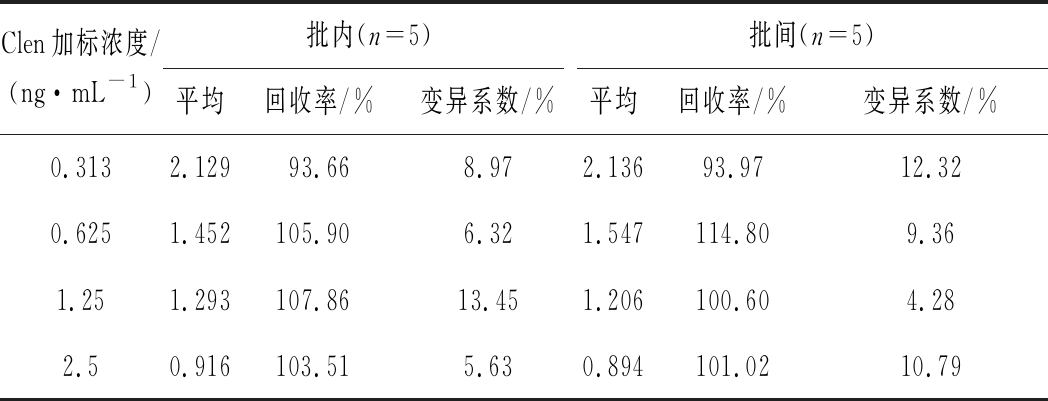
Clen加标浓度/(ng·mL-1)批内(n=5)批间(n=5)平均回收率/%变异系数/%平均回收率/%变异系数/%0.3132.12993.668.972.13693.9712.320.6251.452105.906.321.547114.809.361.251.293107.8613.451.206100.604.282.50.916103.515.630.894101.0210.79

图8 MGNPs试纸条和ELISA试剂盒检测结果之间的相关性分析
Fig.8 A correlation analysis of the detection results of MGNPs-ICA and ELISA kit
本研究通过乳液自组装方法成功制备了具有“磁包金”核壳异质结构的磁/金双功能纳米材料。相较于传统的“金包磁”纳米结构,本研究所构建的“磁包金”核壳异质结构有效规避了金壳层对磁核的磁屏蔽效应,显著提高了MGNPs的磁饱和强度以及光学信号强度。以其作为免疫层析试纸条新型标记探针,该方法检测猪尿中Clen的最低检出限为0.041 ng/mL。此外相较于实验室常用ELISA和LC-MS,MGNPs-ICA检测猪尿中Clen只需15 min,且不需昂贵的设备、专业的操作人员以及复杂的样本前处理,适于Clen的现场检测。总之,本研究为复杂基质样本中待测物的高灵敏检测提供了新的技术支撑。
[1] 陈宝文. 动物检疫中猪瘦肉精的危害及其检测方法[J]. 畜牧兽医科学(电子版), 2019(1):68-69.
[2] LOZANO M S, CHAVEZ J F, LOPEZ F A, et al. Horse meat sold as beef and consequent clenbuterol residues in the unregulated Mexican marketplace[J]. Food Control, 2020, 110:107 028.
[3] TANG Yiwei, GAO Jingwei, LIU Xiuying, et al. Ultrasensitive detection of clenbuterol by a covalent imprinted polymer as a biomimetic antibody[J].Food Chemistry, 2017, 228:62-69.
[4] DUFAYET L, GORGIARD C, VAYSSETTE F, et al. Death of an apprentice bodybuilder following 2,4-dinitrophenol and clenbuterol intake[J]. International Journal of Legal Medicine, 2020, 134:1 003-1 006.
[5] 杨慧,吴劭一,毛益申,等.盐酸克伦特罗对人类诱导多能干细胞来源心肌细胞的毒性作用[J].微循环学杂志, 2015, 25(4):15-18.
[6] XU J, LI Y, GUO J, et al. Fluorescent detection of clenbuterol using fluorophore functionalized gold nanoparticles based on fluorescence resonance energy transfer[J]. Food Control, 2014, 46:67-74.
[7] 朱自平.高效液相色谱检测猪肉盐酸克伦特罗的方法优化[J].现代食品, 2017(16):95-99.
[8] LIA L A, TOMLINSON J A, SATZGER R D, et al. Detection of clenbuterol in bovine retinal tissue by high-performance liquid chromatography with electrochemical detection[J]. Journal of Chromatography A, 1997, 762(1-2):275-280.
[9] DUVIVIER W F,VAN BEEK T A V,MEIJER T,et al. Ultratrace LC-MS/MS analysis of segmented calf hair for retrospective assessment of time of clenbuterol administration in agriforensics[J]. Journal of Agricultural and Food Chemistry, 2015, 63(2):493-499.
[10] 刘迪,韩莉,黄坤,等. 超高效液相色谱-串联质谱同时测定猪肉中传统型和新型瘦肉精[J]. 食品与机械,2019, 35(7):87-93.
[11] MA Luyao, NILGHAZ A, CHOI J R, et al. Rapid detection of clenbuterol in milk using microfluidic paper-based ELISA[J]. Food Chemistry, 2018, 246:437-441.
[12] PENG Dapeng, ZHANG Lingyan, SITU C, et al. Development of monoclonal antibodies and indirect competitive enzyme-linked immunosorbent assay kits for the detection of clenbuterol and salbutamol in the tissues and products of food-producing animals[J]. Food Analytical Methods, 2017, 10(11):3 623-3 633.
[13] HUANG Zhen,XIONG Zhijuan,CHEN Yuan, et al. Sensitive and matrix-tolerant lateral flow immunoassay based on fluorescent magnetic nanobeads for the detection of clenbuterol in swine urine[J]. Journal of Agricultural and Food Chemistry, 2019, 67(10):3 028-3 036.
[14] LI Yu, ZHOU Yaofeng, CHEN Xirui, et al. Comparison of three sample addition methods in competitive and sandwich colloidal gold immunochromatographic assay[J]. Analytica Chimica Acta, 2020,1 094:90-98.
[15] 李超辉, 罗薇, 徐波,等. 胶体金免疫层析试纸条定量检测猪尿中克伦特罗[J].食品科学,2013, 34(12):114-118.
[16] YU Q, LIU J, ZHAO G, et al. A silica nanoparticle based 2-color immunochromatographic assay for simultaneous determination of clenbuterol and ractopamine[J]. Mikrochimica Acta, 2019, 186(7):1-9.
[17] HUANG Z, PENG J, HAN J, et al. A novel method based on fluorescent magnetic nanobeads for rapid detection of Escherichia coli O157:H7[J]. Food Chemistry, 2019,276:333-341.
[18] GUO L, SHAO Y, DUAN H, et al. Magnetic quantum dot nanobead-based fluorescent immunochromatographic assay for the highly sensitive detection of aflatoxin B1 in dark soy sauce[J]. Analytical Chemistry, 2019, 91(7):4 727-4 734.
[19] 崔希,熊齐荣,熊勇华,等.免疫磁分离结合胶体金免疫层析法快速检测大肠杆菌O157∶H7[J].分析化学,2013, 41(12):1 812-1 816.
[20] CHOWDHURY A D, AGNIHOTRI N, DOONG R, et al. Label-free and nondestructive separation technique for isolation of targeted DNA from DNA-protein mixture using magnetic Au-Fe3O4 nanoprobes[J]. Analytical Chemistry, 2017, 89(22):12 244-12 251.
[21] 吕晓玥, 刘玉泉, 惠文利. 基于PCR-金磁纳米微粒层析技术检测乙醛脱氢酶2基因多态性方法的建立及应用[J]. 现代检验医学杂志,2017,32(4):21-24.
[22] HUI W, ZHANG S, ZHANG C, et al. A novel lateral flow assay based on GoldMag nanoparticles and its clinical applications for genotyping of MTHFR C677T polymorphisms[J]. Nanoscale, 2016, 8(6):3 579-3 587.
[23] YOU S M, LUO K, JUNG J Y, et al. Gold nanoparticle-coated starch magnetic beads for the separation, concentration and SERS-based detection of E. coli O157∶H7[J]. ACS Applied Materials & Interfaces, 2020, 12(16):18 292-18 300.
[24] MAZUEL F, ESPINOSA A, RADTKE G, et al. Magneto-thermal metrics can mirror the long-term intracellular fate of magneto-plasmonic nanohybrids and reveal the remarkable shielding effect of gold[J]. Advanced Functional Materials, 2017, 27(9):1 605 997.
[25] HU Y, MENG L, NIU L, et al. Facile Facile synthesis of superparamagnetic Fe3O4@polyphosphazene@Au shells for magnetic resonance imaging and photothermal therapy[J].ACS Applied Materials & Interfaces, 2013, 5(11):4 586-4 591.
[26] CHEN X, ZHU J, CHEN Z, et al. A novel bienzyme glucose biosensor based on three-layer Au-Fe3O4@SiO2 magnetic nanocomposite[J]. Sensors and Actuators B.Chemical, 2011, 159(1):220-228.
[27] AND H H, OSTERLOH F E. A simple large-scale synthesis of nearly monodisperse gold and silver nanoparticles with adjustable sizes and with exchangeable surfactants[J]. Chemistry of Materials, 2004, 16(13):2 509-2 511.
[28] FU R, JIN X, LIANG J, et al. Preparation of nearly monodispersed Fe3O4/SiO2 composite particles from aggregates of Fe3O4 nanoparticles[J]. Journal of Materials Chemistry, 2011, 21(39):15 352-15 356.
[29] HAO L, LENG Y, ZENG L, et al. Core-shell-heterostructured magnetic-plasmonic nanoassemblies with highly retained magnetic-plasmonic activities for ultrasensitive bioanalysis in complex matrix[J]. Advanced Science, 2020, 7(2):1 092 433.