表1 不同品种桃果内生细菌测序数据统计
Table 1 Statistics of sequencing data of endophytic bacteria in different peaches
样品编号原始序列数质控序列数有效序列有效OTUsYT84 21075 18261 33398PT72 09363 49550 99283SMT82 43772 95658 56189总计238 740211 633170 886106
桃作为五果之首[1],含有多种功能性的糖、酸、蛋白质、粗纤维、维生素及无机盐、胡萝卜素、尼克酸等营养物质,易于人体的消化吸收,具有美肤、清胃、润肺、祛痰等功效[2-3]。同时,桃果中的含铁量为苹果和梨的4~6倍,能够有效预防缺铁性贫血[4-5]。桃起源于中国,且种植面积及产量均居世界首位。新疆因特殊的地理条件,日照充足,昼夜温差大,利于瓜果糖分的累积,是久负盛名的“瓜果之乡”。桃作为新疆的特色水果,在南北疆广泛种植。常见的种类有水蜜桃、油桃、蟠桃等,不仅是鲜食的佳品,也可加工成桃干、罐头、果汁等产品,具有极高的食用和经济价值,是当地的特色林果和农民增收的手段[6-7]。目前,国内外相关研究主要集中于其采后生理生化变化、保鲜技术方法等方面[8-9]。近年来,植物内生菌因具有促生、固氮、抑菌防病、提高宿主抗逆能力等多种生物学作用被作为研究的热点,且在已开展的植物研究中均发现有内生菌的存在[10-11]。然而,暂未见桃果内生菌的相关研究,对其内生菌的组成与分布规律,是否存在与人体健康相关的潜在功能微生物等相关研究,更是鲜有报道。
因此,本研究以新疆特色油桃、水蜜桃、蟠桃为试验对象,采用高通量测序技术,对3类桃果采后内生细菌群落结构组成及多样性进行较为全面的解析,并对其中存在的与人体健康潜在相关的微生物进行了分析。本文的开展,为揭示桃果实内生细菌的多样性,进一步研究桃果内生细菌群落与人体健康潜在的相互关系,深度挖掘与利用内生细菌资源研究提供了科学依据。
油桃(YT)、水蜜桃(SMT)、蟠桃(PT)样品,分别采自吐鲁番市托克逊镇、阿克苏市阿瓦提县和石河子市农八师143团果园中。采用随机采样法,选择自然成熟、表皮有光泽且无损伤、颜色大小一致的桃果,经发泡网包裹装筐后,12 h内运回实验研究室,于4 ℃下贮藏。
1.2.1 预处理
各样品流水冲洗10 min,无菌纸吸干水分;75%无水乙醇处理5 min,无菌水洗涤;3.3% NaClO浸泡3 min,无菌水冲洗;75%无水乙醇浸泡1 min后,无菌水冲洗,吸干水分,并对洗涤液涂板检测确认表面消毒完全[12]。
1.2.2 DNA抽提
采用十六烷基三甲基溴化铵法对样本的基因组DNA进行大量提取,超微量分光光度计检测DNA纯度和浓度;1%琼脂糖凝胶,5V/cm电压,时间20 min检测DNA完整性[13]。
1.2.3 PCR扩增
采用引物为515F和806R,PCR参数:94 ℃、5 min;94 ℃、30 s,60 ℃、30 s,72 ℃、30 s,30 个循环;72 ℃ 、10 min。每个样本3个重复,将同一样本的PCR产物混合后取3 μL上样2%琼脂糖凝胶电泳检测。使用凝胶回收试剂盒切胶回收PCR产物,Tris-HCl洗脱;2%琼脂糖电泳检测。样品送至北京诺禾致源生物信息科技有限公司进行高通量测序[14]。
1.2.4 生物信息学分析
所得序列经Tags数据(Clean Tags)去嵌合体,排除宿主叶绿体序列数据的干扰后,以相似性97%水平以上的序列视为一个操作分类单元(operational taxonmic units,OTU),进行聚类处理,利用数据库注释物种,开展相关微生物丰度、多样性等方面的分析处理,以此来确定出微生物群落结构特征信息[15]。
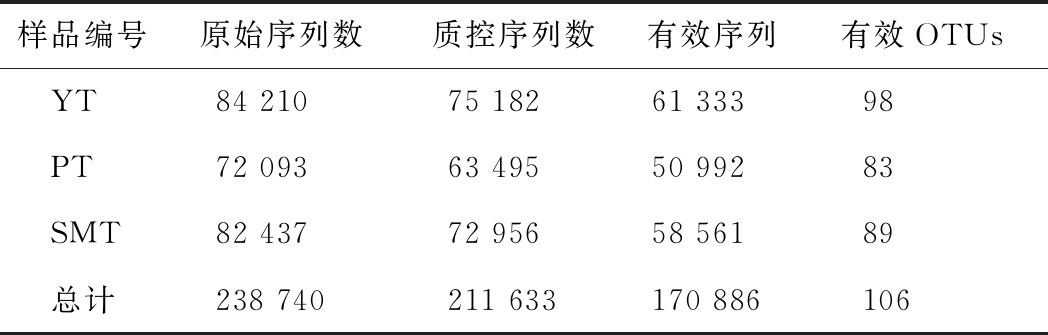
样品共测得原始序列238 740条,过滤掉低质量序列后,总数为211 633条。在上述序列进行去冗余处理后,有效序列数170 886条,并在97%相似度下将其聚类为用于物种分类的OTUs,并去除植物体内的线粒体、叶绿体相关序列后,共获得106个OTUs,其中油桃的内生细菌所得OTUs最高,共测得98个OTUs。统计得到所有样品在不同OTUs中的丰度信息,各样品测序信息结果如表1所示。
稀释曲线反映了测序的深度,也可以用来评价测序量是否足以覆盖样品所有种群。由图1可知,油桃、水蜜桃、蟠桃的稀释曲线均基本趋于平缓,但仍未达到饱和,说明此次所得序列可基本反映出桃果中真实的内生细菌菌落结构。
表1 不同品种桃果内生细菌测序数据统计
Table 1 Statistics of sequencing data of endophytic bacteria in different peaches

样品编号原始序列数质控序列数有效序列有效OTUsYT84 21075 18261 33398PT72 09363 49550 99283SMT82 43772 95658 56189总计238 740211 633170 886106
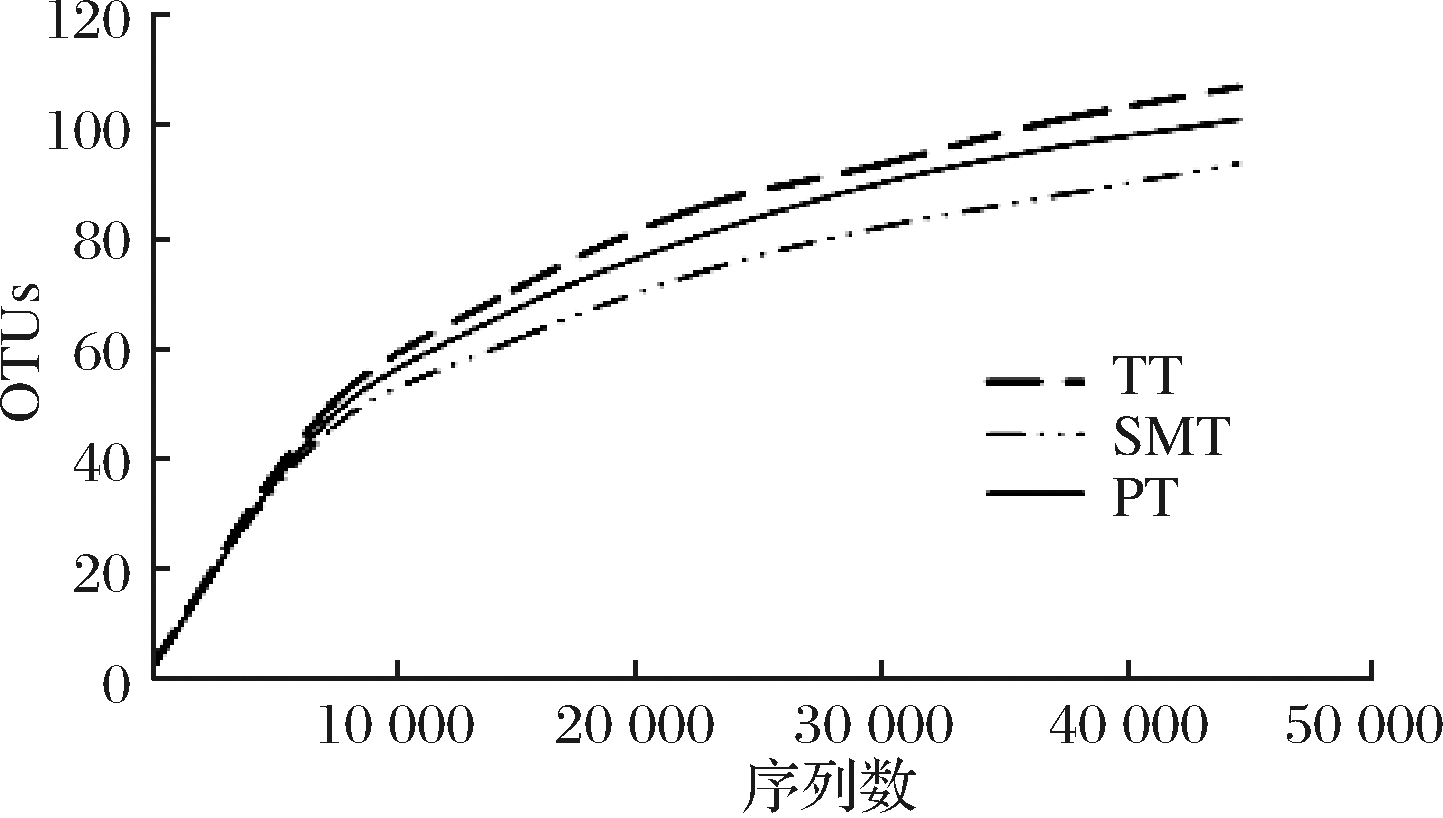
图1 桃果内生细菌的稀释曲线
Fig.1 Rarefaction curve of endophytic bacteria communities in different peaches
以各样品中分布的OTUs数为计算依据,对各样品中群落梯状性进行分析,并构建韦恩图。韦恩图能够直观反映样品当前重叠情况下的共有单元和非重叠情况下的特有分类单元数目。如图2所示,3类桃果实中共包含106个OTUs,其中以油桃的OTUs最多,包含98个OTUs,而水蜜桃中含89个OTUs,蟠桃中含有83个OTUs。在所有的106个OTUs中73个OTUs均同时出现在油桃、蟠桃和水蜜桃果实中,说明在实验选取的3类桃果中,存在极为相似的内生细菌组成。
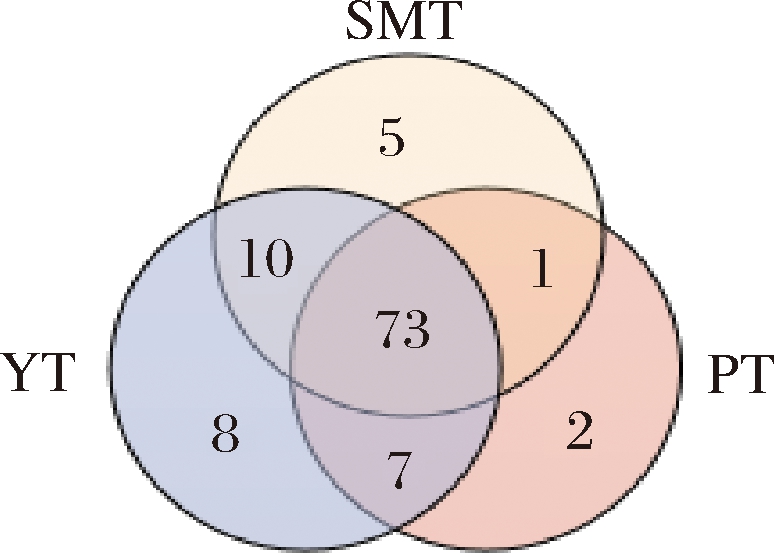
图2 三类桃果内生细菌群落相关性分析
Fig.2 Correlation analysis of endophytic bacteria communities in three kinds of peaches
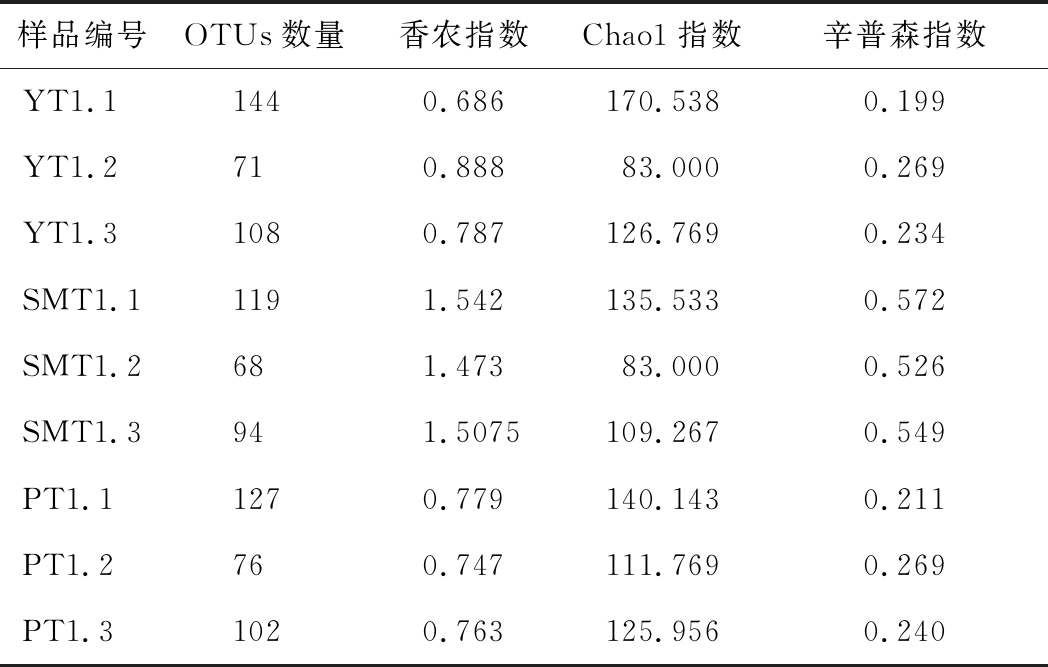
采用Alpha多样性指标中的香农指数、Chao1指数和辛普森指数反映桃果内生细菌的丰富程度。由表2可知,3类样品的Alpha多样性指数明显不同,油桃、蟠桃的Chao1数值与水蜜桃相比差异较大,说明油桃、蟠桃的分化较为明显;香农指数、辛普森指数表明,水蜜桃与油桃、蟠桃微生物群落多样性存在明显的差异。综上所述,尽管3类桃果中内生细菌群落组成较为相似,但多样性仍存在明显差异。
表2 不同品种桃果样品多样性数据统计
Table 2 Statistics of sequencing data of endophytic bacteria communities in different peaches
样品编号OTUs数量香农指数Chao1指数辛普森指数YT1.11440.686170.538 0.199 YT1.2710.88883.000 0.269 YT1.31080.787126.769 0.234 SMT1.11191.542135.533 0.572 SMT1.2681.47383.000 0.526 SMT1.3941.5075109.267 0.549 PT1.11270.779140.143 0.211 PT1.2760.747111.769 0.269 PT1.31020.763125.956 0.240
将OTU注释到各分类水平,结果如图3所示,实验所得的106个OTUs共涉及细菌的9个门,31个目,59个属。3类桃果样本中均包含变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)、芽单胞菌门(Gemmatimonadetes)、柔膜菌门(Tenericutes)、热微菌门(Thermomicrobia)、奇古菌门(Thaumarchaeota)共9个门。且均以变形菌门、厚壁菌门、拟杆菌门和放线菌门4个菌门为主,共占样品菌群的95%以上。
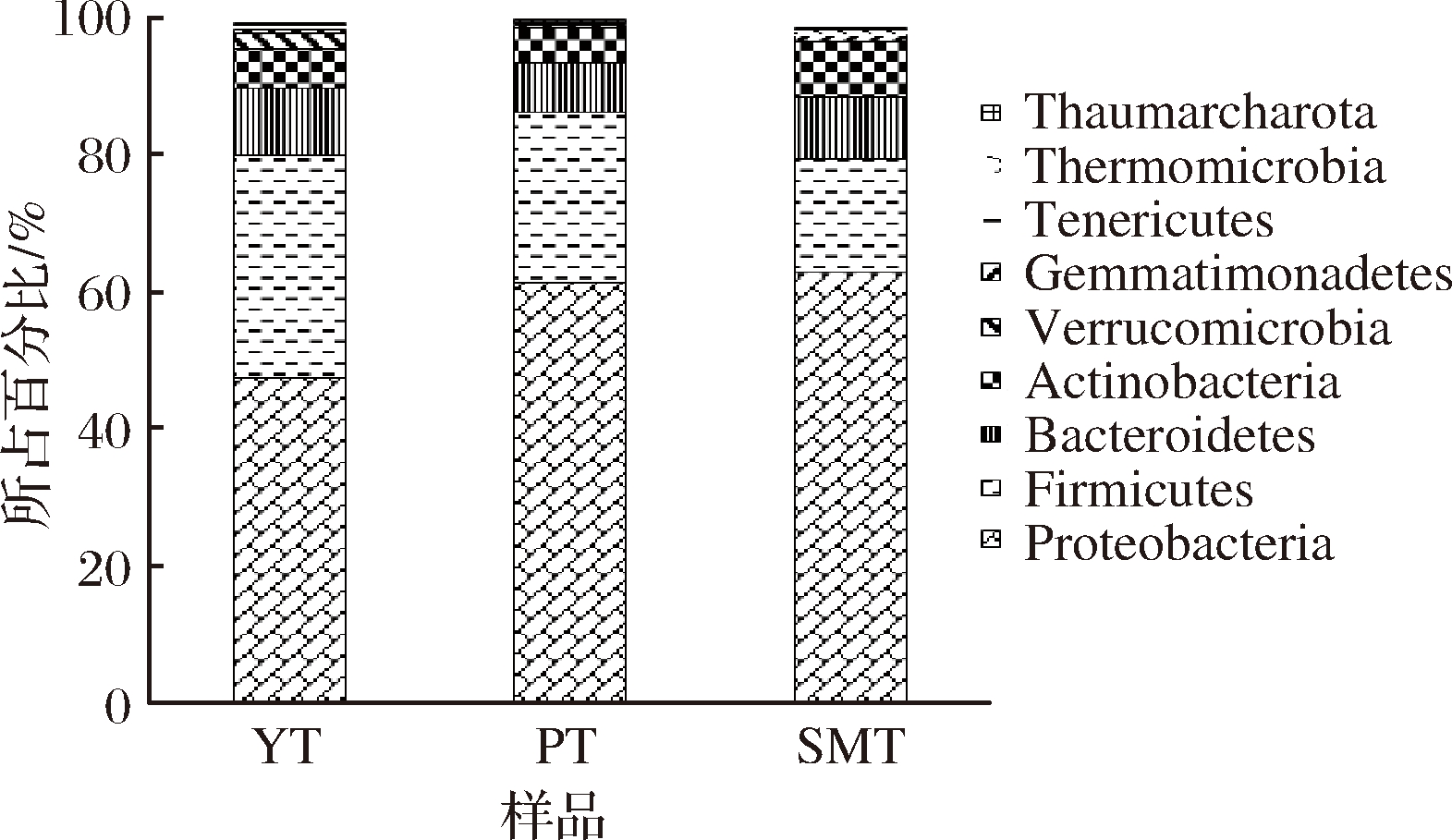
图3 各样品门水平上主要的内生细菌群落组成
Fig.3 Major phylums of endophytic bacteria communities in different peaches
目水平分析结果如图4所示,3类桃果样品中假单胞菌目(Pseudomonadales)、肠杆菌目(Enterobacteriales)均为优势菌群,二者总计占油桃、蟠桃、水蜜桃菌群的29.35%、54.82%和45.37%,但二者在不同桃果样品中的所占比例存在一定差异。蟠桃中肠杆菌目菌群相对含量最高,占总菌群数的36.67%,单胞菌目菌群仅占18.14%;水蜜桃中假单胞菌目菌群相对含量最高,占总菌群数的34.32%,肠杆菌目菌群仅占11.05%;而油桃中假单胞菌目、肠杆菌目相对含量均占总菌群数的15%左右。此外,芽孢杆菌目(Bacillales)菌群在油桃和蟠桃中的相对含量均约为16%左右,而在水蜜桃中仅占7.66%。
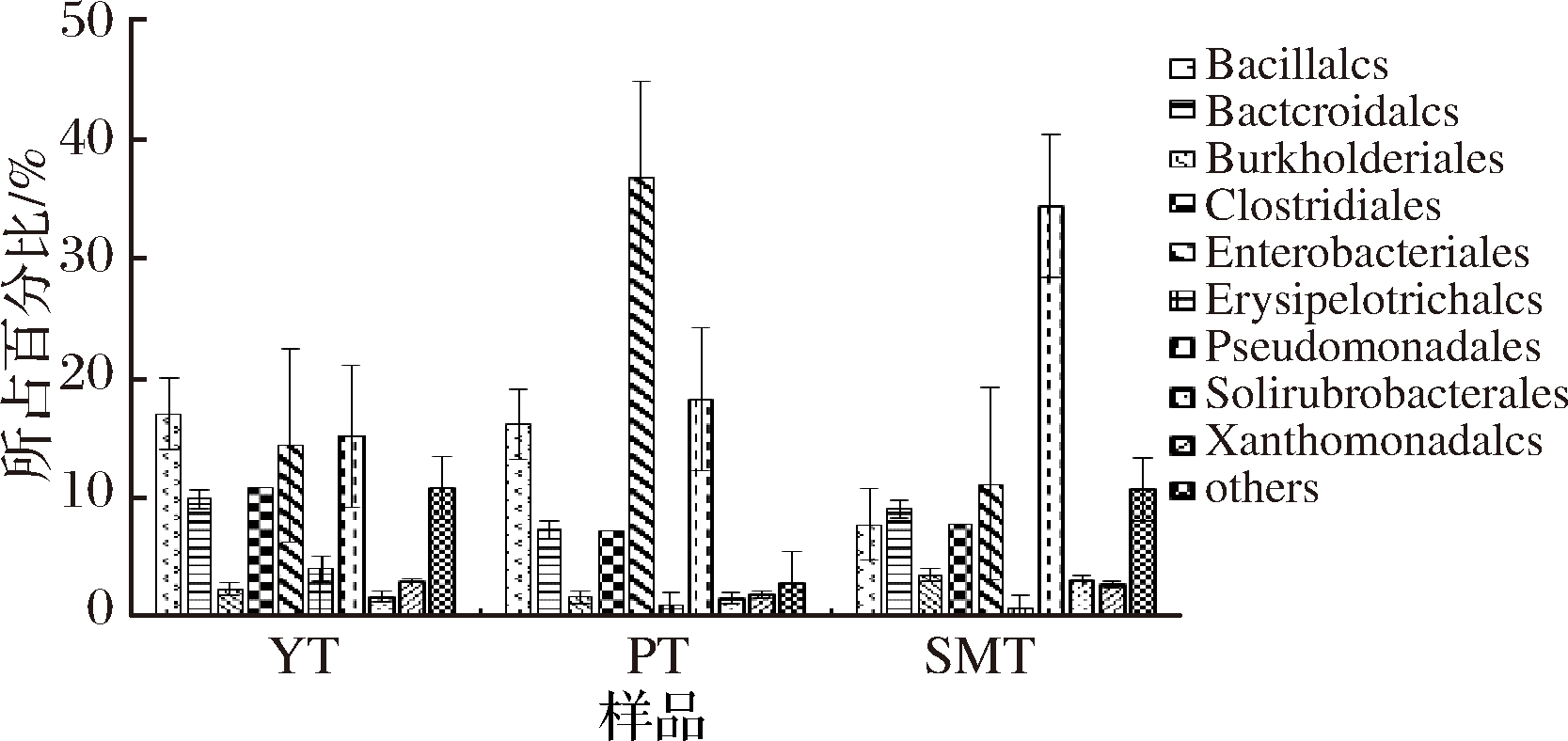
图4 各样品目水平上主要的内生细菌群落组成
Fig.4 Major orders of endophytic bacteria communities in different peaches
进一步对其属水平进行分析发现(表3),3类桃果内生细菌共涉及59个属。其中,22个为主要优势菌属,约共占总菌群的83%以上,但其所占比例在不同品种的桃果中呈现出显著差异。如表3所示,芽孢杆菌属(Bacillus)和未分类菌群高度富集于油桃果实中,分别占15.63%和15.15%;而在水蜜桃中主要菌群为泛菌属(Pantoea)和芽孢杆菌属,其中泛菌属菌群数占到总计的1/3以上;蟠桃中则为假单胞菌属(Pseudomonas)和未分类菌属菌群,分别占19.83%和16.57%。此外,不动杆菌属(Acinetobacter)、拟杆菌属(Bacteroides)也均为3类桃果的优势菌群,其所占比例均大于4%。需要指出的是,在3类桃果中均存在大量未分类菌属,表明桃果中存在大量未知的微生物资源,有待进一步发掘。
表3 各样品属水平上主要的内生细菌群落组成
Table 3 Major genera of endophytic bacteria communities in different peaches
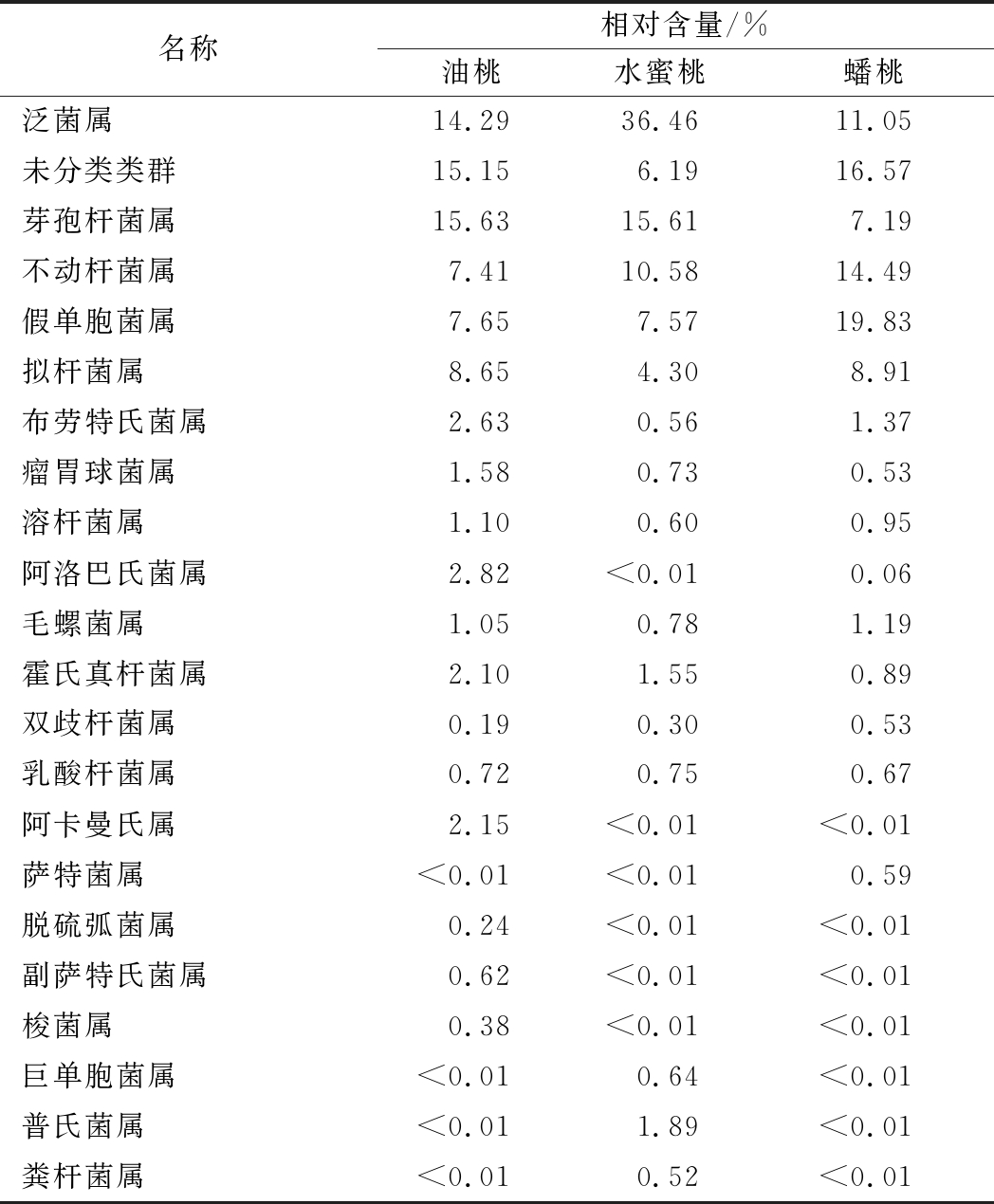
名称相对含量/%油桃水蜜桃蟠桃泛菌属14.2936.4611.05未分类类群15.156.1916.57芽孢杆菌属15.6315.617.19不动杆菌属7.41 10.58 14.49 假单胞菌属7.657.5719.83拟杆菌属8.654.308.91布劳特氏菌属2.630.561.37瘤胃球菌属1.580.730.53溶杆菌属1.100.600.95阿洛巴氏菌属2.82<0.010.06毛螺菌属1.050.781.19霍氏真杆菌属2.101.550.89双歧杆菌属0.190.300.53乳酸杆菌属0.720.750.67阿卡曼氏属2.15<0.01<0.01萨特菌属<0.01<0.010.59脱硫弧菌属0.24<0.01<0.01副萨特氏菌属0.62<0.01<0.01梭菌属0.38<0.01<0.01巨单胞菌属<0.010.64<0.01普氏菌属<0.011.89<0.01粪杆菌属<0.010.52<0.01
同时,研究发现,桃果中存在大量与人体健康相关的菌群。主要以芽孢杆菌属、拟杆菌属、布劳特氏菌属、毛螺菌属等肠胃代谢相关的有益菌群为主。以上所述菌群能够直接参与宿主的消化、吸收、代谢、营养和免疫等生理过程。此外,桃果中也存在着如浅黄假单胞菌属、铜绿假单胞菌属等潜在的条件致病菌株,但其在桃果实的含量极少,均在0.9%以下,具体情况如表4、表5所示。
表4 各样品中与人体健康有关的潜在有益菌
Table 4 Potentially beneficial bacteria on human health in different peaches
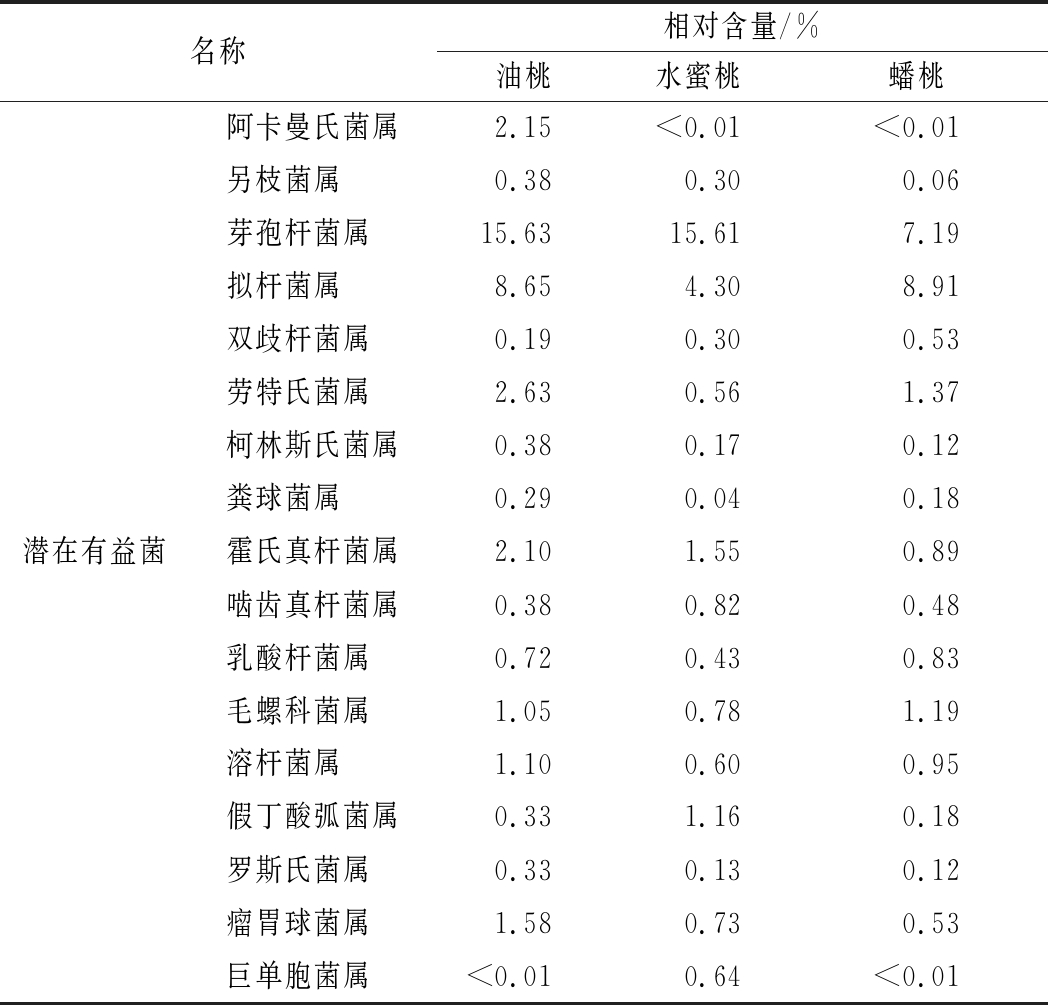
名称相对含量/%油桃水蜜桃蟠桃阿卡曼氏菌属2.15<0.01<0.01另枝菌属0.380.300.06芽孢杆菌属15.6315.617.19拟杆菌属8.654.308.91双歧杆菌属0.190.300.53劳特氏菌属2.630.561.37柯林斯氏菌属0.380.170.12粪球菌属0.290.040.18潜在有益菌霍氏真杆菌属2.101.550.89啮齿真杆菌属0.380.820.48乳酸杆菌属0.720.430.83毛螺科菌属1.050.781.19溶杆菌属1.100.600.95假丁酸弧菌属0.331.160.18罗斯氏菌属0.330.130.12瘤胃球菌属1.580.730.53巨单胞菌属<0.010.64<0.01
表5 各样品中与人体健康有关的条件致病菌
Table 5 Conditional pathogenic bacteria on human health in different peaches
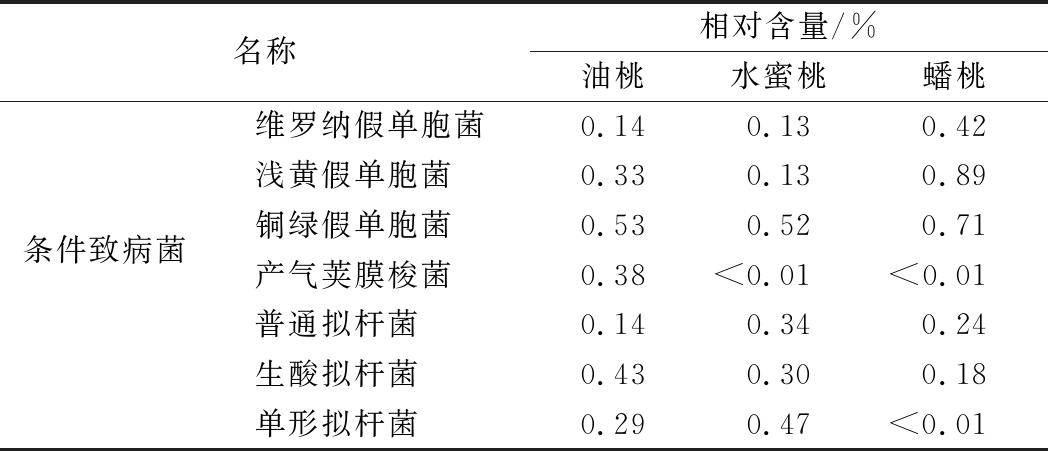
名称相对含量/%油桃水蜜桃蟠桃维罗纳假单胞菌0.140.130.42浅黄假单胞菌0.330.130.89条件致病菌铜绿假单胞菌0.530.520.71产气荚膜梭菌0.38<0.01<0.01普通拟杆菌0.140.340.24生酸拟杆菌0.430.300.18单形拟杆菌0.290.47<0.01
植物内生菌在长期的系统演化过程中,与宿主形成了高度协同进化关系。植物可为内生菌提供生长所需要的能量及营养,内生菌可通过相关的信号传导作用和自身的代谢产物对植物生长产生影响[16]。蔡学清等[17-18]发现内生细菌能在荔枝叶片、花、幼果及采后果皮上定殖,可在花和幼果间传导,且对果实中的营养成分产生一定影响。如内生细菌能够降低荔枝果实的可溶性糖、甘氨酸、丙氨酸和精氨酸含量,提高还原性VC及游离有机酸和氨基酸含量。许日升等[19]发现内生细菌为花生的主要类群,具有固氮、抗病、分泌植物激素、促进花生吸收营养元素等多方面的有益作用。目前也有少量研究表明,一些食品功能因子可以通过影响肠道微生物,间接地影响人体健康[20]。如KRAUTKRAMER等[21-22]发现劳特氏菌、粪球菌、瘤胃球菌、柯林斯氏菌等与体重指数和血脂代谢密切相关,可被认为是肠道微生物群与肥胖之间的中介。郭虹雯等[23-24]发现通过改善肠道中拟杆菌门与厚壁菌门的相对丰度,降低厚壁菌门与拟杆菌门比例,可达到减肥降脂的效果。
本文采用高通量测序技术,对新疆特色油桃、蟠桃、水蜜桃果内生细菌群落结构组成及多样性进行了分析。结果表明,桃果中存在着丰富的内生细菌资源,3类实验桃果内生细菌共涉及9个门的59个属,其中以变形菌门、厚壁菌门、拟杆菌门和放线菌门4个菌门为主。但不同品种间的桃果内生细菌群落组成存在显著差异。如芽孢杆菌属菌群高度富集于油桃果实组织内部,而在水蜜桃中则为泛菌属类,蟠桃中为假单胞菌属类。此外,通过对3类桃果内生细菌群落组成的分析发现,桃果中存在着大量利于人体健康的有益菌群,可能与人体肠胃代谢相关。如双歧杆菌可以发酵碳水化合物产生乳酸,帮助消化吸收,酸化肠内环境,阻止有害菌在肠上皮的黏附[25]。阿克曼氏菌能够分解细胞泌的黏蛋白,改善肥胖,降低血糖[26]。一些芽孢杆菌和酵母菌可参与和调节宿主对营养物质的正常消化和吸收,同时维持肠道内微生物菌群的平衡等,降低肥胖、炎症性肠炎、糖尿病和免疫缺陷疾病等的发生概率[27-28]。同时,实验也发现在桃果中存在一定数量的条件致病菌,其是否会在食用过程中定植并导致相关疾病,有待进一步研究和验证。
上述研究结果,初步揭示了新疆3类桃果采后内生细菌群落结构组成及多样性,为进一步分析桃果内生细菌群落与人体健康的相互关系,深度挖掘与利用内生细菌资源等研究提供了科学依据。
[1] 邢震. 保鲜剂处理结合冰温对大久保桃采后品质劣变的影响研究[D]. 石河子: 石河子大学, 2010.
[2] 陈健. 五果之首属鲜桃[J]. 健康指南:医疗保健服务, 2016(9): 38-39.
[3] WANG Y, LIN D, WANG X, et al. The impact of a novel peach gum-derived polysaccharide on postprandial blood glucose control in streptozotocin-induced diabetic mice[J]. International Journal of Biological Macromolecules, 2017, 98: 379-386.
[4] 卢娟芳, 刘盛雨, 芦旺, 等. 不同类型桃果肉酚类物质及抗氧化活性分析[J]. 中国农业科学, 2017, 50(16): 3 205-3 214.
[5] SATTAR S, IMRAN M, MUSHTAQ Z, et al. Functional quality of optimized peach-based beverage developed by application of ultrasonic processing[J]. Food Science & Nutrition, 2019, 7(11):3 692-3 699.
[6] 克里木·伊明, 韩立群, 玛尔哈巴·吾斯曼, 等. 新疆桃果实性状调查与评价研究[J]. 新疆农业科学, 2017, 54(6): 1 041-1 046.
[7] 邰晓亮. 不同贮藏条件对蟠桃采后生理及贮藏效果影响的研究[D]. 石河子: 石河子大学, 2010.
[8] WANG Q, WEI Y, CHEN X, et al. Postharvest strategy combining maturity and storage temperature for 1-MCP-treated peach fruit[J]. Journal of Food Processing and Preservation, 2020,44(4):e14 388.
[9] ZHOU D, WEI Y, PENG J, et al. Carvacrol and eugenol inhibit postharvest soft rot disease by enhancing defense response in peaches during storage[J]. Journal of Food Processing and Preservation, 2019, 43(9): e14 086.
[10] 黄敬瑜, 张楚军, 姚瑜龙, 等.植物内生菌生物抗菌活性物质研究进展[J].生物工程学报, 2017, 33(2): 178-186.
[11] 程亮.青藏高原矮火线草内生细菌多样性及生物功能分析[J].南方农业学报,2019,50(10):2 222-2 233.
[12] 张猛, 王琼, 冯发运, 等. 植物内生特基拉芽胞杆菌的分离、鉴定及防治西瓜枯萎病效果[J].中国生物防治学报, 2017, 33(3): 371-377.
[13] 王玉霞, 李唯, 王旺田,等. 植物果实特异性启动子E8基因的克隆[J]. 华北农学报, 2008, 23(3): 16-19.
[14] 木尼热木·阿力木江, 楚敏, 唐琦勇, 等. 辐射污染区盐爪爪根际可培养细菌群落组成及功能特性[J]. 微生物学通报, 2018, 45(7): 1 416-1 425.
[15] 申艳红,姜涛,刘璐琪,等.基于高通量测序发掘番木瓜果实成熟相关miRNA[J].果树学报,2019,36(1):1 473-1 482.
[16] 王梦颖. 香蕉内生菌多样性分析及广谱拮抗菌筛选[D]. 海口: 海南大学, 2014.
[17] 蔡学清, 陈炜, 林娜, 等. 内生细菌在荔枝体内的定殖及其防病保鲜功能[J]. 应用生态学报, 2011, 22(8): 2 140-2 146.
[18] 蔡学清, 林娜, 陈炜, 等. 内生细菌对荔枝果实营养成分的影响[J]. 福建农林大学学报(自然科学版), 2010,39(3):236-240.
[19] 许日升, 张伟, 苏春沦, 等. 花生内生菌及其应用研究进展[EB/OL]. 北京: 中国科技论文在线.[2015-02-09].http://www.paper.edu.cn/releasepaper/content/4631609.
[20] 周克茹. n-3多不饱和脂肪酸对肠道菌作用线虫模型的建立与应用[D]. 无锡: 江南大学, 2017.
[21] KRAUTKRAMER K, KREZNAR J, ROMANO K A, et al. Diet-microbiota interactions mediate global epigenetic programming in multiple host tissues[J]. Molecular Cell, 2016,64(5):982-992.
[22] HOODA S, BOLER B M V, KERR K R, et al. The gut microbiome of kittens is affected by dietary protein:Carbohydrate ratio and associated with blood metabolite and hormone concentrations[J]. British Journal of Nutrition, 2013, 109(9): 1 637-1 646.
[23] 郭虹雯, 许翔雨, 陈莹婕, 等. 绿茶茶汤对肥胖相关肠道菌群的影响[J]. 茶叶科学, 2016, 36(4): 354-362.
[24] 黄菊青, 林斌, 徐庆贤, 等. 绞股蓝茶饮对高脂血症大鼠脂质代谢和肠道菌群的影响[J]. 中国食品学报, 2018, 18(6): 27-32.
[25] MARCO T, ROBERTA D G I, LAURA S, et al. Effect of Lactobacillus rhamnosus HN001 and Bifidobacterium longum BB536 on the healthy gut microbiota composition at phyla and species level: A preliminary study[J]. World Journal of Gastroenterology, 2017, 23(15): 2 696-2 704.
[26] DAO M C, EVERARD A, ARON-WISNEWSKY J, et al. Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity: Relationship with gut microbiome richness and ecology[J]. Gut Microbiota, 2016, 65(3): 426-436.
[27] 秦红, 蔡传江, 赵燕, 等. 酿酒酵母和芽孢杆菌对育肥猪养分表观消化率、肠道形态结构和肠道免疫的影响[J]. 动物营养学报, 2017, 29(12): 4 459-4 468.
[28] 江向洋. 肠道菌群与NAFLD发生发展的关联代谢机制研究[D]. 杭州: 浙江大学, 2017.