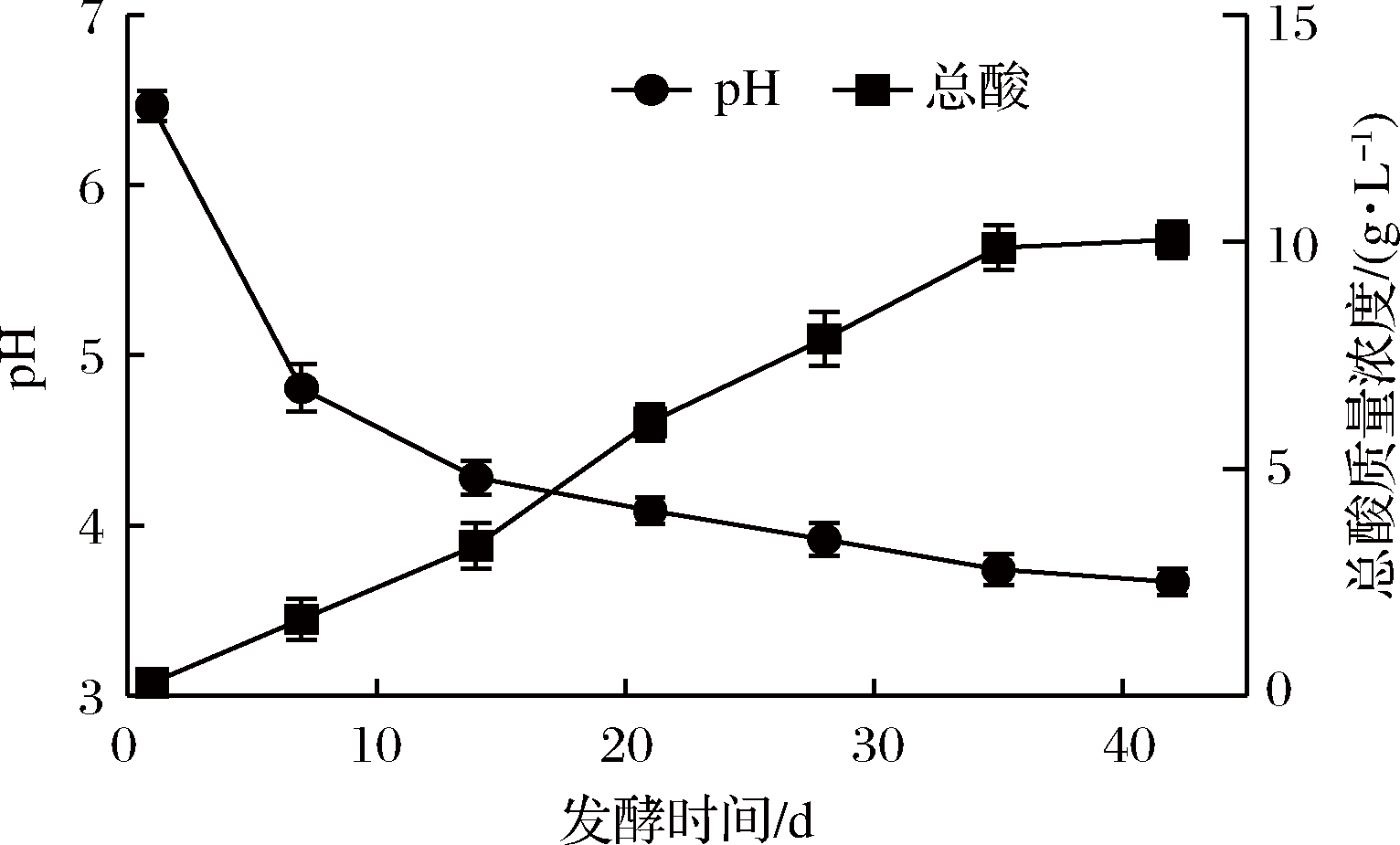
图1 酸菜发酵过程中pH和总酸含量的动态变化
Fig.1 Dynamic changes of pH and total acid content during the fermentation of sauerkraut
酸菜是指蔬菜在低盐盐渍的环境下经过发酵腌制而得到的传统发酵食品,通常以白菜为主要原料进行腌制。经过发酵后的酸菜制品,不仅具有酸鲜纯正、脆嫩芳香、清爽可口、增进食欲等特点,还提高了原料的营养价值,深受人们喜爱[1]。正是酸菜过程中微生物的多样性及代谢的复杂变化才造就其酸香可口的口感。在整个发酵过程中,发酵液中各项理化指标及微生物群落结构的变化对酸菜品质和风味等起着至关重要的作用。为精确调控发酵工艺,有必要全面解析发酵过程中微生物群落结构和化学成分的动态变化,这对于形成口感俱佳、风味独特和营养价值高的产品尤为重要[2-3]。
近年来,高通量测序[4-5]技术被广泛用于研究传统酿造食品的微生物群落组成。折米娜等[4]采用高通量测序发现恩施地区酸菜水中乳杆菌属的相对丰度可达76.25%,说明乳酸菌是酸菜发酵最为重要的微生物之一。乳酸菌可能来源于发酵原料和自然环境,其可将原料中的小分子糖类物质转化为酸类化合物,从而赋予酸菜柔和的酸感;部分糖类物质被转化为醇类化合物,这些醇类物质和酸类代谢物反应形成酯类物质,进而赋予产品具有酯香和醇香等特征[6]。乳酸菌通过蛋白水解系统分解发酵基质中的可溶性蛋白形成短肽和氨基酸等小分子,赋予产品独特的鲜味特征[7]。此外,DU等[8]发现接种干酪乳杆菌(Lactobacillus casei 11MZ-5-1)会显著降低酸菜发酵过程中细菌的多样性和丰富度。韩宏娇等[9]发现乳酸菌的数量与pH及可溶性蛋白含量呈显著负相关,而大肠菌群的数量与pH、还原糖、可溶性蛋白及氨基酸态氮含量呈显著正相关。然而,对原核微生物群落与这些理化因子变化的潜在作用和关系还知之甚少。
本研究利用16S rRNA高通量测序技术揭示酸菜发酵过程中原核微生物群落的组成和演替,并探究理化因子的变化规律和不同发酵时间的标志性微生物。建立理化因子与细菌群落结构之间的典型相关分析(canonical correlation analysis, CCA)和与不同物种之间的相关性分析。旨在探究细菌群落与理化因子之间的相互关系,以期更好地了解酸菜发酵过程中的菌群变化原因,为精确人工调控提供理论依据。
取安徽省某调味品有限公司2个不同发酵缸发酵1、7、14、21、28、35、42 d的酸菜发酵液,置于-20 ℃下贮藏,待用。
(CH2COO)2Zn、亚铁氰化钾、盐酸萘乙二胺、酒石酸钾钠等(分析纯),国药集团化学试剂有限公司;乳酸、乙酸、柠檬酸、酒石酸、草酸、苹果酸、琥珀酸等(色谱纯),上海阿拉丁生化科技股份有限公司;E.Z.N.A.® 水样DNA 提取试剂盒,美国Omega公司;微生物高通量测序建库试剂盒,北京诺禾致源公司。MinElute® PCR Purification Kit,德国Qiagen公司;Truseq® DNA PCR-Free Sample Preparation Kit,美国Illumina公司。
FE28 pH计,瑞士Mettler-Toledo公司;UV-2550紫外可见分光光度计,日本岛津公司;5810R高速冷冻离心机,德国Eppendorf公司;1260高效液相色谱仪,美国Agilent公司;Illumina Miseq PE250测序仪,美国Illumina公司;NaneDrop 2000超微量分光光度计,美国Thermo公司。
1.3.1 理化性质分析
用pH计测定酸菜发酵液样品的pH值;使用滴定法测定总酸含量[10];采用斐林试剂滴定法测定还原糖含量[11];采用盐酸萘乙二胺法测定亚硝酸盐含量[12];使用甲醛滴定法测定氨基酸态氮含量[13]。
采用高效液相色谱仪检测有机酸含量。取适量酸菜发酵液,加入等体积的ZnSO4和亚铁氰化钾,摇匀,10 000 r/min离心20 min,保留上清液过0.45 μm水系滤膜后待用。色谱条件:进样量10 μL;流动相为0.02 mol/L的NaH2PO4溶液;柱流速 0.7 mL/min;检测波长210 nm;柱温30 ℃。
1.3.2 DNA提取与Illumina高通量测序
使用E.Z.N.A.®水样DNA 提取试剂盒提取酸菜液样品中微生物的基因组DNA。使用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)进行聚合酶链式反应(polymerase chain reation,PCR)扩增,扩增体系(20 μL)包括模板DNA 10 ng,正向及反向引物各 10 pmol/L,2×Phusion Master Mix 10 μL。扩增程序参考沈毅等[14]的方法,扩增产物使用2%(质量分数)的琼脂凝胶进行电泳检测。使用MinElute® PCR Purification Kit对PCR扩增产物进行纯化。利用Truseq® DNA PCR-Free Sample Preparation Kit制备测序文库并添加接头序列,经NaneDrop 2000确定文库质量,使用Illumina Miseq PE250测序平台进行高通量测序。
1.3.3 测序数据处理与统计学分析
采用FLASH软件[15]对测序的原始数据进行拼接,利用QIIME软件[16]对低质量的拼接序列进行过滤,使用UCHIME软件[17]去除嵌合体,得到优质序列。根据UCLUST软件[18]在相似性97%的水平上对优质序列进行聚类,得到各可操作分类单元(operational taxonomic unit, OTU),以各OTU中丰度最高的序列作为代表序列。在80%置信水平下,通过Silva 132数据库[19]对OTU进行分类学注释,将蓝藻门和不能注释到门水平的OTU删除。利用QIIME软件[16]对样品进行多样性分析。基于OTU列表的主成分分析、样本聚类分析、CCA和各OTU与理化因子的pearson相关性分析均通过R软件实现。酸菜样本理化因子之间的差异显著性分析通过SPSS方差分析(ANOVA)实现。
理化因子是决定酸菜产品品质的重要因素之一。图1是酸菜发酵过程中pH和总酸的变化情况,发酵1~14 d,发酵液的pH值快速降低,从pH值6.47下降至4.28;随后pH值随发酵时间的延长而缓慢下降,于发酵42 d稳定在3.68。此外,总酸含量则随着发酵时间而持续上升,在发酵35 d达到稳定,可达9.88 g/L。酸性环境会抑制不耐酸有害菌的生长,可促进部分抗酸乳酸菌的繁殖,导致总酸含量持续增加[20]。而在发酵35 d之后,发酵环境中的碳源和氮源被大量消耗而不足,造成微生物群落结构和数量趋于稳定,使发酵环境中总酸含量趋于稳定。

图1 酸菜发酵过程中pH和总酸含量的动态变化
Fig.1 Dynamic changes of pH and total acid content during the fermentation of sauerkraut
还原糖是促进微生物生长繁殖的主要能源物质之一。由图2可知,还原糖含量在整个酸菜发酵过程中持续下降。发酵1~21 d,发酵液的还原糖含量快速降低,由2.22%下降至0.51%;随后缓慢降低,于发酵35 d达到稳定,其还原糖含量维持在0.01%(体积分数)左右。结果表明,微生物降解还原糖主要发生在发酵1~21 d。说明较高的还原糖含量可为微生物提供了丰富的营养来源,使其大量繁殖,进一步将还原糖转化为酸、醇和酯等风味物质[21]。
酸菜属于腌制食品,在腌制初期,酸菜及发酵器具上携带的肠杆菌和黄杆菌属等革兰氏阴性菌会分泌硝酸还原酶,从而将酸菜中的大量硝酸盐还原为亚硝酸盐[22]。如图2所示,发酵液中亚硝酸盐含量在整个发酵过程中呈先上升后下降的趋势,于发酵14 d达到最大值,可达到50.73 mg/L。这个结果与ZHOU等[23]研究结果一致。亚硝酸盐含量在发酵35~42 d达到稳定,维持在2.02 mg/L左右,其含量远低于国标规定泡菜中的亚硝酸盐含量为20 mg/L的限量标准[24]。
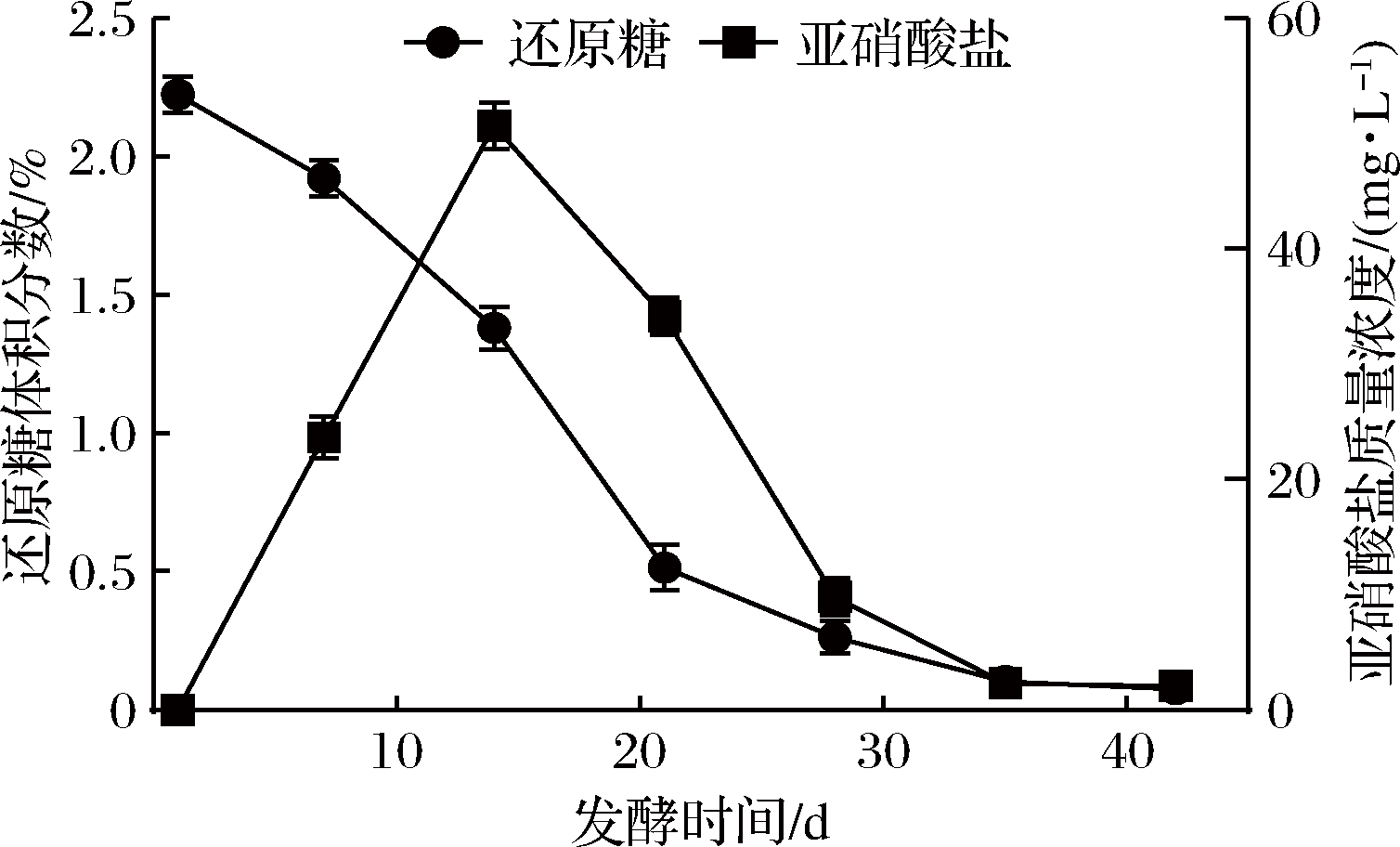
图2 酸菜发酵过程中还原糖和亚硝酸盐含量的动态变化
Fig.2 Dynamic changes of reducing sugar and nitrite content during the fermentation of sauerkraut
有机酸是指示酸菜发酵进程的一个重要指标。监测了乳酸、乙酸、柠檬酸、草酸、苹果酸、琥珀酸和酒石酸在整个发酵过程的变化规律。由表1可知,在发酵1 d时,只检测到了柠檬酸、草酸和琥珀酸这3种有机酸,但随着发酵的不断进行,这3种有机酸的含量也在逐渐增加,其在发酵42 d时可分别达到2 162.03、913.84和293.12 mg/L。此外,在发酵42 d时还检测到乳酸、乙酸、苹果酸和酒石酸,这些有机酸含量在整个发酵过程也呈增加的趋势,其中乳酸含量增加最显著,在发酵42 d时质量浓度可达9 087.35 mg/L,占整个有机酸比例的64.14%。说明乳酸是影响酸菜口感的主要有机酸,其含量及比例决定了酸菜的品质。马艺荧等[25]发现乳酸在东北酸菜酸感形成过程中起主导作用,柠檬酸、乙酸、草酸、苹果酸、琥珀酸及酒石酸则起到辅助作用,且这些有机酸含量及比例合适时对酸菜柔和酸感起到促进作用,而含量及比例不合适时会破坏柔和酸感。
表1 酸菜发酵过程中有机酸的动态变化 单位:mg/L
Table 1 Dynamic changes of organic acid content during the fermentation of sauerkraut
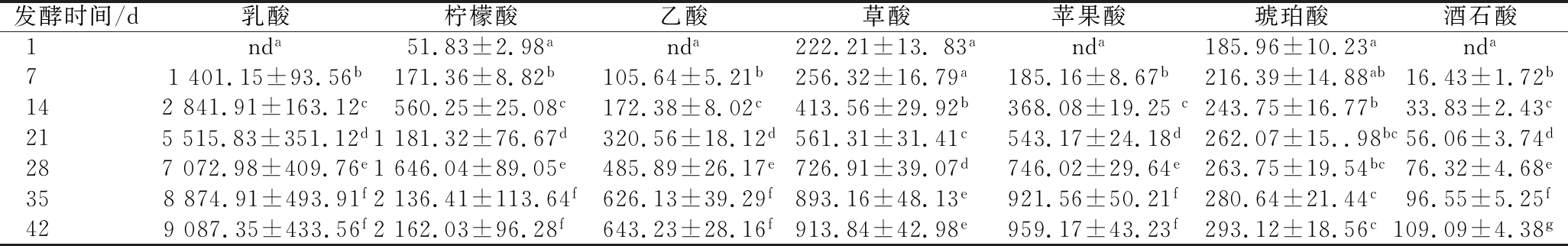
发酵时间/d乳酸柠檬酸乙酸草酸苹果酸琥珀酸酒石酸1nda51.83±2.98anda222.21±13.83anda185.96±10.23anda71401.15±93.56b171.36±8.82b105.64±5.21b256.32±16.79a185.16±8.67b216.39±14.88ab16.43±1.72b142841.91±163.12c560.25±25.08c172.38±8.02c413.56±29.92b368.08±19.25c243.75±16.77b33.83±2.43c215515.83±351.12d1181.32±76.67d320.56±18.12d561.31±31.41c543.17±24.18d262.07±15..98bc56.06±3.74d287072.98±409.76e1646.04±89.05e485.89±26.17e726.91±39.07d746.02±29.64e263.75±19.54bc76.32±4.68e358874.91±493.91f2136.41±113.64f626.13±39.29f893.16±48.13e921.56±50.21f280.64±21.44c96.55±5.25f429087.35±433.56f2162.03±96.28f643.23±28.16f913.84±42.98e959.17±43.23f293.12±18.56c109.09±4.38g
注:nd表示未检出,同列不同小写字母表示差异显著(P <0.05)
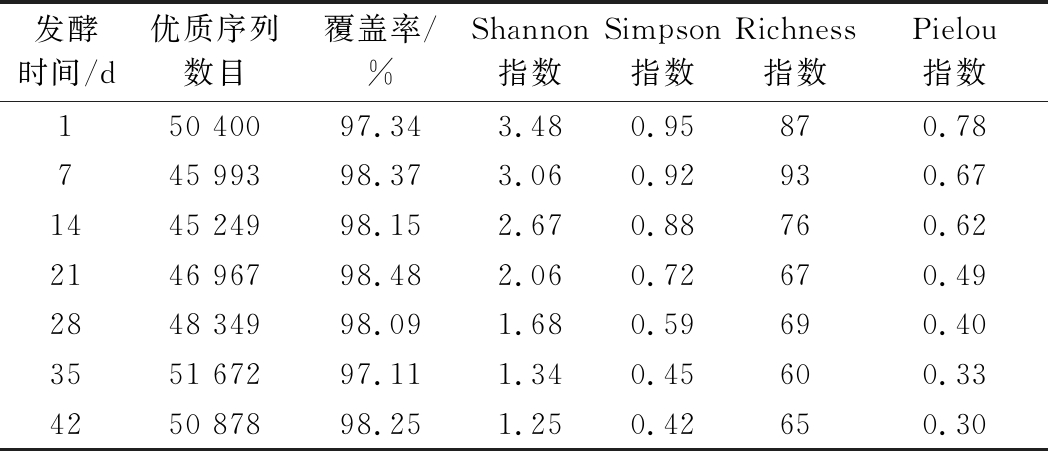
利用Illumina Miseq高通量测序技术可得到679 020条优质序列,平均42 581 ~ 53 062条/样本。根据样本的最低序列数对所有样本进行抽平,抽平后进行后续分析。通过OTU聚类(97%相似度)后可得到105个OTU,OTU平均65~95个/样本。每个样本的测序覆盖率>97%,说明测序数目足够,测序序列可以代表其菌群组成。Shannon指数、Simpson指数、Richness指数和Pielou指数是评价群落多样性、丰富度和均匀度的常用指数。由表2可知,发酵1 d时,样本中细菌的Shannon指数、Simpson指数和Pielou指数均最高,说明在发酵初始时群落的多样性和均匀度最高。结果说明酸菜、发酵器具及发酵环境中含有大量的细菌,可能正是这些细菌促进了酸菜发酵。随着发酵的不断进行,Shannon指数、Simpson指数和Pielou指数均逐渐下降。说明酸性环境会抑制大部分微生物的生长繁殖,但会促进某些耐酸微生物的增殖,增加其在群落中的比例,从而造成微生物多样性和均匀度均下降。而Richness指数在整个发酵过程中呈先下降后上升的趋势,说明有些微生物只能在特定的环境下才能激活其生长繁殖,而在其他环境下可处于休眠的状态。
表2 酸菜发酵过程中原核微生物群落序列数量和多样性参数
Table 2 Sequence numbers and diversity indices of prokaryotic microbial communities during the fermentation of sauerkraut
发酵时间/d优质序列数目覆盖率/%Shannon指数Simpson指数Richness指数Pielou指数150 40097.343.480.95870.78745 99398.373.060.92930.671445 24998.152.670.88760.622146 96798.482.060.72670.492848 34998.091.680.59690.403551 67297.111.340.45600.334250 87898.251.250.42650.30
注:表中数值为2个同一天发酵样本的平均值
根据原核微生物群落信息对14个酸菜样本进行聚类分析。如图3所示,发现2个不同发酵缸的原核微生物群落变化具有一致性,说明酸菜发酵具备批次稳定性。稳定的微生物群落变化造就了产品口感、品质和功能的稳定。此外,对14个酸菜样本的OTU列表进行主成分分析。由图4所示,这些样本在第1主成分(90.94%)的差异非常明显,而在第2主成分(6.52%)的差异却很小。说明某些OTU是主导着整个发酵的变化,驱动着发酵不断进行。
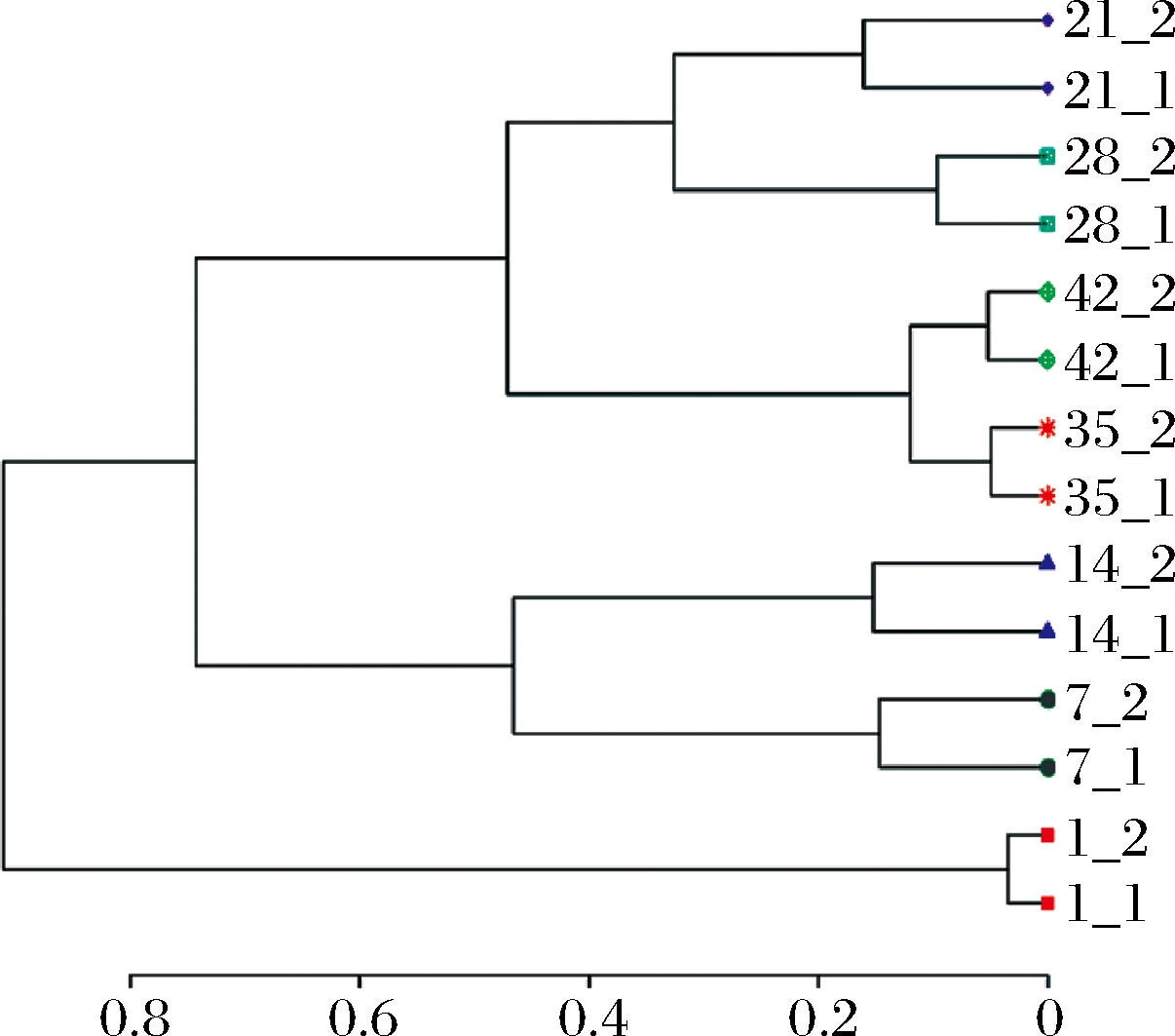
图3 酸菜发酵过程中样本的层次聚类
Fig.3 Hierarchical clustering of samples during the fermentation of sauerkraut
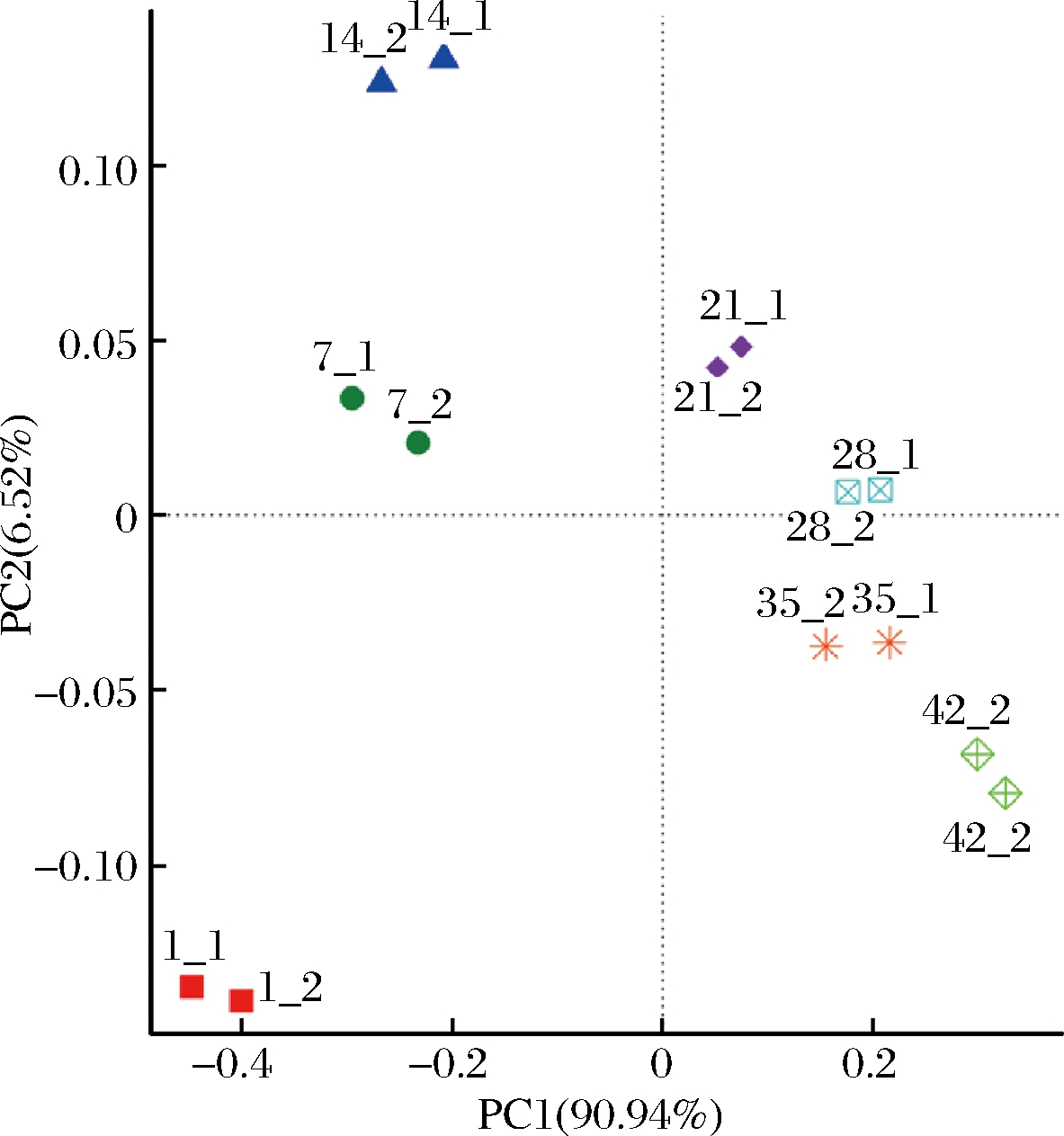
图4 酸菜发酵过程中菌群OTU组成的主成分分析
Fig.4 Cluster analysis of the OTU composition of samples based on principal component analysis during the fermentation of sauerkraut
如图5所示,根据数据库注释结果,可将OTU分为5个不同的门,分别为放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、Patescibacteria和变形菌门(Proteobacteria)。拟杆菌门、厚壁菌门和变形菌门在整个酸菜发酵过程占绝对优势,其相对丰度之和>98%。在发酵过程中,拟杆菌门和变形菌门的相对丰度持续降低,分别从19.19%和61.15%下降至低于0.01%和2.11%。而厚壁菌门则在发酵过程中逐渐增加,其相对丰度从16.73%增加至97.85%。说明厚壁菌门对酸菜发酵起主导作用。
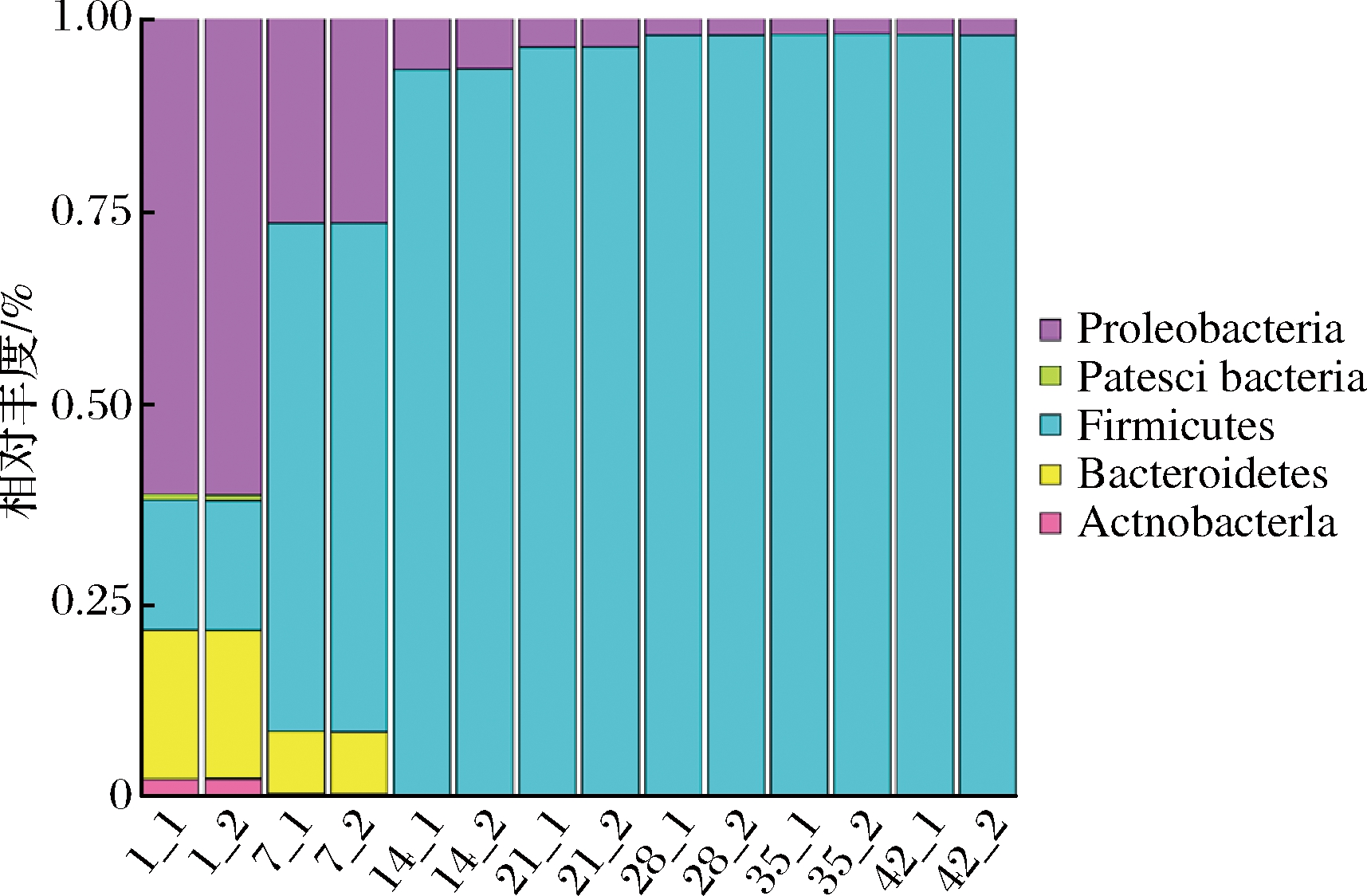
图5 酸菜发酵过程中原核微生物群落在门水平的分布
Fig.5 Distribution of prokaryotic microbial communities in samples at phylum level during the fermentation of sauerkraut
发酵1 d的样本中细菌群落组成与其他样本差异显著。从图6可知,发酵1 d的样本中平均相对丰度超过1%的优势属为不动杆菌属(Acinetobacter)、柄杆菌属(Caulobacter)、柠檬酸杆菌属(Citrobacter)、肠球菌属(Enterococcus)、爱文氏菌属(Ewingella)、乳球菌属(Lactococcus)、明串珠菌属(Leuconostoc)、泛菌属(Pantoea)、假单胞菌属(Pseudomonas)、沙雷氏菌属(Serratia)、鞘氨醇杆菌属(Sphingobacterium)、鞘氨醇单胞菌属(Sphingomonas)和Stenotrophomonas,其种类远多于其他发酵时期,说明多种微生物调节着酸菜发酵的启动。其中鞘氨醇杆菌属的平均相对丰度最高,可达14.71%,其次分别为假单胞菌属(13.68%)和乳球菌属(10.94%)。鞘氨醇杆菌属和乳球菌属均广泛存在于我国的传统发酵食品,而假单胞菌属存在于新鲜蔬菜中,生存能力强,适应环境范围广[26]。随着发酵的不断进行,具有耐酸且厌氧特性的微生物可在该环境中迅速生长繁殖,并占领足够多的生态位,而不耐酸的微生物的生长则受到抑制。有趣的是,乳杆菌属(Lactobacillus)的平均相对丰度从0.11%增加至81.45%,说明酸菜发酵过程中乳杆菌属起着主导作用。此外,盐单胞菌属(Halomonas)、魏斯氏菌属(Weissella)和片球菌属(Pediococcus)的平均相对丰度均在酸菜发酵过程中持续增加。其中盐单胞菌属从0.03%增加至1.59%;魏斯氏菌属从0.13%增加至4.68%;片球菌属从0.04%增加至3.23%。说明这些微生物可以和乳杆菌属互利共生。盐单胞菌属和片球菌属具有耐盐的特性,能分解葡萄糖,产生多种风味物质,推测它的存在与生产酸菜“盐渍”这一步骤有关[27]。魏斯氏菌属广泛存在与含盐的发酵食品中,可参与生成醛、醇和酮等挥发性风味物质,还可使发酵食品的颜色更鲜亮、口感更醇厚[28]。
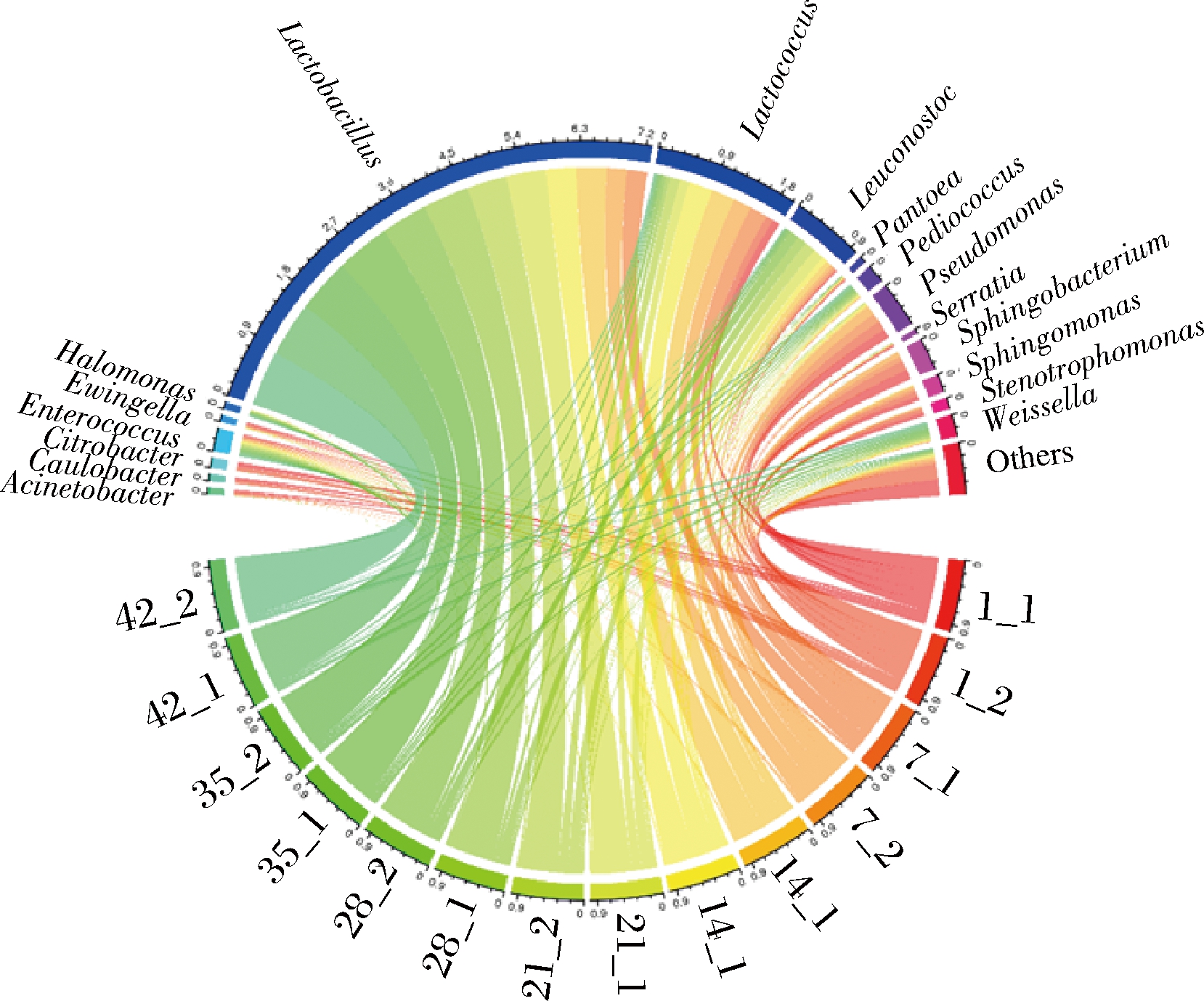
图6 酸菜发酵过程中原核微生物群落在属水平的分布
Fig.6 Distribution of prokaryotic microbial communities in samples at genus level during the fermentation of sauerkraut
线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)分析是一种用于发现和解释高维度数据生物标识的分析工具,用于发现不同生物条件或环境下的2组或多组样本中最能解释组间差异的物种特征,以及这些特征对组间差异的影响程度。因此,LEfSe分析有助于鉴定出不同发酵时间的标志性微生物。根据图7可知,发酵1 d的样本中的标志性微生物最多,共有18个,表明该日的微生物群落与其他发酵时间的群落差异显著。这些标志性微生物分别来自在Weeksellaceae,鞘氨醇杆菌目(Sphingobacteriales)、根瘤菌目(Rhizobiales)、Sphingomodales、肠杆菌目(Enterobacteriales)和Pseudomodales。而其他发酵时间的标志性微生物则都来自乳杆菌目(Lactobacillales)。
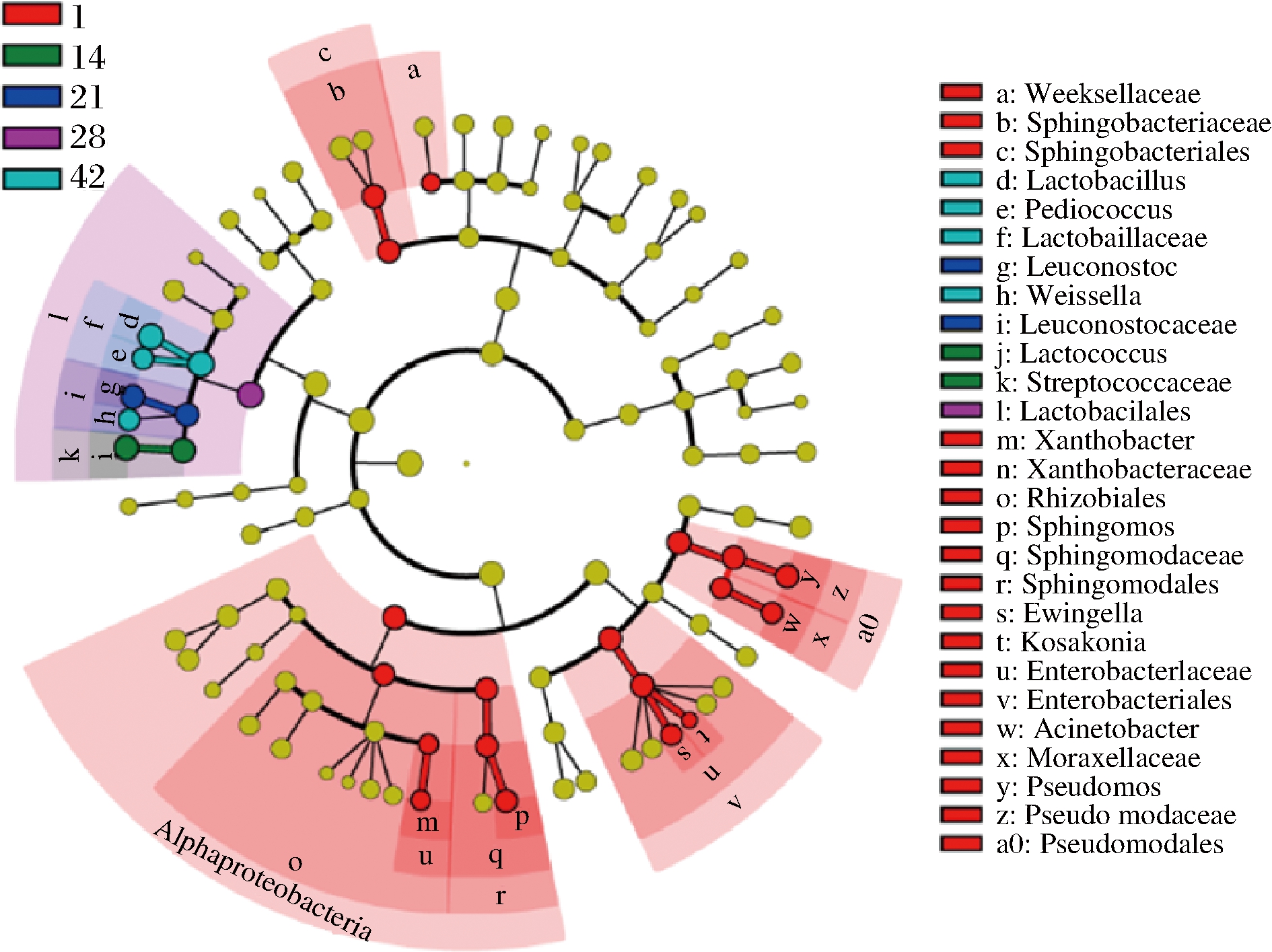
图7 酸菜发酵过程中不同发酵时期生物标志性微生物的分析
Fig.7 Analysis of biomarker microorganism in different stage during the fermentation of sauerkraut
酸菜发酵过程中理化因子和原核微生物群落之间的CCA如图8所示,前2个成分可以解释89.29%微生物菌群的变异。pH和还原糖含量只有与发酵1 d和7 d的样本菌群呈正相关,与其他发酵时间的菌群呈负相关,表明这些样本中pH和还原糖含量相对其他样本较高。原因是由于发酵初期乳酸菌的生长处于劣势,发酵环境中产酸较少,但随着发酵的进行,乳酸菌在厌氧环境中利用原料中的还原糖生长繁殖,并代谢产生大量的酸性物质,使pH和还原糖含量不断降低。总酸含量和检测到的有机酸含量与发酵1 d和7 d的样本菌群呈负相关,而与其他发酵时间的菌群呈正相关,说明乳酸菌是酸菜发酵过程的优势微生物和产酸主要微生物。有趣的是,亚硝酸盐含量只与发酵14 d和21 d的样本菌群呈正相关,说明乳酸菌会抑制肠杆菌和黄杆菌属等微生物的生长代谢,从而降低酸菜中亚硝酸盐的含量。这个发现与ZHOU等[23]的研究结果一致。
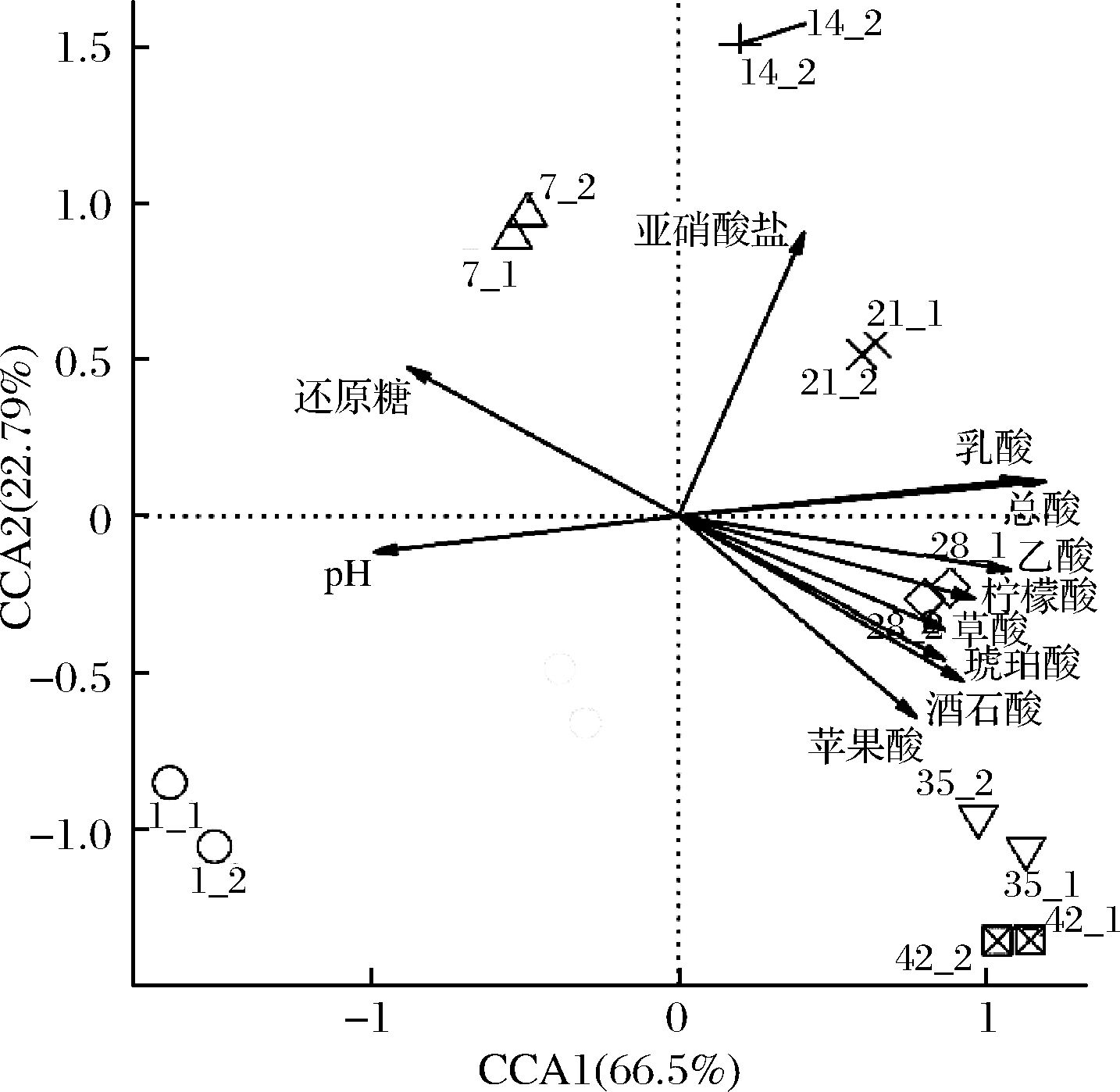
图8 酸菜发酵过程中理化因子与原核微生物菌群之间的CCA关系图
Fig.8 Canonical correlation analysis between physicochemical factors and prokaryotic microbial communities during the fermentation of sauerkraut
注:箭头表示理化因子与微生物群落结构之间关联性的方向与大小;箭头的长度代表相关性的大小,中心点样本菌群点之间的连线与箭头
的夹角,锐角表示菌群与相应的理化因子呈正相关,钝角表示负相关
为全面了解微生物与理化因子之间的关系,将酸菜自然发酵过程中理化因子与主要属水平微生物进行相关性分析。为了降低错误率,只保留相关系数(|r|>0.6)和具有显著性(P<0.05)的值。如图9所示,乳杆菌属与总酸和各种有机酸呈正相关,而与pH和还原糖呈负相关。这个结果与韩宏娇等[9]研究结果一致。此外,肠球菌属、盐单胞菌属、片球菌属和魏斯氏菌属与理化因子之间的相关性和乳杆菌属是一致的,而其他微生物却呈现相反的趋势。亚硝酸盐与乳酸乳球菌和明串珠菌属呈正相关,说明乳酸乳球菌和明串珠菌属是酸菜发酵的启动微生物。
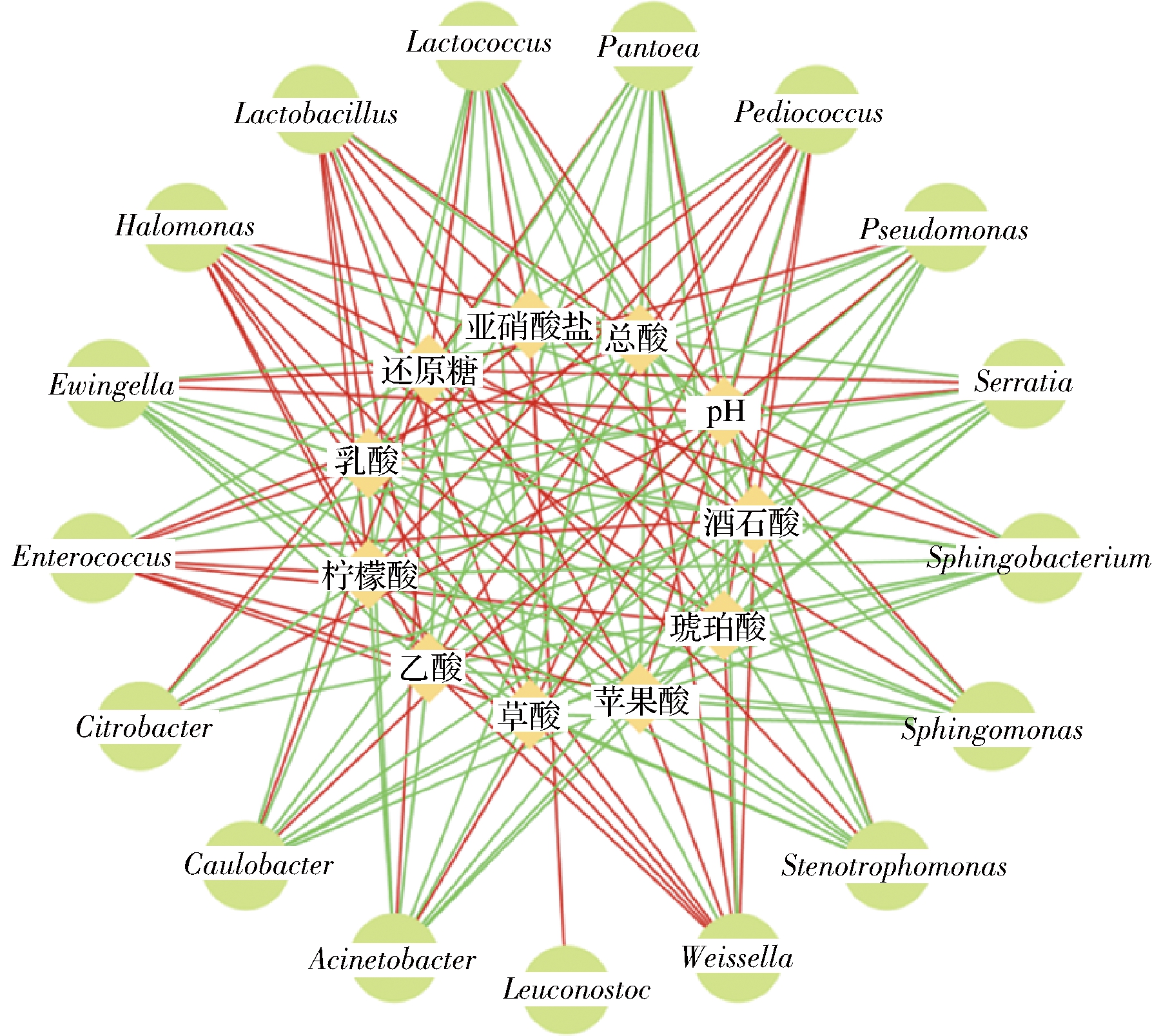
图9 酸菜发酵过程中理化因子与属水平原核微生物之间的相关性图
Fig.9 Correlation analysis between physicochemical factors and prokaryotic microbial communities in genes level during the fermentation of sauerkraut
注:外部圆圈表示不同属水平微生物,内部菱形表示理化因子,红色的线表示该属水平微生物与相应的理化因子呈正相关,绿色的线表示呈负相关
本研究利用16S rRNA高通量测序技术揭示酸菜发酵过程中原核微生物群落的组成和演替规律,分析微生物群落演替过程中理化因子的变化。随发酵时间的延长,pH和还原糖含量下降,总酸含量上升,而亚硝酸盐含量呈先增后减的变化趋势,原核微生物群落的多样性和均匀性均减少。相比发酵初期的原核微生物群落,其他发酵时间不仅群落差异显著而且标志性微生物较少。乳杆菌属是发酵过程中处于绝对优势微生物,其相对丰度从0.11%增加至81.45%。此外,相关性分析表明,发酵初期的群落与pH及还原糖含量呈正相关,发酵中期的群落与亚硝酸盐含量呈正相关,而发酵后期的群落与总酸、乳酸、乙酸、酒石酸、琥珀酸、柠檬酸、草酸和苹果酸含量呈正相关,乳杆菌属与pH和还原糖含量呈负相关。综上所述,本研究深入解析酸菜发酵过程中菌群的演替并分析其驱动因素,为精确人工调控提供理论依据。
[1] 宋春璐,胡文忠,陈晨,等.酸菜发酵工艺与贮藏特性的研究进展[J].食品工业科技,2016,37(9):376-379.
[2] 武俊瑞,张苗,蔡淼,等.自然发酵酸菜发酵液中化学成分测定[J].食品科学,2012,33(16):117-119.
[3] LI X W,YUE X Q.Analysis of the microbiota in naturally fermented cabbage of northeastern part of china by high-throughput sequencing of the V3-V4 regions of the 16S rRNA gene[J].International Journal of Agriculture and Biology,2016,6(18):1 153-1 158.
[4] 折米娜,望诗琪,赵慧君,等.酸菜水中细菌多样性研究[J].中国调味品,2019,44(1):26-31.
[5] LIU Z G,LI J Y,WEI B L,et al.Bacterial community and composition in Jiang-shui and Suan-cai revealed by high-throughput sequencing of 16S rRNA[J]. International Journal of Food Microbiology,2019,306(10):1-9.
[6] ABDEL-RAHMAN M A,TASHIEO Y,SONOMOTO K.Lactic acid production from lignocellulose-derived sugars using lactic acid bacteria: Overview and limits[J].Journal of Biotechnology,2011,156(4):286-301.
[7] 杜书,岳喜庆,武俊瑞,等.自然发酵酸菜游离氨基酸的分析[J].食品与发酵工业,2013,39(2):174-176.
[8] DU R,ZHAO D, ZHAO D,et al.Bacterial diversity and community structure during fermentation of Chinese sauerkraut with Lactobacillus casei 11MZ-5-1 by Illumina Miseq sequencing[J].Letters in Applied Microbiology,2017,66(2):55-62.
[9] 韩宏娇,丛敏,李欣蔚,等.自然发酵酸菜化学成分含量和微生物数量的动态变化及其相关性分析[J].食品工业科技, 2019, 40(2):148-153.
[10] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 12456—2008,食品中总酸的测定[S].北京:中国标准出版社,2008.
[11] 中华人民共和国国家卫生和计划生育委员会.GB 5009.7—2016,食品安全国家标准 食品中还原糖的测定[S].北京:中国标准出版社,2008.
[12] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.33—2010,食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定[S].北京:中国标准出版社,2010.
[13] 中国人民共和国国家卫生和计划生育委员会.GB 5009.235—2016,食品安全国家标准 食品中氨基酸态氮的测定[S].北京:中国标准出版社,2016.
[14] 沈毅,陈波,王西,等.酱香型郎酒高温大曲、酒醅和窖泥中细菌群落结构分析[J].中国酿造,2020,39(2):89-93.
![]() T,SALZBERG S L.FLASH: Fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics,2011,27(21):2 957-2 963.
T,SALZBERG S L.FLASH: Fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics,2011,27(21):2 957-2 963.
[16] CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods,2010,7(5):335-336.
[17] EDGAR R C,HAAS B J,CLEMENTE J C,et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2 194-2 200.
[18] EDGAR R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2 460-2 461.
[19] QUAST C,PRUESSE E,YILMAZ P,et al.The SILVA ribosomal RNA gene database project: Improved data processing and web-based tools[J].Nucleic Acids Research,2012,41:590-596.
[20] LIU S N,HAN Y,ZHOU Z J.Lactic acid bacteria in traditional fermented Chinese foods[J].Food Research International,2011,44(3):643-651.
[21] 马欢欢,吕欣然,林洋,等.传统东北酸菜自然发酵过程中乳酸菌与营养物质同步分析[J].食品与发酵工业,2017,43(2):79-84.
[22] WOLF G,HAMMES W P.Effect of hematin on the activities of nitritereductase and catalase in Lactobacilli[J].Archive Microbiology,1988,149(6):220-224.
[23] ZHOU Q, ZANG S Z,ZHAO Z N,et al.Dynamic changes of bacterial communities and nitrite character during northeastern Chinese sauerkraut fermentation[J].Food Science and Biotechnology,2018,27(1):79-85.
[24] 中国人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 2762—2017,食品安全国家标准 食品中污染物限量[S].北京:中国标准出版社,2017.
[25] 马艺荧,孙波,张宇,等.东北酸菜不同发酵时间有机酸变化及其对产品酸感的影响[J].食品与发酵工业,2019,45(5):45-50.
[26] NÜBLING S,SCHMIDT H,WEISS A.Variation of the Pseudomonas community structure on oak leaf lettuce during storage detected by culture-dependent and -independent methods[J].International Journal of Food Microbiology,2016,129(5):95-103.
[27] 裴乐乐,罗青春,孟霞,等.不同原料四川发酵泡菜的细菌多样性分析[J].中国调味品,2016,41(2):39-43.
[28] 李巧玉,方芳,堵国成,等.魏斯氏菌在发酵食品中的应用[J].食品与发酵工业,2017,43(10):241-247.