
a-pH变化;b-活菌数变化
图1 低频低强度超声波辅助植物乳杆菌发酵白果汁过程中pH和活菌数的变化
Fig.1 Changes of pH value and viable cell counts during ginkgo kernel juice fermentation by L. plantarum assisted with low-frequency and low-intensity ultrasound
超声波是一种频率超过人类听觉上限(20 kHz)的声波,常根据频率不同分为低频超声波和高频超声波[1]。低频超声波的频率为20~100 kHz,其中具有高能量的低频超声波因能产生强大的剪切力和机械力,可破坏物质结构,加速传质和化学反应而常用于食品加工领域[2]。
关于超声波在微生物领域的应用,最早是利用高强度超声波对微生物的致死作用,将其用于非热杀菌领域,而将超声波加载于微生物发酵过程中的研究开展的较晚。近年来,越来越多的研究证实低频低强度超声波可促进微生物的生长,提高目的代谢产物的产量。DAI等[3]发现在酿酒酵母的生长迟滞期采用频率为28 kHz,强度为140 W/L超声作用1 h,可使酿酒酵母的生物量提升127%。AVHAD等[4]的研究表明,在频率为25 kHz,强度为160 W,作用时间为10 min的超声条件下,芽孢杆菌的纤维蛋白分解酶的产量比未超声处理组高出1.48倍左右。而低频低强度超声波对微生物发酵的这一辅助作用,主要归因于其产生的物理化学效应对细胞的损伤较小,可使微生物处于一种“亚致死”状态,增强了细胞膜的通透性,改善了传质,从而提高了发酵效率[2,5]。
白果是银杏科银杏属银杏树的种子,不仅含有淀粉、蛋白质、脂质和矿物质等营养成分,还含有一些特异性生物活性物质,包括银杏酸、银杏萜内酯以及各种酚类化合物[6]。其中,银杏萜内酯具有很强的药理活性,对心脑血管和神经系统疾病具有一定的防治作用[7]。而银杏酸因具有潜在的免疫毒性、神经毒性和细胞毒性[8],为白果及其制品的食用安全性带来了隐患。
本实验室前期选用了3种乳酸菌,分别为嗜酸乳杆菌、植物乳杆菌和干酪乳杆菌发酵白果汁,就乳酸菌在白果汁中的发酵特性展开研究。研究表明,3株乳酸菌在白果汁中长势良好,可充分利用基质中的糖类产生大量乳酸,并可通过降解白果汁中的银杏酸以及富集银杏内酯和酚类物质来提高白果汁的食用安全性和营养价值[9]。若在乳酸菌发酵白果汁过程中辅以低频低强度超声处理,或可增强乳酸菌发酵对白果汁所产生的积极影响。因此,本实验在前期研究的基础上,选用了活力较强,代谢较旺盛的植物乳杆菌作为白果汁的发酵菌株,并以非超声处理的植物乳杆菌发酵白果汁作为对照,研究了低频低强度超声波对植物乳杆菌发酵白果汁过程中菌体生长及代谢的影响。
白果(品种:大佛指),由江苏省泰州市杏润食品有限公司提供;植物乳杆菌(Lactobacillus plantarum BNCC194165),购于北京北纳创联生物技术研究院,以冻干粉的形式贮存;MRS液体培养基,上海博微生物科技有限公司;MRS琼脂培养基,上海盛思生化科技有限公司;α-淀粉酶(4 000 U/g)、糖化酶(100 000 U/g)、银杏酸标准品、银杏萜内酯标准品、酚类物质标准品(色谱纯),上海源叶生物科技有限公司;甲醇(色谱纯),美国天地有限公司;冰乙酸(色谱纯),上海麦克林生化科技有限公司;四氢呋喃(色谱纯),上海阿拉丁生化科技有限公司;其他试剂均为分析纯。
VCX130超声波细胞破碎仪,美国nicolet公司;LDZF-50KB立式压力蒸汽灭菌锅,上海申安医疗器械厂;SW-CJ-1FD单人单面净化工作台,苏州净化设备有限公司;PYX-DHS.500BS-Ⅱ隔水式电热恒温培养箱,上海跃进医疗器械有限公司;RE-52旋转蒸发仪,上海亚荣生化仪器厂;GL-20G-Ⅱ高速冷冻离心机,上海安亭科学仪器厂;UV5100B,紫外可见分光光度计,上海元析仪器有限公司;L-8900全自动氨基酸分析仪,日本日立高新技术公司;LC-2010A高效液相色谱仪,日本岛津公司。
1.2.1 白果汁的制备
在ZHANG等[10]方法的基础上进行一定的修改。去除白果的外壳和内种皮,洗净后与纯净水按照1∶5(g∶mL)打浆。为了提高出汁率和可溶性糖的含量,加入20 U/g α-淀粉酶和30 U/g糖化酶(均以白果的质量计),于60 ℃进行液化和糖化处理2 h。酶解完成后,通过4 000 r/min离心20 min去除不溶物,并采用90 ℃水浴杀菌20 min。待果汁冷却后,于无菌操作台上进行分装,每500 mL灭菌的锥形瓶中加入300 mL白果汁。
1.2.2 种子液的制备
将植物乳杆菌冻干粉置于MRS肉汤培养基中进行活化复壮,并将其接种至试管斜面。制备种子液时,从试管斜面上取1环,接种至MRS肉汤培养基中,于37 ℃静置培养至菌体浓度达9.0 lg CFU/mL。
1.2.3 低频低强度超声波辅助植物乳杆菌发酵白果汁
将种子液以2%的接种量接种至灭菌白果汁中,37 ℃静置培养48 h。在发酵第0、4、8、12、24、36、48 h,在超净台内将超声波设备(20 kHz)的探头(直径为10 mm)伸入液面以下1 cm处,超声处理接种后的白果汁。超声强度分别为58.9、93.6和 120.8 W/L,超声时间为1 min,处理模式为5 s开5 s关。因超声时间较短,超声波热效应对发酵液的温度不产生显著影响,因此,超声过程中未对发酵液进行控温处理。每次超声之前取样进行相应的微生物及理化指标的测定。除微生物指标外,其余指标均取离心后(10 000 r/min,15 min)的发酵上清液进行测定。
1.2.4 活菌数的测定
采用平板计数法[11]进行测定。样品经过生理盐水梯度稀释后,根据其含有的活菌数,选择2~3个连续的稀释梯度,每个稀释度取0.1 mL样液置于灭菌培养皿中,倒入MRS琼脂培养基后摇匀,待培养基冷却凝固后于37 ℃培养36~48 h。选取菌落数在30~300 CFU的平板进行计数,结果以lg CFU/mL表示。
1.2.5 pH的测定
利用精密pH计直接测定。
1.2.6 有机酸的测定
采用高效液相色谱(high performance liquid chromatography,HPLC)法对样品中有机酸的组成和含量进行分析。色谱条件参照LIMA等[12]的报道并稍加修改。色谱柱为Agilent TC-C18柱(250 mm × 4.6 mm,5 μm);流动相为0.08 mmol/L KH2PO4水溶液(pH用H3PO4调至2.9);流速0.7 mL/min;柱温30 ℃;紫外检测波长210 nm;进样体积20 μL。离心上清液过0.22 μm水系滤膜后直接进样分析。通过有机酸标准品获得保留时间和标准曲线对发酵液中有机酸进行定性和定量,结果以g/L表示。
1.2.7 单体糖的测定
参照VERVOORT等[13]的方法,通过高效液相色谱-蒸发光散射检测器(HPLC-evaporative light scattering detector,HPLC-ELSD)法对样品中单体糖的种类及含量进行测定。采用安捷伦1200系列液相色谱仪,外部连接Alltech 3300蒸发光散射检测器。色谱柱为Prevail carbohydrate ES column(250 mm × 4.6 mm,5 μm),连接一个Prevail C18柱(7.5 mm × 4.6 mm,5 μm)作为保护柱。柱温30 ℃;流动相为V(乙腈)∶V(水)=75∶25;流速1 mL/min;漂移管温度80 ℃;氮气流速1.5 L/min。进样量10 μL。采用标准品获得保留时间和标准曲线对发酵液中单体糖进行定性和定量,结果表示为g/L。
1.2.8 游离氨基酸的测定
采用全自动氨基酸分析仪分析了样品中游离氨基酸的种类及含量。进样前,将发酵上清液与4%(质量分数)的磺基水杨酸溶液等比例混合,并在4 ℃静置1 h,以沉淀样品中的蛋白和多肽[14]。之后于15 000 r/min离心15 min,上清液过0.22 μm水系滤膜后进样分析,结果以mg/L表示。
1.2.9 银杏酸的测定
1.2.9.1 银杏酸的提取纯化
在HE等[15]方法的基础上,采用液液萃取法提取样品中的银杏酸。取50 mL样品通过减压真空浓缩法浓缩至5 mL。然后与等体积的甲醇混合,超声提取(40 kHz,250 W)30 min后,离心收集上清液。上清液中的甲醇通过旋转蒸发去除后,加入正己烷萃取3次,每次10 mL。合并有机相,用旋转蒸发仪浓缩至干,残渣用甲醇溶解并定容至1 mL,用0.45 μm有机滤膜过滤后采用HPLC进行测定。
1.2.9.2 银杏酸的HPLC分析
HPLC条件在田晓清等[16]的基础上稍作修改。采用Waters XTerra MS-C18柱(150 mm × 4.6 mm, 5 μm),在310 nm下进行测定。流动相为V(甲醇)∶V(体积分数为3%冰乙酸)=92∶8;流速0.8 mL/min;柱温30 ℃;进样体积20 μL。精密称取银杏酸标准品溶解于甲醇中,梯度稀释成不同浓度的溶液并进样分析。以峰面积为纵坐标,浓度为横坐标绘制标准曲线。比对样品和标准品的色谱图,根据出峰时间确定样品中银杏酸的种类,并利用标准曲线计算样品中不同银杏酸的含量,结果以mg/L表示。
1.2.10 银杏萜内酯的测定
1.2.10.1 银杏萜内酯的提取纯化
参考DUBBER等[17]的方法,采用液液萃取法提取样品中的银杏萜内酯。其中甲醇提取部分与银杏酸甲醇提取步骤一致,待去除上清液中的甲醇后,加入乙酸乙酯萃取3次,每次10 mL。合并有机相,用旋转蒸发仪浓缩至干,残渣用甲醇溶解并定容至1 mL,用0.45 μm有机滤膜过滤后采用HPLC-ELSD进行测定。
1.2.10.2 银杏萜内酯的HPLC-ELSD分析
色谱条件参照KAUR等[18]并稍作修改。采用Krosmail 100-C18柱 (250 mm × 4.6 mm, 5 μm);流动相为V(水)∶V(甲醇)∶V(四氢呋喃)=65∶25∶10;流速为1.0 mL/min;柱温30 ℃,蒸发光检测器的漂移管温度为90 ℃;N2压力设置在350 kPa左右;进样体积20 μL。精密称取银杏内酯标准品溶解于甲醇中,梯度稀释成不同浓度的溶液并进样分析。以峰面积的对数为纵坐标,银杏内酯浓度的对数为横坐标绘制标准曲线。比对样品和标准品的色谱图,根据出峰时间确定样品中银杏内酯的种类,并利用标准曲线计算样品中不同银杏内酯的含量,结果以mg/L表示。
试验设置3次重复,结果以平均值±标准差的形式表示,采用Microsoft Excel 2016和SPSS 20.0软件对试验数据进行作图、方差分析、显著性分析以及聚类分析。均值间比较采用Duncan’s多重比较,显著性检验在0.05水平上进行(P<0.05)。
由图1-a可知,3个超声处理组的pH变化趋势与对照组基本一致。在发酵的0~8 h,pH快速下降,且超声处理组的pH下降速度快于对照组。之后各组别pH的变化幅度均趋于平稳,超声处理组与对照组之间pH差异不明显。发酵过程中pH下降的主要因素是乳酸菌利用糖产生了大量的乳酸,在发酵初期,菌体代谢活力旺盛,超声波可能会通过促进植物乳杆菌对糖的代谢利用来提高其产酸能力。但当pH下降到一定程度时,植物乳杆菌的产酸能力受到环境的限制,导致了超声的作用效果不明显。WU等[19]通过超声波辅助混合菌种发酵酸奶证实了超声对菌体产酸的促进作用,但该作用也仅体现在一定的pH范围内。
由图1-b可知,接种至白果汁中的植物乳杆菌在0~8 h快速增殖,发酵12 h后菌种的生长速率变缓,之后进入稳定期。在对数生长期内,超声处理组和对照组之间活菌数差异不显著,这可能是因为对数期菌体生长旺盛,超声处理的影响较小[20]。但进入稳定期之后,超声处理组的活菌数显著高于对照组。尤其是在发酵后期,当对照组活菌数出现下降的趋势时,超声处理组的活菌数仍维持在一个较高的水平。这一现象可能与超声波的空化效应有关。由于低频低强度超声波可产生稳定且较温和的空化效应,对菌体细胞造成可修复的损伤,增加了细胞膜的通透性,加速细胞内外物质的传输,提高了新陈代谢速率[3]。此外,超声波可以将微生物在培养过程中形成的细胞束松散开来,提高了菌体对营养物质的利用,从而促进了菌体的生长繁殖,提高了微生物的生物量[2]。总体上,本实验所选用的3个超声强度对菌体的生长均有一定的促进作用,但3个强度之间的差异不显著。

a-pH变化;b-活菌数变化
图1 低频低强度超声波辅助植物乳杆菌发酵白果汁过程中pH和活菌数的变化
Fig.1 Changes of pH value and viable cell counts during ginkgo kernel juice fermentation by L. plantarum assisted with low-frequency and low-intensity ultrasound
低频低强度超声波处理对植物乳杆菌代谢有机酸和单体糖的影响如表1所示。未发酵白果汁中共鉴定出8种有机酸,分别为草酸、丙酮酸、奎尼酸、苹果酸、莽草酸、柠檬酸、富马酸和琥珀酸,其中以柠檬酸的含量最高,乳酸在发酵后产生。单体糖有3种,分别为蔗糖、葡萄糖和果糖,以蔗糖的含量较高。在发酵过程中,3种单体糖含量均随着发酵的进行大幅度降低。其中葡萄糖作为乳酸菌优先利用的碳源,在植物乳杆菌接入后便被迅速消耗利用,而超声处理组中植物乳杆菌对葡萄糖的利用能力显著高于对照组,这可能与超声提高了植物乳杆菌对葡萄糖的转运能力,促进了相关水解酶的产生有关[19]。由于乳酸菌对葡萄糖的利用主要涉及糖酵解途径,作为葡萄糖的转化物,丙酮酸在发酵前4 h含量逐渐升高,且超声处理组的丙酮酸的积累量高于对照组。丙酮酸可通过糖酵解途径进一步转化为乳酸。由表1可知,超声处理组的乳酸产量在发酵的前12 h显著高于对照组,特别是发酵第4 h,58.9、93.6和120.8 W/L超声处理组的乳酸含量分别比对照组高21.8%、31.2%和36.2%。但之后几个组别的差异不显著,这与超声处理对pH的影响情况基本一致。乳酸一方面可经过糖酵解途径产生,另一方面可直接由苹果酸脱羧生成[21]。所以,苹果酸含量在发酵开始后显著降低,且超声处理组,特别是93.6和120.8 W/L 2个超声组在发酵前12 h的苹果酸消耗速度显著高于对照组。除此之外,柠檬酸、琥珀酸和富马酸等与三羧酸循环密切相关的有机酸,在超声处理组和对照组的含量差异也主要体现在发酵初期,尤其是发酵的前4 h。这可能是由于发酵后期乳酸大量积累使得整个代谢途径受到抑制,从而削弱了超声波的刺激作用。
为了更好地比较不同强度的低频超声处理下,植物乳杆菌代谢白果汁中有机酸和糖类的差异特征,以9种有机酸和3种单体糖的差异信息为基础,采用组间平均链锁法,按照指标间的平方Euclidean距离进行聚类分析,聚类分析结果如图2所示。样品基本按照了发酵时间点进行了聚类,说明不同发酵时间点植物乳杆菌对有机酸和糖的代谢差异较大,且超声处理没有使植物乳杆菌的糖酸代谢速率发生较大幅度的提升。但依据每个类别内对照组和超声处理组的位置排布可以发现,超声处理组基本位于对照组的上方,即更接近于下一个发酵时间点植物乳杆菌的糖酸代谢状态,说明本实验选用的超声条件可在一定程度上促进植物乳杆菌对有机酸和糖的代谢。
低频低强度超声波辅助植物乳杆菌发酵白果汁过程中氨基酸的代谢情况如表2所示。白果汁中共鉴定出了17种氨基酸,大部分氨基酸经植物乳杆菌发酵后含量有所下降,且超声处理组和对照组在氨基酸代谢方面存在一定的差异。精氨酸作为白果汁中含量最高的氨基酸,在发酵过程中呈现先上升后下降的趋势。在其含量快速上升的前12 h,超声处理组的上升速度显著高于对照组,这可能是因为超声波促进了植物乳杆菌对蛋白质的降解。之后由于乳酸菌可通过精氨酸脱亚氨基酶途径对精氨酸进行转化从而导致其含量降低[22],但这个过程中超声的作用效果不显著。由于植物乳杆菌可产生谷氨酸脱羧酶将谷氨酸转化为γ-氨基丁酸[23],所以谷氨酸的含量在发酵24 h内显著降低。其中超声处理组尤其是93.6、120.8 W/L 2个超声处理组中谷氨酸的下降幅度分别是对照组的1.12、1.17倍。这说明超声可刺激植物乳杆菌产生更多的谷氨酸脱羧酶来加快反应的进行。超声的这一作用机制也体现在天冬氨酸以及苏氨酸的代谢上。由于天冬氨酸可在乳酸菌产生的氨基转移酶的作用下转化为草酰乙酸,并进一步转化为二乙酰、乙偶姻和1,3-丁二醇等风味物质[24],而苏氨酸则可在苏氨酸醛缩酶的作用下转化为乙醛,然后进一步转化为乙酸和乙醇[25],故两者的含量均呈下降趋势。3个超声处理组中天冬氨酸和苏氨酸的降幅均高于对照组,说明超声可促进植物乳杆菌对天冬氨酸以及苏氨酸的转化。甘氨酸作为苏氨酸转化途径的中间产物之一,其含量在发酵24 h后有所增加,且超声处理组中甘氨酸的含量高于对照组,尤其是58.9 W/L超声处理组中甘氨酸含量比对照组高11.36%,这也进一步证实了超声对苏氨酸转化的促进作用。其他氨基酸,如亮氨酸、异亮氨酸、苯丙氨酸、甲硫氨酸以及半胱氨酸,都可以在乳酸菌产生的特异性氨基转移酶的作用下转化为相应的挥发性风味成分[24],而超声处理对这些氨基酸的代谢具有一定的促进作用,但在不同的发酵时间内,作用效果存在一定的差异。
表1 低频低强度超声波处理对植物乳杆菌发酵白果汁
过程中有机酸及单体糖含量的影响 单位:g/L
Table 1 Changes of organic acids and sugars content
during ginkgo kernel juice fermentation by L. plantarum assisted with low-frequency and low-intensity ultrasound

处理组发酵时间/h04122448有机酸对照0.13±0.00A0.12±0.01Ba0.12±0.00Ba0.12±0.00Ba0.12±0.00Bc草酸58.9 W/L0.13±0.00A0.13±0.01Aa0.13±0.01Aa0.12±0.01Aa0.13±0.00Aa93.6 W/L0.13±0.00A0.13±0.00ABa0.12±0.00ABa0.11±0.00Ba0.12±0.00ABbc120.8 W/L0.13±0.00A0.13±0.01Aa0.12±0.00Aa0.12±0.00Aa0.13±0.00Aab对照0.49±0.02A0.47±0.01Aa0.44±0.01Ba0.44±0.02Bab0.38±0.01Ca奎宁酸58.9 W/L0.49±0.02A0.46±0.02Ba0.45±0.01Ba0.42±0.02Cb0.38±0.01Da93.6 W/L0.49±0.02A0.44±0.01Bb0.45±0.02Ba0.43±0.01Bab0.38±0.02Ca120.8 W/L0.49±0.02A0.45±0.01Ba0.46±0.02Ba0.45±0.02Ba0.40±0.04Ca对照0.05±0.00C0.08±0.00Ab0.07±0.00Ba0.05±0.00Ca0.05±0.00Ca丙酮酸58.9 W/L0.05±0.00C0.09±0.00Aab0.07±0.00Ba0.05±0.00Ca0.04±0.00Ca93.6 W/L0.05±0.00CD0.08±0.00Aab0.07±0.01Ba0.05±0.01Ca0.04±0.00Da120.8 W/L0.05±0.00C0.09±0.00Aa0.07±0.00Ba0.06±0.00BCa0.04±0.00Ca对照0.60±0.00A0.45±0.02Ba0.21±0.01Db0.18±0.01Da0.23±0.02Ca苹果酸58.9 W/L0.60±0.00A0.42±0.02Bab0.20±0.01CDab0.18±0.01Da0.22±0.01Ca93.6 W/L0.60±0.00A0.39±0.02Bb0.20±0.01Dab0.18±0.00Ea0.22±0.01Ca120.8 W/L0.60±0.00A0.40±0.03Bb0.19±0.01Ca0.16±0.00Cb0.23±0.02Da对照0.02±0.00BC0.02±0.00Ba0.02±0.00Ca0.02±0.00Ca0.02±0.00Aa莽草酸58.9 W/L0.02±0.00B0.02±0.00ABa0.02±0.00ABa0.02±0.00ABa0.02±0.00Aa93.6 W/L0.02±0.00A0.02±0.00Aa0.02±0.00Aa0.02±0.00Aa0.02±0.02Aa120.8 W/L0.02±0.00B0.02±0.00ABa0.02±0.00ABa0.02±0.00ABa0.02±0.03Aa对照-0.70±0.05Db2.34±0.06Cb3.16±0.04Ba3.44±0.22Aa乳酸58.9 W/L-0.85±0.07Ca2.61±0.17Ba3.05±0.07Aa3.22±0.14Aa93.6 W/L-0.92±0.07Ca2.62±0.13Ba3.13±0.13Aa3.20±0.09Aa120.8 W/L-0.96±0.08Ca2.56±0.11Bab3.16±0.10Aa3.24±0.12Aa对照2.09±0.01C7.23±0.07Ac2.30±0.12Ba1.07±0.10Da0.76±0.03Ea柠檬酸58.9 W/L2.09±0.01C7.36±0.06Ab2.26±0.09Ba1.13±0.08Da0.70±0.03Eb93.6 W/L2.09±0.01C7.49±0.05Aa2.43±0.26Ba1.02±0.11Da0.67±0.01Eb120.8 W/L2.09±0.01B7.51±0.07Aa2.21±0.04Ba1.08±0.08Ca0.69±0.00Db对照0.05±0.00A0.04±0.00Ba0.01±0.00Ca0.01±0.00Ca0.01±0.00Ca富马酸58.9 W/L0.05±0.00A0.04±0.00Ba0.01±0.00Ca0.01±0.00Ca0.01±0.00Ca93.6 W/L0.05±0.00A0.04±0.00Ba0.01±0.00Ca0.01±0.00Cb0.01±0.00Ca120.8 W/L0.05±0.00A0.04±0.00Ba0.01±0.00Ca0.01±0.00Cb0.01±0.00Cb对照0.18±0.00AB0.21±0.01Ab0.17±0.01BCb0.16±0.01BCb0.12±0.00Ca琥珀酸58.9 W/L0.18±0.00B0.24±0.01Aa0.17±0.01Bab0.19±0.02ABa0.12±0.00Ca93.6 W/L0.18±0.00A0.23±0.02Aab0.18±0.01Aa0.20±0.01Aa0.10±0.01Bb120.8 W/L0.18±0.00AB0.22±0.02Aab0.18±0.00Bab0.18±0.03ABa0.11±0.00Cab单体糖对照1.408±0.01A1.06±0.04Ba0.83±0.00Ca0.80±0.02Da0.78±0.01Da果糖58.9 W/L1.408±0.01A0.64±0.04Ba0.49±0.01Ca0.44±0.01Da0.33±0.00Ea93.6 W/L1.408±0.01A1.04±0.01Ba0.84±0.00Ca0.77±0.00Db0.77±0.02Da120.8 W/L1.408±0.01A1.05±0.03Ba0.84±0.00Ca0.79±0.02Dab0.76±0.03Da对照1.456±0.04A0.64±0.04Ba0.49±0.01Ca0.44±0.01Da0.33±0.00Ea葡萄糖58.9 W/L1.456±0.04A0.55±0.01Bb0.48±0.00Cab0.43±0.01Dab0.32±0.01Eab93.6 W/L1.456±0.04A0.53±0.00Bb0.46±0.01Cc0.42±0.00Db0.33±0.00Eab120.8 W/L1.456±0.04A0.56±0.02Bb0.47±0.00Cb0.41±0.01Db0.32±0.00Eb对照12.800±0.37A11.13±0.40Bb7.41±0.09Cbc6.28±0.31Db2.69±0.26Ea蔗糖58.9 W/L12.800±0.37A11.91±0.33Ba7.38±0.15Cc6.97±0.09Da2.91±0.64Ea93.6 W/L12.800±0.37A12.47±0.08Ba7.57±0.02Cab6.88±0.35Da3.00±0.41Ea120.8 W/L12.800±0.37A12.38±0.33Ba7.72±0.05Ca7.03±0.05Da3.01±0.15Ea
注:大写字母表示不同发酵时间样品之间存在显著差异(P<0.05);小写字母表示不同超声处理组之间存在显著差异(P<0.05)(下同)
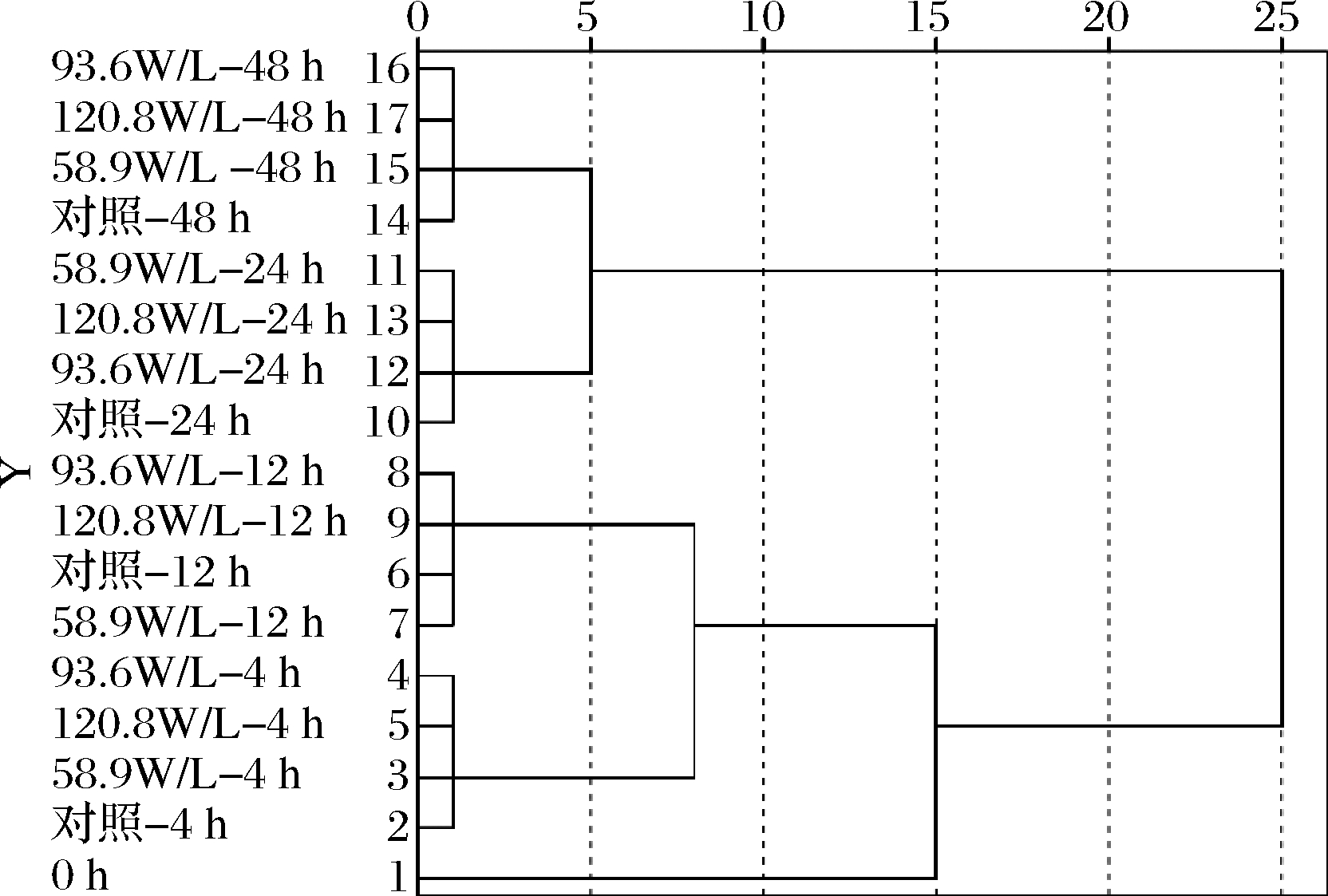
图2 低频低强度超声波辅助植物乳杆菌发酵白果汁过程中有机酸和糖含量变化的聚类分析
Fig.2 Clustering analysis of changes of organic acids and sugars content during ginkgo kernel juice fermentation by L. plantarum assisted with low-frequency and low- intensity ultrasound
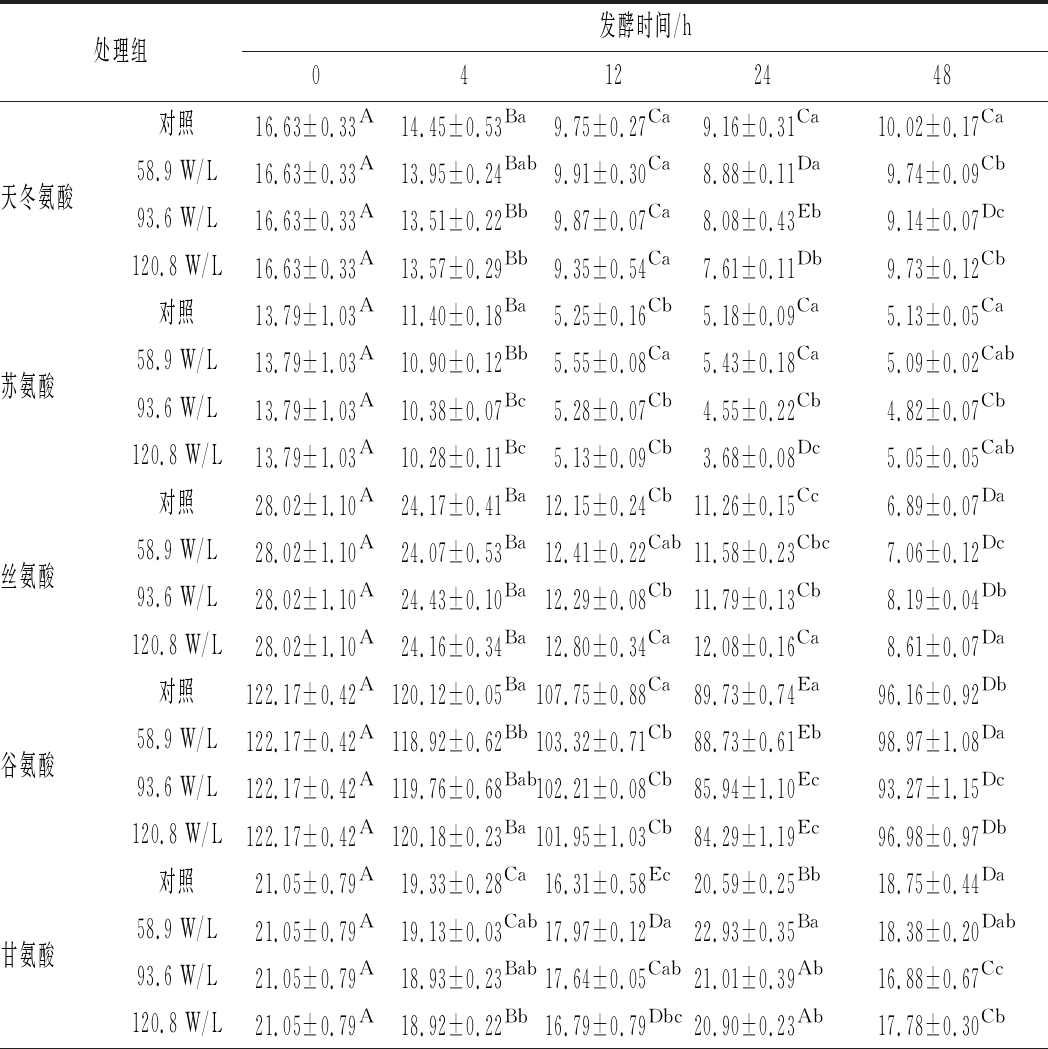
通过聚类分析可以更好地呈现不同强度的低频超声处理对植物乳杆菌代谢氨基酸的影响,聚类分析结果如图3所示。所有的样品并未严格按照发酵时间点进行聚类。在发酵第4 h,对照组与未发酵样品聚为一类,而其他3个超声组聚为一类,说明在发酵初期,低频低强度超声处理可显著加快植物乳杆菌对白果汁中氨基酸的代谢。由于发酵12 h之后氨基酸含量整体的变化趋势放缓,不同发酵时间点样品之间的类间距离缩小,只在类间距离小于5时出现了聚类差异。在发酵第12 h和24 h,对照组和超声组虽然聚为一类,但超声组均比对照组更接近下一个发酵时间点的氨基酸代谢状态,即超声仍可在一定程度上促进植物乳杆菌对氨基酸的代谢。发酵第48 h,对照组和120.8 W/L的超声组聚为一类,58.9 W/L的超声组与发酵12 h的样品聚为一类,而93.6 W/L的超声组单独聚为一类,说明在发酵后期,超声整体的作用规律不明显。
表2 低频低强度超声波处理对植物乳杆菌发酵白果汁
过程中氨基酸含量的影响 单位:mg/L
Table 2 Changes of amino acids content during ginkgo kernel juice fermentation by L. plantarum assisted with low-frequency and low-intensity ultrasound
处理组发酵时间/h04122448对照16.63±0.33A14.45±0.53Ba9.75±0.27Ca9.16±0.31Ca10.02±0.17Ca天冬氨酸58.9 W/L16.63±0.33A13.95±0.24Bab9.91±0.30Ca8.88±0.11Da9.74±0.09Cb93.6 W/L16.63±0.33A13.51±0.22Bb9.87±0.07Ca8.08±0.43Eb9.14±0.07Dc120.8 W/L16.63±0.33A13.57±0.29Bb9.35±0.54Ca7.61±0.11Db9.73±0.12Cb对照13.79±1.03A11.40±0.18Ba5.25±0.16Cb5.18±0.09Ca5.13±0.05Ca苏氨酸58.9 W/L13.79±1.03A10.90±0.12Bb5.55±0.08Ca5.43±0.18Ca5.09±0.02Cab93.6 W/L13.79±1.03A10.38±0.07Bc5.28±0.07Cb4.55±0.22Cb4.82±0.07Cb120.8 W/L13.79±1.03A10.28±0.11Bc5.13±0.09Cb3.68±0.08Dc5.05±0.05Cab对照28.02±1.10A24.17±0.41Ba12.15±0.24Cb11.26±0.15Cc6.89±0.07Da丝氨酸58.9 W/L28.02±1.10A24.07±0.53Ba12.41±0.22Cab11.58±0.23Cbc7.06±0.12Dc93.6 W/L28.02±1.10A24.43±0.10Ba12.29±0.08Cb11.79±0.13Cb8.19±0.04Db120.8 W/L28.02±1.10A24.16±0.34Ba12.80±0.34Ca12.08±0.16Ca8.61±0.07Da对照122.17±0.42A120.12±0.05Ba107.75±0.88Ca89.73±0.74Ea96.16±0.92Db谷氨酸58.9 W/L122.17±0.42A118.92±0.62Bb103.32±0.71Cb88.73±0.61Eb98.97±1.08Da93.6 W/L122.17±0.42A119.76±0.68Bab102.21±0.08Cb85.94±1.10Ec93.27±1.15Dc120.8 W/L122.17±0.42A120.18±0.23Ba101.95±1.03Cb84.29±1.19Ec96.98±0.97Db对照21.05±0.79A19.33±0.28Ca16.31±0.58Ec20.59±0.25Bb18.75±0.44Da甘氨酸58.9 W/L21.05±0.79A19.13±0.03Cab17.97±0.12Da22.93±0.35Ba18.38±0.20Dab93.6 W/L21.05±0.79A18.93±0.23Bab17.64±0.05Cab21.01±0.39Ab16.88±0.67Cc120.8 W/L21.05±0.79A18.92±0.22Bb16.79±0.79Dbc20.90±0.23Ab17.78±0.30Cb
续表2

处理组发酵时间/h04122448对照55.94±0.03A47.44±0.44Bc34.80±0.38CDd35.61±0.55Cb33.52±0.53Db丙氨酸58.9 W/L55.94±0.03A50.48±0.06Ba38.05±0.19Ca36.98±0.44Da36.16±0.51Ea93.6 W/L55.94±0.03A49.77±0.29Bb36.53±0.27Cb31.64±0.53Dc36.54±0.52Ca120.8 W/L55.94±0.03A50.49±0.18Ba35.59±0.47Cc30.57±0.88Dc35.52±0.88Ca对照4.60±0.20A3.88±0.09Ba2.46±0.11Cab2.02±0.00Db1.77±0.05Ec半胱氨酸58.9 W/L4.60±0.20A3.90±0.00Ba2.55±0.00Ca2.05±0.01Da2.09±0.20Db93.6 W/L4.60±0.20A3.68±0.01Bb2.43±0.00Dab1.92±0.15Ebc2.82±0.19Ca120.8 W/L4.60±0.20A3.70±0.05Bb2.34±0.17Cb1.81±0.01Dc2.32±0.08Cb对照26.67±0.38A26.72±0.32Aa17.90±0.42Bbc17.84±0.52Bab17.72±0.16Bab缬氨酸58.9 W/L26.67±0.38A26.81±0.21Aa18.94±0.35Ba18.30±0.14Ca18.26±0.15Ca93.6 W/L26.67±0.38A26.63±0.14Aa18.43±0.02Bab17.50±0.55Cc18.25±0.26Ba120.8 W/L26.67±0.38A26.54±0.22Aa17.52±0.52Bc17.62±0.48Bbc17.62±0.48Bb对照11.56±0.38A8.96±0.13Ba3.59±0.23Ca2.37±0.15Ea2.77±0.10Dc甲硫氨酸58.9 W/L11.56±0.38A8.38±0.11Bb3.53±0.11Ca2.03±0.05Eb3.08±0.17Dab93.6 W/L11.56±0.38A7.78±0.19Bc3.45±0.01Ca2.03±0.02Eb2.87±0.07Dbc120.8 W/L11.56±0.38A7.43±0.04Bd3.46±0.19Ca2.15±0.06Db3.18±0.23Ca对照18.43±0.49A17.17±0.18Ba7.97±0.09Cbc7.25±0.08Da7.12±0.02Db异亮氨酸58.9 W/L18.43±0.49A16.85±0.18Bb8.37±0.22Ca6.93±0.08Eb7.50±0.09Da93.6 W/L18.43±0.49A16.59±0.08Bb8.20±0.03Cab6.77±0.03Eb7.52±0.06Da120.8 W/L18.43±0.49A16.51±0.19Bb7.81±0.24Cc7.19±0.01Da7.34±0.19CDa对照28.23±0.22A26.01±0.43Ba12.97±0.33Ca12.51±0.42Ca12.69±0.12Ca亮氨酸58.9 W/L28.23±0.22A24.51±0.31Bb12.77±0.14Ca12.17±0.12Dab12.69±0.32Ca93.6 W/L28.23±0.22A23.65±0.07Bc12.72±0.03Cab12.20±0.20Dab11.66±0.36Eb120.8 W/L28.23±0.22A23.37±0.16Bc12.17±0.41Cb12.12±0.03Cb11.88±0.28Cb对照12.95±0.19A9.90±0.15Ba2.31±0.24Ca2.09±0.28CDa2.00±0.05Db酪氨酸58.9 W/L12.95±0.19A9.72±0.11Ba2.37±0.05Ca2.06±0.13Da2.15±0.06Da93.6 W/L12.95±0.19A9.23±0.02Bb2.28±0.01Ca2.04±0.07Da1.99±0.04Eb120.8 W/L12.95±0.19A9.36±0.10Bb2.23±0.24Ca2.24±0.12Ca2.14±0.02Ca对照45.87±0.71A33.45±0.62Ba14.04±0.13Ca13.46±0.61Ca13.45±0.51Cb苯丙氨酸58.9 W/L45.87±0.71A33.36±0.26Ba14.12±0.06Ca12.74±0.63Da14.53±0.20Ca93.6 W/L45.87±0.71A32.24±0.15Bb14.11±0.02Ca10.78±0.78Db13.94±0.45Cab120.8 W/L45.87±0.71A32.46±0.04Bb13.75±0.40Cb11.42±0.03Db14.34±0.03Ca对照32.63±0.60E46.64±0.45Ab40.89±0.55Ac40.10±0.01Bb38.46±0.35Dc赖氨酸58.9 W/L32.63±0.60E48.77±0.20Aa43.05±0.34Ba41.80±0.31Ca40.71±0.20Db93.6 W/L32.63±0.60E48.30±0.36Aa41.91±0.07Bb40.20±0.32Db40.95±0.43Cb120.8 W/L32.63±0.60E48.44±0.05Aa39.92±0.69Dd41.54±0.04Ca43.65±0.40Ba对照22.58±0.21A19.28±0.20Bb17.00±0.30Db17.58±0.00Cb15.67±0.34Ea组氨酸58.9 W/L22.58±0.21A20.26±0.04Ba17.99±0.11Da18.39±0.09Ca15.46±0.03Ea93.6 W/L22.58±0.21A19.95±0.06Ba17.47±0.07Cab17.55±0.54Cb15.29±0.70Da120.8 W/L22.58±0.21A13.94±0.53Cc11.59±0.44Dc17.35±0.56Bb9.81±0.19Eb对照290.84±2.89C304.95±6.03Bb333.77±6.85Aab345.06±3.45Aa329.60±3.66Aa精氨酸58.9 W/L290.84±2.89D329.00±6.45Ca340.86±2.14Ba348.10±3.26Aa331.36±2.73Ca93.6 W/L290.84±2.89D335.22±5.99ABa330.22±3.29Bb343.82±7.50Aa311.43±3.69Cb120.8 W/L290.84±2.89D327.54±7.51Ca340.61±4.80Aa337.71±3.88BCb324.87±3.84Ca对照94.39±0.22Aa91.90±0.12Cb89.22±0.25Db90.43±0.58Ca94.93±0.47Ba脯氨酸58.9 W/L94.39±0.22Aa91.09±0.01Bc91.56±0.46Ba89.25±0.55Cb88.16±0.67Cb93.6 W/L94.39±0.22Aa89.13±0.28Bd88.63±0.27Bc83.57±0.49Cc83.25±0.79Cd120.8 W/L94.39±0.22Aa91.96±0.17Ba90.36±0.59Cb80.53±0.10Ed86.12±0.27Dc
图3 低频低强度超声波辅助植物乳杆菌发酵白果汁过程中游离氨基酸含量变化的聚类分析
Fig.3 Clustering analysis of changes of free amino acids content during ginkgo kernel juice fermentation by L. plantarum assisted with low-frequency and low-intensity ultrasound
由图4可知,白果汁中鉴定出了4种银杏酸,分别为银杏酸C15∶1、C17∶2、C15∶0、C17∶1,以银杏酸C15∶1的含量最高。白果汁中的4种银杏酸含量在乳酸菌发酵过程中均显著降低,其中,超声处理组与对照组中银杏酸含量在发酵初期差异不显著。随着发酵的进行,尤其是12 h之后,超声处理组中的银杏酸含量开始低于对照组。发酵结束时,对照组中4种银杏酸的总量由发酵前的(2.71±0.19) mg/L降低至发酵后(0.89±0.08)mg/L,降解率为67.13%左右,而58.9、93.6、120.8 W/L的超声处理组在发酵结束后,4种银杏酸总量分别为(0.81±0.05)、(0.82±0.04)、(0.76±0.06)mg/L,降解率分别为70.09%、69.79%、72.12%左右。根据本实验室之前的研究结果分析,银杏酸的降解可能与菌体分泌的某种酶有关[9]。而低频低强度超声波在提高微生物产酶率,增强酶活性等方面早有报道[5]。NGUYEN等[26]采用20 kHz,强度为100 W的超声辅助双歧杆菌发酵牛奶,发现超声波可以刺激双歧杆菌胞内乳糖酶的分泌。所以,超声处理组中银杏酸的降解率高于对照组,可能与低频低强度超声刺激了植物乳杆菌产生银杏酸降解酶的机制有关。
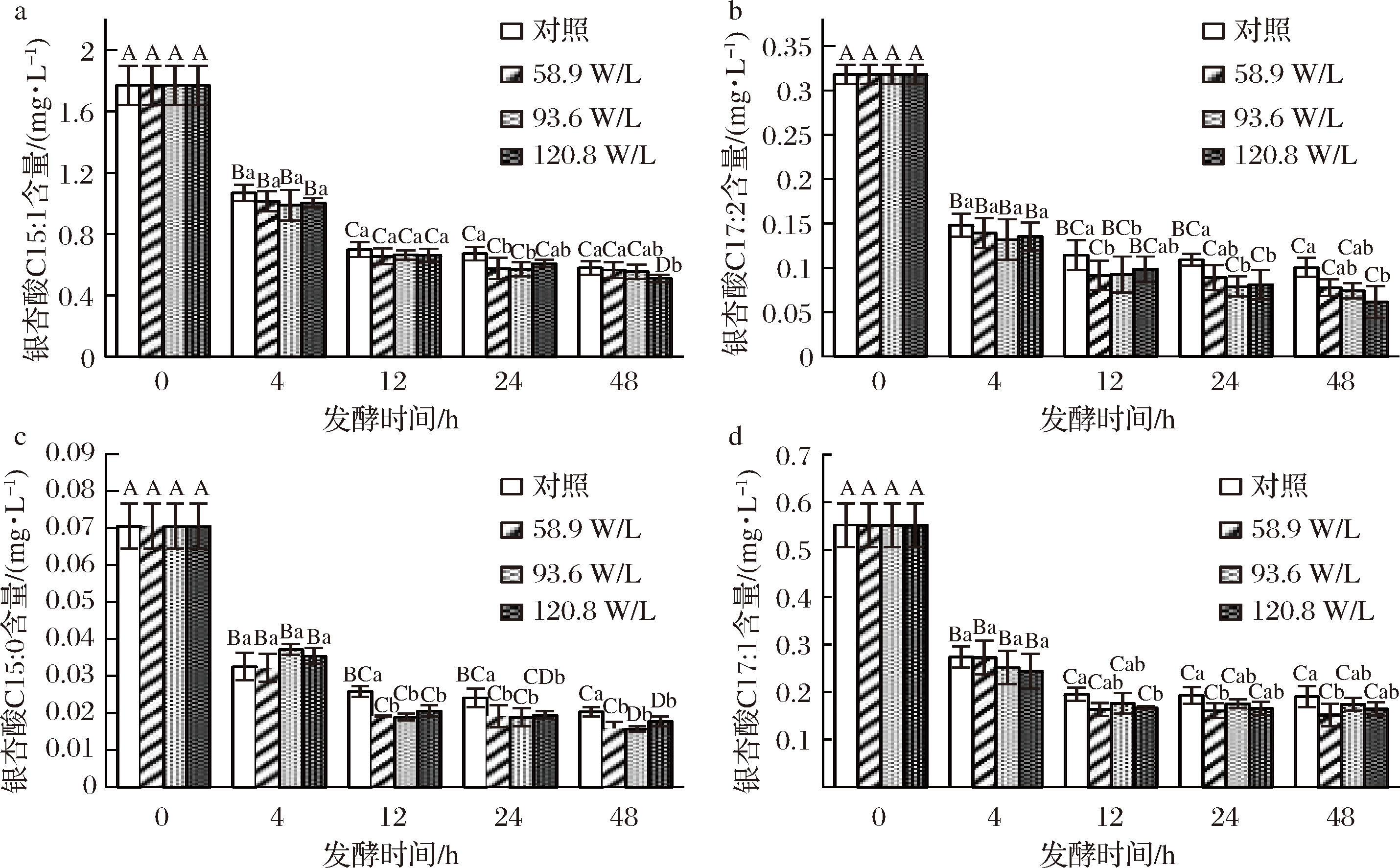
a-银杏酸C15∶1;b-银杏酸C17∶2;c-银杏酸C15∶0;d-银杏酸C17∶1
图4 低频低强度超声波辅助植物乳杆菌发酵白果汁过程中4种银杏酸含量的变化
Fig.4 Changes of four ginkgolic acids content during ginkgo kernel juice fermentation by L. plantarum assisted with low-frequency and low-intensity ultrasound
由图5可知,在未发酵的白果汁中共鉴定出3种银杏萜内酯,分别为银杏内酯A、银杏内酯B和银杏内酯C,以银杏内酯B的含量最高。白果汁中3种银杏内酯的含量均随着发酵的进行逐渐升高,且对照组和超声处理组的变化趋势一致。在对银杏内酯A的富集方面,超声处理组和对照组之间无显著性差异。但在发酵后期,超声处理组,尤其是93.6、120.8 W/L 2个超声处理组显示出了对银杏内酯B以及银杏内酯C的富集优势。到达发酵终点时,对照组中银杏内酯B的含量比发酵前提高了16.7%左右,而58.9、93.6、120.8 W/L 3个超声处理组分别将银杏内酯B含量提高了20.03%、23.93%、22.89%左右。对于银杏内酯C,对照组将其含量提高了15.03%左右,而58.9、93.6、120.8 W/L 3个超声处理组则将其含量分别提高了18.27%、25.98%、22.61%。虽然乳酸菌对银杏内酯的合成机理尚不明晰,但根据本实验室之前的结果分析,银杏萜内酯的合成与丙酮酸,乙酰辅酶A等物质有关[27],而这些物质作为植物乳杆菌糖酸代谢的中间产物,其含量在超声波的作用下有所增加,可能在一定程度上促进了银杏萜内酯的合成。
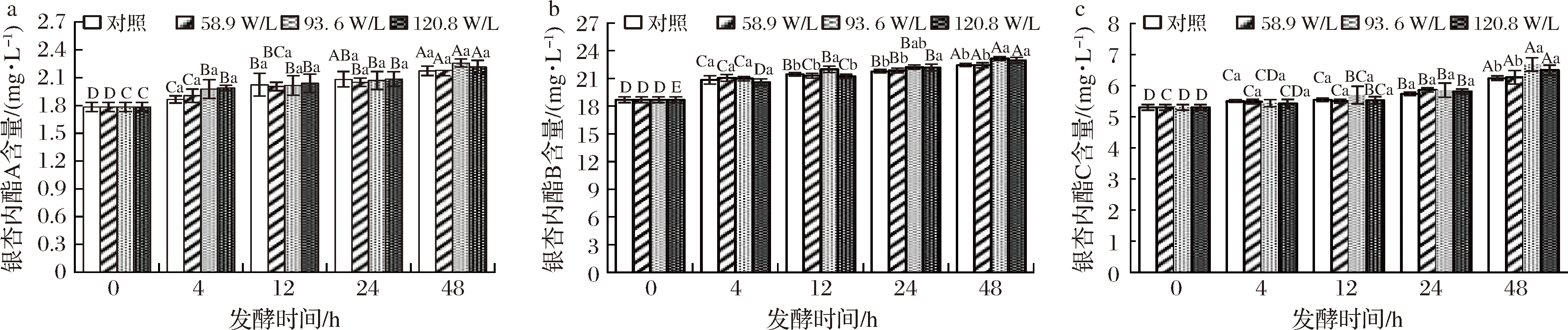
a-银杏酸内酯A;b-银杏酸内酯B;c-银杏酸内酯C
图5 低频低强度超声波辅助植物乳杆菌发酵白果汁过程中3种银杏内酯含量的变化
Fig.5 Changes of three ginkgolides content during ginkgo kernel juice fermentation by L. plantarum assisted with low-frequency and low-intensity ultrasound
研究选取的3个低强度的低频超声波均可促进植物乳杆菌在白果汁中生长,显著提高了生长稳定期活菌数,延缓其进入衰亡期的时间。在发酵初期,低频低强度超声处理可加快乳酸菌的代谢,促进植物乳杆菌对糖类的消耗,从而提高乳酸的产量。但当乳酸达到一定浓度时,超声作用被削弱。同时,低频低强度超声处理可在发酵前12 h显著加快植物乳杆菌对氨基酸的代谢进程。此外,低频低强度超声波有助于提升植物乳杆菌对银杏酸的降解以及对银杏内酯的富集能力。发酵结束时,58.9、98.6、120.8 W/L的超声处理组中,银杏酸的总含量分别比对照组低9.01%、8.10%、15.18%,银杏内酯的总含量分别比对照组高0.10%、4.01%、2.67%。
通过研究结果可以看出,低频低强度超声波对植物乳杆菌代谢白果汁中的营养和生物活性成分具有一定的积极作用,为低频低强度超声波在提高微生物发酵效率方面的运用提供了试验依据。此外,本研究所选取的3个强度的超声波对发酵均未产生负面影响,这说明该强度均在菌体的可接受范围内。但3个超声强度之间的作用效果差异不显著,更适宜的超声作用条件有待进一步的探索。
[1] JAYASOORIYA S D, TORLEY P J, D’ARCY B R, et al. Effect of high power ultrasound and ageing on the physical properties of bovine Semitendinosus and Longissimus muscles[J]. Meat Science, 2007, 75(4): 628-639.
[2] HUANG Guoping, CHEN Suwan, DAI Chunhua, et al. Effects of ultrasound on microbial growth and enzyme activity[J]. Ultrasonics Sonochemistry, 2016, 37: 144-149.
[3] DAI Chunhua, XIONG Feng, HE Ronghai, et al. Effects of low-intensity ultrasound on the growth, cell membrane permeability and ethanol tolerance of Saccharomyces cerevisiae[J]. Ultrasonics Sonochemistry, 2017, 36: 191-197.
[4] AVHAD D N, RATHOD V K. Ultrasound assisted production of a fibrinolytic enzyme in a bioreactor[J]. Ultrasonics Sonochemistry, 2015, 22: 257-264.
[5] OJHA K S, MASON T J, O’DONNELL C P, et al. Ultrasound technology for food fermentation applications[J]. Ultrasonics Sonochemistry, 2017, 34: 410-417.
[6] ZHOU Guisheng, YAO Xin, TANG Yuping, et al. An optimized ultrasound-assisted extraction and simultaneous quantification of 26 characteristic components with four structure types in functional foods from ginkgo seeds[J]. Food Chemistry, 2014, 158(S1): 177-185.
[7] VAN BEEK T A, MONTORO P. Chemical analysis and quality control of Ginkgo biloba leaves, extracts, and phytopharmaceuticals[J]. Journal of Chromatography A, 2009, 1216(11): 2 002-2 032.
[8] BREITENEDER H, MILLS E N C. Plant food allergens—structural and functional aspects of allergenicity[J]. Biotechnology Advances, 2005, 23(6): 395-399.
[9] WANG Yuchen, HAN Yongbin, TAO Yang, et al. Metabolic profile of ginkgo kernel juice fermented with lactic aicd bacteria: A potential way to degrade ginkgolic acids and enrich terpene lactones and phenolics[J]. Process Biochemistry, 2019, 76: 25-33.
[10] ZHANG Hui, WANG Zhang, XU Shiying. Optimization of processing parameters for cloudy ginkgo (Ginkgo biloba Linn.) juice[J]. Journal of Food Engineering, 2007, 80(4): 1 226-1 232.
[11] KAPRASOB R, KERDCHOECHUEN O, LAOHAKUNJIT N, et al. Fermentation-based biotransformation of biaoctive phenolics and volatile compounds from cashew apple juice by select lactic acid bacteria[J]. Process Biochemistry, 2017, 59: 141-149.
[12] LIMA M D S, SILANI I D S V, TOALDO I M, et al. Phenolic compounds, organic acids and antioxidant activity of grape juices produced from new Brazilian varieties planted in the Northeast Region of Brazil[J]. Food Chemistry, 2014, 161(6): 94-103.
[13] VERVOORT L, VAN DER PLANCKEN I, GRAUWET T, et al. Comparing equivalent thermal, high pressure and pulsed electric field processes for mild pasteurization of orange juice: Part Ⅱ: Impact on specific chemical and biochemical quality parameters[J]. Innovative Food Science & Emerging Technologies, 2011, 12(4): 466-477.
[14] RIZZELLO C, CASSONE A, DI CAGNO R, et al. Synthesis of angiotensin I-converting enzyme (ACE)-inhibitory peptides and γ-aminobutyric acid (GABA) during sourdough fermentation by selected lactic acid bacteria[J]. Journal of Agricultural & Food Chemistry, 2008, 56(16): 6 936-6 943.
[15] HE Jingren, XIE Bijun. Reversed-phase argentation high-performance liquid chromatography in phytochemical analysis of ginkgolic acids in leaves from Ginkgo biloba L[J]. Journal of Chromatography A, 2002, 943(2): 303-309.
[16] 田晓清, 王锡昌, 吴文惠, 等. 高压液相色谱分析法测定大佛指银杏酚酸含量[J]. 营养学报, 2010, 32(6): 608-611.
[17] DUBBER M J, KANFER I. Determination of terpene trilactones in Ginkgo biloba solid oral dosage forms using HPLC with evaporative light scattering detection[J]. Journal of Pharmaceutical & Biomedical Analysis, 2006, 41(1): 135-140.
[18] KAUR P, CHAUDHARY A, SINGH B, et al. Optimization of extraction technique and validation of developed RP-HPLC-ELSD method for determination of terpene trilactones in Ginkgo biloba leaves[J]. Journal of Pharmaceutical & Biomedical Analysis, 2009, 50(5): 1 060-1 064.
[19] WU H, HULBERT G J, MOUNT J R. Effects of ultrasound on milk homogenization and fermentation with yogurt starter[J]. Innovative Food Science & Emerging Technologies, 2000, 1(3): 211-218.
[20] LANCHUN S, BOCHU W, ZHIMING L, et al. The research into the influence of low-intensity ultrasonic on the growth of S.cerevisiaes[J]. Colloids and Surfaces B: Biointerfaces, 2003, 30(1): 43-49.
[21] CHEN D, LIU S Q. Transformation of chemical constituents of lychee wine by simultaneous alcoholic and malolactic fermentations[J]. Food Chemistry, 2016, 196: 988-995.
[22] ORDU A R M D, LIU S Q, PATCHETT M L, et al. Kinetics of the arginine metabolism of malolactic wine lactic acid bacteria Lactobacillus buchneri CUC-3 and Oenococcus oeni Lo111[J]. Journal of Applied Microbiology, 2000, 89(3): 547-552.
A R M D, LIU S Q, PATCHETT M L, et al. Kinetics of the arginine metabolism of malolactic wine lactic acid bacteria Lactobacillus buchneri CUC-3 and Oenococcus oeni Lo111[J]. Journal of Applied Microbiology, 2000, 89(3): 547-552.
[23] DI CAGNO R, MAZZACANE F, RIZZELLO C G, et al. Synthesis of γ-aminobutyric acid (GABA) by Lactobacillus plantarum DSM19463: Functional grape must beverage and dermatological applications[J]. Applied Microbiology and Biotechnology, 2010, 86(2): 731-741.
[24] ARD Y. Flavour formation by amino acid catabolism[J]. Biotechnology Advances, 2006, 24(2): 238-242.
[25] LEES G J, JAGO G R. Formation of acetaldehyde from threonine by lactic acid bacteria[J]. Journal of Dairy Research, 1976, 43(1): 75-83.
[26] NGUYEN T M P, YUAN K L, ZHOU W. Stimulating fermentative activities of bifidobacteria in milk by highintensity ultrasound[J]. International Dairy Journal, 2009, 19(6): 410-416.
[27] SABATER-JARA A B, YOUSSEF S, NOVO-UZAL E, et al. Biotechnological approaches to enhance the biosynthesis of Ginkgolides and bilobalide in Ginkgo biloba[J]. Phytochem Rev,2013,12:191-205.