
a-初筛平板; b-复筛平板
图1 亚硒酸钠还原菌的分离纯化
Fig.1 Isolation and purification of selenite reducting bateria
硒为人体必须的微量元素之一,它在机体内有诸多生物学功能,如抗氧化、细胞修复、增强免疫力以及防癌等[1-3];人体缺硒会引起脏器机能失调,引发各种疾病[4-6]。以克山病为例,患者主要表现为急性或慢性心功能不全、心脏扩大、心率失常等。调查显示,克山病发生在低硒地区,患者血液及毛发中的硒含量明显低于非病地区,口服含硒产品能起到预防克山病的效果,但长期食用含硒量较高的食物会引起硒慢性中毒。中国营养学会针对不同人群制定了硒安全摄入量,建议成人硒最高摄入量为400 μg/d,推荐摄入量为50~250 μg/d,儿童为20~50 μg/d,普通癌症患者为200~400 μg/d[5]。
由于人体不能直接合成硒,通过饮食摄取硒是唯一途径。不同形态的硒在人体内的吸收、生物效应及毒性等也不同。常见的补硒产品大致分为兼具活性与毒性的硒化合物和毒性低的零价硒。有机硒类补硒品相对于无机硒来说,其生物活性和毒性有很大的改善,但其仍然面临诸多问题,如生物安全性、生产成本等制约了有机硒产品的进一步开发[7]。纳米尺寸单质硒的出现为硒类产品进一步研发带来了新的曙光,其主要由化学法和生物合成法合成。用化学方法合成的元素硒呈红色、灰色、褐色或黑色,且颗粒粗大的红色单质硒易聚合转变成灰色或黑色单质硒;生物合成纳米硒呈红色胶体状,这种纳米硒是以蛋白质为核、红色单质硒为膜和以蛋白质为分散剂的纳米颗粒[8]。由于化学方法制备得到的红色单质硒一般粒径较大,且容易聚合而不稳定,人们开始研究控制单质硒聚合的方法制备出了纳米硒,有研究表明纳米硒在100~500 nm有助于植物、动物、人类和微生物对硒的吸收[9]。
研究显示,微生物细胞能将硒酸钠或亚硒酸钠还原为纳米硒[10]。OREMLAND等[11]于2004年利用厌氧菌将有毒性的硒转化成毒性低的纳米硒;2010年蒋东华[12]及FESHARAK等[13]分别完成了纳米单质硒的生物转化。不同微生物还原亚硒酸钠生成纳米硒的粒径会有不同,刘红芳[7]利用乳酸菌LA4将亚硒酸钠还原为红色纳米的粒径在50~200 nm;李利军等[14]利用解淀粉芽孢杆菌Lxz-41合成纳米硒的粒径在300 nm左右。除了利用微生物细胞合成纳米硒外,微生物胞外聚合物也有还原亚硒酸钠为纳米硒的能力[15]。
鉴于纳米硒比其他形式的硒具有更高的生物活性和更低的毒性,使其在医药保健品市场上具有更大的吸引力与竞争力,可以预料,纳米硒将具有强大的发展潜力和应用前景。国外在利用微生物硒还原方面研究较多,而国内在这方面研究相对较少;因此,发掘更多、更安全的生物纳米硒转化菌具有重大的经济效益和社会意义。
1.1.1 实验材料
土样,2018年4月在湖北恩施州渔塘坝富硒矿区采集。采集后的土样用无菌离心管封装并于4 ℃条件下运至实验室用于立即处理。
1.1.2 试剂
酵母抽提物、蛋白胨,OXIOD;琼脂粉,Biosharp;亚硒酸钠,Alfa;其他试剂购自国药集团(分析纯)。
1.1.3 培养基
亚硒酸钠还原菌筛选培养基:向LB培养基中添加1 g/L的亚硒酸钠,制备液体和固体培养基;
亚硒酸钠耐受性测试培养基:向LB培养基中添加亚硒酸钠到指定浓度,制备液体培养基。
AXIS Ultra DLD X射线光电子能谱仪,日本岛津公司;JEOL 7600F扫描电镜,日本电子公司;FA-45-12-17 eppendorf离心机,德国艾本德公司;D-1A-50真空冷冻干燥机,江苏天翎仪器有限公司。
1.3.1 亚硒酸钠还原菌的分离纯化
取1 g采集的土壤样品置于含10 mL LB的试管中,用ABSON涡旋仪充分振荡,转速为2 000 r/min,然后进行梯度稀释。稀释后的样品涂布于富集培养基上,于30 ℃恒温培养箱内培养72 h后观察菌落颜色。挑选红色菌落进行复筛,得到纯化的亚硒酸钠还原菌用于后续实验。
1.3.2 亚硒酸钠还原菌对亚硒酸钠耐受性分析
取1株上述纯化后的亚硒酸钠还原菌经LB液体培养基活化后按2%的接种量接种至相应的耐受性测试培养基,培养5 d,每天观察菌体生长与纳米硒的生成状况。
1.3.3 亚硒酸钠还原菌形态
经LB培养基活化的亚硒酸钠还原菌离心,按照梁静南等[16]的方法制备样品进行扫描电镜测试。
1.3.4 亚硒酸钠还原菌鉴定
提取活化后亚硒酸钠还原菌基因组,送生工生物工程(上海)股份有限公司进行16S rRNA测序;测序结果经BLAST比对后利用MEGA 6.0软件构建系统发育树。
1.3.5 纳米硒的纯化及表征
1.3.5.1 纳米硒的纯化
在含亚硒酸钠(10 mg/mL)的LB培养基中按照2%的接种量接种新鲜亚硒酸钠还原菌的培养物,在30 ℃恒温摇床中培养,转速为180 r/min;培养36 h后在6 000×g下离心收集沉淀物。
50 mL培养物形成的沉淀重悬于2 mL的无菌水中,将重悬物移至预制的蔗糖密度梯度管中(由质量分数50%、60%、70%三个梯度的蔗糖制备),8 000×g离心10 min后,收集离心管底部红色沉淀。
1.3.5.2 纳米硒的表征
纳米硒扫描电镜测试:按照1.3.5.1的方法制备的纳米硒在冷冻干燥机上干燥48 h,干燥后的样品在扫描电镜上进行测试。
纳米硒X射线光电子能谱发(X-ray photoelectron spectroscopy, XPS)分析:按照1.3.5.1方法制备的纳米硒在冷冻干燥机上干燥48 h,干燥后的样品进行XPS分析;不添加亚硒酸钠的LB培养基培养菌体,离心收集菌体且冷冻干燥后进行XPS测试作为对照。扫描电镜及XPS分析委托武汉铄思百检测技术有限公司进行测试。
样品土壤重悬并稀释涂布于亚硒酸钠还原菌的筛选培养基上,培养72 h后挑选红色单菌落在同样的培养基上进行复筛,所得结果如图1所示。在初筛平板上出现了红色菌落和白色菌落(图1-a),红色菌落作为亚硒酸钠还原菌的候选菌株。挑选初筛平板上较大的红色单菌落重悬后进行复筛,复筛平板上所有菌落呈现红色且较初筛平板上的菌落颜色深(图1-b)。从平板筛选的结果可以看出,纯化后的菌落能将亚硒酸钠还原为红色产物,该菌作为制备生物活性纳米硒的候选菌株。

a-初筛平板; b-复筛平板
图1 亚硒酸钠还原菌的分离纯化
Fig.1 Isolation and purification of selenite reducting bateria
挑选复筛平板上菌落较大的菌株进行活化,活化后的纳米硒还原菌候选株培养物按照2%的接种量接种到含不同质量浓度的亚硒酸钠耐受性测试培养基中,连续培养5 d并观察,结果如图2所示。结果显示,0 d,各培养瓶中菌液颜色一致;1 d后,未添加亚硒酸钠的培养基中菌体生长迅速,培养基明显浑浊,而添加了亚硒酸钠的培养基仍然澄清;2 d后,含10 mg/mL亚硒酸钠的培养瓶中呈现红色,而亚硒酸钠其他浓度的培养瓶中无明显变化;3~4 d后,在10 mg/mL亚硒的培养瓶呈现深红,其他各浓度的培养物(除0 mg/mL亚硒酸钠)中略显红色,不含亚硒酸钠添加物的培养物呈现乳白色,为菌体本身颜色; 5 d后,含20 mg/mL亚硒酸钠的培养瓶呈现暗红且三角瓶底部有灰色沉淀物,推测灰色沉淀物是由于纳米硒颗粒团聚造成[8],而其他各培养瓶较4 d培养物未出现明显变化。5 d连续观察发现,在实验浓度范围内当亚硒酸钠质量浓度为5~10 mg/mL时菌体生长良好,当亚硒酸钠浓度高于10 mg/mL时菌体受到抑制,当浓度高于20 mg/mL时菌体几乎不生长;结果说明菌株对亚硒酸钠的耐受性在10~20 mg/mL,该菌株较现有已报道的菌株对亚硒酸钠有较高的耐受性[12,14, 17-18],有利于生物制备纳米硒。

图2 亚硒酸钠还原菌对亚硒酸钠耐受性测试
Fig.2 Assay of the selenite tolerance by the selenite reducting bacterium
图3展示了亚硒酸钠还原菌的菌落形态及菌体的扫描电镜结果。图3-a显示亚硒酸钠还原菌菌落光滑、呈乳白色、易挑起;从扫描电镜图(图3-b)可以看出,亚硒酸钠还原菌为杆状菌,形态均一,长约2 μm,宽约0.8 μm。

a-亚硒酸钠还原菌菌落; b-亚硒酸钠还原菌电镜图
图3 亚硒酸钠还原菌菌落及扫描电镜图
Fig.3 Colonies and scanning electronic microscopy of the selenite reducting baterium
从生工生物工程(上海)股份有限公司获得该菌株的16S rRNA序列并提交至GenBank,获得序列号为MN853382。利用BLAST软件进行序列比对,比对结果利用MEGA6.0软件构建系统发育树,如图4所示。图中标记为目的菌株,根据系统发育树(Neighbor-Joining法构建)结果,鉴定为Pseudomonas sp.,即本研究分离获得的菌株为1株具有亚硒酸钠还原性的假单胞菌属菌株。

图4 亚硒酸钠还原菌的系统发育树
Fig.4 The phylogenetic tree of the selenite reducting bacterium
2.5.1 纳米硒的纯化及电镜表征
按照1.3.5.1的方法对培养物进行蔗糖密度梯度离心,培养物中红色颗粒沉积在离心管底部,微生物细胞弥散在离心管的中部区域,呈现乳白色,如图5-a所示。收集离心管底部的红色沉淀,冷冻干燥后低温保存用于后续分析。
图5-b为培养物常规离心收集沉淀物经冷冻干燥后的样品扫描电镜图,从图中可以观察到培养物中生成的纳米硒附着在菌体表面,呈聚集状,颗粒为球形,粒径主要分布在100~200 nm,纳米硒颗粒粒径与刘红芳[7]、王东亮等[19]报道基本一致;纳米颗粒中出现少量团聚(图中白色箭头所示),团聚体粒径在500~1 000 nm。图5-c为培养物常规离心收集沉淀物后再经蔗糖密度梯度离心,收集底部沉淀物冷冻干燥后的样品扫描电镜图,颗粒呈球形,粒径在100~200 nm;经蔗糖密度梯度离心后的产物纯度高,未见完整细胞及细胞碎片。该结果表明,蔗糖密度梯度离心适合用于纳米硒的分离纯化。纳米硒粒径大小在100~500 nm有利于植物、动物、人类和微生物对硒的吸收[8],因此,本研究中生物转化的纳米硒能有较好的生物活性。

a-蔗糖密度梯度离心; b-未梯度离心培养物电镜图; c-密度梯度离心后的培养物电镜图
图5 纳米硒的纯化及电镜图
Fig.5 Purification and SEM of nano-selenium
2.5.2 纳米硒的XPS分析
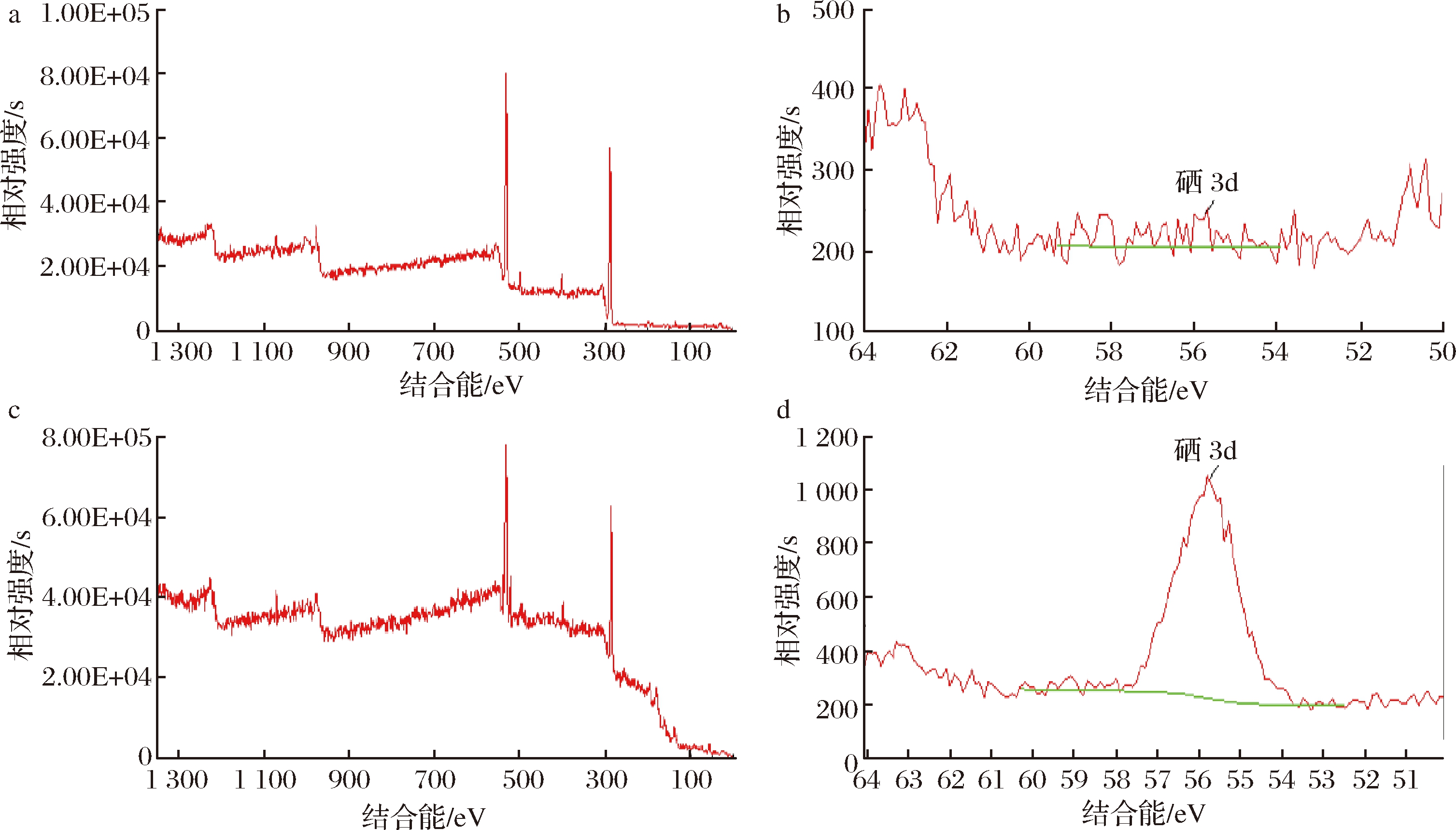
采用XPS测试确定硒元素的价态。图6-a和图6-b分别为不添加亚硒酸钠培养的菌体XPS全扫描图谱及硒元素3d的图谱,全扫描图谱和硒元素3d的XPS图谱中均未出现硒元素的峰,说明样品中不含硒元素;而纯化后的沉淀物的XPS全扫描图谱(图6-c)硒元素3d的XPS扫描图谱(图6-d)均出现了硒元素的特征电子结合能峰,且硒元素3d的特征峰值在56.24 eV处。据刘红芳[7]、HAN等[20]报道,单质硒的电子束缚能位于54.6~57.5 eV,由此可推断本研究分离得到的假单胞菌能将亚硒酸钠中的硒(Ⅳ)转化为单质硒。
本研究从湖北省恩施州富硒矿区的土壤中分离到了1株具有将亚硒酸钠还原为红色产物能力的菌株,初步鉴定为假单胞菌(Pseudomonas sp.)。通过对该菌亚硒酸钠耐受性测试表明,该菌的耐受在10~20 mg/mL;电镜及XPS分析表明,红色产物为纳米单质硒,呈球形,粒径在100~200 nm;实验结果也表明,蔗糖密度梯度离心为纳米硒的分离提供了很好的途径。该假单胞菌菌株作为生产红色纳米单质硒的菌株具有非常好的前景,可为硒的生物转化提供参考。
a-菌体的XPS全扫描图谱;b-菌体的硒3d XPS扫描图谱;c-纯化后纳米硒的XPS全扫描图谱;d-纯化后硒3d的XPS扫描图谱
图6 纳米硒的XPS测试
Fig.6 XPS analysis of nano-selenium
[1] CHEN Y, PRABHU K S, MASTRO A M. Is selenium a potential treatment for cancer metastasis?[J]. Nutrients, 2013, 5(4): 1 149-1 168.
[2] ZHANG L, ZENG H, CHENG W H. Beneficial and paradoxical roles of selenium at nutritional levels of intake in healths plan and longevity[J]. Free Radical Biology and Medicine, 2018, 127:3-13.
[3] 杨婷, 张夏兰,丁晓雯. 元素形态对食品安全影响的研究进展[J].食品与发酵工业, 2018, 44(10): 295-303.
[4] 崔宏伟. 硒及其化合物在调控肿瘤干细胞进程中的作用[J]. 中国肿瘤生物治疗杂志, 2020, 27(1): 76-81.
[5] 王立平, 唐德剑, 沈亚美, 等. 硒的营养缺乏现状及补充方式[J]. 食品工业, 2020, 41(1): 339-343.
[6] 余青, 秦乐蓉, 丽蕊, 等. 硒的生理功能及其对禽蓄动物性能和肉质的影响研究进展[J]. 肉类研究, 2020, 34(3): 94-99.
[7] 刘红芳. 乳酸菌源纳米硒的表征及生物学效应研究[D]. 南昌:南昌大学, 2014.
[8] 高学云, 张劲松, 张立德. 纳米红色元素硒的急性毒性和生物利用度[J]. 卫生研究, 2000, 29(1):57-58.
[9] ZHANG J,WANG H, YAN X, et al. Comparison of short-term toxicity between Nano-Se and selenite in mice[J]. Life sciences, 2005, 76(10): 1 099-1 109.
[10] 厉舒祯, 沈文丽, 邓晔, 等. 微生物还原Se(VI)和Se(IV)合成SeNPs机理研究新进展[J]. 应用与环境生物学报, 2017, 23(3): 579-585.
[11] OREMLAND R S, HERBEL M J, BLUM J S, et al. Structural and spectral features of selenium nanospheres produced by Se-respiring bacteria[J]. Applied and Environmental Microbiology, 2004, 70(1): 52-60.
[12] 蒋华东, 何晓红, 张礼霞, 等. 一株假单胞菌(Pseudomonas alcaliphila MBR)好氧还原亚硒酸钠为红色单质硒[J]. 微生物学报, 2010, 50(10): 1 347-1 352.
[13] FESHARAKI P J, NAZARI P, SHAKIBAIE M, et al. Biosynthesis of selenium nanoparticles using Klebsiella pneumoniae and their recovery by a simple sterilization process[J]. Brazilian Journal of Microbiology, 2010, 41(2): 461-466.
[14] 李利军, 马英辉, 卢美欢. 纳米硒合成菌Lxz-41的鉴定、培养条件优化及其在富硒猕猴桃栽培中的应用[J]. 食品工业科技, 2019, 40(21): 110-117.
[15] ZHANG X, FAN W Y, YAO M C, et al. Redox state of microbial extracellular polymeric substances regulates reduction of selenite to elemental selenium accompanying with enhancing microbial detoxification in aquatic environments[J]. Water Research, 2020, 172: 115 538.
[16] 梁静南, 刘一苇, 谢家仪. 制备细菌类单细胞生物扫描电镜样品方法的改进[J]. 电子显微学报, 2013, 32(3): 276-278.
[17] 何彩梅, 吴桂容, 蒋英军, 等. 柑橘果酒富硒酵母的选育及其富硒条件优化[J]. 北方园艺, 2018(13): 125-132.
[18] 梁丛丛, 孙宇杰, 胡治铭,等.富硒益生菌的筛选及其富硒条件的优化[J]. 食品与生物技术学报, 2016, 35(6): 667-671.
[19] 王东亮, 肖敏, 钱卫, 等. 还原亚硒酸盐产生红色单质硒光合细菌菌株的筛选与鉴定[J]. 微生物学报, 2007, 47(1): 44-47.
[20] HAN D S, BATCHELOR B, ABDEL-WAHAB A. XPS analysis of sorption of selenium(Ⅳ) and selenium(Ⅵ) to mackinawite (FeS)[J]. Environmental Progress & Sustainable Energy, 2013, 32(1): 84-93.