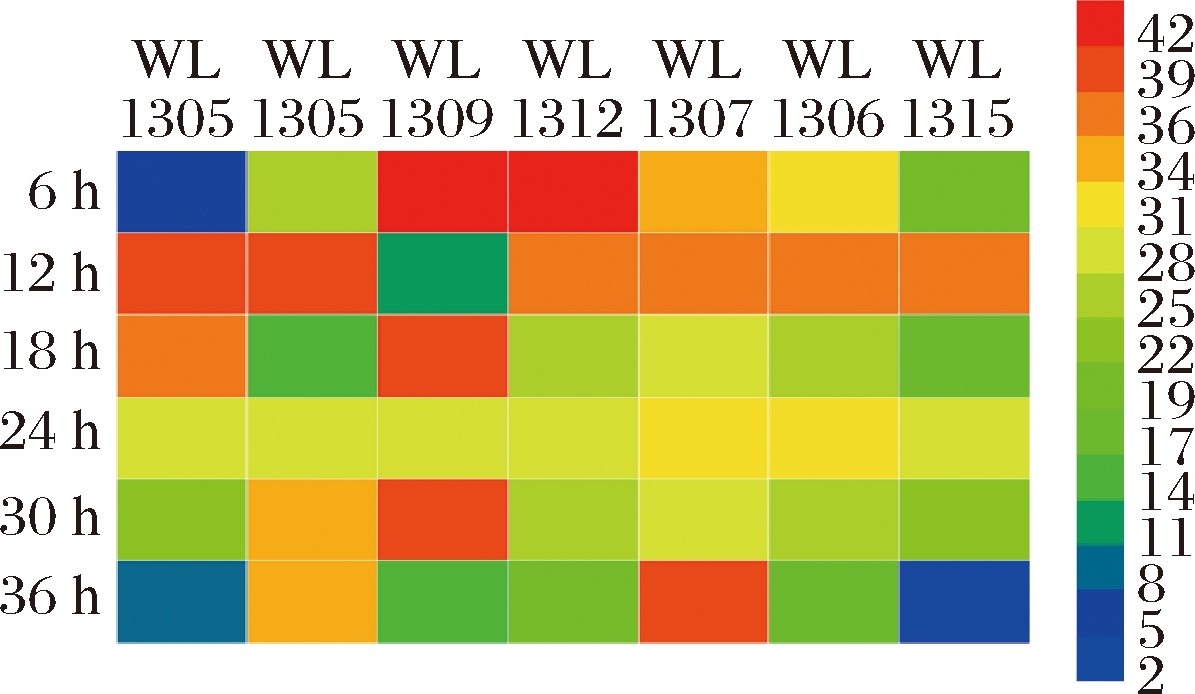
图1 七株细菌发酵液中的丁二酸含量
Fig.1 Succinic acid content of the seven strains in the fermentation broth
丁二酸(succinic acid,SA)是三羧酸循环中重要的中间代谢产物,也是C4平台重要的化合物,它作为一种重要的有机化工原料,可用于合成1,4-丁二醇、四氢呋喃、丁内酯、α-吡喏烷酮(α-pyrrolidone,NKP)、N-甲基吡咯烷酮及可降解生物高分子材料聚丁二酸丁二醇酯(polybutylene succiante,PBS)等原料,广泛应用于医药、食品、日化、纺织、农业、塑料等工业领域[1-2]。同时,丁二酸也是最重要的积木化学品之一,2004年被美国能源部认定为未来12种潜在的生物基化学品之一[3-8]。由于其多样化的应用,全球丁二酸市场迅速增长,于建荣等[9]预计2020年丁二酸的产量达7~8万t,市场价值将达到5.4亿美元。近年来,随着生物工程技术的迅速发展,生物发酵法生产丁二酸因具资源可再生利用等优势,有较大的发展潜力[10]。较多微生物菌种都可通过一定代谢途径合成丁二酸,原核微生物中,丁二酸合成的代谢途径主要有3条:(1)从三羧酸循环的还原性支路合成,在该途径中,丁二酸从磷酸烯醇式丙酮酸起始经由一些中间代谢物包括草酰乙酸、苹果酸和富马酸的转化而合成;(2)从乙醛酸循环途径合成,该途径中,2 mol乙酰CoA转化合成1 mol丁二酸;(3)从氧化三羧酸循环合成,该途径从乙酰CoA的转化开始,依次转化为柠檬酸、异柠檬酸、丁二酸,合成的丁二酸再在丁二酸脱氢酶的作用下转化为富马酸[11]。为此,代谢产物的监测可在一定程度上弄清微生物合成丁二酸的代谢途径。
克雷伯氏菌是工业生产中重要的发酵菌种,用于多种生物基化学品如1,3-丙二醇、2,3-丁二醇、乙醇、生物氢等的发酵生产中。并且,克雷伯氏菌还有较广的基质利用特性,尤其是有的野生菌株能利用木质纤维素水解液进行生物基化学品的发酵生产,如CHENG等[12]报道了1株Klebsiella oxytoca能够发酵玉米芯酸解液生产2,3-丁二醇,JIANG等[13]报道了1株Klebsiella oxytoca能够发酵麻风树皮酸解液生产2,3-丁二醇。在克雷伯氏菌中,丁二酸是伴随一些生物基化学品产生的重要代谢物,CHENG等[14]报道了pH值和溶解CO2水平对Klebsiella pneumonia中2,3-丁二醇和丁二酸产量的影响。然而,迄今,较少研究涉及克雷伯氏菌用于生物丁二酸的生产。
棉秆是新疆广泛存在的生物质原料,近年来棉秆的高值化利用备受关注,棉秆高值化产品的开发也呈现多样化。在棉秆转化生产丁二酸的研究中,有学者报道了采用产琥珀酸放线杆菌发酵纤维素酶处理的棉秆纤维用于丁二酸的生产[15-16],然而,关于微生物共利用棉秆水解糖液中的葡萄糖和木糖生产丁二酸的研究尚未见报道。本课题组在前期研究工作中已分离获得7株克雷伯氏菌,本研究旨在通过对这些菌株发酵棉秆水解糖液过程中丁二酸产量及其关键酶和代谢产物的监测和分析,明晰菌株发酵产丁二酸的代谢途径。
1.1.1 菌株
由本课题组分离获得并保藏于塔里木盆地生物资源保护利用兵团重点实验室的7株克雷伯氏菌,编号分别为WL1305、WL1316、WL1309、WL1312、WL1307、WL1306、WL1315。
1.1.2 原料
新疆阿拉尔市棉田中的棉花秸秆,风干、粉碎后过20目筛备用。
1.1.3 试剂
丁二酸检测试剂盒、丙酮酸检测试剂盒、磷酸烯醇式丙酮酸羧化酶检测试剂盒、乳酸检测试剂盒、琥珀酸脱氢酶检测试剂盒、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂、地衣酚试剂等,上海誉谱化工科技有限公司。
1.1.4 培养基的制备
斜面活化培养基(g/L):木糖10,葡萄糖10,牛肉膏5,蛋白胨10,NaCl 5,KH2PO4 0.5,MgSO4·7H2O 1,琼脂22,pH 7.0,水1 L,110 ℃灭菌30 min。
种子培养基(g/L):木糖10,葡萄糖10,牛肉膏5,蛋白胨10,NaCl 5,KH2PO4 0.5,MgSO4·7H2O 1,pH 7.0,水1 L,110 ℃灭菌30 min。
发酵培养基(g/L):牛肉膏5,蛋白胨10,NaCl 5,KH2PO4 0.5,MgSO4·7H2O 1,pH 7.0,棉秆的酸解糖液1 L,110 ℃灭菌30 min。棉秆水解糖液初始糖质量分数为5%。
1.2.1 发酵棉秆酸解糖液的制备
采用实验室前期优化的酸解方法[17]制备棉秆酸解液:配制体积分数为4%的稀H2SO4,调节固液比为1∶5(g ∶mL),于121 ℃,103 kPa高温高压下水解30 min,抽滤获得棉秆酸解液。
获得的酸解液放置于室温,调节pH值至10.0,4 000 r/min 离心10 min,取上清液,用稀H2SO4回调至pH=5.0,实现其脱毒。所得糖液经脱毒脱色大孔树脂过滤,即得酸解糖液。
1.2.2 菌株活化、种子制备及发酵培养
斜面活化的菌种,接种于活化培养基中,于37 ℃、180 r/min的摇床中培养12~16 h,调节OD600约为1.0,接种于发酵培养基中,于37 ℃,180 r/min的摇床中发酵培养。分别于6、12、18、24、30、36 h取样、离心,分别收集上清液和细菌细胞,用于测定丁二酸及其关键酶和代谢产物。
1.2.3 克雷伯氏菌发酵棉秆水解糖液还原糖及丁二酸测定
葡萄糖含量采用DNS比色法测定[18],木糖含量采用地衣酚试剂比色法测定[19],丁二酸含量采用丁二酸试剂盒测定;乳酸含量通过乳酸含量试剂盒检测;丙酮酸含量通过丙酮酸含量测定试剂盒检测;琥珀酸脱氢酶活性通过琥珀酸脱氢酶试剂盒检测;磷酸烯醇式丙酮酸羧化酶活性通过磷酸烯醇式丙酮酸羧化酶试剂盒检测。
检测了7株克雷伯氏菌在发酵6、12、18、24、30和36 h的丁二酸含量,结果如图1所示。

图1 七株细菌发酵液中的丁二酸含量
Fig.1 Succinic acid content of the seven strains in the fermentation broth
由图1可知,7株克雷伯氏菌在6~36 h均能有效发酵棉秆水解糖液产丁二酸。其中,菌株WL1309和WL1312在发酵早期(6 h)即获得了较高的丁二酸产量,此时的丁二酸含量均达42 g/L以上,之后丁二酸产量有一定降低。其余5株细菌在发酵12 h的丁二酸含量均达峰值,表明了这些菌株在较早期(12 h)产丁二酸的特性,可见这7株克雷伯氏菌在发酵产丁二酸的时间集中于6~12 h,为此,可初步推测,这些菌株可能通过还原性三羧酸循环途径产丁二酸。在发酵18~36 h,大多数菌株所产丁二酸均有一定降低(WL1307除外),大多数低于20 g/L,有的甚至低于10 g/L,可推测,这些菌株所产丁二酸可能在三羧酸循环途径中较多地转化,为此,调控发酵时间对于高产量丁二酸的获得至关重要。
这7株克雷伯氏菌在发酵过程均能有效利用棉秆水解糖液中的葡萄糖和木糖。由图2可知,至发酵结束(36 h),这7株菌已利用了棉秆水解糖液中大多数的葡萄糖和木糖,其葡萄糖利用率均高于85%,木糖利用率均高于90%,由此可见,这些菌株对棉秆水解糖液中葡萄糖和木糖的利用能力均较高。

图2 七株细菌发酵结束的还原糖利用率
Fig.2 Utilization rate of reducing sugar at the end of fermentation of seven bacria
2.2.1 琥珀酸脱氢酶活性的结果分析
琥珀酸脱氢酶(succinate dehydrogenase)是柠檬酸循环中唯一与膜结合的不溶性酶,也是连接呼吸电子传递和氧化磷酸化的枢纽之一,琥珀酸在琥珀酸脱氢酶的作用下被氧化生成延胡索酸,因此,作为一种直接作用于琥珀酸的不可逆性酶,它的活性高低直接影响合成丁二酸的含量[20]。
由图3可知,7种克雷伯氏菌在6~36 h的琥珀酸脱氢酶均有一定的活性,但相对较低,都在0~0.005 5 nmol/(min·104cell),其中,WL1305、WL1316、WL1309在6~36 h时发酵过程中均有一定的峰值,说明该酶在某一时间段均有促进丁二酸转化为延胡索酸的能力,不利于丁二酸的积累,因此,需严格控制发酵时间,减少发酵过程中丁二酸的转化。而WL1312、WL1307、WL1306、WL1315在6~36 h整个发酵时间段酶的活性均较低,显示其对菌株发酵过程中丁二酸的产量影响较小。
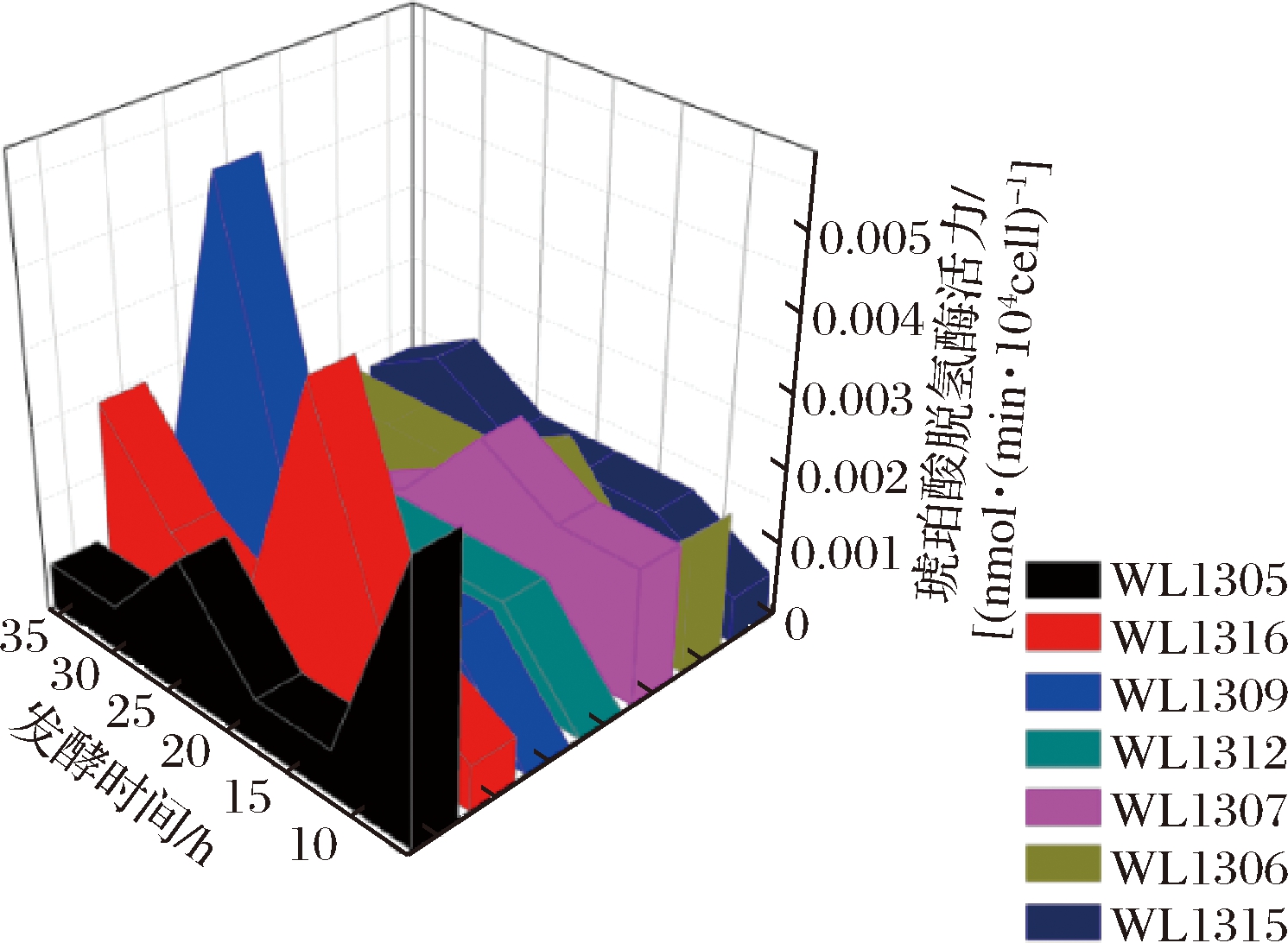
图3 七株菌发酵产丁二酸过程中的琥珀酸脱氢酶活性
Fig.3 Succinic acid dehydrogenase activity during fermentation of succinic acid by seven strains
2.2.2 磷酸烯醇式丙酮酸羧化酶活性结果分析
磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,Pepck)是丁二酸代谢途径中的关键酶,与CO2反应生成草酰乙酸呈不可逆反应的酶。它的活性直接影响磷酸烯醇式丙酮酸(phosphoenolpyruvate,Pep)与草酰乙酸之间代谢流的畅通,从而影响产丁二酸的含量[21]。
结合图3、图4可知,磷酸烯醇式丙酮酸羧化酶的活性远远高于琥珀酸脱氢酶的活性,其中,7株菌在24~36 h 活性有显著增加的趋势,说明在这一时间段该酶有利于磷酸烯醇式丙酮酸脱羧形成草酰乙酸,但这一时间段7株菌(WL1307除外)产丁二酸的能力均下降,推断可能是因为磷酸烯醇式丙酮酸经过磷酸烯醇式丙酮酸脱羧酶作用下形成草酰乙酸后,促进了三羧酸循环的进行,竞争了还原性三羧酸循环生成丁二酸。

图4 七株菌发酵产丁二酸过程中的磷酸烯醇式丙酮酸羧化酶活性
Fig.4 Phosphoenolpyruvate carboxylase activity during fermentation of succinic acid by seven strains
2.3.1 菌株细胞内外丙酮酸浓度分析
丙酮酸是联系细胞代谢的关键节点化合物。由图5-a可知,7株细菌细胞内的丙酮酸含量在发酵36 h内均较低,大多数菌株在12~18 h达到一个峰值,之后有一定降低,最后有一定升高,表明丙酮酸节点处的代谢流分布受诸多代谢途径的影响,随着时间的增加有明显升高的趋势,在36 h时含量较高,都高于1.1 μg/104cell,表明克雷伯氏菌在这一点是利用棉秆水解液进行糖酵解产丙酮酸的关键时间点,更有利于进行三羧酸循环从而转向丁二酸,而在0~30 h丙酮酸的浓度总体偏低,说明在此期间还原糖通过其他途径进行代谢产丁二酸,从而降低了丙酮酸的浓度。由图5-b可知,7株克雷伯氏菌细胞外的丙酮酸含量从总体来看均较高,高于80 mg/L,并且随着时间的增加呈梯度缓慢上升,至发酵后期(30~36 h),其含量已达140 mg/L以上。因此,丙酮酸作为还原性三羧酸循环中丁二酸合成的竞争代谢产物及氧化性三羧酸循环中丁二酸合成和转化的关键化合物,其高浓度在发酵早期(6~12 h)可能开始竞争丁二酸合成支路的代谢流分布,而在发酵的中后期(24~36 h),使得较多的代谢流分布于氧化性三羧酸循环,这时丁二酸有一定积累,但仍在加速转化,导致丁二酸的浓度并不会太高,甚至有降低的趋势。

a-胞内丙酮酸浓度;b-胞外丙酮酸浓度
图5 七株菌发酵产丁二酸过程中的胞内外丙酮酸浓度
Fig.5 Intracellular and extracellular pyruvate concentration during fermentation of succinic acid by seven strains
2.3.2 细胞内外乳酸浓度的分析
由图6-a可知,7株细菌细胞内的乳酸浓度在全发酵周期内非常低,尤其在6~12 h与24~36 h两个时间段,7株细菌细胞内乳酸浓度几乎接近0,而在12~24 h出现一个峰值,由此表明,尽管菌株细胞内乳酸含量极低,但在发酵12~24 h仍有一定积累。由图6-b可知,7株克雷伯氏菌的胞外乳酸含量从整体来看仍然不高,除WL1315以外,其余6株细菌细胞外的乳酸浓度都在0~15 mmol/L,只是在发酵过程中有一定的积累,处理一定峰值(WL1309、WL1307和WL1315有2个峰值)。从这些菌株胞内外乳酸浓度来看,总体都不高,表明乳酸发酵途径在发酵0~36 h,对丁二酸的竞争作用并不算太强,对丁二酸合成支路代谢流分布的竞争作用相对较弱。
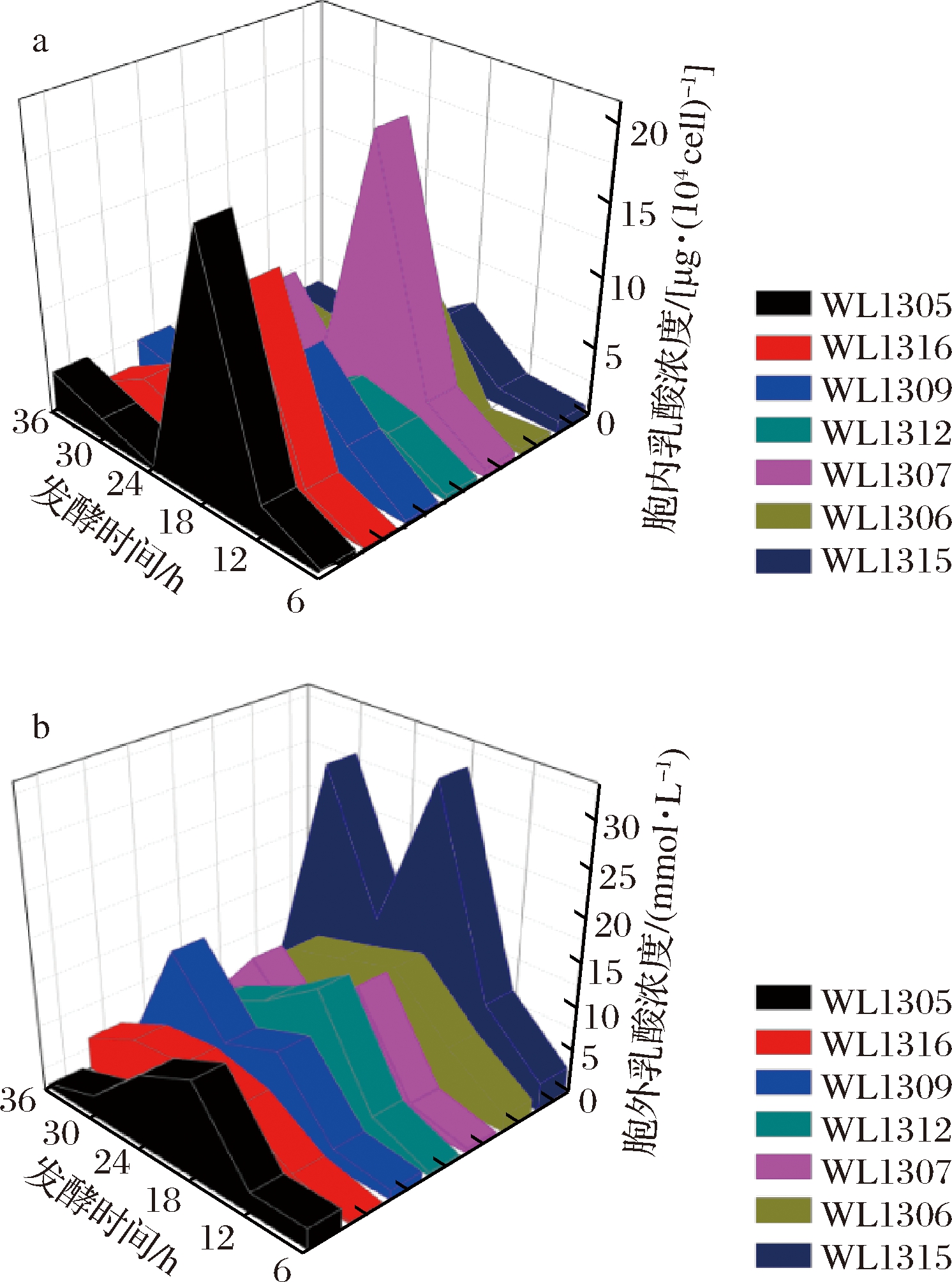
a-胞内乳酸浓度;b-胞外乳酸浓度
图6 七株菌发酵产丁二酸过程中的胞内外乳酸浓度
Fig.6 Intracellular and extracellular lactic acid concentration during fermentation of succinic acid by seven strains
本文研究了克雷伯氏菌发酵棉秆水解糖液产丁二酸代谢的特性,通过对菌株发酵过程中丁二酸含量、葡萄糖和木糖利用率、丙酮酸含量、乳酸含量及关键酶活性的测定、利用及分析,弄清了这些克雷伯氏菌发酵棉秆产丁二酸的主要代谢途径及其竞争代谢支路。获得的结论如下:
(1)7株克雷伯氏菌在6~36 h均能有效发酵棉秆水解糖液产丁二酸,且其在发酵早期(6~12 h)获得的丁二酸产量最高,在发酵过程中能有效利用棉秆水解糖液中葡萄糖和木糖,至发酵结束(36 h),这7株菌的葡萄糖利用率均高于85%,木糖利用率均高于90%。
(2)7株克雷伯氏菌在发酵产丁二酸过程中,琥珀酸脱氢酶活性均较低,而磷酸烯醇式丙酮酸羧化酶活性较高,并且在发酵6~12 h及24~36 h对丁二酸合成的影响较强,表明其在发酵早期(6~12 h)可能促进了丁二酸在还原性三羧酸循环途径的合成,而在发酵后期(24~36 h),因其产物(草酰乙酸)的消耗,加之丙酮酸节点高的代谢流分布,则加速了丁二酸的转化。
(3)7株克雷伯氏菌细胞外发酵液的丙酮酸含量从总体来看均较高,尤其在发酵后期其质量浓度已达140 mg/L以上,从其浓度变化可推测,丙酮酸节点可能在发酵中后期(24~36 h)加速了丁二酸的转化,引起丁二酸合成支路代谢流分布的降低。相较而言,7株细菌胞内外乳酸浓度在发酵过程中均不高,只是在一定发酵阶段有一点积累,但其对丁二酸合成支路代谢流分布的影响仍较弱。
丁二酸是许多厌氧和兼性厌氧微生物的发酵终产物之一。目前研究的工业菌株主要有厌氧的谷氨酸棒杆菌(Corynebacterium glutamicum)[22]和厌氧螺菌(Anaerobiospirillum succiniciproducens)[23]、兼性厌氧放线杆菌(Actinobacillus succinogenes)[24]和大肠杆菌(Escherichia coli)[25]。其发酵方式分为两种:(1)好氧发酵。在有氧的状况下,菌株具有较快的生长和代谢速率,但到菌株稳定期发酵时由于溶氧不足会使产酸速率降低及副产物增加;(2)厌氧发酵。发酵需绝对厌氧,条件较为苛刻,碳源利用缓慢,发酵周期较长,但丁二酸转化速率高。本研究采用兼性厌氧菌—克雷伯氏菌进行发酵棉秆水解糖液产丁二酸的整个过程中,发现丁二酸含量在发酵前期较高,到后期有所降低,根据关键酶及发酵产物的变化,推测原因是发酵前期没有代谢流的竞争,主要是通过还原性三羧酸循环途径进行,到后期在磷酸烯醇式丙酮酸脱羧酶作用下形成草酰乙酸后,促进了三羧酸循环的进行,使得丁二酸在三羧酸循环途径中较多地转化从而降低了丁二酸的产量。因此,在发酵过程中,控制发酵时间是至关重要的。此外,对于细胞代谢的丙酮酸节点,细胞外的含量远高于细胞内,但总体上来看,都呈现上升的趋势,推测在发酵早期(6~12 h),氧化性三羧酸循环已经开始竞争丁二酸合成支路的代谢流分布,在发酵的中后期(24~36 h),由于较多的代谢流分布于氧化性三羧酸循环,并且有少量的乳酸副产物的产生,使得后期丁二酸的浓度有降低的趋势。
[1] LIU R,LIANG L,CAO W,et al.Succinate production by metabolically engineered Escherichia coli,using sugarcane bagasse hydrolysate as the carbon source[J]. Bioresource Technology, 2013,135(3):574-577.
![]() D,SMITH H,JOHN P C S,et al.Succinic acid production from lignocellulosic hydrolysate by Basfia succinic-iproducens[J].Bioresource Technology,2016,214:558-566.
D,SMITH H,JOHN P C S,et al.Succinic acid production from lignocellulosic hydrolysate by Basfia succinic-iproducens[J].Bioresource Technology,2016,214:558-566.
[3] WEEPY T A,HOLLADAY J,WHITE J F,et al.Top Value Added Chemicals From Biomass:I. Results of Screening for Potential Candidates from Sugars and Synthesis Gas[N]. U S:National Renewable Energy Laboratory, 2004.
[4] 金城.丁二酸发酵新进展[J]. 微生物学通报, 2015,42(9):1 832.
[5] YU Y,HONG Y,WANG Y,et al. Mecaptosuccinic acid modified gold nanoparticles as colorimetric sensor for fast detection and simultaneous identification of Cr3+[J]. Sensors & Actuators B Chemical, 2017, 239:865-873.
[6] BRETZ K.Succinic acid production in fed-batch fermentation of Anaerobiospirillum succiniciproducens using glycerol as carbon source[J]. Chemical Engineering & Technology, 2015,38(9):1 659-1 664.
[7] EBENEZER D,DESHPANDE A P,HARIDOSS P.Cross-linked poly (vinyl alcohol)/sulfosuccinic acid polymer as an electrolyte/electrode material for H2-O2 proton exchange membrane fuel cells[J]. Journal of Power Sources, 2016, 304:282-292.
[8] SHELDON R A.Green and sustainable manufacture of chemicals from biomass:State of the art[J].Green Chemistry,2014,16(3):950-963.
[9] 于建荣,毛开云,陈大明,等.生物基丁二酸产业化发展及态势分析[J].生物产业技术, 2014(1):42-46.
[10] CHENG K K , ZHAO X B , ZENG J , et al. Downstream processing of biotechnological produced succinic acid[J]. Appl Microbiol Biotechnol, 2012, 95(4):841-850.
[11] CHENG K K,WANG G Y,ZENG J,et al.Improved succinate production by metabolic engineering[J]. BioMed Res Inter,2013,94(7): S38 790.
[12] CHENG K K,LIU Q,ZHANG J A,et al.Improved 2,3-butanediol production from corncob acid hydrolysate by fed-batch fermentation using Klebsiella oxytoca[J]. Process Biochem,2010,45(4):613-616.
[13] JIANG L Q,FANG Z,GUO F,et al.Production of 2,3-butanediol from acid hydrolysates of jatropha hulls with Klebsiella oxytoca [J].Bioresour Technol, 2012,107:405-410.
[14] CHENG K K, WU J, WANG G Y, et al. Effects of pH and dissolved CO2 level on simultaneous production of 2,3-butanediol and succinic acid using Klebsiella pneumoniae[J]. Bioresource Technology, 2013, 135:500-503.
[15] LI Q,YANG M H,WANG D,et al. Efficient conversion of crop stalk wastes into succinic acid production by Actinobacillus succinogenes[J]. Bioresour Technol, 2010,101(9):3 292-3 294.
[16] LI Q,LEI J D,ZHANG R Y,et al.Efficient decolorization and deproteinization using uniform polymer microsp- heres in the succinic acid biorefinery from bio-waste cotton (Gossypium hirsutum L.) stalks [J]. Bioresour Technol, 2013,135:604-609.
[17] 张琴,李艳宾,曹亚龙.棉秆稀酸水解及微生物共发酵生产单细胞蛋白工艺优化研究[J].食品科学, 2011, 32(5):192-197.
[18] VARGHESE H T,PANICKER C Y,PHILIP D,et al.IR, Raman and SERS spectra of 3,5-dinitrosalicylic acid [J]. Journal of Raman Spectroscopy,2010,38(3):323-331.
[19] PHAM P J,HERNANDEZ R,FRENCH W T,et al.A spectrophotometric method for quantitative determinati on of xylose in fermentation medium[J]. Biomass & Bioenergy, 2011, 35(7):2 814-2 821.
[20] CAO Zhifa,CHEN Weicai,YANG PeiPei,et al.Advances of succinate dehydrogenase mutation in cancers[J]. Progress in Biochemistry and Biophysics,2017,44(1):31-43.
[21] WANG D,LI Q,MAO Y,et al.High-level succinic acid production and yield by lactose-induced expression of phosphoenolpyruvate carboxylase in ptsG mutant Escherichia coli[J].Applied Microbiology & Biotechnology, 2010, 87(6):2 025-2 035.
[22] LITSANOV B A,KABUS A,BROCKER M,et al.Efficient aerobic succinate production from glucose in minimal medium with Corynebacterium glutamicum[J].Microb Biotechnol, 2012, 5(1):116-128.
[23] BRETZ K, KABASCI S.Feed-control development for succinic acid production with Anaerobiospirillum succini ciproducens[J]. Biotechnology Bioengineering, 2012,109(5):1 187-1 192.
[24] WANG C C, ZHU L W, LI H M, et al. Performance analyses of a neutralizing agent combination strategy for the production of succinic acid by Actinobacillus succinogenes ATCC55618[J].Bioprocess Biosyst Eng,2012, 35(4):659-664.
[25] THAKKER C, SAN K Y, BENNET G N. Production of succinic acid by engineered E. coli strains using soybean carbohydrates as feedstock under aerobic fermentation conditions[J].Bioresource Technology, 2012, 130:398-405.