表1 PCR反应体系 单位:μL
Table 1 PCR reaction system

试剂 体积Taq酶25上游引物1.5下游引物1.5MgCl21基因组DNA2ddH2O20总体积50
益生菌是人和动物体肠道内的正常菌群,可用来开发功能性食品。功能性食品是新兴领域,可促进健康,为消费者提供多种食品选择[1]。乳酸杆菌作为动物体内重要的益生菌,可调节肠道菌群平衡,增强机体的免疫力和抵抗力[2]。在乳酸杆菌属中,唾液乳杆菌(Lactobacillus salivarius)和发酵乳杆菌是人类唾液中最常见的2种菌[3-4]。唾液乳杆菌具有极大的黏附咽黏膜的潜力[5],且具有抗部分肠道或阴道乳酸杆菌和根除无乳链球菌(Streptococcus agalactiae,GBS)的效果,可用于新型乳基益生菌发酵食品[6-7]。其他唾液乳杆菌菌株都已被证明在动物模型[8]和人体临床试验[9]中均有良好的耐受性和安全性,包括孕妇在内[10-12]。唾液乳杆菌作为一种具有极大潜力的益生性乳杆菌已成为近年研究的热点,正被广泛用于制成适用于人和动物的益生菌制剂[13-16]。目前由唾液乳杆菌制备的相关益生菌制剂已在市场上销售[17]。随着对唾液乳杆菌的深入研究,将会有更多的适用于人和动物的微生态制剂问世。
高抗氧化型乳酸菌能提高植物抗氧化活性和植物化学浓度[18],帮助清除人体内自由基,提高细胞抗氧化能力,增强免疫力[19]。乳酸菌被认为是兼性厌氧型细菌,抗氧胁迫机制尚不完善。在O2存在的情况下,菌株自身代谢过程中产生的活性氧族,严重危害菌株的生长和生存。因此降低活性氧族的伤害,是提高乳酸菌生物量和菌体存活的有效手段之一[20]。可从2个方面入手,一方面是向培养基中直接添加过氧化氢酶。由于乳酸菌生长是不断酸化的过程,处于细胞外的过氧化氢酶可能由于pH值不断降低导致其活性也不断降低。另一方面,对部分菌株而言,在培养过程中加入特定物质以激活呼吸链,表达内源过氧化氢酶[21-22],从而达到促进菌体生长,并减弱活性氧族的威胁,提高细胞的存活力等目的[23]。
一条有功能的呼吸链,至少具备获取电子及H+的脱氢酶类,负责传递电子的醌类物质和将电子及H+交给分子氧的细胞色素氧化酶这3个部分[20]。在有氧培养过程中,随着血红素(heme)或血红素与四烯甲萘醌(VK2)获得及O2的参与,呼吸链将被激活,乳酸乳球菌、植物乳杆菌等具备有氧呼吸潜力的菌株可以由发酵作用进入有氧呼吸阶段。通过研究基因信息对比证实唾液乳杆菌呼吸链组成,在外源添加血红素的情况下,乳酸菌的细胞色素氧化酶能被激活,使菌株能够进行有氧呼吸[21]。值得注意的是,虽然唾液乳杆菌具备了多数有氧呼吸所需要的基因,但是没有报道、实验中也没有发现该菌具有有氧呼吸的潜力。另一方面在有氧培养过程中乳酸菌会产生大量的H2O2,高浓度的H2O2并不能通过有氧呼吸进行降解,唾液乳杆菌具有血红素依赖的过氧化氢酶基因[20],因此可以探究内源过氧化氢酶和外源过氧化氢酶对唾液乳杆菌的作用。
传统的乳酸菌发酵多为无氧或静置培养,菌株生长过程中较少接触到分子氧,受到的氧胁迫作用较为有限;但现代化工厂进行发酵产品的生产、储存及销售过程,则往往难以避免O2的接触,氧胁迫对菌株生存生长造成的不利影响更为明显[20]。本实验就唾液乳杆菌抗氧胁迫、有氧生长进行研究。
唾液乳杆菌GDW1994(Lactobacillus salivarius)由广西大学生命科学与技术学院自主分离、筛选和保藏。
MRS 肉汤: 蛋白胨 10 g/L,牛肉浸汁 10 g/L,酵母浸汁 10 g/L,葡萄糖 5 g/L,吐温-80 1 mL/L, 番茄汁 200 g/L;pH 6.2, 115 ℃高压蒸汽灭菌 30 min。
MRS琼脂培养基:蛋白胨10 g/L,牛肉浸汁10 g/L,酵母浸汁10 g/L,葡萄糖5 g/L,吐温-80 1 mL/L,番茄汁200 g/L,琼脂15 g/L;pH 6.2,115 ℃高压蒸汽灭菌30 min。
30%(体积分数)H2O2、四烯甲萘醌(VK2)、血红素(heme)、过氧化氢酶(catalase)、Marker DNA,北京索莱宝科技有限公司。
MQD-S3R恒温振荡培养箱,上海旻泉仪器有限公司;NanoDrop one微量紫外-可见光分光光度计,Thermo Fisher;LRH-250A生化培养箱,韶关市泰宏医疗器械有限公司;biometra tone基因扩增仪,德国耶拿分析仪器股份公司;SW-CJ-1F洁净工作台,苏州净化设备有限公司;Czone 8菌落计数仪,杭州讯数科技有限公司;Toledo 320 pH计,METTLER TOLEDO。
1.3.1 乳酸菌的分离纯化与保藏
MRS肉汤为筛选培养基,37 ℃、200 r/min 摇床培养。稀释涂布,培养至出现明显单菌落,挑选形态饱满单菌落至MRS液体培养基中,进行多次划线传代培养后,挑选形态特征与《伯杰氏细菌鉴定手册》[22]对乳酸菌描述(圆形、表面光滑、乳白色等)相一致的菌落进行革兰氏染色,生理生化鉴定及16S rDNA 测序鉴定。将筛选的菌株接种于MRS肉汤中,37 ℃ 恒温培养12 h,并传至3代备用。将纯化后的菌种富集培养,再与30%(体积分数)甘油以体积比1∶1混合至-80 ℃冰箱中保藏[22]。
1.3.2 菌种鉴定
采用《乳酸细菌现代研究实验技术》[23]中所述方法对菌株进行生理生化鉴定。将筛选出抗氧化性强的乳酸菌进行16S rDNA 序列分析。采用《乳酸细菌现代研究实验技术》[23]中所述方法提取基因组DNA。设计细菌的16S rDNA 序列引物。正向引物:TGAGAGTTTGATCCTGGCTCAG;反向引物:TACGGCTACCTTGTTA-CGAC。聚合酶链式反应(polymerase chain reaction,PCR)反应体系和反应程序如表1和表2所示[24]。
表1 PCR反应体系 单位:μL
Table 1 PCR reaction system

试剂 体积Taq酶25上游引物1.5下游引物1.5MgCl21基因组DNA2ddH2O20总体积50
表2 PCR反应程序
Table 2 PCR response procedure

反应温度/℃反应时间/min9410940.5550.5721.57210
注:反应为30个循环
将PCR产物测序结果与GenBank中已知16S rDNA序列进行同源性比较,用MEGA 5.0 软件构建系统发育树。
1.3.3 乳酸菌活菌数的测定
发酵液中的活菌数按GB 4789.35—2016《食品安全国家标准 乳酸菌检验》[25]中的方法测定,并转化为对数值进行统计分析。
1.3.4 生长曲线的测定
将分离纯化后的唾液乳杆菌接种至MRS液体培养基中过夜培养,取活化后的菌液以接种量为1%接种至50 mL的MRS培养基中,置于37 ℃恒温培养箱中,每隔3 h取1次样,使用紫外分光光度计测生物量[3]。然后以培养时间为横坐标,生物量为纵坐标,绘制唾液乳杆菌生长曲线。
1.3.5 有氧培养对生物活性的影响
将菌株按1%接种量在MRS培养基中分别进行有氧条件、无氧条件培养,每隔7 h后取1 mL菌液稀释相应的3个梯度,涂布平板,每个梯度3个平行,将平板放入37 ℃恒温培养箱中培养2 d,使用细胞计数仪记录细胞数。
1.3.6 菌株GDW1994对酸的耐受性测定
将菌株在MRS培养基中有氧培养15 h,取1 mL菌液使用高速冷冻离心机8 000 r/min 4 ℃离心10 min收集菌体,使用蒸馏水洗涤3次,分别用 pH值为2、3、4、5、6的新鲜MRS培养基重悬菌体,37 ℃静止保温1 h后,稀释平板涂布,同时统计1 mL未经酸处理的菌液中活菌数,处理后的活菌数与未处理的活菌数之比为细胞存活率。
1.3.7 菌株GDW1994对H2O2的耐受性测定
将菌株按1%接种量接种于 MRS 液体培养基中,有氧培养15 h,取1 mL菌液使用高速冷冻离心机8 000 r/min,4 ℃离心10 min收集菌体,使用蒸馏水洗涤3次,分别用浓度为2、3、4、5、6 mmol/L H2O2的新鲜MRS培养基重悬菌体,37 ℃静止保温1 h后,稀释平板涂布,同时统计1 mL未经H2O2处理的菌液中活菌数。处理后的活菌数与未处理的活菌数之比为细胞存活率。
1.3.8 菌株GDW1994内源有氧呼吸
菌株GDW1994接入优化的MRS液体培养基中,培养基中分别加入VK2、heme、VK2+ heme,进行有氧培养12 h,测活菌数。
1.3.9 外源及内源过氧化氢酶对菌株的影响
将菌株GDW1994接入MRS液体培养基中,分别加入VK2和血红素,为实验组,加入30 g/L过氧化氢酶,在相同培养条件下培养为对照组。进行有氧培养12 h,每隔3 h取样,测生物量。实验组和对照组均在 160 r/min、 37 ℃ 摇床中培养12 h,放入4 ℃冰箱中保存,每隔2 d测1次活菌数。
1.3.10 培养基的优化
以MRS为基础培养基,37 ℃静置培养12 h后,以生物活性为考察目标[26]。葡萄糖为碳源,蛋白胨、酵母粉和牛肉膏为混合碳源,利用L9(43)正交试验设计9种增殖培养基,将唾液乳杆菌过夜培养后,以1%接种量分别接种于上述增殖培养基中,37 ℃恒温培养12 h 后,将所有三角瓶放入冰箱中终止培养,进行活菌数检测[27]。L9(43)正交试验设计如表3所示。
表3 MRS基础培养基碳氮源正交优化 单位:g/L
Table 3 Orthogonal optimization of carbon and nitrogen sources in basic cμLture medium of MRS

水平蛋白胨酵母膏葡萄糖牛肉膏152.515521052010315152515
无机盐为CH3COONa、MgSO4·7H2O和MnSO4 ·H2O,在确认最适宜碳源、氮源质量浓度后,正交试验设计9种增殖培养基,如表4所示。唾液乳杆菌经MRS培养基过夜活化后,以1%接种量分别接种于上述增殖培养基,37 ℃恒温培养12 h,放入冰箱终止培养,进行活菌数检测。
表4 MRS无机盐正交优化 单位:g/L
Table 4 Orthogonal optimization of inorganic salts in MRS

水平CH3COONaMgSO4·7H2OMnSO4·H2O120.20.1250.60.23810.3
1.3.11 培养条件优化
在培养基配方优化完成的基础上,以接种量1%(体积分数),过氧化氢酶20 g/L,起始pH 6.0,转速180 r/min,温度分别为30、34、47、40、44 ℃下培养12 h。全部放置冰箱中终止培养,进行稀释涂布活菌计数。
在培养基配方优化完成的基础上,将培养基调至初始pH值分别为5.5、6.0、6.2、6.4、6.9,接种量1%,过氧化氢酶20 g/L,转速180 r/min,温度37 ℃的摇床中培养12 h后,全部移至冰箱终止培养,进行活菌数检测。
在培养配方优化完成的基础上,起始pH值为6.4,过氧化氢酶20 g/L,接种量分别为1%、2%、3%、4%、5%,放置转速180 r/min,温度37 ℃的摇床中培养12 h后,全部移至冰箱中终止培养,进行活菌数检测。
在培养基配方优化完成的基础上,接种量为4%,起始pH值为6.4,过氧化氢酶20 g/L转速分别为 140、 160、 180、 200、 220 r/min,温度37 ℃摇床中培养12 h后,全部移至冰箱终止培养,进行活菌数检测。
在培养基配方优化完成的基础上,接种量为4%,起始pH值为6.4,过氧化氢酶分别为0、10、20、30、40 g/L,放置转速160 r/min,温度37 ℃的摇床中培养12 h后,全部移至冰箱终止培养,进行活菌数检测[26]。
所得数据均为平行测定3次以上取平均值,并计算出正负标准偏差,用误差线表示。使用Stat-graphics Centurion XVI程序通过简单和多变量的方差分析以及95%的置信水平评估,在所获得的结果上考虑不同变量的统计显著性程度。
GDW1994菌株在MRS培养基上稀释涂布培养后,生长良好,MRS琼脂上菌落大小为0.6~1.5 mm,圆形、呈乳白色、边缘整齐、表面光滑并凸起。革兰氏染色结果为阳性,生理生化鉴定如表5所示,根据《伯杰氏菌种鉴定手册》[22]对比,可以初步鉴定所分离的菌株为乳杆菌属。
表5 菌株GDW1994的生理生化鉴定表
Table 5 Physiological and biochemical identification form of GDW 1994

项目结果项目结果形状杆状尿酶试验+革兰氏染色+石蕊牛奶试验+有氧生长+葡萄糖(产气)+45 ℃生长+蔗糖+精氨酸产氨-甘油-V-P试验-麦芽糖+七叶苷+海藻糖+过氧化氢酶-乳糖+明胶水解-甘露醇+淀粉水解-山梨醇+硫化氢+葡聚糖的产生-
注:“- ”表示反应为阴性;“+ ”表示反应为阳性
菌株GDW1994扩增后得到1 500 bp左右的DNA序列如图1所示。将结果在NCBI 数据库中比对并构建系统发育树如图2所示。由系统发育树可确定为唾液乳杆菌。菌株GBE17 与Lactobacillus salivarius strain(JQ837457.1),GBE29与L. salivarius strain (CP029616.1)有最接近的亲缘关系,相似度达到96%。
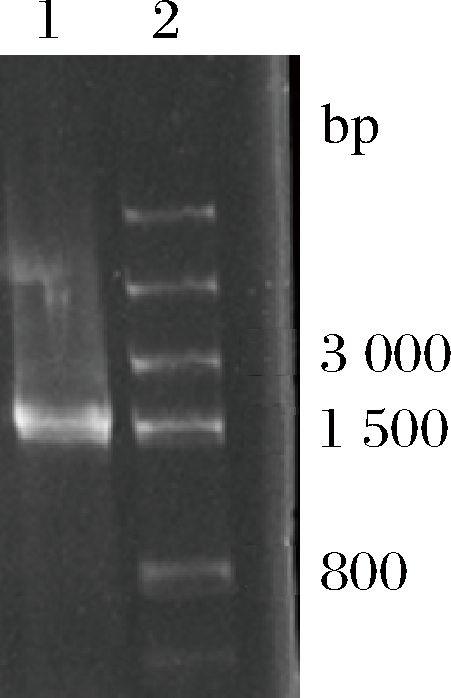
1-Marker;2-菌株GDW1994
图1 菌株GDW1994 PCR电泳图
Fig.1 GDW1994 PCR electrophoresis of strain

图2 菌株GDW1994的系统发育树
Fig.2 Systemic tree of strain GDW1994
由图3可知,菌株GDW1994在经过3 h的延滞期后,即开始快速生长,6 h后进入对数生长期,在此期间菌体生长繁殖速度较快,pH值随代谢产物乳酸及其他有机酸的累积而下降较快。在培养了约15 h以后,菌体进入平稳期,菌体密度基本维持不变。
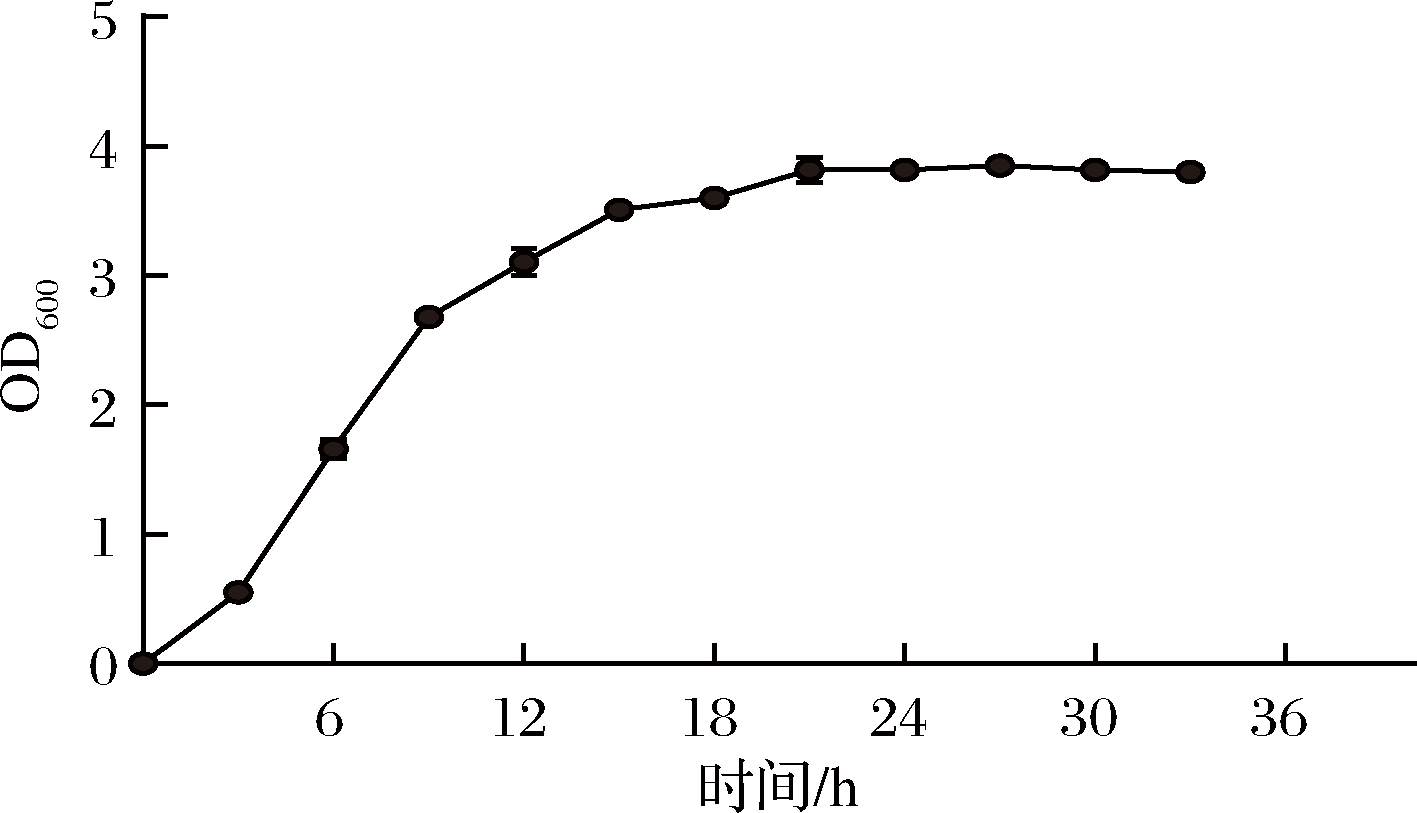
图3 菌株GDW1994的生长曲线
Fig.3 Growth curve of GDW1994
2.3.1 有氧培养对生物活性的影响
如图4所示,在无氧培养条件下,唾液乳杆菌培养14 h后,活菌数达到最高为1.45×109 CFU/mL,此后随着时间的增加,活菌数开始迅速下降,当培养49 h后,活菌数开始呈数量级下降,说明无氧培养会使唾液乳杆菌到达稳定并死亡;而有氧培养的发酵乳杆菌细胞活力比较稳定,在49 h内活菌数一直稳定在8×108CFU/mL左右。说明有氧培养对唾液乳杆菌的生物活性和保存时间具有积极作用。另一方面,有氧培养的最高菌密度比无氧培养低,从提高唾液乳杆菌的抗氧胁迫能力和优化有氧培养条件对达到高密度且不易死亡来说具有一定意义。
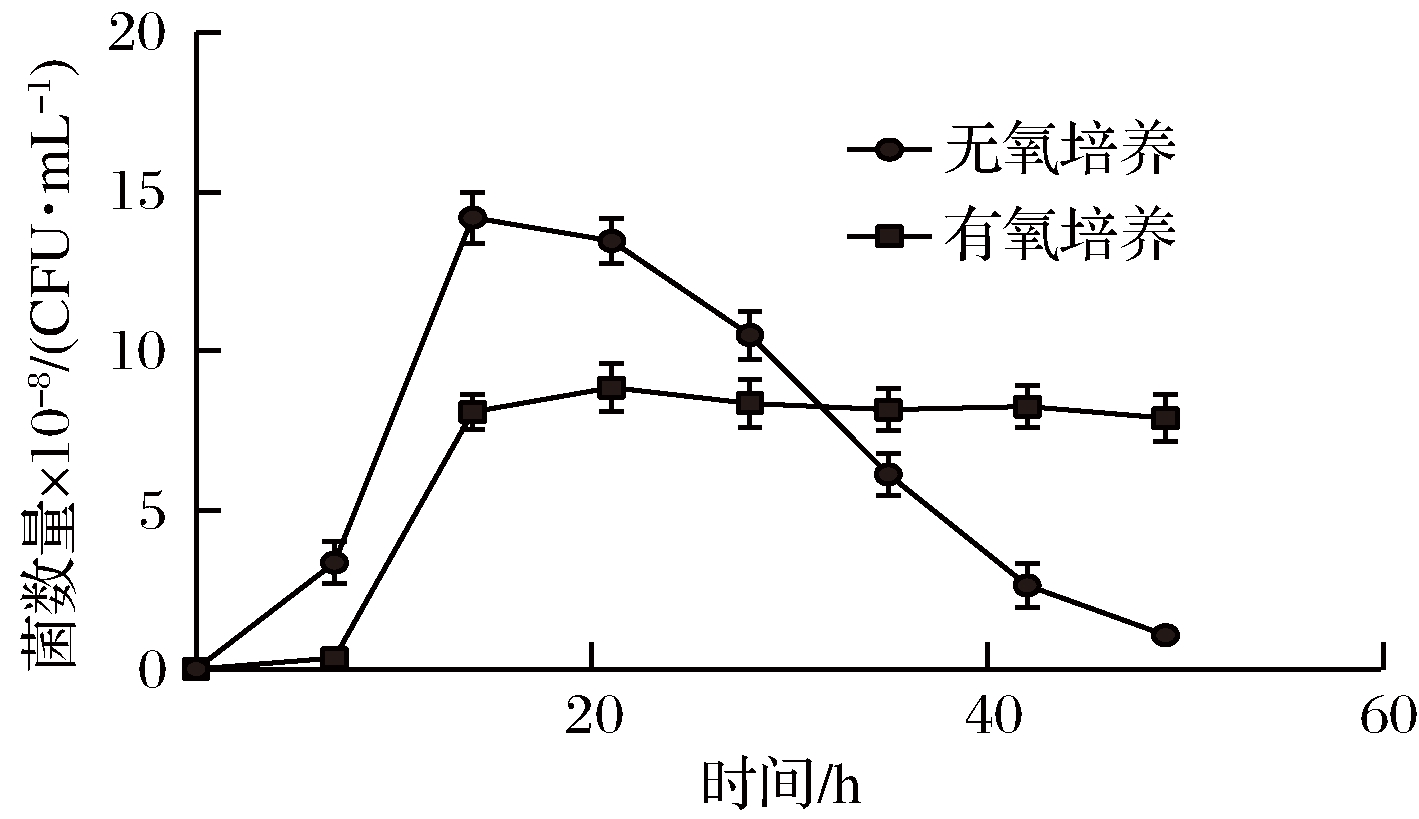
图4 有氧培养对菌株GDW1994的影响
Fig.4 Effect of strain GDW1994 on aerobic culture
2.3.2 有氧条件下对酸的耐受性测定
唾液乳杆菌应用于实际生产中,必须要有耐酸能力。由图5可知,有氧条件下,菌株在pH值为3时,存活率可达80%左右,当pH值为2时菌株存活率降至17%左右。说明pH对唾液乳杆菌活性有一定影响,可以推断唾液乳杆菌在发酵过程中产生的有机酸使培养基中pH值降低,从而造成菌株迅速死亡。在有氧条件下,菌株培养24 h后培养基终pH值为4.5左右;无氧条件下,菌株培养24 h后培养基终pH值为3.7左右,由此也可说明有氧培养更有利于菌株培养与保藏。
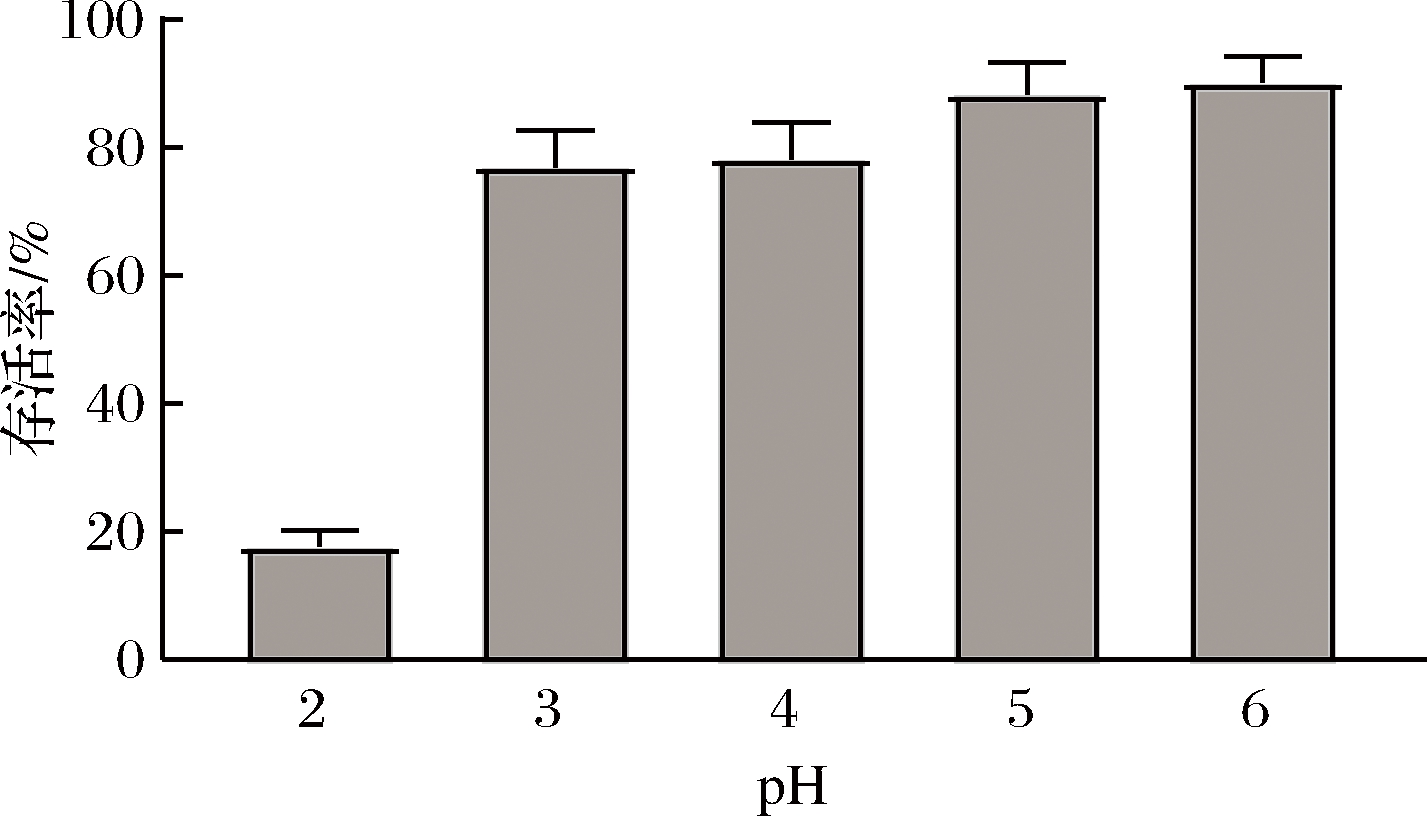
图5 pH对菌株GDW1994的影响
Fig.5 Effect of pH on strain GDW1994
2.3.3 H2O2的耐受性测定
有氧培养过程中,菌株没有产过氧化氢酶的能力,导致培养基中H2O2的积累,从而对菌株产生毒性作用。由图6可知,当H2O2的浓度为2 mmol/L时,菌株GDW1994的存活率约为81%;随着H2O2浓度的增加,菌株存活率开始下降;当H2O2浓度为6 mmol/L时,菌株存活率仅为32%,说明H2O2对菌株活性影响较大。

图6 H2O2对菌株GDW1994的影响
Fig.6 Effect of H2O2 on strain GDW1994
菌株若要进行有氧呼吸,必须具备执行该功能的所有组分,既必须要有一条可以发挥功能的呼吸链。由图7可知,菌株GDW1994不具备完整的醌类物质合成能力,其呼吸链的激活需要同时外加heme和VK2,从而内源产生过氧化氢酶。最高活菌数可达 3×109 CFU/mL。
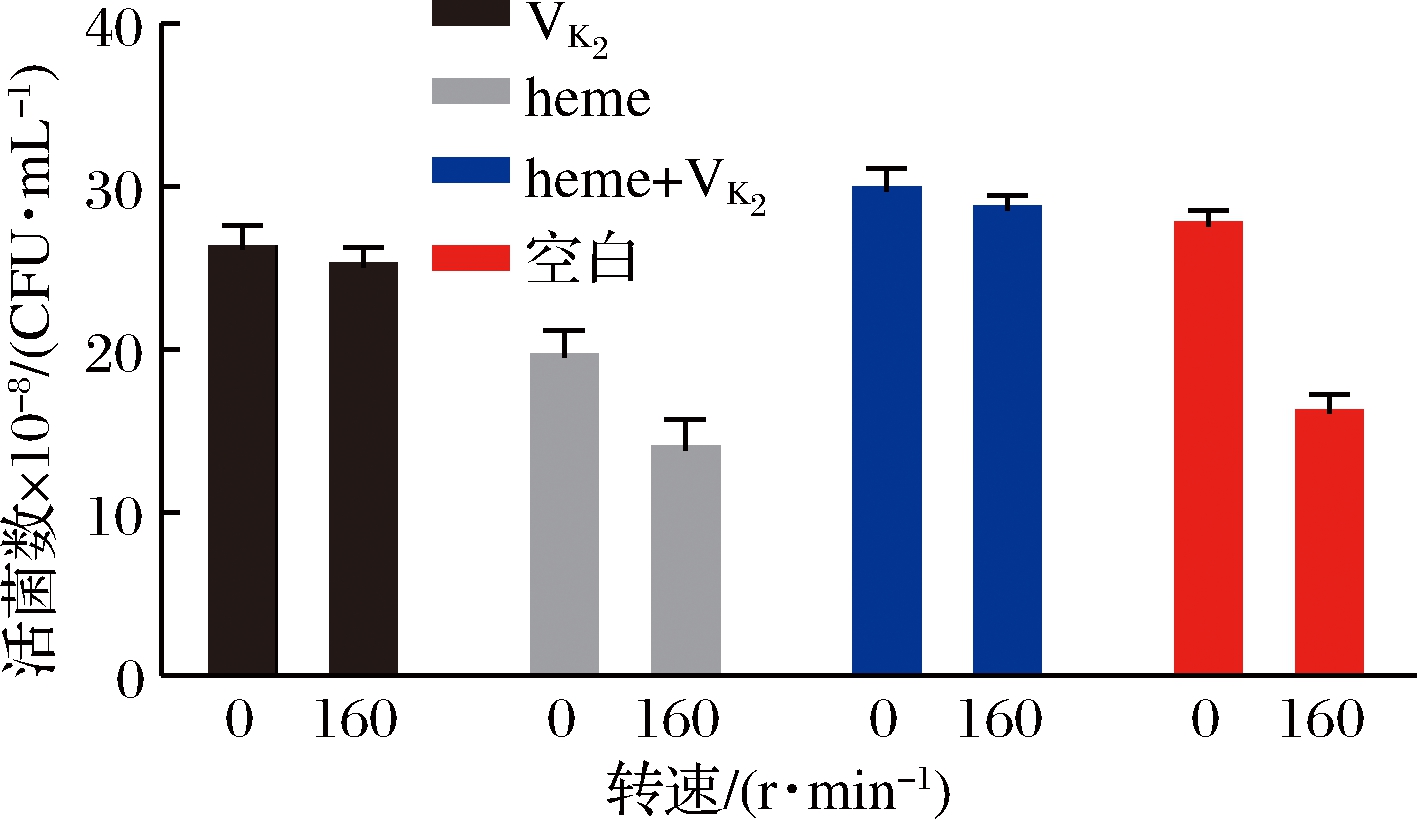
图7 内源过氧化氢酶对菌株GDW1994的作用
Fig.7 Effect of endogenous catalase on GDW1994
由图8可知,有氧呼吸对菌株GDW1994带来显著变化是发生在指数后期、稳定期。加入过氧化氢酶或VK2和heme,生物量明显增高,细胞生长周期延长。由于细胞外环境复杂多变,外源过氧化氢酶的酶活性不断降低,菌株GDW1994的活性必然会受到影响。菌株GDW1994具有内源性的过氧化氢酶,由图9可知,随着heme与VK2的获得及O2的参与,菌株GDW1994在4 ℃冰箱中保存可长达30 d,活菌数为108 CFU/mL。存活率是没有加heme和VK2和O2参与的100倍,是外源过氧化氢酶的20倍。由于胞内环境相对温和发挥作用更加长久且直接,相对于外源过氧化氢酶,能使菌株更为强壮且存活时间更加持久。在工业生产中,需要高密度发酵菌株,菌株的生物量和生物活性为指标,选择内源过氧化氢酶更有价值。
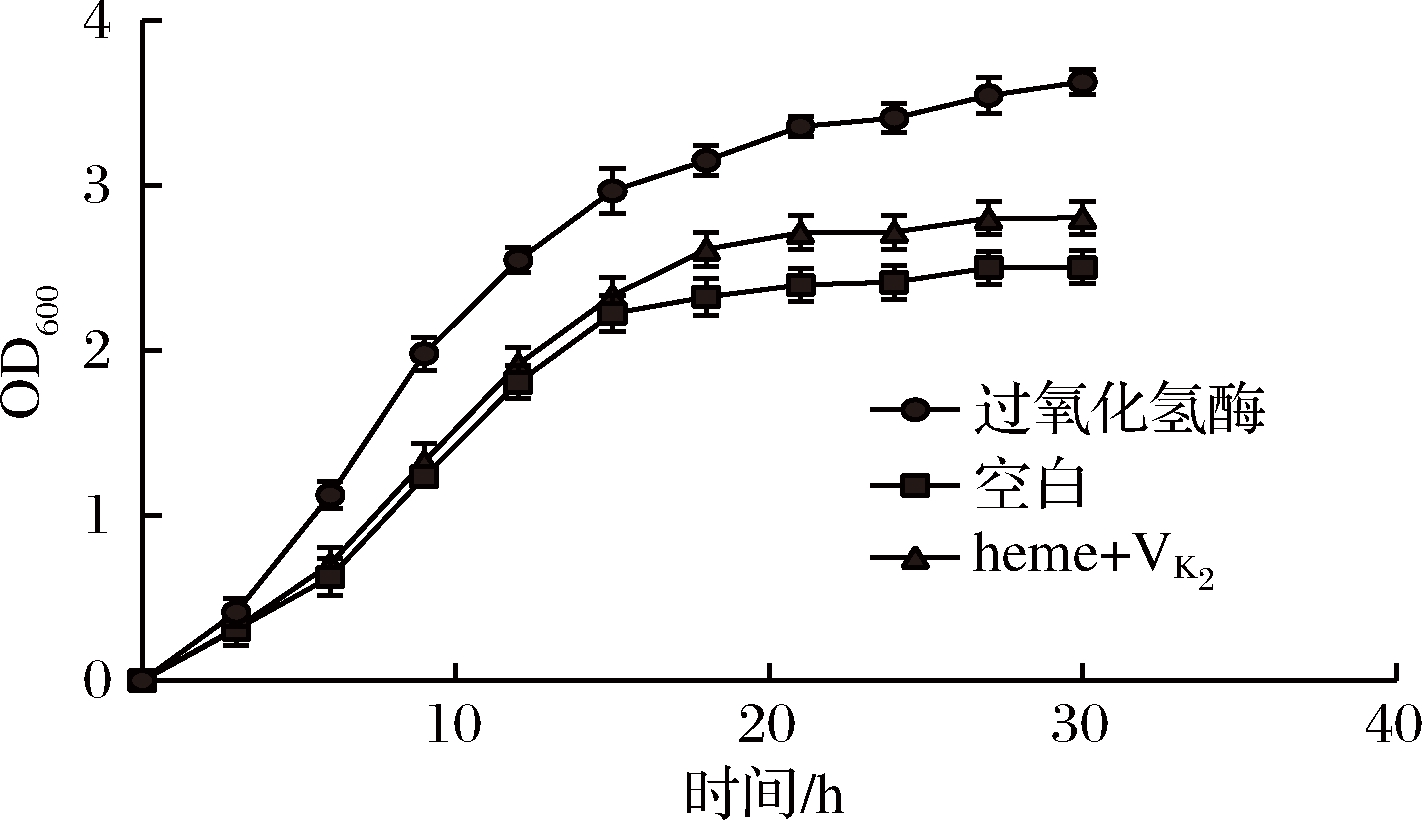
图8 外源及内源过氧化氢酶对菌株生物量的影响
Fig.8 Effect of exogenous and endogenous catalase on the biomass of strain
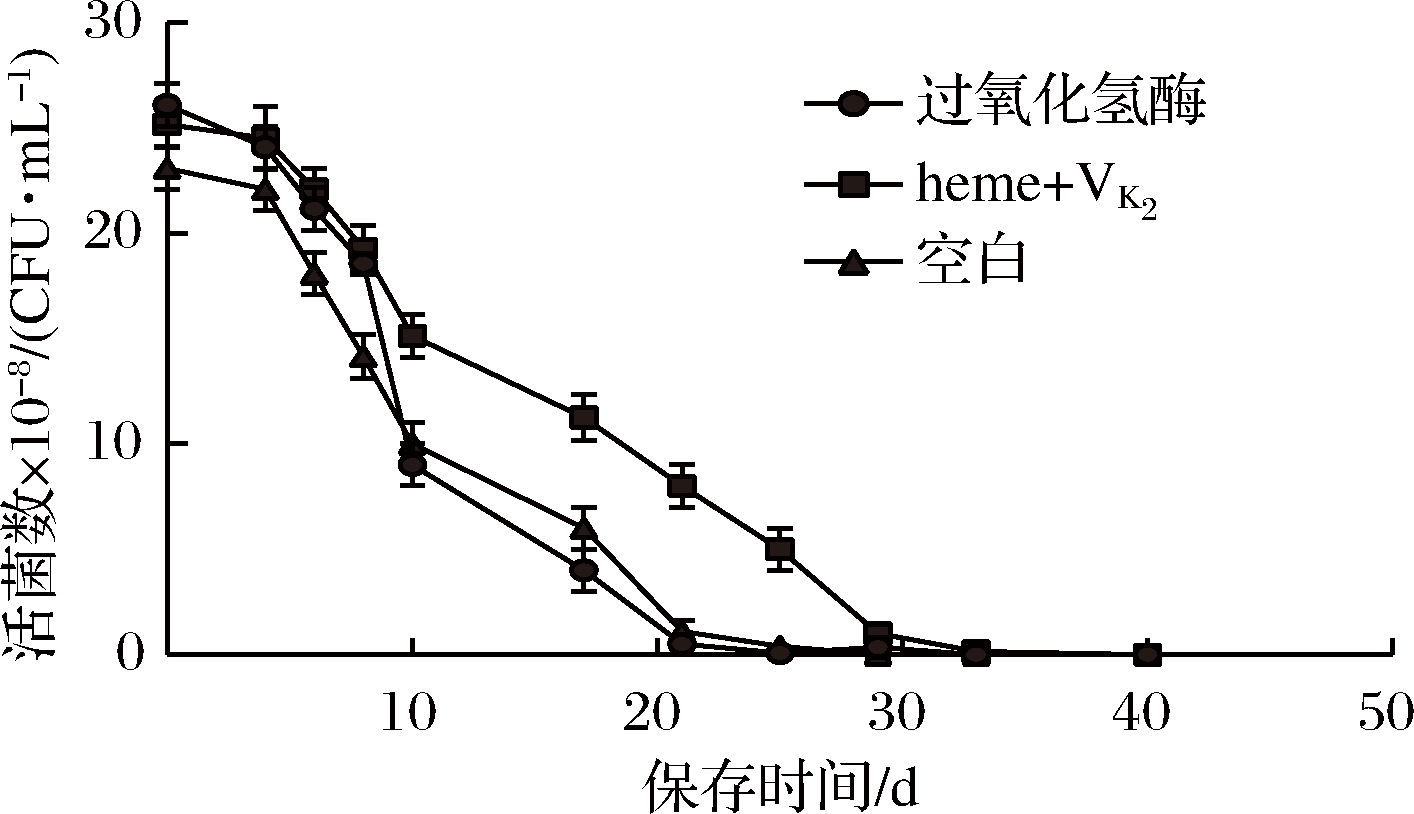
图9 外源及内源过氧化氢酶对菌株保存时间的作用
Fig.9 Effect of exogenous and endogenous catalase on the preservation time of strain
2.6.1 培养基配方优化
设计正交试验表,对培养基中碳、氮源和无机盐成分进行优化,以活菌数为判断指标,结果如表6和表7所示。碳氮源4号配方和无机盐3号配方为最佳配方。优化后的基础培养基配方为蛋白胨10 g/L、酵母膏2.5 g/L、葡萄糖20 g/L、牛肉膏15 g/L、CH3COONa 2 g/L、MgSO4 0.6 g/L、MnSO4·H2O 0.2 g/L。优化前最高活菌数为3.13×108 CFU/mL,优化后最高活菌数为1.37×109 CFU/mL,活菌数提高约 4.4倍。
表6 唾液乳杆菌GDW1994培养基碳氮源L9(43)正交试验结果
Table 6 Orthogonal test results of GDW1994 culture medium carbon nitrogen source L9(43)
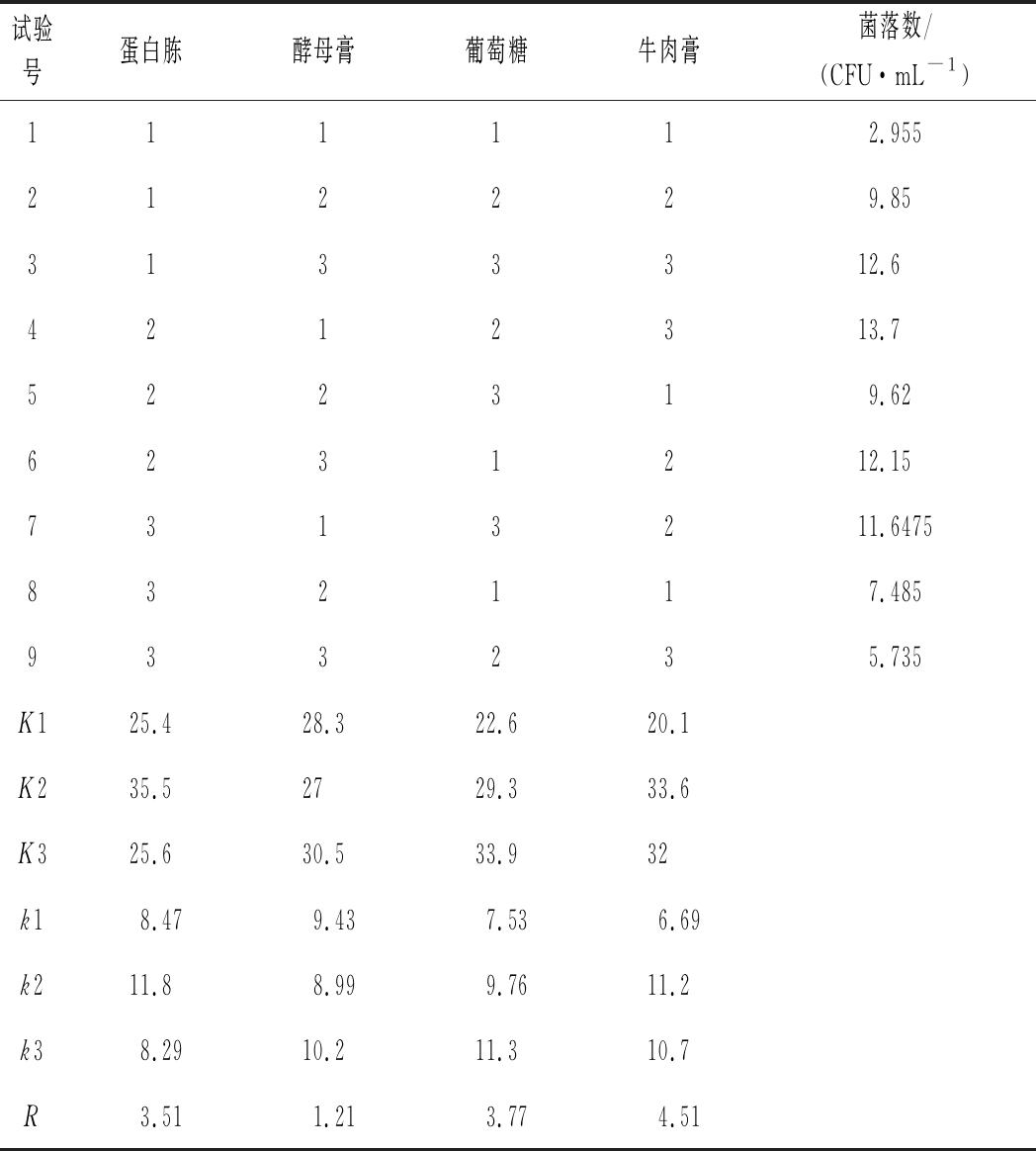
试验号蛋白胨酵母膏葡萄糖牛肉膏菌落数/(CFU·mL-1)111112.955212229.853133312.64212313.7522319.626231212.157313211.6475832117.485933235.735K125.428.322.620.1K235.52729.333.6K325.630.533.932k18.479.437.536.69k211.88.999.7611.2k38.2910.211.310.7R3.511.213.774.51
表7 唾液乳杆菌GDW1994培养基无机盐L9(43)正交试验结果
Table 7 Orthogonal results of GDW1994 culture medium inorganic salt L9(43)
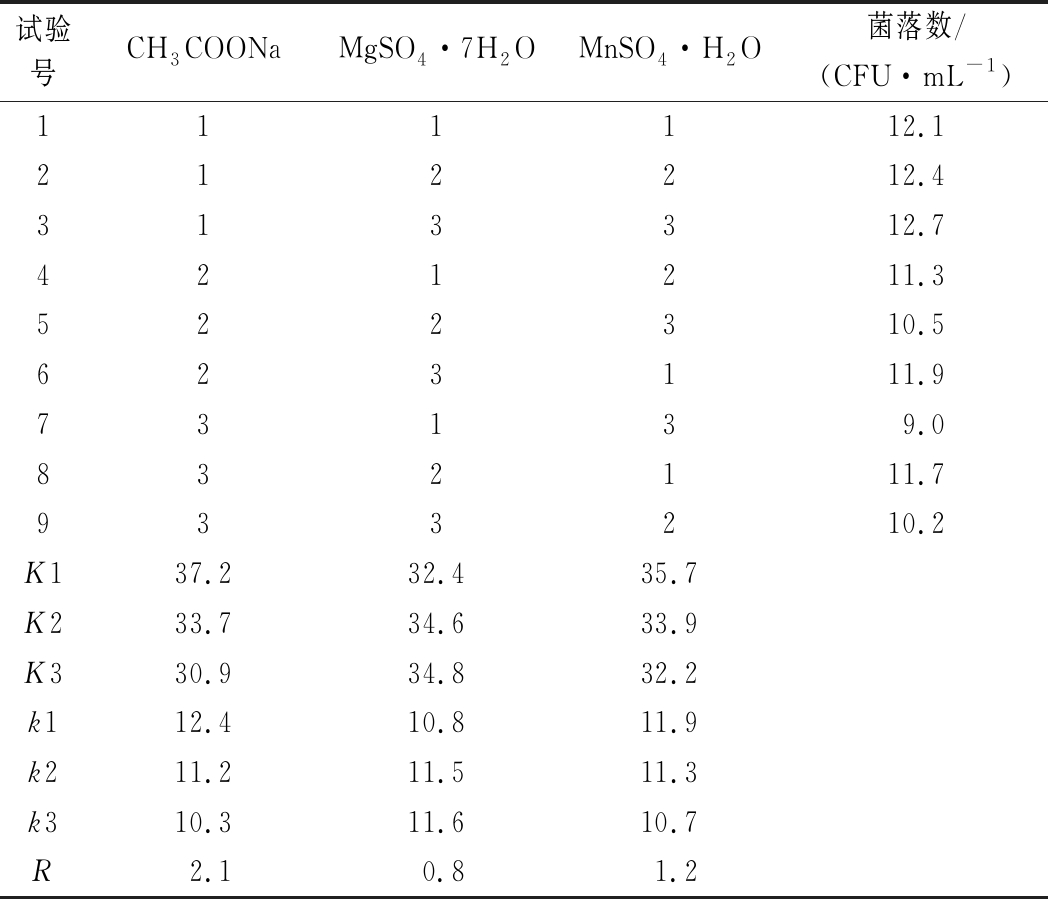
试验号CH3COONaMgSO4·7H2OMnSO4·H2O菌落数/(CFU·mL-1)111112.1212212.4313312.7421211.3522310.5623111.973139.0832111.7933210.2K137.232.435.7K233.734.633.9K330.934.832.2k112.410.811.9k211.211.511.3k310.311.610.7R2.10.81.2
2.6.2 培养基条件优化
由图10可知,随着发酵温度的上升,活菌数呈先增加后下降的趋势,菌株GDW1994最适温度为37 ℃,最高活菌数为1.142×109 CFU/mL。起始最适pH值为6.4,最高活菌数为1.175×109 CFU/mL。随接种量的增高菌株活菌数增高,接种量为5%时,活菌数增加幅度最大,最高活菌数为2.0×109 CFU/mL,考虑到过高的接种量对发酵体系物质消耗的因素以及菌体自溶带来的影响,选择接种量为4%为最适接种量。通过摇瓶培养,增加通氧量,随着转速的增加,氧对细胞的毒性增加,转速为160 r/min时,细胞活菌数最高。随着过氧化氢酶浓度的增高,菌株GDW1994活菌数依次增加,当过氧化氢酶质量浓度为30 g/L时,活菌数最高,可达2.07×109 CFU/mL,选择过氧化氢酶质量浓度30 g/L。通过单因素试验得到最适培养温度30 ℃、接种量4%、起始pH 6.4、最佳转速160 r/min及最适过氧化氢酶质量浓度30 g/L。培养条件优化后活菌数提高约1.5倍。
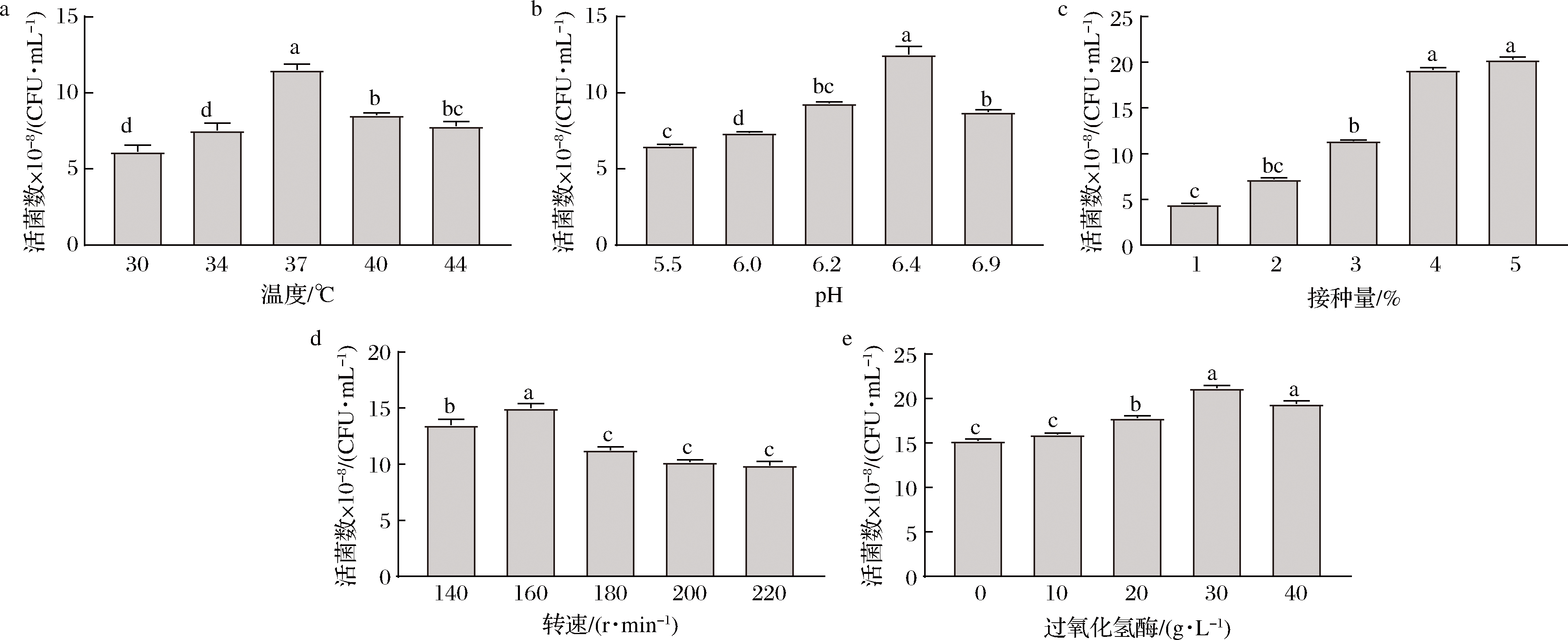
a-发酵温度;b-发酵起始pH值;c-接种量;d-发酵转速;e-过氧化氢酶
图10 培养基条件对活菌数的影响
Fig.10 Effect of medium conditions on the number of viable bacteria
注:不同字母表示差异显著(P<0.05)
自然条件下,乳酸菌大多生长在无氧或微氧环境中,但现代化发酵工业生产中,乳酸菌常常需要进行有氧增殖。影响乳酸菌生长的主要两大决定因素分别是低酸度环境和活性氧族的毒性。本研究分离的菌株对酸和抗氧胁迫有较好的耐受性。菌株GDW1994在无氧培养过程中产生的有机酸不利于菌株活力的长期保持;在有氧培养过程中,菌株积累大量H2O2虽然降低了菌株活菌数,但提高了菌株存活时间。改变其传统发酵培养方式,通入氧气和外加酶解的办法清除、分解已生成的活性氧族,探究呼吸链的完整性,提高抗氧胁迫能力,从而降低对细胞的伤害。通过对菌株GDW1994内源有氧呼吸的研究,菌株GDW1994不具备完整的对醌类物质合成能力,其呼吸链的激活需要同时外加heme和VK2,最高活菌数可达3×109 CFU/mL。对普通的MRS培养基进行优化,使唾液乳杆菌菌株GDW1994活菌数提高4.4倍。优化出唾液乳杆菌GDW1994最佳工艺参数为发酵时间15 h、发酵温度37 ℃、发酵起始pH值6.4、接种量4%、转速160 r/min、过氧化氢酶质量浓度30 g/L,在此条件下发酵液中唾液乳杆菌活菌数可达2.07×109 CFU/mL,在培养基优化后的基础上唾液乳杆菌菌株活菌数再提高约1.5倍。通过改变发酵方式,菌株GDW1994细胞生长周期延长,菌体存活性延长。对酸胁迫和氧胁迫等不良环境的抗性能力大幅度提升。活菌数明显提高,最终收获的菌体总量显著增多。从生产角度考虑,为使发酵剂菌株更为强壮,获得存活性长、菌体数目高的发酵工艺为最终目的。特殊风味产量更大往往是人们所追求的目标,乳酸菌的有氧呼吸有着十分广阔的应用前景。
[1] KHAN, UMER S. Probiotics in dairy foods: A review [J]. Nutrition &Food Science, 2014,44(1), 71-88.
[2] REN Dayong, LI Chang, QIN Yanqing, et al. Evaluation of immunomodulatory activity of two potential probiotic Lactobacillus strains by in vivo tests[J]. Anaerobe, 2015, 35: 22-27.
[3] HOJO K, MIZOGUCHI C, TAKETOMO N, et al. Distribution of salivary Lactobacillus and Bifidobacterium species in periodontal health and disease[J]. Biosci Biotechnol Biochem,2007,71(1):152-157.
[4] K LL-KL
LL-KL IS P, M
IS P, M NDAR R, LEIBUR E, et al. Oral Lactobacilli in chronic periodontitis and periodontal health: Species composition and antimicrobial activity[J]. Oral Microbiol Immunol, 2005, 20(6):354-361.
NDAR R, LEIBUR E, et al. Oral Lactobacilli in chronic periodontitis and periodontal health: Species composition and antimicrobial activity[J]. Oral Microbiol Immunol, 2005, 20(6):354-361.
[5] PEREZ-CANO F J,HONGLIN D,YAQOOD P.In vitro immunomodula-tory activity of Lactobacillus fermentum CECT5716 and Lactoba-cillus salivarius CECT5713:Two probiotic strains isolated from human breast milk[J].Immunobiology,2010,215(12):996-1 004.
[6] JIA G C,CHE N,XIA Y J,et al. Adhesion to pharyngeal epithelium and modulation of immune response: Lactobacillus salivarius AR809, a potential probiotic strain isolated from the human oral cavity[J].Journal of Dairy Science,2019,102(8):6 738-6 749.
[7] MART N V,C
N V,C RDENAS N,OCA
RDENAS N,OCA A S,et al. Rectal and vaginal eradication of streptococcus agalactiae (GBS) in pregnant women by using Lactobacillus salivarius CECT 9145, a target-specific probiotic strain[J]. Nutrients, 2019, 11(4): 810.
A S,et al. Rectal and vaginal eradication of streptococcus agalactiae (GBS) in pregnant women by using Lactobacillus salivarius CECT 9145, a target-specific probiotic strain[J]. Nutrients, 2019, 11(4): 810.
[8] LARA-VILLOSLADA F, SIERRA S, MART N R,et al. Safety assessment of two probiotic strains, Lactobacillus coryniformis CECT5711 and Lactobacillus gasseri CECT5714[J]. Appl Microbiol, 2007, 103(1):175-184.
N R,et al. Safety assessment of two probiotic strains, Lactobacillus coryniformis CECT5711 and Lactobacillus gasseri CECT5714[J]. Appl Microbiol, 2007, 103(1):175-184.
[9] ARROYO R, MART N V, MALDONADO A, et al. Treatment of infectious mastitis during lactation: Antibiotics versus oral administration of Lactobacilli isolated from breast milk [J].Clin Infect Dis. 2010, 50(12): 1 551-1 558.
N V, MALDONADO A, et al. Treatment of infectious mastitis during lactation: Antibiotics versus oral administration of Lactobacilli isolated from breast milk [J].Clin Infect Dis. 2010, 50(12): 1 551-1 558.
[10] 王刚,金星,印伯星,等.1株具有拮抗空肠弯曲杆菌作用的唾液乳杆菌的研究[J].中国食品学报,2014,14(12):6-12.
[11] 白凤翎,张柏林,蒋湘宁,等.乳酸菌有氧呼吸代谢研究进展[J].食品科学,2009,30(13):262-267.
[12] FERN NDEZ L, C
NDEZ L, C RDENAS N,ARROYO R, et al. Prevention of infectious mastitis by oral administration of Lactobacillus salivarius PS2 during late pregnancy[J].Clin Infect Dis,2016,62(5):568-573.
RDENAS N,ARROYO R, et al. Prevention of infectious mastitis by oral administration of Lactobacillus salivarius PS2 during late pregnancy[J].Clin Infect Dis,2016,62(5):568-573.
[13] LEE J Y,HAN G G, LEE H B, et al. Prohibition of antibiotic growth promoters has affected the genomic profiles of Lactobacillus salivarius inhabiting the swine intestine[J].PloS One,2017,12(10):e186 671.
[14] MACFARLANE S,DILLON J F. Microbial biofilms in the human gas-trointestinal tract[J]. J Appl Microbiol,2007,102(5):1 187-1 196.
[15] 陈晓峰,王淼.Lactobacillus salivarius FBC05 益生特性的研究[D].无锡:江南大学,2007.
[16] WANG Z,ZENG X M,MO Y M,et al. Identification and characterization of a bile salt hydrolase from Lactobacillus salivarius for development of novel alternatives to antibiotic growth promoters[J].Appl Environ Microb,2012,78(24):8 795-8 802.
[17] 倪敬轩,孙晓磊,杨英,等.苦豆籽粕-两歧双歧杆菌-唾液乳杆菌合生元微胶囊的研制[J].动物医学进展,2012,33(6):64-68.
[18] HUANG Y,WANG H Y,ZHU C H. Effect of lactic acid bacteria fermentation on antioxidation and bioactivity of hawthorn pulp[J]. IOP Conference Series: Earth and Environmental Science, 2019,267(6):1 755-1 315.
[19] 刘文文,李洋,李键,等.高抗氧化乳酸菌发酵剂的筛选及其最佳发酵条件[J].中国乳品工业,2019,47(2):4-9.
[20] 付龙云. 乳酸菌抗氧胁迫及有氧生长的研究[D].济南:山东大学,2013.
[21] GAUDU P, VIDO K, CESSELIN B, et al. Respiration capacity and consequences in Lactococcus lactis[J]. Antonie Van Leeuwenhoek, 2002, 82(1-4): 263-269.
[22] STEVENS M J A,WIERSMA A,VOS W M D V, et al. Improvement of Lactobacillus plantarum aerobic growth as directed by comprehensive transcriptome analysis[J]. Appl Environ Microbiol, 2008, 74(15): 4 776-4 778.
[23] 郭兴华,凌代文. 乳酸细菌现代研究实验技术[M].北京:中国科学出版社,2019:91-121.
[24] 李晓军,马跃英,龚虹,等.具高抗氧化能力乳酸菌菌株的筛选与鉴定[J].中国微生态学杂志,2018,30(6):663-666.
[25] 中国人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 4789.35——2016 食品国家安全标准 食品微生物学检验 乳酸菌检验[S].北京:中国标准出版社,2016.
[26] 桑跃,刘力,欧扬雯珊,等.唾液乳杆菌FDB86小试高密度发酵培养基的优化研究[J].中国奶牛,2015(15):40-43.
[27] 修立颖,韩雪冰,孙远芳,等.唾液乳杆菌发酵条件的研究[J].黑龙江畜牧兽医,2018(15):28-33.