红曲菌(Monascus)为一类小型、腐生的丝状真菌[1]。红曲起源于中国,被称为我国的“国曲”,其可信的制作历史已有上千年,是红曲菌(Monascus spp.)发酵米饭制成的紫红色曲米[2]。红曲菌可产生莫纳可林类、γ-氨基丁酸、麦角固醇及食用色素等多种有益代谢产物[3-5],被广泛用作食品着色剂、鱼肉防腐剂、醋酒发酵剂以及心血管病治疗药物等[5-7],因此开发红曲菌具有重要的经济意义。目前我国工业化生产的红曲产品主要有3类,即酿造红曲、色曲和功能性红曲,分别富含酯化酶或糖化酶、红曲色素和莫纳可林K[4,8]。以功能性红曲为原料可开发成保健品和中药,其代表产品分别为天曲牌益脂康片和血脂康胶囊[9]。
自ENDO[3]发现红曲菌可以产生具有降血脂功能的莫纳可林K(monacolin K,又名洛伐他汀)以来,国内外兴起红曲产品开发的热潮。然而,1977年WONG等[10]从红曲中分离出一种抑菌因子monascidin A,该物质在1995年被证实为一种真菌毒素——桔霉素(又叫桔青霉素,citrinin)[11],对脊椎动物具有肝肾毒性、致畸性和致癌性,故红曲菌及其发酵产品(包括红曲)的安全性受到了人们的质疑。因为桔霉素对人体的危害性极大,我国及其他一些国家和地区对红曲菌发酵产品的桔霉素含量制定了严格的限量标准[8,12]。通过技术革新,我国红曲菌液态发酵产品红曲色素中的桔霉素问题基本得到了解决,但固态发酵红曲米中的桔霉素超标问题还未解决,这既影响我国红曲产品的出口,又危害消费者的身体健康[12]。因此控制红曲菌固态发酵产品中的桔霉素含量,使其符合相关产品标准是红曲产业亟需解决的课题。可以通过优化发酵条件、基因工程改造或菌株选育来控制红曲中的桔霉素含量[5];通过传统的菌株选育已筛选到不产桔霉素可用于生产功能红曲的菌株[13-14]。
鉴于控制红曲菌发酵产品中桔霉素含量的需求很迫切,研究人员开展了红曲菌生物合成桔霉素通路的研究,试图从分子水平上对红曲菌株的产桔霉素特性进行鉴定,发现了一些红曲菌的桔霉素生物合成相关基因[15-17],并对几种红曲菌桔霉素生物合成相关基因的分布情况进行了研究[18]。由于红曲菌合成桔霉素受培养条件和遗传特性的影响,且同一株红曲菌在不同培养条件下的发酵产物中的桔霉素含量往往有很大差异[5],因此通过检测发酵产物中是否含有桔霉素的产毒红曲菌菌株的传统鉴别方法,可能不太适合产桔霉素红曲菌株的鉴定,亟需有效的检测评价方法来减少菌株筛选的工作量,进一步确认红曲菌株产桔霉素的能力。
本研究以22株红曲菌为研究对象,考察其基因组是否含有桔霉素生物合成相关基因,并检测这些菌株通过固态发酵生产的红曲中的桔霉素含量,以探讨菌株的桔霉素生物合成相关基因与采用现行桔霉素检测方法制备的红曲中桔霉素能否检出的相关性,也为评价红曲菌株产桔霉素的能力提供基本信息。
1 材料与方法
1.1 菌株与试剂
1.1.1 菌株
本实验选择11株紫色红曲菌(M. purpureus)和11株红色红曲菌(M. ruber)。其中福建省微生物研究所红曲菌种资源库10株,中国普通微生物菌种保藏管理中心4株,中国工业微生物菌种保藏管理中心6株,美国模式培养物保存库(ATCC)2株。
1.1.2 试剂
桔霉素标准品(纯度98%),上海阿拉丁生化科技股份有限公司。甲醇和乙腈(色谱纯),德国Merck公司;H3PO4(色谱纯),天津市光复精细化工研究所产品;Taq DNA聚合酶、脱氧核糖核苷酸(dNTPs)、DNA分子质量标准C,生工生物工程(上海)股份有限公司;其他常规化学试剂均为分析纯。
1.1.3 培养基配制
马铃薯葡萄糖(potato dextrose agar,PDA)培养基:去皮马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水1 000 mL,用于制备PDA斜面。种子培养基(g/L):葡萄糖50,蛋白胨15,酵母粉10,MgSO4 0.5,KH2PO4 1,NaNO3 3,用于固态发酵中红曲菌种子液的制备。米饭培养基:市售大米50 g浸泡过夜,沥干后装入500 mL三角瓶中,用于固态发酵制备红曲。以上培养基均于121 ℃灭菌30 min。
1.2 仪器和设备
Waters 2695高效液相色谱仪、2475荧光检测器,美国Waters公司;XA105型电子分析天平(双量程,d=0.01 mg/0.1 mg),梅特勒-托利多公司;GR110DR型全自动高压蒸汽灭菌锅,厦门致微仪器有限公司;Milli-Q超纯水系统,Millipore公司;S1000 PCR仪,美国Bio-Rad公司;DYY-8C稳流稳压电泳仪,北京六一生物科技有限公司。
1.3 实验方法
1.3.1 红曲菌株的ITS复核
对选取的菌株采用ITS测序和比对的方法进行菌种的复核,11株红曲菌(R3、R5~R14)被鉴定为紫色红曲菌,10株红曲菌(R1、R2、R4、R15~R17、R19~R22)被鉴定为红色红曲菌,R18被鉴定为血红红曲菌(M. sanguineus)[19]。
1.3.2 红曲的制备
将红曲菌株接种至PDA斜面培养基活化后参照文献制备种子液,将培养好的种子液按体积分数10%接种量转接于米饭培养基后进行固态发酵[14]。每个菌株固态发酵做3个平行样本。固态发酵完成后,将红曲米在60 ℃烘干,用料理机粉碎并过60目筛。
1.3.3 桔霉素含量的测定
参照GB 5009.222—2016《食品安全国家标准 食品中桔青霉素的测定》中的免疫亲和柱净化-高效液相色谱法检测红曲米中的桔霉素含量[20]。使用Waters公司的2695高效液相色谱仪及2475荧光检测器。液相色谱条件、所制定的标准曲线及检出限见文献[19]。
1.3.4 桔霉素生物合成相关基因的扩增及测序
菌株的液体培养参照文献[21],培养完成后收集菌丝体用灭菌蒸馏水清洗。获得纯度高、完整性好的DNA是进行分子生物学研究的前提条件,因此采用十六烷基三甲基溴化铵(cetyltrimethyl ammonium bromide,CTAB)法提取DNA。取约200 mg清洗过的菌丝体放入灭菌的研钵中,加入液氮迅速研磨成粉末,再加入CTAB提取缓冲液提取DNA,用异丙醇沉淀DNA后采用蒸馏水溶解。
桔霉素聚酮合酶(citrinin polyketide synthase)基因pksCT的引物为pksCT F (5’-TGATGCGACGAAGATGTTAC-3’) 和pksCT R (5’-TCTCTATGCTGCGACTGAC-3’)[13],扩增产物长度理论上为429 bp。以紫色红曲菌 (AB243687) 和橙色红曲菌(M. aurantiacus,EU309474) 的桔霉素生物合成相关基因簇作为引物设计的模板,采用Primer 5.0设计的转录激活因子ctnA的引物为ctnA F (5’-AACGGACAGGAAGAGCGTGC-3’) 和ctnA R (5’-CACACCACCGATGCCATACC-3’),扩增的片段长度理论上为1520 bp。PCR反应总体积为50 μL: 10×PCR反应缓冲液 5 μL,dNTPs(4种浓度均为2.5 mmol/L)1 μL,引物(均为10 μmol/L)各1 μL,Taq DNA聚合酶2 U,DNA模板2 μL,加灭菌蒸馏水至50 μL。PCR反应程序为:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,33个循环;72 ℃终末延伸10 min。用10 g/L琼脂糖凝胶电泳检测扩增产物,阳性样本送测序公司用凝胶回收试剂盒回收目的片段后进行双向测序。
2 结果与分析
2.1 红曲米中桔霉素含量的测定
表1为22株红曲菌通过固态发酵所制红曲米中桔霉素含量的测定结果。用11株紫色红曲菌发酵生产的红曲中均检出桔霉素,只有R8的桔霉素含量(18.37 μg/kg)最低,R14的含量为377.90 μg/kg,其他9份红曲中的桔霉素含量均高于1 000 μg/kg。在10株红色红曲菌发酵生产的红曲中只在4份红曲(R4、R15、R16和R17)中检出桔霉素,其含量为59.25~137.45 μg/kg,其他6份红曲中未检出桔霉素。血红红曲菌R18生产的红曲中未检出桔霉素。
表1 22株红曲菌所制作的红曲中桔霉素含量检测及桔霉素相关基因扩增结果
Table 1 Citrinin contents of 22 samples of red yeast rice and the amplification results of citrinin biosynthesis related genes

菌株编号中文名拉丁名聚酮合酶基因pksCT转录激活因子ctnA桔霉素/(μg·kg-1)R3紫色红曲菌M.purpureus++8470.10±287.49R5紫色红曲菌M.purpureus++1 890.71±147.26R6紫色红曲菌M.purpureus++3 216.44±401.47R7紫色红曲菌M.purpureus++1 084.30±167.92R8紫色红曲菌M.purpureus++18.37±2.69R9紫色红曲菌M.purpureus++11 064.29±1 160.37R10紫色红曲菌M.purpureus++6 470.14±786.26R11紫色红曲菌M.purpureus++7 341.21±557.52R12紫色红曲菌M.purpureus++3 813.03±183.53R13紫色红曲菌M.purpureus++1 444.48±125.92R14紫色红曲菌M.purpureus++377.90±15.65R18血红红曲菌M.sanguineus+--R1红色红曲菌M.ruber+--R2红色红曲菌M.ruber+--R4红色红曲菌M.ruber++137.45±10.53R15红色红曲菌M.ruber++74.69±11.20R16红色红曲菌M.ruber++59.25±3.56R17红色红曲菌M.ruber++98.71±9.21R19红色红曲菌M.ruber+--R20红色红曲菌M.ruber+--R21红色红曲菌M.ruber+--R22红色红曲菌M.ruber+--
注:“-”表示桔霉素生物合成相关基因扩增阴性或桔霉素未检出;“+”表示桔霉素生物合成相关基因扩增阳性。桔霉素含量数据为3个样品的平均值
2.2 红曲菌桔霉素生物合成相关基因的扩增
经琼脂糖凝胶电泳检测PCR扩增产物,用引物pksCT F和pksCT R在22株红曲菌中的扩增产物均为单一条带,其片段长度符合预期。但只在红曲米中桔霉素检测为阳性的红曲菌中用ctnA F和ctnA R扩增出单一条带,其片段长度符合预期。DNA序列分析表明本研究从10株红色红曲菌和11株紫色红曲菌中扩增的pksCT基因片段完全相同,与紫色红曲菌AB243687的序列相似性均为100%;而血红红曲菌R18与红色红曲菌和紫色红曲菌在扩增的pksCT片段有11个位点的差异,其中包括1个位点的单碱基缺失(AB243687的对应位点为9707T)(图1)。3次扩增及测序结果均显示血红红曲菌R18的pksCT基因片段在此位点有单碱基缺失(图2)。

图1 pksCT基因片段的多重排序
Fig.1 Multiple sequence alignment of pksCT fragments
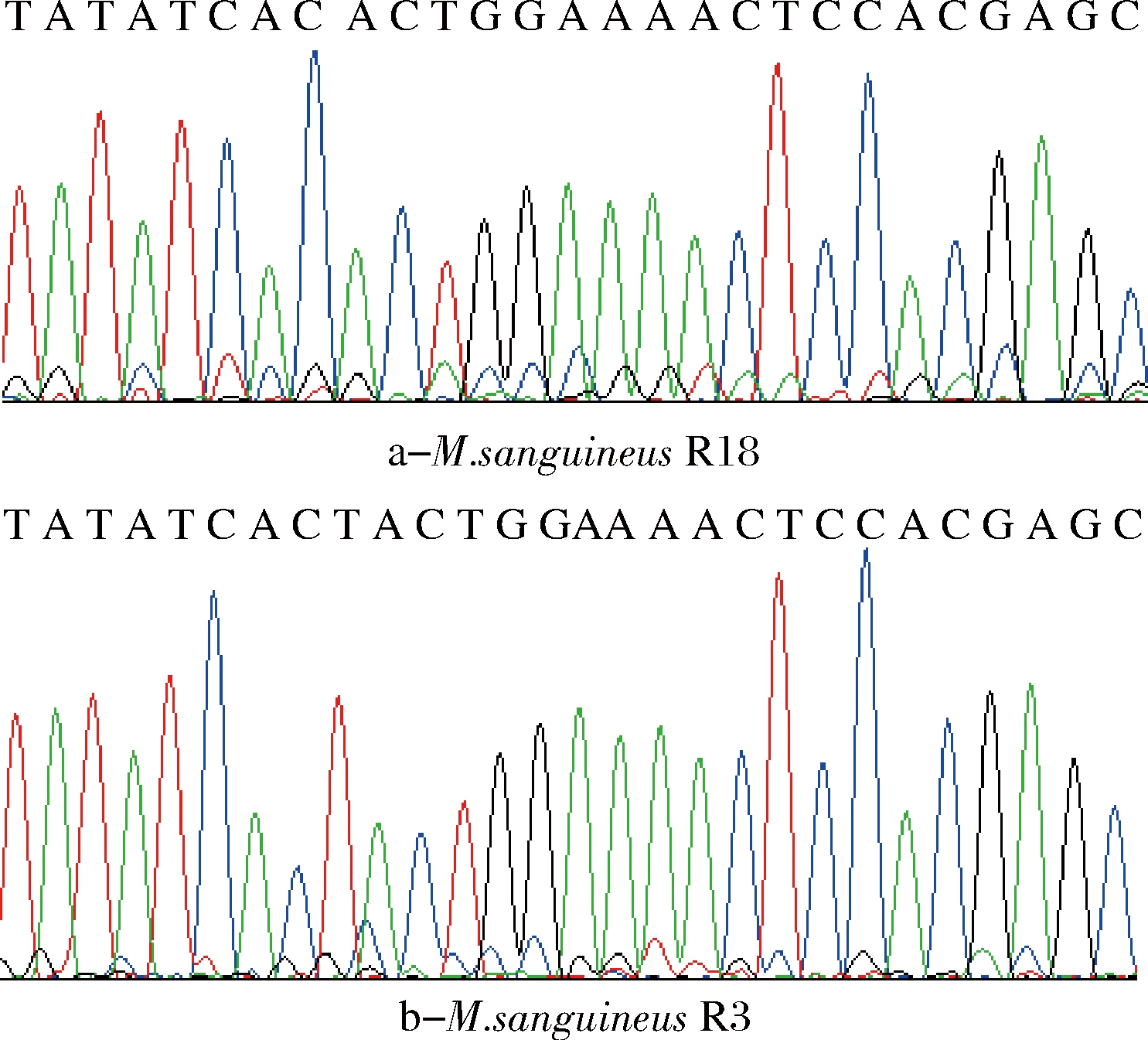
图2 pksCT 基因片段的测序图谱,显示血红红曲菌R18的pksCT基因片段的单碱基缺失位点
Fig.2 Chromatogram of the pksCT fragments. A single-base deletion was observed in the pksCT fragments of M.sanguineus R18
本研究中扩增的pksCT基因片段位于编码区,DNA序列的翻译分析表明该单碱基缺失会引起蛋白质编码基因的移码突变从而导致终止密码子提前出现及多个终止密码子,这表明血红红曲菌R18的pksCT基因不能指导合成有功能的桔霉素聚酮合酶。产桔霉素的4株红色红曲菌和11株紫色红曲菌的ctnA基因片段之间没有序列变异,与紫色红曲菌AB243687的序列相似性均为100%。
3 讨论
红曲菌可用于生产红曲(为药食两用的传统中药材)及食用色素,因此阐明红曲生产菌株的产桔霉素能力是非常重要的。桔霉素、红曲色素和莫纳可林K均属于聚酮类次生代谢产物,该类物质生物合成途径中的关键酶为聚酮合酶。近年来,研究者采用分子生物学方法对红曲菌株的桔霉素生物合成相关基因进行了研究。研究结果表明,通过同源重组破坏紫色红曲菌IFO30873的pksCT基因导致该菌株完全丧失了产桔霉素的能力[15],破坏转录激活因子的编码序列ctnA则导致该菌株pksCT的转录大幅下降及发酵液中的桔霉素含量降低至几乎检测不出的水平[16]。我国学者通过构建fosmid文库对橙色红曲菌AS3.4384的桔霉素合成相关基因簇进行了研究,其基因序列号为EU309474[17]。经DNA序列比较,紫色红曲菌 (AB243687) 和橙色红曲菌(EU309474)的桔霉素生物合成相关基因簇的DNA序列相似性为100%。据报道,利用高产桔霉素的野生型橙色红曲菌AS3.4384构建的pksCT基因缺失株PHDS26在液态发酵和固态发酵中的桔霉素产量均有不同程度下降,其中在酵母浸膏蔗糖培养基和米粉培养基的液态发酵及大米固态发酵中均降低了97%以上[22-23]。这些研究表明,pksCT和ctnA为红曲菌桔霉素生物合成的关键基因,也为从分子水平上鉴别产桔霉素的红曲菌株提供了理论基础。
研究者对一些红曲菌的桔霉素生物合成相关基因的分布情况进行了研究。在CHEN等[18]的研究中,选用的4株M. purpureus和1株M. kaoliang(为M. purpureus的同种异名[24])均具有pksCT和ctnA基因,都可产生桔霉素;而6株M. ruber均缺失pksCT和ctnA基因,发酵产物的桔霉素检测呈阴性;M.sanguineus ATCC200613 的pksCT在扩增的编码区有1个位点的单碱基缺失(AB243687的对应位点为10453C,该单碱基缺失会引起移码突变从而导致生成没有功能的桔霉素聚酮合酶),且不具有ctnA基因,发酵产物的桔霉素检测为阴性。付桂明等[25]对14株产桔霉素的红曲菌的pksCT基因的2个片段(包括翻译起始区部分序列669 bp和终止密码子区部分序列591 bp)进行了分析,发现14株红曲菌的这2个DNA片段序列之间分别具有高度同源性,均与M. purpureus(AB167465)的pksCT对应的区域序列一致。朱丽萍等[26]的研究结果表明,PCR扩增桔霉素合成相关基因为阳性的菌株,其发酵制备的红曲中桔霉素含量超过了QB/T 2847—2007《功能性红曲米(粉)的桔霉素》限量标准50 μg/kg。由于ctnA编码的转录激活因子正向调控红曲菌生物合成桔霉素[16],因此6株M. ruber所生产的红曲米中未检出桔霉素可能与这些菌株缺失ctnA有关;而M. sanguineus R18所生产的红曲米中桔霉素检测阴性可能与该菌株的pksCT无功能化有关。本研究结果也表明,所用红曲菌菌株的桔霉素合成相关基因(pksCT和ctnA)扩增结果均为阳性与菌株所制备的红曲中桔霉素检测阳性结果具有高度的一致性。
CHEN等[18]只在M. purpureus和M. kaoliang中扩增出有功能的pksCT和ctnA。本研究在产桔霉素的4株M. ruber和11株M. purpureus中均扩增出有功能的pksCT和ctnA,且与M. purpureus AB243687的pksCT和ctnA的DNA序列相似性均为100%。完整的ctnA序列包含了4个短内含子[16],本研究中扩增的ctnA序列包含了前3个内含子。一般认为内含子的进化速率远高于外显子,产桔霉素的M. ruber和M. purpureus的ctnA和pksCT之间分别没有序列变异表明产桔霉素的M. ruber和M. purpureus的桔霉素生物合成相关基因ctnA和pksCT高度保守。CHEN等[18]在其所用的M. ruber菌株中均未扩增出pksCT和ctnA,而本研究中所有M. ruber菌株(桔霉素检测为阴性或阳性)均扩增出pksCT,但只在产桔霉素的M. ruber菌株中扩增出ctnA,这表明M. ruber的pksCT和ctnA基因存在与否具有多样性。M. sanguineus ATCC200613 的pksCT 基因的单碱基缺失位点对应AB243687的位点为10453C,本研究中新发现的M. sanguineus R18的单碱基缺失位点对应AB243687的位点为9707T,这表明M. sanguineus的pksCT在多个位点有碱基缺失。由于红曲菌合成桔霉素受培养条件和遗传特性的影响[5],且红曲中桔霉素的检测结果受所用检测方法和仪器灵敏度的影响,因此桔霉素生物合成相关基因pksCT和ctnA基因的扩增可作为筛选低产甚或不产桔霉素红曲菌株的补充方法,以确认低产或不产桔霉素红曲菌株的基因特性。该方法简单、快速,可节约检测时间和检测成本。
[1] 李钟庆,郭芳.红曲菌的形态与分类学[M].北京:中国轻工业出版社,2003.
LI Z Q,GUO F.Morphology and taxonomy of Monascus[M].Beijing:China Light Industry Press,2003.
[2] 林风, 吴丽云.李慧.红曲生产菌种选择管理中的问题与思考[J].中药材,2018,41(2):490-496.
LIN F,WU L Y,LI H.The questions and considerations on the Monascus species selection in the production of red yeast rice[J].Journal of Chinese Medicinal Materials,2018,41(2):490-496.
[3] ENDO A.Monacolin K,a new hypocholesterolemic agent produced by a Monascus species[J].J Antibiot (Tokyo),1979,32(8):852-854.
[4] 何坤, 周有祥,邵彦春,等.不同红曲菌株产麦角固醇、色素及桔霉素的比较分析[J].中国农学通报,2019,35(3):51-57.
HE K,ZHOU Y X,SHAO Y C,et al.A comparative analysis of the abilities to produce ergosterol.pigment and citrinin by different Monascus strains[J].Chinese Agricultural Science Bulletin,2019,35(3):51-57.
[5] CHEN W,HE Y,ZHOU Y,et al.Edible filamentous fungi from the species Monascus:Early traditional fermentations.modern molecular biology and future genomics[J].Compr Rev Food Sci Food Saf,2015,14(5):555-567.
[6] YANG Y,LIU B,DU X,et al.Complete genome sequence and transcriptomics analyses reveal pigment biosynthesis and regulatory mechanisms in an industrial strain.Monascus purpureus YY-1[J].Scientific Reports,2015,5(1):1 207-1 217.
[7] LIU Z,WANG Z,LV X,et al.Comparison study of the volatile profiles and microbial communities of Wuyi Qu and Gutian Qu.two major types of traditional fermentation starters of Hong Qu glutinous rice wine[J].Food Microbiol,2018,69:105-115.
[8] 侯雅琦, 刘姣,赵明明,等.红曲产品相关标准的分析研究[J].中国酿造,2020,39(2):1-6.
HOU Y Q.LIU J.ZHAO M M.et al.Analysis of the related standards about Monascus products[J].China Brewing,2020,39(2):1-6.
[9] 傅金泉. 浅谈发展我国红曲业的几个问题[J].中国食品添加剂,2007(z1):89-91.
FU J Q.Development on Hongqu in China[J].China Food Additives,2007(z1):89-91.
[10] WONG H C,BAU Y S.Pigmentation and antibacterial activity of fast neutron-and X-ray-induced strains of Monascus purpureus went[J].Plant Physiol,1977,60(4):578-581.
[11] BLANC P J,LAUSSAC J P,LE BARS J,et al.Characterization of monascidin A from Monascus as citrinin[J].Int J Food Microbiol,1995,27(2):201-213.
[12] 李贞景, 薛意斌,刘妍,等.红曲菌中桔霉素的控制策略及研究进展[J].食品科学,2018,39(17):263-268.
LI Z J,XUE Y B,LIU Y,et al.Recent progress on control strategies against citrinin in Monascus spp.[J].Food Science,2018,39(17):263-268.
[13] FENG Y,CHEN W,CHEN F.A Monascus pilosus MS-1 strain with high-yield monacolin K but no citrinin[J].Food Sci Biotechnol,2016,25(4):1 115-1 122.
[14] 刘颖, 林风,郑军荣,等.低桔霉素且产Monacolin K红曲菌株的筛选与鉴定[J].福建农林大学学报(自然科学版),2015,44(5):456-461.
LIU Y,LIN F,ZHENG J R,et al.Screening and identification of Monacolin K-production Monascus with low citrinin[J].Journal of Fujian Agriculture and Forestry University (Natural Science Edition),2015,44(5):456-461.
[15] SHIMIZU T,KINOSHITA H,ISHIHARA S,et al.Polyketide synthase gene responsible for citrinin biosynthesis in Monascus purpureus[J].Appl Environ Microb,2005,71(7):3 453-3 457.
[16] SHIMIZU T,KINOSHITA H,NIHIRA T.Identification and in vivo functional analysis by gene disruption of ctnA,an activator gene involved in citrinin biosynthesis in Monascus purpureus[J].Appl Environ Microb,2007,73(16):5 097-5 103.
[17] LI Y,XU Y,HUANG Z.Isolation and characterization of the citrinin biosynthetic gene cluster from Monascus aurantiacus[J].Biotechnol Lett,2012,34(1):131-136.
[18] CHEN Y P,TSENG C P,CHIEN I L,et al.Exploring the distribution of citrinin biosynthesis related genes among Monascus species[J].J Agric Food Chem,2008,56(24):11 767-11 772.
[19] 李志强, 刘颖,林风,等.两种红曲菌固态发酵产莫纳可林K和桔霉素的比较[J].食品与发酵工业,2020,46(17):94-98.
LI Z Q,LIU Y,LIN F,et al.Comparison of monacolin K and citrinin production by two Monascus species in red yeast rice[J].Food and Fermentation Industries,2020,46(17):94-98.
[20] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局,GB 5009,222—2016 食品安全国家标准食品中桔青霉素的测定[S].北京:中国标准出版社,2016.
National Health and Family Planning Commission of the People’s Republic of China.China Food and Drug Adminnistration,GB 5009,222—2016 Chinese national standards for determination of citrinin in food[S].Beijing:China Standards Press,2016.
[21] 李志强, 刘颖,林风,等.福建古田红曲生产用红曲霉菌主要种类的鉴别[J].食品与发酵工业,2017,43(5):64-69.
LI Z Q,LIU Y,LIN F,et al.Identification of major Monascus sp.involved in industrial production of Gutian Hongqu[J].Food and Fermentation Industries,2017,43(5):64-69.
[22] FU G,XU Y,LI Y,et al.Construction of a replacement vector to disrupt pksCT gene for the mycotoxin citrinin biosynthesis in Monascus aurantiacus and maintain food red pigment production[J].Asia Pac J Clin Nutr,2007, 16 (S1):137-142.
[23] 张淑云. 红曲菌pksCT基因缺失株色素和桔霉素的变化及两种新的橙色素结构鉴定[D].南昌:南昌大学,2014.
ZHANG S Y.The changes of pigments and citrinin of pksCT-disrupted strain and structural identification of two new orange pigments[D].Nanchang:Nanchang University,2014.
[24] HAWKSWORTH D L,PITT J I.A new taxonomy for Monascus species based on cultural and microscopical characters[J].Australian Journal of Botany,1983,31(1):51-61.
[25] 付桂明, 许杨,李燕萍,等.产毒红曲菌中生物合成桔霉素基因—pksCT基因的保守性分析[J].食品科学,2008,29(3):359-363.
FU G M,XU Y,LI Y P,et al.Analyzing conservativeness of pksCT gene for citrinin biosynthesis from citrinin-producing Monascus spp.[J].Food Science,2008,29(3):359-363.
[26] 朱丽萍, 冯鎏,黄艳春,等.以合成桔霉素的关键基因为靶标的PCR检测方法与UPLC法检测红曲中桔霉素含量的一致性分析[J].食品工业科技,2019,40(7):138-143.
ZHU L P,FENG L,HUANG Y C,et al.Consistency analysis between PCR detection targeting key genes responsible for citrinin biosynthesis and citrinin content of Hongqu detected by UPLC[J].Science and Technology of Food Industry,2019,40(7):138-143.