黑果腺肋花楸 (Aronia melanocarpa (Michx.) Elliott),俗称黑樱莓,蔷薇科 (Rosaceae) 腺肋花楸属 (Aronia),原产于北美[1],20世纪90年代引入中国种植。其果实中含有丰富的多酚和花青素[2],其中的多酚具有良好的抗氧化作用,对肥胖症、糖尿病和心血管疾病(如高血脂、高血压等)等具有有益作用[3-4]。
目前关于黑果腺肋花楸果酒的研究主要包括酿造工艺[5-7]、风味物质[8]、抗氧化活性[9]等方面。而关于黑果腺肋花楸的抗氧化作用,国内外已展开较多研究,但大多集中在果实及果汁中。如KOBUS等人[10]和徐福成等人[11]对黑果腺肋花楸抗氧化性研究中都发现果汁的DPPH自由基清除能力高达60%~90%;MENG等人[12]对辽宁地区黑果腺肋花楸中花色苷抗氧化性的研究中发现花色苷的ABTS总抗氧化能力和FRAP还原铁能力强于维生素C;黄佳双[13]在黑果腺肋花楸多酚含量和抗氧化性的研究中发现果实的![]() 清除率高达67.14%。目前,关于黑果腺肋花楸果酒陈酿过程中抗氧化性及单体酚变化的相关研究还未见报道。
清除率高达67.14%。目前,关于黑果腺肋花楸果酒陈酿过程中抗氧化性及单体酚变化的相关研究还未见报道。
本研究主要通过对黑果腺肋花楸酒在不同容器陈酿过程中总酚、总花色苷、单体酚以及3种不同抗氧化指标(ABTS、DPPH、FRAP)的变化进行测定,分析不同陈酿容器和陈酿时间对黑果腺肋花楸果酒抗氧化性的影响。本研究不仅为黑果腺肋花楸酒陈酿过程中抗氧化变化及潜在的有益健康作用提供参考,同时对酒的陈酿方式提供了选择依据。
1 材料与方法
1.1 实验材料
1.1.1 材料与试剂
黑果腺肋花楸(A.melanocarpa (Michx.) Elliott)果实(产自长白山);3 L中国橡木桶(蒙古栎(Q.mongolica),中度烘烤,东佳兄弟橡木桶有限公司);3 L法国橡木桶(法国无柄橡(Quercus petraea),中度烘烤,法国维卡项目公司);3 L不锈钢罐,曲阜市恒通酒容器有限公司;D254酵母,法国Lallemand公司;果胶酶EX-V,法国Laffort公司;白砂糖(市售);福林酚(Folin-Phenol)试剂,美国Sigma-Aldrich公司;绿原酸、原儿茶酸、咖啡酸、没食子酸、表儿茶素、p-香豆酸、鞣花酸、芦丁(色谱级,纯度>95%),美国Sigma-Aldrich公司;1,1-二苯基-2-苦基肼自由基(1,1-diphenyl-2-picrylhydrazyl,DPPH)(Sigma-Aldrich公司);96孔板(麦斯诺有限公司);甲醇(色谱纯,上海安谱科学仪器公司);氯化钾醋酸钠葡萄糖、盐酸、3,5-二硝基水杨酸、酒石酸钾钠、苯酚、无水亚硫酸钠等试剂(国药集团化学试剂有限公司);总抗氧化能力(3-ethylbenzothiazoline-6-sulfonic acid,ABTS)测定试剂盒、铁还原抗氧化能力(ferric reducing/antioxidant power,FRAP)试剂盒(上海哈灵生物有限公司)。
1.1.2 主要仪器与设备
超声波清洗器,宁波新芝生物科技股份有限公司;FE20实验室pH计,梅特勒-托利多仪器有限公司;Avanti J-E高速离心机,BeckMAN公司;旋转蒸发仪,瑞士BUCHI公司;DK-S24型恒温水浴锅,上海森信实验仪器有限公司;酶标仪,美国Thermoscientific公司;FA1004天平,HANGPING公司;WFZ UV-2802H型紫外可见分光光度计,尤尼柯仪器有限公司;Milli-Q纯水仪,美国Millipore公司;ACQUITY UPLC H-Class 超高效液相色谱仪、ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm, 1.7 μm), 美国Waters公司。
1.2 实验方法
1.2.1 果酒的发酵及陈酿工艺
黑果腺肋花楸果实破碎后,按照质量比2∶1加水稀释,加入60 mg/L SO2, 12 h后添加0.2%的果胶酶,放置3 h,添加蔗糖将含糖量调整为226.4 g/L,按照2%的比例接入活化好的酵母,27 ℃控温发酵。发酵结束将皮渣分离,将SO2的质量浓度调整至80 mg/L获得原酒。将原酒分别置于不锈钢罐、中国橡木桶和法国橡木桶中,20 ℃恒温避光陈酿,陈酿的第0、10、20、30、60、90、180、270天取样,于-20 ℃保存备用。
1.2.2 基本理化指标的测定
总糖、总酸、酒精度按照国标GB/T15 038—2006测定,pH利用pH计测定。
色度和色调参照CHIRA等[14]的方法,先将酒样稀释10倍再利用分光光度计进行测定。
色度=A420+A520+A620
(1)
色调![]()
(2)
1.2.3 总酚的测定
采用福林酚法。用蒸馏水将酒样稀释50倍,取0.5 mL样品于试管中,加入1 mL福林酚试剂、3 mL 10% Na2CO3溶液,混合均匀于37 ℃避光反应40 min,在760 nm的波长下测定吸光值。以没食子酸作为标准品绘制标准曲线,总酚含量以没食子酸当量表示(mg/L)。
1.2.4 总花色苷的测定
采用pH示差法。取0.1 mL酒样于试管中,分别加入pH=1.0(KCl-HCl)缓冲液和pH=4.5(CH3COONa)的缓冲溶液,定容至5 mL,摇匀,避光稳定15~20 min,分别于520和700 nm下测定吸光值,在30 min之内完成测定。总花色苷按公式(2)计算:
ΔA=(A250-A700)pH 1.0-(A520-A700)pH 4.5
(3)
ω(花色苷)![]()
(4)
式中:ω,样品中花色苷质量浓度,mg/L;n,稀释倍数;MW,矢车菊素-3-葡萄糖苷(Cy-3-Glu)的相对分子质量,449.2;ε,矢车菊素-3-葡萄糖苷的消光系数,26 900;l,液层的厚度,cm。
1.2.5 单体酚的测定
采用ACQUITY UPLC BEH C18 (100 mm×2.1 mm,1.7 μm)色谱柱,流速0.3 mL/min,进样量1 μL,以外标法定量。洗脱程序参照课题组前期已建立的方法[15]。酒样用0.45 μm的有机相滤膜过滤后直接进样。
1.2.6 ABTS自由基清除能力测定
按照ABTS试剂盒标注方法进行测定。
1.2.7 FRAP还原铁能力测定
按照FRAP试剂盒标注方法进行测定。
1.2.8 DPPH自由基清除能力测定
DPPH甲醇溶液:12.5 mg DPPH溶于甲醇,定容至100 mL后稀释5倍得到2 mmol/L的DPPH-甲醇溶液。
参照唐柯等[16]的方法稍有修改。将0.1 mL酒样添加到3.9 mL DPPH-甲醇溶液中,涡旋振荡,在室温下于黑暗中静置30 min,在516 nm下测定吸光度,空白对照用10%的甲醇代替样品,结果表示为DPPH(%)。DPPH自由基清除率按公式(5)计算:
DPPH自由基清除率![]()
(5)
式中:Ai,空白对照在516 nm下的吸光度,nm;Aj,酒样在516 nm下的吸光度,nm。
1.3 数据处理
每组数据重复3次取平均值,用平均值±标准偏差(mean ± SD)表示,使用IBM SPSS Statistics 24软件对数据进行统计分析,并使用Origin 8.5软件绘图。
2 结果与分析
2.1 基本理化指标的变化
如表1所示,陈酿后3组酒样的总糖、pH、总酸、色度和色调与原酒相比存在显著差异,主要是在陈酿期间酒样发生了一系列反应。橡木桶的酒样总酸含量显著高于原酒和不锈钢组,同时pH降低,这是因为橡木桶陈酿过程中浸出物含有挥发酸类物质使酒样总酸含量升高[17]。橡木桶内酒样酒精度显著降低的主要原因是:陈酿过程中少量酒精会通过橡木桶桶隙蒸发;陈酿过程中酒精与一些酸类物质结合生成了酯类物质。色度和色调是评价果酒颜色的重要指标,2个橡木桶组之间的差异不显著,但色度比对照组和原酒组显著降低;3组酒样的色调都比原酒组显著升高。
表1 黑果腺肋花楸酒基本理化指标的变化
Table 1 Change of basic physical and chemical indexes of A.melanocarpa wine

样品总糖/(g·L-1)酒精度/%(vol)pH值总酸/(g·L-1)(以酒石酸计)色度色调YJ8.48±0.13a8.80±0.16a3.76±0.03a7.04±0.14a1.01±0.01a0.79±0.02aD2706.80±0.19a8.58±0.04ab3.64±0.00b6.17±0.09b0.87±0.53b0.91±0.00bZ2706.22±0.18b8.49±0.14ab3.52±0.01c7.83±0.18c0.53±0.01c0.97±0.00cF2706.20±0.17b8.40±0.17b3.58±0.00d7.69±0.12c0.58±0.00c0.98±0.01c
注:(1)YJ表示发酵结束后未经陈酿的原酒;D270表示在不锈钢罐里陈酿了270 d的对照组;Z270表示在中国橡木桶里陈酿了270 d的酒样;F270表示在法国橡木桶里陈酿了270 d的酒样
(2)小写字母不同表示同一列之间差异显著,P<0.05
2.2 陈酿过程中活性物质的变化
2.2.1 陈酿过程中总酚的变化
不同陈酿容器的黑果腺肋花楸果酒陈酿过程中总酚含量变化如图1所示,原酒总酚含量是2 916.74 mg/L。在陈酿期间3组样品的总酚含量都逐渐降低,可能是因为在陈酿期间酚类物质发生了氧化反应或单宁类物质发生缩合反应产生沉淀[18]。但是在陈酿270 d 后,不锈钢罐组总酚含量显著高于2个橡木桶组,具体为不锈钢罐组比初始降低了14.53%,中国橡木桶组降低了27.67%,法国橡木桶降低了25.89%。
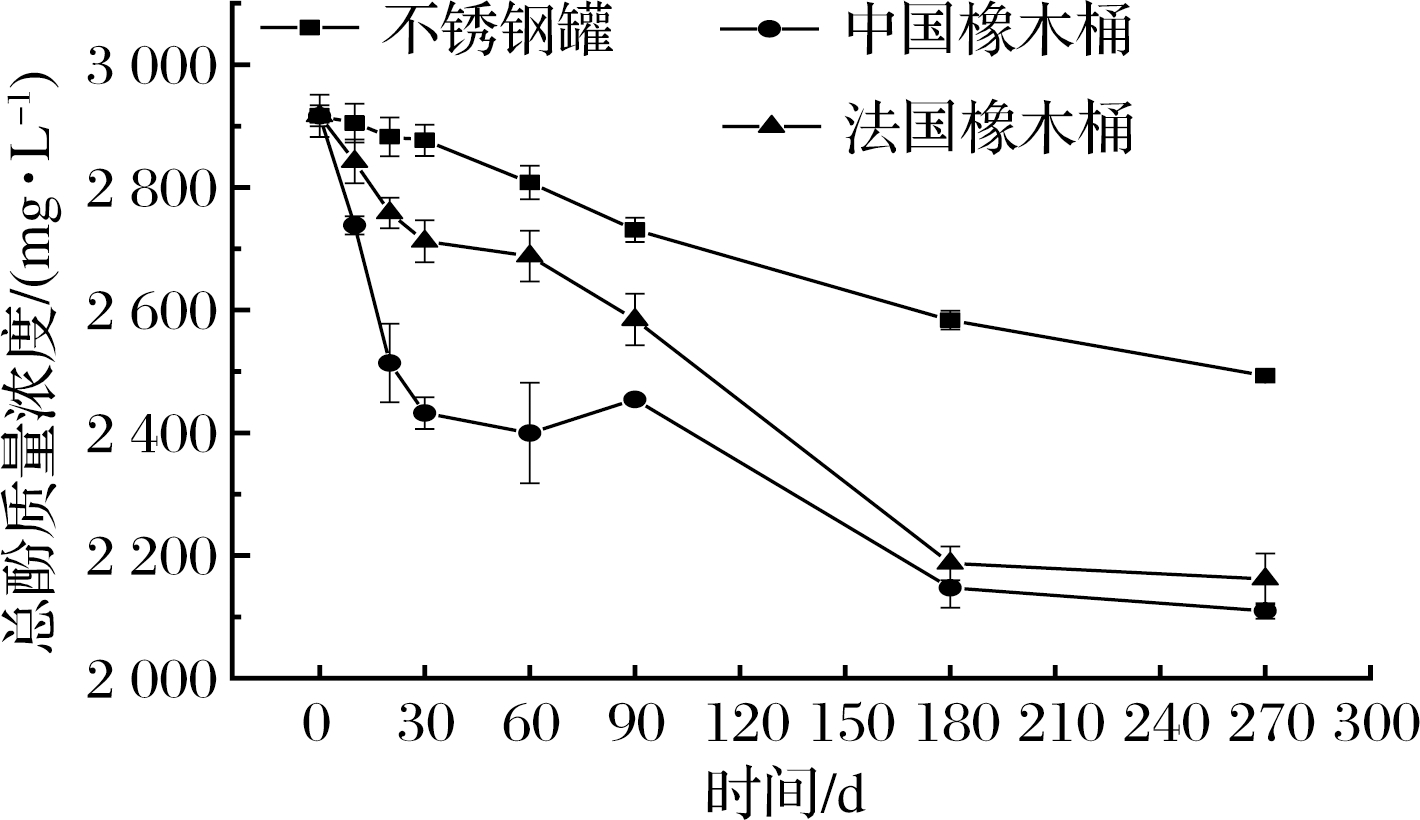
图1 黑果腺肋花楸果酒陈酿过程中总酚含量变化
Fig.1 Change of total phenolic concentration in A.melanocarpa wine
2个橡木桶组酒样在陈酿的前60 d总酚含量下降速度显著大于不锈钢罐组,可能是因为橡木桶提供了微氧的环境促进了黄烷醇和花色苷的缩合反应以及花色苷的氧化反应[19]。在陈酿的180~270 d橡木桶内总酚的浓度逐渐趋于稳定,而不锈钢罐组仍在持续下降。
2.2.2 陈酿过程中花色苷的变化
如图2所示,在0~20 d三组酒样的总花色苷质量浓度迅速降低,可能是由于新酒中含有大量的溶解氧,花色苷在氧气充足的情况下发生了一系列反应[20]。在30~60 d两个橡木桶组花色苷浓度下降速度缓慢,可能是因为橡木桶浸出物发生花色苷不参加的氧化反应消耗了部分溶解氧[21]
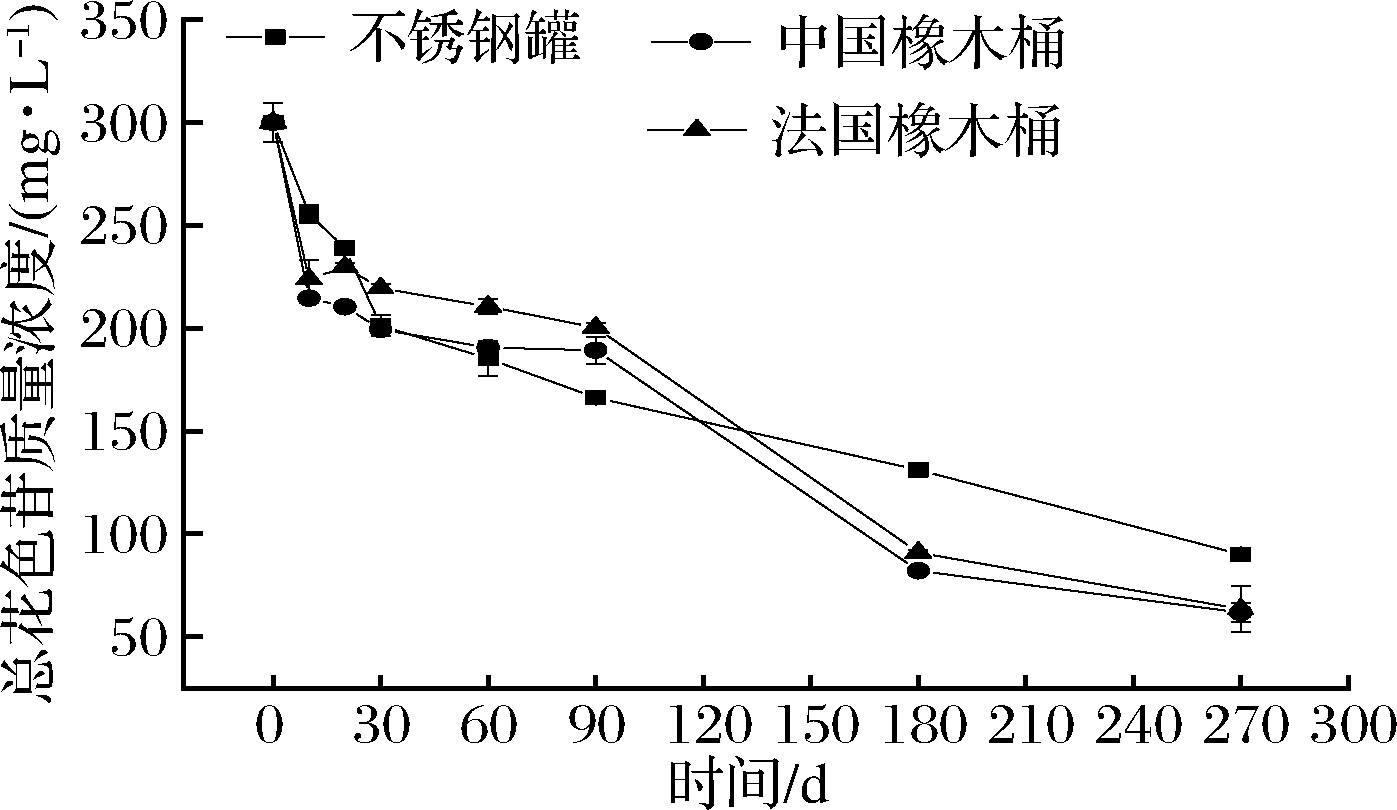
图2 黑果腺肋花楸酒总花色苷浓度变化
Fig.2 Change of total anthocyanins concentration in A.melanocarpa wine
新酒的总花色苷质量浓度是300 mg/L,陈酿270 d后,3组酒样的花色苷质量浓度都大幅度降低,分别降低了58%、71%和74%。这是由于新鲜果酒中花色苷主要是以单体的形式存在,而在陈酿过程中,单体花色苷通过与其他化合物反应形成花色苷衍生物,包括吡喃花色苷、聚合花色苷等[22]。据报道,多数花色苷聚合反应都有其他酚类物质的参加[23]。而橡木桶内花色苷降低速度比不锈钢罐组快可能是由于:酒样中部分单体花色苷被橡木桶的木材吸附[24];橡木桶提供了微氧环境加快了花色苷及其衍生物的沉淀;橡木桶浸出物在乙醛的作用下与花色苷进行了缩合反应[13],产生了沉淀。
2.2.3 陈酿过程中单体酚的变化
单体酚检测结果见表2。以不同方式陈酿,从样品中共检测出8种单体酚,其中包括6种酚酸(绿原酸、原儿茶酸、咖啡酸、没食子酸、p-香豆酸、鞣花酸),1种黄烷醇(表儿茶素)和1种黄酮醇(芦丁)。
3组酒样中的绿原酸、表儿茶素和芦丁均随着陈酿时间的延长浓度降低,在陈酿270 d,绿原酸在中国橡木桶的下降速度显著高于法国橡木桶和不锈钢罐;表儿茶素在橡木桶中下降的速度显著高于不锈钢罐,具体为在中国橡木桶中降低了54.70%、法国橡木桶中降低了85.47%、不锈钢罐中降低了10.26%;芦丁在橡木桶中下降的速度同样显著高于不锈钢罐,具体为在中国橡木桶中降低了75.64%、法国橡木桶中降低了76.77%、不锈钢罐中仅降低了63.27%。与之相反的是原儿茶酸、没食子酸和鞣花酸均随着陈酿时间的延长含量不断上升,其中原儿茶酸和没食子酸在橡木桶中上升的速度显著低于不锈钢罐。由于橡木桶内的鞣花酸主要是橡木桶浸渍的水解单宁水解生成的[25],因此,不锈钢罐组中并未检测到鞣花酸。而其他两种单体酚:咖啡酸在橡木桶中无明显变化,在不锈钢罐中升高了28.79%;p-香豆酸在中法2个橡木桶中分别升高了9.59%、9.75%,而不锈钢罐中略降低。
2.3 陈酿过程中抗氧化能力的变化
2.3.1 ABTS总抗氧化能力
如图3所示,3组酒样的ABTS自由基清除能力在陈酿的过程中显著下降。这与BEER等[26]在皮诺塔吉、赤霞珠、霞多丽和白诗南葡萄酒陈酿过程中抗氧化性持续降低的研究结论相似。不锈钢罐组降低了17.16%,中国橡木桶组降低了30.83%,法国橡木桶组降低了24.78%。2组橡木桶酒样的ABTS自由基清除能力明显比对照组的下降速度快,在陈酿270 d 时3组样品ABTS自由基清除能力大小排序:不锈钢罐组>法国橡木桶组>中国橡木桶组,这一结果与陈酿过程中总酚浓度变化结果相似。
表2 黑果腺肋花楸酒中单体酚含量的变化 单位:mg/L
Table 2 Change of free phenols of A.melanocarpa wine
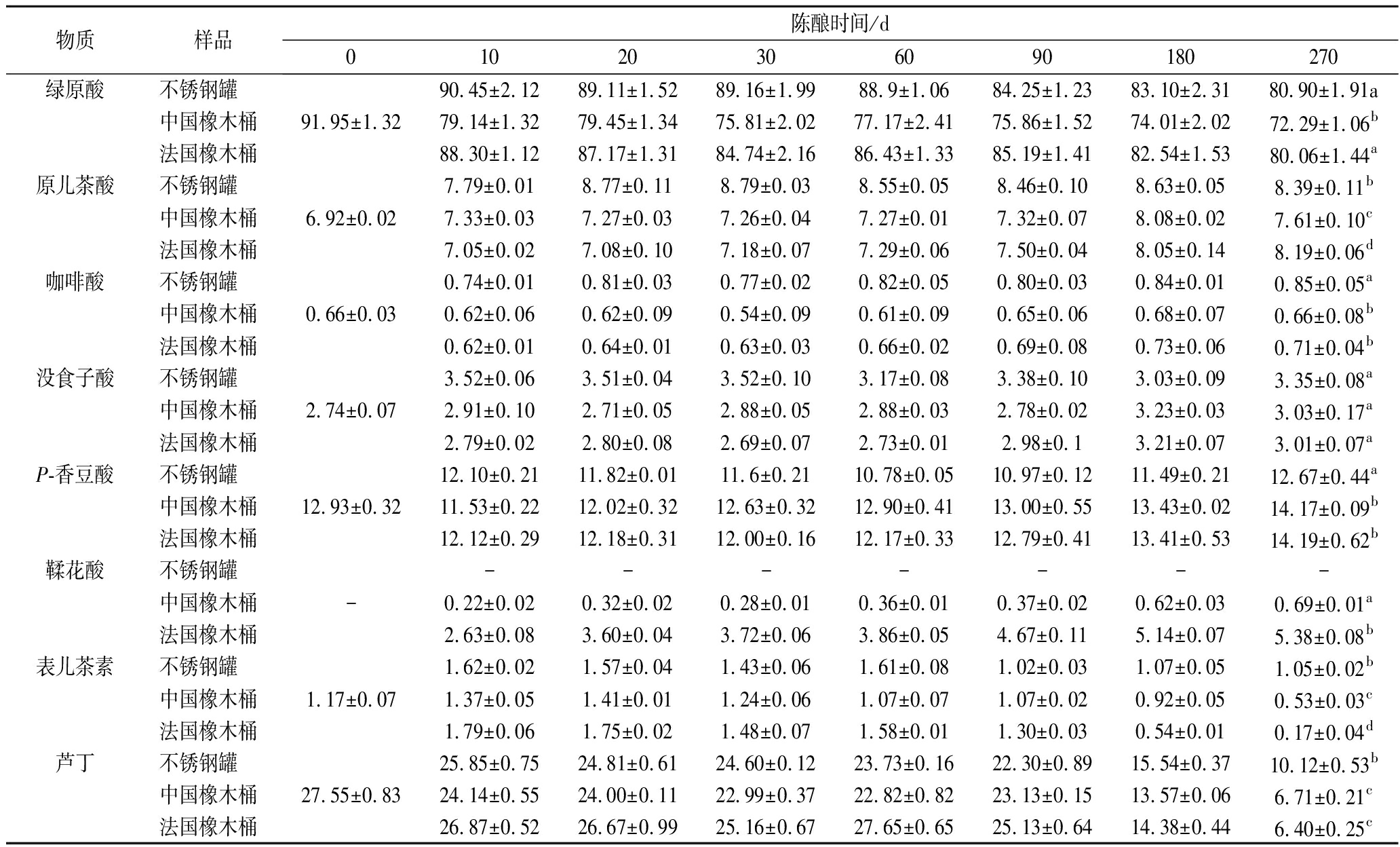
物质样品陈酿时间/d01020306090180270绿原酸不锈钢罐90.45±2.1289.11±1.5289.16±1.9988.9±1.0684.25±1.2383.10±2.3180.90±1.91a中国橡木桶91.95±1.3279.14±1.3279.45±1.3475.81±2.0277.17±2.4175.86±1.5274.01±2.0272.29±1.06b法国橡木桶88.30±1.1287.17±1.3184.74±2.1686.43±1.3385.19±1.4182.54±1.5380.06±1.44a原儿茶酸不锈钢罐7.79±0.018.77±0.118.79±0.038.55±0.058.46±0.108.63±0.058.39±0.11b中国橡木桶6.92±0.027.33±0.037.27±0.037.26±0.047.27±0.017.32±0.078.08±0.027.61±0.10c法国橡木桶7.05±0.027.08±0.107.18±0.077.29±0.067.50±0.048.05±0.148.19±0.06d咖啡酸不锈钢罐0.74±0.010.81±0.030.77±0.020.82±0.050.80±0.030.84±0.010.85±0.05a中国橡木桶0.66±0.030.62±0.060.62±0.090.54±0.090.61±0.090.65±0.060.68±0.070.66±0.08b法国橡木桶0.62±0.010.64±0.010.63±0.030.66±0.020.69±0.080.73±0.060.71±0.04b没食子酸不锈钢罐3.52±0.063.51±0.043.52±0.103.17±0.083.38±0.103.03±0.093.35±0.08a中国橡木桶2.74±0.072.91±0.102.71±0.052.88±0.052.88±0.032.78±0.023.23±0.033.03±0.17a法国橡木桶2.79±0.022.80±0.082.69±0.072.73±0.012.98±0.13.21±0.073.01±0.07aP-香豆酸不锈钢罐12.10±0.2111.82±0.0111.6±0.2110.78±0.0510.97±0.1211.49±0.2112.67±0.44a中国橡木桶12.93±0.3211.53±0.2212.02±0.3212.63±0.3212.90±0.4113.00±0.5513.43±0.0214.17±0.09b法国橡木桶12.12±0.2912.18±0.3112.00±0.1612.17±0.3312.79±0.4113.41±0.5314.19±0.62b鞣花酸不锈钢罐-------中国橡木桶-0.22±0.020.32±0.020.28±0.010.36±0.010.37±0.020.62±0.030.69±0.01a法国橡木桶2.63±0.083.60±0.043.72±0.063.86±0.054.67±0.115.14±0.075.38±0.08b表儿茶素不锈钢罐1.62±0.021.57±0.041.43±0.061.61±0.081.02±0.031.07±0.051.05±0.02b中国橡木桶1.17±0.071.37±0.051.41±0.011.24±0.061.07±0.071.07±0.020.92±0.050.53±0.03c法国橡木桶1.79±0.061.75±0.021.48±0.071.58±0.011.30±0.030.54±0.010.17±0.04d芦丁不锈钢罐25.85±0.7524.81±0.6124.60±0.1223.73±0.1622.30±0.8915.54±0.3710.12±0.53b中国橡木桶27.55±0.8324.14±0.5524.00±0.1122.99±0.3722.82±0.8223.13±0.1513.57±0.066.71±0.21c法国橡木桶26.87±0.5226.67±0.9925.16±0.6727.65±0.6525.13±0.6414.38±0.446.40±0.25c
注:陈酿270 d的样品采用方差分析,小字母不同表示同一物质3个样品之间差异显著,P<0.05
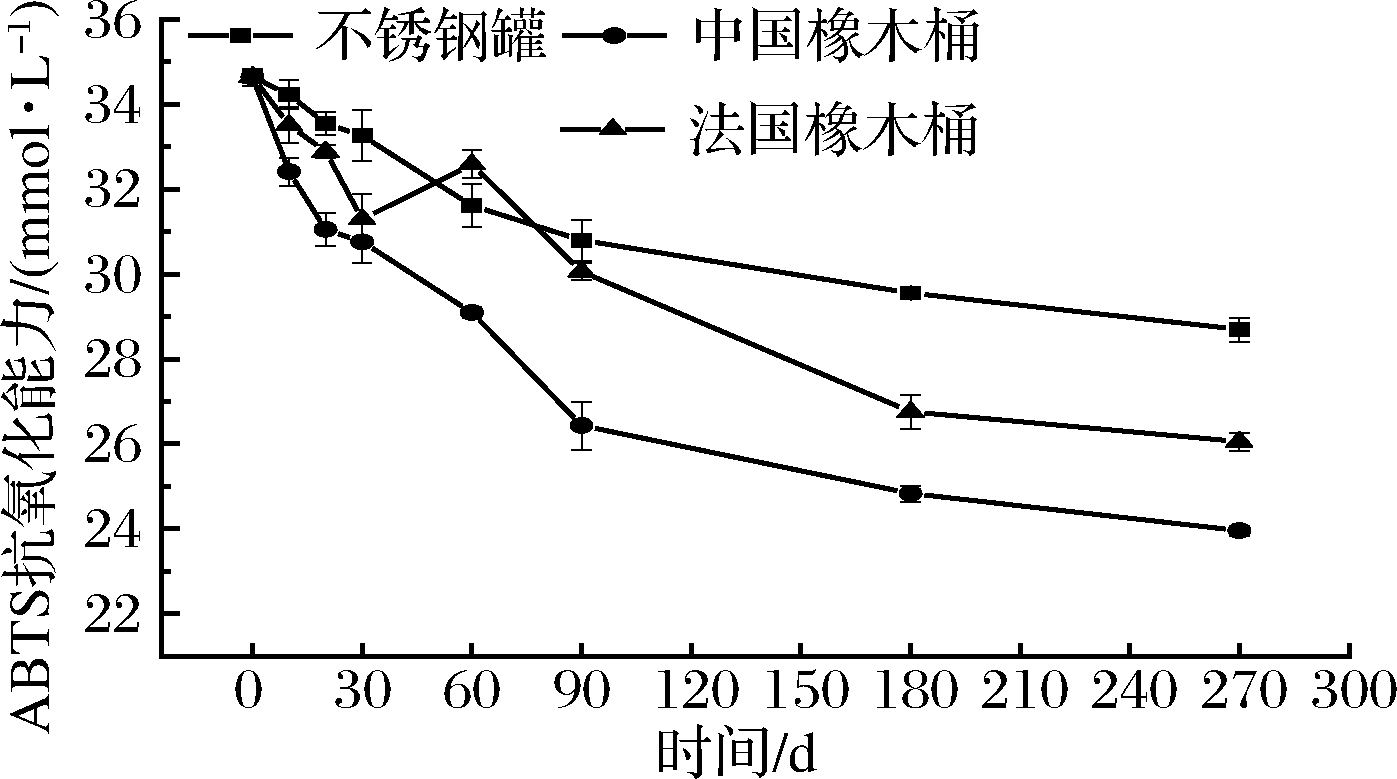
图3 黑果腺肋花楸果酒的ABTS总抗氧化能力
Fig.3 Change of ABTS antioxidant capacity in A.melanocarpa wine
2.3.2 DPPH自由基清除能力测定
如图4所示,3组酒样的DPPH自由基清除能力同样在陈酿的过程中显著下降:不锈钢罐组降低了18.31%,中国橡木桶组降低了25.35%,法国橡木桶组降低了22.54%。在0~30 d两组橡木桶DPPH自由基清除能力快速下降,而不锈钢罐组下降速度稍微缓慢一些。30~60 d两组橡木桶DPPH自由基清除能力升高可能与花色苷浓度升高有关[27]。
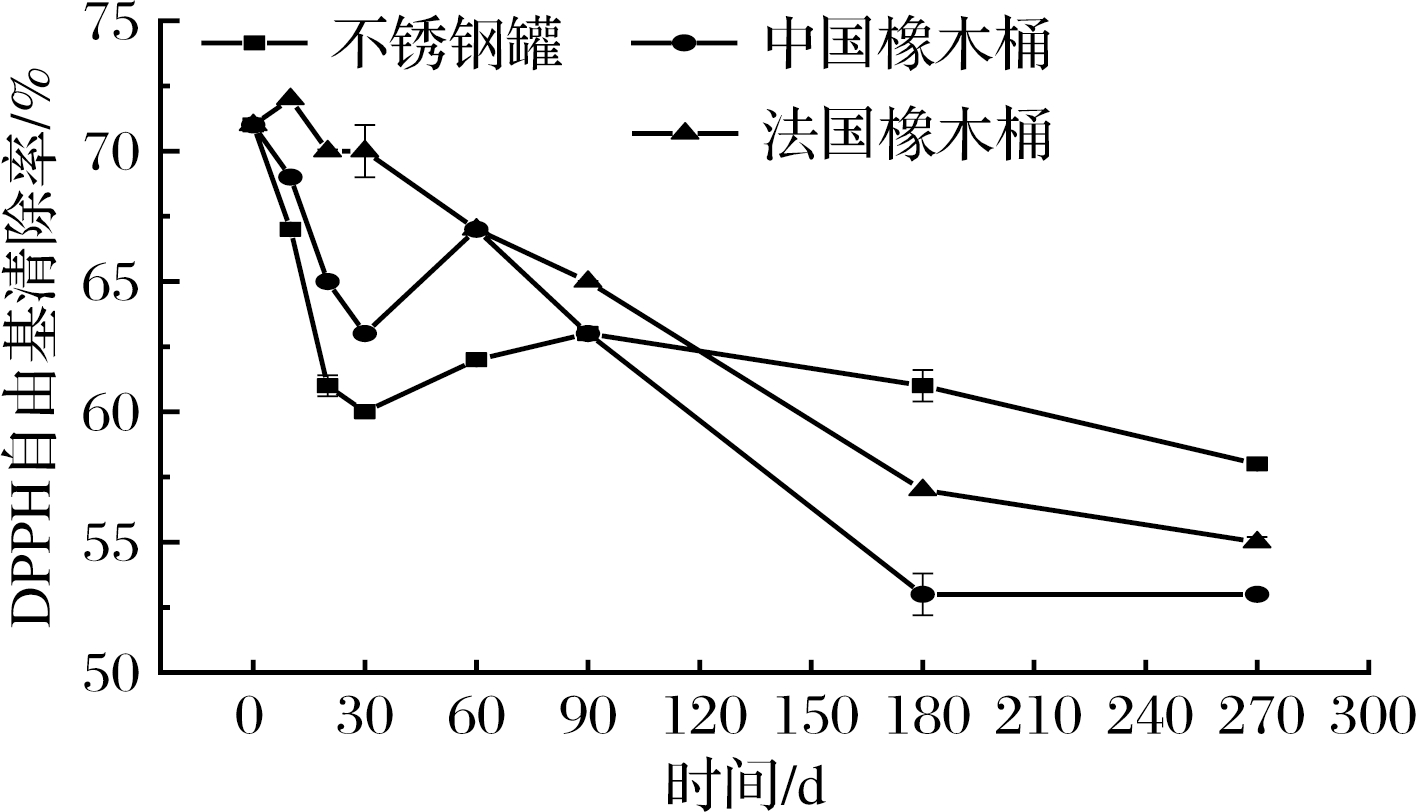
图4 黑果腺肋花楸果酒的DPPH自由基清除能力
Fig.4 Change of DPPH free radical scavenging rate in A.melanocarpa wine
2.3.3 FRAP还原铁能力测定
如图5所示,在陈酿的0~20 d三组酒样的FRAP还原铁能力快速降低:不锈钢罐组降低了60.15%;中国橡木桶组降低了74.05%;法国橡木桶组降低了52.80%。这一规律与花色苷的变化相似。据TSAI等人[28]的研究,FRAP还原铁能力与单体花青素含量密切相关。而3组样品在20 d以后随着陈酿时间的延长,FRAP还原铁能力没有太大的变化。

图5 黑果腺肋花楸果酒FRAP还原铁能力测定变化
Fig.5 Change of FRAP ability in A.melanocarpa wine
2.4 相关性分析
表3为总酚、总花色苷与3种抗氧化能力的相关性分析结果,这5个指标呈两两正相关。其中总酚与ABTS和DPPH相关性极显著,这与王婷婷等[29]在研究复合浆果酒的酚类物质和抗氧化性关系的结论一致;花色苷与ABTS、DPPH和FRAP的相关性极显著,据SUN等人[30]的报道,吡喃花青素具有很强的DPPH自由基清除能力,并且吡喃环越多,DPPH自由基清除能力越强。
表3 总酚、总花色苷与三种抗氧化能力的相关性
Table 3 Correlation between total phenol, total anthocyanin and three antioxidant capacity

指标总酚总花色苷ABTSDPPHFRAP总酚10.656∗∗0.868∗∗0.541∗∗0.319∗花色苷10.729∗∗0.705∗∗0.473∗∗ABTS10.601∗∗0.458∗DPPH10.347∗FRAP1
注:*表示相关性显著,P<0.05;**表示相关性极显著,P<0.01
3 结论
陈酿时间和陈酿容器对黑果腺肋花楸酒的3种抗氧化能力(ABTS、FRAP、DPPH)均有影响。随着陈酿时间的延长,3组酒样的抗氧化性都是降低的,而2个橡木桶组在陈酿过程中降低的速度比不锈钢罐组快,这与总酚和总花色苷含量的变化趋势相似,说明黑果腺肋花楸酒陈酿时间越长,总酚和总花色苷浓度越低,抗氧化能力越弱。由相关性分析可知,总酚、总花色苷、ABTS、FRAP、DPPH呈两两正相关,其中ABTS总抗氧化能力、DPPH自由基清除能力与总酚和总花色苷的相关性极显著(P<0.01);FRAP还原铁能力与花色苷相关性极显著(P<0.01)。陈酿时间和陈酿容器对黑果腺肋花楸酒中的单体酚含量均有影响。其中,绿原酸、表儿茶素和芦丁随着陈酿时间的延长,含量不断降低;鞣花酸、没食子酸和原儿茶酸则随着陈酿时间的延长,含量不断上升;其他2种单体酚含量变化不大。此外,在不同陈酿容器中,单体酚的变化趋势也略有不同。
本研究明确了不同陈酿容器和陈酿时间对黑果腺肋花楸酒抗氧化能力的影响,研究不仅为深入研究黑果腺肋花楸酒陈酿过程中抗氧化变化机理提供理论基础,而且对黑果腺肋花楸酒陈酿过程中调控也具有良好的实践意义。
[1] SIDOR A,DROZDZYNSKA A,GRAMZA-MICHALOWSKA A.Black chokeberry (Aronia melanocarpa) and its products as potential health-promoting factors-An overview [J].Trends in Food Science & Technology,2019,89(13):45-60.
[2] BRAND M H,CONNOLLY B A,LEVINE L H,et al.Anthocyanins,total phenolics,ORAC and moisture content of wild and cultivated dark-fruited Aronia species[J].Scientia Horticulturae,2017,2(24):332-342.
[3] RODRIGUEZ-WERNER M,WINTERHALTER P,ESATBEYOGLU T.Phenolic composition,radical scavenging activity and an approach for authentication of aronia melanocarpa berries,juice,and pomace[J].Journal of Food Science,2019,84(7):1 791-1 798.
[4] OLAS B.Berry phenolic antioxidants-implications for human health[J].Frontiers in Pharmacology,2018,9(26):1-14.
[5] 杨婧娀,王佐民,赵云财.黑果腺肋花楸白兰地[J].酿酒,2019,46(11):108-109.
YANG J S,WANG Z M,ZHAO Y C.Aronia melanocarpa brandy[J].Brewing,2019,46(11):108-109.
[6] 杨婧娀,王佐民,赵云财.黑果腺肋花楸发酵酒[J].酿酒,2020,47(1):121-123.
YANG J S,WANG Z M,ZHAO Y C.Aronia melanocarpa wine[J].Brewing,2020,47(1):121-123.
[7] 杨婧娀,王佐民,赵云财.黑果腺肋花楸果冰酒[J].酿酒,2019,46(9):110-111.
YANG J S,WANG Z M,ZHAO Y C.Aronia melanocarpa ice wine[J].Brewing,2019,46(9):110-111.
[8] 毛建利,李艳.黑果腺肋花楸酒与赤霞珠葡萄酒香气物质对比分析[J].食品科学,2019,40(22):270-276.
MAO J L,LI Y.Comparative analysis of Aroma components of black chokeberry wine and cabernet sauvignon wine[J].Food Science,2019,40(22):270-276.
[9] 徐贝贝,张赛,冯香玉,等.酶对黑果腺肋花楸酿酒过程花色苷浸出率的影响[J].吉林农业,2017(10):59-61.
XU B B,ZHANG S,FENG X,et al.Effect of enzymes on the extraction rate of anthocyanin in the wine-making process of Aronia Melanocarpa[J].Jilin Agricultural,2017(10):59-61.
[10] KOBUS Z,NADULSKI R,WILCZYNSKI K,et al.Effect of the black chokeberry (Aronia melanocarpa (Michx.) Elliott) juice acquisition method on the content of polyphenols and antioxidant activity[J].PloS One,2019,14(7):1-18.
[11] 徐福成,李静雯,玛丽娜·库尔曼.不同产地的黑果腺肋花楸抗氧化活性比较[J].中国林副特产,2018,15(4):5-8.
XU F C,LI J W,MALINA K.Comparison of antioxidant activities of Aronia melanocarpa in different habitats[J].Forest By-Product and Speciality in China,2018,15(4):5-8.
[12] MENG L,ZHU J,MAY,et al.Composition and antioxidant activity of anthocyanins from Aronia melanocarpa cultivated in Haicheng,Liaoning,China[J].Food Bioscience,2019,30(7):1-10.
[13] 陈妍竹,胡文忠,姜爱丽.黑果腺肋花楸功能作用及食品加工研究进展[J].食品工业科技,2016,37(9):397-400.
CHEN Y Z,HU W Z,JIANG A L.Food processing and functional character of Aronia melanocarpa[J].Science And Technology of Food Industry 2016,37(9):397-400.
[14] CHIRA K,JOURDES M,TEISSEDRE P L.Cabernet sauvignon red wine astringency quality control by tannin characterization and polymerization during storage[J].European Food Research & Technology,2012,234(2):253-261.
[15] TANG K,LI JM,WANG B,et al.Evaluation of nonvolatile flavor compounds in Vidal icewine from China[J].American Journal of Enology and Viticulture,2013,64(1):110-117.
[16] 唐柯,王梓萱,张伟宏,等.不同品种蓝莓酚类物质组成特征及抗氧化能力比较分析[J].食品与发酵工业,2017,43(8):103-107.
TANG K,WANG Z X,ZHANG W H,et al.Comparative analysis of phenolic content and profile,and antioxidant capacity in different blueberry varieties[J].Food and Fermentation Industries,2017,43(8):103-107.
[17] ZENG C,KANG S,ZHANG J,et al.Effect of aging time on volatile aroma compounds of apple brandy[J].Journal of Food Science and Technology,2019,37(3):76-85.
[18] BURIN V M,COSTA L L F,ROSIER J P,et al.Cabernet Sauvignon wines from two different clones,characterization and evolution during bottle ageing[J].LWT-Food Science and Technology,2011,44(9):1 931-1 938.
[19] LI S Y,DUAN C Q.Astringency,bitterness and color changes in dry red wines before and during oak barrel aging:An updated phenolic perspective review[J].Critical Reviews in Food Science and Nutrition,2019,59(12):1 840-1 867.
[20] 苗丽平,赵新节,韩爱芹,等.红葡萄酒中花色苷的影响因素[J].酿酒科技,2016(2):40-46.
MIAO L P,ZHAO X J,HAN A Q,et al.The main influencing factors of anthocyanins in red wine[J].Liquor-Making Science & Technology,2016(2):40-46.
[21] 刘霞,令小雨,马东琳.橡木片陈酿对赤霞珠干红葡萄酒品质的影响[J].中国酿造,2016,35(11):78-82.
LIU X,LING X Y,MA D L.Effect of oak chips aging on quality of cabernet sauvignon dry wine[J].China Brewing,2016,35(11):78-82.
[22] 于庆泉.蛇龙珠红葡萄酒酿造过程中花色苷的变化规律研究[D].北京:中国农业大学,2006.
YU Q Q.Changes of anthocyanins in the enological process of cabeinet gernischet red wines[D].Beijing:China Agricultural University,2006.
[23] 唐柯,倪高玉,李记明,等.辅色素对葡萄酒单体花色苷及颜色影响的研究[J].食品与发酵工业,2019,45(22):55-60.
TANG K,NI G Y,LI J M,et al.Effect of co-pigment on monomeric anthocyanin and color of wine[J].Food And Fermentation Industries,2019,45(22):55-60.
[24] BARRERA-GARCIA V D,GOUGEON R D,DI MAJO D,et al.Different sorption behaviors for wine polyphenols in contact with oak wood[J].Journal of Agricultural and Food Chemistry,2007,55(17):7 021-7 027.
[25] LEE J,H,STEPHEN T,T.Ellagic acid and ellagitannins affect on sedimentation in Muscadine juice and wine[J].Food Chemistry 2002,50:3 971-3 976.
[26] BEER D D,JOUBERT E,GELDERBLOM W C A,et al.Changes in the phenolic composition and antioxidant activity of Pinotage,Cabernet Sauvignon,Chardonnay and Chenin Blanc wines during bottle ageing[J].South African Journal of Enology and Viticulture,2005,26(1):6-15.
[27] 张笑菊,蔡逸安,李昕悦,等.响应面法优化紫甘蓝中花色苷提取工艺及抗氧化性研究[J].食品研究与开发,2019,40(1):94-100.
ZHANG X J,CAI Y A,LI X Y,et al.The optimization of anthocyanin extraction in red cabbage by response surface and their antioxidant activity[J].Food Research and Development,2019,40(1):94-100.
[28] TSAI P J,HUANG H P,HUANG T C.Relationship between anthocyanin patterns and antioxidant capacity in mulberry wine during storage [J].Journal of Food Quality,2005,27(6):497-505.
[29] 王婷婷,苑伟,李华,等.复合小浆果果酒中的酚类物质及其抗氧化活性分析[J].食品与发酵工业,2019,45(3):87-192.
WANG T T,YUAN W,LI H,et al.Analysis of phenolics and their antioxidant activities in compounded small berry wines [J].Food And Fermentation Industries,2019,45(3):87-192.
[30] SUN J,LI X,LUO H,et al.Comparative study on the stability and antioxidant activity of six pyranoanthocyanins based on malvidin-3-glucoside[J].Journal of Agricultural and Food Chemistry,2020,68(9):2 783-2 794.