海红果(Malus micromalus Makino)为蔷薇科苹果属滇池海棠系的西府海棠种,属世界珍稀果品,在我国境内仅分布于秦、晋、苏三省部分地区,陕西府谷为主产区,至今已有上千年的栽培历史。据测定,海红果营养丰富,钙、黄酮、氨基酸等成分远优于同属果品,其药用价值潜力巨大,发展前景广阔。但海红果在自然放置下易腐烂,使其经济价值严重降低。目前海红果贮藏方式基本以自然放置和冷藏为主,低温保藏效果虽好,但耗资大,盈利少,限制了海红果鲜品销量。随着海红果产量以及市场认可度的提升,探寻一种绿色高效的海红果贮藏技术已经势在必行。
目前,利用微生物防治技术降低果蔬病害,提高贮藏品质成为了生物防治的研究热点。而拮抗酵母以其遗传稳定、抑菌效果明显、安全性高以及能与多种物理和化学方法相结合等优点成为了果蔬采后病害防治的主要生防菌,因此拮抗酵母作为一种有效的生物防治剂,代替化学杀菌剂备受人们的关注[1-2]。其中,罗伦隐球酵母(Cryptococcus laurentii)是国内外研究较多的一种拮抗酵母,对灰霉病[3-4]、青霉病[5-6]、软腐病[7]、炭疽病[8]等病原菌具有抑制作用,且在苹果[9]、樱桃小番茄[4,10]、桃[7]、冬枣[11]、柑橘[6]、芒果[8]、梨[12]、葡萄[13]等水果的保鲜技术方面已有研究。壳聚糖(chitosan)作为一种生物保护剂,近年来被广泛地应用于果蔬贮藏保鲜[14-16]。壳聚糖无味无毒无害,具有较强的附着性,吸附于物体表面后能迅速固化成膜,将其涂抹于采后果蔬表面,可限制空气中丰富的O2进入,阻止CO2的排出,因此降低了果实的呼吸作用,减缓了其他有害物质的产生,在一定程度上延缓组织细胞的衰老,提高果蔬贮藏品质。其次,壳聚糖在果蔬表面形成的保护层,能有效阻止病原菌的入侵,降低果蔬的病害感染率。研究结果表明,酵母菌能有效抑制病原菌,但其无法使果蔬与病原菌完全隔离,果蔬贮藏后期由于营养流失严重,极易引起病原菌大量繁殖而加速腐烂。如果在果蔬表面涂抹一层水溶性壳聚糖(water soluble chitosan,WSC),则在其表面将形成一层由壳聚糖构成的半透性保护膜,阻断果蔬与自然环境的直接接触,恰好能够弥补拮抗酵母菌的不足,而拮抗酵母结合WSC对果蔬保鲜效果的研究报道甚少。本文以海红果为试验材料,研究罗伦隐球酵母结合WSC对海红果常温贮藏品质的影响,为开发海红果保鲜技术提供参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 果实和菌株
海红果(Malus micromalus Makino),府谷县麻镇海红果种植基地,采时果实应有的风味和香气未表现,坚硬且有淀粉味,采后装入内径为440 mm×325 mm×225 mm的泡沫箱立即运回实验室,4 ℃冰箱冷藏备用。
灰葡萄孢霉(Botrytis cinerea),北纳创联生物技术有限公司,产品编号BNCC 338228。
罗伦隐球酵母(Cryptococcus laurentii),北纳创联生物技术有限公司,产品编号BNCC 189135。
1.1.2 主要仪器
HSX-160恒温恒湿培养箱,常州迈科诺仪器有限公司;JY3002电子分析天平,上海良平仪器仪表有限公司;UV-1780分光光度计,日本岛津公司;D-37520高速冷冻离心机,赛默飞世尔(苏州)仪器有限公司;SKY-1102C恒温培养震荡器,上海苏坤实业有限公司;MLR-352光照箱,上海创奕科教设备有限公司;手持糖量仪(0~32%),上海力辰邦西仪器科技有限公司;MLS-3781L高压蒸汽灭菌锅,日本松下。
1.1.3 主要试剂
WSC(分析纯),上海沪震实业有限公司;甲硫氨酸(分析纯),天津市致远化学试剂有限公司;氮蓝四唑(nitro-blue tetrazolium,NBT)、核黄素(分析纯),上海蓝剂;硫代巴比妥酸(分析纯),上海科丰化学试剂有限公司;三氯乙酸(分析纯),天津市科密欧化学试剂有限公司;乙二胺四乙酸二钠(分析纯),成都市科龙化工试剂厂;愈创木酚(分析纯),福晨(天津)化学试剂有限公司。
1.2 实验方法
1.2.1 微生物的活化及菌悬液的制备
1.2.1.1 灰葡萄孢霉
将灰葡萄孢病原菌接种到马铃薯葡萄糖琼脂培养基(200 g马铃薯取其滤液、20 g葡萄糖、20 g琼脂、1 L蒸馏水)上,在25~28 ℃下进行活化培养5~7 d后,用无菌生理盐水冲洗孢子,之后用血球计数板调整其浓度为105 spores/mL的孢子悬浊液,待用。
1.2.1.2 罗伦隐球酵母
将罗伦隐球酵母接种到5°Bé麦芽汁琼脂培养基(5°Bé麦芽汁 1.0 L,琼脂 15.0 g,自然pH)上,在25~28 ℃下活化培养3 d,用接种环刮取菌落于麦芽汁液体培养基(5°Bé麦芽汁 1.0 L,自然pH),26 ℃,200 r/min摇床振荡培养24 h,4 000 r/min离心10 min后收集菌体于无菌生理盐水中,运用稀释分离的方法和血球计数板调整浓度分别为105、106、107、108和109 CFU/mL。
1.2.2 拮抗酵母菌生防效果最适浓度的筛选
1.2.2.1 果实处理
选取品质较优的海红果6组,每组30个。用体积分数0.1% NaClO溶液消毒5 min后,用蒸馏水将消毒液冲洗干净,通风处自然晾干。在海红果果实的最大直径处,用消毒后的打孔器对称扎取直径2 cm,深2 cm的孔洞,分别将浓度为105、106、107、108、109 CFU/mL的20 μL拮抗酵母菌溶液接种在海红果孔洞中,待菌液吸收2 h后,再接种105 spores/mL灰葡萄孢孢子溶液20 μL保持2 h后,将处理后的6组果实分别放入托盘中,用聚乙烯保鲜膜包裹后置于常温下(温度22~24 ℃,相对湿度85%~90%)连续培养6 d,每2 d记录病害发病率和病斑直径。以不接种拮抗酵母菌溶液为对照组(CK),每组重复3次。
1.2.2.2 指标测定
(1)发病率:当海红果果实的初始接种孔处出现直径大于2 cm的霉菌性病斑即记为发病孔。
发病率![]()
(1)
(2)病斑直径:用游标卡尺直接测定霉菌性病斑孔的直径。
1.2.3 最适浓度的拮抗酵母结合WSC对海红果采后贮藏品质的影响
1.2.3.1 果实处理
海红果的选材和消毒方法同1.2.2小节,共计7组。消毒后果实取其1组用蒸馏水浸泡3 min,记CK1,作空白对照组。用配制好的107 CFU/mL酵母悬菌液中浸泡其余6组果实2 min,取出后稍微晾干,取其中1组记CK2,作罗伦隐球酵母单菌对照组。其余5组分别放入质量浓度为5.00、7.50、10.00、12.50和15.00 g/L WSC溶液中浸泡2 min,取出后强通风冷却晾干,晾干后的海红果放入托盘用聚乙烯保鲜膜包裹后置于常温(温度22~24 ℃,相对湿度85%~90%)下连续培养15 d,每隔2 d指标测定,每组重复3次。
1.2.3.2 指标测定
(1)失重率:采用单个称重法测定。
失重率![]()
(2)
(2)腐烂率:当海红果果实表面出现缺陷或水浸状病斑作为腐烂果。
腐烂率![]()
(3)
(3)可溶性固形物(total soluble solids,TSS)含量:采用糖量法,用手持糖量仪测定,结果以%表示。
(4)超氧化物歧化酶(superoxide dismutase,SOD)活性:采用NBT光化还原法[17],以抑制NBT光化还原达50%所需的酶液量为1个酶活力单位(U)。
(5)过氧化物酶(peroxidase,POD)活性:采用愈创木酚法[17],以每1 min的A470变化值表示酶活力。
(6)过氧化氢酶(catalase,CAT)活性:采用紫外吸收法[17],以1 min内A240减少0.1的酶量为1个酶活力单位(U)。
(7)丙二醛(malondialdehyde,MDA)含量:采用硫代巴比妥酸法[17]。
(8)VC含量:采用分光光度计法[18]。
1.3 统计分析
采用Origin 2018软件进行数据统计和绘图,采用SPSS 22.0软件在0.05水平下进行单因素方差分析和邓肯氏多重比较。
2 结果与分析
2.1 拮抗酵母生防效果最佳浓度的筛选
发病率和病斑直径直观反映果实的抗病性能。由表1知,海红果的发病率和病斑直径随贮藏时间的增加逐渐增大。与CK相比,处理组的海红果发病率和病斑直径均低于CK,达到显著水平(P<0.05)。处理组之间相比,随酵母菌浓度的增大,其对灰葡萄孢的抑菌作用呈先增大后降低的趋势,当酵母菌悬液浓度达到107 CFU/mL时的抑菌作用最大,该浓度下的发病率显著低于其他处理组,病斑直径也于贮藏第6天显著低于其他处理组(P<0.05)。与CK相比,107 CFU/mL酵母菌悬液处理下的果实在贮藏第2、4和6天发病率依次降低了94.33%、90.38%和87.70%,病斑直径分别减小了67.86%、71.86%和73.04%。以上结果表明,拮抗酵母能显著提高对灰葡萄孢的抑菌效果(P<0.05),且酵母菌溶液的最适浓度为107 CFU/mL,低于或高于最适浓度均会降低其对病原菌的抑制作用。说明拮抗酵母抑制病原菌具有群体效应,其浓度达到一定值后能在果实表面迅速定殖,成为优势种群,致使病原菌繁殖被抑制。LAI等[3]研究结果表明,108 CFU/mL C.Laurentii溶液能显著降低梨由灰葡萄孢引发的灰霉病(P<0.05)。毛淑波等[19]研究结果也表明,采前喷施108 CFU/mL C.Laurentii溶液能有效降低草莓灰霉病的发生。本文研究结果与前人研究结果相似,其抑菌机理是,现阶段研究的生防酵母菌均分离于果蔬表面[20-21],属果蔬的益生菌群,与病原真菌相比,果实表面微环境更适合酵母菌的生长,使其会在果蔬表面迅速增殖,争夺了病原菌的生存养料和空间,达到抑菌效果[3,22]。
表1 拮抗酵母对灰葡萄孢霉的抑菌成效
Table 1 Antibacterial effect of antagonistic yeast on B.cinerea

处理贮藏时间/d246发病率/%病斑直径/cm发病率/%病斑直径/cm发病率/%病斑直径/cm030.00±4.00a2.80±0.71a52.00±11.26a5.90±1.19a81.33±4.16a8.53±0.43a105 CFU/mL19.67±7.09b1.96±0.26b37.33±4.16b3.73±0.28b54.67±7.02b5.60±0.70b106 CFU/mL11.00±2.65c1.20±0.25bc21.00±6.25c2.90±0.45bc32.67±8.33c4.03±0.52c107 CFU/mL1.7±1.53d0.90±0.36c5.00±3.61d1.66±0.15c10.00±2.00d2.30±0.65d108 CFU/mL12.67±1.53bc1.55±0.55bc21.33±4.16c2.46±0.50bc41.00±7.00c3.86±1.06c109 CFU/mL20.33±9.60b1.30±0.15bc27.67±4.51bc3.53±0.11b43.33±3.06c5.13±0.89b
注:表中数值用平均值±标准误表示。同一列中小写字母不同者,表示经邓肯氏多重比较后的处理组之间差异显著(P<0.05)
2.2 海红果贮藏过程中拮抗酵母结合WSC对其品质的影响
活体接种试验表明,107CFU/mL C.Laurentii溶液能够最大程度地抑制灰葡萄孢霉引起的灰霉病,为了提高拮抗酵母的生防效果,实验选取了107 CFU/mL拮抗酵母与不同质量浓度的WSC结合处理,研究其对贮藏中海红果品质的影响。
2.2.1 失重率的影响
贮藏期果实失重的主要原因是水分的自然蒸发以及呼吸作用对有机物的分解代谢所致[23],因此失重率是反映贮藏期果实品质的重要指标。由图1所知,随着贮藏时间的延长,海红果失重率逐渐升高, CK1均显著高于CK2(P<0.05),表明拮抗酵母的单独使用能显著降低海红果贮藏过程中水分和有机质的耗损。复合处理组的海红果失重率均低于CK2,在贮藏第6天开始达到显著水平(P < 0.05)。当WSC质量浓度为10.00 g/L时,海红果失重率始终处于最低水平,尤其在贮藏第15天时,较CK2和CK1分别降低了33.61%和51.49%。整个贮藏期,复合处理组间的海红果失重率差异不显著(P > 0.05),说明一定质量浓度范围内的WSC对海红果的失重率影响不大。以上结果表明,107 CFU/mL拮抗酵母结合一定质量浓度的WSC能降低海红果的失重率。与MENG等[13]研究结果相似,其机理主要归因于果实经WSC浸泡后,可在其表面形成一层半透性保护膜,水分的蒸发被阻止,同时也减少了外部O2的进入,使果实表面形成了高CO2低O2的微环境,呼吸强度被减弱,从而减缓了海红果贮藏过程中的水分丢失和有机质的分解[24-25]。
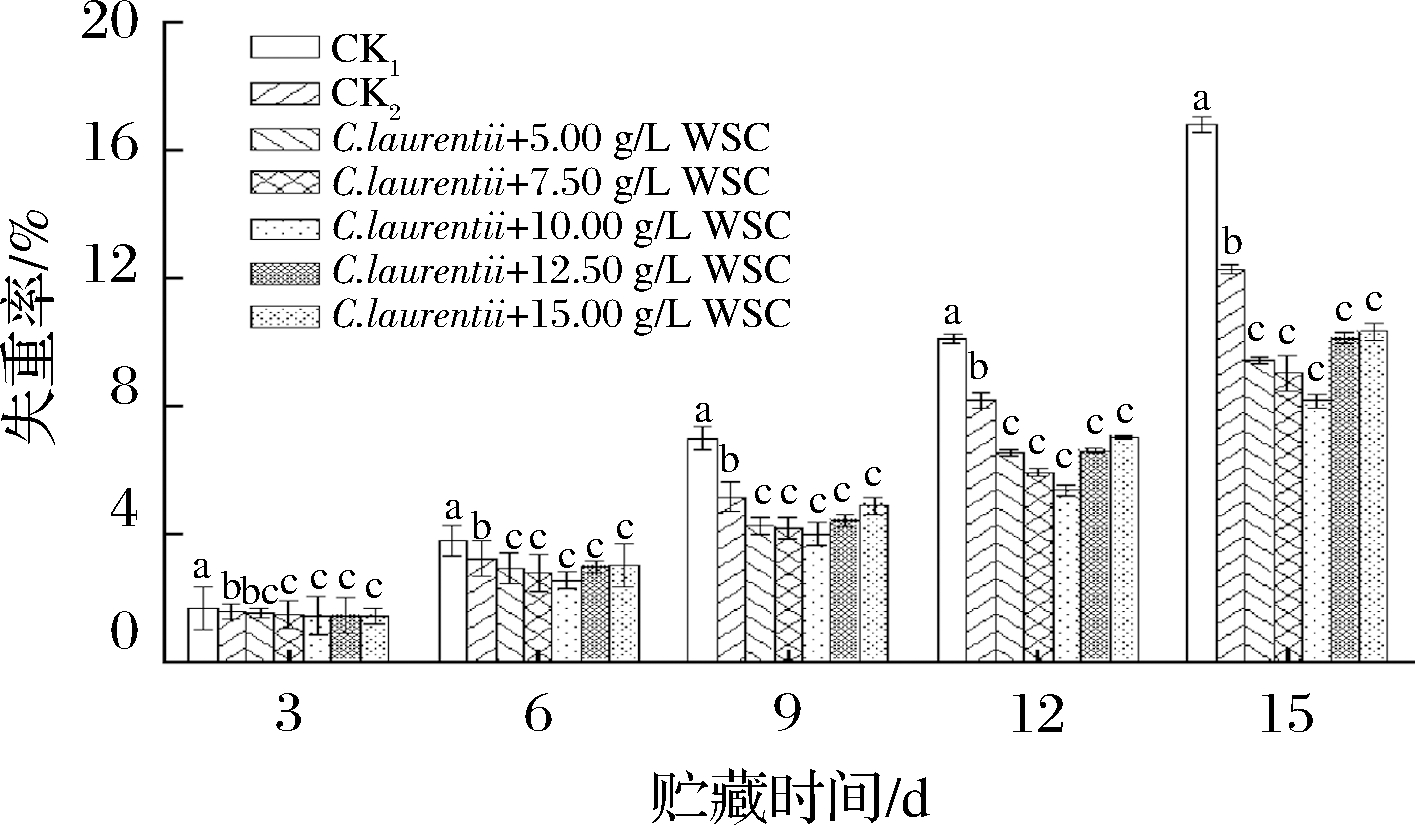
图1 拮抗酵母结合水溶性壳聚糖对海红果贮藏
期失重率的影响
Fig.1 Effect of antagonistic yeast combined with WSC
on weight loss of circassian fruit during storage
注:不同小写字母表示差异显著,(P<0.05),下同
2.2.2 腐烂率的影响
由图2可知,CK1和CK2海红果于贮藏第6天出现了不同程度的腐烂,CK2腐烂率显著低于CK1(P<0.05)。随WSC质量浓度的不断增大,复合处理组果实腐烂率呈先降低后增加的趋势,且从贮藏12 d开始均显著增加(P<0.05)。当WSC质量浓度为10.00 g/L时的果实腐烂率最低,且仅在贮藏的第15天出现了腐烂现象,腐烂率显著低于其他组,较CK2提高88.42%,较CK1提高92.89%(P<0.05);其次,果实腐烂率较低的是7.50 g/L WSC复合处理组,该组在贮藏12 d开始也显著低于其他3个复合处理组(P<0.05)。以上结果表明,拮抗酵母的单独使用,或与WSC结合使用,均能显著抑制灰葡萄孢的侵染,进而降低果实的腐烂率,延长贮藏寿命,且结合处理组的抑菌效果更好。原因是C.laurentii能对多种引起水果腐烂的病原微生物产生抑制作用,但其不能隔离病原微生物,这一缺点刚好被WSC所弥补,WSC在水果表面形成的可食性保护膜隔离了病原微生物,使得C.laurentii迅速繁殖,成为优势菌群后更好地抑制了病原菌滋生[26-27]。因此WSC和拮抗剂酵母在抑菌方面表现出了协同效应。当拮抗酵母结合5.00~10.00 g/L WSC时的抑菌效果呈上升趋势,WSC质量浓度继续升高时开始下降,其中107 CFU/mL的拮抗酵母与10.00 g/L WSC结合后的抑菌效果最佳。分析原因可能是拮抗酵母均来源于果实表面,因此属好氧或微好氧型真菌,WSC质量浓度太大,包裹于果实表面,严重地阻断了酵母菌代谢对O2的需求,因此抑制了酵母菌的定殖和繁殖,反而减弱了对病原菌的拮抗作用。

图2 拮抗酵母结合水溶性壳聚糖对海红果
贮藏期腐烂率的影响
Fig.2 Effect of antagonistic yeast combined with WSC
on decay rate of circassian fruit during storage
2.2.3 TSS含量的影响
TSS是指单糖、双糖、有机酸等可溶性的有机物类小分子,能够反映果实的成熟度,决定果实的口感,其含量高低也是决定果实贮藏品质的重要指标[28]。如图3所示,TSS随贮藏时间的延长,整体含量呈下降趋势,且较为平缓。整个贮藏期,CK2海红果TSS含量始终略高于CK1,差异均不显著(P > 0.05),这表明拮抗酵母单菌处理对海红果TSS含量的影响作用不明显。这与毛淑波等[19]研究显示的采前喷施C.laurentii对草莓TSS含量以及WEI等[4]研究表明的采后喷施C.laurentii对圣女果TSS含量影响均不显著的结果相同。复合组与CK2相比,TSS含量在贮藏后期(第12天开始)均显著高于CK1和CK2,但复合组间的TSS含量差异不显著(P > 0.05),其中WSC质量浓度在10.00 g/L时的复合处理组TSS含量始终略高于其他组。说明拮抗酵母与WSC复合处理时对TSS含量的降低有一定的减缓作用,这种缓减作用在贮藏前期不明显,后期显著。WANG等[29]研究结果也表明,西柚采后贮藏的8 d内,从贮藏的第6天开始,羧甲基壳聚糖与C.laurentii的结合处理组TSS的含量显著性高于C.laurentii单独处理组,与本试验结果类似。说明拮抗酵母与WSC的结合在一定程度上能够使果实的口感较好的保持,该试验中,当WSC质量浓度为10.00 g/L时的复合处理效果最好。
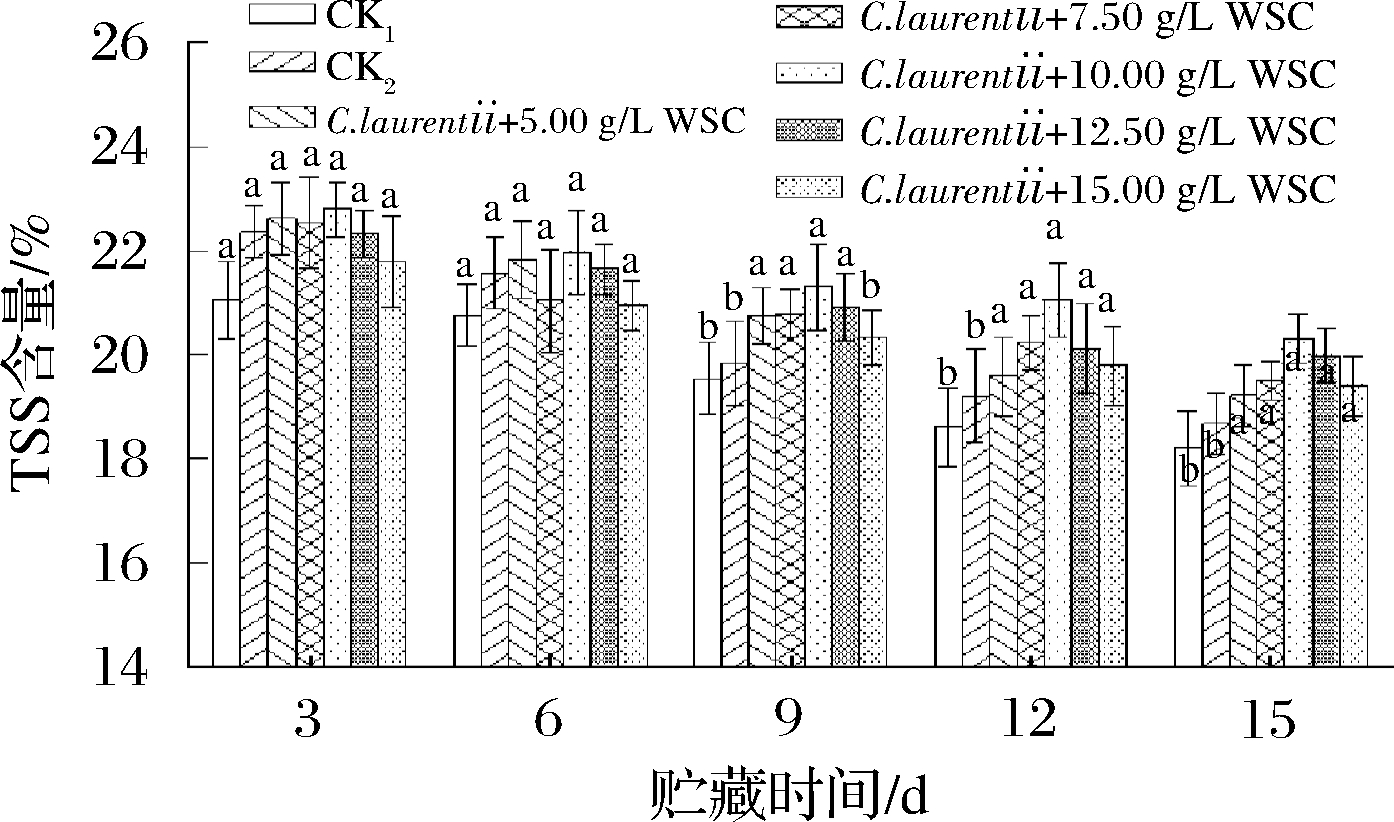
图3 拮抗酵母结合水溶性壳聚糖对海红果
贮藏期TSS含量的影响
Fig.3 Effect of antagonistic yeast combined with WSC
on TSS content of circassian fruit during storage
2.2.4 抗氧化酶活性的影响
2.2.4.1 SOD酶活性的影响
SOD属于生物体内的抗氧化酶之一,保护生物组织免受活性氧损伤,该酶活性的高低反映了海红果清除活性氧的能力。由图4可知,海红果贮藏期,SOD酶活性整体呈先增强后减弱的趋势。CK1、CK2和15.00 g/L WSC复合处理组的SOD酶活性峰值在第9天出现,其他复合处理组的酶活性峰值均在第12天出现。整个贮藏期内,CK2组的SOD酶活性均显著高于CK1(P<0.05),表明单独拮抗酵母菌处理海红果能有效提高其SOD活性。与CK2相比,7.50 g/L WSC复合组的SOD酶活性均高于CK2,达到了显著水平(P < 0.05),且该处理组下的SOD酶活性始终处于最高水平,在贮藏第15天时,SOD酶活性是CK1的1.42倍,CK2的1.13倍;10.00 g/L和5.00 g/L WSC复合处理组的酶活性从贮藏第9天也显著高于CK2(P<0.05);12.50 g/L WSC复合处理组的SOD酶活性除在第12天显著性高于CK2外,其他时间内均略高于CK2,差异不显著(P > 0.05);15.00 g/L WSC复合处理组与CK2相比,SOD酶活性整个贮藏期出现了负增长,差异不显著(P > 0.05)。以上结果表明,与单独拮抗酵母处理组相比,复合处理组中SOD酶活性受WSC质量浓度调控,其中,当WSC质量浓度为7.50 g/L时的果实SOD酶活性达到了最大。
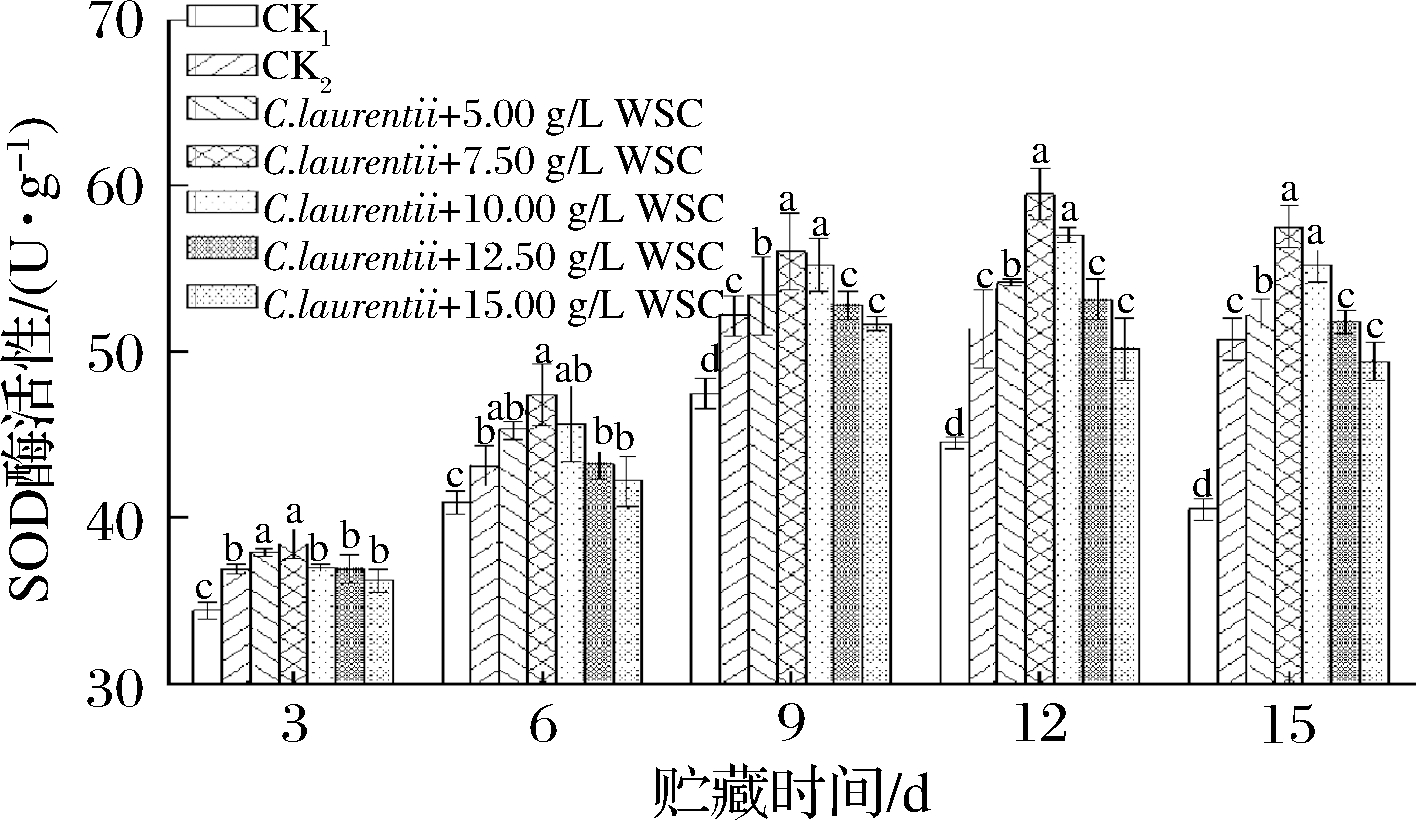
图4 拮抗酵母结合壳聚糖对海红果贮藏期SOD酶活性的影响
Fig.4 Effect of antagonistic yeast combined with chitosan on SOD activity of circassian fruit during storage
2.2.4.2 POD活性的影响
POD属于生物体能抗氧化防御系统中的保护酶,能够清除SOD与超氧阴离子自由基![]() 反应产生的H2O2,破坏
反应产生的H2O2,破坏![]() 与H2O2的反应形成的羟自由基(·OH),降低膜脂过氧化程度,该酶活性高低反映了细胞受氧自由基迫害的程度。由图5可知,POD活性整体呈先上升后下降趋势,酶活性峰值均在第12天出现,此时CK2活性是CK1的1.08倍,整个贮藏期CK2 组POD活性均显著性高于CK1(P<0.05)。复合处理组与CK2相比,WSC质量浓度为5.00~12.50 g/L时的各复合组在贮藏后期(第12天)POD活性显著高于CK2(P<0.05),其中7.50 g/L WSC组的POD活性在整个贮藏期显著高于CK2(P<0.05),但15.00 g/L WSC组在整个贮藏期与CK2相比,差异不显著(P > 0.05),且贮藏后期活性有所下降。以上表明,WSC质量浓度在7.50 g/L时与拮抗酵母结合处理可明显提高贮藏期果实POD活性,但WSC质量浓度过高对POD活性有抑制现象,与其对SOD活性的影响结果相似。
与H2O2的反应形成的羟自由基(·OH),降低膜脂过氧化程度,该酶活性高低反映了细胞受氧自由基迫害的程度。由图5可知,POD活性整体呈先上升后下降趋势,酶活性峰值均在第12天出现,此时CK2活性是CK1的1.08倍,整个贮藏期CK2 组POD活性均显著性高于CK1(P<0.05)。复合处理组与CK2相比,WSC质量浓度为5.00~12.50 g/L时的各复合组在贮藏后期(第12天)POD活性显著高于CK2(P<0.05),其中7.50 g/L WSC组的POD活性在整个贮藏期显著高于CK2(P<0.05),但15.00 g/L WSC组在整个贮藏期与CK2相比,差异不显著(P > 0.05),且贮藏后期活性有所下降。以上表明,WSC质量浓度在7.50 g/L时与拮抗酵母结合处理可明显提高贮藏期果实POD活性,但WSC质量浓度过高对POD活性有抑制现象,与其对SOD活性的影响结果相似。
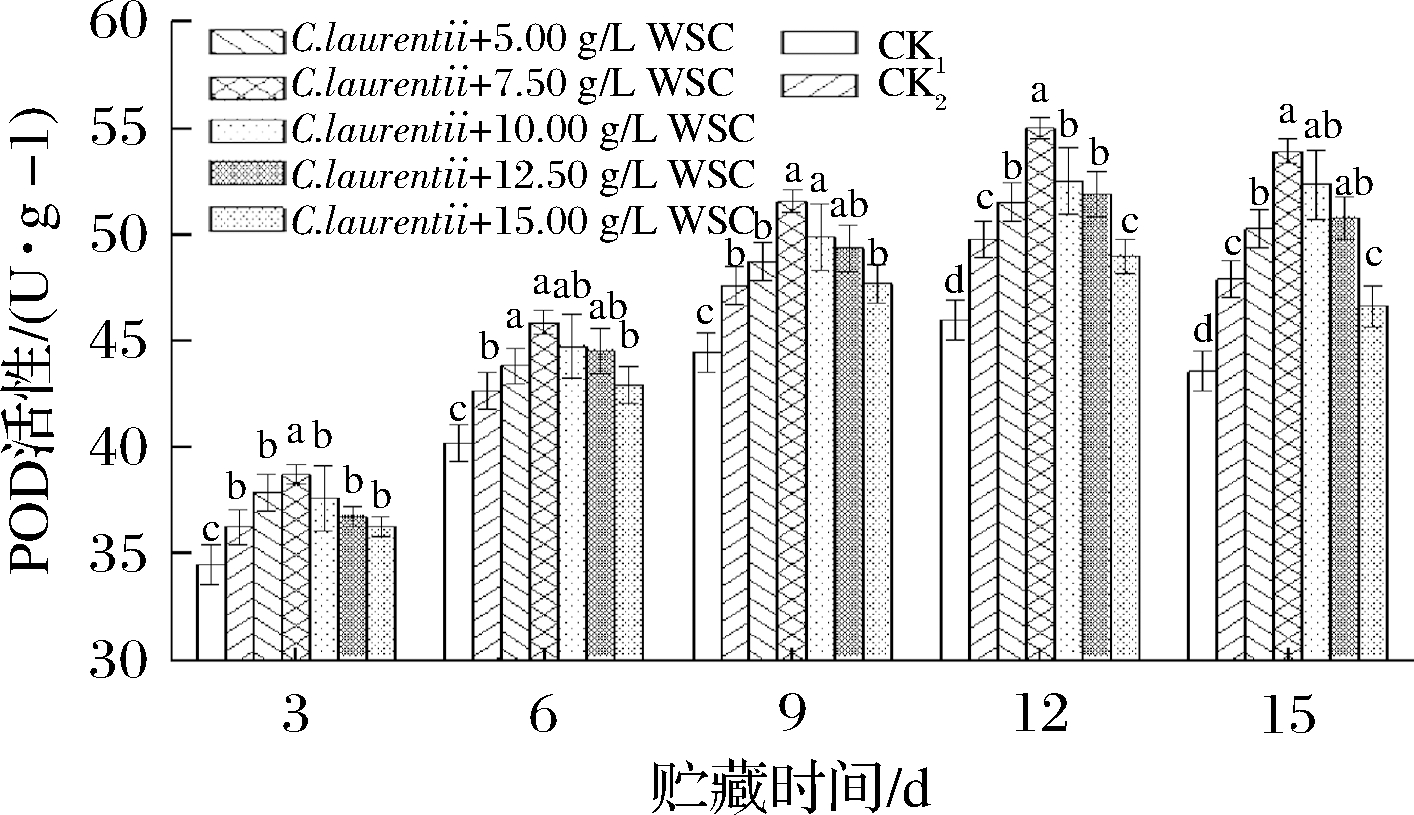
图5 拮抗酵母结合壳聚糖对海红果贮藏期POD活性的影响
Fig.5 Effect of antagonistic yeast combined with chitosan on POD activity of circassian fruit during storage
2.2.4.3 CAT活性的影响
CAT功能和POD类似,可清除H2O2。由图6可知,果实贮藏期CAT活性变化类似于SOD和POD,随着贮藏时间的增加,也呈先增强后减弱趋势,CK1酶活性峰值在第9天出现,其他组酶活性峰值均在第12天出现。整个贮藏期,CK2组CAT活性显著高于CK1(P < 0.05),说明拮抗酵母单独处理能较好地提高海红果CAT活性。复合处理组与CK2相比,WSC质量浓度在7.50 g/L和10.00 g/L时酶活性显著高于CK2(P<0.05),其中7.50 g/L WSC处理组的CAT活性最高,但与10.00 g/L WSC处理组相比差异不显著(P>0.05);5.00 g/L WSC处理组在贮藏第12天开始也显著高于CK2(P<0.05),当WSC质量浓度增高到12.50 g/L时的处理组与CK2相比,CAT活性略高于CK2,差异均不显著(P>0.05);当WSC质量浓度继续升高到15.00 g/L时,处理组CAT酶活性较CK2出现了负增长,且从第6天开始较CK2显著性降低。说明WSC质量浓度为7.50~10.00 g/L时,能有效诱导果实产生CAT酶,并维持其活性处于较高水平。
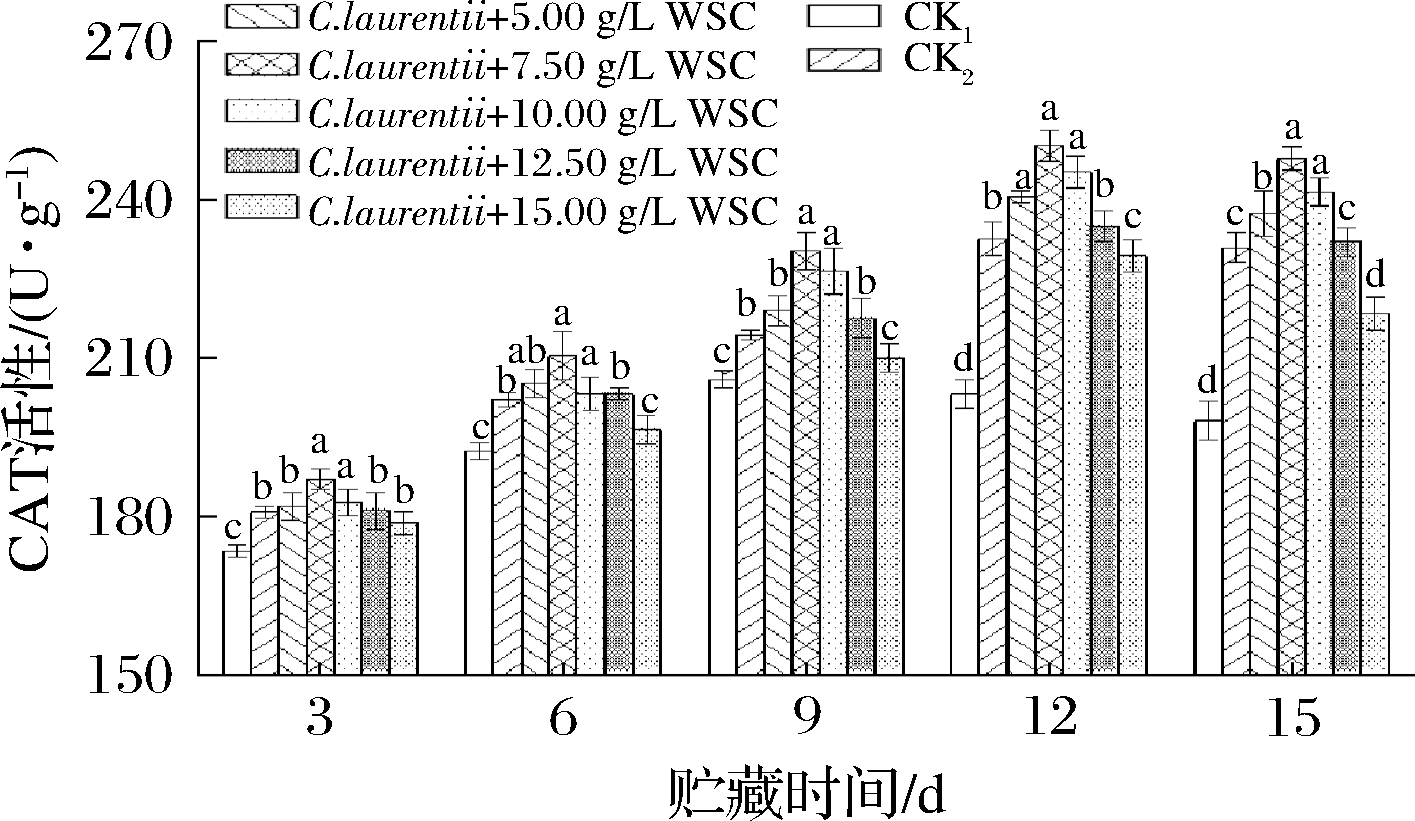
图6 拮抗酵母结合壳聚糖对海红果贮藏期CAT活性的影响
Fig.6 Effect of antagonistic yeast combined with chitosan on CAT activity of circassian fruit during storage
SOD、CAT、POD是果蔬体内3种极为重要的防御性酶,SOD将细胞代谢产生的![]() 等各种有害活性氧分子歧化为H2O2,在POD和CAT的作用下,H2O2又进一步转变为H2O。这3种酶通常相互协同,其活性的高低反映了组织细胞的抗逆性,与果蔬储藏品质成正相关[30]。该试验所呈现的3种酶活性均为先增后降的趋势,分析其原因可能是脱离母体供养的海红果,在采后贮藏中,细胞的衰老代谢产生了大量的
等各种有害活性氧分子歧化为H2O2,在POD和CAT的作用下,H2O2又进一步转变为H2O。这3种酶通常相互协同,其活性的高低反映了组织细胞的抗逆性,与果蔬储藏品质成正相关[30]。该试验所呈现的3种酶活性均为先增后降的趋势,分析其原因可能是脱离母体供养的海红果,在采后贮藏中,细胞的衰老代谢产生了大量的![]() 诱导细胞合成较多的SOD平衡体内的超氧化状态,因此,经SOD歧化
诱导细胞合成较多的SOD平衡体内的超氧化状态,因此,经SOD歧化![]() 产生的H2O2作为植物体内一种很重要的信号分子,产生并激活了POD和CAT,因此,海红果在贮藏前期3种酶活性均升高。随后3种酶活性降低的原因是贮藏后期,细胞的进一步衰老凋亡,导致了活性氧的超量积累,细胞膜脂程度加剧,破坏细胞结构,进而降低了果实体内3种酶的合成能力,导致酶活性下降。大量研究表明,拮抗酵母能够促进采后果蔬的生防效果,其作用之一就是通过激发细胞内部的抗氧化信号通路,合成大量的抗氧化酶,降低膜脂过氧化,减缓细胞的衰老进程,因此高活性的3种酶能够反映组织抗氧化能力强,进而延缓了细胞的衰老。该实验研究结果表明,与CK1相比,拮抗酵母单独处理组的3种酶活性均显著高于CK1(P<0.05),也进一步验证了拮抗酵母的生防作用之一是促进细胞的抗氧化酶活性来提高宿主对活性氧的防御性能。秦晓杰等[31]研究表明,采前喷施拮抗酵母能提高采后草莓贮藏期的SOD、POD和CAT活性,这与本研究结果类似。与CK2相比,0.50~10.00 g/L WSC复合处理组的果实从贮藏第12天开始表现出很强的抗氧化性能,3种酶活性均显著高于CK2(P<0.05),当WSC质量浓度升高至15.00 g/L时却出现了负增长的现象。整个贮藏期间,7.50 g/L WSC复合处理组的3种酶活性均处于最高水平,显著性高于CK2。因此WSC与拮抗酵母结合来提高海红果抗氧化酶活性,WSC存在最适浓度。这与彭茹等[32]研究结果相似,即较低壳聚糖浓度下,对柑橘果实3种保护酶活性显著提高(P<0.05),但高浓度则表现出一定的抑制作用。究其原因,较厚的壳聚糖涂膜阻止了果实呼吸作用产生的CO2的排放,对果实产生了毒害。说明不同质量浓度WSC对酶活性的影响结果不同,适宜WSC质量浓度是这项保鲜技术成败的关键。
产生的H2O2作为植物体内一种很重要的信号分子,产生并激活了POD和CAT,因此,海红果在贮藏前期3种酶活性均升高。随后3种酶活性降低的原因是贮藏后期,细胞的进一步衰老凋亡,导致了活性氧的超量积累,细胞膜脂程度加剧,破坏细胞结构,进而降低了果实体内3种酶的合成能力,导致酶活性下降。大量研究表明,拮抗酵母能够促进采后果蔬的生防效果,其作用之一就是通过激发细胞内部的抗氧化信号通路,合成大量的抗氧化酶,降低膜脂过氧化,减缓细胞的衰老进程,因此高活性的3种酶能够反映组织抗氧化能力强,进而延缓了细胞的衰老。该实验研究结果表明,与CK1相比,拮抗酵母单独处理组的3种酶活性均显著高于CK1(P<0.05),也进一步验证了拮抗酵母的生防作用之一是促进细胞的抗氧化酶活性来提高宿主对活性氧的防御性能。秦晓杰等[31]研究表明,采前喷施拮抗酵母能提高采后草莓贮藏期的SOD、POD和CAT活性,这与本研究结果类似。与CK2相比,0.50~10.00 g/L WSC复合处理组的果实从贮藏第12天开始表现出很强的抗氧化性能,3种酶活性均显著高于CK2(P<0.05),当WSC质量浓度升高至15.00 g/L时却出现了负增长的现象。整个贮藏期间,7.50 g/L WSC复合处理组的3种酶活性均处于最高水平,显著性高于CK2。因此WSC与拮抗酵母结合来提高海红果抗氧化酶活性,WSC存在最适浓度。这与彭茹等[32]研究结果相似,即较低壳聚糖浓度下,对柑橘果实3种保护酶活性显著提高(P<0.05),但高浓度则表现出一定的抑制作用。究其原因,较厚的壳聚糖涂膜阻止了果实呼吸作用产生的CO2的排放,对果实产生了毒害。说明不同质量浓度WSC对酶活性的影响结果不同,适宜WSC质量浓度是这项保鲜技术成败的关键。
2.2.5 MDA含量的影响
MDA是膜脂过氧化的产物,其含量的高低反映了海红果在贮藏期组织细胞的衰老程度。由图7可知,随贮藏时间的延长,各组MDA含量均呈先降后升趋势,在第9天时最低,之后逐渐上升。与CK1相比,CK2和复合组的MDA含量均显著性降低(P<0.05)。复合组相比,在相同时间内,随WSC质量浓度的增加,MDA含量呈先下降后升高的趋势,当WSC质量浓度为7.50 g/L时,各处理组的MDA含量最低,该处理下的MDA含量在整个贮藏期均显著低于其他处理组(P<0.05)。5.00 g/L和10.00 g/L WSC处理组的MDA含量在整个贮藏期也显著低于CK2(P<0.05),12.50和15.00 g/L WSC处理组分别在贮藏第9和12天开始显著低于CK2(P<0.05)。以上结果表明,拮抗酵母单独处理以及结合WSC复合处理均能显著降低贮藏期海红果的MDA含量(P<0.05),当WSC质量浓度为7.50 g/L时,和拮抗酵母结合处理对延缓海红果MDA积累的效果最佳。MDA 含量是毒性作用和保护作用的综合反映[33],充分地说明了7.50 g/L WSC复合处理组下的海红果组织细胞内的综合抗氧化能力很高,减少了MDA的累积。说明适度的WSC协同拮抗酵母,能够较好地抑制膜脂过氧化的发生,减轻果实体内遭受逆境的伤害程度,从而延缓了果实的衰老,提高贮藏品质。

图7 拮抗酵母结合壳聚糖对海红果贮藏期MDA含量的影响
Fig.7 Effect of antagonistic yeast combined with chitosan on MDA content of circassian fruit during storage
2.2.6 VC含量的影响
VC是一种抗氧化剂,可以清除果实体内活性氧和自由基,但其自身也很容易氧化。由图8可知,随贮藏时间的增加,VC含量整体呈下降趋势。在海红果贮藏前6 d,各组VC含量均无显著性差异(P>0.05)。与CK1相比,CK2的海红果VC含量在贮藏9 d之内略高于CK1,在第12和15天时,分别提高了1.27和1.17倍,达到了显著水平(P < 0.05),说明拮抗酵母单独处理海红果,使其在贮藏后期(第12天开始)仍能维持较高含量的VC。复合处理组的VC含量均不同程度地高于CK2,当WSC质量浓度为7.50~12.50 g/L时,贮藏的第9天开始VC含量均显著高于CK2(P < 0.05),5.00和15.00 g/L WSC处理组分别于第12和第15 天开始显著(P < 0.05)性高于CK2。以上结果表明,拮抗酵母单独处理和与WSC复合处理均能延缓海红果VC的氧化速率,且复合处理的效果优于单独处理,当WSC质量浓度在7.50~12.50 g/L时的复合处理对海红果VC的降解有明显的缓解作用。原因为较低质量浓度的WSC成膜过薄,对O2的隔离效果差,高质量浓度的WSC成膜过厚,完全阻隔了有氧呼吸,适宜质量浓度的WSC通过影响气体交换,从而改变呼吸作用,提高果实的抗氧化能力,保持VC含量[34]。
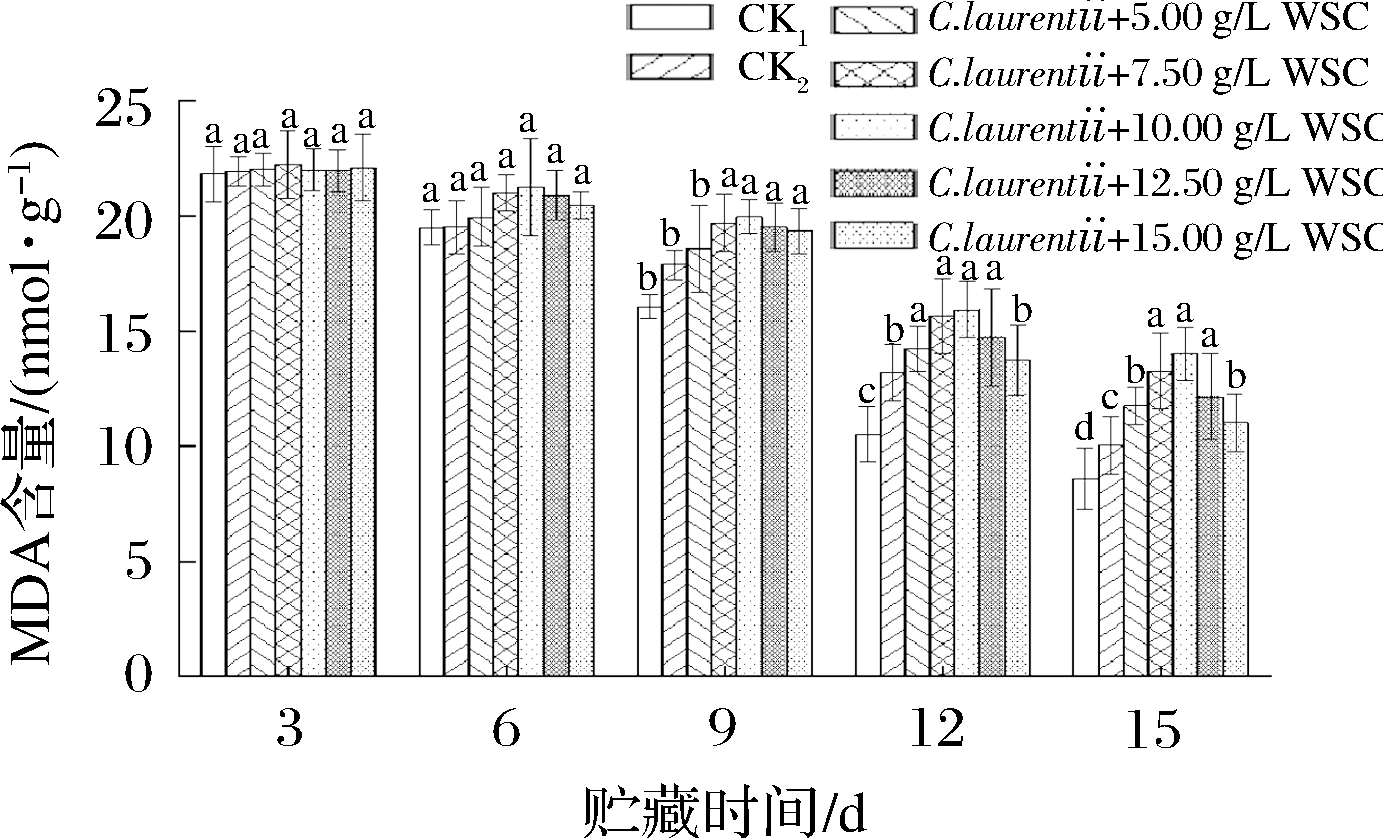
图8 拮抗酵母结合壳聚糖对海红果贮藏期VC含量的影响
Fig.8 Effect of antagonistic yeast combined with chitosan on VC content of circassian fruit during storage
3 结论
拮抗酵母能显著降低采后海红果果实内人工活体接种的灰葡萄孢霉引发的发病率和病斑直径,其中,107 CFU/mL是其最适浓度;107 CFU/mL C.laurentii结合WSC处理采后海红果,通过降低果实的发霉率、失重率和MDA含量,提高SOD、POD、CAT活性和VC含量来提升其贮藏品质,且单独C.laurentii处理的效果远不及其与WSC复合处理的效果好,其中,WSC质量浓度在7.50~10.00 g/L时的复合处理效果好,如果将其商业化应用,考虑尽量降低生产成本,因此建议采用WSC的质量浓度为质量7.50 g/L。以上表明,在C.laurentii的基础上,结合适宜质量浓度的WSC,能有效提升海红果对病害的防御性能,延缓果实的后熟衰老,增强果实的耐受性,提高果实的贮藏品质。
[1] 曾荣,董华强,林丽超,等.酵母菌对草莓采后生理及贮藏效果的影响[J].食品与发酵工业,2009,35(7):189-191.
ZENG R,DONG H Q,LIN L C,et al.Effects of yeast on physiology and preservation of post harvest strawberry[J].Food and Fermentation Industries,2009,35(7):189-191.
[2] 闫岩,王明力,李岑,等.汉逊德巴利酵母对采后柑橘青霉病的防治及贮藏品质的影响[J].食品与发酵工业,2013,39(8):216-220.
WNAG Y,WANG M L,LI C,et al.Effects of Debaryomyces hansenii on blue mold and quality of postharvest orange[J].Food and Fermentation Industries,2013,39(8):216-220.
[3] LAI J,CAO X,YU T,et al.Effect of Cryptococcus laurentii on inducing disease resistance in cherry tomato fruit with focus on the expression of defense-related genes[J].Food Chemistry,2018,254:208-216.
[4] WEI Y Y,XU M,WU H L,et al.Defense response of cherry tomato at different maturity stages to combined treatment of hot air and Cryptococcus laurentii[J].Postharvest Biology and Technology,2016,117:177-186.
[5] ZHANG Z Q,CHEN J,LI B Q,et al.Influence of oxidative stress on biocontrol activity of Cryptococcus laurentii against blue mold on peach fruit[J].Frontiers in Microbiology,2017,8:1-10.
[6] LI J K,LI H,JI S F,CHEN T,et al.Enhancement of biocontrol efficacy of Cryptococcus laurentii by cinnamic acid against Penicillium italicum in citrus fruit[J].Postharvest Biology and Technology,2019,149:42-49.
[7] 林丽,田世平,秦国政,等.两种拮抗酵母菌对桃果实贮藏期间主要病害的防治效果[J].中国农业科学,2003(12):1 535-1 539.
LIN L,TIAN S P,QIN G Z,et al.Biocontrol of postharvest diseases in peach fruits using two antagonistic yeasts during storage periods[J].Scientia Agricultura Sinica,2003(12):1 535-1 539.
[8] PEDRO U B R,MONTSERRAT C S,ROSAL A S V,NORMA A O
A S V,NORMA A O  ,et al.Biocontrol action mechanisms of Cryptococcus laurentii on Colletotrichum gloeosporioides of mango[J].Crop Protection,2014,65:194-201.
,et al.Biocontrol action mechanisms of Cryptococcus laurentii on Colletotrichum gloeosporioides of mango[J].Crop Protection,2014,65:194-201.
[9] LEONARDO G.NAVARTA,JUAN C,et al.Postharvest control of gray mold in apples with lyophilized formulations of Cryptococcus laurentii:The effect of cold stress in the survival and effectiveness of the yeast[J].Food and Bioprocess Technology,2014,7(10):2 962-2 968.
[10] LAI J,CAO X,YU T,et al.Effect of Cryptococcus laurentii on inducing disease resistance in cherry tomato fruit with focus on the expression of defense-related genes[J].Food Chemistry,2018,254:208-216.
[11] 李青云,刘文玉,魏长庆,等.拮抗酵母对北疆冬枣采后病害生防效果的研究[J].食品工业,2015,36(12):72-75.
LI Q Y,LIU W Y,WEI C Q,et al.Antagonistic yeast against disease and effect on quality of postharvest northern winter jujube[J].The Food Industry,2015,36(12):72-75.
[12] ZHANG Z Q,CHEN J,LI B Q,et al.Influence of oxidative stress on biocontrol activity of Cryptococcus laurentii against blue mold on peach fruit[J].Frontiers in Microbiology,2017,8:151.
[13] MENG X H,QIN G Z,TIAN S P.Influences of preharvest spraying Cryptococcus laurentii combined with postharvest chitosan coating on postharvest diseases and quality of table grapes in storage[J].LWT-Food Science and Technology,2009,43(4).596-601.
[14] 谢春晖,位思清,王兆升,等.壳聚糖涂膜保鲜冬枣的研究[J].山东农业大学学报(自然科学版),2010,41(1):45-50.
XIE C H,WEI S Q,WANG Z S,et al.Study on chitosan coationg in storage of Chinese winter jujube[J].Journal of Shandong Agricultural University(Natural Science),2010,41(1):45-50.
[15] 杨涛,原双进,张润光,等.壳聚糖和噻苯咪唑处理对晋枣鲜果贮藏品质的影响[J].食品与发酵工业,2019,45(8):109-114.
YANG T,YUAN S J,ZHANG R G,et al.Effects of chitosan and thiabendazole on the storage quality of fresh Jin jujube[J].Food and Fermentation Industries,2019,45(8):109-114.
[16] 董泽义,谭丽菊,王江涛.壳聚糖保鲜膜研究进展[J].食品与发酵工业,2014,40(6):147-151.
DONG Z Y,TAN L J,WANG J T.The present situation of chitosan film[J].Food and Fermentation Industries,2014,40(6):147-151.
[17] 曹建康,姜微波,赵玉梅.果蔬采后生理生化试验指导[M].北京:中国轻工业出版社,2007:101-142.
CAO J K,JIANG W B,ZHAO Y M.Guidance for postharvest physiological and biochemical tests of fruits and vegetables[M].Beijing:China Light Industry Press,2007:101-142.
[18] 李慧芸,李蒙蒙,余琼,等.纳他霉素结合壳聚糖保鲜对鲜食核桃霉变及采后生理的影响[J].农产品加工,2019(1):23-26.
LI H Y,LI M M,YU Q,et al.Effect of natamycin combined with chitosan on mildew and physiological and of fresh walnut[J].Farm Products Processing,2019(1):23-26.
[19] 毛淑波,朱娜,韦莹莹,等.采前喷施拮抗菌罗伦隐球酵母对草莓保鲜效果的影响[J].食品工业科技,2013,34(4):344-348.
MAO S B.ZHU N,WEI Y Y,et al.Effect of preharvest spraying antagonistic yeast Cryptococcus laurentii on the preservation of strawberry[J].Science and Technology of Food Industry,2013,34(4):344-348.
[20] 梁泉峰,池振明.间型假丝酵母菌株对多种水果蔬菜腐败霉菌的拮抗效果和拮抗机制的研究[J].食品与发酵工业,2002,28(1):34-39.
LIANG Q F,CHI Z M.Study on antagonistic effect and mechanism by Candida intermedia for biological control of moulds on vegetables and fruits[J].Food and Fermentation Industries,2002,28(1):34-39.
[21] SHARMA R R,DINESH S,RAJBIR S.Biological control of postharvest diseases of fruits and vegetables by microbial antagonists:A review[J].Biological Control,2009,50(3):205-221.
[22] 刘普,方静凡,程运江,等.生防酵母菌防治果品采后病害机理的研究进展[J].华中农业大报,2013,32(2):134-140.
LIU P,FANG J F,CHENG Y J,et al.Research progress on action mechanism of biocontrol yeast against postharvest fruit pathogen[J].Journal of Huzhong Agricultural University,2013,32(2):134-140.
[23] 徐丹,刘琴.壳聚糖复合涂膜的微观形貌变化及其对红桔的保鲜效果[J].食品与发酵工业,2018,44(2):233-239.
XU D,LIU Q,Morphologies changes of chitosan composite coating and effects on preservation of tangerine[J].Food and Fermentation Industries,2018,44(2):233-239.
[24] 栗子茜,高彦祥.壳聚糖在果蔬涂膜保鲜的应用[J].中国食品添加剂,2018(1):139-145.
LI Z X,GAO Y X.Chitosan-based coating in fruits and vegetables preservation[J].China Food Additives.2018(1):139-145.
[25] 杨涛,原双进,张润光,等.壳聚糖和噻苯咪唑处理对晋枣鲜果贮藏品质的影响[J].食品与发酵工业,2019,45(8):109-114.
YANG T,YUAN S J,ZHANG R G,et al.Effects of chitosan and thiabendazole on the storage quality of fresh Jin jujube[J].Food and Fermentation Industries,2019,45(8):109-114.
[26] MARTINS C J C,LIMA M K S,SILVA R A,et al.Development of biodegradable films based on purple yam starch/chitosan for food application[J].Heliyon,2020,6(4):3 718-3 728.
[27] 李慧妍,秦文,辛松林,等.壳聚糖和1-甲基环丙烯对黄秋葵果实低温贮藏品质及生理的影响[J].食品与发酵工业,2015,41(12):202-207.
LI H Y,QIN W,XIN S L,et al.Effect of chitosan or 1-methylcyclopropene treatment on physiology and quality of okra stored in low temperature[J].Food and Fermentation Industries,2015,41(12):202-207.
[28] 盘柳依,赵显阳,陈明,等.外源茉莉酸甲酯处理对采后猕猴桃果实品质和抗氧化酶活性的影响[J].食品与发酵工业,2019,45(9):190-196.
PAN L Y,ZHAO X Y,CHEN M,et al.Effects of exogenous methyl jasmonate on fruit qualities and antioxidases activities of postharvest kiwifruits[J].Food and Fermentation Industries,2019,45(9):190-196.
[29] WANG F,DENG J,JIAO J Y,et al.The combined effects of carboxymethyl chitosan and Cryptococcus laurentii treatment on postharvest blue mold caused by Penicillium italicum in grapefruit fruit[J].Scientia Horticulturae,2019,253:35-41.
[30] 董红兵,朱蝶.不同浓度的壳聚糖对鲜切胡萝卜的保鲜效果[J].武汉商学院学报,2018,32(4):93-96.
DONG H B,ZHU D.On preservation of fresh-cut carrots with chitosan coating of different concentrations[J].Journal of Wuhan Business University,2018,32(4):93-96.
[31] 秦晓杰,高梦,蒋晓玲,等.采前喷施拮抗酵母菌对草莓采后贮藏性能的影响[J].南京农业大学学报,2015,38(1):152-160.
QIN X J,GAO M,JIANG X L,et al.Effect of preharvest spraying antagonistic yeast on the postharvest storability of strawberry[J].Journal of Nanjing Agricultural University,2015,38(1):152-160.
[32] 彭茹,张璐,曾凯芳.膜醭毕赤酵母与壳聚糖复合处理对柑橘果实防御酶及防御物质的影响[J].食品科学,2014,35(10):212-217.
PENG R,ZHANG L,ZENG K F.Effects of Pichia membranefaciens combined with chitosan on defensive enzymes and substances in citrus fruits[J].Food Science,2014,35(10):212-217.
[33] 当赖廷和,何斌源,范航清,等.重金属Cd胁迫对红树蚬的抗氧化酶、消化酶活性和MDA含量的影响[J].生态学报,2011,31(11):3 044-3 053.
DANG L T H,HE B Y,FAN H Q,et al.Effects of cadmium stress on the activities of antioxidant enzymes,digestive enzymes and the membrane lipid peroxidation of the mangrove mud clam Geloina coaxans (Gmelin)[J].Acta Ecologica Sinica,2011,31(11):3 044-3 053.
[34] 刘括,聂国朝,卢蔚莹,等.VC/壳聚糖复合涂膜对荔枝常温保鲜性能的研究[J].玉林师范学院学报,2018,39(2):49-55.
LIU K,NIE G C,LU W Y,et al.Effect of VC/chitosan composite coatings on fresh keeping property of litchi at room temperature[J].Journal of Yulin Normal University,2018,39(2):49-55.