过量活性氧诱导的氧化应激是导致细胞结构和生物分子功能损伤的重要原因[1]。近年来越来越多的研究发现许多富含生物活性物质的植物提取物表现出很强的抗氧化活性,可以缓解氧化应激[2],且它们被认为比商业合成的抗氧化剂更经济、更安全[3]。此外,含有多种植物成分的复合物可能具有更高的药用价值和/或较低的毒性[4-5]。因此,天然植物抗氧化剂作为食品添加剂、功能性食品和保健食品的潜力受到了人们的广泛关注。
青钱柳(Cyclocarya paliurus)为胡桃科、青钱柳属植物[6]。在1999年,青钱柳叶茶成为中国第一个通过美国食品药品管理局认证的保健茶[7]。因其药用价值,目前已经被列入中国新食品资源名单[8]。有研究表明,多糖是青钱柳叶的主要活性成分,具有一系列独特的生物活性,如抗氧化、免疫调节和降血糖作用等[9-10]。根据前期研究得知,青钱柳多糖粗提物可通过激活秀丽隐杆线虫(Caenorhabditis elegans,以下简称线虫)的抗氧化防御系统,从而提高抗逆性[11]。苦瓜(Momordica charantia),俗称凉瓜、癞瓜,也是一种药食同源的植物[12]。苦瓜皂苷不仅具有降血糖、调节糖脂代谢和抗肥胖的药理作用和保健价值,还具有提高免疫力、抗氧化和抗逆等作用[12]。但苦瓜独特的苦味,极大地限制了其开发利用。课题组研究发现青钱柳多糖提取物能很好地协调苦瓜皂苷提取物的苦味,基于此,课题组前期以青钱柳多糖和苦瓜皂苷提取物为原料,自主研制了一款新型复合茶——苦瓜青钱柳复合保健茶(专利申请号:CN 108935842 A)。
本研究采用线虫模型测定苦瓜青钱柳复合茶的抗氧化应激作用,分析其在不同氧化应激模型的生存率,进一步测定其对线虫抗氧化防御体系及相关基因表达的影响。研究结果为苦瓜青钱柳复合保健茶的抗氧化应激功效提供了有效的理论数据,并增加青钱柳和苦瓜的价值,也对今后研发具有高效、无毒、天然的植物类保健品有着十分重要的借鉴意义。
1 材料与方法
1.1 材料与试剂
青钱柳干叶,湖南省张家界诺康生态茶业有限公司;苦瓜干片,广州康圣药业有限公司;甜菊糖、木糖醇、柠檬酸,均为食品级,当地超市,符合GB 2760—2014要求;二氯百草枯(paraquat),美国Sigma-Aldrich有限公司;生化分析试剂盒,南京建成生物工程研究所;其他试剂均为国产分析纯。
1.2 苦瓜青钱柳复合茶的制备和涂布
原料的制备:按照先前报道的方法,制备青钱柳多糖提取物[11]和苦瓜皂苷提取物[13]的储备液。
青钱柳多糖储备液的特征:青钱柳多糖的平均分子质量主要集中在84 061.23 Da,占58%,其次是1 312.41 Da,占29%。真空冷冻干燥后,将样品重悬于超纯水中(水溶性多糖质量浓度137.46 μg/mL),并保存在-20 ℃下以获得储备液[11]。
苦瓜皂苷储备液的特征:先前的研究初步确定了苦瓜皂苷提取物中含有14种苦瓜皂苷,其中aglycone of momordicoside I、goyaglycoside d、momordicoside P和momordicine I是检测到的主要成分,储备液以25.09 mg/mL的质量浓度储存在-20 ℃(其中皂苷质量浓度为726.23 μg/mL人参皂苷Rg1当量)[13]。
保健茶储备液的制备:在初始预实验的基础上,通过单因素试验考察青钱柳多糖、苦瓜皂苷、柠檬酸和木糖醇的添加量对保健茶的感官评分以及青钱柳多糖和苦瓜皂苷的保留率的影响,并通过L9(34)正交试验进行优化。最佳工艺条件如下:体积分数10%的青钱柳多糖提取物储备液,体积分数0.1%的苦瓜皂苷提取物储备溶液,质量分数2.25%的木糖醇,质量分数0.2%的柠檬酸储备溶液和质量分数0.02%甜菊糖。其制备的茶饮具有较高的稳定性,且色泽清晰、香气宜人、酸甜可口,并具有青钱柳叶和苦瓜片的独特风味。最后,将保健茶真空浓缩至原体积的1/10制成储备液,并保存在4 ℃。
保健茶工作液的制备和涂布:保健茶储备液(实验组,Y)或灭菌纯水(对照组,CK)与大肠杆菌OP50菌液按体积比为1∶9的比例混合,涂布于线虫生长培养基上。
1.3 线虫培养
野生型秀丽隐杆线虫(the Bristol strain N2),雌雄同体,北京市生命科学研究院惠赠;TK22 [mev-1 (kn1) III]突变体线虫,秀丽隐杆线虫遗传学中心;大肠杆菌OP50,周庆华教授(暨南大学生物医学转化研究所)惠赠。参考文献[14]的方案,采用高氯酸钠裂解法对线虫进行同期化处理。
1.4 实验方法
1.4.1 H2O2诱导的氧化应激试验
H2O2诱导的氧化应激试验操作参考文献[11]的方案,挑取60只处理3 d的线虫暴露于0.1%体积分数为30%的H2O2诱导的氧化应激压力下。每隔30 min记录线虫生存、死亡数,直至线虫全部死亡。
1.4.2 百草枯诱导的氧化应激试验
百草枯诱导的氧化应激实验操作参考文献[11]的方案,挑取60只处理3 d的线虫转移至补充了10 mmol/L百草枯的药物/对照线虫生长培养基中,每隔24 h记录生存、死亡数,直至线虫全部死亡。
1.4.3 抗氧化酶或非酶活性测定
按照之前的方案[15],根据试剂盒提供的说明书进行测定,结果通过蛋白质浓度标准化。
1.4.4 关键抗逆/抗氧化基因表达分析
实时荧光定量聚合酶链式反应(quantitative real time,polymerase chain reaction, qRT-PCR)的操作参考文献[14]。引物如附表4所示,act-1为内参基因,使用2-ΔΔCt法对表达基因进行相对定量。
1.4.5 繁殖力测定
繁殖力通过产卵量、后代数和孵化率来综合评价[13]。在产卵期每隔24 h将10条L4期幼虫转移至新平板中直至线虫停止产卵,每组产卵的总数被认为是产卵量,孵出的后代数量是后代数,孵化率是后代数与产卵量的比值。
1.4.6 生长率测定
同期化的卵在20℃孵化48h后,对每个发育阶段的线虫数量进行计数[13]。
1.4.7 移动力测定
参考文献[16]的方法记录移动力。Ⅰ:线虫不需经触碰刺激可自发运动;Ⅱ:线虫必须受到触碰刺激才可运动;Ⅲ:线虫在受到触碰刺激之后只能摆动头或尾。
1.5 数据处理
所有实验均至少重复3次,结果以平均数±标准差表示,并通过SPSS 16.0软件采用单因素方差分析法进行显著性分析,P<0.05为显著差异。其中,生存曲线使用GraphPad(Windows 5.00版)软件进行log-rank检验分析显著性。
2 结果与分析
2.1 对线虫抗氧化应激性的影响
2.1.1 对野生型N2线虫抗氧化应激性的影响
在H2O2急性氧化胁迫下,复合茶处理使线虫生存曲线发生显著右移(图1-a),线虫的平均寿命提高了11%,中位寿命和最大寿命分别提高了15%和20%(表1)。同时,在百草枯诱导的氧化胁迫下也发现类似的保护作用,平均存活时间比未经处理的显著增加了25%(图1-b和表1)。
2.1.2 对突变体TK22线虫抗氧化应激性的影响
为进一步测定复合茶对氧化损伤的防御作用,利用对氧化应激敏感的TK22 [mev-1 (kn1) III]突变体进行了H2O2诱导的氧化应激存活分析[17]。与对照组相比,经过复合茶培养的TK22突变体不仅生存曲线发生显著右移(图2),而且平均寿命、中位寿命和最大寿命都得到显著延长(表1)。综上,复合茶具有提高线虫的抗氧化应激的潜力。

a-H2O2诱导;b-百草枯诱导
图1 氧化胁迫下野生型N2的存活曲线
Fig.1 Survival curve of wild type N2 under oxidative stress
注:寿命曲线中*表示差异显著(*为P< 0.05,**为P < 0.01
和***为P < 0.001)(下同)
表1 不同处理条件下线虫存活时间
Table 1 Survival time of C.elegans under
different treatments
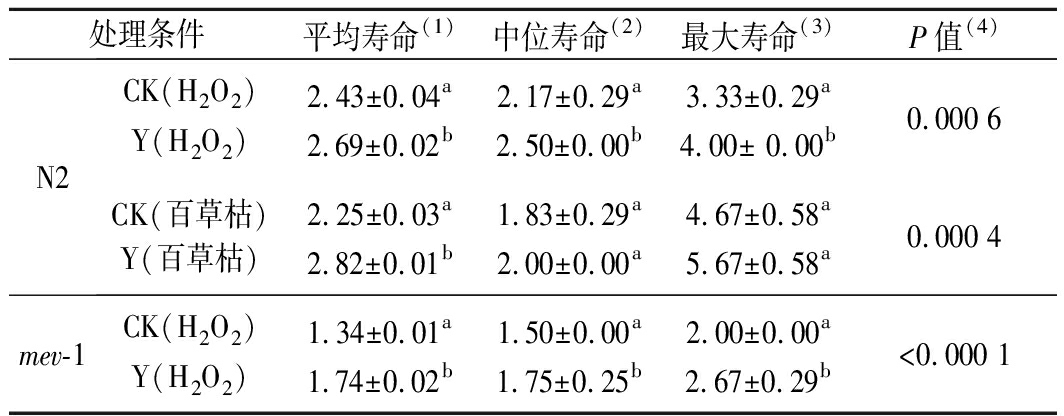
处理条件平均寿命(1)中位寿命(2)最大寿命(3)P值(4)N2CK(H2O2)Y(H2O2)2.43±0.04a2.69±0.02b2.17±0.29a2.50±0.00b3.33±0.29a4.00± 0.00b0.000 6CK(百草枯)Y(百草枯)2.25±0.03a2.82±0.01b1.83±0.29a2.00±0.00a4.67±0.58a5.67±0.58a0.000 4mev-1CK(H2O2)Y(H2O2)1.34±0.01a1.74±0.02b1.50±0.00a1.75±0.25b2.00±0.00a2.67±0.29b<0.000 1
注:(1)平均寿命![]() 其中j生存时间(d),dj是在年龄间隔(xj,xj+1)内死亡的线虫数量,n是线虫总数。
其中j生存时间(d),dj是在年龄间隔(xj,xj+1)内死亡的线虫数量,n是线虫总数。
(2)中位寿命是指存活率等于50%的时间。
(3)最大寿命是指存活率等于0%的时间。
(4)不同字母表示差异显著(P<0.05)(下同)
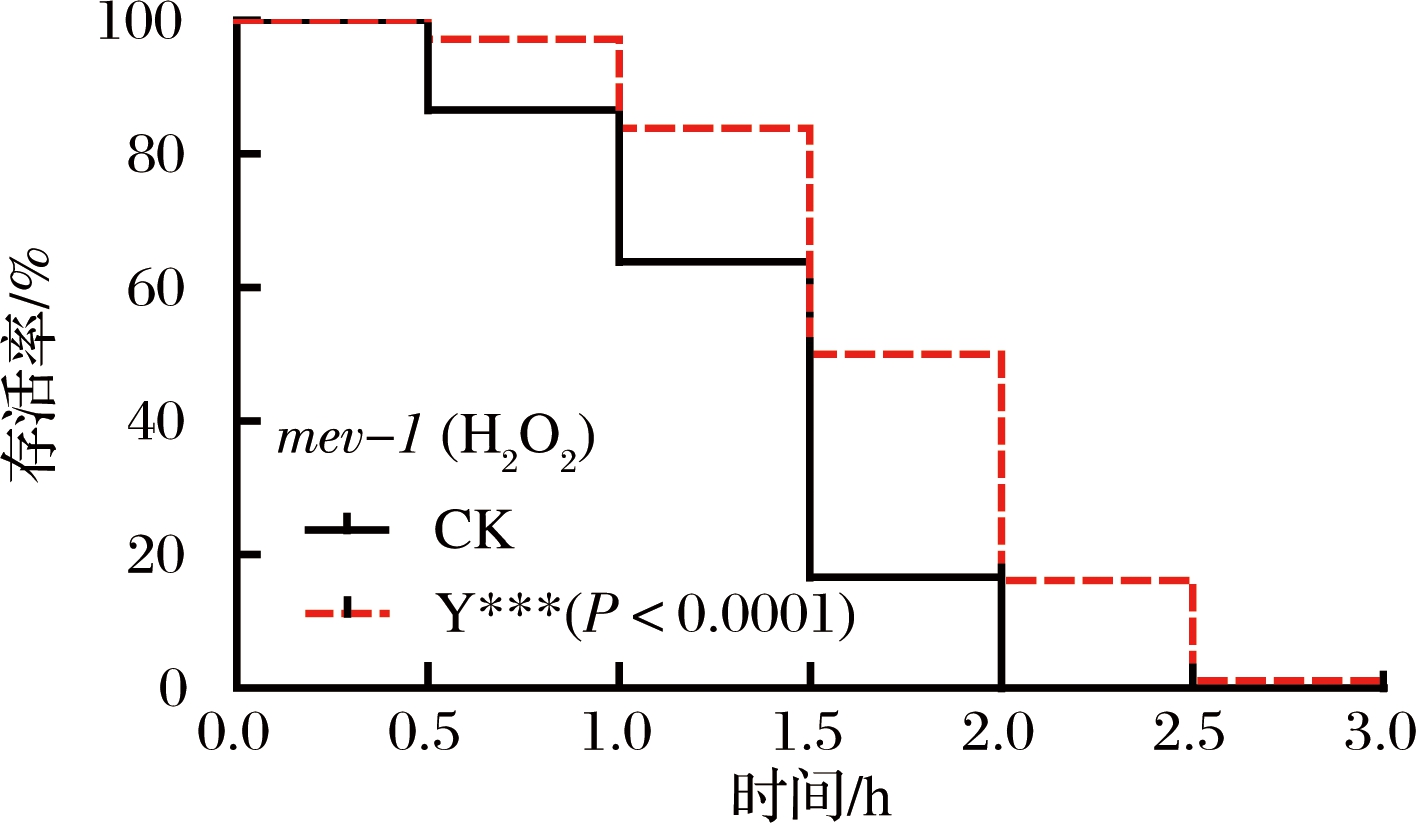
图2 H2O2诱导的氧化胁迫下突变体TK22的存活曲线
Fig.2 Survival curve of mutant TK22 under H2O2-induced oxidative stress
2.2 对线虫抗氧化防御体系的影响
2.2.1 对线虫抗氧化酶防御体系的影响
作为机体抗氧化能力的重要组成部分,抗氧化防御系统也得到了进一步的研究[18]。由图3可知,在抗氧化防御体系方面,复合茶处理组的线虫在培养96 h后,其超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)的酶活力均得到显著提高,分别增加了28%、106%和78%。
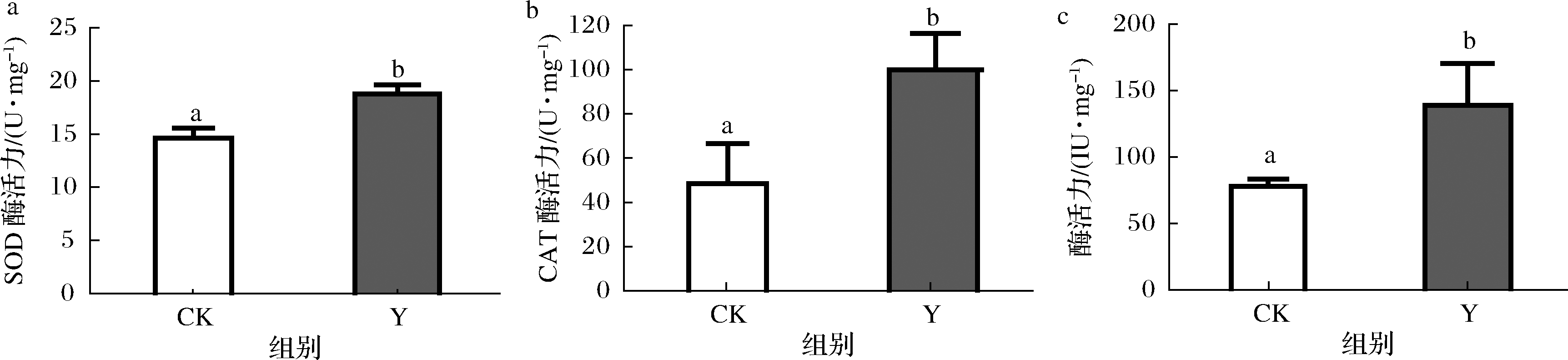
a-对线虫SOD酶活力的影响; b-对线虫CAT酶活力的影响; c-对线虫GSH-Px酶活力的影响
图3 对线虫抗氧化酶防御系统的影响
Fig.3 Effect of health tea on the antioxidant enzyme defense system in C.elegans
2.2.1 对线虫抗氧化非酶防御体系的影响
在抗氧化非酶系统方面,线虫培养96 h后,复合茶处理组的GSH含量显著增加33%(图4-a),氧化性谷胱甘肽(glutathione oxidized,GSSG)水平显著降低了44%(图4-b)。如图4-c所示,作为氧化应激的动态指标——GSH/GSSG的比值从30.57显著增加到72.83,与对照组相比显著提高了1.38倍,这与GSH-Px的水平被复合茶显著提高的结果相符,结果表明复合茶可能具有激活线虫抗氧化防御系统的潜力。
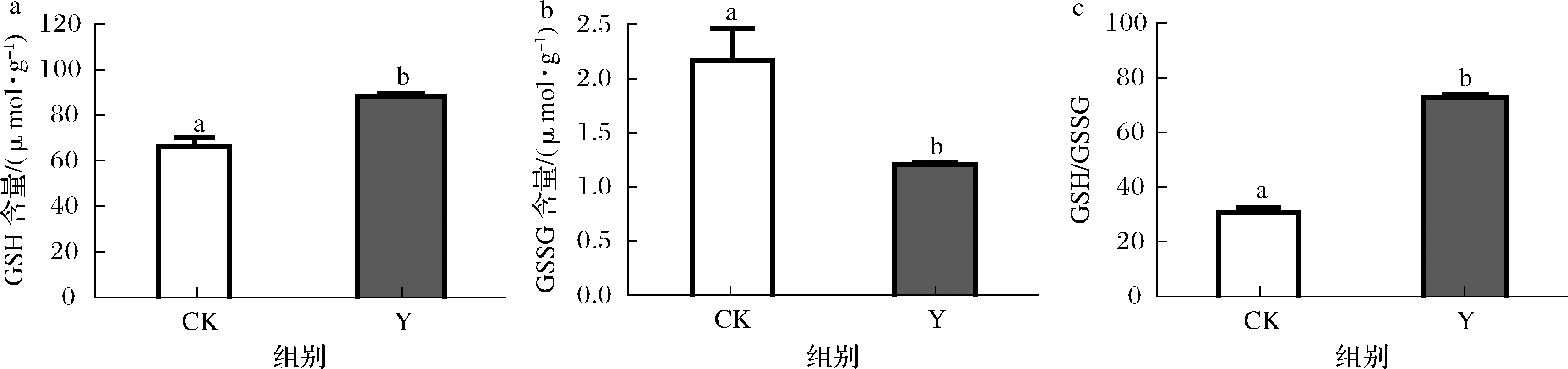
a-GSH含量; b-GSSG含量; c-GSH/GSSG的比例
图4 对线虫抗氧化非酶防御系统的影响
Fig.4 Effect of health tea on the antioxidant nonenzyme defense system in C.elegans
2.3 对线虫关键抗氧化和抗逆基因表达的影响
已知在线虫中鉴定了许多调控氧化应激反应的遗传因子和通路途径[19],因此通过qRT-PCR来定量一些对调节氧化应激反应起着关键作用的抗逆和抗氧化基因的表达水平。如图5所示,与对照组相比,复合茶处理后超氧化物歧化酶基因(sod-3和sod-5)和过氧化氢酶基因(ctl-1和ctl-2)、热激蛋白基因(hsp-16.1和hsp-16.2)的表达量显著升高,因此复合茶增强线虫抗氧化应激能力可能与促进抗氧化酶和抗逆基因的表达有关。
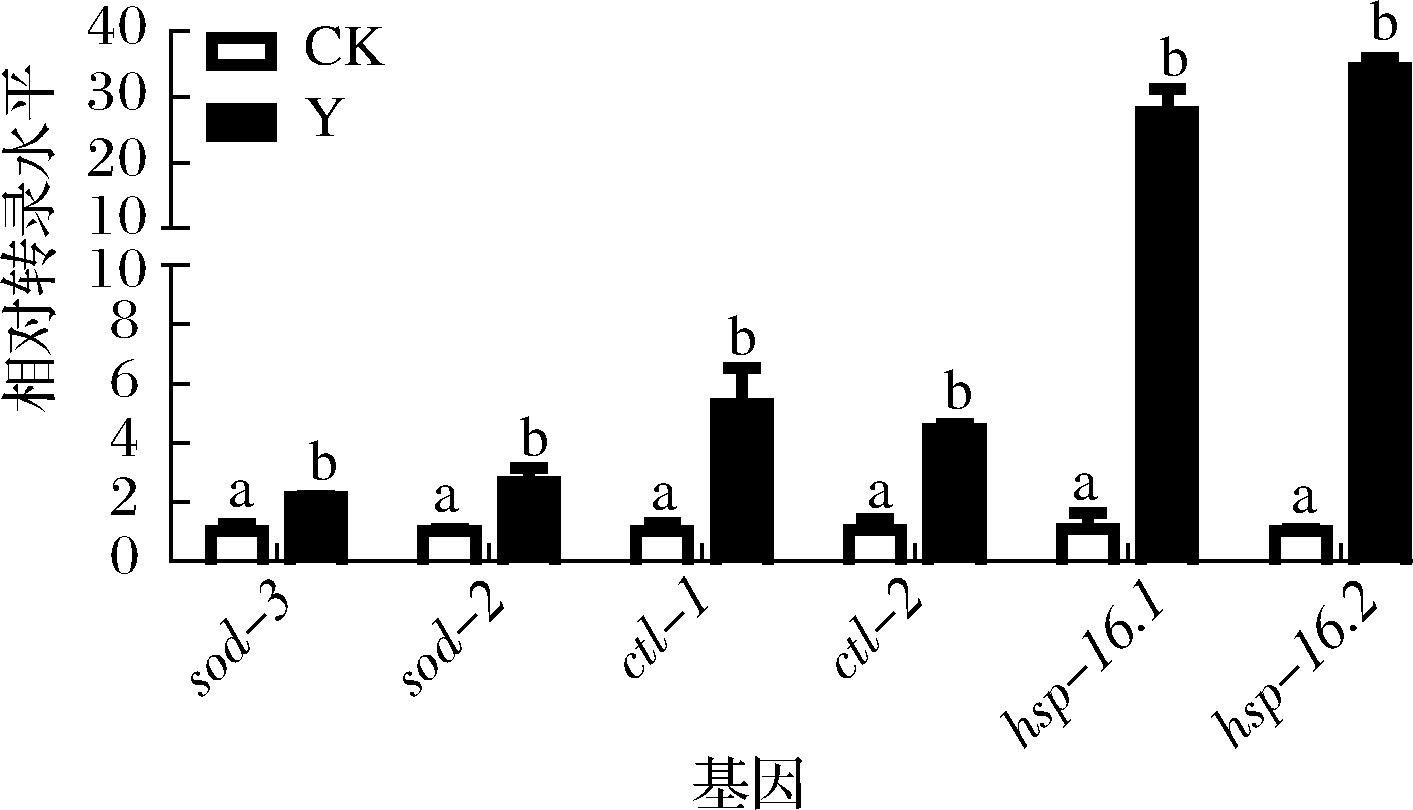
图5 对线虫关键抗氧化和抗逆基因表达的影响
Fig.5 Effects of health tea on the expression of key antioxidant and stress resistant genes in C.elegans
2.4 对线虫生理功能的影响
2.4.1 对线虫繁殖的影响
如图6所示,与对照组相比,线虫的总产卵量、总后代数以及孵化率均没有明显的变化。复合茶处理的线虫的第1天产卵量和后代数被显著提高,而第3天产卵量和后代数被显著抑制,原因可能是保健茶具有促进母体线虫卵细胞的释放的潜力,从而减少卵细胞在子宫内的滞留(图6-a, 6-b)。考虑到总繁殖力没有显著变化,认为复合茶不会损害线虫的繁殖力。
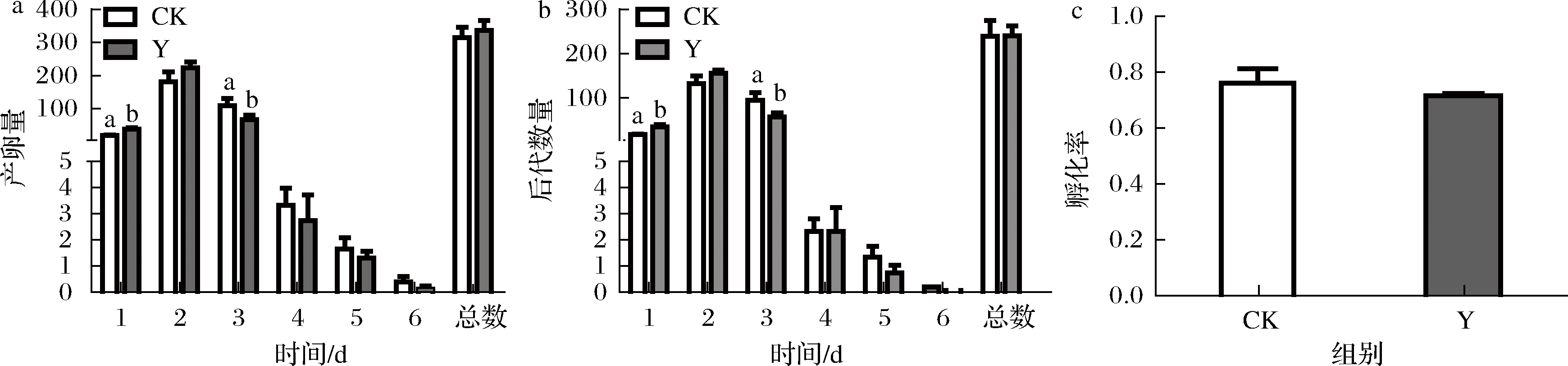
a-线虫产卵量;b-线虫后代数量;c-线虫孵化率
图6 对线虫繁殖力的影响
Fig.6 Effects of health tea on the fecundity in C.elegans
2.4.2 对线虫发育的影响
为了进一步探究复合茶是否会影响线虫的生理功能,从发育的角度进行了初步评价。如图7所示,同步化的卵经48 h孵化后,80%~84%的线虫处于L4期,6%~8%达到L2/L3期,11~12%达到成虫期。而经复合茶处理后,线虫的发育情况并无明显差异。
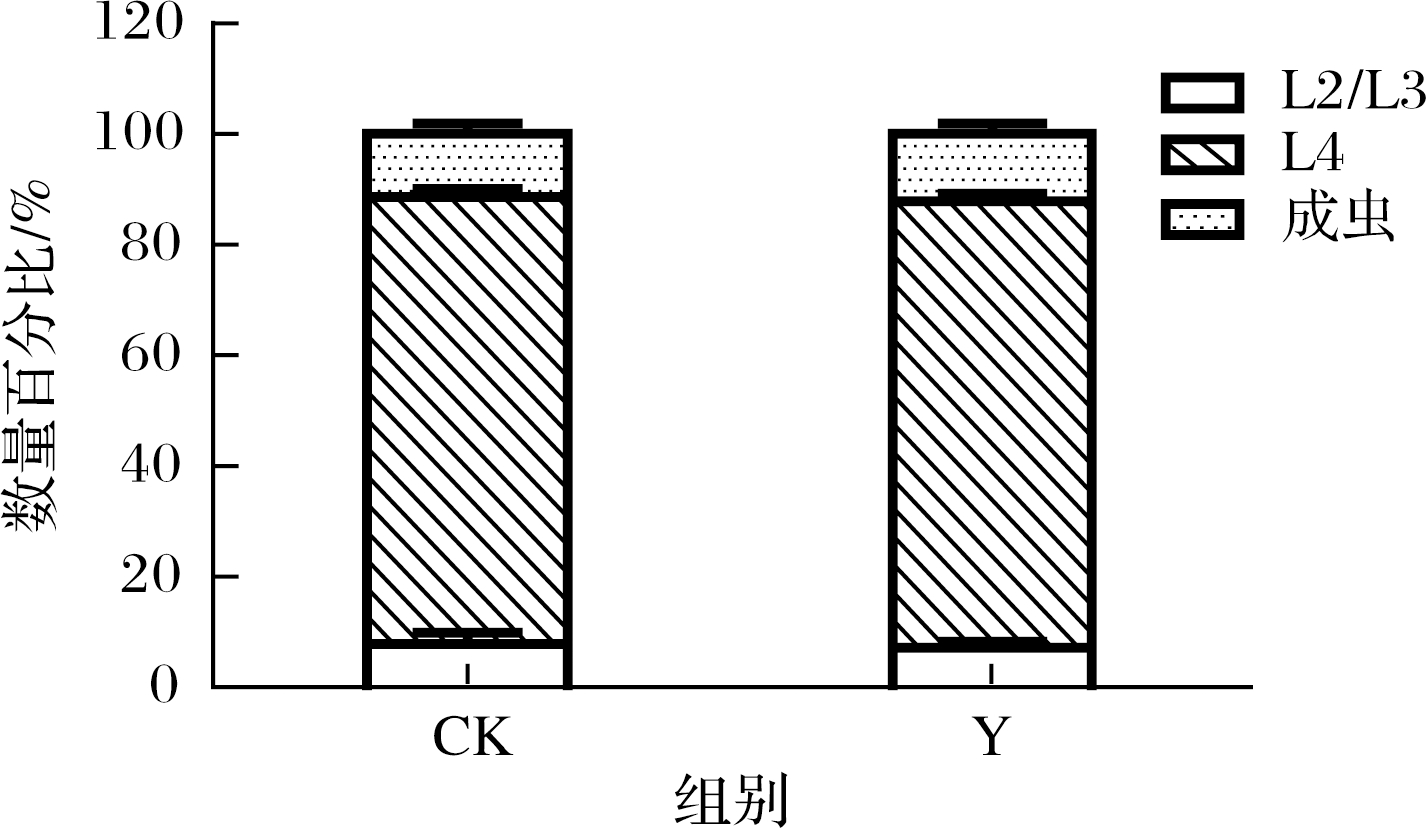
图7 对线虫发育的影响
Fig.7 Effects of health tea on the development in C.elegans
2.4.3 对线虫移动力的影响
线虫的衰老伴随着移动能力及对外界机械刺激反应的退化[20]。如图8所示,复合茶能明显提高线虫移动能力,在后期(第11天)尤其显著。
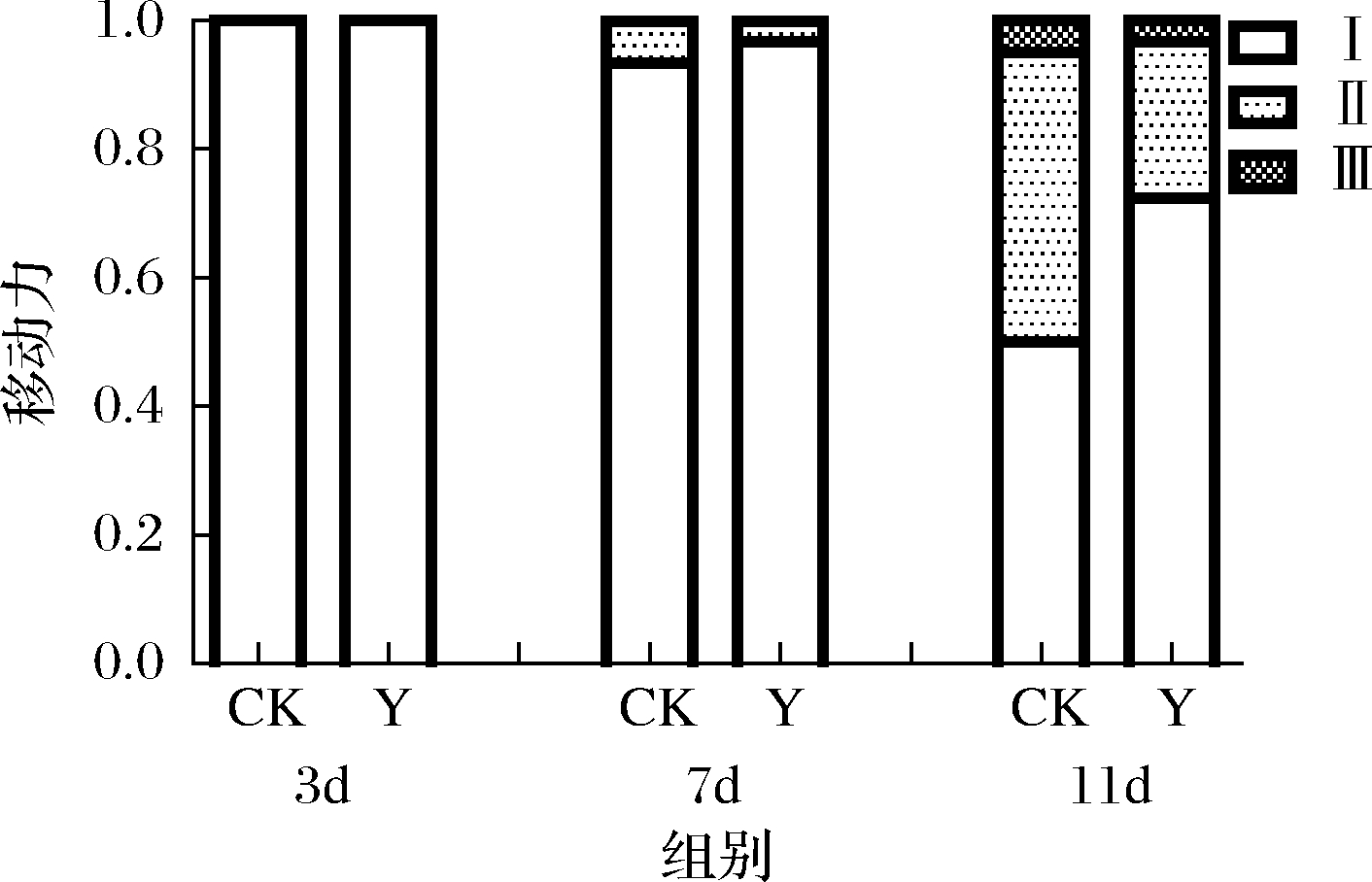
图8 对线虫移动力的影响
Fig.8 Effects of health tea on the locomotivity in C.elegans
综上,苦瓜青钱柳复合茶可以防止氧化应激的益处可能与其主要成分青钱柳多糖和苦瓜皂苷相关。据报道,苦瓜和青钱柳叶具有促进健康的潜力且是多功能的,具有多种生物活性,包括减肥、抗氧化、神经保护、抗糖尿病、抗癌、降压、抗菌、抗高脂血症和抗炎等体外和体内活性[21-22]。研究表明,苦瓜皂苷和青钱柳多糖分别是苦瓜和青钱柳叶中的主要活性成分[23-24]。青钱柳多糖也被证实可以保护氧化应激环境下的线虫[11],关于苦瓜皂苷对氧化应激下的线虫提供的保护作用仍在研究中。因此,苦瓜青钱柳复合茶是一种富有前景的创新功能饮料。
3 结论
本研究利用秀丽隐杆线虫模型探究一款自主研发的苦瓜青钱柳复合茶的抗氧化胁迫作用,结果表明,该复合茶具有优秀的抗氧化胁迫保护潜力且不影响线虫的基本生理功能。进一步探究线虫的抗氧化防御体系,发现其介导的抗氧化应激作用可能与上调抗氧化和抗逆相关基因的表达,从而激活机体抗氧化酶和非酶活性有关。总之,该复合茶具有用于预防氧化应激相关疾病的前景。同时,本研究也为今后以苦瓜皂苷和青钱柳多糖作为一种潜在的功能性配方开发更多具有健康益处的创新产品奠定了基础。
[1] AUTEN R L,DAVIS J M.Oxygen toxicity and reactive oxygen species:The devil is in the details[J].Pediatric Research,2009,66(2):121-127.
[2] LOIZZO M R,TUNDIS R.Plant antioxidant for application in food and nutraceutical industries[J].Antioxidants,2019,8(10):453.
[3] SHAHIDI F.Antioxidants in food and food antioxidants[J].Food / Nahrung,2000,44(3):158-163.
[4] 赵奎君, 李卓明,陈小莺,等.从当归补血汤的研究探讨和分析中药复方共煎的合理性[J].世界科学技术-中医药现代化,2009,11(2):294-298.
ZHAO K J,LI Z M,CHEN X Y,et al.The rationality of mixed preparation of traditional herbal decoction:From the perspective of Danggui Buxue Tang[J].Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology,2009,11(2):294-298.
[5] EBUEHI O A T,ERUKAINURE O L,ADIONE R,et al.A novel herbal beverage from Moringa oleifera,Dennettia tripetala,and Citrus sinensis abates Bonny light crude oil-induced oxidative injury in rat brain and liver[J].Comparative Clinical Pathology,2018,3(27):699-704.
[6] XIE J H,XIE M Y,NIE S P,et al.Isolation,chemical composition and antioxidant activities of a water-soluble polysaccharide from Cyclocarya paliurus (Batal.) Iljinskaja[J].Food Chemistry,2010,119(4):1 626-1 632.
[7] 徐庆, 宋芸娟.青钱柳的研究概况[J].华夏医学,2004,17(3):451-453.
XU Q,SONG Y J.Research status on Cyclocarya paliurus[J].Acta Medicinae Sinica,2004,17(3):451-453.
[8] 刘同方, 于燕波,李淑娟,等.新资源食品提取物辅助降血糖配方的确定[J].食品科学技术学报,2019,37(4):78-83.
LIU T F,YU Y B,LIU S J,et al.Determination of hypoglycemic formula assisted by new resources food extracts[J].Journal of Food Science and Technology,2019,37(4):78-83.
[9] LIU X,XIE J H,JIA S,et al.Immunomodulatory effects of an acetylated, Cyclocarya paliurus,polysaccharide on murine macrophages RAW264.7[J].International Journal of Biological Macromolecules, 2017,98:576-581.
[10] WANG Q Q,JIANG C H,FANG S Z,et al.Antihyperglycemic,antihyperlipidemic and antioxidant effects of ethanol and aqueous extracts of Cyclocarya paliurus leaves in type 2 diabetic rats[J].Journal of Ethnopharmacology,2013,150(3):1 119-1 127.
[11] LIN C X,SU Z X,LUO J,et al.Polysaccharide extracted from the leaves of Cyclocarya paliurus (Batal.) Iljinskaja enhanced stress resistance in Caenorhabditis elegans via skn-1 and hsf-1[J].International Journal of Biological Macromolecules,2020,143:243-254.
[12] GROVER J K,YADAV S P.Pharmacological actions and potential uses of Momordica charantia:A review[J].Journal of Ethnopharmacology,2004,93(1):123-132.
[13] LIN C X,LIN Y Z,CHEN Y,et al.Effects of Momordica saponin extract on alleviating fat accumulation in Caenorhabditis elegans[J].Food & Function,2019,10(1):3 237-3 251.
[14] LIN C X,ZHANG X Y,XIAO J,et al.Effects on longevity extension and mechanism of action of carnosic acid in Caenorhabditis elegans[J].Food & Function,2019,10(3):1 398-1 410.
[15] LIN C X,XIAO J,XI Y,et al.Rosmarinic acid improved antioxidant properties and healthspan via the IIS and MAPK pathways in Caenorhabditis elegans[J].BioFactors,2019,45(5):774-787.
[16] HERNDON L A,SCHMEISSNER P J,DUDARONEK J M,et al.Stochastic and genetic factors influence tissue-specific decline in ageing C.elegans[J].Nature,2002,419(6 909):808-814.
[17] HARTMAN P S,ISHII N,KAYSER E,et al.Mitochondrial mutations differentially affect aging,mutability and anesthetic sensitivity in Caenorhabditis elegans[J].Mechanisms of Ageing and Development,2001,122(11):1 187-1 201.
[18] FINKEL T,HOLBROOK N J.Oxidants,oxidative stress and the biology of ageing[J].Nature,2000,408(6 809):239-247.
[19] WILSON M A,SHUKITT-HALE B,KALT W,et al.Blueberry polyphenols increase lifespan and thermotolerance in Caenorhabditis elegans[J].Aging Cell,2006,5(1):59-68.
[20] HUANG C, XIONG C J,KORNFELD K.Measurements of age-related changes of physiological processes that predict lifespan of Caenorhabditis elegans[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(21):8 084-8 089.
[21] WANG S,LI Z,YANG G,et al.Momordica charantia:A popular health-promoting vegetable with multifunctionality[J].Food Function,2017,8(5):1 749-1 762.
[22] LI Q,HU J,XIE J,et al.Isolation,structure,and bioactivities of polysaccharides from Cyclocarya paliurus (Batal.) Iljinskaja[J].Annals of the New York Academy of Sciences,2017,1 398(1):20-29.
[23] XIE J H,XIE M Y,SHEN M Y,et al.Optimisation of microwave-assisted extraction of polysaccharides from Cyclocarya paliurus (Batal.) Iljinskaja using response surface methodology[J].Journal of the Science of Food and Agriculture,2010,90(8):1 353-1 360.
[24] WU S B,YUE G G,TO M H,et al.Transport in Caco-2 cell monolayers of antidiabetic cucurbitane triterpenoids from Momordica charantia fruits[J].Planta Medica,2014,80(11):907-911.