γ-氨基丁酸(γ-aminobutyric acid,GABA),也称γ-氨酪酸,分子式为C4H9NO2,相对分子质量为103.12,由谷氨酸(glutamic acid,Glu)经谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)催化而来。GABA作为一种抑制性神经递质在神经系统中发挥重要作用,如与GABA-A受体结合可以扩张血管降低血压[1];可以增加神经元细胞膜对Cl-的通透性,引起细胞超极化,产生突触后抑制效应,达到镇静神经的效果。GABA通过促进GABA神经递质的释放,增加GABA能神经元细胞数目,缓解因GABA神经元细胞减少导致的小鼠抑郁[2]。此外,GABA还可以调节β-淀粉样蛋白相关的功能活性,缓和阿尔兹海默症[3]。近来发现GABA还具有抑制肿瘤细胞增殖、改善脑血栓、降低1型糖尿病等功能[4]。尽管GABA具有诸多功能性,但是人体内GABA含量会随着人的年龄以及外界环境压力的增加而日益减少,因此在日常饮食中补充GABA对改善人体健康具有重要意义。
食品中的GABA可通过食品原料富集和外源添加2种方式强化。食品原料富集是指对含有GABA的食用性植物原料通过胁迫处理增加其体内GABA合成量,即植物源富集法。外源添加分为微生物合成法和化学合成法。微生物合成法包括直接发酵生产法和全细胞转化法。化学合成法是以吡咯烷酮、丁内酯、氯化亚砜等为原料通过化学反应开环制得GABA。但是由于化学法存在成本因素限制、副反应多及环境污染等局限性,因此目前主要通过绿色、安全的植物源富集法和微生物合成法制备GABA。随着科技的发展,近来新兴非加热技术在植物源GABA富集方面也表现出较好的应用前景。本文简要概述了GABA的生物合成机制,对GABA制备方法及其功能性食品的开发现状进行了综述,并对其未来研究开发方向进行了展望。
1 植物源GABA合成机制及富集方法
GABA广泛分布于小麦、大豆、发芽糙米等多种植物中,但含量较低。通常植物受到外界因素刺激时,机体启动自我防御机制,体内GABA水平增加,以利于植物适应外界环境变化,因此可以通过胁迫的方式提高植物原料中GABA的水平。
1.1 植物富集GABA的内在机制
高等植物中GABA的富集主要包括2条途径(如图1所示)[5],第一条是植物体内GAD催化L-谷氨酸生成GABA,生成的GABA经GABA转氨酶(GABA transaminase,GABA-T)、琥珀酸半醛脱氢酶(succinate semialdehyde dehydrogenase,SSADH)催化生成进入TCA循环的琥珀酸半醛(succinate semialdehyde,SSA)、琥珀酸,这些反应和GAD催化反应一起构成GABA支路。其中,GAD、GABA-T和SSADH是该途经重要的调控酶,激活GAD或抑制GABA-T、SSADH可提高GABA富集量。目前的研究多通过激活GAD富集GABA。第二条途径是由二胺氧化酶(diamine oxidase,DAO)和多胺氧化酶(polyamine oxidase,PAO)降解多胺中间产物(腐胺、亚精胺)生成,与第一条途经相比,该途径生成GABA较少,不是GABA富集生产的主要途径。
高等植物体在生长过程中通过合成GABA来抵御盐碱胁迫、缺氧、机械刺激等逆境环境。比如盐胁迫下植物体GAD 活性提高,GABA含量显著增加以适应胁迫。缺氧和机械刺激导致植物体胞内H+积累,胞内pH降低,激活GAD促进植物体GABA的合成;同时该GABA合成过程消耗了增加的质子,因此能够发挥稳定植物细胞内pH的作用。由此可见,在植物生长过程中逆境环境会胁迫体内合成GABA。
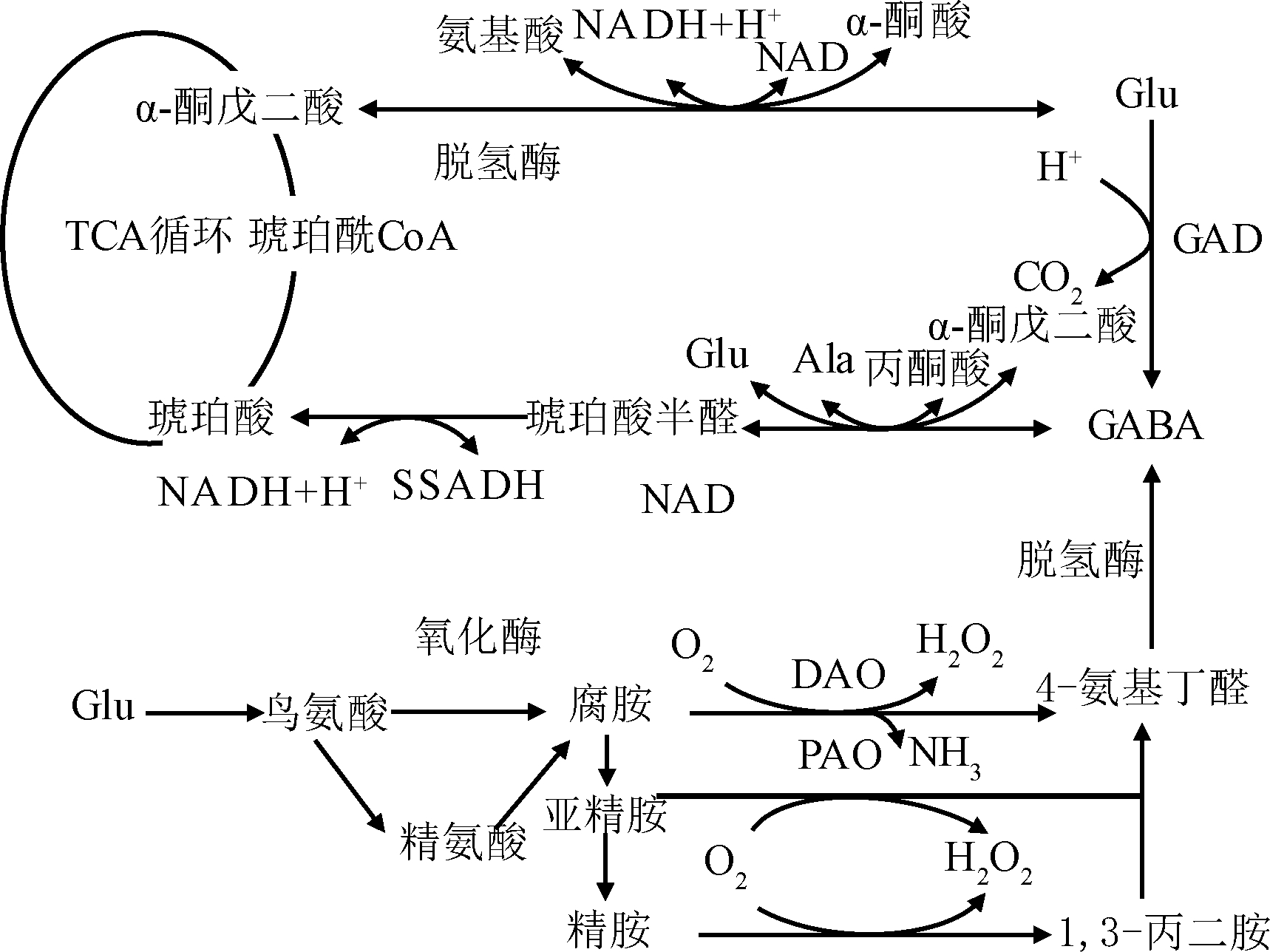
图1 GABA支路及多胺降解生成GABA途径
Fig.1 The pathway of GABA formation by GABA branch and polyamine degradation
1.2 植物种子发芽胁迫法富集GABA
植物体内的GABA本身含量较低,但经浸泡发芽处理后GAD、蛋白酶等内源酶被激活,因此GABA得到富集。谷类种子如糙米、小麦、荞麦等,豆类中大豆、绿豆、蚕豆等都可用于发芽富集GABA。适宜的温度、时间浸泡发芽处理可以激活种子中的蛋白酶促进蛋白质分解增加Glu含量,Glu进一步由激活的GAD催化生成GABA。SOMBOON等[6]在35 ℃浸泡3 h籼稻糙米再使其发芽21 h,GABA含量达(44.89±7.81) mg/100 g,是不发芽组的15.5倍。WANG等[7]发现,25 ℃浸泡6 h的小麦在发芽12 h时GABA增加了50.7%。TRUONG等[8]测得35 ℃浸泡8 h的绿豆发芽12 h后,GABA含量约为108 mg/100 g,显著高于原绿豆中GABA含量。XU等[9]在25 ℃浸泡大豆Jindou 25 5 h后,于19、25和32 ℃ 3个不同温度下萌发102 h,测其GAD活力均增加,其中以32 ℃增加2.45倍最为显著,相应的GABA含量增加6.97倍,为(23.82±0.82) mg/100 g。此外,CHEN等[10]发现浸泡发芽处理绿豆中GABA的富集还与激活的多胺氧化酶转化多胺生成GABA有关。利用植物种子发芽富集GABA方法简单、绿色安全,可作为富含GABA的植物性食品原料用于功能性食品的加工。
逆境胁迫会刺激植物体内H+和Ca2+增加,从而激活GAD促进GABA的积累[5]。如低氧条件下植物电子传递链受阻,糖类物质经糖酵解途径大量生成丙酮酸,进而积累乙醇和乳酸,导致细胞质酸化[11]。高盐浓度逆境条件增加细胞渗透压导致植物细胞膜流动性改变,引发一系列磷酸化反应并激活Ca2+通道,导致大量Ca2+释放到细胞质中。而发芽胁迫法将发芽与胁迫处理相结合(图2),进一步促进了GAD的表达,为利用植物种子富集GABA提供了很好的思路(表1)。
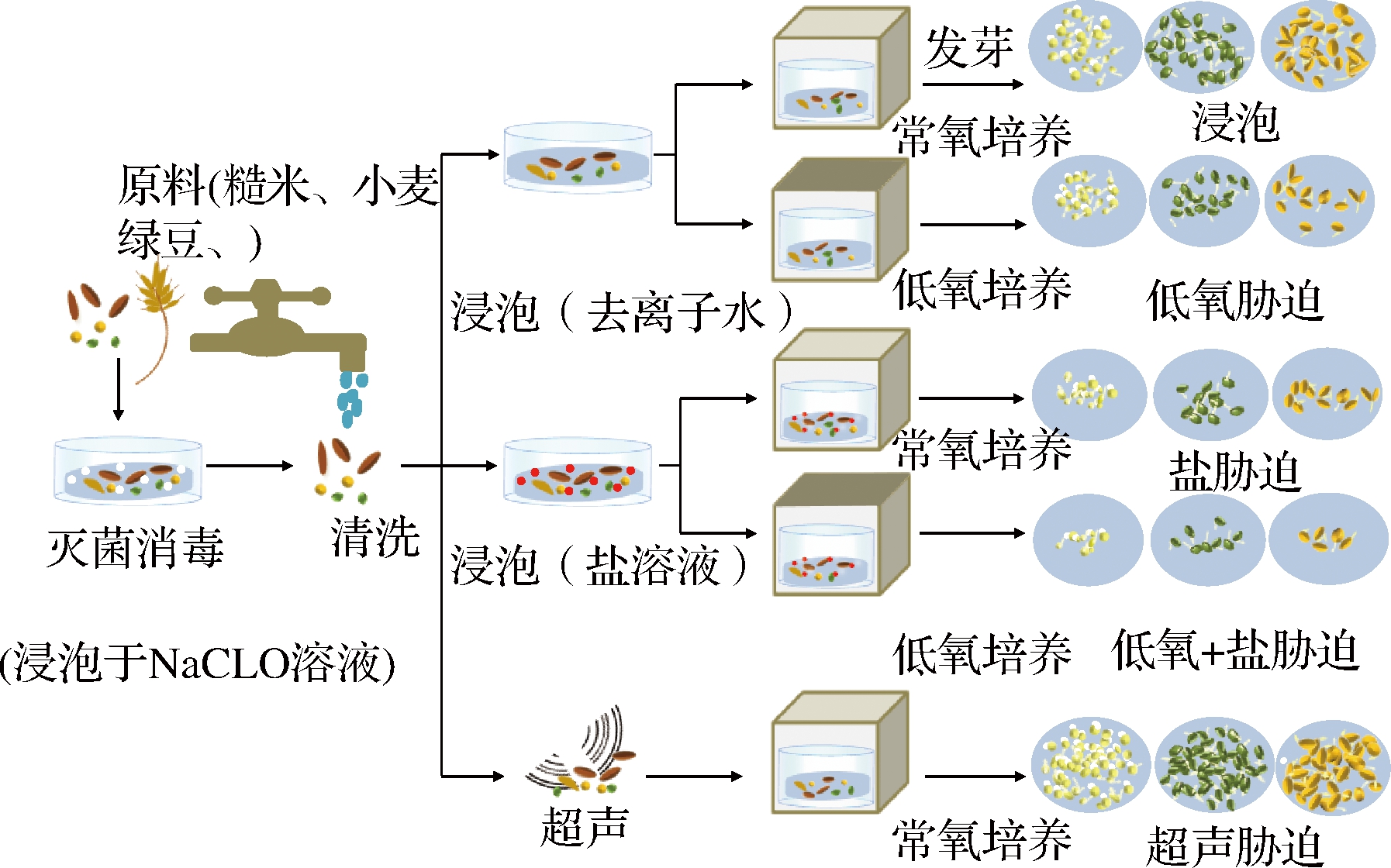
图2 不同胁迫种子发芽方式
Fig.2 Different ways of seed germination under different stress
表1 GABA植物源富集法
Table 1 Enrichment of GABA in plant materials

植物原料富集方式富集条件胁迫方式GABA含量/(mg/100 g)参考文献小麦发芽处理25 ℃氧质量浓度为5.5 mg/L暗水培养箱中培养12 h低氧胁迫268±12 [7]小麦发芽处理(28±2) ℃、相对湿度(95±3)%萌发72 h、超声30 min超声波胁迫64.98±2.13[21]糙米发芽处理35 mmol/L的Ca2+溶液中浸泡发芽21 h、1.5 L/min的通气量通气9 h,共发芽30 h通气、金属离子胁迫28.18[15]糙米发芽处理37 ℃、100%湿度下发芽36 h、100 MPa、10 min高压胁迫12.82 [16]糙米发芽处理NaCl浓度7.5 mmol/L,Ca2+浓度为15.0 mmol/L,29 ℃发芽2.3 d盐胁迫144.98 [25]小米发芽处理35 ℃浸泡13 h、CaCl2浓度3.5 mmol/L、31 ℃发芽48 h 浸泡、盐胁迫251.46 [26]小米发芽处理NaCl浓度100 mol/L、Ca2+浓度5.0 mmol/L的黑暗培养箱中(25±1)℃培养48 h盐胁迫31.92[27]绿豆发芽处理有盖的暗培养箱中25 ℃发芽5 d、NaCl 30 mmol/L、VB6 70 mol/L、CaCl2 10 mmol/L低氧、盐胁迫30.24[10]绿豆发芽处理35 ℃浸泡8 h、真空包装塑料袋中35 ℃发芽12 h浸泡、低氧胁迫151.91±1.96 [8]大豆发芽处理30 ℃黑暗条件发芽5 d、25 ℃ 300 W超声30 min浸泡、超声波胁迫119.29 [28]黑米发芽处理0.5 mmol/L CaCl2浸泡24 h、22 ℃培养4 d盐胁迫12.32 [29]米糠发芽处理N2处理,置于暗处塑料袋中40 ℃培养8 h低氧胁迫171.50[12]苦荞发芽处理NaCl浓度34 mmol/L、31 ℃发芽5 d盐胁迫25.01 [13]
WANG等[7]探究了低氧对发芽小麦GABA含量的影响,发现经低氧处理后小麦中GABA增加88.73%。OH等[12]在40 ℃厌氧条件下培养8 h浸湿的米糠,GABA含量从10.7 mg/100 g增加到171.5 mg/100 g,进一步添加谷氨酸、辅酶后,GABA的积累量达最大值2 242 mg/100 g。朱云辉等[13]用盐胁迫发芽苦荞来富集GABA,在NaCl浓度为34 mmol/L条件下,苦荞中GABA富集量达25.01 mg/100 g,是未发芽胁迫的2.47倍。此外研究表明,采用2种或2种以上胁迫方式比单一胁迫富集GABA更有效。尹永祺等[14]探究了低温联合低氧胁迫对发芽玉米籽粒中GABA含量的影响,发现玉米籽粒经低氧胁迫发芽72 h后,在-18 ℃冷冻6 h和25 ℃回温4 h条件下,GABA含量达152 mg/100 g,增加29.9倍。张颖等[15]将通气胁迫、Ca2+胁迫结合处理发芽糙米,在35 mmol/L的Ca2+溶液中浸泡糙米使其发芽21 h,然后以1.5 L/min的通气量通气9 h,最终糙米GABA含量28.18 mg/100 g,比正常发芽的样品提高了64.42%。
1.3 新兴胁迫技术促进植物源GABA富集
新兴的非热加工技术(如高静压、超声波、电解水、等离子体)因可激活植物组织中的酶增加GABA含量,同时具有冷加工可灭活微生物但不会对热敏性物质产生破坏作用的特点,在植物源GABA富集方面具有独特优势。低于400 MPa的高静压可以增强GAD和蛋白酶的活性。如XIA等[16]采用100 MPa高压条件处理发芽糙米10 min后,GABA含量从9.30 mg/100 g增加到12.82 mg/100 g。SHIGEAKI等[17]以200 MPa的压力处理大豆,贮存3 d时测其GABA量是未经高压处理组的1.35倍。UENO等[18]发现,浸泡15 h的大豆在200 MPa处理10 min时GABA生成速率为21 μmol/(g·min),而在300 MPa处理相同时间时为74 μmol/(g·min),表明在300 MPa处理10 min的压力-时间组合下GABA产量更高。超声波可以通过降解发芽糙米细胞壁周围物质增加细胞内Ca2+和H+浓度有效激活GAD[19]。张祎等[20]利用超声波处理发芽糙米富集GABA时发现,样品以30 kHz频率处理15 min时GABA积累量达到最大,而增加频率GABA含量下降,表明在相同时间处理情况下低频超声波处理对GABA的积累优于高频。DING等[21]以25 kHz的频率超声波处理30 min发芽小麦GABA含量增加了30.69%。电解水作为一种胁迫处理不仅可以提高GAD的活性,在促进谷物发芽方面还可以发挥抑菌防霉作用,且制备方便成本低廉,因此在富集GABA方面受到关注。HAO等[22]发现微酸性电解水(有效氯含量20.3 mg/L)可使得发芽荞麦中GABA的积累达到143.20 mg/100 g。LIU等[23]也发现中等有效氯质量浓度为17.76 mg/L的强酸性电解水可使发芽糙米GABA富集量达到最大值24.36 mg/100 g。低压等离子体技术也可以激活糙米中GAD活性,将糙米置于3 kV的低压等离子体中处理10 min后发芽24 h,GABA由初始的7.5 mg/100 g显著增加到28 mg/100 g[24]。可见,新兴技术在富集GABA方面也得到广泛应用。
2 微生物源GABA合成机制及生产工艺
微生物合成法包括发酵法和全细胞转化法,前者指微生物直接发酵基质中的L-谷氨酸/钠盐生成GABA,发酵液为成分复杂的多相体系,GABA分离提纯难度较大。后者是指先发酵培养出含GAD的微生物,再分离出细胞作为催化剂催化L-谷氨酸/钠盐生产GABA,转化液成分简单,GABA提纯简便、得率高。
2.1 生产GABA的微生物源及合成机制
生产GABA的菌株来源广泛且种类多样(表2),其合成机制主要是通过微生物体内GAD催化L-谷氨酸脱羧形成GABA。而对于耐酸性细菌,其GABA合成还依靠于一种特有的GAD抗酸系统,该系统中存在负责Glu和GABA转运的Glu-GABA(Glu-GABA antiproter)蛋白,当细胞处于酸性环境中时,该蛋白可将Glu转运至细胞内消耗H+合成GABA[30],由于H+的消耗形成了质子电化学梯度,膜上质子泵F0F1-ATPase将胞外H+转至胞内并生成ATP为细胞生长提供能量。即耐酸性细菌在维持胞内外pH平衡过程中也会生成GABA。
2.2 发酵法生产GABA
2.2.1 乳酸菌发酵法
发酵法中以公认安全且具有多种益生功能的乳酸菌研究最多,其GABA的合成依赖于不同菌种、菌株及培养条件的差异,对于产GABA的菌株通过优化其培养条件可以提高GABA产量。RIBEIRO等[31]从奶酪中分离出植物乳杆菌、副干酪乳杆菌、肠系膜明串珠菌、乳酸乳球菌等多种产GABA的乳酸菌,在添加30 mg/L谷氨酸钠的MRS肉汤中30 ℃培养48 h后,植物乳杆菌产GABA量最多(937 mg/L),分别是其他菌株的1.6、19.1和15.1倍。RAFFAELLA等[32]利用植物乳杆菌DSM 19463于添加20 mmol/L 谷氨酸钠、1%葡萄汁(质量分数)的MRS肉汤中30 ℃发酵72 h,GABA生成量为498.1 mg/L。LIM等[33]从泡菜中筛选出1株短乳杆菌 HYE1,在含质量分数1%谷氨酸的MRS培养基中30 ℃培养48 h后得到1 509.68 mg/L GABA,在2.14%麦芽糖、4.01%胰蛋白酶、2.38%谷氨酸(均为质量分数)、初始pH为4.74优化条件下同等温度、时间培养后GABA增加28%。此外,混合乳酸菌发酵也能显著增加GABA的产量。KIM等[34]在含有3% L-谷氨酸、10%冷冻天麻粉(均为质量分数)的培养基中添加0.5%的短乳杆菌GABA 100与双歧杆菌BGN4菌液,30 ℃条件下联合发酵6 d后GABA产量为1.26×104 mg/L,显著高于短乳杆菌GABA 100单独发酵时的产量。HAN等[35]选用1株产GABA的嗜热链球菌与鼠李糖乳杆菌1∶1(接种量皆为106 CFU/mL)共接种于含有15 g/L谷氨酸钠和质量分数10%脱脂乳粉的培养基中37 ℃发酵48 h后时产生的GABA质量浓度达8 300 mg/L,是其单独培养时(2 800 mg/L)的2.96倍。总之,产GABA的乳酸菌以乳杆菌的报道最多,通过优化其工艺条件或与混合菌株共培养可有效提高发酵效率,但大部分菌种发酵产量较低,因此筛选高产GABA的协同发酵菌株或开发高效GABA发酵工艺尤为重要。
2.2.2 酵母菌发酵法
近来发现酵母菌具有大量氨基酸和较高的GAD酶活性,且安全性高,也被用来发酵生产GABA。但酵母菌GABA合成效率低于乳酸菌,工业上较少单独使用酵母菌发酵生产GABA,而是通常将其与乳酸菌联用来增加GABA产量。如范媛媛等[36]在添加60 g/L 的L-谷氨酸钠、50 g/L葡萄糖发芽糙米培养基中接种体积分数4%的复合菌(短乳杆菌L2∶卡斯酒香酵母ZSM-001体积比为2∶1),于30 ℃培养90 h后将发酵液纯化浓缩,测得GABA含量达3.33×104 mg/L,比单用卡斯酒香酵母ZSM-001菌发酵提高了50.8%。ZHANG等[37]用植物乳杆菌BC114和酿酒酵母菌 SC125共接种于100 mL含有5 g/L L-谷氨酸的灭菌桑葚培养基中,在30 ℃孵育72 h后得到2 420 mg/L的GABA,是单独用酵母菌培养时的2.35倍。可见,将产GABA的酵母菌与乳酸菌协同发酵可提高GABA产率,且酵母菌安全性高,是复合菌种发酵法制备GABA的理想选择菌株。
2.2.3 霉菌发酵法
霉菌作为发酵工业中的重要菌也可用于发酵制备GABA,但霉菌发酵时间长、效率低,单独用霉菌发酵制备GABA不仅耗时且产量低,而将其与乳酸菌共培养或通过优化发酵条件可以提高GABA产量。如边鑫等[38]对8株霉菌培养至稳定期后进行接种发酵筛选高产GABA的霉菌菌株,观察到发酵36 h时黑曲霉B的GABA产量首先到达最大,为346 mg/L,而米曲霉3.800发酵到48 h左右时才达到最大GABA值,也仅为674 mg/L。刘志强等[39]将红曲霉SM048和植物乳杆菌Lac.1共同接种于TYG培养基中,在 pH 4~4.5、30 ℃的条件下进行分段发酵,GABA 产量为520 mg/L,比红曲霉SM048单独发酵时提高了147.62%。张庆庆等[40]将红曲霉接种在添加61.4%干豆渣、38.6%大米粉、0.45%谷氨酸钠、0.20%(NH4)2SO4、0.23% MgSO4、0.37% KH2PO4、0.25% CaCl2(均为质量分数)优化的固态培养基中,并在优化的32 ℃下培养12 h,GABA产量为41.7 mg/100 g,比优化前提高13.4%。霉菌发酵速度慢、产量低,虽然对其进行工艺优化后产GABA量有所提升但产量仍较低,效率不及乳酸菌和酵母菌。
2.3 全细胞转化法富集GABA
全细胞转化法是利用菌体细胞作为酶源,先培养细胞生长到一定的浓度,之后将收集、洗涤培养的细胞加入底物反应体系中,再经细胞内的GAD作用催化底物脱羧生成GABA。具有周期短、生产成本低、工业化生产潜力高等优点。常用的微生物类型包括野生菌株和基因工程菌株。
2.3.1 野生菌株转化法
野生菌株转化生产GABA的反应条件温和、所产GABA易于分离纯化,具有较好地工业化应用前景。目前野生菌株转化法所用微生物以乳酸菌研究报道居多。张术聪等[41]制备了植物乳杆菌GB01-21的转化液,测得GABA的含量为139.2 g/L,转化率为99.3%。孙丽慧等[42]以短乳杆菌DLF-19076全细胞作为催化剂,通过3次补料后以87.84%的转化率获得85.71 g/L的GABA。除乳酸菌外,也有霉菌转化生产GABA的研究。田东亮[43]筛选出1株横梗霉,在最优条件下转化12 h后GABA产量达到3.79 g/L,转化率达到36.8%。王志超[44]以霉菌MQ-9为出发菌株,先对其进行紫外-LiCl复合诱变处理,之后优化条件并固定菌体,最终GABA转化率达到 33.98%。虽然研究表明优化条件后利用霉菌产GABA的转化率有所提高,但与多数乳酸菌生产GABA的转化率(90%以上)相比,霉菌的转化率仍相对较低,因此利用霉菌转化生产GABA的研究少于乳酸菌。
2.3.2 基因工程菌株转化法
基因工程菌株因具备表达水平高、生产效率高等优势,在GABA全细胞转化方面具有较高的工业化生产潜力,已报道的利用基因工程技术改造细胞作为催化剂富集GABA的菌株种类多样,有乳酸菌、大肠杆菌、芽孢杆菌等,其中研究较多的是乳酸菌和大肠杆菌。乳酸菌产GABA得率高、安全度高,是转化生产GABA的理想菌种。大肠杆菌具有目标基因表达水平高、易于培养、成本低、GAD活性普遍很高等优点,因此常以大肠杆菌作为重组微生物的宿主菌,异源表达产GABA乳酸菌的GAD构建基因工程菌作为生产GABA的细胞催化剂。KE等[45]以大肠杆菌BW25113为宿主菌,异源表达乳酸乳球菌的GABD基因,之后以构建的基因工程菌作为全细胞生物催化剂在转化12 h时GABA产量为308.96 g/L,转化率为99.9%。田灵芝等[46]从1株具有较高GAD活力的植物乳杆菌扩增获得 GAD基因lpgad,构建了重组质粒pET-28a-lpgad,并在大肠杆菌BL21(DE3)中高效诱导其表达,然后将培养至14 h的菌体离心收集、洗涤,以6.2 g/L的菌浓转化L-谷氨酸底物24 h后GABA产量可达143.5 g/L,转化率为 97.32%,是原始菌株的2.19倍。此外,芽孢杆菌也可经基因工程改造全细胞转化制备GABA。如张六六等[47]通过在枯草芽孢杆菌中优化GAD及辅因子磷酸吡哆醛再生基因的串联表达,构建了1株高产 L-谷氨酸脱羧酶的重组枯草芽孢杆菌,通过全细胞催化底物L-谷氨酸24 h,GABA产量可达327 g/L。与发酵周期长、后处理过程繁琐的传统发酵法相比,全细胞转化法生产GABA周期短、收率高,且利用基因工程技术异源表达重组GAD进行定向改造能够进一步提高全细胞转化法生产GABA的效率。
表2 产GABA的菌株及GABA产量
Table 2 GABA-producing strains and their GABA production
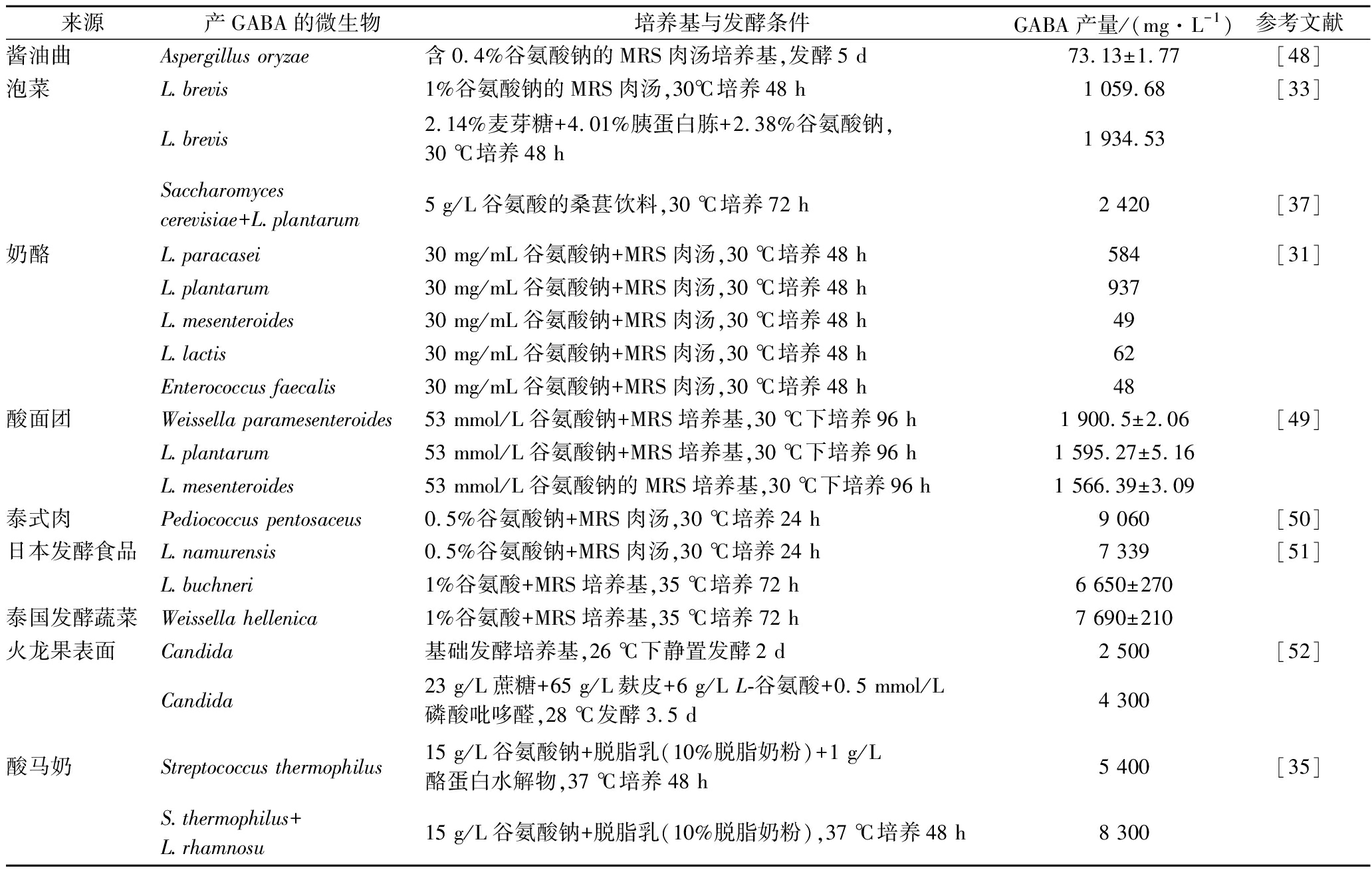
来源产GABA的微生物培养基与发酵条件GABA产量/(mg·L-1)参考文献酱油曲Aspergillus oryzae含0.4%谷氨酸钠的MRS肉汤培养基,发酵5 d73.13±1.77 [48]泡菜L.brevis1%谷氨酸钠的MRS肉汤,30℃培养48 h1 059.68 [33]L.brevis2.14%麦芽糖+4.01%胰蛋白胨+2.38%谷氨酸钠,30 ℃培养48 h1 934.53Saccharomyces cerevisiae+L.plantarum5 g/L谷氨酸的桑葚饮料,30 ℃培养72 h2 420 [37]奶酪L.paracasei30 mg/mL谷氨酸钠+MRS肉汤,30 ℃培养48 h584 [31]L.plantarum30 mg/mL谷氨酸钠+MRS肉汤,30 ℃培养48 h937L.mesenteroides30 mg/mL谷氨酸钠+MRS肉汤,30 ℃培养48 h 49L.lactis30 mg/mL谷氨酸钠+MRS肉汤,30 ℃培养48 h62Enterococcus faecalis30 mg/mL谷氨酸钠+MRS肉汤,30 ℃培养48 h48酸面团Weissella paramesenteroides53 mmol/L谷氨酸钠+MRS培养基,30 ℃下培养96 h1 900.5±2.06 [49]L.plantarum53 mmol/L谷氨酸钠+MRS培养基,30 ℃下培养96 h1 595.27±5.16 L.mesenteroides53 mmol/L谷氨酸钠的MRS培养基,30 ℃下培养96 h1 566.39±3.09 泰式肉Pediococcus pentosaceus0.5%谷氨酸钠+MRS肉汤,30 ℃培养24 h9 060[50]日本发酵食品L.namurensis0.5%谷氨酸钠+MRS肉汤,30 ℃培养24 h7 339[51]L.buchneri1%谷氨酸+MRS培养基,35 ℃培养72 h6 650±270泰国发酵蔬菜Weissella hellenica1%谷氨酸+MRS培养基,35 ℃培养72 h7 690±210 火龙果表面Candida基础发酵培养基,26 ℃下静置发酵2 d2 500 [52]Candida23 g/L蔗糖+65 g/L麸皮+6 g/L L-谷氨酸+0.5 mmol/L磷酸吡哆醛,28 ℃发酵3.5 d4 300酸马奶Streptococcus thermophilus15 g/L谷氨酸钠+脱脂乳(10%脱脂奶粉)+1 g/L酪蛋白水解物,37 ℃培养48 h5 400 [35]S.thermophilus+L.rhamnosu15 g/L谷氨酸钠+脱脂乳(10%脱脂奶粉),37 ℃培养48 h8 300
注:%均为质量分数
3 GABA功能性食品开发现状
大健康背景下人们对生活质量的追求提高,功能性食品的开发能够满足人们对传统食品提出的深层次要求,GABA作为一种功能性因子,在功能性食品生产中的应用越来越广泛。
3.1 GABA粮食制品的开发
粮食食品是人类生存与发展的基本条件,采用浸泡、发芽等方法加工粮食作物可以开发出多种富含GABA的粮食制品,使得人们能够在日常的膳食饮食中摄入所需的GABA。米类中以发芽糙米为研究热点,在日本已经获得了产业化生产,其GABA含量比普通白米高7倍。以发芽糙米为原料进行再加工可以制得丰富的GABA糙米食品。最为简单的是GABA营养粉,如孙雨茜等[53]挤压膨化发芽糙米,进行超微粉碎后添加玉米粉、麦芽糊精等辅料得到GABA含量16.63 mg/100 g的风味营养粉,高于未发芽的营养粉产品近 3 倍。发芽糙米也被用于烘焙、饮料和酒类食品的加工,生产富含GABA的糙米面包、饼干、糙米乳酸菌饮料、糙米白酒等[54]。麦类胚芽中含有较高的Glu含量,是用于生产GABA食品的优良原料。以发芽小麦为原料可以制备出GABA饮料、麦茶,进行磨粉后用于生产富含GABA的馒头、面包等主食。柴美清等[55]以46 ℃水浴保温孵育1.5 h的麦胚为原料制备了一种GABA含量为82 mg/100 mL的麦胚饮料,是普通麦胚饮料GABA含量的4.56倍。尹永祺等[56]对发芽后的小麦进行炒制焙香,制得一种麦芽茶,其GABA含量为20 mg/100 g。王沛等[57]以小麦为原料先制得富含GABA的芽麦全粉,再添加酵母、水等辅料生产富含GABA的全芽麦馒头,含量在200~280 mg/100 g,是一种新型功能性全麦食品。对豆类进行发芽发酵不仅可以提高GABA含量,还可以改善其营养组分、降低抗营养因子,从而提高其利用价值。其中最简单的形式是豆芽食品,以豆类原料直接胁迫发芽制得。另外较为常见是豆乳食品,如吴嘉琪等[58]以富含GABA的发芽大豆为主要原料,制作了一种GABA含量为18.56 mg/100 mL的谷芽豆乳。此外还有富含GABA的豆奶、豆酱、豆豉等豆类制品[59]。粮食作物种类丰富且发芽生长快、周期短,易于实现工业化生产,目前以开发出的富含GABA的粮食制品形式最为多样。随着食品加工技术的快速发展,GABA食品种类会更加多元化。
3.2 GABA乳制品的开发
乳酸菌发酵制得的乳制品由于口感好而广受消费者青睐,因此以发酵乳制品为载体开发GABA功能性食品具有较好的市场前景,同时也符合国家乳业振兴促进乳制品创新升级的国家政策。GABA乳制品通常是以高产GABA的乳酸菌为发酵剂生产富含GABA的奶酪、酸奶、发酵乳。此外在发酵过程中添加一定量的谷氨酸盐或辅酶磷酸吡哆醛进行优化可以提高产品中GABA产量。CARAFA等[60]利用产GABA嗜热链球菌84C(106CFU/mL)和短乳杆菌DSM 32386(10 CFU/mL)混合发酵制备奶酪,在成熟20 d时得到GABA含量(9.1±2.2) mg/100 g 的奶酪,高于嗜热链球菌84C单独发酵时(7.1±2.1) mg/100 g,为利用共培养物开发功能性奶酪提供了思路。EL-FATTAH等[61]利用浓缩乳清蛋白强化的脱脂乳粉发酵酸奶,在发酵剂中添加能赋予酸奶高粘特性和产GABA混合菌后发现,酸奶中GABA含量达1.64 mg/100 mL,是相应只添加具有高粘性菌株处理组的4.56倍。韩啸[62]以1株产GABA的短乳杆菌DL1-11制备了一种功能性发酵乳,在添加0.15%的L-谷氨酸钠进行优化后产品中GABA含量达(101.20±2.48) mg/100 g,是优化前的2.37倍。总之,通过高产GABA乳酸菌的筛选及乳品配料的改良,如添加谷氨酸钠等物质,能够显著提高乳制品中GABA产量,但由于谷氨酸钠在乳制品中应用较少,因此筛选或培育高产GABA的乳酸菌可行性更好。
3.3 GABA肉制品的开发
GABA肉制品的开发研究与粮食制品和乳制品相比较少,主要报道的是用乳酸菌添加于发酵剂中制备富含GABA的肉制品。在乳酸菌发酵4个月和12个月的日本发酵鱼制品aji-no-susu中分别检测到150和140 mg/100 g的GABA,并从中分离出2株产GABA的蛋白酶乳杆菌KN1和KN2,表明产GABA的乳酸菌可用于发酵生产含GABA的肉制品[63]。KANTACHOTE等[64]将高产GABA的菌株用于发酵香肠的制作,以产GABA的戊糖片球菌HN8和那慕尔乳杆菌NH2为混合发酵剂(接种量各为6 lg CFU/g)发酵猪肉香肠,得到的产品中GABA含量达396.2 mg/100 g。RATANABUREE等[65]使用同样的2株菌用于一种泰式“Nham”香肠的制作,在发酵剂中添加质量分数0.5%谷氨酸钠后其GABA含量为405.1 mg/100 g,大约高出市面上普通“Nham”香肠的8倍。目前GABA肉制品的开发报道较少,通常能在发酵肉中存活的细菌需要很强的耐受力,因此需要筛选高产GABA且高耐受力的乳酸菌以更好地应用于GABA肉制品的开发。
4 展望
GABA作为一种对人体有多种生理功能的生物活性物质,已受到国内外研究学者的广泛关注。近来蛋白质组学、分子生物学等领域的发展及不断提高的生活健康水平为GABA的研究提供了更为广阔的研究空间,未来GABA资源的开发方向之一是可以通过深入了解GAD的催化机制,利用组学等知识对该酶进行蛋白质结构改良以获得高转化效率的GAD,从而提高GABA合成量。另一开发方向是有针对性地开发适合不同人群的富含GABA的食品,如开发适合中老年人群的GABA主食类产品(馒头、面包、发芽糙米等)、开发适合中青年人群的便携式休闲化GABA食品(饼干、发酵奶片等)以及适合大众人群的GABA酸奶等乳酸菌发酵食品,以期通过在日常生活中摄入这些富含GABA的食品来改善现代人因生活节奏快、压力大等因素导致的焦虑、失眠等亚健康状况。
[1] NGO D-H,VO T S,TORRES M D,et al.An updated review on pharmaceutical properties of gamma-aminobutyric acid[J].Molecules,2019,24(15):1-23.
[2] VEERAIAH P,NORONHA J M,MAITRA S,et al.Dysfunctional glutamatergic and γ-aminobutyric acidergic activities in prefrontal cortex of mice in social defeat model of depression[J].Biological Psychiatry,2014,76(3):231-238.
[3] CHRISTOPHE S,ANETTE K.The users of novel psychoactive substances:Online survey about their characteristics,attitudes and motivations[J].The International Journal on Drug Policy,2016,32:1-33.
[4] AMRO A,HEBA A,ETARERI E S,et al.Screening potential probiotic characteristics of Lactobacillus brevis strains in vitro and intervention effect on type I diabetes in vivo[J].Bio Med Research International,2018,2018:1-20.
[5] 王斌, 丁俊胄,贾才华,等.环境胁迫植物富集γ-氨基丁酸的研究进展[J].食品工业科技,2018,39(18):342-346;352.
WANG B,DING J Z,JIA C H,et al.Research progress on enrichment of γ-aminobutyric acid in plants under environmental stress[J].Science and Technology of Food Industry,2018,39(18):342-346;352.
[6] SOMBOON T,SUWIMON K,ATHIP B.Enhancing gamma-aminobutyric acid content in germinated brown rice by repeated treatment of soaking and incubation[J].Food Science and Technology International,2013,19(1):25-33.
[7] WANG P,LIU K X,GU ZH X,et al.Enhanced γ-aminobutyric acid accumulation,alleviated componential deterioration and technofunctionality loss of germinated wheat by hypoxia stress[J].Food Chemistry,2018,269:1-36.
[8] TRUONG T N,DANH N T,DAO D T A.Effects of ph soaking solutions and hypoxia/anaerobic treament on gaba accumulation in germinated mung bean (Vigna radiata L.)[J].Vietnam Journal of Science and Technology,2017,55(2):150-160.
[9] XU J G,HU Q P.Changes in γ-aminobutyric acid content and related enzyme activities in Jindou 25 soybean (Glycine max L.) seeds during germination[J].LWT-Food Science and Technology,2014,55(1):341-346.
[10] CHEN J,WU J,LIN K,et al.Optimization of culture conditions and culture solution compositions for γ-aminobutyric acid accumulation in germinating Mung Bean (Vigna radiata L.)[J].Journal of Biobased Materials and Bioenergy,2018,12(1):115-121.
[11] 王凯凯,孙朦,宋佳敏,等.γ-氨基丁酸(GABA)形成机理及富集方法的研究进展[J].食品工业科技,2018,39(14):323-329.
WANG K K,SUN M,SONG J M,et al.Research progress in the formation mechanism and accumulation methods of γ-aminobutyric acid (GABA)[J].Science and Technology of Food Industry,2018,39(14):323-329.
[12] OH S-J,KIM H S,LIM S-T,et al.Enhanced accumulation of gamma-aminobutyric acid in rice bran using anaerobic incubation with various additives[J].Food Chemistry,2019,271:187-192.
[13] 朱云辉, 郭元新.响应面法优化盐胁迫发芽苦荞富集γ-氨基丁酸的培养条件[J].食品科学,2015,36(19):96-100.
ZHU Y H,GUO Y X.Optimization of culture conditions for accumulating γ-aminobutyric acid (GABA) in germinated tartary buckwheat under salt stress by response surface methodology[J].Food Science,2015,36(19):96-100.
[14] 尹永祺, 吴进贤,刘春泉,等.低氧与低温胁迫对发芽玉米籽粒中γ-氨基丁酸富集的影响[J].食品科学,2015,36(1):89-93.
YIN Y Q,WU J X,LIU C Q,et al.Effects of hypoxia and cold stress on γ-aminobutyric acid accumulation in germinating maize[J].Food Science,2015,36(1):89-93.
[15] 张颖, 何健,王涛,等.通气和金属离子双重胁迫对糙米萌发富集γ-氨基丁酸的影响[J].食品与机械,2019,35(5):55-60;77.
ZHANG Y,HE J,WANG T,et al.Effects of coercion germination with aeration and metal irons on the enrichment of γ-aminobutyric acid in germinated brown rice[J].Food and Machinery,2019,35(5):55-60;77.
[16] XIA Q,WANG L,XU C,et al.Effects of germination and high hydrostatic pressure processing on mineral elements,amino acids and antioxidants in vitro bioaccessibility,as well as starch digestibility in brown rice (Oryza sativa L.)[J].Food Chemistry,2017,214:533-542.
[17] SHIGEAKI U,TAKUMI K,TAKAE W,et al.Enzymatic production of γ-aminobutyric acid in soybeans using high hydrostatic pressure and precursor feeding[J].Bioscience,Biotechnology,and Biochemistry,2013,77(4):706-713.
[18] UENO S,KAWAGUCHI Y,OSHIKIRI Y,et al.Enrichment of free amino acid content and reduction of astringent taste compounds in soybean by high hydrostatic pressure[J].High Pressure Research,2019,39(2):398-407.
[19] 张祎, 赵婷婷,申娟利,等.超声波处理对发芽糙米GABA积累及抗氧化能力影响的研究[J].食品工业科技,2016,37(2):130-133;137.
ZHANG Y,ZHAO T T,SHEN J L,et al.Study on effect of ultrasonic treatment on GABA accumulation and antioxidant capacity in germinated brown rice[J].Science and Technology of Food Industry,2016,37(2):130-133;137.
[20] 张祎, 赵婷婷,赵炳涵,等.发芽糙米富集GABA的超声波处理条件优化[J].食品研究与开发,2016,37(11):34-39.
ZHAGN W,ZHAO T T,ZHAO B H,et al.Optimization of ultrasonic treatment for enriching GABA in germinated brown rice[J].Food Research and Development,2016,37(11):34-39.
[21] DING J Z,HOU G G,NEMZER V N,et al.Effects of controlled germination on selected physicochemical and functional properties of whole-wheat flour and enhanced γ-aminobutyric acid accumulation by ultrasonication[J].Food Chemistry,2018,243:1-34.
[22] HAO J X,WU T J,LI H Y,et al.Dual effects of slightly acidic electrolyzed water (SAEW) treatment on the accumulation of γ-aminobutyric acid (GABA) and rutin in germinated buckwheat[J].Food Chemistry,2016,201:87-93.
[23] LIU R,HE X,SHI J,et al.The effect of electrolyzed water on decontamination,germination and γ-aminobutyric acid accumulation of brown rice[J].Food control,2013,33(1):1-5.
[24] CHEN H H,CHANG H C,CHEN Y K,et al.An improved process for high nutrition of germinated brown rice production:Low-pressure plasma[J].Food Chemistry,2016,191:120-127.
[25] 张亮, 静恩岳,孙宇,等.NaCl胁迫联合Ca2+调控糙米发芽富集GABA的工艺优化[J].食品研究与开发,2018,39(21):7-14.
ZHANG L,JING E Y,SUN Y,et al.Optimization of GABA accumulation in brown rice under NaCl stress and Calcium regulation[J].Food Research and Development,2018,39(21):7-14.
[26] 程建军, 徐丽,欧才智,等.优化催芽温度及CaCl2溶液浓度提高发芽小米中γ-氨基丁酸含量[J].Transactions of the Chinese Society of Agricultural Engineering,2019,35(3):301-308.
CHENG J J,XU L,OU C Z,et al.Optimization of germination temperature and CaCl,concentrati on to improve γ-aminobutyrie acid content in germination millet[J].Transactions of the Chinese Society of Agricultural Engineering,2019,35(3):301-308.
[27] BAI Q Y,YANG R Q,ZHANG L X,et al.Salt stress induces accumulation of γ-aminobutyric acid in germinated foxtail millet (Setaria italica L.)[J].Cereal Chemistry,2013,90(2):145-149.
[28] YANG H,GAO J Y,YANG A S,et al.The ultrasound-treated soybean seeds improve edibility and nutritional quality of soybean sprouts[J].Food Research International,2015,77:704-710.
[29] FU W,LV X L,SUN Y M.Study on content changes of γ-aminobutyric acid and mineral element during the processing of black rice germination[J].Science and Technology of Food Industry,2011,32(9):178-180.
[30] 赵伟睿. 微生物细胞催化合成γ-氨基丁酸效能强化的研究 [D].杭州:浙江大学,2015.
ZHAO W R.Improvement of γ-aminobutvric acid biosvnthesisability of microbial cells[D].Hangzhou:Zhejiang University,2015.
[31] RIBEIRO S C,DOMINGOS-LOPES M F,STANTON C,et al.Production of γ-aminobutyric acid (GABA) by Lactobacillus otakiensis and other Lactobacillus sp.isolated from traditional Pico cheese[J].International Journal of Dairy Technology,2018,71(4):1 012-1 017.
[32] RAFFAELLA D C,FRANCESCO M,GIUSEPPE R C,et al.Synthesis of gamma-aminobutyric acid (GABA) by Lactobacillus plantarum DSM19463:functional grape must beverage and dermatological applications[J].Applied Microbiology and Biotechnology,2010,86(2):731-741.
[33] LIM H S,CHA I-T,ROH S W,et al.Enhanced production of gamma-aminobutyric acid by optimizing culture conditions of Lactobacillus brevis HYE1 isolated from kimchi,a Korean fermented food[J].Journal of Microbiology and Biotechnology,2017,27(3):450-459.
[34] KIM J A,PARK M S,KANG S A,et al.Production of γ-aminobutyric acid during fermentation of Gastrodia elata Bl.by co-culture of Lactobacillus brevis GABA 100 with Bifidobacterium bifidum BGN4[J].Food Science and Biotechnology,2014,23(2):459-466.
[35] HAN M,LIAO W Y,WU S M,et al.Use of Streptococcus thermophilus for the in situ production of γ-aminobutyric acid-enriched fermented milk[J].Journal of Dairy Science,2019,103(1):1-8.
[36] 范媛媛, 丁俊胄,熊善柏,等.复合菌种发酵法提高发芽糙米中γ-氨基丁酸[J].中国粮油学报,2019,34(3):1-6.
FAN Y Y,DING J Z,XIONG S B,et al.Increasing γ-aminobutyric acid in germinated brown rice by synergistic fermentation[J].Journal of Chinese Journal of Cereals and Oils Association,2019,34(3):1-6.
[37] ZHANG Q,SUN Q,TAN X,et al.Characterization of γ-aminobutyric acid (GABA)-producing Saccharomyces cerevisiae and coculture with Lactobacillus plantarum for mulberry beverage brewing[J].Journal of Bioscience and Bioengineering,2019,1-7.
[38] 边鑫, 吴非.高产γ-氨基丁酸霉菌菌株的筛选及诱变育种[J].食品科学,2012,33(21):213-216.
BIAN X,WU F.Screening and mutation breeding of a high-yield γ-aminobuyric acid (GABA) mould strain[J].Food Science,2012,33(21):213-216.
[39] 刘志强, 肖翔,周立平.红曲霉与乳酸菌混合发酵产γ-氨基丁酸工艺研究[J].中国食品添加剂,2011 (3):112-117.
LIU Z Q,XIA X,ZHOU L P.Study on production of γ-aminobutyric acid by mixed culture fermentation of Monascus and Lactobacillus plant[J].China Food Additives,2011(3):112-117.
[40] 张庆庆, 吕闻闻,汤文晶,等.红曲霉ZL307固态发酵豆渣产γ-氨基丁酸的工艺优化[J].食品与发酵工业,2012,38(1):96-100.
ZHANG Q Q,LV W W,TANG W J,et al.Optimization of solid-state fermentation conditions for production of γ-aminobutyric acid by Monascus ZL307[J].Food and Fermentation Industries,2012,38(1):96-100.
[41] 张术聪, 刘婷婷,杨套伟,等.从植物乳杆菌全细胞转化液中分离纯化γ-氨基丁酸的工艺研究[J].食品与发酵工业,2010,36(11):1-5.
ZHANG S C,LIU T T,YANG T W,et al.Study on separation and purification technology of γ-aminobutyric acid by whole-cell bioconversion[J].Food and Fermentation Industries,2010,36(11):1-5.
[42] 孙丽慧, 李胜男,宫宇晴,等.短乳杆菌 DLF-19076 全细胞催化合成 γ-氨基丁酸[J].食品科技,2019,44(8):31-36.
SUN L H,LI S N,GONG Y Q,et al.Synthesis of γ-aminobutyric acid by whole cells of Lactobacillus brevis DLF-19076[J].Food Science and Technology,2019,44(8):31-36.
[43] 田东亮. 转化法合成γ-氨基丁酸的霉菌筛选及条件优化[D].济南:齐鲁工业大学,2013.
TIAN D L.Screeming of γ-aminobutyric acid produced molds by biotransformation and optimizing of technology conditions[D].Jinan:Qilu University of Technology,2013.
[44] 王志超. 霉菌转化法合成 γ-氨基丁酸的研究[D].济南:齐鲁工业大学,2016.
WANG Z C.The research of γ-aminobutyric acid synthesized by mold transformation[D].Jinan:Qilu University of Technology,2016.
[45] KE C R,YANG X W,RAO H X,et al.Whole-cell conversion of L-glutamic acid into gamma-aminobutyric acid by metabolically engineered Escherichia coli[J].Springerplus,2016,5(1):591-598.
[46] 田灵芝, 徐美娟,饶志明.一株重组大肠杆菌/pET-28a-lpgad的构建及其高效生产γ-氨基丁酸转化条件的优化[J].生物工程学报,2012,28(1):65-75.
TIAN L Z,XU M J,RAO Z M.Construction of a recombinant Escherichia coli BL21/pET-28a-lpgad and the optimization of transformation conditions for the efficient production of γ-aminobutyric acid[J].Chinese Journal of Biotechnology,2012,28(1):65-75.
[47] 张六六, 毛连山.利用重组枯草芽孢杆菌生产γ-氨基丁酸的研究[J].安徽农业科学,2016,44(9):171-173;176.
ZHANG L L,MAO L S.Study on utilizing a recombinant B.subtilis 168/pHT01-gadA-pdxH for synthesis of γ-aminobutyric acid[J].Journal of Anhui Agricultural Sciences,2016,44(9):171-173;176.
[48] AB KADIR S,WAN W A A Q I,MOHAMMAD R,et al.Evaluation of commercial soy sauce koji strains of Aspergillus oryzae for γ-aminobutyric acid (GABA) production[J].Journal of Industrial microbiology & Biotechnology,2016,43(10):1 387-1 395.
[49] DEMIRBA
![]() H,KURNAZ A A,et al.Antimicrobial and functional properties of lactic acid bacteria isolated from sourdoughs[J].LWT-Food Science and Technology,2017,79:361-366.
H,KURNAZ A A,et al.Antimicrobial and functional properties of lactic acid bacteria isolated from sourdoughs[J].LWT-Food Science and Technology,2017,79:361-366.
[50] RATANABUREE A,KANTACHOTE D,CHARERNJIRATRAKUL W,et al.Selection of γ-aminobutyric acid-producing lactic acid bacteria and their potential as probiotics for use as starter cultures in Thai fermented sausages (Nham)[J].International Journal of Food Science & Technology,2013,48(7):1 371-1 382.
[51] BARLA F,KOYANAGI T,TOKUDA N,et al.The γ-aminobutyric acid-producing ability under low pH conditions of lactic acid bacteria isolated from traditional fermented foods of Ishikawa Prefecture,Japan,with a strong ability to produce ACE-inhibitory peptides[J].Biotechnology Reports,2016,10:105-110.
[52] 郑鸿雁, 赵炜彤,昌妍希.响应面法优化假丝酵母Y6产γ-氨基丁酸发酵工艺[J].食品科学,2015,36(9):130-135.
ZHENG H Y,ZHAO W T,CHANG Y X.Optimization of medium components and culture conditions for enhanced yield of γ-aminobutyric acid by Candida sp.Y6 by response surface methodology[J].Food Science,2015,36(9):130-135.
[53] 孙雨茜, 杨润强,尹永祺,等.高γ-氨基丁酸发芽营养粉的研制[J].食品工业科技,2014,35(21):238-241+247.
SUN Y X,YANG R Q,YIN Y Q,et al.Development of germinated nutritional grain powder with high γ-Aminobutyric acid[J].Science and Technology of Food Industry,2014,35(21):238-241;247.
[54] 马先红, 刘景圣,陈翔宇.粮食发芽富集GABA及食品开发研究进展[J].食品研究与开发,2015,36(21):198-200.
MA X H,LIU J S,CHEN X Y.Research progress on enrichment of γ-aminobutyric acid in germinated grain and function food[J].Food Research and Development,2015,36(21):198-200.
[55] 柴美清, 徐倩,杨庭,等.富含γ-氨基丁酸的麦胚饮料的研制[J].食品研究与开发,2012,33(11):126-129.
CHAI M Q,XU Q,YANG T,et al.Preparation of enriched γ-aminobutyric acid wheat germ beverage[J].Food Research and Development,2012,33(11):126-129.
[56] 尹永祺, 陆燕婷,宋雨翔,等.一种富含γ-氨基丁酸的小麦芽茶的生产方法:中国,201710312019.3[P].2020-03-06.
YIN Y Q,LU Y T,SONG Y X,et al.Production method for enriched γ-aminobutyric acid malt tea:China,201710312019.3[P].2020-03-06.
[57] 王沛, 刘可欣,杨润强,等.一种富含γ-氨基丁酸的全芽麦馒头生产技术:中国,201811078361.2[P].2020-03-17.
WANG P,LIU K X,YANG R Q,et al.Production technology of enriched γ-aminobutyric acid whole bud wheat steamed bread:China,201811078361.2[P].2020-03-17.
[58] 吴嘉琪, 王沛,王红霞,等.富含γ-氨基丁酸谷芽豆乳生产技术研究[J].江苏农业科学,2017,45(6):182-185.
WU J Q,WANG P,WANG H X,et al.Research on the production technology of enriched γ-aminobutyric acid soybean milk[J].Jiangsu Agricultural Sciences,2017,45(6):182-185.
[59] SONG H Y,YU R C.Optimization of culture conditions for gamma-aminobutyric acid production in fermented adzuki bean milk[J].Journal of Food and Drug Analysis,2018,26(1):74-81.
[60] CARAFA I,STOCCO G,NARDIN T,et al.Production of naturally γ-aminobutyric acid-enriched cheese using the dairy strains Streptococcus thermophilus 84C and Lactobacillus brevis DSM 32386[J].Frontiers in Microbiology,2019,10:1-11.
[61] EL-FATTAH A A,SAKR S,EL-DIEB S,et al.Developing functional yogurt rich in bioactive peptides and gamma-aminobutyric acid related to cardiovascular health[J].LWT-Food Science and Technology,2018,98:390-397.
[62] 韩啸. 乳杆菌产γ-氨基丁酸能力分析及其发酵乳改善睡眠效果评价[D].无锡:江南大学,2019.
HAN X.The discrepancy analysis on γ-aminobutyric acid production ability among Lactobacillus and its fermented milk used in sleep improvement[D].Wuxi:Jiangnan University,2019.
[63] KUDA T,TANIBE R,MORI M,et al.Microbial and chemical properties of aji-no-susu,a traditional fermented fish with rice product in the Noto Peninsula,Japan[J].Fisheries Science,2009,75(6):1 499-1 506.
[64] KANTACHOTE D,RATANABUREE A,SUKHOOM A,et al.Use of γ-aminobutyric acid producing lactic acid bacteria as starters to reduce biogenic amines and cholesterol in Thai fermented pork sausage (Nham) and their distribution during fermentation[J].LWT-Food Science and Technology,2016,70(2):171-177.
[65] RATANABUREE A,KANTACHOTE D,CHARERNJIRAKUL W,et al.Enhancement of γ-aminobutyric acid (GABA) in Nham (Thai fermented pork sausage) using starter cultures of Lactobacillus namurensis NH2 and Pediococcus pentosaceus HN8[J].International Journal of Food Microbiology,2013,167(2):1-33.