糖苷类化合物是次级代谢中最重要的天然产物之一[1]。糖基化通常会对化合物的理化和生物特性产生显著影响,包括溶解性、稳定性和生物活性等[2],使糖苷成为更具吸引力的化合物,广泛应用于药物、食品添加剂和保健品等领域[3]。以珍稀藏药红景天活性成分红景天苷为例,它具有抗氧化、抗疲劳和抗衰老的等作用,被广泛添加于食品和保健品中[4]。因此,红景天苷类似物的木质素单体醇糖苷引起了我们的注意。构效关系研究表明,木质素单体醇糖苷的生物活性受到苯环上羟基的数量和位置、酚羟基上甲氧基的引入以及糖连接类型的影响[5-8],因此,作为在苯环上具有2个羟基单元的咖啡醇糖苷,可能显示出更优的生物学和药理学活性。但是目前咖啡醇糖苷的获取仍是巨大的挑战,虽然有报道从玉簪花(Hosta plantaginea)中分离出较低含量的天然咖啡醇-4-O-葡萄糖苷[9],也有报道利用化学还原途径,从相应的苯基丙酸生产木质素单体醇及其糖苷衍生物[10],但植物提取和化学合成受限于起始资源、繁琐的程序和较低的产量,从而限制了咖啡醇糖苷的研究和应用。
近几年,随着合成生物学的发展,利用微生物发酵生产植物天然产物和高价值化学品成为一种具有广阔应用前景的生产方式[11]。2016年,CHEN等[12]将工程化的大肠杆菌进行共培养来合成一系列木质素单体醇。2019年通过构建人工生物合成途径,实现了在大肠杆菌中生产肉桂醇糖苷及对香豆醇单-双糖苷[13]。这使得通过微生物高效生产咖啡醇糖苷成为可能。
本文旨在利用微生物细胞工厂发酵生产咖啡醇葡萄糖苷(合成途径见图1)。因羟化酶HpaBC具有底物宽泛性,易将酪氨酸氧化为不稳定的中间体L-多巴,从而导致碳源的流失[12],所以本研究采用共培养策略,降低HpaBC对酪氨酸的转化。首先,在酪氨酸高产大肠杆菌菌株BTAL[13]中引入来自粘红酵母的酪氨酸解氨酶(tyrosine ammonia lyase,TAL),来自欧芹的对羟基肉桂酰辅酶A连接酶(4CL),来自拟南芥的肉桂酰辅酶A还原酶(cinnamyl-coa reductase,CCR),并利用大肠杆菌内源性醇脱氢酶(alcohol dehydrogenase,ADHs)或醛酮还原酶(aldosterone reductase,AKRs),构建了对香豆醇的生物合成途径,该重组菌株命名为BTAL-CAD01。然后,将来自大肠杆菌的羟化酶HpaBC和来自拟南芥的葡萄糖基转移酶UGT73C5在大肠杆菌BL21(DE3)中表达,得到重组菌株BWT-CAD01。通过共培养重组菌株BTAL-CAD01和BWT-CAD01成功实现了咖啡醇葡萄糖苷的生产。据我们所知,这是关于微生物发酵生产咖啡醇葡萄糖苷的首次报道,为后续构效分析提供了新的候选化合物,有望得到具有较好生物活性的咖啡醇糖苷化合物,也为生物发酵法廉价生产咖啡醇糖苷提供借鉴意义。

图1 咖啡醇葡萄糖苷的生物合成途径
Fig.1 Biosynthetic pathway from glucose to caffeyl alcohol glucosides
1 材料和方法
1.1 实验材料
1.1.1 菌株和质粒(表1)
大肠杆菌DH5α用于克隆携带特定基因的质粒,大肠杆菌BL21(DE3)及其改造菌株用于蛋白质表达和目标化合物的合成,均由本实验室提供。
表1 本研究使用的质粒及菌株
Table 1 Strains and plasmids used in this study

名称特征来源质粒 pRSFDuet-1RSF ori with PT7; KanRNovagen pCDFDuet-1CDF ori with PT7; SMRNovagen pCDFDuet-AtCCR-Pc4CL-RgTALpCDFDuet-1 carrying AtCCR, Pc4CL and RgTAL[13] pCDFDuet-AtCCR-Pc4CL-RgTAL-HpaBCpCDFDuet-1 carrying AtCCR, Pc4CL and RgTAL-HpaBC本研究 pCDFDuet-HpaBCPCDFDuet-1 carrying HpaBC 本研究 pRSFDuet-AtUGT73C5pRSFDuet-1 carrying AtUGT73C5本研究菌株 BTALE.coli BL21 (DE3) with gene tyrR, pheA and trpE deleted[14] BTAL-CAD01E.coli BTAL containing pCDFDuet-RgTAL-Pc4CL-AtCCR and pRSFDuet-1本研究 BWT-CAD01E.coli BL21 (DE3) containing pCDFDuet-HpaBC and pRSFDuet-AtUGT73C5本研究 BTAL-DE.coli BTAL containing pCDFDuet-RgTAL-Pc4CL-AtCCR-HpaBC and pRSFDuet-AtUGT73C5本研究
1.1.2 大肠杆菌培养基
LB培养基用于分子克隆、种子液培养、诱导蛋白表达、2步发酵的第1步培养,包括:蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L。
M9Y培养基用于两步法发酵的第2步发酵培养。培养基配方:5×M9 缓冲液,200 mL;20% 葡萄糖 100 mL;0.025% 酵母提取物 700 mL;1 mol/L MgSO4 2 mL;1 mol/L CaCl2 0.1 mL。
5×M9 缓冲液的配方:Na2HPO4·12H2O 85.5 g;KH2PO4 15 g,NaCl 2.5 g;NH4Cl 5 g,补水至1 000 mL。
根据需要将50 mg/L卡那霉素和100 mg/L链霉素添加到培养基中。
1.1.3 酶与试剂
1 kb DNA Ladder,天津乐宝生物科技有限公司;DNA聚合酶、限制性内切酶、DNA连接酶、PCR所用酶以及ClonExpress® 非连接酶依赖型的多片段一步克隆技术试剂盒等,南京诺唯赞生物科技有限公司;T4连接酶,赛默飞世尔公司;质粒小量提取试剂盒、PCR产物回收试剂盒、凝胶回收试剂盒,北京天根生化科技有限公司。
1.1.4 主要仪器与设备
循环水式真空泵(SHB-ⅢA),郑州长城科工贸有限公司;旋转蒸发仪(Hei-VAP.Value G3),德国海道夫旋蒸仪公司;高效液相色谱制备系统(LC-6AD),岛津仪器(苏州)有限公司;1260 Infinity UV检测器和配备ESI电离探针的Bruker microQ-TOF II质谱仪的Agilent 1260系统,安捷伦科技有限公司和瑞士Bruker公司;核磁共振波谱仪Bruker Avance 400,瑞士Bruker公司。
1.2 实验方法
1.2.1 质粒的构建
本研究中使用的所有引物均列于表2。HpaBC基因通过PCR从大肠杆菌BL21(DE3)的基因组DNA中扩增而来(重组质粒图谱见图2)。
表2 本研究所使用的引物
Table 2 Primers used in this study

名称序列来源HpaBC-FCGGGATCCCATGAAACCAGAAGATTTCC本研究HpaBC-RGGAATTCTTAAATCGCAGCTTCCATTTCC本研究73C5-5FACTGGATCCGATGGTGAGCGAAACCACCAAATCTAGTCCG本研究73C5-3RTGAGTCGACTTAGTGGTGGTGGTGGTGGTGATTATTCGG本研究RgTAL-3RTCGATTATGCTTATGCCAGCATCTTCAGCAGAACGTTGT本研究HpaBC-5FGCTGGCATAAGCATAATCGAAATTAATACGACTCACTATA本研究HpaBC-3RATGCGGCCGCTTAAATCGCAGCTTCCATTTCCAGCATCAC本研究
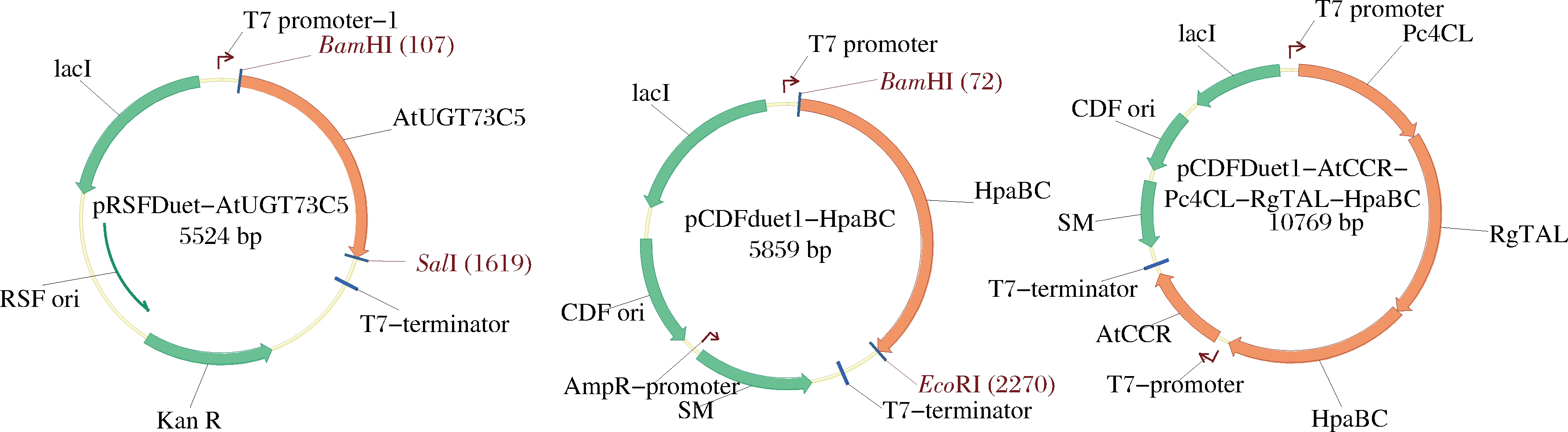
图2 重组质粒图谱
Fig.2 Maps of recombinant plasmids
通过使用限制性位点BamH I和EcoR I将HpaBC片段酶连插入pCDFDuet-1来构建pCDFDuet-HpaBC。利用引物73C5-5F/73C5-3R PCR,以根据大肠杆菌密码子偏好性进行优化并合成的基因AtUGT73C5为模板进行PCR扩增,通过BamH I和Sal I酶切AtUGT73C5片段,并连接到BamH I和Sal I酶切的载体pRSFDuet-1中,得到重组质粒pRSFDuet-AtUGT73C5。重组质粒pCDFDuet-AtCCR-Pc4CL-RgTAL的构建已在之前的工作中进行了描述[15],重组质粒pCDFDuet-AtCCR-Pc4CL-RgTAL-HpaBC的构建与之前的工作[13]方法一致,添加的引物:RgTAL-3R、HpaBC-5F和HpaBC-3R。
1.2.2 微生物发酵生产咖啡醇糖苷
采用两步发酵法生产目标化合物。在第1阶段,将重组大肠杆菌菌株BTAL-CAD01、BWT-CAD01的单个克隆分别接种到5 mL液体LB培养基中,并在37 ℃以200 r/min培养过夜。然后将1 mL的BTAL-CAD01、BWT-CAD01种子液分别转移至50 mL液体LB培养基中,37 ℃ 200 r/min培养至OD600达到0.6~0.8,并添加终浓度为0.1 mmol/L的异丙基硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)在16 ℃,200 r/min培养12~16 h以诱导蛋白表达。然后于4 000 r/min离心10 min收获细胞,用M9Y液体培养基将细胞重悬OD600值至2.0。在第2阶段,将第1阶段重悬后的BTAL-CAD01和BWT-CAD01细胞,以50 mL的总体积量,分别以7∶1、5∶1、3∶1、1∶1、1∶3的体积比混合。于30 ℃ 200 r/min继续振荡培养发酵96 h,以一定时间间隔取样,进行HPLC分析和OD600值测量。单菌BTAL-D发酵同样采用50 mL总体积两步发酵法。
1.2.3 化合物的纯化
将2 L重组菌株BTAL-CAD01和BWT-CAD01的混合发酵液离心,收集上清液并用三菱SP825L型大孔吸附树脂吸附,使用1体积(BV)不同体积分数的乙醇(10%、20%、30%、60%和80%)梯度洗脱目标化合物。利用HPLC分析确定洗脱液中含有目标化合物的成分,通过真空旋转蒸发仪浓缩至干,最后将粗提取物重悬于3 mL甲醇中。利用半制备HPLC纯化咖啡醇单糖苷。使用YMC-pack ODS-A(10 mm×250 mm,5 μm)进行化合物分离,洗脱条件除流速为4 mL/min外,其他与HPLC分析方法相同。
1.2.4 化学分析与定量
重组菌株的次级代谢产物使用配备有1260 Infinity UV检测器和配备ESI电离探针的Bruker microQ-TOF II质谱仪的Agilent 1260系统,通过LC-MS分析。使用Innoval C18色谱柱(4.6 mm×250 mm,5 μm)进行HPLC分析。咖啡醇葡糖苷的洗脱条件为:溶剂A,H2O(含体积分数0.1%甲酸);溶剂B,甲醇;流速,1 mL/min;0~5 min,80%A和20%B,6~25 min,80%A和20%B到100%B(线性梯度)。25~30 min,100%B; 31~40 min,含20%B。所有产物均在254 nm波长处检测到。MS分析以阳离子模式进行。用一系列已知浓度的发酵产生的纯化的咖啡醇单糖苷化合物生成标准校准曲线。所有实验一式3份进行,并重复至少2次,滴度表示为平均值±SD。
1.2.5 核磁共振分析
NMR实验在Bruker Avance 400(德国卡尔斯鲁厄)上进行,样品溶于500 μL CD3OD。
2 结果与分析
2.1 大肠杆菌共培养生产咖啡醇单糖苷
用HpaBC和UGT73C5进一步扩展之前构建的对香豆醇途径[15]来生产咖啡醇单糖苷。HpaBC广泛存在于大肠杆菌B、C和W系基因组中,但相关报道证明通过诱导其过表达才能发挥羟化作用[12-15]。因羟化酶HpaBC具有底物宽泛性,易将酪氨酸氧化为不稳定的中间体L-多巴,从而导致碳源的流失[12]。所以单菌BTAL-D生产咖啡醇及其糖苷产量并不理想(图3-a和图6-a)。共培养策略旨在最大程度地降低HpaBC对酪氨酸的消耗(图1)。在第1个培养阶段,分别诱导了含有pCDFDuet-RgTAL-Pc4CL-AtCCR和pRSFDuet-1的重组大肠杆菌菌株BTAL-CAD01、含有pCDFDuet-HpaBC和pRSFDuet-AtUGT73C5的重组大肠杆菌菌株BWT-CAD01。然后将培养的BTAL-CAD01和BWT-CAD01的细胞以1∶1的比例混合并在第2阶段共培养96 h。LC-MS检测结果显示,除咖啡醇(图3-b,峰1)外,还产生了峰2、3和4三个新峰(图3-b,峰2、3和4),MS分析显示化合物2、3和4具有相同的相对分子质量314.10,推断为3个咖啡醇单葡萄糖苷(图3-d~图3-f)。为进一步确定3个咖啡醇单葡萄糖苷的结构,我们进行了2 L混菌发酵培养。
2.2 咖啡醇糖苷的分析与定量
将2 L重组菌株BTAL01和BWT01的混合发酵液离心,制备得到咖啡醇单糖苷,通过LC-MS和NMR分析确定并鉴定了2个咖啡醇单葡萄糖苷,咖啡醇-4-O-葡萄糖苷和咖啡醇-9-O-葡萄糖苷的结构(图4和图5)。优势单糖苷化合物4被证明是咖啡醇-4-O-葡萄糖苷(图3-b,峰4;图4),其最高产量在72 h内达到(126.98±2.42)mg/L(图6-a)。化合物3经NMR分析鉴定为咖啡醇-9-O-葡萄糖苷(图3-b,峰3;图5)。化合物2制备量不足,未进行NMR分析,因咖啡醇结构中共有3个—OH基团可被UGT73C5糖基化,化合物3和4已经鉴定为咖啡醇-9-O-葡萄糖苷和咖啡醇-4-O-葡萄糖苷,推断化合物2为咖啡醇-3-O-葡萄糖苷。咖啡醇-3-O-葡萄糖苷(图3-b,峰2)和咖啡醇-9-O-葡萄糖苷(图3-b,峰3)由于产量较低,未能定量。发酵72 h后,残留有大量咖啡醇(图3-b,峰1)。
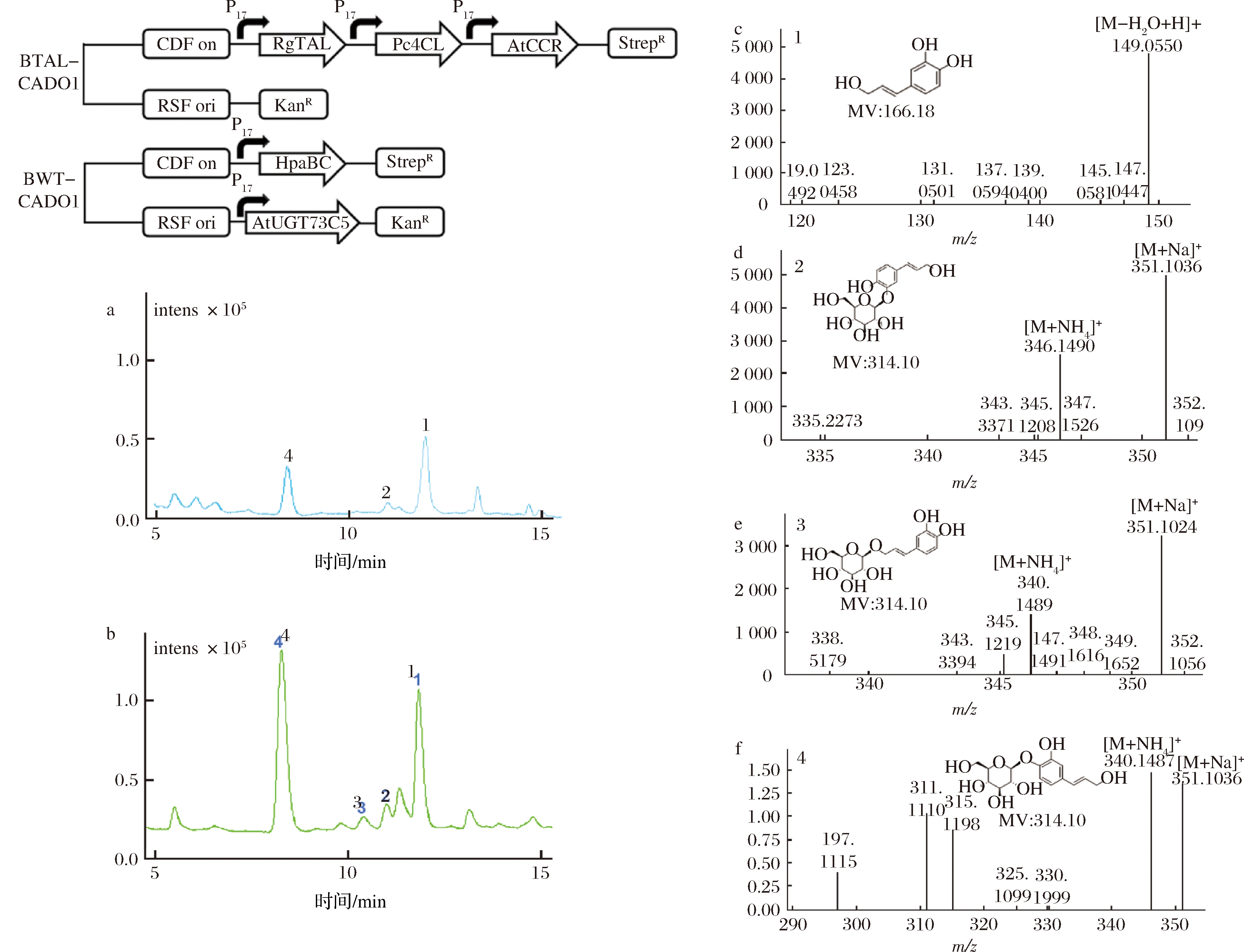
a-HPLC分析重组菌株BTAL-D发酵上清液中的产物;b-HPLC分析共培养的重组菌株BTAL-CAD01和BWT-CAD01混合培养的发酵
上清液中的产物;c-产物1(咖啡醇);d-产物2(咖啡醇-3-O-葡萄糖苷);e-产物3(咖啡醇-9-O-葡萄糖苷);f-产物4(咖啡醇-4-O-葡萄糖苷)
图3 大肠杆菌共培养生产咖啡醇单糖苷
Fig.3 Production of caffeyl alcohol monoglucosides by E.coli co-culture

图4 咖啡醇-4-O-葡萄糖苷氢谱和碳谱图
Fig.4 1H and 13C NMR spectrum of caffeyl alcohol-4-O-glucoside (4) in CD3OD
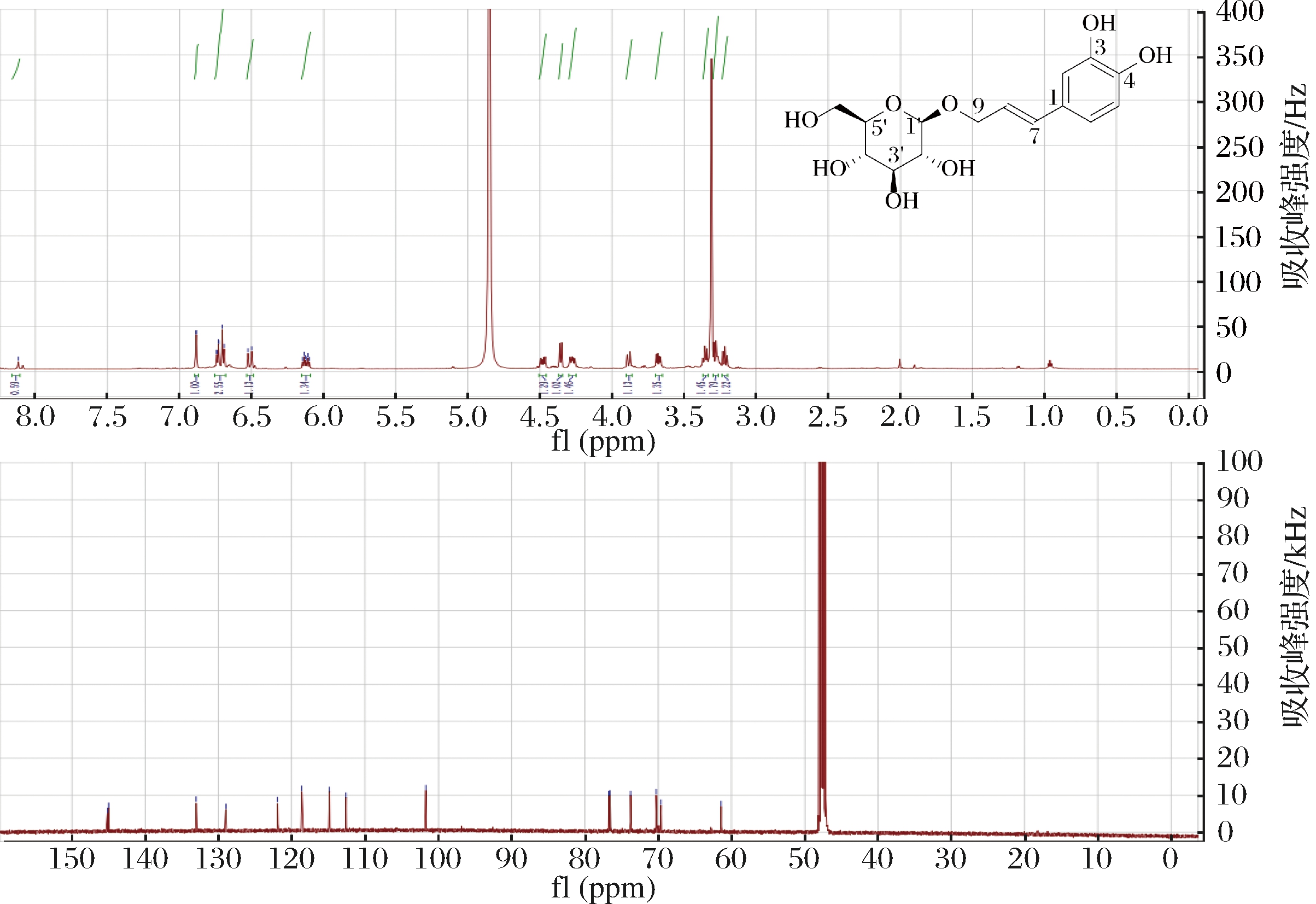
图5 咖啡醇-9-O-葡萄糖苷氢谱和碳谱图
Fig.5 1H and 13C NMR spectrum of caffeyl alcohol-9-O-glucoside (3) in CD3OD
将样品溶于500 μL CD3OD,进行核磁检测,化学位移以δ(ppm)表示,耦合常数(J)以赫兹(Hz)给出:
化合物 3:1H-NMR(400 MHz,CD3OD) δ:6.88(1H, d, J=2.0 Hz, H-2), 6.70(1H, d, J=8.2 Hz, H-5), 6.73(1H, dd, J=8.2, 2.0 Hz, H-6), 6.51(1H, d, J=15.9 Hz, H-7), 6.12(1H, dt, J=15.9, 6.6 Hz, H-8), 4.48(1H, dd, J=12.5, 6.5 Hz, H-9a), 4.27(1H, dd, J=12.5, 7.0 Hz, H-9b), 4.36(1H, d, J=7.8 Hz, H-1′), 3.88(1H, dd, J=12.0, 2.1 Hz, H-6′a), 3.68(1H, dd, J=12.0, 5.3 Hz, H-6′b), 3.21~3.36(4H, m, Glu-H-2′, 3′, 4′, 5′). 13C NMR(150 MHz, CD3OD) δ:129.0(C-1), 112.6(C-2), 144.9(C-3), 145.1(C-4), 114.8(C-5), 118.6(C-6), 133.0(C-7), 121.9(C-8), 69.6(C-9), 101.7(C-1′), 76.5(C-2′), 73.7(C-3′), 70.3(C-4′), 76.7(C-5′), 61.4(C-6′)。
化合物 4:1H-NMR(400 MHz,CD3OD) δ:6.96(1H, d, J=2.0 Hz, H-2), 7.15(1H, J=8.5 Hz, H-5), 6.86(1H, dd, J=8.5, 2.0 Hz, H-6), 6.51(1H, d, J=15.8 Hz, H-7), 6.24(1H, dt, J=16.0, 5.7 Hz, H-8), 4.22(2H, d, J=7.0 Hz, H-9), 4.79(1H, d, J=7.0 Hz, H-1′), 3.93(1H, d, J=12.0 Hz, H-6′a), 3.75(1H, dd, J=12.0, 4.8 Hz, H-6′b), 3.33~3.53(4H, m, Glu-H-2′, 3′, 4′, 5′). 13C NMR(150 MHz, CD3OD) δ:132.9(C-1), 113.2(C-2), 147.0(C-3), 145.0(C-4), 117.3(C-5), 118.2(C-6), 129.9(C-7), 127. 4(C-8), 62.3(C-9), 102.8(C-1′), 76.2(C-2′), 73.5(C-3′), 69.9(C-4′), 76.9(C-5′), 61.0(C-6′)。
2.3 优化发酵比例提高咖啡醇单糖苷的产量
为了提高咖啡醇单糖苷的产量,测试了BTAL-CAD01和BWT-CAD01的不同体积比混合比例(7∶1~1∶3)。结果显示,当BTAL-CAD01和BWT-CAD01的混合体积比为3∶1,发酵72 h时,咖啡醇-4-O-葡糖苷的产量最高,达到(139.06±1.55) mg/L(图6-a),是单菌BTAL-D生产咖啡醇-4-O-葡糖苷产量(14.59±0.82) mg/L的9.53倍。当BTAL-CAD01和BWT-CAD01的体积比为3∶1,发酵72 h时,中间产物咖啡醇剩余量最少,为(96.78±3.16)mg/L,说明3∶1混合比例消耗了咖啡醇,促进了咖啡醇-4-O-葡糖苷的生产(图6-a),1∶3和单菌BTAL-D咖啡醇剩余量分别为(38.09±2.35)和(42.60±1.09) mg/L的原因是因为本身生产能力不足。在第2个发酵阶段中,咖啡醇-4-O-葡萄糖苷的产量在48 h内迅速增加,然后在96 h内逐渐达到最高值(141.63±3.42) mg/L(图6-b)。
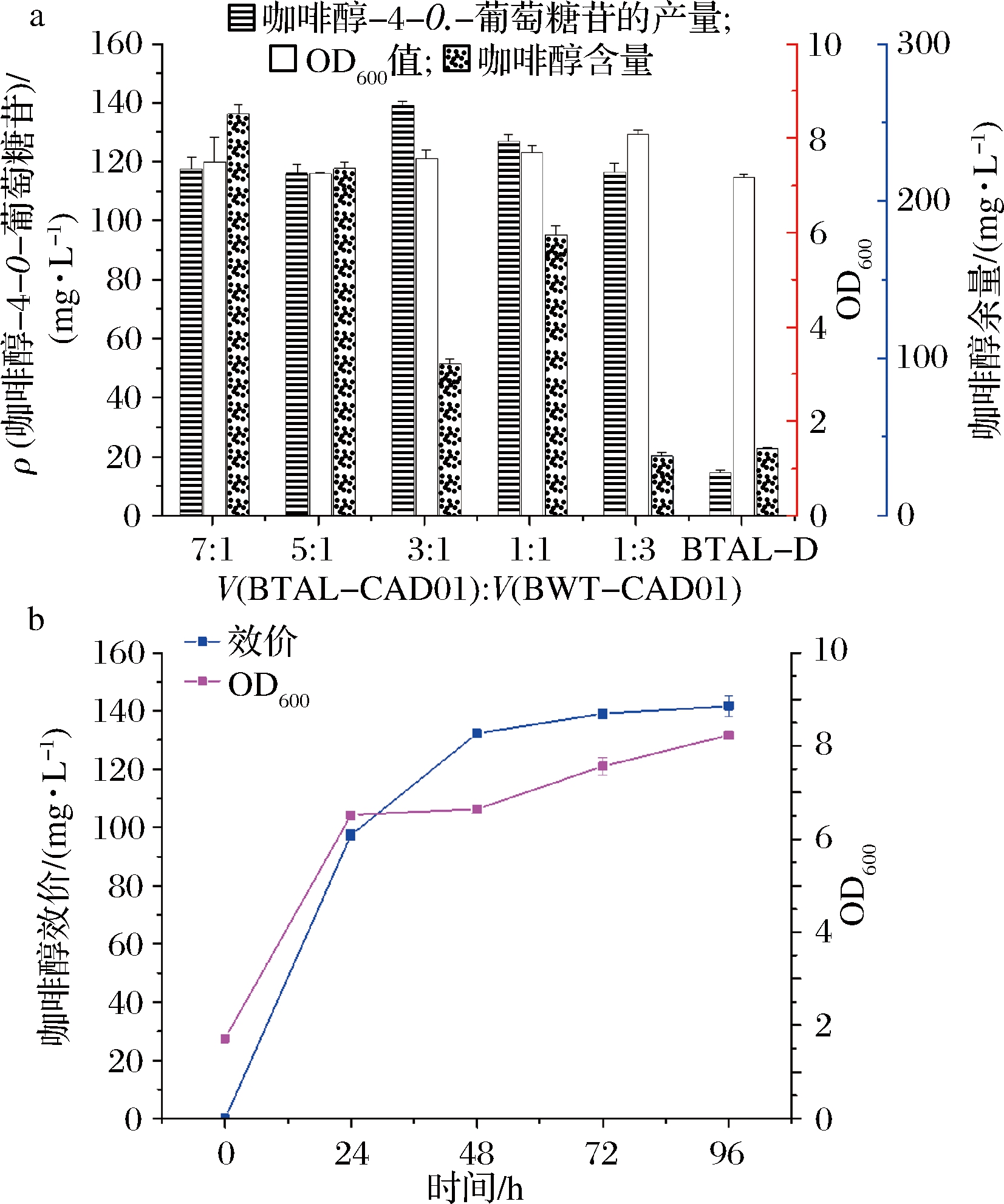
图6 通过优化大肠杆菌共培养比例提高咖啡醇单糖苷的生产
Fig.6 Production optimization of caffeyl alcohol monoglucosides by E.coli co-culture
3 总结
微生物发酵法作为一种潜在而有效的技术已被用于不同天然产物的异源生物合成中[16],它提供了一种绿色且可持续的方法。为了最大程度地减少HpaBC与酪氨酸接触形成不稳定的中间体L-多巴,导致碳源的损失,本文设计共培养发酵的方法,合成了3种咖啡醇葡萄糖苷,同时测试了不同混合比例的BTAL-CAD01和BWT-CAD01来提高咖啡醇单糖苷的生产率,当二者混合比例设为3∶1时,咖啡醇-4-O-葡萄糖苷的产量最高,是单菌生产咖啡醇-4-O-葡萄糖苷的9.53倍。后续可通过筛选挖掘底物选择性更专一及催化活性更高的糖基转移酶,并通过对莽草酸通路和UDP-糖通路的代谢调控,实现特定咖啡醇糖苷的高效合成。据我们所知,这是第一次实现微生物中咖啡醇糖苷的生物合成。除咖啡醇-4-O-葡萄糖苷以外,其他2种咖啡醇糖苷都是非天然化合物。作为在苯环上具有2个羟基单元的木质素单体醇糖苷,与其他木质素单体醇糖苷衍生物相比,咖啡醇糖苷有望表现出独特的生物学和药理活性。这些咖啡醇糖苷的非天然类似物将为构效关系研究提供基础材料,并有望发现具有改善的生物活性和药理特性的新类似物。
[1] LIANG Dongmei,LIU Jiaheng,WU Hao,et al.Glycosyltransferases:Mechanisms and applications in natural product development[J].Chem Soc Rev,2015,44(22):8 350-8 374.
[2] 刘爽,李凯,王双,等.微生物及其酶催化的天然产物糖基化反应[J].药学进展,2018,42(1):14-20.
LIU S,LI K,WANG S,et al.Glycosylation of natural products catalyzed by microorganisms and their enzymes[J].Progress in Pharmaceutical Sciences,2018,42(1):14-20.
[3] LULEY-GOEDL C,NIDETZKY B.Glycosides as compatible solutes:biosynthesis and applications[J].Nat Prod Rep,2011,28(5):875-896.
[4] 吴捷,吴传超,顾秋亚,等.红景天有效成分微生物发酵高值化转化[J].食品与发酵工业,2019,45(9):29-34.
WU J,WU C C,GU Q Y,et al.High value conversion of effective components in Rhodiola by microbial fermentation[J].Food and Fermentation Industries,2019,45(9):29-34.
[5] KURKIN V A.Phenylpropanoids as the biologically active compounds of the medicinal plants and phytopharmaceuticals[J].Adv Biol Chem,2013,3(1):26-28.
[6] PINEDO T D A,PENALVER P,MORALES J C.Synthesis and evaluation of new phenolic-based antioxidants:structure-activity relationship[J].Food Chem,2006,103(1):55-61.
[7] HEILMANN J,CALIS I,KIRMIZIBEKMEZ H,et al.Radical scavenger activity of phenylethanoid glycosides in FMLP stimulated human polymorphonuclear leukocytes:structure-activity relationships[J].Planta Med,2000,66(8):746-8.
[8] KURKIN V A.Phenylpropanoids from medicinal plants:Distribution,classification,structural analysis,and biological activity[J].Chemistry of Natural Compounds,2003,39(2):123-153.
[9] YANG Li,HE Junwei.Hosta plantaginea (Lam.) Aschers (Yuzan):An overview on its botany,traditional use,phytochemistry,quality control and pharmacology[J].RSC Advances,2019,9(60):35 050-35 058.
[10] STEPHANE, QUIDEAU,JOHN,et al.Facile large-scale synthesis of coniferyl,sinapyl,and p-coumaryl alcohol[J].Journal of Agricultural and Food Chemistry,2002,40(7):1 108-1 110.
[11] 王程程,郑璞,陈鹏程,等.重组大肠杆菌发酵生产树莓酮[J].食品与发酵工业,2019,45(9):9-14.
WANG C C,ZHENG P,CHEN P C,et al.Production of raspberry ketone by recombinant Escherichia coli[J].Food and Fermentation Industries,2019,45(9):9-14.
[12] CHEN Zhenya,SUN Xinxiao LI Ye,et al.Metabolic engineering of Escherichia coli for microbial synthesis of monolignols[J].Metab Eng,2016,11(3):1 096-7 176.
[13] BI Huiping,WANG shuai,ZHOU wei,et al.Producing gram-scale unnatural rosavin analogues from glucose by engineered escherichia coli[J].ACS synthetic biology,2019,8(8):1 931-1 940.
[14] LI Tianzhen,ZHOU Wei,BI Huiping,et al.Production of caffeoylmalic acid from glucose in engineered Escherichia coli[J].Biotechnol Lett,2018,40(7):1 057-1 065.
[15] LI Xianglai,CHEN Zhenya,WU Yifei,et al.Establishing an artificial pathway for efficient biosynthesis of hydroxytyrosol[J].ACS synthetic Biology,2018,7(2):647-654.
[16] CHEN Tingting,ZHOU Yiyao,LU Yinghua,et al.Advances in heterologous biosynthesis of plant and fungal natural products by modular co-culture engineering[J].Biotechnol Lett,2019,41(1):27-34.