海鲈鱼(Perca fluviatilis)又名日本真鲈、七星鲈、鲈鲛等,其体型粗而长,下颌长于上颌,鱼嘴较尖,体侧上部及背鳍有黑色斑点[1]。海鲈鱼是我国沿海地区常见的经济鱼类之一,主要分布于太平洋西部,我国沿海及通海的淡水水域中均产,其中渤海、黄海和东海海域产量较多[2]。海鲈鱼肉质细嫩鲜美,骨刺较少,肌肉中蛋白质含量丰富,氨基酸种类全面且比例合适,同时富含二十碳五烯酸和二十二碳六烯酸,深受消费者的喜爱[3-4]。
近年来,随着人们生活水平的提高,食品的营养价值愈发受到关注。蛋白消化率主要反映了食物中的蛋白质在消化道内被消化酶分解的程度,是评价食物蛋白质营养价值的重要指标[5]。目前关于食品蛋白消化率的研究主要采用胃蛋白酶-胰蛋白酶体外模拟消化的方法,利用体外仿生模拟消化系统能有效模拟人体或动物的消化道及其消化环境、消化道内的流体动态行为等[6]。肉类一般需经加热熟化后再食用,而熟化的温度和时间对最终产品的品质、风味和营养价值都具有重要影响。加热处理会使蛋白质的结构发生改变,从而影响蛋白酶的作用位点及蛋白质的消化吸收率。已有研究表明,不同的热处理温度对肉类蛋白质的消化率有一定的影响。韦婕妤等[7]采用胃蛋白酶-胰蛋白酶体外模拟消化法研究了不同热加工方法对羊肉制品蛋白消化性的影响,发现不同的热加工方式及加热终点温度对蛋白质体外消化率的影响不同,研究结果为家庭烹饪选择合理的加热方式和温度提供理论依据。杨万君等[8]研究了3种品牌酱排骨中蛋白质的体外模拟消化情况,结果表明不同的加工工艺对酱排骨的蛋白体外消化率、酶解粒径及消化产物均存在显著影响。蒸制和炸制是常见的2种熟化方式,其加热温度不同,对产品的品质及营养特性具有重要影响。本文以海鲈鱼为研究对象,选取背部肌肉,采用体外模拟胃肠消化模型,研究蒸制和炸制2种常见的熟化方法对海鲈鱼肉体外消化特性的影响,旨在为海鲈鱼食品化菜品的开发提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
新鲜海鲈鱼购于锦州市林西街水产市场,每尾长(20±5) cm,尾重约1 kg。色拉油购于锦州市万达超市。甲醛,天津市大茂化学试剂厂;尼罗蓝、α-淀粉酶,上海阿拉丁试剂公司;胃蛋白酶、胰蛋白酶,上海Sigma-Aldrich公司;胆盐,北京沃凯生物科技有限公司;NaOH、无水乙醇、CuSO4、K2SO4、三氯乙酸、浓H2SO4(均为分析纯),国药集团化学试剂有限公司;FeCl2,上海萨恩化学技术有限公司;菲洛嗪,上海源叶生物科技有限公司。
1.2 仪器与设备
DIVHS-I体外仿生动态人胃模拟消化系统,苏州晓东宜健仪器设备有限公司;Biofuge stratos台式高速冷冻离心机,美国Thermo Fisher Scientific公司;FOSS 8400型全自动定氮仪,丹麦FOSS公司;NanoBrook 90 Plus激光粒度仪,美国布鲁克海文仪器公司;LSM 510激光扫描共聚焦显微镜,德国卡尔·蔡司股份公司;XE-70原子力显微镜,韩国Park Systems公司;UV-2550紫外可见光分光光度计,岛津仪器(苏州)有限公司;ZB-20型数显恒温水浴锅,诸城市瑞恒食品机械厂;MS105DU分析天平,梅特勒-托利多仪器有限公司。
1.3 实验方法
1.3.1 样品预处理
取海鲈鱼背部肌肉,切成大小均匀的鱼块(5 cm×5 cm×1.5 cm),洗净沥干后,分别进行蒸制和炸制处理,并以未经处理的新鲜鱼块为对照组。将鱼块摆放在带孔不锈钢盘中,置于蒸锅中加热12 min,取出用滤纸吸去表面水分得到蒸制样品;将鱼块浸没于预先加热至180 ℃的油中油炸4 min,取出用吸油纸充分吸去样品表面油分得到炸制样品。
1.3.2 体外模拟消化模型
参考MINEKUS等[9]的方法,按照表1分别配制唾液模拟液(simulated saliva fluid,SSF)、胃液模拟液(simulated intestinal fluid,SGF)及肠液模拟液(simulated intestinal fluid,SIF)的原液。最终的SSF中α-淀粉酶的浓度为150 U/mL,SGF中胃蛋白酶的浓度为4 000 U/mL,SIF中胰蛋白酶和胆盐的浓度分别为200 U/mL和20 mmol/L。
取210 g鱼肉样品放入食品料理机中,加入80 mL唾液模拟液,在8档搅拌30 s,模拟口腔消化。然后取搅拌后的样品200 g放入模拟消化系统中的胃模型内,进行胃、十二指肠消化120 min,模型中空腹胃液为20 mL,累计流加胃液280 mL,肠液552 mL。设备运行参数[10]:胃部滚轮转速12 r/min;挤压板挤压频率和深度为5 次/min和25 mm;倾斜角0~30 min右倾斜30°,30~60 min右倾斜22.5°,60~90 min倾斜15°,60~120 min倾斜7.5°;幽门挤压频率为2次/min,挤压末端位置25 mm,挤压张开位置10 mm;肠部滚轮转速为12 r/min。消化进行30、60、90和120 min时分别于十二指肠处收集相应的消化样品,然后在4 ℃、8 000×g下离心15 min,分离沉淀和上清液,在-80 ℃冰箱贮存,备用。
表1 模拟消化液原液制备表
Table 1 Preparation of stock solutions of simulated digestion fluids
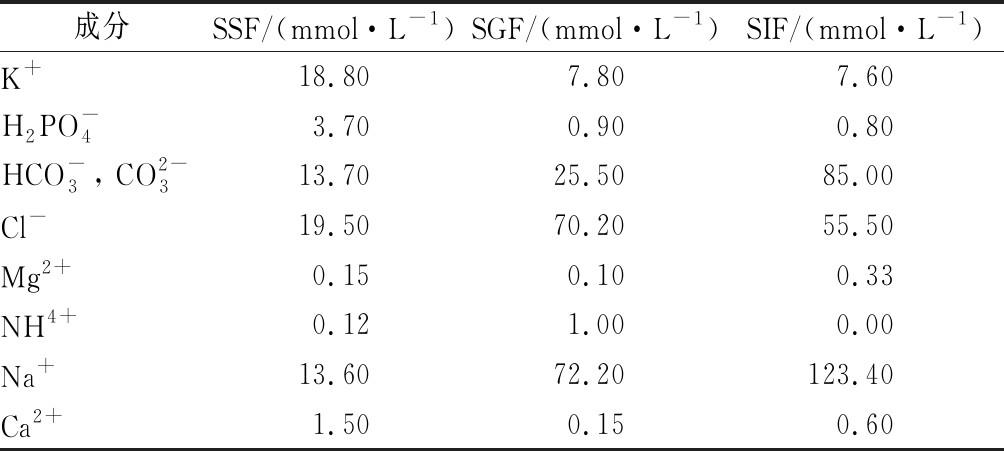
成分SSF/(mmol·L-1)SGF/(mmol·L-1)SIF/(mmol·L-1)K+18.807.807.60H2PO-43.700.900.80HCO-3, CO2-313.7025.5085.00Cl-19.5070.2055.50Mg2+0.150.100.33NH4+0.121.000.00Na+13.6072.20123.40Ca2+1.500.150.60
1.3.3 蛋白质体外消化率的测定
采用凯氏定氮法[11](GB 5009.5—2016)测定样品中总氮含量,每组3个平行。参考刘萍等[12]的方法,蛋白体外消化率以消化前样品中蛋白质含量M1与消化后沉淀物中蛋白质含量M2来计算,如公式(1)所示:
蛋白体外消化率![]()
(1)
1.3.4 粒径的测定
参照BELICIU等[13]的方法进行粒径的测定。取不同消化时间的样品上清液,稀释20倍后,采用激光粒度仪测定平均粒径,每组6个平行。
1.3.5 激光共聚焦显微镜观察
采用激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)观察鱼肉蛋白消化液的微观结构,参考杨小斌等[14]和LIU等[15]的方法略有修改。用无水乙醇配制0.1%的尼罗蓝染色剂,在4 ℃下避光保存。取1 mL消化液样品,添加40 μL尼罗蓝染色剂,充分混匀后取1滴置于载玻片中央,然后用LSCM观察其微观结构。激发波长为633 nm,接收波长为680 nm。
1.3.6 硫代巴比妥酸(thiobarbituric acid,TBA)值的测定
参考张诗雯[10]的方法进行测定。准确量取5 mL消化样品上清液,加入15 mL三氯乙酸(75 g/L)和乙二胺四乙酸二钠(10 g/L)的混合液,混匀后静置过滤,取滤液2.5 mL,加入0.02 mol/L的10 g/L溶液2.5 mL,摇匀后在90 ℃水浴中反应50 min,取出冷却至室温,在532 nm处测定样品吸光值。TBA值用每升样品中丙二醛(malondialdehyde,MAD)的毫克数表示。
1.3.7 Fe2+螯合能力的测定
参考XING等[16]的方法略有修改。准确量取3.7 mL消化样品上清液,加入0.2 mL 5 mmol/L菲洛嗪和0.1 mL 2 mmol/L FeCl2,充分混匀后在室温下静置10 min,然后在562 nm处测定样品吸光值。以去离子水替代消化液作为空白组。
1.4 数据分析
采用Excel 2013软件、Origin 8.5软件和SPSS软件对数据进行处理、作图及显著性分析;采用Gwyddion 2.53对图片进行处理。
2 结果与分析
2.1 蛋白消化率的变化
蛋白质的消化率是衡量肉品蛋白质营养价值的重要指标之一,它反映了食物中蛋白质在消化道内被蛋白酶酶解的程度,蛋白质的消化率越高,表示其被机体的消化吸收率越大[17]。由图1可知,随着消化时间的延长,各组鱼肉的蛋白体外消化率均显著上升。和新鲜鱼肉样品相比,蒸制和炸制处理显著提高了蛋白质的消化率(P<0.05),这是由于鱼肉蛋白对消化酶的敏感性取决于蛋白质的结构,经熟化处理后鱼肉蛋白发生适度热变性,导致蛋白质结构部分展开,使更多的水解位点暴露,有利于蛋白酶的水解作用而被人体消化吸收。当消化进行到终点时,炸制样品的蛋白消化率显著高于其他2组(P<0.05),由于胃蛋白酶和胰蛋白酶专一性的差异,后期模拟肠液消化阶段胰蛋白酶对炸制样品的蛋白消化速率明显增大,而蒸制样品和新鲜样品之间无显著差异(P>0.05),说明未经熟化的鱼肉同样能够被人体充分消化吸收,但消化速率相对较慢。这与韦婕妤[18]关于热处理对羊肉蛋白消化率的影响结果相类似。
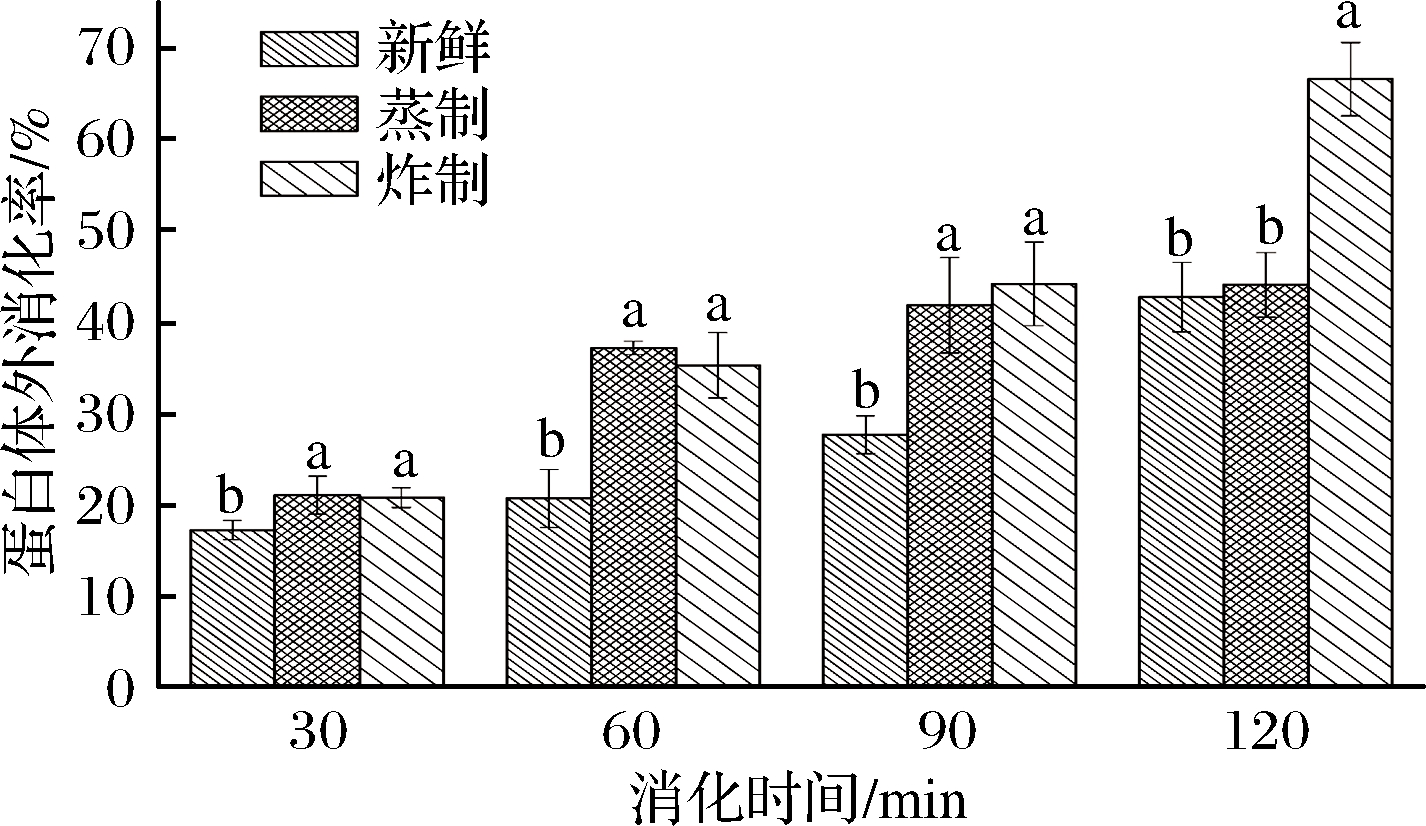
图1 蒸制和炸制对鱼肉体外模拟消化后蛋白消化率的影响
Fig.1 Effects of steaming and frying on protein digestibility of fish muscle after simulated digestion in vitro
注:不同的小写字母表示组间的差异显著(P<0.05)(下同)
2.2 粒径的变化
粒径大小是衡量消化产物的重要指标,可间接反映样品的消化程度。不同熟化方式对海鲈鱼肉体外模拟消化后蛋白质聚集体粒径的影响如图2所示。由图2可知,随着消化时间的延长,各组样品的粒径均显著降低(P<0.05)。在消化的前60 min内,炸制样品组消化后蛋白聚集体的粒径最大,其次是新鲜样品组,蒸制样品组最小,这可能是由于较长时间的高温炸制促进了鱼肉蛋白质发生交联或聚集,阻碍了蛋白质的水解作用。随着消化时间的进一步延长,新鲜样品组的粒径明显高于其他2组(P<0.05),可能是由于蒸制和炸制使蛋白质发生适度变性,有利于蛋白酶的水解作用。在消化达到120 min时,炸制样品组的粒径最小。由此说明,消化前期主要进行的胃消化阶段对蒸制样品的蛋白消化降解影响较大,促进蛋白质分解形成粒径较小的聚集体,而消化后期主要进行的肠消化阶段对炸制样品的消化影响更大,这与蛋白消化率的变化趋势相类似。
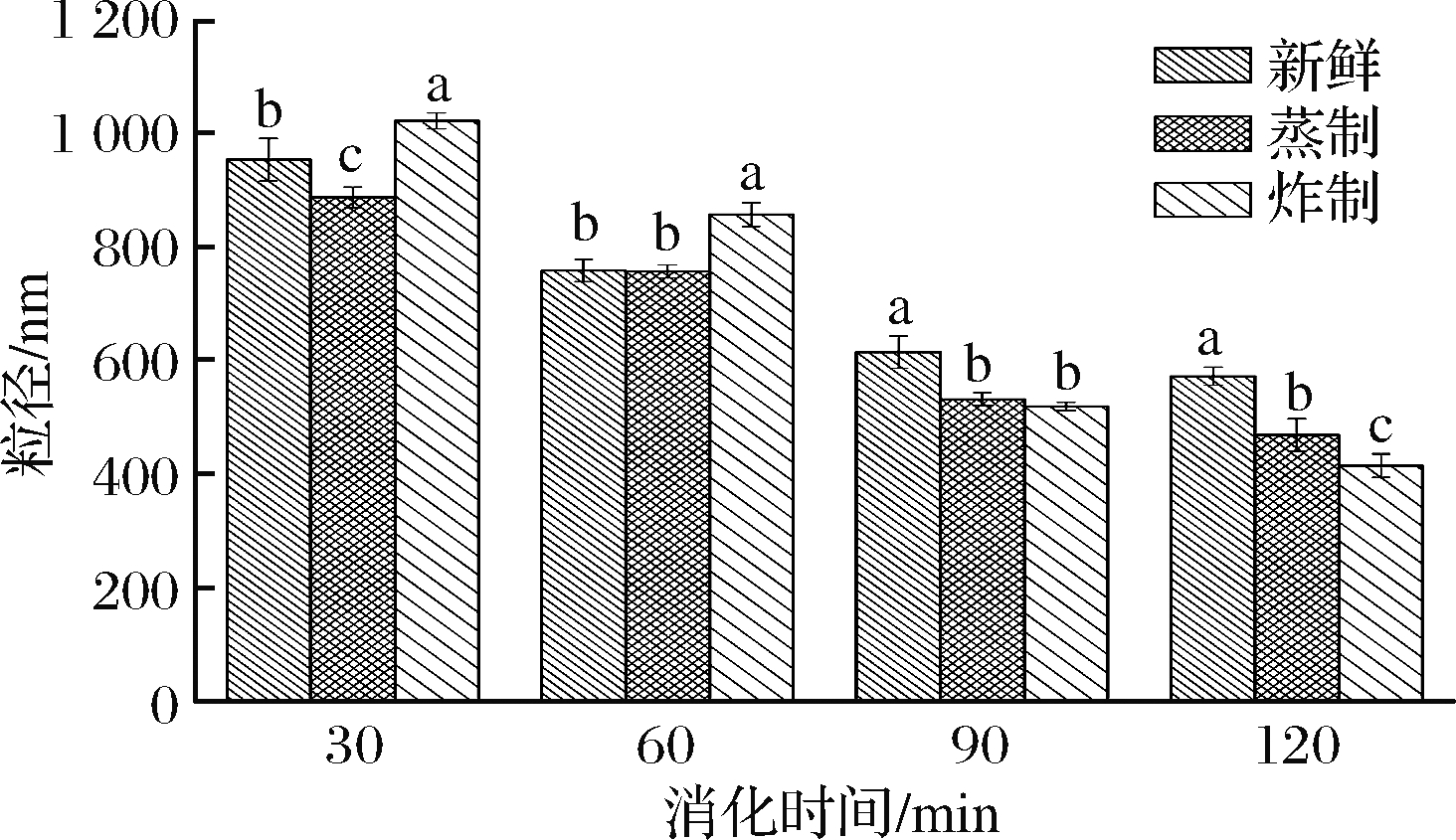
图2 蒸制和炸制对鱼肉体外模拟消化后粒径的影响
Fig.2 Effects of steaming and frying on particle size of fish muscle after simulated digestion in vitro
2.3 激光共聚焦显微镜观察微观结构的变化
激光共聚焦显微镜技术因其先进的光学切片和三维重建技术可直观获得样品清晰的微观结构,成为现代食品科学研究中最有效的荧光显微成像工具之一[19]。蒸制和炸制处理对海鲈鱼肉体外模拟消化后微观结构的影响如图3所示,图中红色荧光亮点表示被尼罗蓝染色后的蛋白颗粒。由图3可见,新鲜鱼肉样品消化液中观察到的红色荧光亮点较少,可能是因为新鲜鱼肉的消化率相对较低,蛋白聚集成团后沉积在某处,分散不均匀所致。消化30 min时,蒸制样品消化液中含有许多呈碎片状的蛋白粒子,且分布较为均匀,说明消化初期蛋白质消化不够彻底,存在较多的大颗粒蛋白聚集体,但随着消化时间的延长,蒸制样品中红色荧光亮点显著减少,说明蛋白质的消化程度明显提高。炸制样品消化30 min时,蛋白粒子被透明圆形包裹,这可能是由于经油炸后样品中的含油量增大,将蛋白颗粒包裹其中,在消化60和90 min时仍有较多较大的颗粒聚集体,说明蛋白消化仍不够彻底,而在消化120 min时样品中呈现出少量的细小颗粒。
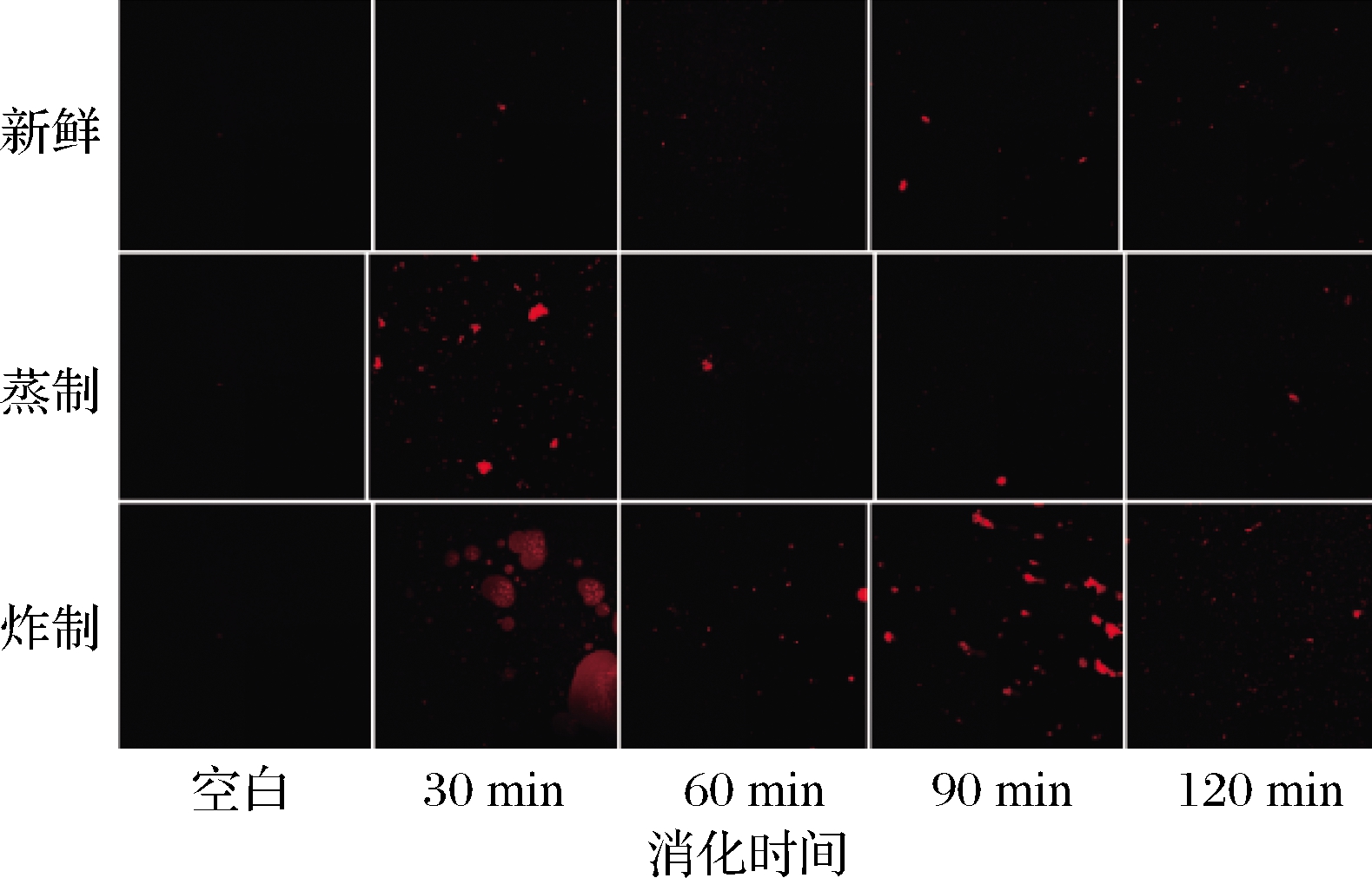
图3 蒸制和炸制对鱼肉体外模拟消化后微观结构的影响
Fig.3 Effects of steaming and frying on microstructure of fish muscle after simulated digestion in vitro
注:空白组是指未加鱼肉样品的模拟消化液
2.4 TBA值的变化
脂质易受自由基的攻击而分解产生氢过氧化物,氢过氧化物进一步分解而产生醛、酮、和醇类等次级产物[20],其中TBA测定法是利用TBA试剂与脂质氧化产生的丙二醛类物质相结合,发生显色反应,从而评价鱼肉脂质的氧化程度。图4反映的是蒸制和炸制处理对海鲈鱼肉体外模拟消化液硫代巴比妥酸值的影响。由图4可知,在消化的前90 min内,随着消化时间的延长,各组样品消化液的TBA值逐渐升高,这是因为鱼肉中含有的血红素、金属离子等物质,在鱼肉消化时可以作为助氧剂与催化剂,促进脂质氧化[21]。但消化120 min时,3组样品消化液的TBA值均又显著降低,可能是因为在胃肠消化过程中鱼肉蛋白发生了强烈的水解作用,产生了很多抗氧化肽类物质,从而使脂肪氧化受到抑制[22]。和新鲜鱼肉样品相比,蒸制和炸制处理均显著提高了消化液的TBA值(P<0.05),说明这2种熟化方式均促进了鱼肉脂肪的氧化反应,其中炸制处理组的TBA值最大,这是因为油炸温度相对较高,使油脂氧化程度增强[23],此外,由于油炸过程中有少量油脂附着在鱼肉表面也可能使炸制样品组的TBA值增大。
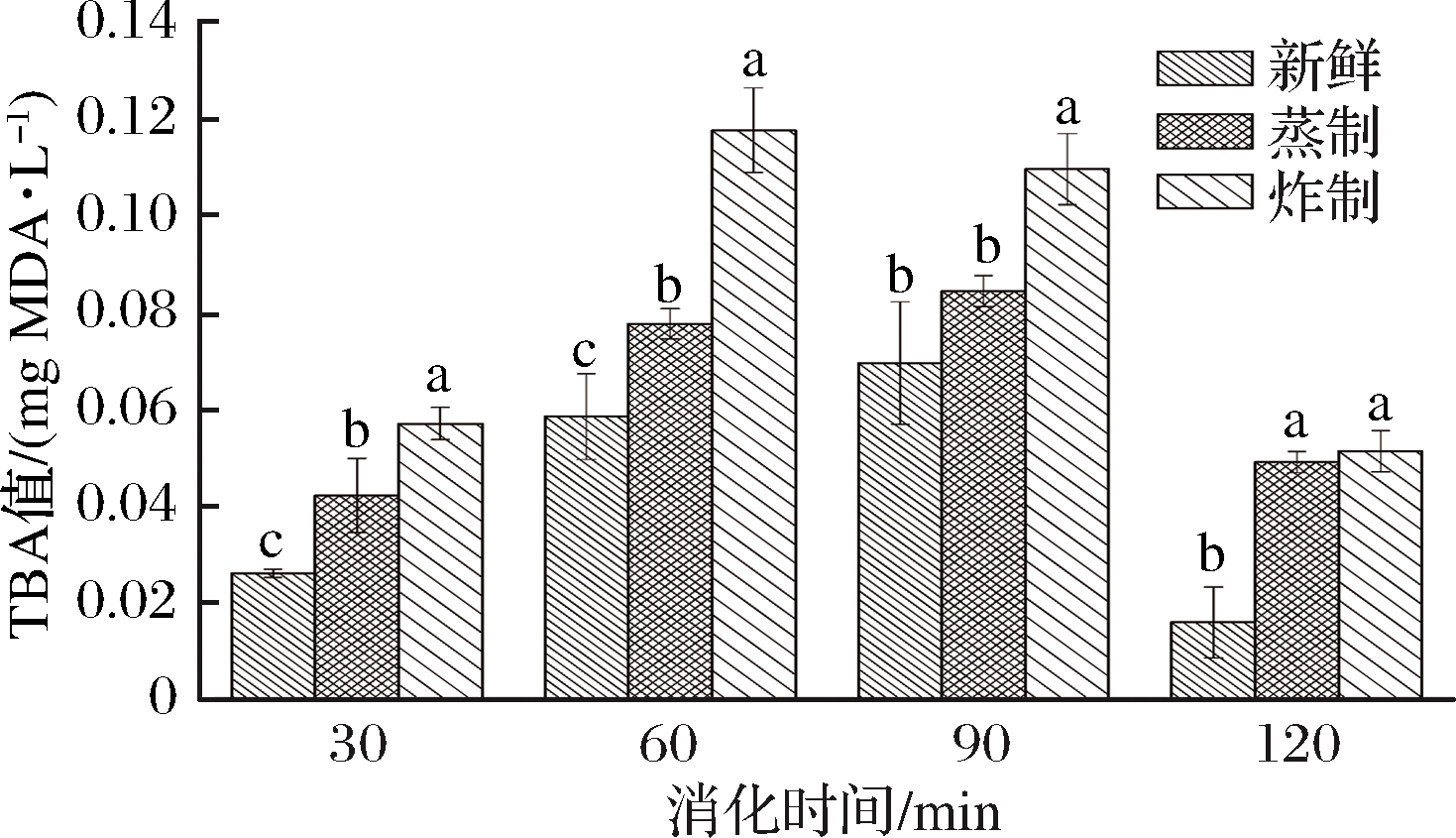
图4 蒸制和炸制对鱼肉体外模拟消化后TBA的影响
Fig.4 Effects of steaming and frying on TBA value of fish muscle after simulated digestion in vitro
2.5 Fe2+螯合能力的变化
Fe2+螯合能力是反映体系抗氧化活力的一个重要指标。Fe2+能与菲洛嗪结合形成紫色复合物,在562 nm处具有最大吸收峰,其吸光值越小,说明样品的抗氧化能力越强[24]。图5反映的是不同熟化方式对海鲈鱼肉体外模拟消化后Fe2+螯合能力的影响。由图5可见,随着消化时间的延长,各组样品的Fe2+螯合能力显著增大,说明鱼肉样品经体外模拟消化促使蛋白质分解产生许多的小肽和游离氨基酸,有些具有良好的抗氧化活性[25]。QIAN等[26]研究表明,一些小分子短肽中暴露的中性和酸性氨基酸,其结构中含有的游离羧基能够抑制金属离子诱导自由基产生,从而具有较强的Fe2+螯合能力。在消化的前60 min内,炸制样品消化液的Fe2+螯合能力显著低于蒸制和新鲜海鲈鱼肉样品(P<0.05),可能是油炸处理促进了自由基的产生及脂质氧所导致的。当消化进行到终点时,蒸制和炸制样品的Fe2+螯合能力明显高于对照组,可能是由于后期消化阶段促使肉分解产生大量含有中性和酸性氨基酸的小肽,从而使其抗氧化能力增强。
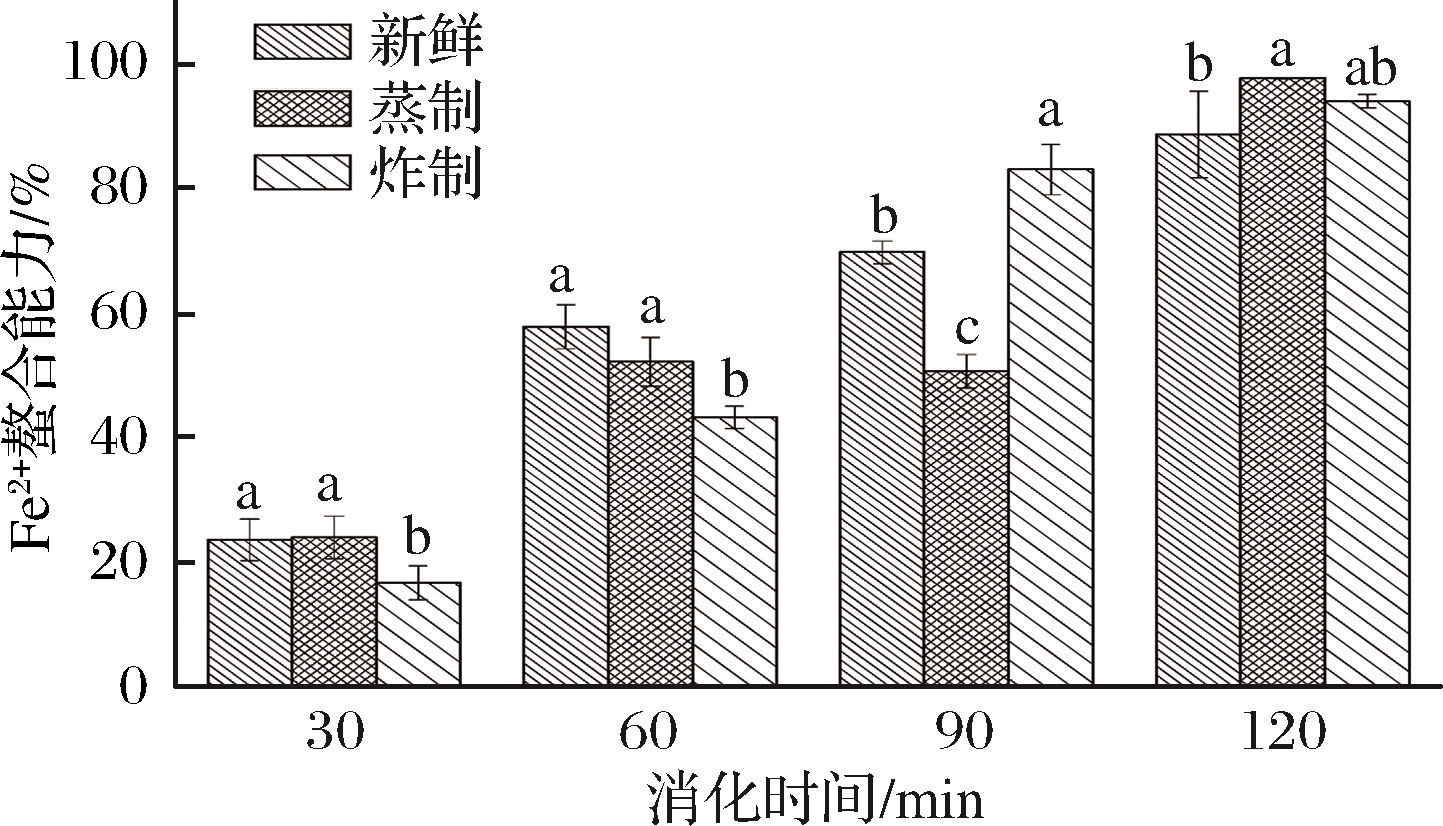
图5 蒸制和炸制对海鲈鱼肉体外模拟消化后Fe2+ 螯合能力的影响
Fig.5 Effects of steaming and frying on Fe2+ chelating capacity of fish muscle after simulated digestion in vitro
3 结论
与对照组相比,蒸制和炸制处理均显著提高了海鲈鱼肉体外模拟消化后的蛋白消化率(P<0.05),显著降低了消化液中蛋白质聚集体的粒径(P<0.05),更有利于人体的消化吸收,其中消化后期模拟肠液阶段对炸制样品的消化速率明显增大;随着体外模拟消化时间的延长,蛋白质聚集体逐渐被分解成细小的颗粒,分散于消化液中。经体外模拟消化后样品的TBA值随消化时间的延长呈先增大后又降低的趋势,表明体外模拟消化加速了脂质氧化,其中炸制样品组脂肪氧化程度较高;随消化时间的延长,样品的Fe2+螯合能力明显提高,其中蒸制样品在消化终点时的Fe2+螯合能力最大,其抗氧化性较强。
[1] 吴燕燕, 李冰, 朱小静, 等.养殖海水和淡水鲈鱼的营养组成比较分析[J].食品工业科技, 2016, 37(20):348-352.
WU Y Y, LI B, ZHU X J, et al.Comparison of nutrient composition of cultured sea bass and cultured fresh-water bass, Lateolabrax japonicas and Micropterus salmoides[J].Science and Technology of Food Industry, 2016, 37(20):348-352.
[2] 蔡路昀, 马帅, 曹爱玲, 等.6-姜酚协同超高压处理对冷藏海鲈鱼品质的影响[J].中国食品学报, 2017, 17(11):158-165.
CAI L Y, MA S, CAO A L, et al.Effects of Ultra-high pressure combined with 6-gingerol on the quality of Japanese sea bass during refrigerated storage[J].Journal of Chinese Institute Of Food Science and Technology, 2017, 17(11):158-165.
[3] CAI L, CAO A, BAI F, et al.Effect of ε-polylysine in combination with alginate coating treatment on physicochemical and microbial characteristics of Japanese sea bass (Lateolabrax japonicas) during refrigerated storage[J].LWT-Food Science and Technology, 2015, 62(2):1 053-1 059.
[4] 王煜坤. 两种鱼的营养特征及鲈鱼贮藏期品质变化分析[D].广州:广东药科大学, 2018.
WANG Y K.Analyses on nutritional characteristics of two fishes and changes in quality of frozen bass[D].Guangzhou:Guangdong Pharmaceutical University, 2018.
[5] 邓泽元, 乐国伟.食品营养学[M].南京:东南大学出版社, 2007.
DENG Z Y, LE G W.Food Nutrition[M].Nanjing:Southeast University Press, 2007.
[6] 伍鹏, 王晶晶, 董志忠, 等.体外仿生消化系统的研究进展——从静态到动态[J].生物产业技术, 2019(6):26-41.
WU P, WANG J J, DONG Z Z, et al.Advance in biomimetic in vitro digestion systems-from static to dynamic[J].Biotechnology and Business, 2019,6:26-41.
[7] 韦婕妤, 唐善虎, 杨琪.不同热加工方法对羊肉制品体外模拟可消化性研究[J].食品科技, 2018, 43(12):125-130.
WEI J Y, TANG S H, YANG Q.Study on the digestion of mutton products in vitro by different heat processing methods[J].Food Science and Technology, 2018, 43(12):125-130.
[8] 杨万君, 周轶亭, 周光宏, 等.三种品牌酱排骨中蛋白质体外消化研究[J].肉类工业, 2017(3):17-23.
YANG W J, ZHOU Y T, ZHOU G H, et al.Study on the vitro digestion of protein in three brands sauced spare ribs[J].Meat Industry, 2017, (3):17-23.
[9] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food-An international consensus[J].Food Function, 2014, 5(6):1 113-1 124.
[10] 张诗雯. 芹菜对鱼糜制品凝胶品质及体外消化特性的影响[D].锦州:渤海大学, 2019.
ZHANG S W.Effects of celery on gel quality and in vitro digestion characteristics of surimi-based production[D].Jinzhou:Bohai University, 2019.
[11] 中国卫生和计划生育委员会.GB 5009.5—2016 食品安全国家标准 食品中蛋白质的测定[S].北京:中国标准出版社, 2016:1-3.
National Health and Family Planning Commission of PRC.GB 5009.5—2016 Determination of protein in foods[S].Beijing:China Standards Press, 2016:1-3.
[12] 刘萍, 祁兴普, 战旭梅, 等.休闲鱼肉粒的体外消化模拟及其产物抗氧化效果评价[J].食品与机械, 2014(6):135-138.
LU P, QI X P, ZHAN X M, et al.Simulation on in vitro digestion and evaluation on antioxidant evaluation to snack silver carp grain[J].Food and Machinery, 2014(6):135-138.
[13] BELICIU C M, MORARU C I.The effect of protein concentration and heat treatment temperature on micellar casein-soy protein mixtures[J].Food Hydrocolloids, 2011, 25(6):1 448-1 460.
[14] 杨小斌, 周爱梅, 王爽, 等.蓝圆鲹鱼油微胶囊的结构表征与体外消化特性[J].食品科学, 2019, 40(1):117-122.
YANG X B, ZHOU A M, WANG S, et al.Structure characterization and in vitro digestibility of microencapsulated decapterus maruadsi fish oil[J].Food Science, 2019, 40(1):117-122.
[15] LIU W, LANIER T C.Combined use of variable pressure scanning electron microscopy and confocal laser scanning microscopy best reveal microstructure of comminuted meat gels[J].LWT-Food Science and Technology, 2015, 62(2):1 027-1 033.
[16] XING L J, HU Y Y, HU H Y, et al.Purification and identification of antioxidative peptides from dry-cured Xuanwei ham[J].Food Chemistry, 2016, 194:951-958.
[17] 游义娇, 佟平, 袁娟丽, 等.食物蛋白质体外消化模型研究进展[J].食品工业科技, 2017,38(6):381-385.
YOU Y J, TONG P, YUAN J L, et al.Progress on in vitro model for protein digestion[J].Science and Technology of Food Industry, 2017,38(6):381-385.
[18] 韦婕妤. 热加工方式对羊肉制品蛋白质氧化及体外模拟消化性的影响研究[D].成都:西南民族大学, 2019.
WEI J Y.Effects of thermal processing on protein oxidation and digestive simulation of mutton products in vitro[D].Chengdu:Southwest University for Nationalities, 2019.
[19] 陈晨, 陆乃彦, 范大明, 等.激光共聚焦扫描显微镜技术在不同食品体系中的应用研究[J].食品安全质量检测学报, 2018, 9(17):4 581-4 586.
CHEN C, LU N Y, FAN D M, et al.Application of confocal laser scanning microscope in food system[J].Journal of Food Safety and Quality, 2018, 9(17):107-112.
[20] GUYON C, MEYNIER A, DE LAMBALLERIE M.Protein and lipid oxidation in meat:A review with emphasis on high-pressure treatments[J].Trends in Food Science and Technology, 2016,3 750:131-143.
[21] 胡吕霖. 烹饪对鲟鱼蛋白质氧化及消化性的影响研究[D].杭州:浙江大学, 2018.
HU L L.Effect of cooking styles on protein oxidation and proteolysis of muscle from sturgeon (Acipenser gueldenstaedtii)[D].Hangzhou:Zhejiang University, 2018.
[22] 霍艳姣, 王波, 郭珊珊, 等.鱼肉蛋白肽在模拟胃肠消化吸收过程中的抗氧化活性和生物利用度[J].食品工业科技, 2016,37(6):174-178.
HUO Y J, WANG B, GUO S S, et al.Antioxidant activity and bioavailability of the Pacific cod meat peptides during simulated gastrointestinal digestion and absorption[J].Science and Technology of Food Industry, 2016,37(6):174-178.
[23] 吴琼. 熟化方式对大菱鲆肌肉品质的影响[D].大连:大连工业大学, 2016.
WU Q.Effect of different cooking methods on the quality of turbot (Scophthalmus maximus) muscle[D].Dalian:Dalian Polytechnic University, 2016.
[24] 王正旋. 大米蛋白体外消化及抗氧化作用效果的研究[D].哈尔滨:哈尔滨工业大学, 2017.
WANG Z X.Effects of rice protein on in vitro digestibility and antioxidation[D].Harbin:Harbin Institute of Technology, 2017.
[25] 王乐, 成晓瑜, 马晓钟, 等.金华火腿加热烹饪和体外模拟消化后粗肽抗氧化和ACE抑制活性比较研究[J].肉类研究, 2018, 32(1):16-22.
WANG L, CHENG X Y, MA X Z, et al.Comparison of antioxidant and angiotensin converting enzyme inhibitory activities of crude peptide extract from jinhua ham after cooking and in vitro simulated gastrointestinal digestion[J].Meat Research, 2018, 32(1):16-22.
[26] QIAN Z, JUNG W, KIM S.Free radical scavenging activity of a novel antioxidative peptide purified from hydrolysate of bullfrog skin, Rana catesbeiana Shaw[J].Bioresource Technology, 2008, 99(6):1 690-1 698.