龙葵果(Solanum nigrum fruit) 为茄科茄属龙葵种,一年生草本植物,全国大部分省区均有分布[1],具有清热解毒、活血化瘀、利水消肿等功效。龙葵果中的主要成分大体可分为三类,即生物碱类成分、皂苷类成分和非皂苷类成分。其中最主要的有效活性成分的是生物碱类,其次是多糖。龙葵果多糖作为龙葵果中的主要成分之一,近年来国内外学者通过实验证明其具有抗肿瘤、抗氧化、抗炎、肾脏保护、免疫调节等作用[2-3]。
在对龙葵果多糖进行提取时,发现了多糖提取液中含有较多的蛋白质,而对龙葵果多糖生物学功效研究的前提是获得纯度均一的多糖,所以脱蛋白是多糖分离纯化中首要的、关键的环节[4]。分离蛋白的方法主要有:三氯乙酸法、Sevage法及酶法脱蛋白等。其中Sevage 法脱蛋白条件较为温和, 但脱蛋白效率不高, 往往需要操作多次才能达到满意的效果, 操作繁琐。酶法脱蛋白对复合酶的种类及比例选择性高,应用较为困难,实际操作中应用较少。三氯乙酸法脱蛋白时,反应较为剧烈,易破坏多糖原有构型,部分多糖发生水解。但是三氯乙酸法是根据蛋白质在有机酸的作用下,形成不可逆的沉淀,所以脱蛋白效果好且效率高[5-7]。
因此,本文通过响应面法优化了三氯乙酸脱除龙葵果多糖中蛋白质的最佳工艺,为龙葵果多糖后续研究工作奠定基础。
1 材料与方法
1.1 材料与仪器
无水乙醇、三氯乙酸、苯酚、浓H2SO4、考马斯亮蓝、牛血清白蛋白、葡萄糖等试剂均为分析纯或化学纯;实验所用药材购自于长春市吉林大药房,经鉴定为龙葵果。
紫外可见分光光度计,上海元析仪器有限公司UVT5500TC;数显恒温水浴锅,常州天瑞仪器有限公司HH4;循环水式多用真空泵,上海豫康科教仪器设备有限公司;电子天平,上海浦春计量仪器有限公司;DHG—9070A电热恒温鼓风干燥箱,上海精宏实验设备有限公司;TG16G台式高速离心机,湖南凯达科学仪器有限公司;FD-1A-50冷冻干燥机,北京博医康实验仪器有限公司;HAO-100A小型快速粉碎机,广州赛豪机械有限公司。
1.2 实验方法
1.2.1 葡萄糖标准曲线绘制
精密量取储备液0、0.2、0.4、0.6、0.8、1.0、1.2 mL于试管中,需平行测定3次,并以蒸馏水补至2.0 mL,加入6%苯酚1 mL,随后加入浓H2SO4 5 mL,振荡摇匀至沸水浴中,加热30 min,取出后冷却至室温,然后用紫外分光光度计于480 nm处测吸光值。以葡萄糖溶液浓度(x)为横坐标,吸光度(y)为纵坐标绘制标准曲线,考察线性关系[8],葡萄糖标准曲线为y=8.503 4x-0.007 7,R2=0.998 7。
1.2.2 蛋白质标准曲线绘制
取0.05 mg/mL牛血清白蛋白标准溶液0、0.2、0.4、0.6、0.8、1.0 mL,补加蒸馏水至1.0 mL,随后加入4 mL考马斯亮蓝溶液,轻轻振荡,使其混匀,室温静置15 min,采用蒸馏水为空白对照,测定吸光光度值A595,测定3个平行样,并取其平均值。横坐标(x)为牛血清白蛋白质量,纵坐标(y)为595 nm处吸光值,绘制标准曲线[9]。
1.2.3 龙葵果多糖提取
取干燥龙葵果50 g,加入1 000 mL蒸馏水(料液比1∶20),沸水浴上加热5 h,重复2次,抽滤,取滤液,浓缩至一定体积,加4倍量的无水乙醇,静置24 h,抽滤沉淀,即得深棕色粉末状物质[10]。冷冻干燥,称重,得龙葵果粗多糖27.5 g。
1.2.4 三氯乙酸法脱蛋白
将龙葵果粗多糖配制成50 g/L的粗多糖水溶液,取粗多糖样品溶液20 mL,加入适量的三氯乙酸,调节至最终浓度为50 g/L,4 ℃低温静置过夜, 3 000 r/min 条件下离心5 min,弃去沉淀,取上清液测蛋白质含量[11]。
1.2.5 龙葵果多糖损失率的计算
采用苯酚-硫酸法,以葡萄糖为对照品,取1 mL龙葵果粗多糖溶液,同法显色后,按照标准曲线操作方式测量吸光度值A,代入葡萄糖标准无线中,计算脱蛋白前后多糖溶液中葡萄糖的含量[12],按公式(1)计算多糖损失率:
多糖损失率![]()
(1)
式中:m1表示脱蛋白前多糖溶液中葡萄糖含量;m2表示脱蛋白后多糖溶液中葡萄糖含量。
1.2.6 龙葵果多糖中蛋白脱除率的计算
采用考马斯亮蓝法,以牛血清白蛋白为对照品,取1 mL龙葵果粗多糖溶液,同法显色后,按照标准曲线操作方式测量吸光度值A,代入蛋白质标准曲线,计算脱蛋白前后多糖溶液中蛋白质的含量,按公式(2)计算蛋白脱除率:
蛋白脱除率![]()
(2)
式中:c1表示脱蛋白前多糖溶液中蛋白质的含量;c2表示脱蛋白后多糖溶液中蛋白质的含量。
1.2.7 三氯乙酸法脱蛋白单因素试验
将振荡时间、除蛋白次数、三氯乙酸浓度作为考察因素,实验设计如下:振荡时间分别为10、15、20、25、30 min;除蛋白次数分别为1、2、3、4、5次;三氯乙酸质量浓度分别为20、40、60、80、100 g/L。除了变动的单因素外,其余均采用预实验中各因素的合适条件:振荡时间20 min,除蛋白次数2次,三氯乙酸质量浓度60 g/L。
1.2.8 龙葵果多糖脱蛋白的响应面实验
响应面实验是在单因素实验的基础上通过分析各因素对龙葵果多糖脱蛋白率的影响程度,设计振荡时间、除蛋白次数、三氯乙酸浓度为自变量,采用Design-Expert 8.0.6软件进行3因素3水平的Box-Behnken中心组合实验设计,对三氯乙酸法脱除龙葵果多糖中蛋白质的条件进行优化,其实验因素和水平设计见表1[13-15]。
表1 Box-Behnken实验设计因素和水平表
Table 1 Box-behnken experimental designfactors and level table

水平因素振荡时间(A)/min除蛋白次数(B)/次三氯乙酸质量浓度(C)/(g·L-1)-115140020260125380
使用Design-Expert 8.0.6软件的数据处理系统对响应面实验数据进行分析,最终获得三氯乙酸法脱除龙葵果多糖中蛋白质的最佳工艺条件。
1.3 数据处理
单因素实验采用Excel 2010进行数据处理。Box-Behnken设计采用Design-Expert 8.0.6软件对响应面实验数据进行二次多项回归拟合方差分析、显著性检测和响应面分析,获取回归模型及最佳提取工艺参数。各组试验均重复3次,数据结果以平均值±标准偏差(n=3)的形式表示。
2 结果与分析
2.1 三氯乙酸法脱除龙葵果多糖中蛋白质的单因素结果分析
2.1.1 振荡时间对蛋白脱除率和多糖损失率的影响
本实验在三氯乙酸质量浓度为60 g/L,除蛋白2次的条件下,分别振荡5、10、15、20、25、30 min时,蛋白脱除率和多糖损失率如图1所示。
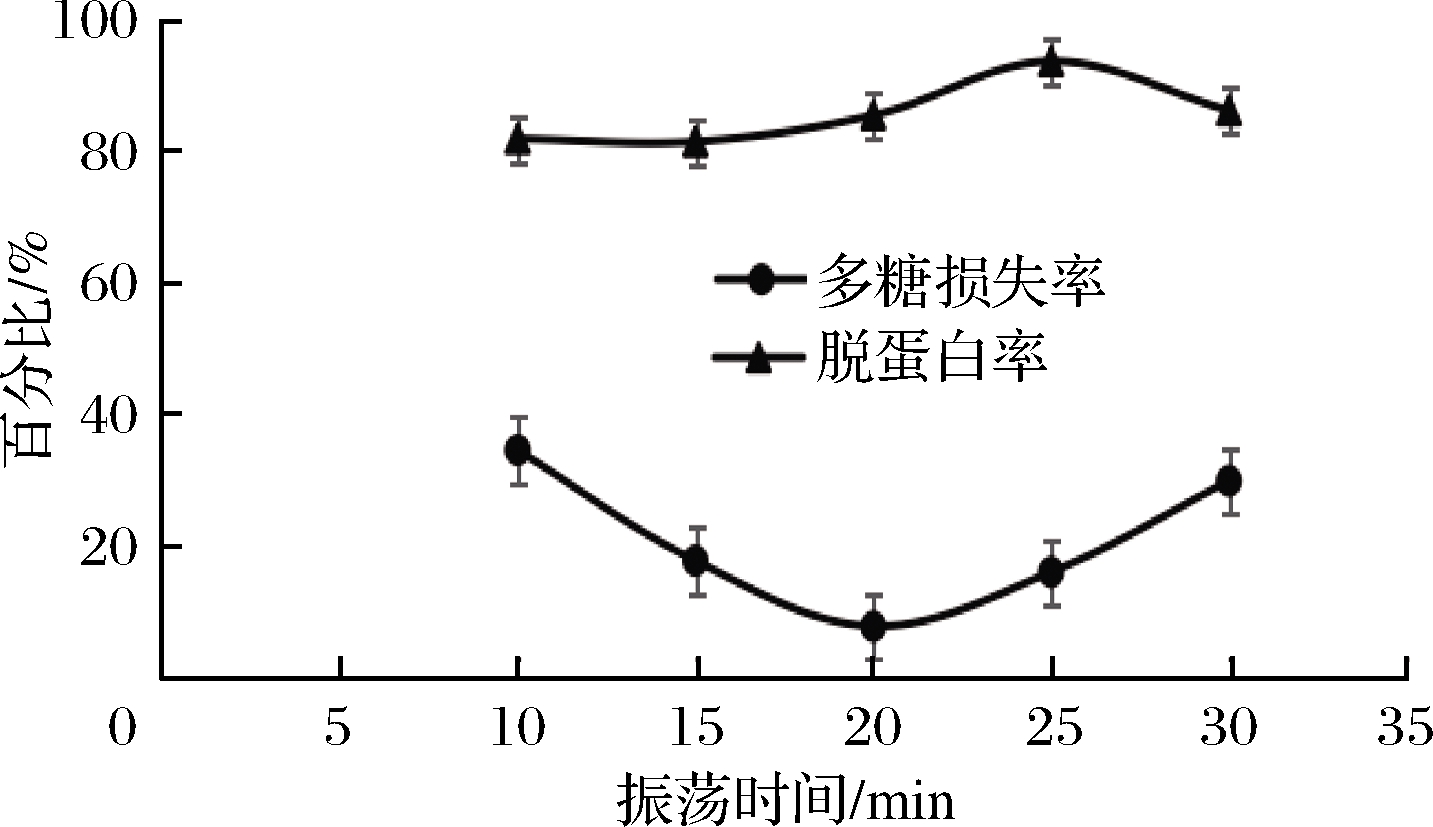
图1 振荡时间对蛋白脱除率和多糖损失率的影响
Fig.1 Effect of oscillation time on protein removal rate and polysaccharide loss rate
由图1可知,随着振荡时间的增加,龙葵果多糖中蛋白质脱除率呈缓慢增加又降低的趋势,当脱蛋白时间在20~25 min时,随着时间延长蛋白质脱除率逐渐升高,在25 min时,蛋白质脱除率达到最高值为93.54%。之后随着时间的增长,蛋白脱除率逐渐降低,所以蛋白脱除时间不宜过长[16-18]。但是在振荡20 min时,多糖的损失率最小,因此,综合考虑振荡时间20 min为最佳。选择15、20、25 min作为响应面设计的3个水平。
2.1.2 除蛋白次数对蛋白脱除率和多糖损失率的影响
本实验在三氯乙酸质量浓度为60 g/L,振荡20 min的条件下,除蛋白1、2、3、4、5次时,蛋白脱除率和多糖损失率如图2所示。
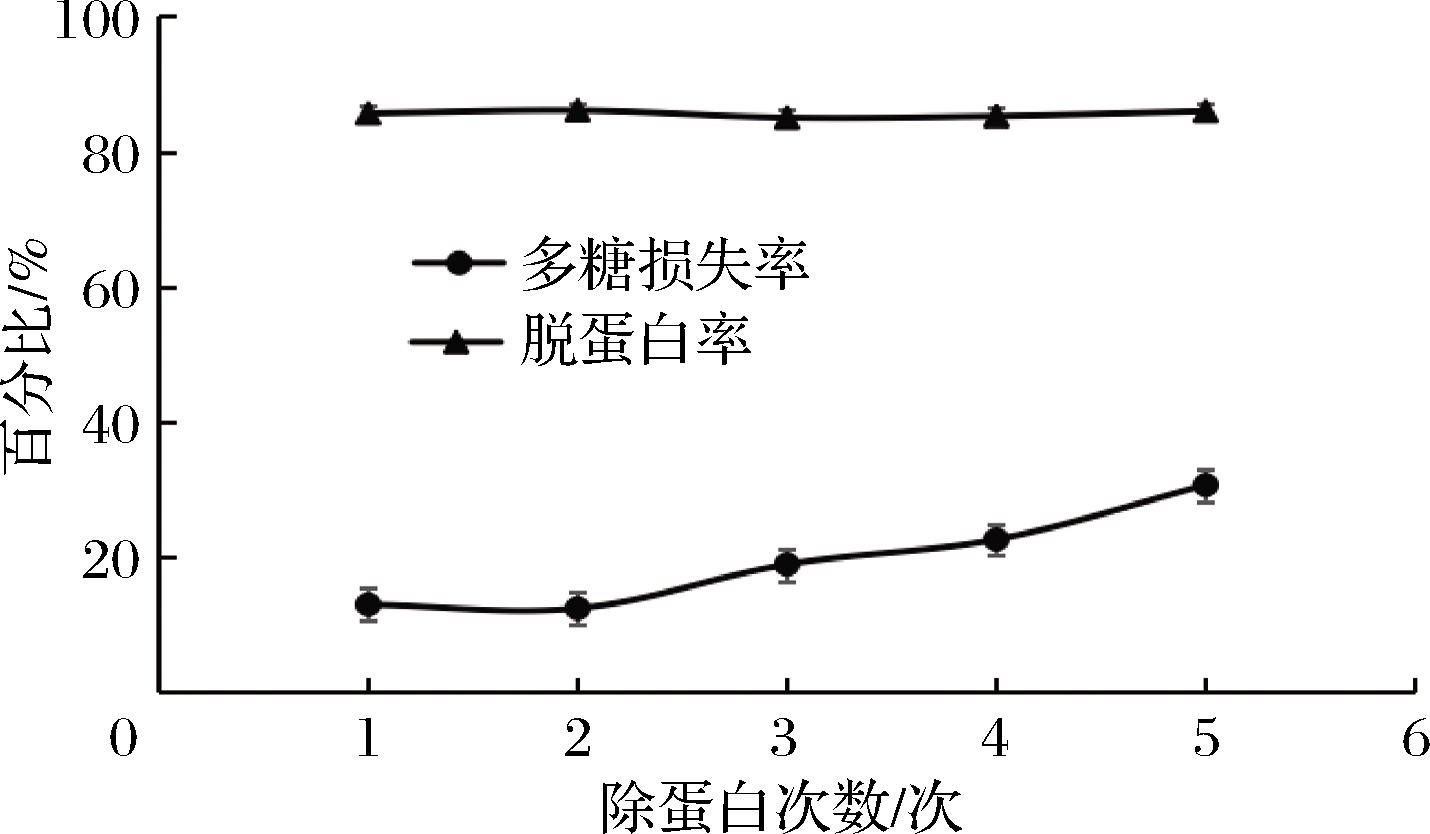
图2 除蛋白次数对蛋白脱除率和多糖损失率的影响
Fig.2 Effect of the number of protein removal on protein removal rate and polysaccharide loss rate
由图2可知,除蛋白次数对脱蛋白率的影响不是很大,但是随着除蛋白次数的增多,多糖的损失率也随之增大,这是由于三氯乙酸与多糖溶液容易发生剧烈的反应,导致多糖降解,影响多糖得率[19-21]。因此,综合考虑选择除蛋白次数2次,这时蛋白脱除率为86.06%。选择1、2、3次作为响应面设计的3个水平。
2.1.3 三氯乙酸质量浓度对蛋白脱除率和多糖损失率的影响
本实验在振荡20 min,除蛋白2次的条件下,分别加入质量浓度为20、40、60、80、100 g/L的三氯乙酸,其蛋白脱除率和多糖损失率如图3所示。
由图3可知,随着三氯乙酸浓度的增加,蛋白脱除率逐渐增大,在60 g/L时,蛋白脱除率达到最大值72.34%,随着三氯乙酸浓度的持续升高,蛋白脱除率不再有显著的变化,而多糖损失率却逐渐增大。因此选取三氯乙酸溶液质量浓度为60 g/L,此时多糖的损失率也达到最低值19.67%。选择三氯乙酸质量浓度为40、60、80 g/L作为响应面设计的3个水平。

图3 三氯乙酸浓度对蛋白脱除率和多糖损失率的影响
Fig.3 Effect of trichloroacetic acid concentration on protein removal rate and polysaccharide loss rate
2.2 响应面法优化三氯乙酸脱除龙葵果多糖蛋白质的工艺
2.2.1 Box-Behnken中心组合实验设计及结果
在单因素实验基础上,根据Box-Behnken中心组合实验设计原理,确定以振荡时间(A)、除蛋白次数(B)、三氯乙酸质量浓度(C)为基础设计3因素3水平共17组响应面分析实验,实验方案设计及结果见表2。
表2 Box-Behnken中心组合实验设计及结果
Table 2 Box-Behnken center combination experimental design and results
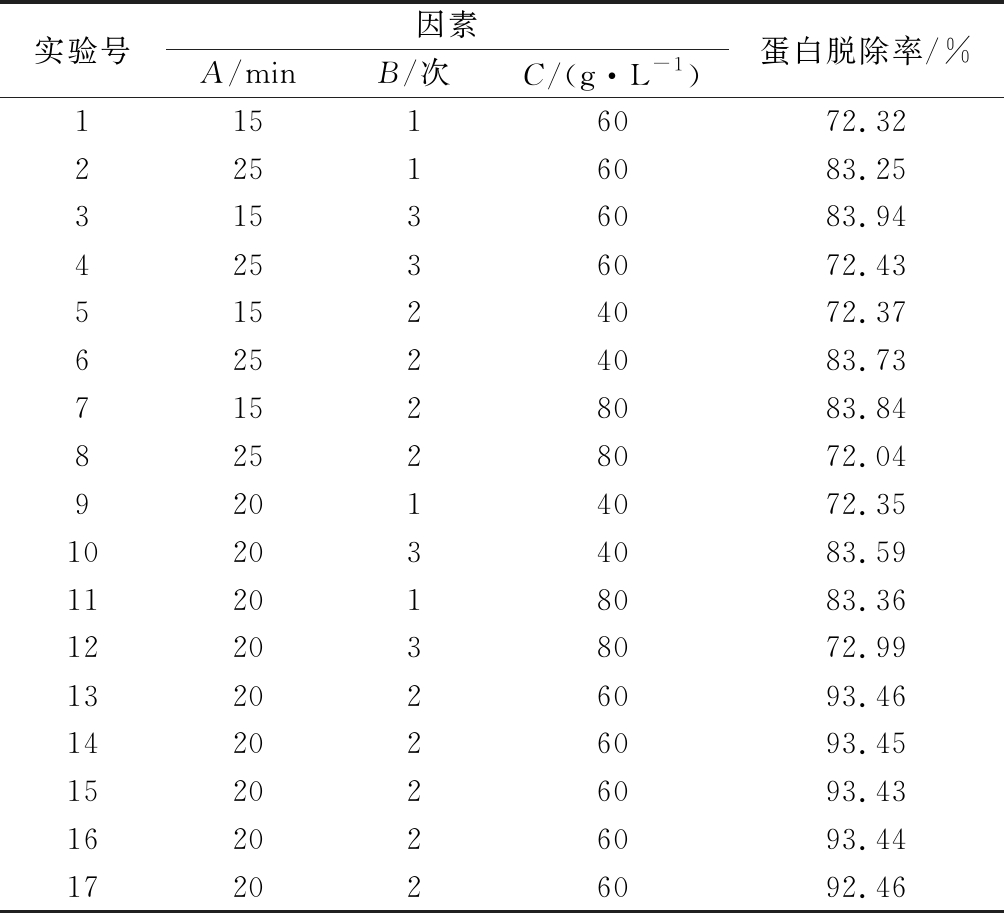
实验号因素蛋白脱除率/%A/minB/次C/(g·L-1)11516072.3222516083.2531536083.9442536072.4351524072.3762524083.7371528083.8482528072.0492014072.35102034083.59112018083.36122038072.99132026093.46142026093.45152026093.43162026093.44172026092.46
2.2.2 回归模型的建立及显著性分析
以龙葵果多糖中蛋白脱除率为影响值,对中心组合的实验结果进行回归分析,获得一个二次多项回归方程:Y=93.25-0.13A+0.21B+0.024C-5.61AB-5.79AC-5.40BC-7.67A2-7.59B2-7.58C2
由表3可知,模型P值小于0.000 1,表明回归模型极显著,失拟项F=0.090,P值为0.961 5大于0.05,不显著,说明回归方程模型能够较好地拟合实验数据。相关系数R2=0.999 3,调整决定系数为![]() 变异系数CV=0.98%较小,说明模型拟合度较好,误差较小,能准确预测实际情况[22]。其中,振荡时间(A)、除蛋白次数(B)、三氯乙酸浓度(C)的二次项都达到了极显著水平,振荡时间和除蛋白次数的相互作用、振荡时间和三氯乙酸浓度以及除蛋白次数和三氯乙酸浓度的相互作用对龙葵果多糖中蛋白质的脱除率影响也是极显著的。
变异系数CV=0.98%较小,说明模型拟合度较好,误差较小,能准确预测实际情况[22]。其中,振荡时间(A)、除蛋白次数(B)、三氯乙酸浓度(C)的二次项都达到了极显著水平,振荡时间和除蛋白次数的相互作用、振荡时间和三氯乙酸浓度以及除蛋白次数和三氯乙酸浓度的相互作用对龙葵果多糖中蛋白质的脱除率影响也是极显著的。
表3 回归模型方差分析表
Table 3 Regression model analysis of variance table
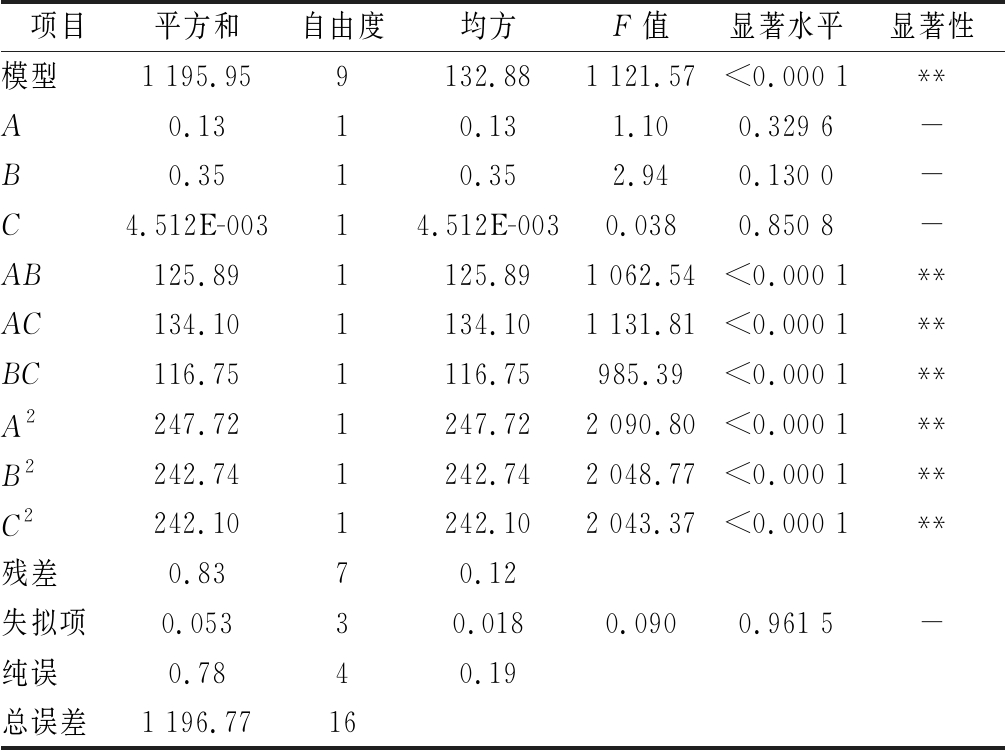
项目平方和自由度均方F值显著水平显著性模型1 195.959132.881 121.57<0.000 1**A0.1310.131.100.329 6-B0.3510.352.940.130 0-C4.512E-00314.512E-0030.0380.850 8-AB125.891125.891 062.54<0.000 1**AC134.101134.101 131.81<0.000 1**BC116.751116.75985.39<0.000 1**A2247.721247.722 090.80<0.000 1**B2242.741242.742 048.77<0.000 1**C2242.101242.102 043.37<0.000 1**残差0.8370.12失拟项0.05330.0180.0900.961 5-纯误0.7840.19总误差1 196.7716
注:“**”表示差异极显著(P<0.000 1);“-”表示差异不显著(P>0.05)
2.2.3 响应面优化分析
采用Design-Expert 8.0.6软件绘制得到响应面曲面图和等高线图,如图4、图5、图6所示,分别表示振荡时间(A)和除蛋白次数(B)、振荡时间(A)和三氯乙酸质量浓度(C)、除蛋白次数(B)和三氯乙酸质量浓度(C)交互作用的响应面曲面图和等高线图。在响应面图中,坡面越陡峭,则表明蛋白质脱除率受实验因素影响越显著,反之响应面的坡面越平缓,则蛋白质脱除率受实验因素影响越小[23]。由图4可以看出,在振荡时间和除蛋白次数的交互作用下,对蛋白脱除率的影响是极显著的,但是振荡时间对蛋白脱除率的影响要大于除蛋白次数对蛋白脱除率的影响;图5表明,在三氯乙酸质量浓度和振荡时间的相互作用下,三氯乙酸浓度对蛋白脱除率的影响大于振荡时间对蛋白脱除率的影响;由图6可以看出,在除蛋白次数和三氯乙酸质量浓度的交互作用下,对蛋白脱除率的影响极为显著,并且三氯乙酸质量浓度对蛋白脱除率的影响要大于除蛋白次数对蛋白脱除率的影响。
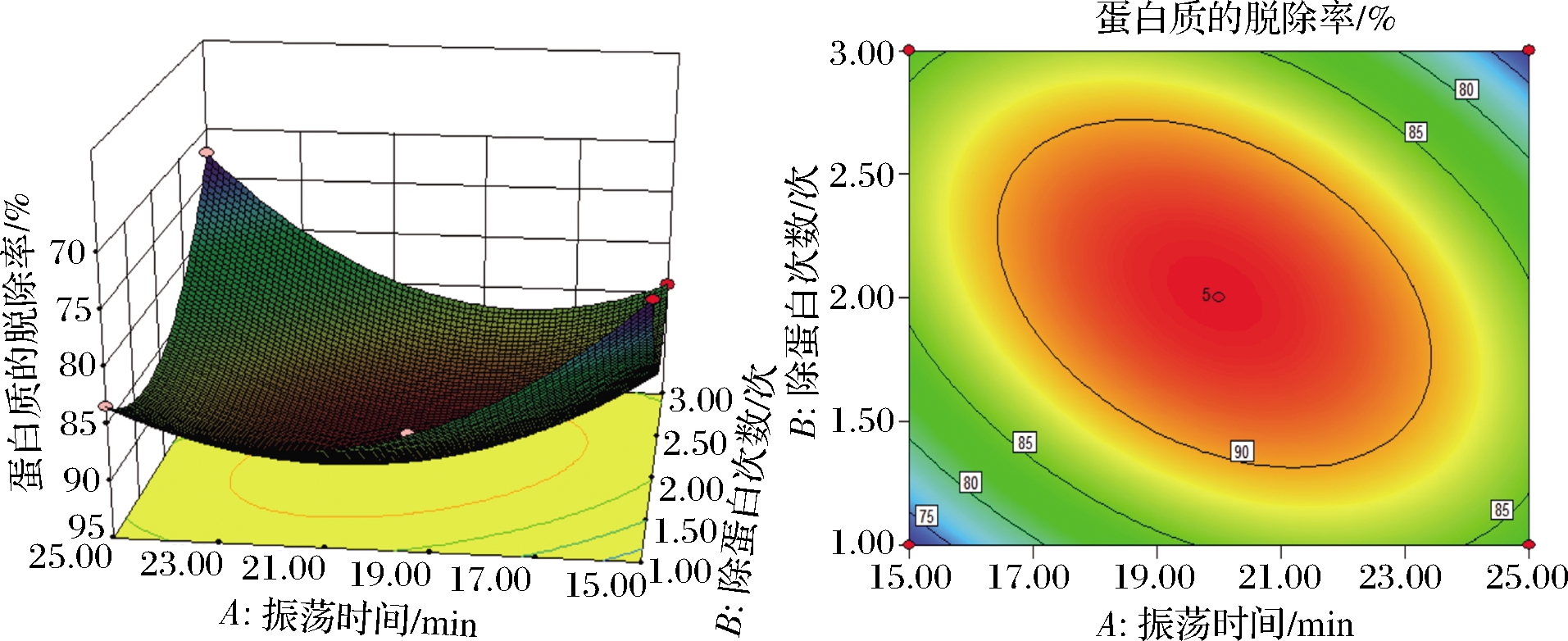
图4 振荡时间和除蛋白次数交互的响应面图
Fig.4 Response plots of interaction of oscillation time and number of protein removal
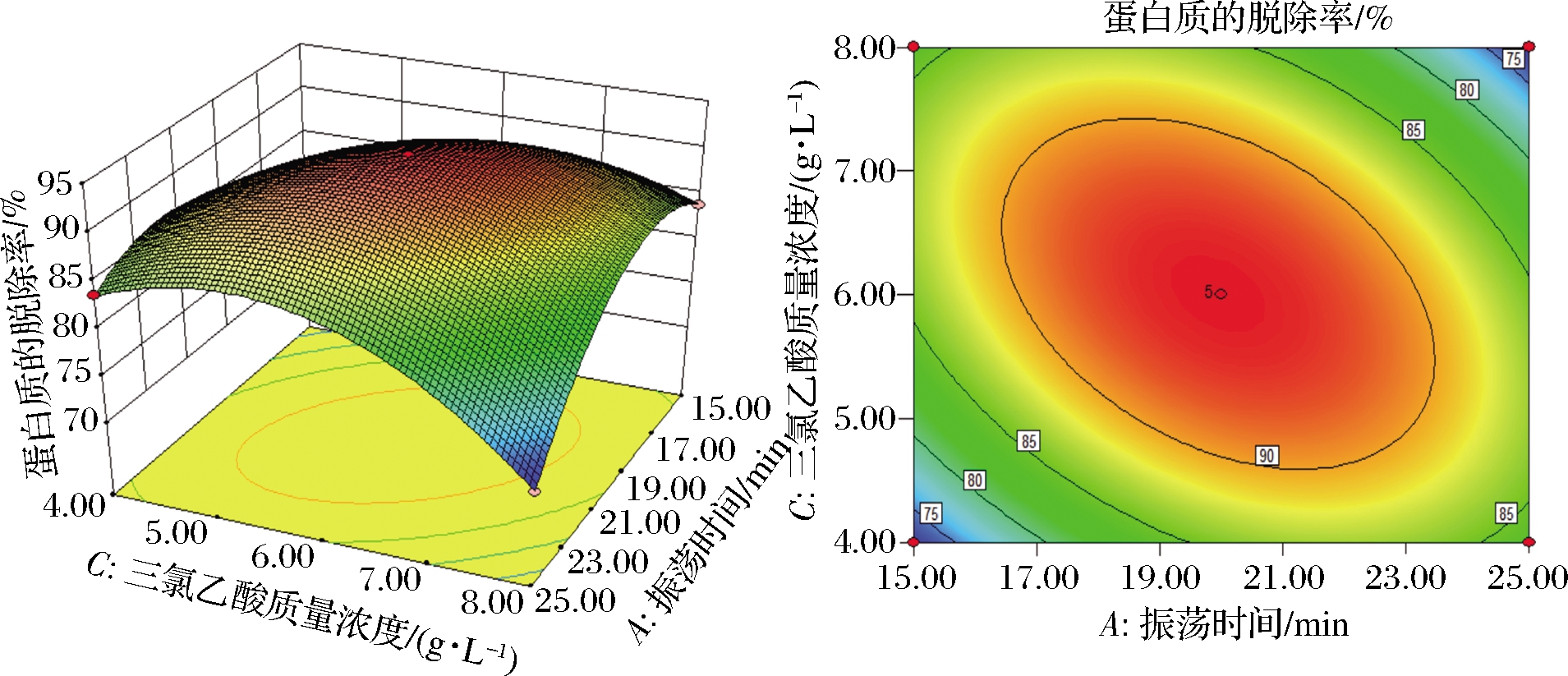
图5 振荡时间和三氯乙酸浓度交互的响应面图
Fig.5 Response surface map of interaction between oscillation time and trichloroacetic acid concentration
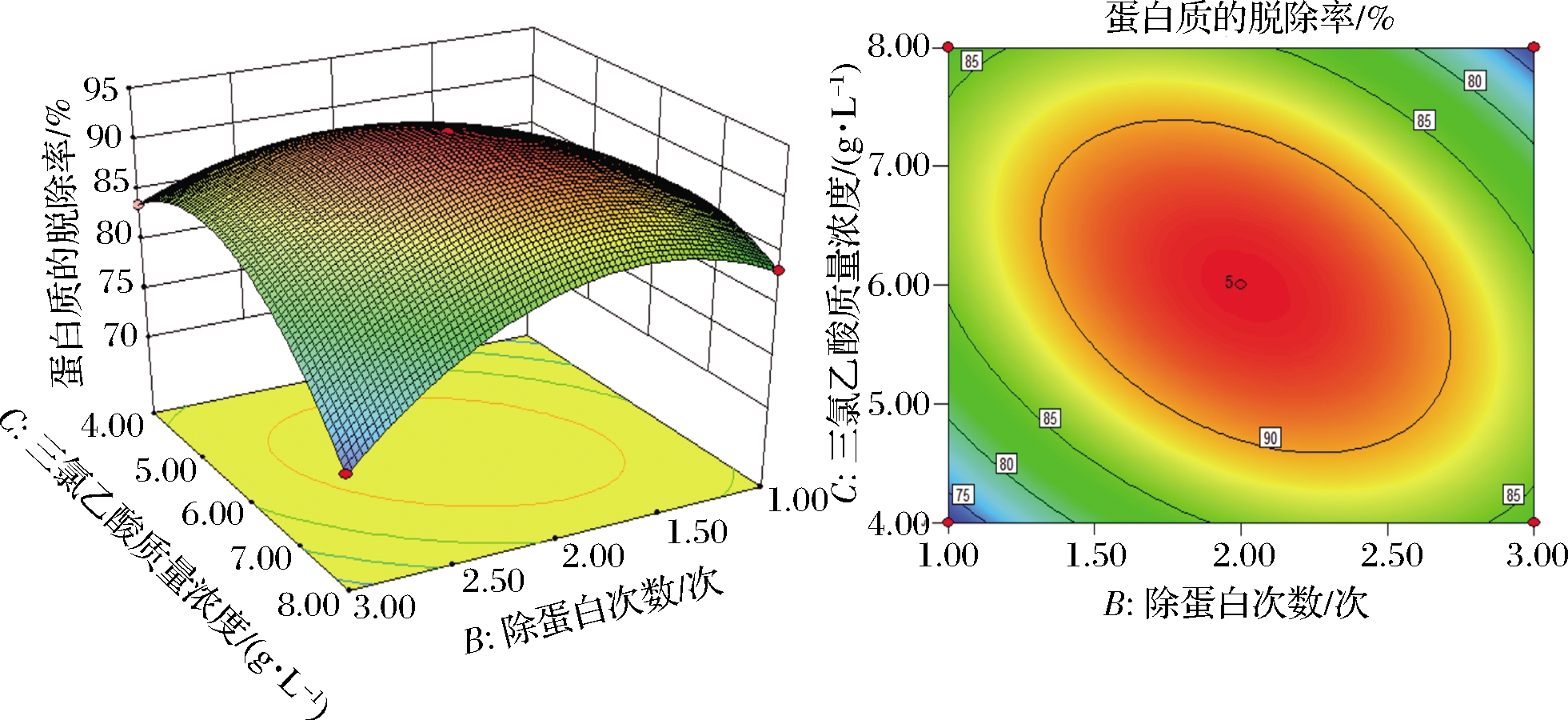
图6 三氯乙酸浓度和除蛋白次数交互的响应面图
Fig.6 Response map of the interaction of trichloroacetic acid concentration and protein removal times
2.3 最佳工艺条件的预测和验证
通过回归模型进行分析,预测出理论条件下的最佳脱蛋白工艺为:振荡时间19.85 min,除蛋白次数1.73次,三氯乙酸质量浓度64.8 g/L。其蛋白质脱除率理论值为92.56%,考虑到实际操作的方便性和可行性,调整最佳工艺参数为:振荡时间20 min,除蛋白次数2次,三氯乙酸质量浓度为60 g/L,按此工艺进行3次平行实验,测得龙葵果多糖中蛋白质的脱除率为93.61%,多糖损失率为16.46%。实测结果与预测结果接近,表明基于响应面法所得的优化蛋白脱除率的参数准确可靠,具有实用价值。
3 结论
通过单因素及响应面优化实验,确定了三氯乙酸法脱除龙葵果多糖中蛋白质的最佳条件为三氯乙酸质量浓度60 g/L,脱除次数2次,振荡时间20 min,此条件下龙葵果多糖中蛋白的脱除率达93.61%,多糖损失率为16.46%。由此证明了三氯乙酸法是一种试剂用量少且效率高的脱除龙葵果多糖蛋白质的有效方法。
[1] 刘利国,郭喜宝,姜小晶.龙葵的研究进展[J].中医药学刊,2006,24(7):1 357-1 358.
LIU L G,GUO X B,JIANG X J,et al.Research progress of Solanum nigrum[J].Chinese Archives of Traditional Chinese Medicine,2006,24(7):1 357-1 358.
[2] 黄华,周建华.龙葵开发研究新进展及应用[J].食品工业科技,2009,30(1):315-318.
HUANG H,ZHOU J H,et al.New research progress of solanum nigrum and its application[J].Science and Technology of Food Industry,2009,30(1):315-318.
[3] 李健,韩增胜,李青旺,龙葵多糖抗肿瘤和免疫调节作用的研究[J].安徽农业科学,2008,36(33):14 589-14 590.
LI J,HAN Z S,LI Q W,et al.Study on antitumor activity and immunomodulating effect of polysaccharides isolated from Solanum nigrum linne[J].Journal of Anhui Agricultural Sciences,2008,36(33):14 589-14 590.
[4] 郝博慧,杨鑫,马莺.蕨麻 Sevage法脱蛋白工艺研究[J].食品工业科技,2011,32(2):255-258.
HAO B H,YANG X,MA Y,et al.Study on deproteinization in extraction of polysaccharides from Patentillaunserina by Sevage[J].Science and Technology of Food Industry,2011,32(2):255-258.
[5] 张萍,贺茂萍,殷力等.石榴皮多糖的 Sevage 法除蛋白工艺研究[J].食品科技,2013,38(12):219-222.
ZHANG P,HE M P,YIN L,et al.Deproteinization of the crude polysaccharide from pomegranate peel with Sevage method [J].Food Science and Technology,2013,38(12):219-222.
[6] 刘小攀,田启建,田春莲.黄精多糖酶法脱蛋白的工艺研究[J].西北林学院学报,2016,31(1):238-242.
LIU X P,TIAN Q J,TIAN C L,et al.Deproteinization of polygonatum polysaccharide[J].Journal of Northwest Forestry University,2016,31(1):238-242.
[7] 赵师师,高旭红,常君等.石榴皮多糖的三氯乙酸法脱蛋白工艺研究[J].广州化工,2015,43(17):64-66.
ZHAO S S,GAO X H,CHANG J,et al.Study on the Deproteinization of the crude polysaccharide from pomegranate peel with trichloroacetic acid method[J].Guangzhou Chemical Industry,2015,43(17):64-66.
[8] 李良,金文娟.枸杞多糖含量测定方法的比较分析[J].食品研究与开发,2016,37(11):143-146.
LI L,JIN W J,et al.Comparative analysis methods of lycium barbarum polysaccharide content determination[J].Food Research and Development,2016,37(11):143-146.
[9] 曹稳根,焦庆才,刘茜,等.考马斯亮蓝显色剂变色反应机理的研究[J].化学学报,2002,60(9):1 656-1 661.
CAO W G,JIAO Q C,LIU X,et al.Study on the mechanism of color changes of commassie brilliant blue G-250[J].Acta Chimica Sinica,2002,60(9):1 656-1 661.
[10] 黄越燕,谭荣德,吴世平.龙葵总多糖的闪式提取工艺优选[J].中国实验方剂学杂志,2015, 21(3):24-26.
HUANG Y Y,TAN R D,WU S P,et al.Optimization of flash extraction process for total polysaccharide from Solanum nigrum[J].Chinese Journal of Experimental Traditional Medical Formulae,2015, 21(3):24-26.
[11] 梁引库,吴三桥.黄精多糖脱色和脱蛋白工艺研究[J].食品科技,2012,37(12):166-169.
LIANG Y K,WU S Q,et al.Study on decoloration and deproteinization of polygonatum polysaccharide[J].Food Science and Technology,2012,37(12):166-169.
[12] 池玥兰,王雪,王仁雷等.蛹虫草基质多糖的脱蛋白方法研究[J].食品科技,2014,39(12):202-206.
CHI Y L,WANG X,WANG R L,et al.Comparative investigation into deproteinization methods for Cordyceps militaris polysaccharides[J].Food Science and Technology,2014,39(12):202-206.
[13] CHEN J L, YAN X P, MENG K, et al.Graphene oxide based photoinduced charge transfer label-free near-infrared fluorescent biosensor for dopamine[J].Anal.Chem., 2011, 83:8 787-8 793.
[14] DONG H F, GAO W C, YAN F, et al.Fluorescence resonance energy transfer between quantum dots and graphene oxide for sensing biomolecules[J].Anal.Chem,2010,82:5 511-5 517.
[15] 荆晶,黄国凤,魏敏,等.响应面法优化绿茶多糖的提取工艺及应用[J].遵义医学院学报,2016,39(1):76-80.
JING J,HUANG G F,WEI M,et al.Optimization of extraction of polysaccharides from green tea by response surface methodology[J].Journal of Zunyi Medical University,2016,39(1):76-80.
[16] 王珊,黄胜阳.植物多糖提取液脱蛋白方法的研究进展[J].食品科技,2012,37(9):188-191.
WANG S,HUANG S Y.Advances in deproteinization of polysaccharide extract from plants[J].Food Science and Technology,2012,37(9):188-191.
[17] WANG Q B, LEI J P, DENG S Y, et al.Graphene - supported ferricporphyrin as a peroxidase mimic for electrochemical DNA biosensing [J].Chem Commun,2013,49:916.
[18] LI J, GUO S J, ZHAI Y M,et al.High-sensitivity determination of lead and cadmium based on the Nation-graphene composite film[J].Anal.Chim.Acta,2009,649(2):196-201.
[19] 黄越燕,胡艳茹,王应浩,等.龙葵多糖脱蛋白工艺的比较研究[J].环球中医药,2018,118(8):1 203-1 207.
HUANG Y Y,HU Y R,WANG Y H,XU J Y,et al.Comparative study on deproteinization of polysaccharide of Solanum nigrum polysaccharide[J].Global Traditional Chinese Medicine,2018,118(8):1 674-1 749.
[20] 刘莉,李泳怡,潘育方.荔枝核糖脱蛋白工艺考察[J].中国实验方剂学杂志,2012,18(23):52-55.
LIU L,LI Y Y,PAN Y F,et al.Study on the technology of ribose deproteinization of Litchi[J].Chinese Journal of Experimental Traditional Medical Formulae,2012,18(23):52-55.
[21] 侯小涛,赵超超,邓家刚.甘蔗叶多糖除蛋白工艺研究[J].食品工业科技,2012,33(20):240-247.
HOU X T,ZHAO C C,DENG J G,et al.Study on deproteinization-technology of polysaccharides in sugarcane leaf[J].Science and Technology of Food Industry,2012,33(20):240-247.
[22] 贺银菊,杨再波,彭莘媚,等.响应面优化紫果西番莲多糖提取工艺及抗氧化活性研究[J].食品研究与开发,2020,41(4):38-44.
HE Y J,YANG Z B,PENG X M,et al.Response surface methodology for optimization of extraction and antioxidant activity of polysaccharides in purple passionfruit[J].Food Research and Development,2020,41(4):38-44.
[23] 杨华,庄陈丰.响应面法优化微波辅助提取龙须菜多糖工艺及其抗氧化活性研究[J].食品科学,2011,32(20)20:79-83.
YANG H,ZHUANG C F,et al.Gracilaria lamaneiformis polysaccharides:Optimization of microwave-assisted extraction by response surface methodology and antioxidant properties[J].Food Science,2011,32(20):79-83.