甲硫氨酸(methionine,Met),包括L-甲硫氨酸和D-甲硫氨酸两种构型,L-甲硫氨酸是人和动物必需的含硫氨基酸,在生物体内具有重要的生理生化功能。具体功能包括参与DNA、蛋白质的合成和蛋白结构的稳定;是精胺、亚精胺和乙烯等的前体,参与细胞分裂分化、凋亡、稳态和基因表达等生物生长发育的各个方面;并通过其主要代谢产物S-腺苷甲硫氨酸(S-adenosylmethionine, SAM)间接调节各种代谢过程,为脂类、蛋白质、核酸、生物碱类和植物固醇等多种化合物提供甲基[1]。近年来,Met的需求量大幅度增加,预计2022年全球市场份额可达73亿美元,其中饲料添加剂是最大的消费市场。此外,Met在食品添加剂、医药和化妆品等领域的需求也呈长期稳定增长趋势[2-5]。
Met的合成主要包括化学法、酶法和微生物发酵法3种,目前工业上主要采用化学法和化学-酶法。尽管化学法和酶法技术成熟、成本低,但微生物发酵法因其绿色、高效和周期短等优势,受到研究者的广泛关注。Met发酵法合成的研究主要集中在大肠杆菌(Escherichia coli)和谷氨酸棒状杆菌(Corynebacterium glutamicum)中,目前已经报道的E.coli和C.glutamicum中Met的最高产量分别约为30 g/L和9.88 g/L[6-15],如表1所示,该水平距离工业化应用还存在一定的差距。随着Met市场需求的逐年增加,对提高Met产量的研究迫在眉睫。代谢物产量的高低与代谢合成过程中关键基因的相互调控密不可分。本文将对近几年Met的合成过程、调控机制和环境因素的研究进展进行全面综述,以期为Met合成产量的提高提供基础。
表1 甲硫氨酸产生菌构建的典型实例
Table 1 Representative examples of the methionine producing strains

菌株基因改造质量浓度/(g·L-1)参考文献C. glutamicum ATCC 13032ΔthrB, ΔmclR/(pJYW-4-homG377E-lysCT311I-brnFE)6.30 [6]C. glutamicum ATCC 13032ΔmetD, ΔthrB, dapAA1G(nucleotide), lysCC932T, pycC1372T, zwfG727A, gndT1083C6.85 [7]C. glutamicum ATCC 13032ΔmetD, ΔthrB, ΔmcbR, lysCfbr, pycfbr, (pLY-4-tacM-gapC)9.88 [8]E. coli W3110ΔmetJ ΔmetI ΔlysA/pTrc-metA-yjeH9.75 [9]E. coli W3110thrA-metL-metE-metF-metH(pETMAfbr-B-Y/pKK, Tac-yjeH-cysE-C)10.10 [10]E. coli W3110W3110 derivative, ΔmetI, ΔmetJ, ΔlysA, pTrc-metH, pTrc-metF, pTrc-cysE, pTrc-serB, pTrc-serC·serAfbr16.86 [11]E. coli W3110pTrcF-cysPUWAM, pTrcF-cysJIH, ΔpykF, ΔpykA,pTrcF-cysPUWAM, pTrcF-cysJIH, ΔpykF, ΔpykA, pCClBAC-serB-glyA-serA-serC30.00 [12]E. coli W3110pTrc99A-metA**-yjeH-serAm12.08 [13]E. coli W3110ΔmetJ, ΔmetI, ΔlysA, pTrc-metH, pTrc-metF, pTrc-cysE, pTrc-met BL/pTrc99A/metA*/yjeH7.60 [14]C. glutamicum ATCCLY-6/pXMJ19-tacM-gapC7.23[15]
1 Met的生物合成
Met能够在大多数的植物和微生物中合成,其合成途径已经被完全解析,主要涉及两个部分,即从头合成途径-天冬氨酸合成途径和硫同化过程(图1)[16-17]。
1.1 从头合成途径
除Met以外,必需氨基酸异亮氨酸、赖氨酸和苏氨酸也是由该途径的不同分支产生(图1)。以C.glutamicum中从头合成途径为例,Met合成的具体过程是天冬氨酸在天冬氨酸激酶(Aspartate kinase, lysC)的催化下形成天冬氨酰-4-磷酸,然后被天冬氨酸半醛脱氢酶(Aspartaldehyde dehydrogenase, asd)催化形成天冬氨酸-4-半醛,后者被高丝氨酸脱氢酶(Homoserine dehydrogenase, hom)氧化成高丝氨酸;高丝氨酸在高丝氨酸-O-乙酰基转移酶(Homoserine acetyltransderase, metX)的作用下生成O-乙酰-L-高丝氨酸,然后再依次在胱硫醚γ合成酶(Cystathinine γ-synthase, metB)和胱硫醚β裂解酶的作用下分别形成胱硫醚和高半胱氨酸,最后高半胱氨酸在甲硫氨酸合成酶(Methionine synthase, metEH)的作用下,以四氢叶酸(CH3-THF)作为甲基供体合成Met。此外,在C.glutamicum中O-乙酰-L-高丝氨酸还可以在O-乙酰-L-高丝氨酸硫化酶(O-acetylhomoserine sulfhydrylase, metY)的作用下直接合成高半胱氨酸,进而合成Met。
在不同的生物中,合成途径存在一定的差异(图1, 表2),如高丝氨酸在C.glutamicum中经过高丝氨酸乙酰转移酶(Homoserine acetyltransferase, HAT)催化形成O-乙酰-L-高丝氨酸,而在E.coli和植物中则分别被高丝氨酸-O-琥珀酰基转移酶(Homoserine succinyltransderase, metA)和高丝氨酸激酶(Homoserine kinase, HK)催化形成O-琥珀酰-L-高丝氨酸和O-磷酸-L-高丝氨酸[18]。在古细菌中,天冬氨酸-4-半醛可以在硫化酶的作用下,直接合成高半胱氨酸[17]。
1.2 硫同化
Met包含21.5%的硫,即每生产1 g的Met需要0.22 g的硫,硫的同化是Met合成硫的主要来源。硫的同化主要指![]() 的还原同化途径(assimilatory sulfate reducting,ASR),
的还原同化途径(assimilatory sulfate reducting,ASR),![]() 在其转运体的作用下首先转运到细胞内,在细胞内,硫酸根在硫酸腺苷酸转移酶(ATP sulfurylase, cysDN)的作用下合成5-磷酸腺苷硫酸盐(adenosine-5-phosphosulfate, APS),接着在腺苷硫酸盐激酶(APS kinase, cysC)的作用下形成3′-磷酸腺苷-5-磷酸硫酸盐(3′-phosphoadenosine-5-phosphosulfate, PAPS),PAPS进一步经PAPS还原酶(PAPS reductase, cysH)和亚硫酸还原酶(Sulfite reductase, cysIJ/cysG)还原形成H2S,H2S可直接进入Met等有机硫化物的合成[17,19]。此外,
在其转运体的作用下首先转运到细胞内,在细胞内,硫酸根在硫酸腺苷酸转移酶(ATP sulfurylase, cysDN)的作用下合成5-磷酸腺苷硫酸盐(adenosine-5-phosphosulfate, APS),接着在腺苷硫酸盐激酶(APS kinase, cysC)的作用下形成3′-磷酸腺苷-5-磷酸硫酸盐(3′-phosphoadenosine-5-phosphosulfate, PAPS),PAPS进一步经PAPS还原酶(PAPS reductase, cysH)和亚硫酸还原酶(Sulfite reductase, cysIJ/cysG)还原形成H2S,H2S可直接进入Met等有机硫化物的合成[17,19]。此外,![]() 也是重要的硫源,
也是重要的硫源,![]() 在E.coli中通过半胱氨酸合成酶B(Cysteine synthase B, cysM)进入有机含硫化合物的合成,而在酿酒酵母中则通过Rdl1/2直接转化成
在E.coli中通过半胱氨酸合成酶B(Cysteine synthase B, cysM)进入有机含硫化合物的合成,而在酿酒酵母中则通过Rdl1/2直接转化成![]() 或H2S进而进入有机硫化物的合成[20]。
或H2S进而进入有机硫化物的合成[20]。
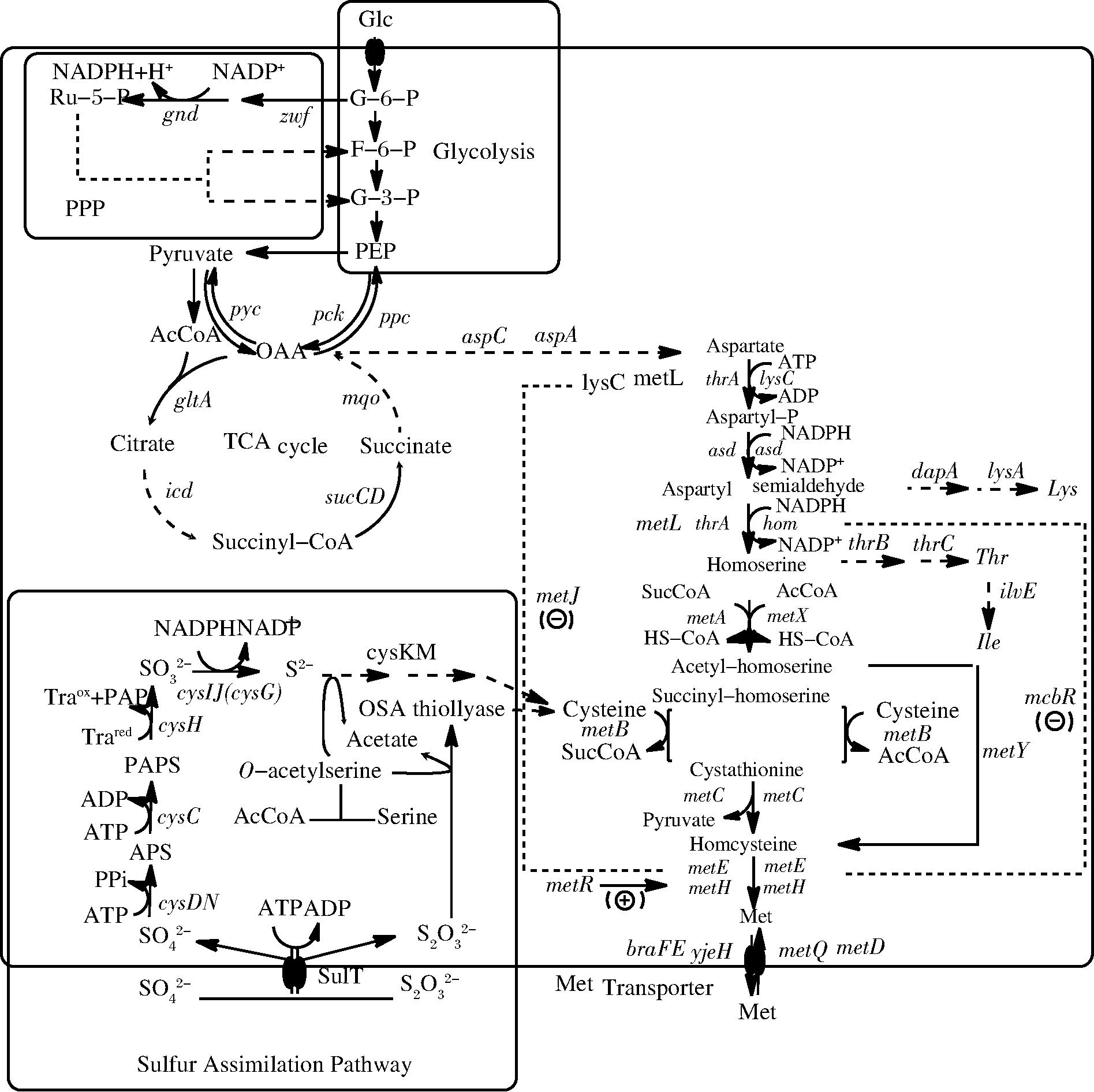
图1 甲硫氨酸生物合成途径与调控
Fig.1 Biosynthesis pathway and regulation of Methionine
从头合成途径中天冬氨酸直接合成Met需要1个ATP和2个NADPH,无机硫的同化则需要2个ATP和4个NADPH。因此Met的合成除了受到从头合成途径和硫同化内部途径关键酶等合成过程的调控外,还受到能量、辅因子和外界环境等多种不同层次的综合调控。
2 Met合成过程的调控
2.1 Met合成关键酶的调控
甲硫氨酸的合成受到多个关键酶的调控。首先,天冬氨酸激酶(Aspartate kinase,AK)是Met合成途径的第一个限速酶,催化ATP依赖的天冬氨酸磷酸化形成天冬氨酰-4-磷酸。在E.coli中AK由thrA、metL和lysC三个基因编码,这些基因的表达分别受苏氨酸、Met和赖氨酸的反馈阻遏调节[21]。而在C.glutamicum中AK仅有一个编码基因lysC,其表达同时受到苏氨酸和赖氨酸的反馈阻遏[22]。过表达lysC以及不受赖氨酸反馈抑制的突变体可使最终产物的含量显著提高。此外,在酶活水平上,AK还受其终端产物反馈抑制调节。在C.glutamicum中,对基因lysC进行定点突变为A279T和G359D,结果表明,lysC的突变可部分解除AK的活性受苏氨酸和赖氨酸的反馈阻遏抑制[21,23]。高丝氨酸脱氢酶是天冬氨酸合成途径的关键双功能酶,包含天冬氨酸激酶和高丝氨酸脱氢酶两个功能。在E.coli中,高丝氨酸脱氢酶是由thrA和metL两个基因进行编码。thrA的转录受到苏氨酸和异亮氨酸的抑制,具体原因是thrA、thrB(在苏氨酸合成途径中编码高丝氨酸激酶)和thrC(编码苏氨酸合成酶)在染色体上组成thrABC操纵子,苏氨酸和异亮氨酸通过与该操纵子上游的一段前导序列作用,反馈抑制基因的表达;而metL仅受到Met的反馈抑制。而在C.glutamicum中hom受到苏氨酸的抑制,且其G378S定点突变可部分解除hom的活性受苏氨酸和赖氨酸的反馈阻遏抑制[24-25]。在Met的合成过程中,除了Met以外,其下游产物S-腺苷甲硫氨酸(S- adenosylmethionine, SAM)也参与到Met的合成调控,比如metA和metB均受到SAM的反馈抑制,进而影响Met的合成。
表2 L-甲硫氨酸生物合成相关的酶及其编码基因
Table 2 Enzymes and their encoding genes related to the methionine synthesis

酶基因E.coliC.glutamicum磷酸烯醇式丙酮酸羧化酶ppcppc丙酮酸羧化酶pycpyc天冬氨酸转氨酶aspAaspA天冬氨酸激酶thrA、metL、lysClysC天冬氨酸半醛脱氢酶asdasd高丝氨酸脱氢酶thrA、metLhom高丝氨酸-O-酰基转移酶metAmetX胱硫醚-γ-合成酶metBmetB胱硫醚-β-合成酶metCmetC甲硫氨酸合成酶metE、metHmetE、metH甲硫氨酸转运体metD、metP、yjeHmetQ、metP, braFE苏氨酸合成酶thrCthrC甲硫氨酸腺苷转移酶metKmetK二氢吡啶二羧酸合酶dapAdapA草酰乙酸脱羧酶odxodx柠檬酸合成酶gltAgltA甲硫氨酸阻遏蛋白MetJMetJ甲硫氨酸激活因子MetRMetRAPS激酶cysHcysHPAPS还原酶cysCcysC硫酸盐调节因子cysPTWAcysPTWA硫酸盐转运渗透酶cysPTMAcysPTMA
在E.coli中,metA、metB和metC位于一个操纵子上,高效表达该操纵子基因是提高Met常用的策略。USUDA等[26]在E.coli W3110 中过表达metA,使Met的含量从0.13 g/L提高到0.24 g/L。郭谦等[27]在一株经过紫外诱变筛选选育出的Met高产菌株E.coli YB12的基础上,过表达metA、cysE(丝氨酸合成半胱氨酸途径中丝氨酸乙酰转移酶编码基因)和编码Met转运蛋白的yeaS基因,使E.coli YB12中Met的含量从60 mg/L提高到251 mg/L。另外,在1株生产赖氨酸的C.glutamicum菌株中,对metX和metY基因过表达导致Met的产量提高到16 g/L[28]。因此,Met合成途径的这些关键酶是调控其代谢途径的关键限速酶。WEI等[29]在提高Met重要中间体O-乙酰高丝氨酸的研究中,基于蛋白质工程的进化保守分析和结构指导的工程化提高了关键酶高丝氨酸乙酰转移酶(Homoserine acetyltransferase, metXlm)的活性且减少反馈抑制,使酶的活性增加了12.5倍,并通过守恒优化,最终使产物O-乙酰高丝氨酸产量增加57.14%[29]。
2.2 Met合成竞争途径的阻断
天冬氨酸合成途径中的赖氨酸和苏氨酸合成途径是Met合成的2个关键竞争途径,分别通过天冬氨酸-4-半醛和高丝氨酸实现竞争。研究发现,2个竞争途径的去除会为Met的合成提供更多的天冬氨酸-4-半醛和高丝氨酸底物,从而有效提高Met的产量。研究中常用的是赖氨酸合成途径中dapA(在赖氨酸合成途径编码二氢二吡啶甲酸合酶)和苏氨酸合成途径中thrB的敲除[16]。例如,在C.glutamicum 13032中通过thrB的敲除和赖氨酸合成途径的减弱(dapA中用稀有密码子GTG代替起始密码子ATG),Met的产量从0.89 g/L提高到2.99 g/L,增加了3倍[7]。在E.coli W3110中,通过thrBC的敲除获得苏氨酸营养不良菌株,与野生型相比,其Met产量从无法检测提高到0.008 g/L[26]。吴婷婷[30]在E.coli K-12/pKD46菌株中敲除dapA基因后,其Met的含量提高了2.61倍。
2.3 Met转录调节子的转录调控
Met合成的转录调控除了限速酶的表达受到产物的反馈抑制外,还包括各种调控蛋白的调控[31],如MetJ和MetR。MetJ是Met合成的关键阻遏蛋白,在E.coli中阻遏metL、metA、metB、metC和metE基因的表达[32]。研究发现,将MetJ第54位的Ser替换为Asn,可以消除其反馈阻遏作用,提高Met的产量[33]。与E.coli相对应的,在C.glutamicum中Met的合成和摄入则是由McbR阻遏蛋白调控。McbR是C.glutamicum硫代谢的全局调控因子,涉及的基因包括hom、metX、metB、metE和metH等[34]。很多研究已经表明,通过对细菌metJ或mcbR基因的敲除或修饰,可解除其对细胞生产Met能力的禁锢,使菌株产生更多的Met[6,9,26-27,35]。与MetJ相反,MetR是一类转录激活因子,过表达后可大大促进Met的合成,前期研究,通过共表达metE和metR的研究发现,MetR是metE基因表达的反式激活因子,然而在MetJ蛋白和SAM的存在下,metR基因的表达被抑制[36]。
2.4 Met转运体的调控
菌株经过一系列代谢工程改造后,胞内氨基酸的积累会抑制其合成途径关键酶的催化活性,增加其降解途径的前体可利用性,甚至抑制细胞生长。因此,Met的转运也成为其生产的限速步骤[31,37]。在E.coli中,过表达Met输出蛋白YjeH、YeaS和敲除Met摄入蛋白MetD、MetP均显著增加了Met的积累[38-39]。在基因工程菌C.glutamicum中敲除Met的摄取蛋白MetQP或过表达输出蛋白BrnFE或MetT,Met的含量都显著提高[40-41]。
3 硫同化对Met合成的调控
硫同化过程包括硫的转运和还原,其消耗的能量和还原力显著多于Met从头合成途径,这也暗示了硫同化是限制Met生物合成的一个关键瓶颈。硫同化对代谢流量的控制主要涉及两个方面,即![]() 的转运和APS还原酶,两者的贡献约各占50%,而且受环境因素显著影
的转运和APS还原酶,两者的贡献约各占50%,而且受环境因素显著影![]() 跨膜转运到细胞内是硫同化的第一步,前人已经报道的硫转运体有5种,分别是SulT、SulP、CysP、DASS和CysZ 转运体,其中SulT转运体是E.coli中
跨膜转运到细胞内是硫同化的第一步,前人已经报道的硫转运体有5种,分别是SulT、SulP、CysP、DASS和CysZ 转运体,其中SulT转运体是E.coli中![]() 转运的主要形式[43]。SulT属于ABC-type超家族,包含一个Sbp(硫酸盐结合蛋白),两个通透酶(CysT和CysW)和一个ATP结合蛋白CysA。当Sbp替换成CysP时,SulT也可以转运
转运的主要形式[43]。SulT属于ABC-type超家族,包含一个Sbp(硫酸盐结合蛋白),两个通透酶(CysT和CysW)和一个ATP结合蛋白CysA。当Sbp替换成CysP时,SulT也可以转运![]() 基因形成一个操纵子。研究发现
基因形成一个操纵子。研究发现![]() 和
和![]() 的吸收随着半胱氨酸和其他硫源的可利用性而改变,当环境中可用硫源过量时,半胱氨酸合成过程中的cys基因的表达会被降低一半,而当硫源被限制时,sbp和cysTWA基因会大量表达以获得更多的硫[44]。
的吸收随着半胱氨酸和其他硫源的可利用性而改变,当环境中可用硫源过量时,半胱氨酸合成过程中的cys基因的表达会被降低一半,而当硫源被限制时,sbp和cysTWA基因会大量表达以获得更多的硫[44]。
在ASR的调控中,CysB在E.coli等细菌中是主要的正向调控子。CysB是一类LysR型的转录激活子(LTTR),它可以促进cysPTWAM、sbp、cysDNC、cysJIH和cysK等基因的表达,同时还对自身基因的表达具有抑制作用,并受到![]() 和
和![]() 的抑制[45]。最新的研究表明硫同化途径中编码调控蛋白cysB基因的诱导性过表达可使其转录水平增加64倍,提高了硫转化率,从而增加了下游氨基酸产量[46]。而在C.glutamicum中,LTTR类调节子CmbR调节Met和半胱氨酸合成的绝大多数基因,同时TetR家族的抑制子McbR控制
的抑制[45]。最新的研究表明硫同化途径中编码调控蛋白cysB基因的诱导性过表达可使其转录水平增加64倍,提高了硫转化率,从而增加了下游氨基酸产量[46]。而在C.glutamicum中,LTTR类调节子CmbR调节Met和半胱氨酸合成的绝大多数基因,同时TetR家族的抑制子McbR控制![]() 转运同化以及Met和半胱氨酸合成基因的转录[47]。因此在硫同化对Met的调控影响中,我们可以通过对转运体、同化酶和激活子的过表达,以及抑制子的敲除实现关键酶的解反馈抑制,进而增加代谢流量。
转运同化以及Met和半胱氨酸合成基因的转录[47]。因此在硫同化对Met的调控影响中,我们可以通过对转运体、同化酶和激活子的过表达,以及抑制子的敲除实现关键酶的解反馈抑制,进而增加代谢流量。
4 NADPH对Met合成的影响
Met的合成从硫同化到从头合成途径共需要6个NADPH和3个ATP。因此能量和还原力的提高是保证Met高效合成的关键。NADPH在C.glutamicum和E.coli中分别是以不同的方式进行提供。在C.glutamicum中,NADPH主要是通过戊糖磷酸途径中的葡萄糖-6-磷酸脱氢酶(G6PDH, zwf)和6-磷酸葡萄糖酸脱氢酶(6PGDH, gnd),而在E.coli中主要是通过膜结合的转氢酶合成[48-49]。此外,前人的研究已经尝试了不同策略来增加NADPH的供应,最常用的是调整糖酵解途径和戊糖磷酸途径之间的代谢流量比。C.glutamicum戊糖磷酸途径中的zwf和gnd进行突变以消除其反馈抑制,构建了zwfA243T和gndS361F突变体后,氨基酸的产量呈现了不同程度的增加[50]。此外,通过过表达果糖-1,6-二磷酸酶基因(fbp),加速碳源从糖酵解转向戊糖磷酸途径,也显著增加了还原力的提供[49,51]。此外,BOMMAREDDY等[52]不依赖于戊糖磷酸途径的想法,仅通过改变天然NAD+依赖的甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase, gapA)的辅酶专一性来生成NADP+,在提高甘油醛-3-磷酸脱氢酶对NADP+的催化效率的同时,所有受试突变体的氨基酸产量都得到了显著提高(60%)。因此,糖酵解、戊糖磷酸途径和三羧酸循环等初级代谢途径中能量和辅助因子的通量变化通常会直接影响氨基酸的生物合成,因此,它们为生物工程转化提供了一个潜在的目标,包括与能量和还原力形成相关的反应。
5 环境营养元素对Met合成的影响
5.1 营养元素对Met合成的影响
碳源是微生物生长的物质基础。在工业氨基酸发酵中,葡萄糖、乳糖、可溶性淀粉、甘油和蔗糖是目前最常使用的碳源,其浓度过高或过低均会影响Met的合成。比如,刘俊琦等[53]向培养基中添加高浓度的葡萄糖,导致菌体浓度和Met产量都有所下降。进一步的研究发现,不同的菌株对不同碳源的利用具有显著的顺序作用,如酵母菌、E.coli和枯草芽孢杆菌(Bacillus subtilis)顺序利用较为明显,而C.glutamcum很少表现出对底物碳源的共利用[54]。可见碳源的种类和比例对Met的产量有明显的影响,因此可通过合适的碳源配比来提高Met生产水平。
氮源也是微生物生长的必需营养要素,为生物体合成蛋白质、核酸及其他含氮化合物提供原料。牛肉膏、蛋白胨及尿素是微生物常利用的氮源。不同的氮源对Met产量和菌体浓度均有影响,和其他氮素相比较,尿素的效果最好,适宜的尿素浓度对Met的产量至关重要[53]。
无机盐是维持细胞稳态的重要因子,在Met的合成中不仅提供必需的环境和营养成分,而且还可以合成Met螯合物。Met螯合物因其具有较高的生物价值,增加牲畜的免疫力,现被广泛用于饲料生产[55],如甲硫氨酸硒[56]、甲硫氨酸铜[57-59]、甲硫氨酸锌[60]和甲硫氨酸酪[61]。此外,在培养基中添加半胱氨酸乙硫氨酸等化合物均可使Met的产量显著调高,如KUMAR等[62]在培养基中添加半胱氨酸,可使Met产量从2.34 g/L提高到3.39 g/L。金利群等[63]的研究发现通过控制发酵培养基中Na2S2O3的添加量,可显著提高Met的产量;当Na2S2O3的添加量在3 g/L时,Met产量可提高41.3%。
5.2 培养条件对Met合成的影响
在发酵过程中,除了合理的营养元素外,培养条件也是影响Met产量的关键,包括pH、温度及搅拌速率等。在微生物合成Met的过程中,pH值会直接影响代谢途径中酶的活性。ZHOU等[13]研究发现,pH值为7时,E.coli发酵生产Met产量达到最高,分别比pH值6.5和7.5时提高37.78%和18.10%,表明中性pH值有助于E.coli发酵生产Met。温度影响微生物发酵生长主要涉及两个方面即影响菌体自身生长活力、诱导温度影响代谢途径蛋白质表达水平和相应酶活性[64]。有研究指出,用E.coli作为生产菌株生产Met最适宜温度是28 ℃,此时参与Met生物合成的关键酶活性增强,Met产量为1.24 g/L,较33 ℃和25 ℃时高1.09倍和2.21倍。搅拌速率是影响细胞生长和代谢产物生物合成的重要因素。搅拌速度在200~400 r/min最为适宜,当搅拌速率为300 r/min时Met的产量最高[13]。
6 总结和展望
Met具有重要的工业价值。近几年,随着发酵工程、代谢工程和合成生物学的不断发展和应用,研究者们利用基因工程菌生产Met已经成为Met开发的战略方向,但是基于目前的研究进展,距离工业化生产仍然有待研究。Met合成途径已经被完全解析,合成途径的代谢调控尤其是从头合成途径的调控多数已经被揭示,但是在前体物质H2S和天冬氨酸,以及辅因子NADPH和ATP的提供等方面的调控也是限制Met合成的关键因素,还需要进一步探究。本课题组致力于微生物高产Met的探究,前期的研究发现对各个前体物质合成综合调控的解析和工程化,是提高Met产量的关键。
目前,结合Met生物合成的研究现状,提高Met的产量具体可以采用的策略包括:(1)适宜菌株的选择。菌株的选择对不同化合物的合成影响较大,如赖氨酸的生产主要在谷氨酸棒状杆菌(C.glutamicum)中实现,而柠檬酸和赤霉素则主要在黑曲霉(Aspergillus niger)和赤霉菌(Gibberella fujikuroi)完成等。Met的合成在E.coli、C.glutamicum、苏云金杆菌(Bacillus thuringiensis)、酿酒酵母(Saccharomyces cerevisiae)和甲醇酵母等中均有研究,但主要集中在E.coli和C.glutamicum中,尽管E.coli中的研究显著多于后者,但是目前的最高产量仍在C.glutamicum中。KROMER等[48]通过对E.coli和C.glutamicum系统比较发现他们具有不同的最佳流量分布,且Met最佳产率分别是0.52和0.49 (C-mol)/(C-mol)。但是当把硫源用硫酸盐替换成硫代硫酸盐或H2S以后,C.glutamicum中Met的最高理论产量可达到0.68,进一步以甲硫醇作为硫源和C1碳时,其最高理论产量可达到0.91 (C-mol)/(C-mol)。(2)高产菌株的高通量筛选。对适宜菌株进行诱导突变,通过高通量筛选技术筛选出具有高产Met能力的遗传稳定菌株,也是提高Met产量的重要途径之一。(3)合成途径的选择优化和重组。在合成生物学中实现产物合成的最大化,除了通过过表达、定向进化和敲除基因工程等方法优化合成途径,提高合成效率外,尽可能缩短产物的合成路线和调控也是主要的方法之一。不同生物中Met的合成具有一定的差异,从头合成途径中高半胱氨酸的合成,细菌中涉及O-乙酰高丝氨酸的直接硫化和通过半胱氨酸形成胱硫醚之后再形成半胱氨酸2条途径,而在古细菌中则可由天冬氨酸-4-半醛直接硫化到高半胱氨酸。因此不同生物中合成途径的优化重组为Met的高效合成提供一定的前提。硫同化过程的重组优化不仅可以提高其同化效率,而且可以节约NADPH和ATP的大量消耗。硫源![]() 的同化过程在不同的生物中基本相似,但是
的同化过程在不同的生物中基本相似,但是![]() 在不同的生物中则略有不同,比如,在E.coli中,CysM将
在不同的生物中则略有不同,比如,在E.coli中,CysM将![]() 与O乙酰丝氨酸合成硫代半胱氨酸,进而通过半胱氨酸合成Met;而在S.cerevisiae中则是通过Rdl1/2直接合成H2S,进而进入Met的合成。这种通过在不同生物中合成途径的组合优化,为提高Met产量也提供了一条有效的思路。(4)发酵过程的优化。在基因工程菌株改造完全后,根据菌株的生长生产特点,优化宏观调控发酵条件,并对发酵条件进行调试和创新,使菌株在最适条件下高效生产Met。最后,结合大量实验数据及生物信息学的分析,必将促进生产Met产业的发展,为人类创造更好的经济效益。
与O乙酰丝氨酸合成硫代半胱氨酸,进而通过半胱氨酸合成Met;而在S.cerevisiae中则是通过Rdl1/2直接合成H2S,进而进入Met的合成。这种通过在不同生物中合成途径的组合优化,为提高Met产量也提供了一条有效的思路。(4)发酵过程的优化。在基因工程菌株改造完全后,根据菌株的生长生产特点,优化宏观调控发酵条件,并对发酵条件进行调试和创新,使菌株在最适条件下高效生产Met。最后,结合大量实验数据及生物信息学的分析,必将促进生产Met产业的发展,为人类创造更好的经济效益。
[1] SAUTER M, MOFFATT B, SAECHAO M C, et al.Methionine salvage and S-adenosylmethionine:Essential links between sulfur, ethylene and polyamine biosynthesis[J].Biochem,2013,451(2):145-154.
[2] 陈英军,张卓标,吕海龙.我国蛋氨酸生产现状及市场分析[J].精细与专用化学品, 2005,13(16):22-24.
CHEN Y J, ZHANG Z B, LYU H L.Domestic production situation of methionine and its market analysis[J].Fine and Specialty Chemicals, 2005, 13(16):22-24.
[3] 苏雪梅.食品级L-蛋氨酸的生产工艺[J].中国调味品,2019,44(9):141-143.
SU X M.Production process of feed-grade L-methionine[J].China Condiment, 2019, 44(9):141-143.
[4] 李爱平.几种新型药用氨基酸及衍生物的制备[D].南京:东南大学, 2005.
LI A P.Preparation of several new medicinal amino acids and their derivatives[D].Nanjing:Southeast University, 2005.
[5] SAGONG H Y, KIM K J.Structural insights into substrate specificity of cystathionine γ-synthase from Corynebacterium glutamicum[J].J Agric Food,2017,65(29):6 002-6 008.
[6] QIN T, HU X Q, HU J, et al.Metabolic engineering of Corynebacterium glutamicum strain ATCC13032 to produce L-methionine[J].Biotechnol Appl Biochem,2015,62(4):563-573.
[7] LI Y, CONG H, LIU B N, et al.Metabolic engineering of Corynebacterium glutamicum for methionine production by removing feedback inhibition and increasing NADPH level[J].Anton Leeuw Int J G,2016,109(9):1 185-1 197.
[8] 李莹.基于代谢工程选育谷氨酸棒状杆菌L-蛋氨酸高产菌[D].哈尔滨工业大学,2016.
LI Y.Breeding L-methionine over-producer by Corynebacterium glutamicum based on metabolic engineering[D].Harbin:Harbin Institute of Technology, 2016.
[9] HUANG J F, LIU Z Q, JIN L Q, et al.Metabolic engineering of Escherichia coli for microbial production of L-Methionine[J].Biotechnol Bioeng,2017,114(4):843-851.
[10] 李华.系统代谢工程改造大肠杆菌生产L-蛋氨酸[D].无锡:江南大学,2017.
LI H.Systematic metabolic engineering of Escherichia coli for L-methionine production[D].Wuxi:Jiangnan University, 2017.
[11] HUANG J F, SHEN Z Y, MAO Q L, et al.Systematic analysis of bottlenecks in a multi-branched and multilevel regulated pathway:The molecular fundamentals of methionine biosynthesis in Escherichia coli[J].Acs Synth Biol,2018,7(11):2 577-2 589.
[12] DISCHERT W,
FigGE R.Patent to metabolic explorer:Recombinant microorganism for the fermentative production of methionine[P].WO2013/190343(A1).2013-06-09.
[13] ZHOU H Y, WU W J, NIU K, et al.Enhanced L-methionine production by genetically engineered Escherichia coli through fermentation optimization[J].Biotech,2019,9(3):96.
[14] NIU K, XUY Y, WU WJ, et al.Effect of dissolved oxygen on L-methionine production from glycerol by Escherichia coli W3110BL using metabolic flux analysis method[J].J Ind Microbiol Biotechnol,2020,47(3):287-297.
[15] LI Y,Ai Y Q, ZhANG J Z, et al.A novel expression vector for Corynebacterium glutamicum with an auxotrophy complementation system[J].Plasmid,2020,107:102 476.
[16] PARK S D, LEE J Y, SIM S Y, et al.Characteristics of methionine production by an engineered Corynebacterium glutamicum strain[J].Metab Eng,2007,9(4):327-336.
[17] RUCKERT C.Sulfate reduction in microorganisms—recent advances and biotechnological applications[J].Curr Opin Microbiol,2016,33(5):140-146.
[18] JANDER G, JOSHI V.Recent progress in deciphering the biosynthesis of aspartate-derived amino acids in plants[J].Mol Plant,2010,3(1):54-65.
[19] NAKATANI T, OHTSU I, NONAKA G, et al.Enhancement of thioredoxin/glutaredoxin-mediated L-cysteine synthesis from S-sulfocysteine increases L-cysteine production in Escherichia coli[J].Microb Cell Fac,2012,11(1):62.
[20] CHEN Z G, ZHANG X, LI H, et al.The complete pathway of thiosulfate utilization in Saccharomyces cerevisiae[J].Appl Environ Microbiol,2018,84(22):1-15.
[21] 黄勤勤,王慧梅,梁玲等.定点突变及lysC、asdA串联表达对谷氨酸棒杆菌L-苏氨酸积累的影响[J].生物技术通报, 2019,35(2):93-100.
HUANG Q Q, WANG H M, LIANG L, et al.Effects of site-directed mutation of gene lysC and co-expression of asdA cluster on L-threonine accumulation in Corynebacterium glutamicum[J].Biotechnology Bulletin, 2019, 35(2):93-100.
[22] GANGULY S, SATAPATHY KB.Statistical optimization of culture conditions for L-Methionine production by Corynebacterium glutamicum X300[J].Journal of Theoretical & Computational Science,2017,4(1):1-7.
[23] 徐德雨,郑小梅,赵晶,等.谷氨酸棒杆菌天冬氨酸激酶G359D突变解除赖氨酸与苏氨酸协同抑制的研究[J].生物技术通报,2017,33(11):143-152.
XU D Y, ZHENG X M, ZHAO J, et al.Aspartate kinase G359D from Corynebacterium glutamicum relieves the synergistic inhibition of lysine and threonine[J].Biotechnology Bulletin, 2017, 33(11):143-152.
[24] DONG X, ZHAO Y, ZHAO J, et al.Characterization of aspartate kinase and homoserine dehydrogenase from Corynebacterium glutamicum IWJ001 and systematic investigation of L-isoleucine biosynthesis[J].J Ind Microbiol Biotechnol,2016,43(6):873-885.
[25] REINSCHEID D J, EIKMANNS B J, SAHM H.Analysis of a Corynebacterium glutamicum hom gene coding for a feedback-resistant homoserine dehydrogenase[J].J Bacteriol,1991,173(10):3 228-3 230.
[26] USUDA Y, KURAHASHI O.Effects of deregulation of methionine biosynthesis on methionine excretion in Escherichia coli[J].Appl Environ Microbiol,2005,71(6):3 228-3 234.
[27] 郭谦,方芳,李江华,等.代谢工程改造蛋氨酸代谢途径构建高产L-蛋氨酸大肠杆菌[J].过程工程学报,2013,13(6):1 013-1 019.
GUO Q, FANG F, LI J H, et al.Metabolic engineering of methionine biosynthesis pathway for production of L-methionine by Escherichia coli[J].The Chinese Journal of Process Engineering, 2013, 13(6):1 013-1 019.
[28] MOCKEL B, PFEFFER W, MARX A, et al.Nucleotide sequences which code for the Met Y gene[P].US, 20020110878A1.2002-08-15.
[29] WEI L, WANG Q, XU N, et al.Metabolic engineering strategies for high-level production of O-Acetylhomoserine in Escherichia coli[J].ACS Synth Biol,2019,8(5):1 153-1 167.
[30] 吴婷婷.大肠杆菌dapA基因的敲除及其对蛋氨酸产量影响的研究[D].长春:吉林大学,2008.
WU T T.Study on L-methionine yield of E.coli with dapA gene deletion[D].Changchun:Jilin University,2008.
[31] 万方,陈民良,张斌,等.代谢工程改造微生物高产氨基酸的策略[J].中国生物工程杂志,2015,35(3):99-103.
WANG F, CHEN M L, ZHANG B, et al.Strategy of metabolic engineering microorganism for high yield amino acids[J].China Biotechnology, 2015, 35(3):99-103.
[32] RICARDO M A, MUNEHIRO T, PENELOPE S, et al.Identification of new ligands for the methionine biosynthesis transcriptional regulator (MetJ) by FAC-MS[J].J Mol Microbiol Biotechnol,2012,22(4):205-214.
[33] 闫海洋,林松毅,欧阳红生.大肠杆菌metJ的基因修饰对其蛋氨酸产量的影响[J].现代农业科技,2014(5):296-297;300.
NI H Y, LIN S Y, OUYANG H S, et al.Effect of gene modification in Escherichia coli metJ on its L-Met production[J]. Xian Dai NongYe Ke Ji, 2014(5):296-297.
[34] REY D A, NENTWICH S S, KOCH D J, et al.The McbR repressor modulated by the effector substance S-denosylhomocysteine controls directly the transcription of a regulon involved in sulphur metabolism of Corynebacterium glutamicum ATCC 13032[J].Mol Microbiol,2005,56(4):871-887.
[35] NAKAMORI S, KOBAYASHI S, NISHIMURA T, et al.Mechanism of L-methionine overproduction by Escherichia coli:The replacement of Ser-54 by Asn in the MetJ protein causes the derepression of L-methionine biosynthetic enzymes[J].Appl Microbiol Biotechnol,1999,52(2):179-185.
[36] MAXON M E, REDFIELD B, CAI X Y, et al.Regulation of methionine synthesis in Escherichia coli:Effect of the MetR protein on the expression of the metE and metR genes[J].Proc Natl Acad Sci USA,1989,86(1):85-89.
[37] 董迅衍,王小元.微生物生产L-苏氨酸的代谢工程研究进展[J].食品与生物技术学报,2016,35(12):1 233-1 240.
DONG X Y, WANG X Y.Advances in microbial metabolic engineering to increase L-Threonine production[J].Journal of Food Science and Biotechnology, 2016, 35(12):1 233-1 240.
[38] LIU Q, LIANG Y, ZHANG Y, et al.YjeH is a novel exporter of L-methionine and branched-chain amino acids in Escherichia coli[J].Appl Environ Microbiol,2015,81(22):7 753-7 766.
[39] MERLIN C, GARDINER G, DURAND S, et al.The Escherichia coli metD locus encodes an ABC transporter which includes Abc (MetN), YaeE (MetI), and YaeC (MetQ) [J].J Bacteriol,2002,184(19):5 513-5 517.
[40] TRÖTSCHEL C, DEUTENBERG D, BATHE B, et al.Characterization of methionine export in Corynebacterium glutamicum[J].J Bacteriol,2005,187(11):3 786-3 794.
[41] LANGE C, MUSTAFI N, FRUNZKE J, et al.Lrp of Corynebacterium glutamicum controls expression of the brnFE operon encoding the export system for L-methionine and branched-chain amino acids[J].J Biotechnol,2011,158(4):231-241.
[42] KOPRIVOVA A, KOPRIVA S.Molecular mechanisms of regulation of sulfate assimilation:First steps on a long road[J].Front Plant Sci,2014,5:589.
[43] PILSYK S, PASZEWSKI A.Sulfate permeases-phylogenetic diversity of sulfate transport[J].Acta Biochim Pol,2009,56(3):375-384.
[44] AGUILAR-BARAJAS E, D AZ-PÉREZ C, RAM
AZ-PÉREZ C, RAM REZ-D
REZ-D AZ M I, et al.Bacterial transport of sulfate, molybdate, and related oxyanions[J].BioMetals,2011,24(4):687-707.
AZ M I, et al.Bacterial transport of sulfate, molybdate, and related oxyanions[J].BioMetals,2011,24(4):687-707.
[45] 董伟.转运系统集成改造提升大肠杆菌胞外L-蛋氨酸积累[D].无锡:江南大学,2018.
DONG W.The effect of amino acid transporter system modification on extracellular L-methionine accumulation in Escherichia coli[D].Wuxi:Jiangnan University, 2018.
[46] LIU H, HOU Y, WANG Y, et al.Enhancement of sulfur conversion rate in the production of L-cysteine by engineered Escherichia coli[J].J Agri and Food Chem,2020,68(1):250-257.
[47] GUÉDON E, MARTIN-VERSTRATE.Cysteine metabolism and its regulation in bacteria[M].Springer-Verlag Berlin Heidelberg,2006:195-218.
[48] KR MER J O, WITTMANN C, SCHR
MER J O, WITTMANN C, SCHR DER H,et al.Metabolic pathway analysis for rational design of L-methionine production by Escherichia coli and Corynebacterium glutamicum[J].Metab Eng,2006,8(4):353-369.
DER H,et al.Metabolic pathway analysis for rational design of L-methionine production by Escherichia coli and Corynebacterium glutamicum[J].Metab Eng,2006,8(4):353-369.
[49] GEORGI T, RITTMANN D, WENDISCH V F.Lysine and glutamate production by Corynebacterium glutamicum on glucose, fructose and sucrose:Roles of malic enzyme and fructose-1,6-bisphosphatase[J].Metab Eng, 2005,7(4):291-301.
[50] JUNKO O, RITSUKO K, SATOSHI M, et al.A novel gnd mutation leading to increased L-lysine production in Corynebacterium glutamicum[J].FEMS Microbiol Lett,2005,242(2):265-274.
[51] BECKER J, ZELDER O,Stefan H, et al.From zero to hero-design-based systems metabolic engineering of Corynebacterium glutamicum for L-lysine production[J].Metab Eng,2011,13(2):159-168.
[52] BOMMAREDDY R R, ChEN Z, RAPPERT S, et al.A de novo NADPH generation pathway for improving lysine production of Corynebacterium glutamicum by rational design of the coenzyme specificity of glyceraldehyde 3-phosphate dehydrogenase[J].Metab Eng,2014,25:30-37.
[53] 刘俊琦,于金龙,宋凤亮.北京棒杆菌AS1.299发酵生产蛋氨酸的营养条件优化[J].现代食品, 2018, 5(9):34-38;46.
LIU J Q, YU J L, SONG F L.Optimization of fermentation conditions for producing methionine by Corynebacterium AS 1.299[J].Modern Food, 2018, 5(9):34-38;46.
[54] LI Y, WEI H, WANG T, et al.Current status on metabolic engineering for the production of L-aspartate family amino acids and derivatives[J].Bioresource Technol, 2017, 245:1 588-1 602.
[55] 王宝瑄,袁学斌.蛋氨酸螯合物简易测定方法[J].饲料博览,2003(4):28-29.
WANG B X, YUAN X B.A simple method for the determination of methionine chelate[J].Feed Review, 2003(4):28-29.
[56] 刘强,黄应祥,王聪,等.蛋氨酸硒对西门塔尔牛瘤胃发酵及尿嘌呤衍生物的影响[J].中国生态农业学报,2009,17(1):110-114.
LIU Q, HUANG Y X, WANG C, et al.Effect of selenium methionine on rumen fermentation and purine derivatives in simmental steer[J].Chinese Journal of Eco-Agriculture, 2009, 17(1):110-114.
[57] KRAUSE R J, RIPP S L, SAUSEN P J, et al.Characterization of the methionine S-Oxidase activity of rat liver and kidney microsomes:Immunochemical and kinetic evidence for FMO3 being the major catalyst[J].Arch Biochem Biophy,1996,333(1):109-116.
[58] WANG F, LI S L, XIN J, et al.Effects of methionine hydroxy copper supplementation on lactation performance, nutrient digestibility, and blood biochemical parameters in lactating cows[J].J Dairy Sci,2012,95(10):5 813-5 820.
[59] BHARADWAJ A S, PATNAIK S, BROWDY C L,et al.Comparative evaluation of an inorganic and a commercial chelated copper source in Pacific white shrimp Litopenaeus vannamei (Boone) fed diets containing phytic acid[J].Aquaculture,2014,422-423:63-68.
[60] RANDHAWA S S, DUA K, SING R S, et al.Effect of supplementation of zinc methionine on claw characteristics in crossbred dairy cattle[J].Ind J Anim Sci,2012,82(3):304-308.
[61] LI Y S, ZHU N H, NIU P P, et al.Effects of dietary chromium methionine on growth performance, carcass composition, meat colour and expression of the colour-related gene myoglobin of growing-finishing pigs[J].Asian-Australasian Journal of Animal Sciences,2013,26(7):1 021-1 029.
[62] KUMAR D, SUBRAMANIAN K, BISARIA V S, et al.Effect of cysteine on methionine production by a regulatory mutant of Corynebacterium lilium[J].Bioresour Technol,2005,96(3):287-294.
[63] 金利群,金伟熔,柳志强.硫模块启动子对提高L-甲硫氨酸的生物合成的影响及发酵培养条件的优化[J].食品与发酵工业,2019,45(19):8-16.
JIN L Q, JIN W R, LIU Z Q.Effect of sulfur module promoter on the improvement of L-methionine biosynthesis and optimization of fermentation conditions[J].Food and Fermentation Industry, 2019, 45(19):8-16.
[64] WANG X X, LIN C P, ZHANG X J, et al.Improvement of a newly cloned carbonyl reductase and its application to biosynthesize chiral intermediate of duloxetine[J].Process Biochem,2018,70:124-128.