南美白对虾(Litopenaeus vannamei)中蛋白质、维生素及人体所需的微量元素等含量丰富,据近年来的市场统计,我国虾产量为110万t,其中南美白对虾海水养殖产量为5.58万t[1-2]。目前南美白对虾的应用主要集中在鲜食和冷冻加工方面,但是存在加工过程能耗大,对虾产品研究较少及加工形式单一等问题。虾糜制品以虾为原料,一般经斩拌、成型、凝胶化制成的产品,具有营养价值高、易消化、风味鲜美、易贮藏、食用方便等优点,受到广大消费者的青睐[2]。虽然虾糜制品产量未见明确数据报道,但近年来呈增长趋势。随着消费者的需求增长和产品的多元化发展,对虾糜制品的研究开发具有非常重要的现实意义。
蛋白质是虾类肌肉组织的重要组成部分,对虾类肌肉质量的好坏起着决定性作用。虾类制品在贮藏过程中出现冰晶生长、重结晶及蛋白质变性等问题,导致肌肉凝胶能力和持水力降低[3-5]。目前,大部分的贮藏研究主要以鱼糜研究为主,对南美白对虾肉糜的研究还较少。袁丽等[6]的研究表明蛋白质冷冻变性程度受到蛋白质与水分相互作用的影响,蛋白质结构的稳定程度随二者之间的作用力变大而增强。赵亚等[7]的研究发现Ca2+-ATPase活力受到虾肉水分含量和温度的影响,温度升高和水分含量增加,Ca2+-ATPase的活力降低。在水产品冷冻过程中,国内外学者的研究主要集中在理化特性变化、抗冻保水剂研发等方面[8-9],对蛋白质冻藏过程中蛋白质功能特性的机制鲜有报道。因此,探讨冻藏过程中南美白对虾肉糜蛋白质的凝胶特性及功能特性的变化,对其实际加工利用和新加工技术的应用有一定的理论指导意义。
本研究所用南美白对虾糜是由南美白对虾经采肉、高速捣碎(不经漂洗、精滤)获得,是南美白对虾肌肉的初级分离产物。以南美白对虾仁为对照,将南美白对虾肉糜冻藏于-18 ℃条件下,研究冻藏过程中南美白对虾肉糜蛋白质凝胶特性和功能特性的变化,并分析其变化机制,以期为新加工技术的应用以及南美白对虾资源的利用提供理论参考和技术指导。
1 材料与方法
1.1 材料与试剂
实验原料:鲜活南美白对虾,体长14~16 cm,2019年9月初购于浙江舟山老碶菜场。鲜活对虾碎冰浸没置于保温箱,30 min内运输至实验室进行处理。
主要试剂:KCl,NaCl,NaOH、磷酸盐缓冲液、三氯乙酸(TCA)、5,5-二硫二硝基苯甲酸等,均为分析纯,购自国药化学试剂有限公司。
1.2 仪器与设备
CF-16RN型高速冷冻多用途离心机,日本日立公司;751UVGD型紫外-可见分光光度计,上海第三分析仪器厂;TMS-PRO型物性测试仪,美国FTC公司;DIRECT-Q型超纯水装置,美国MILLIPORE公司;TUBE MILL 100 CONTROL型研磨机,IKA集团。
1.3 实验处理
新鲜南美白对虾用清水清洗后去虾头、壳及肠,采集虾仁;取得的虾仁用组织捣碎器高速切碎混合5 min,收集制作好的南美白对虾肉糜样品,将剩下的虾仁用纱布拭干表面水分,分装。样品均置于-18 ℃冰箱贮藏。以同批次的冻藏完整虾仁样品为对照组,第0、10、20、40、60、80、100和120天取样,解冻后用于各项指标的测定。
1.4 肌原纤维蛋白的制备
参照ZHANG等[10]报道方法。准确称取5.0 g的虾肉糜样品,按1∶9(g∶mL)加入9倍体积生理盐水,于冰浴条件匀浆处理(2 500 r/min,10 min),得到的上清液,即为提取的肌原纤维蛋白溶液,置于4 ℃冰箱备用。
1.5 肌原纤维蛋白凝胶特性测定
1.5.1 肌原纤维蛋白凝胶制备
参照ZHANG等[10]报道方法。将提取的肌原纤维蛋白溶液置于25 mm × 40 mm玻璃瓶,保持液面高度为15 mm。采取二段式加热,第一段水浴锅加热(45 ℃,30 min),第二段水浴锅加热(80 ℃,30 min),凝胶形成后,取出的玻璃瓶预冷后,用自来水冷却至室温。凝胶样品置于4 ℃冰箱中过夜,取出过夜的样品,室温放置30 min后,用于指标的测定。
1.5.2 凝胶质构特性测定
参照贾慧等[11]报道的方法测定冻藏虾仁与虾糜肌原纤维蛋白的凝胶质构特性。室温条件下,用质构剖面分析方法,在测定平台上将准备好的样品固定,用TMS-Pro物性测试仪测定肌原纤维蛋白凝胶的弹性和咀嚼性。
1.5.3 凝胶保水性测定
参照MAO等[12]报道的方法测定冻藏虾仁与虾糜肌原纤维蛋白的凝胶保水性。准确称量空离心管质量(m1)及加入蛋白溶液后总质量(m2)。凝胶制备完成后,经8 000 r/min离心10 min(4 ℃)后去除水分,再称量余下质量(m3)。保水性计算如公式(1)所示:
保水性![]()
(1)
1.6 肌原纤维蛋白功能特性测定
1.6.1 溶解性测定
参照MASATO等[13]的方法测定冻藏虾仁与虾糜肌原纤维蛋白的溶解性。用双缩脲法测定蛋白质量浓度,蛋白溶解度计算如公式(2)所示:
肌原纤维蛋白溶解度/%
(2)
1.6.2 浊度测定
参照SABOW等[14]的方法测定冻藏虾仁与虾糜肌原纤维蛋白的浊度,将肌原纤维蛋白溶液稀释到2 mg/mL,在室温恒温20 min后,于340 nm比色,测溶液吸光度(OD340)即为肌原纤维蛋白溶液浊度。
1.6.3 乳化性及乳化稳定性测定
参照冯实[15]的方法测定冻藏虾仁与虾糜肌原纤维蛋白的乳化性(emulsifying activity index,EAI)及乳化稳定性(emulsion stability index,ESI)。EAI和ESI计算如公式(3)、(4)所示:
(3)
(4)
式中:ρ为蛋白质溶液的质量浓度,g/mL;φ为油相体积分数(φ= 0.2);A0,A10为乳状液在0 min、10 min的吸光值。
1.6.4 起泡性及起泡稳定性测定
参照BUHL等[16]报道的方法测定冻藏虾仁与虾糜肌原纤维蛋白的起泡性(foaming capacity,FC)及起泡稳定性(foaming stability,FS)。FC和FS计算如公式(5)、(6)所示:
(5)
(6)
式中:V0为匀浆操作停止时泡沫体积和液体体积之和;V10为操作停止10 min后的泡沫和液体总体积。
1.7 数据分析
试验数据处理及作图采用Origin 8.1、SPSS 19.0统计分析软件,每个指标均平行测量3次,试验的结果均为平均值±标准偏差表示。
2 结果与分析
2.1 冻藏虾肉糜肌原纤维蛋白凝胶质构特性变化情况
弹性和咀嚼性反映食品恢复形状的能力,可部分反映食物的口感[17]。如图1-A所示,随着冻藏时间延长,虾糜实验组与虾仁对照组肌原纤维蛋白凝胶的弹性呈下降趋势。冻藏第120天时,相比于初始值,虾糜和虾仁肌原纤维蛋白凝胶的弹性分别下降了0.59 N和0.265 N,虾糜肌原纤维蛋白的弹性下降幅度显著。这可能与冻结后形成的冰晶有关,使蛋白质冷冻变性和肌原纤维蛋白结构遭到破坏,最终导致弹性下降[18]。如图1-B所示,随着冻藏时间的延长,虾糜实验组与虾仁对照组肌原纤维蛋白凝胶的咀嚼性呈下降的趋势。冻藏第10天时,虾糜实验组的咀嚼性下降显著,继续冻藏,咀嚼性的下降速率减缓且逐渐趋于平缓;虾仁对照组冻藏第10天时,咀嚼性下降不明显,随着冻藏时间的延长,咀嚼性下降幅度增加。这可能与冻藏过程中出现的自溶现象及蛋白质内部化学作用力变化有关[19]。

A-弹性;B-咀嚼性
图1 冻藏虾仁与虾糜肌原纤维蛋白凝胶 弹性和咀嚼性变化情况
Fig.1 Changes in springiness and chewiness of myofibrillar gel from peeled shrimp and mashed shrimp samples during frozen storage
2.2 冻藏虾肉糜肌原纤维蛋白凝胶保水性变化情况
持水力反映了肌肉维系水分的能力,虾肉的质构、嫩度、多汁性等品质均与肌肉的持水力相关[20]。如图2所示,随着冻藏时间的延长,虾糜实验组与虾仁对照组肌原纤维蛋白凝胶的持水力呈下降趋势,尤其以虾糜实验组下降幅度最为明显。冻藏第10天时,虾糜实验组样品,其肌原纤维蛋白凝胶的持水能力相比于虾仁对照组样品,二者之间并无显著性差异,短期冻藏并不会对虾肉糜的持水能力造成显著性影响。冻藏第20天时,虾糜实验组和虾仁对照组肌原纤维蛋白凝胶的持水力分别下降10.77%和1.6%,虾糜实验组持水力下降明显。冻藏第120天时,虾糜实验组和虾仁对照组肌原纤维蛋白凝胶的持水力分别下降26.21%和12.14%,虾糜实验组持水性下降幅度比虾仁对照组大。相比于组织结构被破坏的虾肉糜样品,以完整虾仁组织状态进行冷冻贮藏,对肌原纤维蛋白凝胶持水能力具有更好的保持作用。在虾肉糜制备过程中,经高速组织捣碎后,肌纤维原有物理结构遭到破坏,致使肌原纤维蛋白部分结构及功能也会受到一定程度的影响,因此其贮藏过程中持水能力的下降速率更加显著。这可能是因为蛋白质结合水脱离和自由水反复冻融诱导了水产品肌肉在冷藏、冻藏过程中出现汁液流失现象的发生[21]。向迎春[22]的研究结果表明,随着贮藏时间的延长,中国对虾的保水性变差,对虾的保水性下降幅度增大。以上研究结果与本实验得出的结果相似,进一步验证了实验数据的准确性。
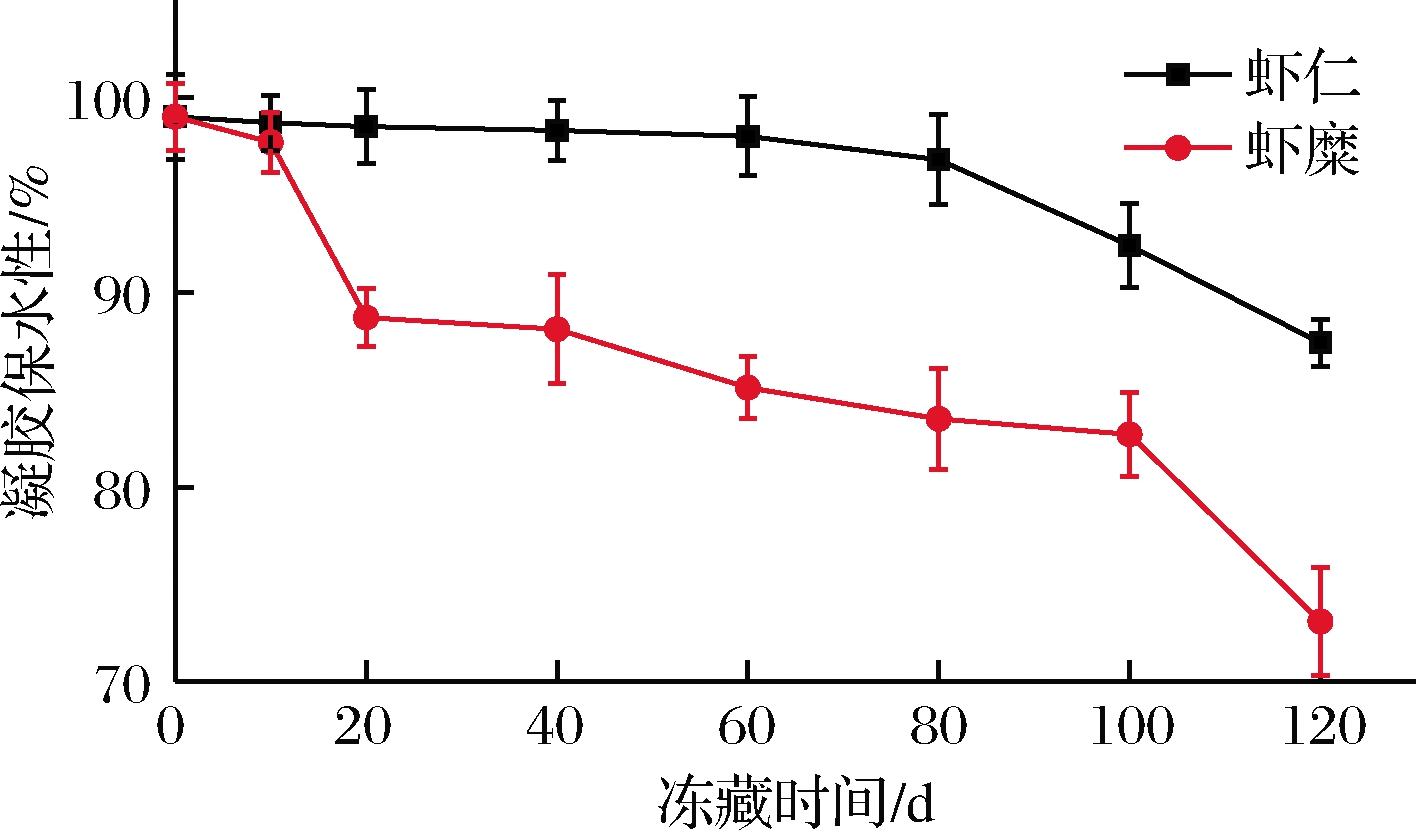
图2 虾仁与虾糜冻藏过程中肌原纤维蛋白 凝胶保水性变化情况
Fig.2 Changes in water retention of myofibrillar gel from peeled shrimp and mashed shrimp samples during frozen storage
2.3 冻藏虾肉糜肌原纤维蛋白溶解性变化情况
蛋白质功能性质受到蛋白质溶解性的显著影响,蛋白溶解性降低,标志着肌肉品质不同程度下降[23]。如图3 所示,随着冻藏时间的延长,虾糜实验组和虾仁对照组肌原纤维蛋白的溶解性呈下降趋势。这可能是在冻藏过程中,蛋白结构发生改变,内部疏水基团、巯基暴露导致表面疏水性增加,降低蛋白质的溶解度[24]。冻藏第10天时,虾糜实验组和虾仁对照组肌原纤维蛋白的溶解性下降明显,这可能是因为肌原纤维蛋白的构象发生改变,聚集程度增大,降低了溶解度。冻藏第120天时,与冻藏初期相比,虾糜实验组和虾仁对照组肌原纤维蛋白的溶解性分别降低了16.69%和18.7%,虾糜实验组的溶解度下降幅度比对照组小。蛋白质溶解性的降低一方面是蛋白质天然构象发生改变,蛋白聚集程度增大;另一方面是疏水性基团暴露,疏水性增加,降低了蛋白质的溶解性[5]。LEI等[19]的研究发现白虾贮藏过程中,随着贮藏时间的延长,蛋白溶解性降低,与本研究结果一致。
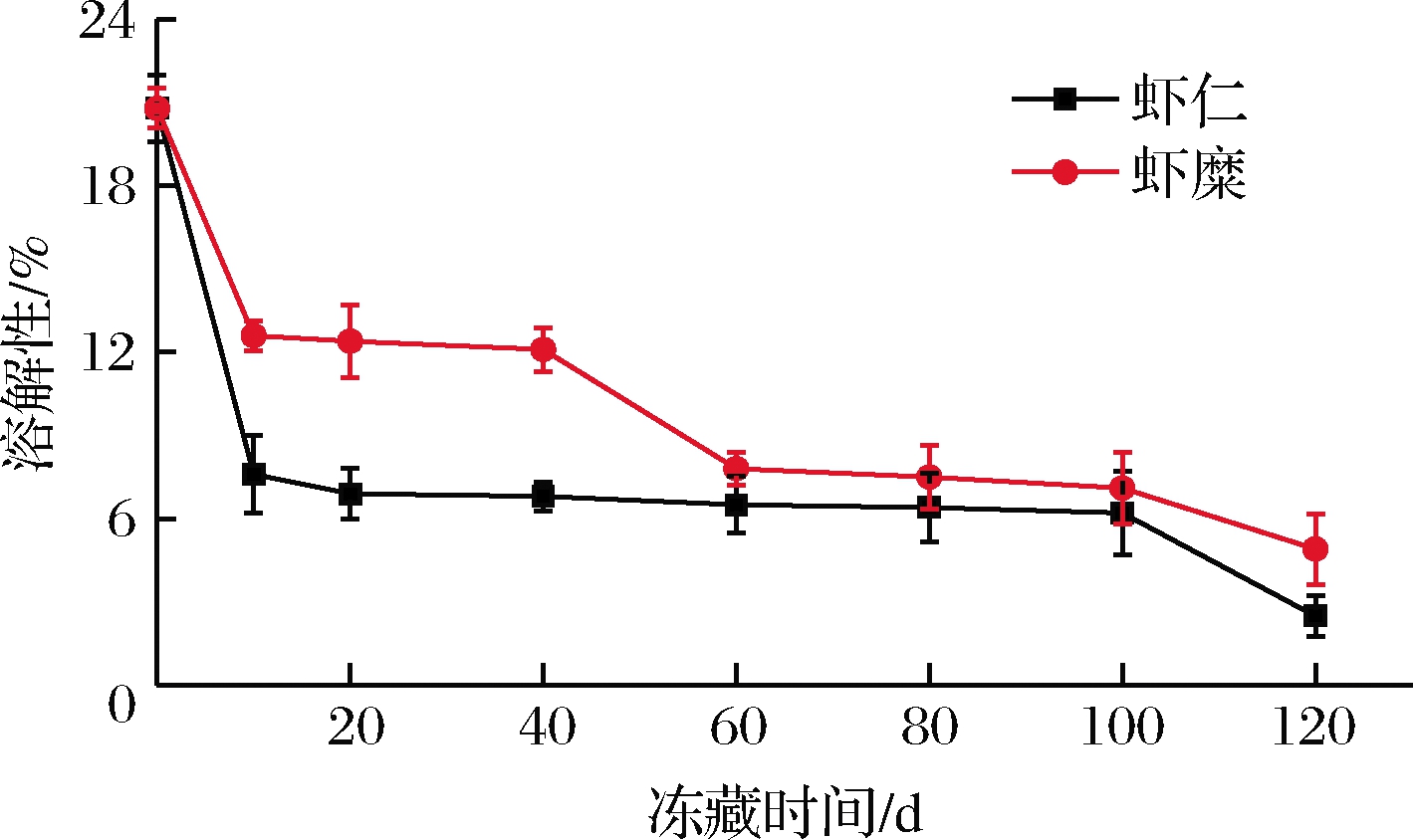
图3 虾仁与虾糜冻藏过程中肌原纤维蛋白质溶解性 变化情况
Fig.3 Changes in solubility of myofibrillar gel from peeled shrimp and mashed shrimp samples during frozen storage
2.4 冻藏虾肉糜肌原纤维蛋白浊度变化情况
蛋白质溶液的浊度,可衡量肌原纤维蛋白的聚集程度,吸光度的增加表明形成了大的聚合物。如图4所示,当温度一定时,随着冻藏时间的延长,虾糜实验组和虾仁对照组肌原纤维蛋白的浊度呈增加的趋势,虾仁对照组的浊度增加幅度比虾糜实验组大。这可能是在冻藏过程中,肌原纤维蛋白被破坏,其内部基团暴露,蛋白聚合程度增大,肌原纤维蛋白的浊度增加。LEE等[25]在研究中发现,冻藏过程中的肌球蛋白在低温下会发生聚集变性。此外,由结果还发现,当冻藏时间一定时,随着温度的升高,虾糜实验组和虾仁对照组肌原纤维蛋白的浊度也呈增加的趋势,50 ℃以上最为明显,此温度下,肌原纤维蛋白的浊度增加幅度逐渐变大。这可能是热处理使蛋白质分子发生变性,内部基团暴露,共价键或非共价键交联聚集的机会增大,肌原纤维蛋白热诱导聚集程度不断增强。这与YUAN等[26]的研究发现一致,肌球蛋白的热诱导过程中,温度在50 ℃以上主要是肌球蛋白的凝聚在起作用,此时蛋白极容易相互聚集。
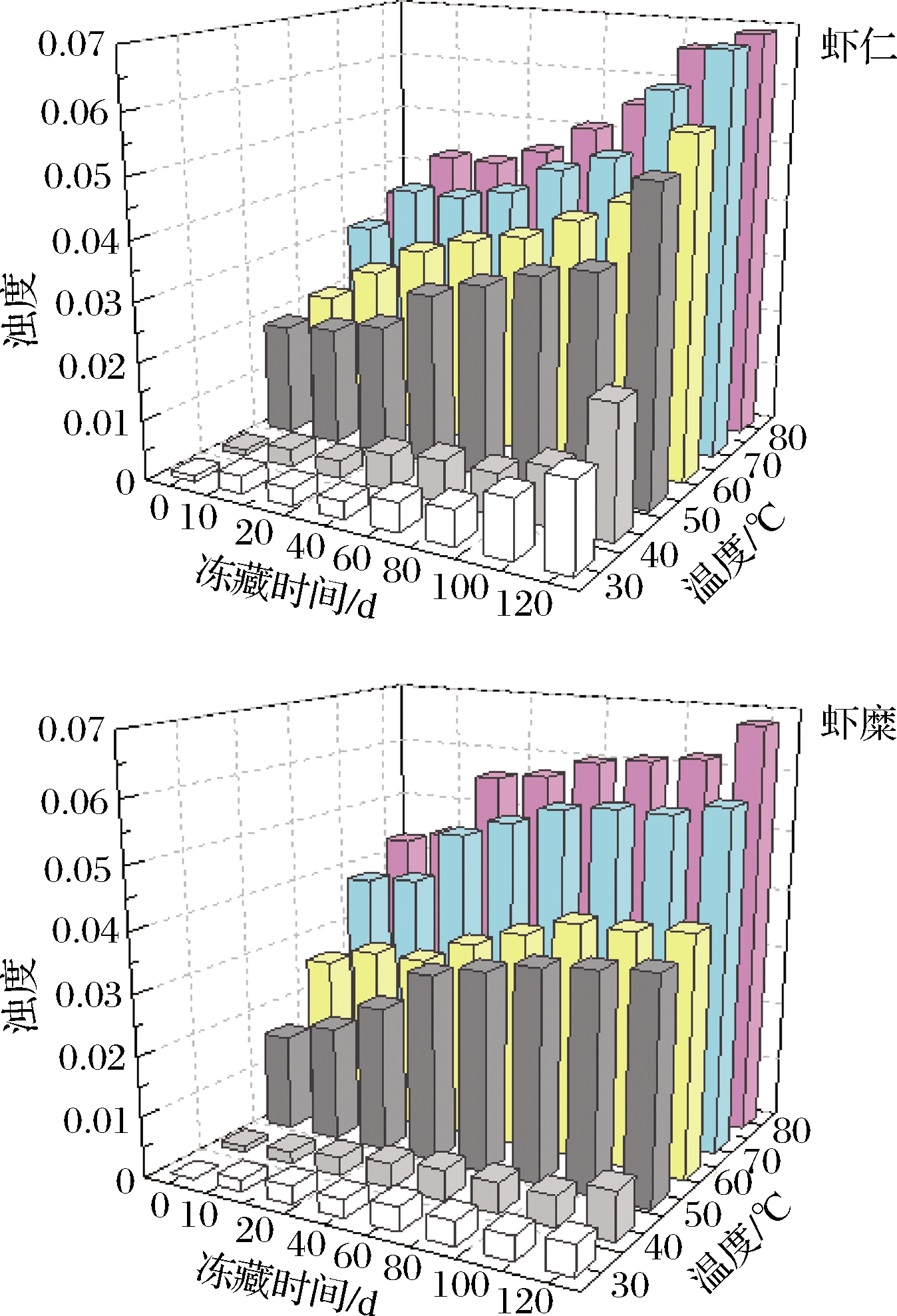
图4 虾仁与虾糜冻藏过程中肌原纤维蛋白质浊度变化情况
Fig.4 Changes in protein turbidity of myofibrillar gel from peeled shrimp and mashed shrimp samples during frozen storage
2.5 冻藏虾肉糜肌原纤维蛋白乳化特性变化情况
蛋白质乳化性是蛋白质的一项重要功能性质,指一定条件下蛋白质所能乳化油的量,包括乳化性和乳化稳定性2个方面。如图5-A所示,随着冻藏时间的延长,虾糜实验组和虾仁对照组肌原纤维蛋白的EAI呈显著的下降趋势。冻藏第120天时,与冻藏初期相比,虾糜实验组和虾仁对照组肌原纤维蛋白的EAI分别下降了14.39 m2/g和15.55 m2/g,虾糜实验组EAI下降的幅度比虾仁对照组小。冻藏过程中,肌原纤维蛋白EAI下降,可能是冻藏时间的延长,肌原纤维蛋白结构的完整性被破坏,肌原纤维蛋白与脂肪之间的作用力减弱。也可能是因为蛋白质的降解和变性作用,使埋藏在内部的分子暴露出来,导致疏水性的增加,降低乳化性[27]。如图5-B所示,随着冻藏时间的延长,虾糜实验组和虾仁对照组肌原纤维蛋白的ESI也呈显著的下降趋势。与冻藏初期相比,冻藏第10天时,肌原纤维蛋白的ESI下降明显,虾糜实验组下降的幅度低于虾仁对照组,分别下降了7.8%和9.9%。冻藏第120天时,虾糜实验组和虾仁对照组肌原纤维蛋白的ESI分别降低了28.08%和31.67%,原因可能是冻藏过程中,蛋白质发生氧化和变性导致蛋白质结构遭到破坏,界面膜形成不稳定,最终导致蛋白质的乳化性和乳化稳定性下降[28]。
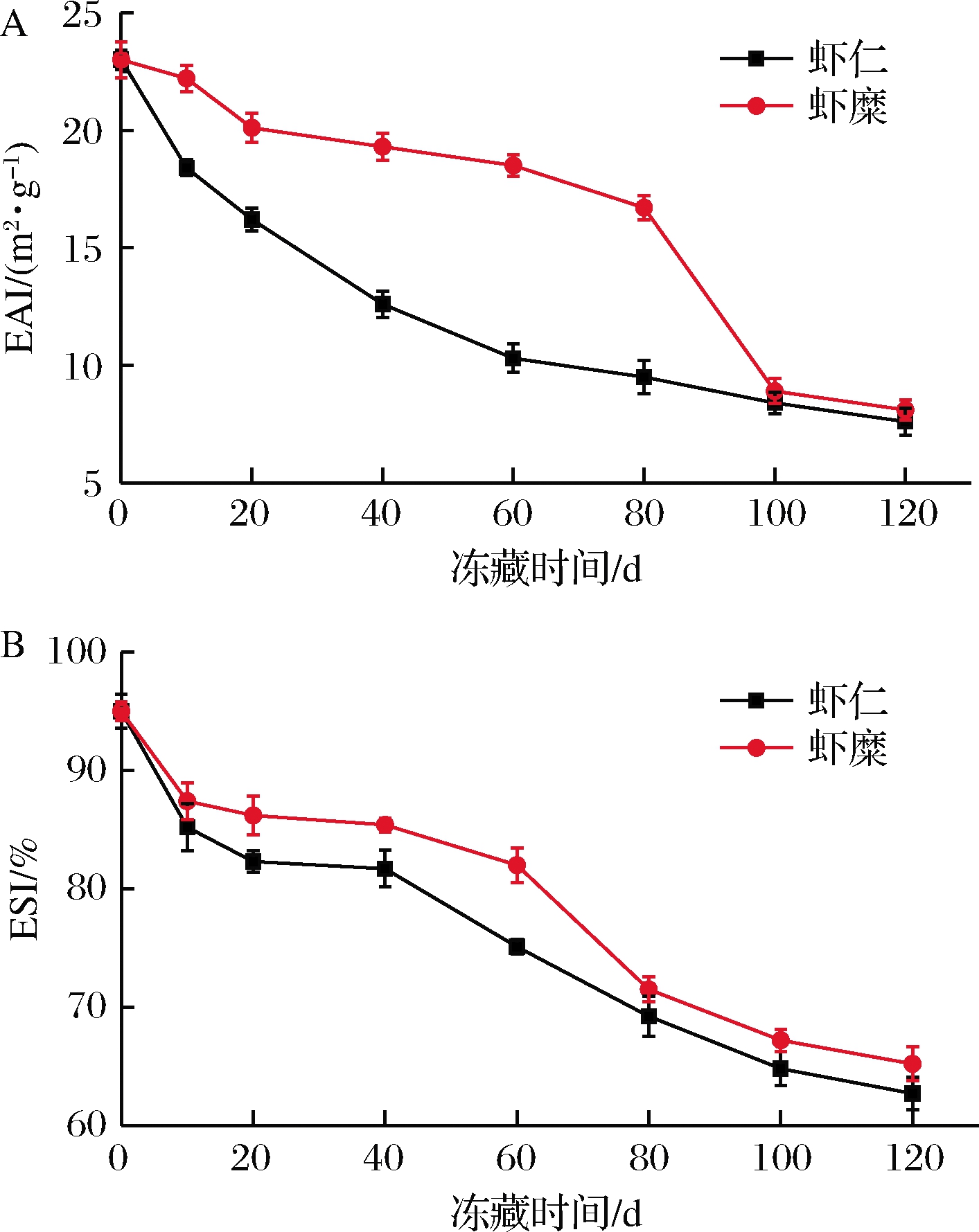
A-EAI;B-ESI
图5 冻藏虾仁与虾糜肌原纤维蛋白EAI和ESI 变化情况
Fig.5 Changes in EAI and ESI of myofibrillar gel from peeled shrimp and mashed shrimp samples during frozen storage
2.6 冻藏虾肉糜肌原纤维蛋白起泡特性变化情况
在食品产品中蛋白质的起泡性和泡沫稳定性的应用非常广,对食品加工中具有重要作用[29]。如图6-A所示,随着冻藏时间的延长,虾糜实验组和虾仁对照组肌原纤维蛋白的起泡性呈显著的下降趋势,冻藏第10天时,虾糜实验组肌原纤维蛋白的起泡性下降幅度低于虾仁对照组,这可能是由于冻藏初期,温度突然降低,蛋白质变性程度增大,蛋白质分子之间的作用力影响,降低了肌原纤维蛋白的起泡性。冻藏第120天时,虾糜实验组和虾仁对照组肌原纤维蛋白的起泡性分别下降了55.66%和58.33%,原因可能是随着冻藏时间的延长,肌原纤维蛋白变性程度加大,蛋白质的起泡性降低[30]。如图6-B所示,虾糜实验组和虾仁对照组肌原纤维蛋白的泡沫稳定性也呈显著的下降趋势。冻藏第120天时,虾糜实验组和虾仁对照组肌原纤维蛋白的泡沫稳定性分别下降了56.67%和59.67%,虾糜实验组肌原纤维蛋白的泡沫稳定性下降幅度低于虾仁实验组。原因可能是冻藏过程中,蛋白分子结构展开导致内部疏水基团与巯基的暴露程度增加,内源蛋白分子形成非共价聚集体加剧,分子间的界面特性与扩散速率受到影响,泡沫稳定性下降[31]。
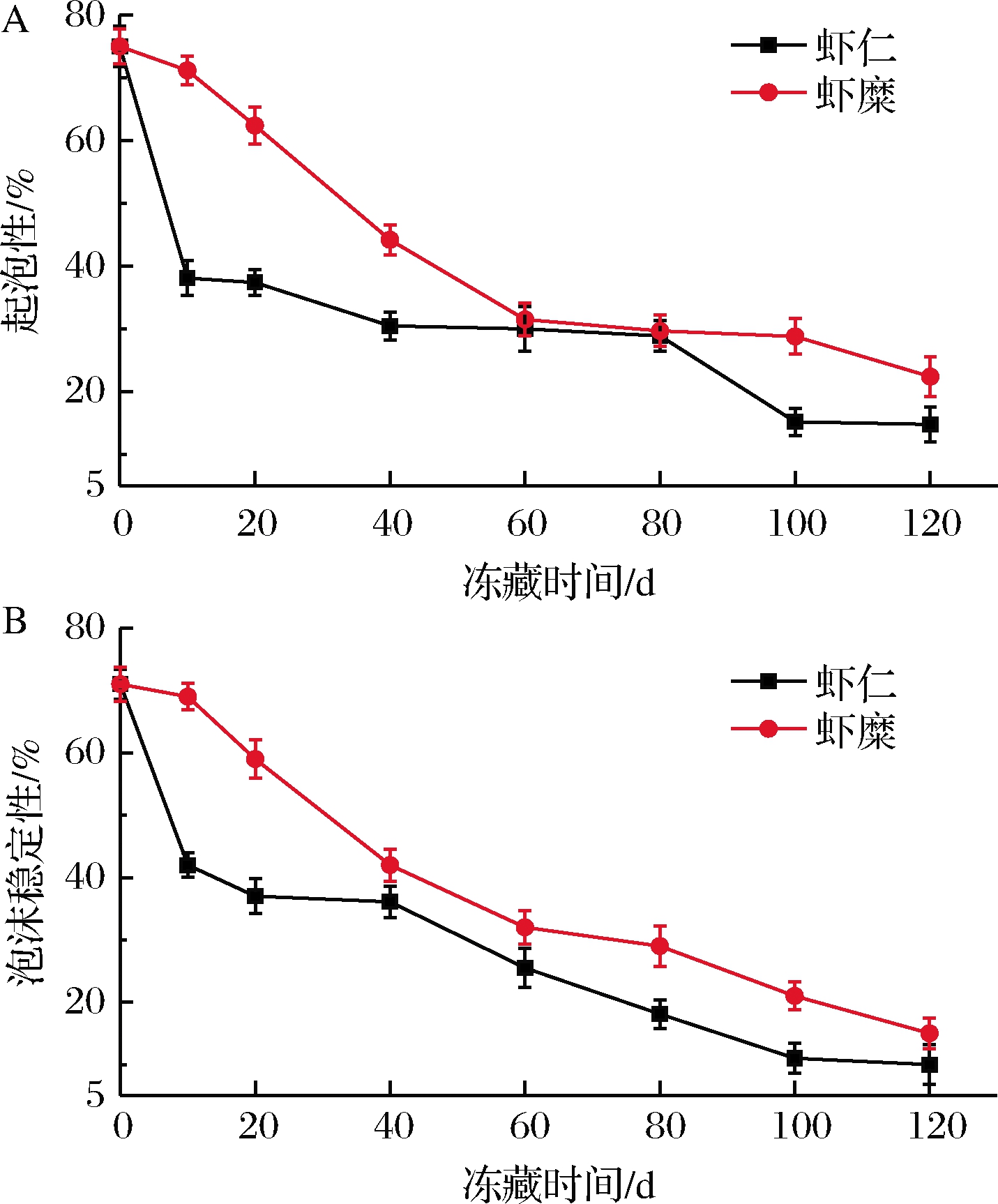
A-起泡性;B-泡沫稳定性
图6 冻藏虾仁与虾糜肌原纤维蛋白起泡性和 泡沫稳定性变化情况
Fig.6 Changes in foamability and foam stability of myofibrillar gel from peeled shrimp and mashed shrimp samples during frozen storage
3 结论
在食品贮藏过程中,蛋白质功能特性的运用和发挥受很多因素的影响。从功能性的角度出发,分析虾仁与虾糜在冻藏过程中的品质变化可以看出,冻藏虾仁与虾糜肌原纤维蛋白凝胶特性、保水性、溶解性、浊度、乳化特性和起泡特性对冻藏虾仁与虾糜均有不同程度的影响。随着冻藏时间的延长,在凝胶特性方面,虾仁对照组肌原纤维蛋白的弹性和咀嚼性以及凝胶保水性比虾糜实验组更佳;而在功能特性方面,虾糜实验组的溶解性、浊度、乳化特性和起泡特性更好。因此,在实际应用中需要兼具蛋白质功能特性时,应综合考虑这些因素,探讨功能特性平衡点,发挥蛋白质的功能性质最大的优势,以期为高值化生产加工提供新的思路和理论参考。
[1] 沈春蕾,张小利,赵金丽,等.糖醇对冻藏南美白对虾的品质保障作用[J].包装工程,2019,40(1):15-23.
SHEN C L, ZHANG X L, ZHAO J L, et al.Effect of sugar alcohols on the quality of shrimp (Litopenaeus Vannamei) during Frozen Storage[J].Packaging Engineering, 2019, 40(1):15-23.
[2] 农业部渔业渔政管理局2019年中国渔业统计年鉴[M].北京:中国农业出版社,2019:22.
Fishery and Fishery Administration Bureau of the Ministry of Agriculture 2019 China Dishery Statistical Yearbook[M].Beijing:China Agriculture Press, 2019:22.
[3] YANG L X, WANG B B, YIN Y L, et al.Effects of heating processing on gel properties of minced white shrimp(Penaeus vanmamei) and soy protein isolate compounds[J].Food and Fermentation Industries, 2017, 43(7):201-206.
[4] ZHANG B, WU H X, YANG H C, et al.Cryoprotective roles of trehalose and alginate oligosaccharides during frozen storage of peeled shrimp (Litopenaeus vannamei)[J].Food Chemistry, 2017, 228(1):257-264.
[5] OKPALA C O R.The Physicochemical Changes of farm-raised pacific white shrimp (Litopenaeus vannamei) as influenced by iced storage[J].Food & Nutrition Ences, 2015, 6(10):906-922.
[6] 袁丽,纪秀,石彤,等.拉曼光谱法分析凡纳滨对虾冻藏过程蛋白质与水分结构变化[J].食品科学,2016, 37(18):202-207.
YUAN L, JI X, SHI T, et al.Protein and water structural changes in whiteleg shrimp (Litopenaeus vannamei) during frozen storage as revealed by raman spectroscopy[J].Food Science, 2016, 37(18):202-207.
[7] 赵亚,石启龙,曹淑敏,等.南美白对虾贮藏期间Ca2+-ATPase活力变化规律与机制[J].食品科学,2018, 39(5):258-264.
ZHAO Y, SHI Q L, CAO S, et al.Variation and underlying mechanisms of Ca2+-ATPase activity in penaeus vannamei during storage[J].Food Science, 2018, 39(5):258-264.
[8] WU S.Effect of trehalose on the state of water, protein denaturation and gel-forming ability of weever surimi[J].Taylor & Francis, 2016, 19(1-4):521-525.
[9] HUANG J, ZHAO J X, HUANG J L, et al.Physicochemical properties of low moisture potato starch and their effects on surimi products[J].Modern Food Science & Technology, 2015, 31(3):108-114.
[10] ZHANG B, HAO G J, CAO H J, et al.The cryoprotectant effect of xylooligosaccharides on denaturation of peeled shrimp (Litopenaeus vannamei) protein during frozen storage[J].Food Hydrocolloids, 2018, 77:228-237.
[11] 贾慧,夏俪宁,李琦,等.两种多酚对马鲛鱼鱼糜凝胶特性的改善[J].食品与发酵工业,2018,44(10):90-95.
JIA H, XIA L N, LI Q, et al.Improvement of the gel properties of japanese spanish mackerel (Scomberomours niphonius) surimi by two polyphenols[J].Food and Fermentation Industries, 2018, 44(10):90-95.
[12] MAO L, MIAO S, YUAN F, et al.Study on the textural and volatile characteristics of emulsion filled protein gels as influenced by different fat substitutes[J].Food Research International, 2018, 103:1-7.
[13] MASATO S, EISUKE T, DAISUKE E, et al.Heat-induced formation of myosin oligomer-soluble filament complex in high-salt solution[J].International Journal of Biological Macromolecules, 2015, 73:17-22.
[14] SABOW A B, SAZILI A Q, AGHWAN Z A, et al.Changes of microbial spoilage, lipid-protein oxidation and physicochemical properties during post mortem refrigerated storage of goat meat[J].Animal Science Journal, 2016, 87(6):816-826.
[15] 冯实.南极磷虾蛋白质的功能特性及改性[D].哈尔滨:哈尔滨商业大学,2016.
FENG S.The features of the antarctic krill protein and its modification[D].Harbin:Harbin University of Commerce, 2016.
[16] BUHL T F, CHRISTENSEN C H, HAMMERSHO J M.Aquafaba as an egg white substitute in food foams and emulsions:Protein composition and functional behavior[J].Food Hydrocolloids, 2019, 96:354-364.
[17] 姜启兴.鳙鱼肉热加工特性及其机理研究[D].无锡:江南大学,2015.
JIANG Q X.Study on thermal processing properties and mechanism of bighead carp (Aristichthys nobilis) muscle[D].Wuxi: Jiangnan University, 2015.
[18] ZHANG L T, SHAN Y K, HONG H, et al.Prevention of protein and lipid oxidation in freeze-thawed bighead carp (Hypophthalmichthys nobilis) fillets using silver carp (Hypophthalmichthys molitrix) fin hydrolysates[J].LWT-Food Science and Technology, 2020, 123:1-7.
[19] LEI Y T, SHI J, GUI P,et al.Effects of glazing with tea polyphenols on the quality characteristics for Pacific white shrimp (Litopenaeus vannamei) during frozen storage[J].Journal of China Agricultural University, 2018, 23(6):92-99.
[20] 王静杰,朱传旭,吴煜彤,等.解冻方法对原料肉品质及蛋白质结构影响的研究进展[J].食品工业科技,2019, 40(16):363-368.
WANG J J, ZHU C X, WU Y T, et al.Research progress on effects of thawing method on meat quality and protein structure of raw materials[J].Science and Technology of Food Industry, 2019, 40(16):363-368.
[21] 迟坤蕊,姜竹茂,华霄,等.冷藏即食虾仁保藏期间品质变化[J].食品工业科技,2018,39(9):283-289.
CHI K R, JIANG Z M, HUA X, et al.The change of quality during storage of shrimp in cold storage[J].Science and Technology of Food Industry, 2018, 39(9):283-289.
[22] 向迎春.超声辅助冻结中国对虾的组织冰晶状态及其品质变化的影响研究[D].杭州:浙江大学,2018.
XIANG Y C.Studies on the effect of ultrasonic assisted freezing on the ice crystals and the quality changes in fenneropenaeus chinensis[D].Hangzhou:Zhejiang University, 2018.
[23] WEI R, WANG P, HAN M Y, et al.Effect of freezing on electrical properties and quality of thawed chicken breast meat[J].Asian Australasian Journal of Animal Sciences, 2017, 30(4):569-575
[24] YUAN L, LIU Y N, GE J, et al.Effects of heat treatment at two temperatures on the myosin cluster of bighead carp for gel formation[J].CyTA - Journal of Food, 2017,15(4):574-581.
[25] LEE J, PARK H W, JENKINS R, et al.Image and chemical analyses of freezing-induced aggregates of fish natural actomyosin as affected by various phosphate compounds[J].Food Bioscience, 2017, 19:57-64.
[26] YUAN L, SUN C C, SHI T, et al.Effect of thermal induction on the characteristic of silver carp myosin[J].Journal of Chinese Institute of Food Science & Technology, 2017, 17(11):28-35.
[27] CHEN A, TANIDJAJA I, DAMODARAN S.Nanostructure and functionality of enzymatically repolymerized whey protein hydrolysate[J].Food Chemistry, 2018,256:405-412.
[28] 李学鹏,周明言,周凯,等.大黄鱼冻藏过程中肌原纤维蛋白氧化及其功能性质的变化[J].中国食品学报,2018,18(7):171-179.
LI X P, ZHOU M Y, ZHOU K, et al.Changes of myofibrillar protein oxidation and functional properties in large yellow croaker (Pseudosciaena crocea) during frozen storage[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(7):171-179.
[29] GHARBI N, LABBAFI M.Influence of treatment-induced modification of egg white proteins on foaming properties[J].Food Hydrocolloids, 2019, 90(5):72-81.
[30] 赵冰,张顺亮,李素,等.脂肪氧化对肌原纤维蛋白氧化及其结构和功能性质的影响[J].食品科学,2018,39(5):40-46.
ZHAO B, ZHANG S L, LI S, et al.Effect of lipid oxidation on myofibrillar protein oxidation, structure and functional characteristics[J].Food Science, 2018, 39(5):40-46.
[31] KUNARAYAKUL S, THAIPHANIT S, ANPRUNG P, et al.Optimization of coconut protein deamidation using protein-glutaminase and its effect on solubility, emulsification, and foaming properties of the proteins[J].Food Hydrocolloids, 2018, 79:197-207.