急性肺损伤(acute lung injury, ALI)属于一种病理性损伤,是急性呼吸衰竭最常见的病因,表现为炎症因子释放、炎症细胞迁移以及肺间质水肿[1-2]。然而,目前ALI的有效治疗药物很少。因此,我们不得不重视研究其可能的分子机制以及更有效的治疗方法。病理状态下,内毒素可诱导机体炎症反应的发生,其中脂多糖(lipopolysaccharide, LPS)作为其有效成分起主要作用。在ALI的一些动物模型中,LPS常被用来诱发肺部炎症,通过结合膜表面Toll样受体4(toll-like receptor 4,TLR4)在免疫系统中发挥重要作用[3]。因此,本研究选用LPS诱导大鼠ALI模型。LPS可通过细胞膜表面TLR4受体,激活PI3K/Akt及NF-κB信号通路,最终促进炎症相关因子(如TNF-α、IL-1β以及IL-6等)的释放,参与ALI过程[4-5]。
榛蘑,学名蜜环菌(Armillaria mellea),属担子菌亚门、白蘑科、蜜环菌属,主要分布于我国东北地区,其具有食用性以及多种药理活性,包括抗凋亡[6],保护内皮细胞[7]、抗血栓[8]、抗炎[9]、抗氧化[10]等功能。本研究以LPS作为诱导剂,建立大鼠ALI模型,探讨榛蘑粗多糖对于LPS造成的ALI的抑制作用及其机制,为阐明其抗炎机制提供理论依据。
1 材料与方法
1.1 药材与试剂
榛蘑于长白山采集,而榛蘑粗多糖为提取物;乌拉坦(麻醉剂),购于Gibco公司;p-PI3K抗体、p-Akt抗体、p-NF-κB p65抗体和Lamin B抗体,购自美国Abcam公司;I-κB抗体,购自美国CST公司;LPS、β-actin 抗体、二抗(羊抗鼠IgG-HRP)、二抗(羊抗兔 IgG-HRP),购自美国Sigma公司;内皮素-1(endothelin-1, ET-1)、血栓调节蛋白(thrombomodulin, TM)、白介素-6(interleukin-6,IL-6)以及肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)试剂盒,购自上海研谨生物科技有限公司;核蛋白提取试剂盒与全蛋白提取试剂盒,购于Solarbio公司。
1.2 实验动物
SD大鼠(清洁级)35只,体重范围为(200±20)g,其合格证书编号为SCXK(吉)2011-0007,本校实验动物中心提供。
1.3 仪器与设备
RT-2100型酶标仪,购自美国Bio-Tek公司;GelDoc XR凝胶成像仪,购自美国Bio-Rad公司;BX53F显微镜,购自日本OLYMPUS 株式会社。
1.4 实验方法
1.4.1 榛蘑粗多糖的制备
野生棒蘑被烘干后,使用热水浴浸提,过滤残渣,将残渣在热水浴中加热浓缩,加入无水乙醇使其完全沉淀,反复洗涤,最终干燥后得到榛蘑粗多糖,产率为2.2%[11]。
1.4.2 动物分组及处理
本实验将大鼠随机分组,共5组,分别为正常对照组、模型组(LPS 20 mg/kg)、阳性对照组(LPS+地塞米松5 mg/kg)、榛蘑粗多糖低、高剂量组(200、400 mg/kg)。榛蘑粗多糖组分别按200、400 mg/kg体质量灌胃,其余3组均以等体积的生理盐水灌胃。第10天,将鼠禁食24 h。次日,将阳性对照组的大鼠以5 mg/kg体质量腹腔注射地塞米松,2 h后,除正常对照组,其他各组大鼠以20 mg/kg体质量注射LPS诱导ALI,正常对照组以等体积的生理盐水注射。LPS损伤6 h后,将大鼠用20%乌拉坦麻醉,仰卧位固定,采血并取出肺组织,用于血清学指标检测、Western bolt实验以及肺组织病理形态学观察。
1.4.3 肺组织形态学观察
使用4%多聚甲醛固定大鼠肺组织,经无水乙醇脱水、石蜡包埋和切片等操作步骤后,使用苏木素-伊红(HE)染色。于显微镜下观察其结构变化。
1.4.4 血清学指标检测
全血置于常温30 min以上,以4 000 r/min转速离心10 min,按ELISA试剂盒操作步骤进行ET-1、TM、IL-6以及TNF-α水平的检测。
1.4.5 Western bolt法
提取肺组织总蛋白,作为检测p-PI3K、p-Akt以及I-κB指标的样品;提取肺组织核蛋白,用于检测p-NF-κB p65 表达水平。
将上述2种蛋白分别进行BCA蛋白定量。在5×上样缓冲液中95 ℃煮沸10 min后,取50 μg蛋白质样品分别进行SDS-PAGE凝胶电泳,随后转移到聚偏二氟乙烯(PVDF)膜上。将转膜后的PVDF以5%脱脂牛奶封闭液封闭 1 h,1 h后用TBST缓冲液(含有tris-buffered,saline和吐温20三种物质)洗涤3次,每次至少5 min,之后以相应的一抗在4 ℃孵育过夜。第2天再次用TBST洗涤,二抗于常温孵育2 h,用凝胶成像仪进行分析。
1.4.6 统计学分析
试验数据用平均数±标准差(x±SD)表示,使用SPSS 20.0统计学软件对数据进行单因素方差统计分析,P<0.05表示差异具有显著意义。
2 结果与分析
2.1 大鼠肺组织形态学观察
HE染色法观察了榛蘑粗多糖对肺组织病理损伤的影响。如图1所示,正常对照组大鼠肺组织未见微血栓形成,肺泡以及肺间质的结构较为完整。经LPS损伤后模型组肺泡结构被破坏,肺泡壁充血以及增厚,肺血管周围可见大量炎症细胞浸润,并观察到微血栓形成。榛蘑粗多糖高剂量组肺泡和肺间质结构趋于恢复正常,未见炎症细胞的过度浸润和血栓的形成。这就提示,榛蘑粗多糖可以减轻LPS引起的肺组织的病理损伤。
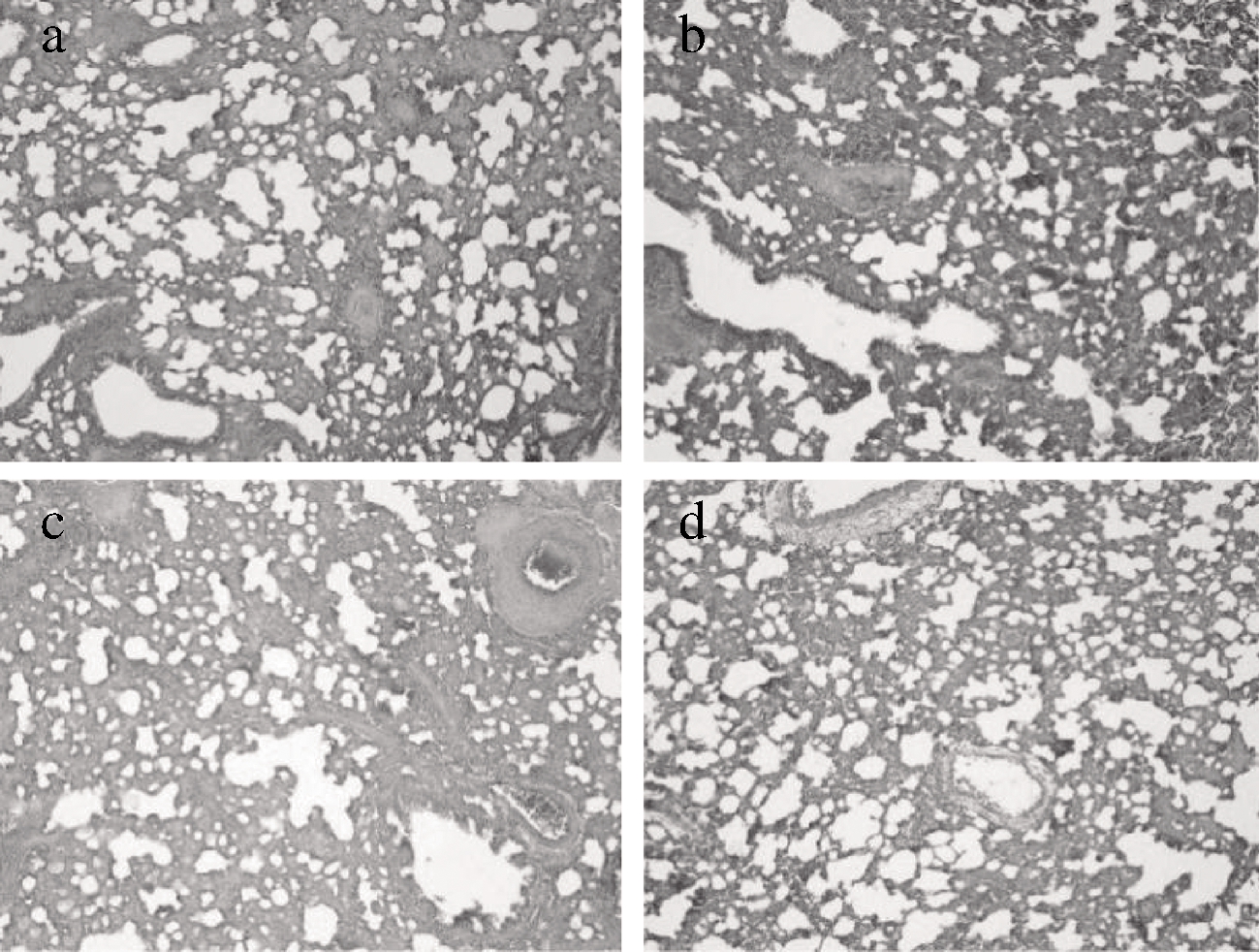
a-正常对照组;b-模型组;c-阴性对照组; d-榛蘑粗多糖高剂量组
图1 大鼠肺组织形态学观察(×100)
Fig.1 Morphological observation of lung tissue in rats
2.2 血清中TNF-α与IL-6水平的检测
与正常对照组相比,模型组中TNF-α和IL-6的含量明显增多(P<0.01),说明LPS作用后可引起炎症因子的释放。与模型组相比,阳性对照组和榛蘑粗多糖高剂量组中TNF-α和IL-6的含量显著减少(P<0.05)。这就提示,地塞米松和榛蘑粗多糖可抑制LPS所致的TNF-α和IL-6水平的升高。与阳性对照组相比,榛蘑粗多糖低剂量组中TNF-α和IL-6的含量有显著差异(P<0.05),见表1。
表1 血清中TNF-α与IL-6水平的检测
Table 1 Detection of TNF-α and IL-6 in serum

分组TNF-α/(ng·L-1)IL-6/(ng·L-1)正常对照组1.6±1.2*##2.8±1.1*##模型组11.2±2.3**7.4±1.2**阳性对照组3.4±1.3##4.2±1.8##榛蘑粗多糖低剂量组7.7±2.2*6.3±1.6*榛蘑粗多糖高剂量组4.6±1.9##5.3±1.6#
注:与模型组相比,#表示差异显著(P<0.05),##表示差异极显著(P<0.01);与阳性对照组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01) (下同)
2.3 血清中TM与ET-1水平的检测
如表2所示,与正常对照组相比,模型组中血栓调节蛋白(TM)和内皮素-1(ET-1)明显增多(P<0.01),说明LPS作用后引起内皮细胞的损伤;与模型组相比,阳性对照组和榛蘑粗多糖低、高剂量组中TM和ET-1的水平显著下降(P<0.05),这就说明地塞米松和榛蘑粗多糖可以减少LPS对内皮细胞的损伤。与阳性对照组相比,榛蘑粗多糖低剂量组中TM和ET-1的含量有显著差异(P<0.05)
表2 血清中TM与ET-1水平的检测
Table 2 Detection of TM and ET-1 in serum

分组TM/(μg·L-1)ET-1/(ng·L-1)正常对照组1.7±0.3##1.5±0.8##模型组3.5±0.6**8.7±1.4**阳性对照组1.8±0.2##2.4±0.7##榛蘑粗多糖低剂量组2.3±0.4*#6.1±1.4*#榛蘑粗多糖高剂量组2.0±0.1#2.4±1.3##
2.4 大鼠肺组织中I-κB蛋白表达以及p-PI3K与p-Akt蛋白水平的检测
为了分析榛蘑粗多糖对LPS所致的ALI的作用机制,我们观察了其对p-PI3K、p-Akt以及I-κB水平的影响。如图2所示,与正常对照组相比,模型组中p-PI3K和p-Akt水平明显升高,I-κB蛋白的表达显著减少(P<0.01),说明LPS作用后可引起PI3K/Akt信号通路相关蛋白的激活;与模型组相比,榛蘑粗多糖低剂量组中p-Akt蛋白水平明显降低,I-κB蛋白的表达明显增多(P<0.01),阳性对照组和榛蘑粗多糖高剂量组中p-PI3K和p-Akt水平显著降低,I-κB蛋白的表达明显增多(P<0.01)。这就说明,地塞米松和榛蘑粗多糖抑制了LPS所致的PI3K/Akt信号通路的激活。与阳性对照组相比,榛蘑粗多糖低剂量组中p-PI3K、p-Akt以及I-κB的水平有显著差异(P<0.05)。
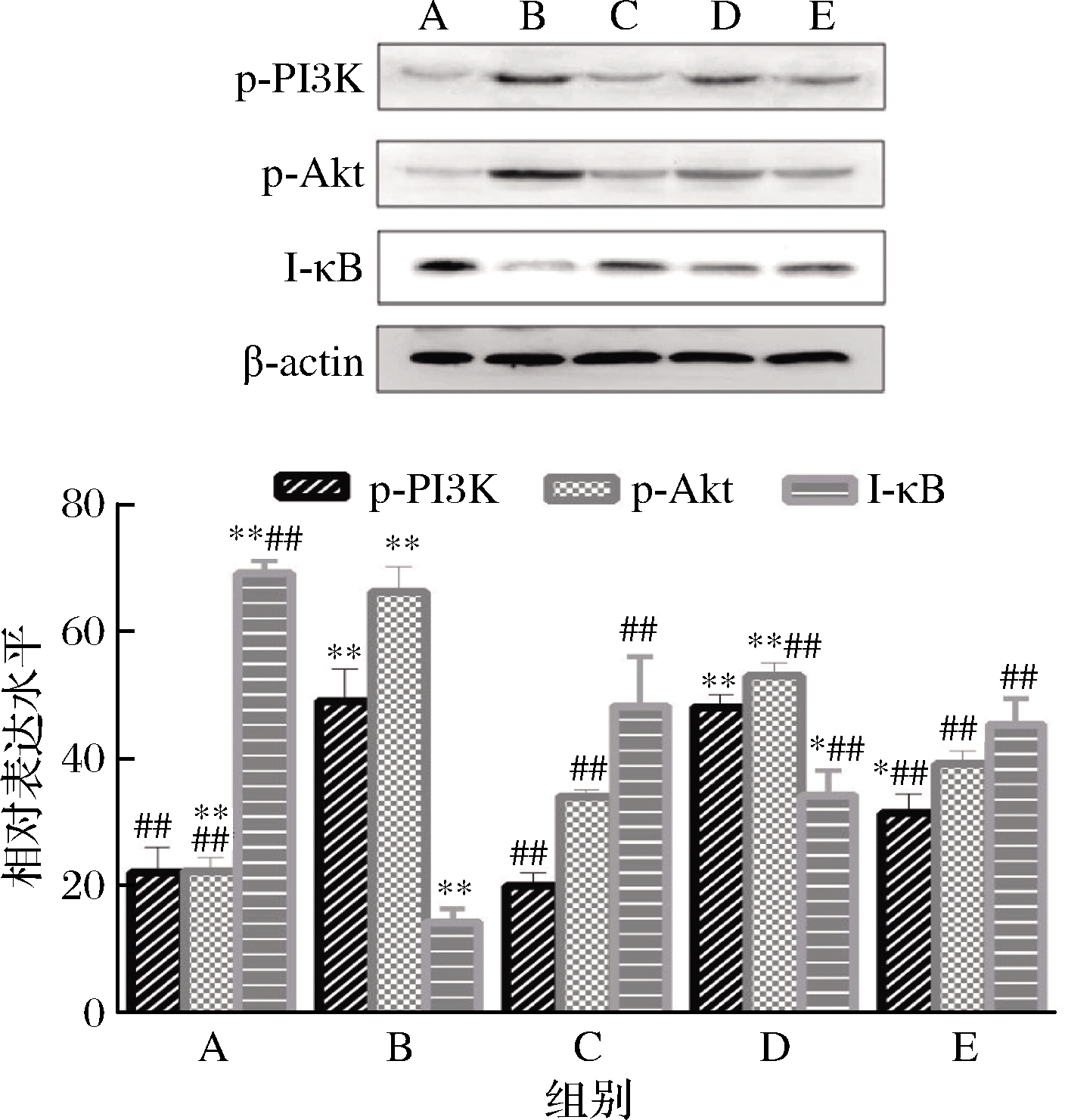
A-正常对照组;B-模型组;C-阳性对照组;D-榛蘑粗多糖低剂量组; E-榛蘑粗多糖高剂量组(下同)
图2 I-κB蛋白表达以及PI3K和Akt蛋白磷酸化水平
Fig.2 The expression of I-κB protein and the phosphorylation level of PI3K and Akt
2.5 大鼠肺组织细胞核中p-NF-κB p65水平的检测
如图3所示:与正常对照组相比,模型组中胞核p-NF-κB p65水平明显升高(P<0.01),说明LPS作用后可引起NF-κB p65活化;与模型组相比,阳性对照组和榛蘑粗多糖低、高剂量组中p-NF-κB p65水平明显降低(P<0.01)。说明地塞米松和榛蘑粗多糖抑制了NF-κB p65的磷酸化水平。与阳性对照组相比,榛蘑粗多糖低剂量组中p-NF-κB p65的水平有显著差异(P<0.01)。

图3 胞核NF-κB p65的磷酸化水平
Fig.3 The phosphorylation level of NF-κB P65 in nucleus
3 讨论与结论
ALI是一种炎症反应造成的肺组织病理性损伤[12],其特征为炎症相关介质的释放(如TNF-α、IL-1以及IL-6等)、中性粒细胞过度迁移以及细胞毒性介质的释放[13]。LPS作为细菌外膜的重要组成部分,会对宿主造成损害,包括炎症反应和对组织器官的损伤[14-15]。因此,本实验以LPS作为诱导剂来建立ALI模型。已有研究证明,地塞米松具有明确的抗炎作用,可以改善呼吸氧合功能,减轻LPS引起的大鼠ALI[16]。所以,本实验选择地塞米松作为阳性药物。LPS结合细胞膜上的特异受体,如CD14和TLR4,引发免疫应答。这些受体激活后可引起核转录因子NF-κB p65活化,而NF-κB p65活化后可进一步促进炎症因子(如TNF-α或IL-6)的合成和释放。研究表明,PI3K/Akt通路可调节肺部炎症中细胞存活以及氧化应激,参与ALI过程[4]。
TNF-α与IL-6是炎症过程中重要的细胞因子,参与ALI的炎症反应[17-18]。在LPS诱导的ALI过程中,这些细胞因子可诱导炎症细胞的浸润,加速其病理改变并放大炎症反应[19]。ET-1和TM作为内皮细胞损伤的指标,在ALI时,其水平显著增高[20-21]。因此,本实验中我们同时检测了ET-1和TM的水平。实验结果表明,榛蘑粗多糖抑制了LPS所致的TNF-α、IL-6、TM以及ET-1的合成与释放,减轻了LPS引起的肺组织的病理损伤。
为了进一步探讨其作用机制,我们还检测了PI3K/Akt信号通路和NF-κB p65。NF-κB p65是基因转录的调节因子,它的激活依赖于IKK复合物。在生理状态下,I-κB与NF-κB p50/NF-κB p65结合,处于非活化状态。在多种诱因的作用下IKK复合物可被激活,促使I-κB发生磷酸化而被降解,进一步促进NF-κB p65发生核转移以及在核内的磷酸化,最终促进炎症介质的释放[22-23]。PI3K和Akt是NF-κB上游分子。研究表明,LPS通过TLR4激活PI3K/Akt信号通路,直接诱导原代培养小鼠肺细胞的炎症反应[24]。MENG等的研究结果表明,在大鼠ALI模型中,右美托咪定通过抑制PI3K/Akt信号通路对ALI起保护作用[4],这与我们的实验结果一致。实验结果表明,榛蘑粗多糖对LPS诱导的大鼠ALI的抑制作用可能与PI3K/Akt信号通路相关。
综上所述,榛蘑粗多糖通过对PI3K/Akt信号通路的调控作用对LPS诱导的ALI起保护作用。
[1] SUN G Y, YANG H H, GUAN X X, et al.Vasoactive intestinal peptide overexpression mediated by lentivirus attenuates lipopolysaccharide-induced acute lung injury in mice by inhibiting inflammation[J].Mol Immunol, 2018, 97:8-15.
[2] CHEN T, GUO Q Q, WANG H M, et al.Effects of esculetin on lipopolysaccharide (lps)-induced acute lung injury via regulation of rhoa/rho kinase/nf-кb pathways in vivo and in vitro[J].Free Radic Res, 2015, 49(12):1 459-1 468.
[3] JIANG K F, GUO S, YANG C, et al.Barbaloin protects against lipopolysaccharide (LPS)-induced acute lung injury by inhibiting the ROS-mediated PI3K/AKT/NF-κB pathway[J].International Immunopharmacology, 2018, 64:140-150.
[4] MENG L, LI L Y, LU S, et al.The protective effect of dexmedetomidine on lps-induced acute lung injury through the hmgb1-mediated tlr4/nf-κb and pi3k/akt/mtor pathways[J].Mol Immunol, 2018, 94:7-17.
[5] ZHOU R, LUO F, LEI H, et al.Liujunzi tang, a famous traditional chinese medicine, ameliorates cigarette smoke-induced mouse model of copd[J].J Ethnopharmacol, 2016, 193:643-651.
[6] CHEN Y J, CHEN CHIEN CHIH, HUANG HUEY LAN.Induction of apoptosis by Armillaria mellea constituent armillarikin in human hepatocellular carcinoma[J].Onco Targets Ther, 2016, 9:4 773-4 783.
[7] 丛贺, 周广亮, 金梅花, 等.榛蘑多糖对大鼠血管内皮细胞的保护作用[J].食品与发酵工业,2015, 41(5):157-159.
CONG H, ZHOU G L, JIN M H, et al.Protective effects of polysaccharides from Armillaria mellea on vascular endothelium in rats[J].Food and Fermentation Industries, 2015, 41(5):157-159.
[8] 王玉娇, 丛贺, 沈明花.榛蘑多糖对三氯化铁所诱导大鼠血栓的抑制作用[J].延边大学医学学报, 2015, 38(3):171-173.
WANG Y J, CONG H, SHEN M H.Inhibitory effects of Armillaria mellea polysaccharides on arterial thrombosis induced by ferric trichloride in rats[J].Journal of Medical Science Yanbian University, 2015, 38(3):171-173.
[9] WU S J, TSAI JENNYI, LAI M N, et al.Armillariella mellea shows anti-inflammatory activity by inhibiting the expression of no, inos, cox-2 and cytokines in thp-1 cells[J].Am J Chin Med, 2007, 35(3):507-516.
[10] ZHANG S S, LIU X Q, YAN L h, et al.Chemical compositions and antioxidant activities of polysaccharides from the sporophores and cultured products of armillaria mellea[J].Molecules, 2015, 20(4):5 680-5 697.
[11] 沈明花, 崔海丹, 王欣彤.榛蘑多糖的抗氧化作用研究[J].食品科技, 2010, 35(5):77-79.
SHEN M H, CHUI H D, WANG X T.Study on the antioxidant activity of Armillariella mellea polysaccharide[J].Food Science and Technology, 2010, 35(5):77-79.
[12] 王国全, 李莎, 余林中, 等.基于JAK2/STAT3和IKKα/NF-κB信号通路探讨清瘟败毒饮对脓毒症急性肺损伤大鼠的保护作用及机制研究[J].中药药理与临床, 2018, 34(3):2-5.
WANG G Q, LI S, YU L Z, et al.Explore the mechanism of prevention of Qingwen Baidu Yin via JAK2/STAT3 and IKKα/NF-κB signal transduction pathway in sepsis rat[J].Pharmacology and Clinics of Chinese Materia Medica, 2018, 34(3):2-5.
[13] GROMMES JOCHEN, SOEHNLEIN OLIVER.Contribution of neutrophils to acute lung injury[J].Mol Med, 2011, 17(3-4):293-307.
[14] STEINER A A, CHAKRAVARTY S, RUDAYA A Y, et al.Bacterial lipopolysaccharide fever is initiated via toll-like receptor 4 on hematopoietic cells[J].Blood, 2006, 107(10):4 000-4 002.
[15] SHI H T, DONG L, JIANG J, et al.Chlorogenic acid reduces liver inflammation and fibrosis through inhibition of toll-like receptor 4 signaling pathway[J].Toxicology, 2013, 303:107-114.
[16] 符榕. 地塞米松对抗大鼠急性肺损伤的作用及其机制[J].山东医药, 2016, 56(26):31-35.
FU R.Effects and mechanism of dexamethasone against acute lung injury in rats[J].Shandong Medical Journal, 2016, 56(26):31-35.
[17] MEDURI GU, HEADLEY S, KOHLER G, et al.Persistent elevation of inflammatory cytokines predicts a poor outcome in ards.plasma il-1 beta and il-6 levels are consistent and efficient predictors of outcome over time[J].Chest, 1995, 107(4):1 062-1 073.
[18] MEDURI G U, KOHLER G, HEADLEY S, et al.Inflammatory cytokines in the bal of patients with ards.persistent elevation over time predicts poor outcome[J].Chest, 1995, 108(5):1 303-1 314.
[19] WANG J, MA C H, WANG S M.Effects of acteoside on lipopolysaccharide-induced inflammation in acute lung injury via regulation of nf-κb pathway in vivo and in vitro[J].Toxicol Appl Pharmacol, 2015, 285(2):128-135.
[20] IBA T, NAKARAI E, TAKAYAMA T, et al.Combination effect of antithrombin and recombinant human soluble thrombomodulin in a lipopolysaccharide induced rat sepsis model[J].Crit Care, 2009, 13(6):203.
[21] COMELLAS A P, BRIVA A.Role of endothelin-1 in acute lung injury[J].Transl Res, 2009, 153(6):263-271.
[22] JIA Z Q, NALLASAMY P, LIU D M, et al.Luteolin protects against vascular inflammation in mice and tnf-alpha-induced monocyte adhesion to endothelial cells via suppressing iκbα/nf-κb signaling pathway[J].J Nutr Biochem, 2015, 26(3):293-302.
[23] 吴洁. TOLL样受体4/核转录因子-κB信号通路在脂多糖诱导奶牛乳腺炎症反应中的作用[D].南京:南京农业大学, 2016.
WU J.Roles of TLR4/NF-κB signaling pathway against inflammatory responses induced mastitis by lipopolysaccharide[D].Nanjing:Nanjing Agricultural University, 2016.
[24] HE Z Y,ZHU Y S,JIANG H.Toll-like receptor 4 mediates lipopolysaccharide-induced collagen secretion by phosphoinositide3-kinase-akt pathway in fibroblasts during acute lung injury[J].Journal of Receptors and Signal Transduction, 2009, 29(2):119-125.