麻竹笋(Dendrocalamus latiflorus)是禾本科竹亚科植物的新生芽,富含膳食纤维、氨基酸,蛋白质以及竹多糖、抗坏血酸和多酚等功能性物质,具有抗氧化、清除血清胆固醇及预防心血管疾病等生理活性功能[1]。鲜笋的采收季节性及贮藏过程中易失水和木质化等特点限制了麻竹笋加工产业的发展,而采后加工有利于解决这一产业瓶颈。腌制麻竹笋加工易,成本低,易于保存,是常用的竹笋加工方法之一[2]。腌制过程伴随着由微生物主导的系列生物化学反应,最终形成独特的风味和较高的营养价值。因此,了解麻竹笋腌制过程中的微生态结构及动态变化对于其风味特征的形成机制研究具有重要作用。
早期微生物多样性研究主要采用传统的分离培养技术,然而绝大多数微生物无法被分离,受到较大限制[3];而后出现的DNA指纹图谱、BIOLOG、基因芯片等技术能够直接对环境中的微生物群落进行分析,但仅能靶标优势类群,无法真实反映微生物的区系变化规律[4]。高通量测序技术采用边合成边测序的方法,能同时对几百万条DNA分子进行测序,不仅耗时短、效率高,还具有较高的安全性和准确性,极大地推进了微生物组学研究[5]。目前高通量测序技术已在腌制发酵蔬菜的微生物多样性研究中得到广泛应用。YU等[6]采用高通量测序技术从四川省6个地区采集的泡菜中分离出185株乳酸菌,准确鉴定出81株植物乳杆菌、38株戊糖乳杆菌和24株短乳杆菌;TANG等[7]应用高通量测序方法比较了重庆和四川两地区腌制萝卜中的优势菌群差异;LIU等[8]利用高通量测序技术对10种发酵蔬菜的细菌群落多样性进行了研究,证明了产地、原料种类以及发酵环境对细菌多样性具有较大影响。
加盐腌制是发酵蔬菜的必要环节,而食盐浓度对腌制麻竹笋中总酸、水分、亚硝酸盐、VC、总黄酮、Ca2+、Mg2+、果胶含量以及细菌菌落总数等均有较大影响,因此对腌制麻竹笋的品质、风味的形成以及微生物群落的组成具有至关重要的作用[9-10]。本课题组前期采用聚合酶链式反应-变形梯度凝胶电泳(polymerase chain reaction denatured gradient gel electrophoresis,PCR-DGGE)技术分析了不同盐浓度腌制麻竹笋中的主要优势菌群[11-12],但目前还未见系统对比不同盐浓度下麻竹笋中菌群动态变化规律的报道。因此,本研究拟采用高通量测序技术探究不同盐浓度腌制条件下麻竹笋中菌落的动态演替,进一步揭示盐浓度对微生物多样性的影响,从而为探寻微生物群落与腌制麻竹笋的品质间的关系奠定理论基础。
1 材料与方法
1.1 材料与试剂
麻竹笋,购于重庆市北碚区农贸市场;琼脂糖凝胶,西班牙biowest公司;聚合酶Fast Pfu Polymerase,北京TransGen公司;DNA纯化试剂盒、AxyPrep DNA凝胶提取试剂盒,美国Axygen公司;土壤基因组提取试剂盒,Omega公司。
1.2 仪器与设备
YX280A手提式不锈钢灭菌锅,上海三申医疗器械有限公司;Eppendorf 5430R小型离心机、Eppendorf 5424R台式高速冷冻离心机,德国Eppendorf有限公司;DYY-6C电泳仪,北京市六一仪器厂;BioTek ELx800酶标仪,美国Biotek公司;TBS380微型荧光计,美国TurnerBioSystems公司;Covaris M220超声波破碎仪,基因有限公司;QL-901涡旋混合器,海门其林贝尔仪器制造有限公司;SW-CJ-1F单人双面净化工作台,苏净净化设备有限公司;S1000 Thermal CyclerPCR 扩增仪,美国Biorad 公司;NanoDrop2000超微量分光光度计,美国Thermo Fisher Scientific 有限公司。
1.3 样品制备
将新鲜竹笋剥壳,切成片状。然后沸水漂烫10 min、沥干后将2 kg竹笋装入泡菜坛,分别向坛中添加5 g/100mL和15 g/100mL的食盐水,料水比为1∶1(g∶mL),将坛子密封后在室温(20~25 ℃)下进行自然发酵。分别在1、3、5、7、10、14、21、28、35、42 d收集发酵液样品(5 g/100mL盐质量浓度组编号为A1、A3、A5、A7、A10、A14、A21、A28、A35、A42;15 g/100mL 盐质量浓度组编号为B1、B3、B5、B7、B10、B14、B21、B28、B35、B42),并将样品在 DNA提取之前储存在-80 ℃至最后一次取样完成后统一进行DNA提取。
1.4 宏基因组DNA提取及PCR扩增
根据Omega土壤基因组提取试剂盒说明书进行总DNA抽提,对DNA浓度和纯度进行检测后,利用1%(质量分数)琼脂糖凝胶电泳检测DNA提取质量。以338F-806R作为引物对细菌16S rRNA V3~V4区序列进行扩增,用2%的琼脂糖凝胶回收PCR产物,利用DNA纯化试剂盒进行纯化,用Tris-HCl洗脱,2%琼脂糖电泳检测。使用微型荧光计对PCR进行检测定量。将处理好的PCR扩增产物送到上海美吉生物医药科技有限公司采用Illumina Miseq进行测序。
1.5 数据与图谱分析
高通量测序数据用美吉云计算平台进行分析。使用UPARSE软件,根据97%的相似度对序列进行操作分类单元(operational taxonomic units,OTUs)聚类,并在聚类的过程中去除单序列和嵌合体。利用RDP(Ribosmal Database Project) classifier对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%。使用RDP细菌16S rRNA数据库注释OTUs序列。
2 结果与分析
2.1 腌制麻竹笋细菌OTU分布
OTU与物种呈现对应关系,可通过分析OTU分布情况了解样本中微生物的多样性与存在量[13]。基于 16S rRNA 基因测序所获得的细菌群落OTU维恩图如图1所示,共得到2 417个OTU。不同盐浓度样本中OTU分布具有较大差异。部分OTU是两种盐浓度样本所共有的(575例,23.79%),高盐质量浓度(15 g/100mL)样本独有的OTU数目为286例(11.83%),总共持有的OTU数目为861例,而低盐质量浓度(5 g/100mL)样本中则有1 556例(64.38%)特异性检测,总共持有2 131例OTU,均显著高于低盐浓度样本。
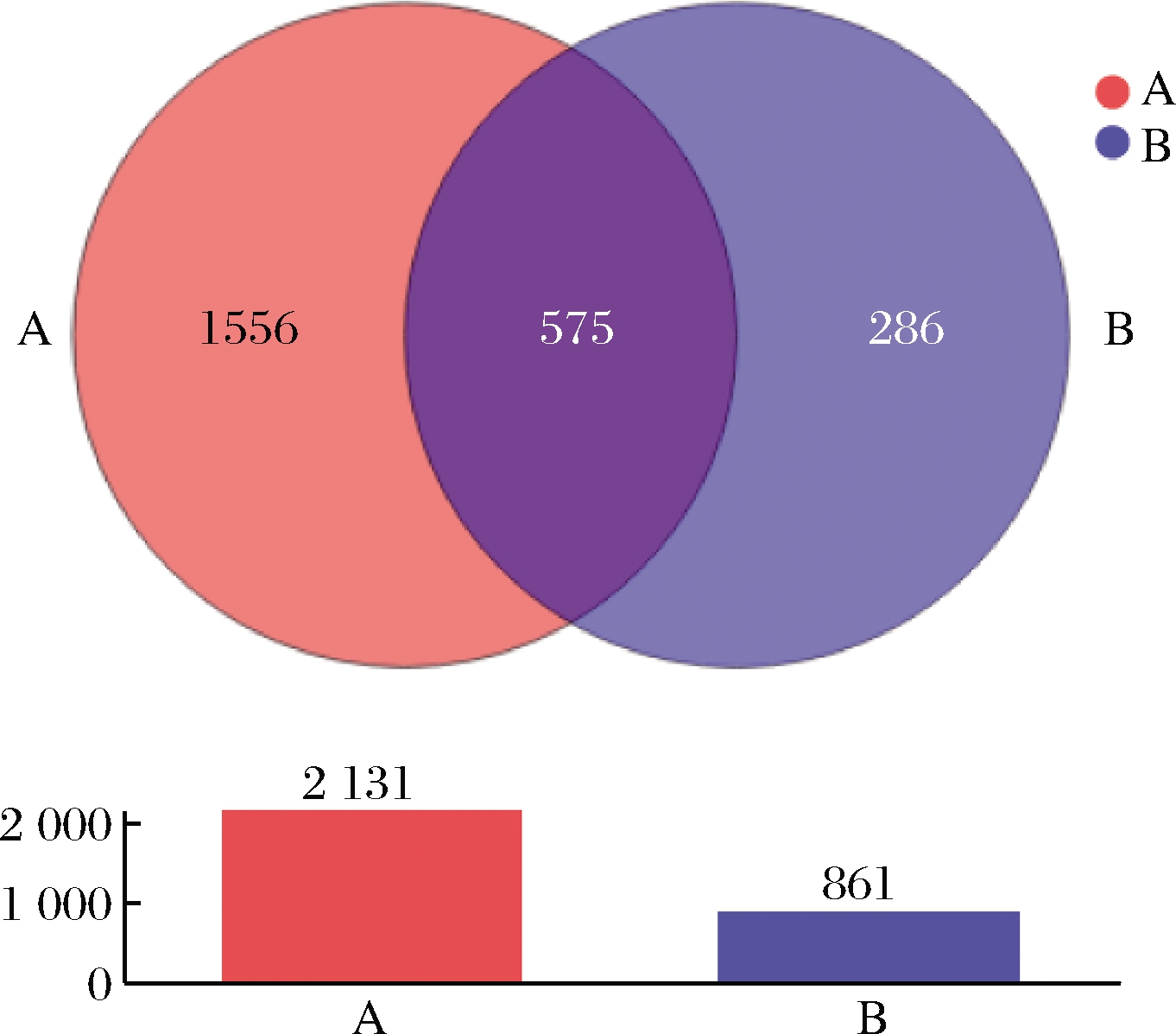
A-5 g/100mL盐质量浓度;B-15 g/100mL盐质量浓度(下同)
图1 不同盐浓度腌制麻竹笋细菌群落的OTU维恩图
Fig.1 OTU Venn diagram of the bacterial in pickled Ma bamboo shoots with different salt concentration
2.2 腌制麻竹笋细菌α多样性
Chao指数反映群落丰富度,Shannon指数反映群落多样性[14]。由图2-a可知,发酵前28 d不同盐浓度样本Chao指数变化趋势均不明显,集中在250左右,并且均在发酵第10天达到最低值,第35天达到最高值。具体来看,5 g/100mL盐质量浓度腌制麻竹笋在第35天Chao指数急速上升至1 372.89,发酵42 d时略有下降(1 252.29);15 g/100mL盐质量浓度样本在第35天达到582.46,后又降低至较低水平(171.78)。说明发酵前、中期(28 d及以前)盐浓度对腌制麻竹笋细菌群落丰富度(OTU数目)影响较小,而高盐浓度抑制了腌制后期(28~35 d)群落丰富度的增长,使得成品竹笋(42 d)群落丰富度较低。群落多样性是群落丰富度及群落均匀度的综合指标[5]。图2-b显示,低盐浓度样本细菌群落多样性波动范围更大,尤其是发酵第7、21、28天,在群落丰富度差异不大的情况下,5 g/100mL盐质量浓度的Shannon指数显著高于15 g/100mL盐质量浓度,说明低盐浓度使得样本中细菌群落均匀度更高。15 g/100mL盐质量浓度Shannon指数维持在较为稳定的水平,说明高盐浓度减缓了麻竹笋腌制过程中细菌群落的演替。
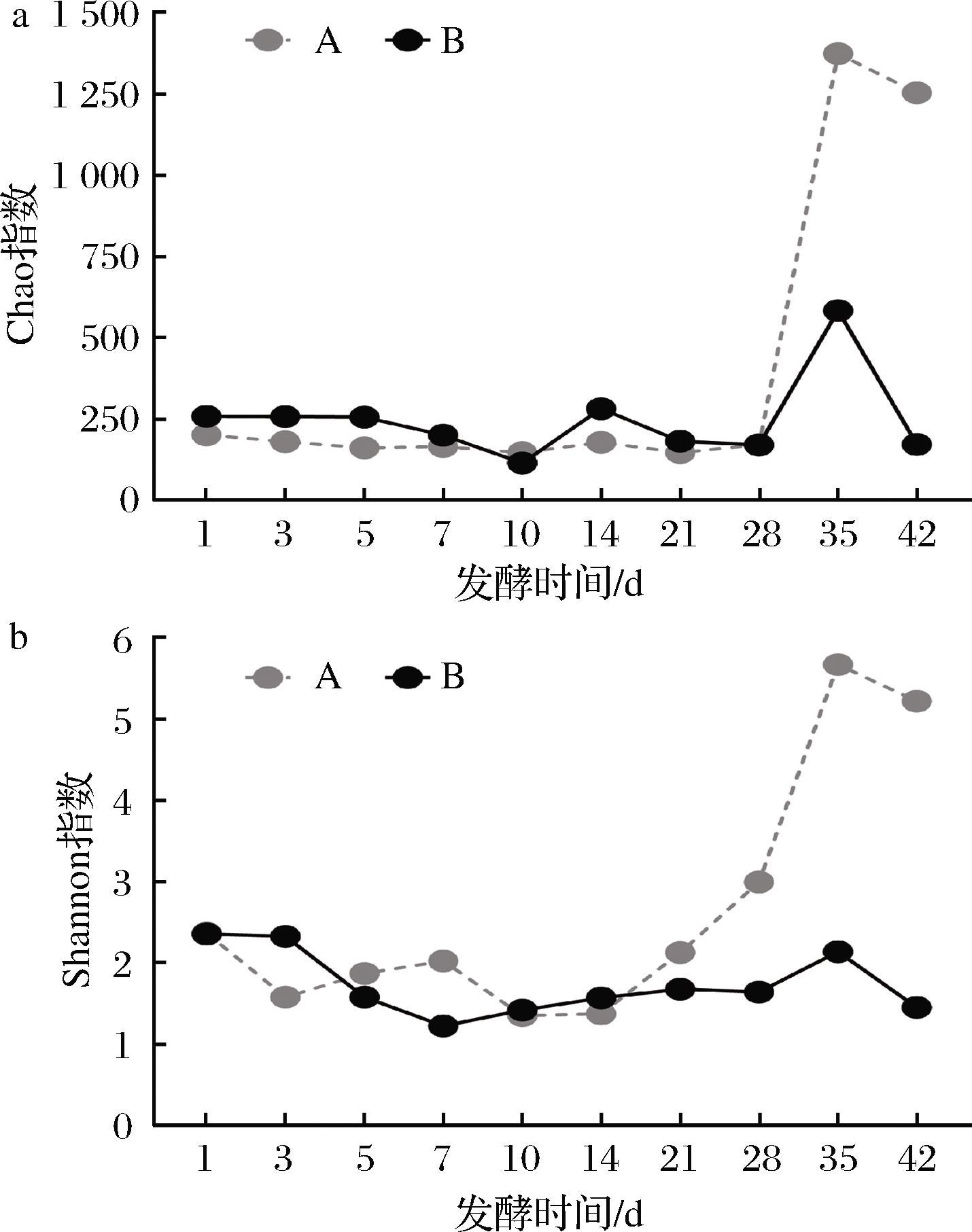
a-Chao指数;b-Shannon指数
图2 不同盐浓度腌制麻竹笋细菌群落α多样性分析
Fig.2 α diversity analysis of the bacterial in pickled Ma bamboo shoots with different salt concentration
2.3 腌制麻竹笋细菌群落结构分析
细菌在门水平上的高通量相对丰度分布如图3-a所示。经分类学注释发现,厚壁菌门(Firmicutes)、变形菌门 (Proteobacteria) 和蓝藻细菌门(Cyanobacteria)在2种盐浓度腌制麻竹笋中均是优势菌门(平均相对丰度>1%),并且同一菌门在两类样本中平均相对丰度较为接近,但分布上有较大差异:低盐浓度下Firmicutes在腌制第3天就占据了98.03%的绝对优势地位,却在腌制第35天降低到22.20%;而高盐浓度下Firmicutes在腌制第7天才达到94.46%,但此后相对丰度一直维持在90%左右;Proteobacteria相对丰度较高的时期分别集中在低盐浓度腌制中、后期(21~42 d)和高盐浓度腌制前期(1~5 d);Cyanobacteria在低盐浓度腌制第1天相对丰度达到54.19%,随着腌制发酵的进行(3~14 d)相对丰度陡然降低至1%以下,在第35天重新提升至14.80%,高盐浓度下Cyanobacteria呈现先降低后趋于稳定的趋势,在整个发酵过程中相对丰度均>1%。拟杆菌门(Bacteroidetes)从第28天迅速上升,在成品竹笋中达到20.05%,成为低盐度样本中的优势菌属。2个盐度样本在腌制35 d时群落结构最丰富,检测到的9种主要菌门均同时出现,但明显除Firmicutes外,其余菌门在低盐样本中的相对丰度均高于高盐样本。
从属水平来看(图3-b),细菌在2种盐浓度样本中的群落结构分布有较大差异。乳酸杆菌属(Lactobacillus)在低盐及高盐样本中的平均相对丰度分别为35.39%及54.48%,是绝对优势菌属,在低盐腌制中呈现逐步增加后迅速降低趋势,在高盐度下呈现迅速增加,并在腌制5~42 d维持在65%左右的水平。5 g/100mL盐质量浓度样本中,乳球菌属(Lactococcus)及魏斯氏菌属(Weissella)的平均相对丰度分别为15.62%和6.79%,属于优势菌属,但两者均随发酵进行相对丰度逐渐降低,而在高盐样本中两者的平均相对丰度还不到0.1%;蓝藻细菌属(Cyanobacteria_norank)、盐单胞菌属(Halomonas)和气球菌属(Aerococcus)的平均相对丰度分别为6.82%、3.86%和2.02%,它们仅集中出现在腌制的某一个时期(分别为第1、21、28天),演替较快。反观15 g/100mL盐质量浓度样本,各主要菌属的更迭速度平缓,其中包括海细菌属(Marinobacterium),平均相对丰度为7.14%,活跃在腌制前5 d,此后降低至较低水平;Cyanobacteria_norank(10.95%),发酵前3 d相对丰度>30%,并且在整个发酵过程中相对丰度都>1%;Aerococcus(17.62%)从发酵第5天开始相对丰度迅速增加,此后在整个腌制过程中均占据主导地位。腌制第35天2个盐浓度样本菌落多样性迅速增加,预示着发酵进入尾声,其中低盐浓度样本的多样性显著高于高盐浓度样本,并且在前期占主导作用的Lactobacillus、Halomonas、Aerococcus等菌属的优势地位被多种新增的相对丰度较小的菌属取代,菌属分布更加均衡,而高盐浓度样本中发挥主导作用的优势菌属并未发生较大变化,与α多样性结果一致。

a-门水平;b-属水平
图3 不同盐浓度腌制麻竹笋中细菌在门水平 和属水平的高通量相对丰度
Fig.3 High flux relative abundance of the bacterial at phylum level (a) and genus level (b) in pickled Ma bamboo shoots with different salt concentration
注:others为平均相对<1%的门或属
2.4 腌制麻竹笋细菌聚类分析及主成分分析
采用非加权组平均法(unweighted pair group method with arithmetic mean,UPGMA)构建树状结构进行层聚类分析,树枝的长短可直观呈现不同盐浓度下麻竹笋腌制过程中群落组成的相似或差异程度。如图4-a所示,15 g/100mL盐质量浓度样本细菌群落结构的遗传距离较短,而5 g/100mL盐质量浓度下细菌群落结构遗传距离较大,尤其是腌制后期与其他时期间存在较大差距,说明高盐浓度下细菌群落结构演替较为缓慢,相邻阶段细菌群落组成的相似度较高,而低盐浓度下细菌演替激烈,尤其是腌制后期(28~42 d)细菌群落组成发生较大变化。由细菌群落结构主成分分析图(图4-b)可知,PC1轴(53.07%)能够很好地区分15 g/100mL盐质量浓度样本腌制过程中的细菌群落,而5 g/100mL盐质量浓度下的细菌群落结构则更易被PC2轴(18.34%)所区分。2种盐浓度样本点整体距离较远,其中5 g/100mL盐质量浓度样本点集中在一、四象限,15 g/100mL盐浓度样本点集中在二、三象限,说明2种盐浓度腌制条件下细菌群落结构组成差异较大。腌制前期样本点A1、B1和B3分布较为集中,与其他样本点隔离开来,结合群落结构分析结果来看,低盐浓度下细菌区系在腌制第3天发生较大变化,而高盐浓度下细菌区系在第5天产生较大改变,2种盐浓度下发酵第1天的菌群构成相似,均以Cyanobacteria_norank、Marinobacterium、希瓦氏菌属(Shewanella)为优势菌属。另一个聚集点出现在腌制第21天,其主要原因是Aerococcus菌属在A21突然涌现,导致A21与B21中细菌群落结构相似。
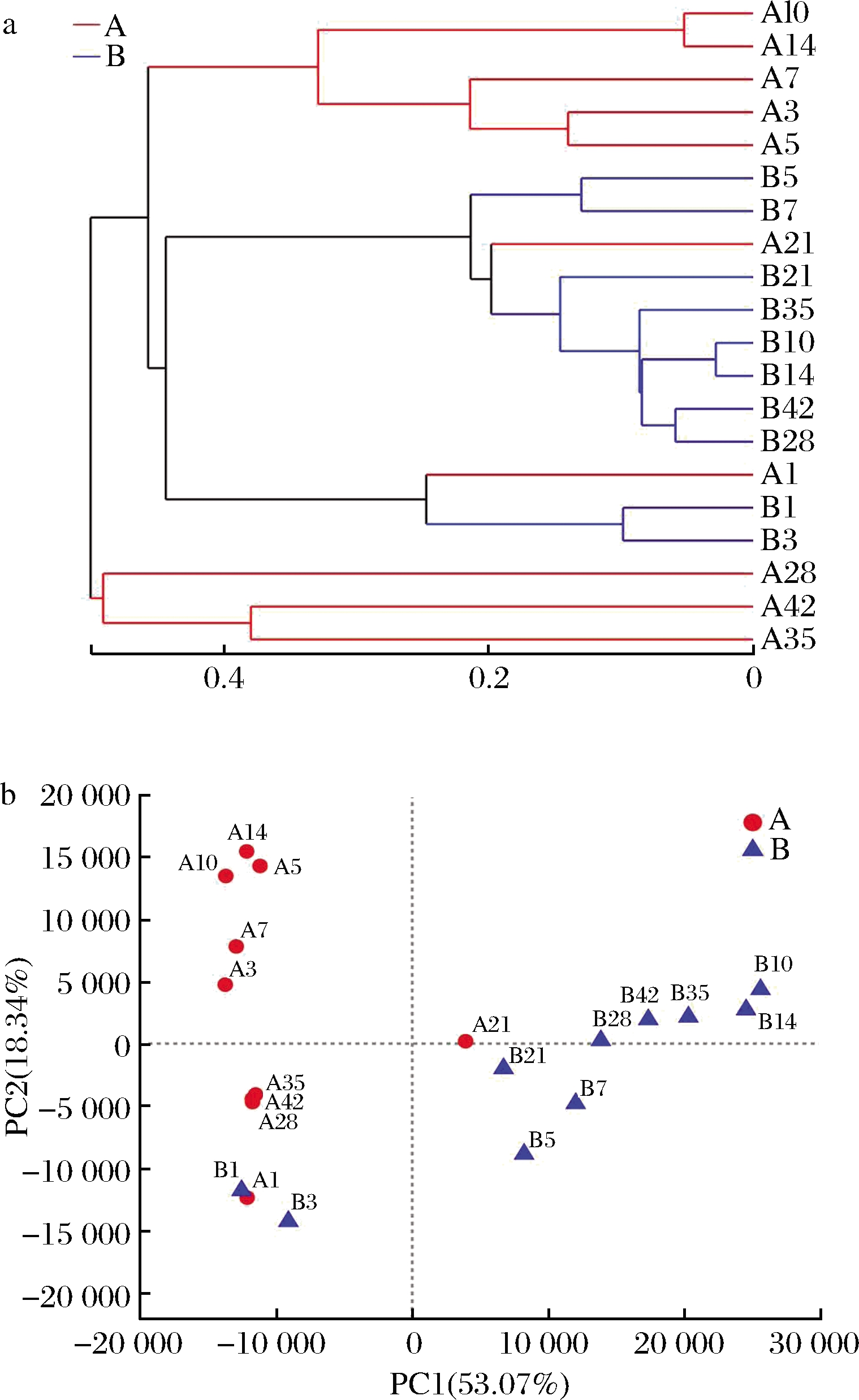
a-聚类分析;b-主成分分析
图4 不同盐浓度腌制麻竹笋中细菌微生物区系 UPGMA聚类分析和主成分分析
Fig.4 UPGMA cluster analysis and principal component analysis of the bacterial in pickled Ma bamboo shoots with different salt concentration
2.5 腌制麻竹笋细菌进化分析
在属分类水平上相对丰度前25位的微生物发育进化树如图5所示。其中乳酸杆菌属(Lactobacillus)的发育进化最简单,在系统发育进化树中独占一支,是腌制麻竹笋发酵过程中的核心菌群。气球菌属(Aerococcus) 与未鉴别的乳杆菌目(unclassified_Lactobacillales)遗传距离较近,拟杆菌门(Bacteroidales_S24-7_group)与拟杆菌属(Bacteroides)遗传距离较近,属于同一支,但两者发育程度差异较大。未鉴别的消化链球菌科(unclassified_Peptostreptococcaceae)与土孢杆菌属(Terrisporobacter)遗传距离较近,乳球菌属(Lactococcus)和肠球菌属(Enterococcus)遗传距离较近。隶属于变形菌门 (Proteobacteria)的几个菌属亲缘关系也较近。右侧柱状图显示,隶属于厚壁菌门(Firmicutes)的Lactobacillus、Aerococcus、Lactococcus和魏斯氏菌属(Weissella)均具有较高占比,其次是隶属于蓝细菌门(Cyanobacteria)的Cyanobacteria_norank,而隶属于变形菌门 (Proteobacteria)的海细菌属(Marinobacterium)和假单胞菌属(Pseudomonas)等菌属占比虽较低,但种类丰富,因此厚壁菌门、蓝细菌门和变形菌门是腌制麻竹笋的核心菌门。其中, Lactococcus、Weissella、盐单胞菌属(Halomonas)、unclassified_Peptostreptococcaceae在低盐浓度样本中占比显著高于高盐浓度样本,而Lactobacillus、Aerococcus、Cyanobacteria_norank和Marinobacterium则在高盐浓度样本中占比更大,正是这些菌属导致了不同盐浓度样本中细菌群落结构的差异。
3 讨论
腌制麻竹笋在不同的发酵环境及生产工艺下,微生物的群落结构及演替各异。过去研究人员采用生理学试验、高通量测序和多重PCR等方法对各类腌制发酵蔬菜中的微生物群落进行研究,普遍发现细菌,尤其是乳酸菌(lactic acid bacteria,LAB)是参与发酵过程的主要菌种[6, 8, 15]。因此,本研究将焦点放在探索腌制发酵麻竹笋中细菌群落动态演替及其与发酵液中盐浓度的内在联系上。发酵第1天2种盐浓度样本中LAB的含量均较低,此后其相对丰度激增,成为群落中的优势生物。这可能意味着只有微量的LAB才是启动发酵所必需的,也代表2种盐浓度下麻竹笋均腌制发酵成功[16]。在5 g/100mL盐质量浓度样本中检测到的LAB包括乳酸杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、魏斯氏菌属(Weissella)和微量的明串珠菌属(Leuconostoc),而在15 g/100mL盐质量浓度样本中仅有Lactobacillus一种LAB的平均相对丰度>1%并发挥主导作用,侧面反映出Lactococcus、Weissella以及Leuconostoc对高渗透压环境耐受力较差。Lactobacillus是传统发酵蔬菜中的典型微生物群落[16],但本课题组前期采用PCR-DGGE技术对6 g/100mL盐质量浓度下腌制麻竹笋研究中仅检测到优势菌属Lactococcus和Weissella[12],说明Illumina平台测序作为一种灵敏度更高的宏基因组学研究手段,能有效检测到更多细菌种属,得到更为准确的细菌多样性研究结果。
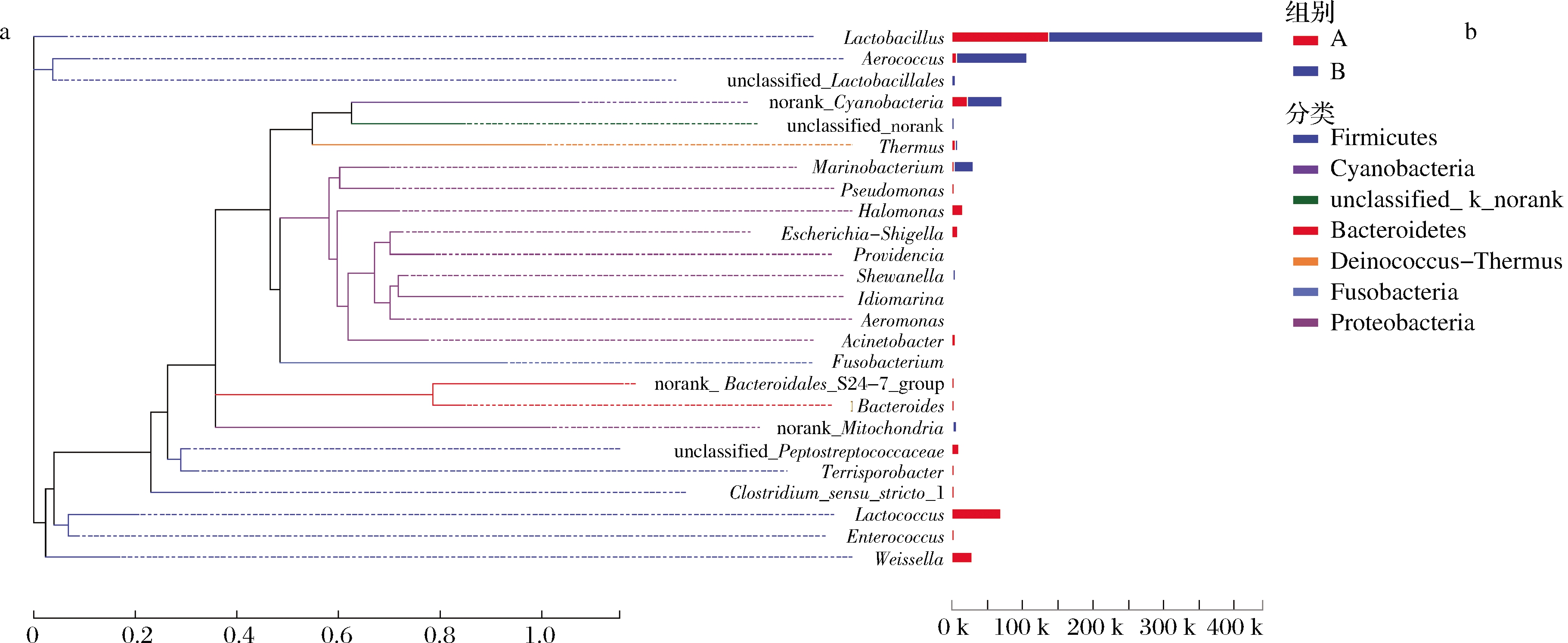
a-系统发育进化树(树枝的颜色对应菌属所属的菌门);b-菌属在2种盐浓度样本中的Reads占比
图5 不同盐浓度腌制麻竹笋中细菌属水平系统发育进化树
Fig.5 Phylogenetic tree of the bacterial in pickled Ma bamboo shoots with different salt concentration at genus level
5 g/100mL盐质量浓度样本发酵中期(3~14 d)LAB占据绝对优势地位,此阶段也是整个发酵过程中杂菌最少的阶段,可能是因为LAB消耗发酵环境中的营养基质抢占其他菌属的生存空间,并且LAB适应环境后代谢产酸降低发酵环境pH值,还能产生细菌素进一步抑制杂菌滋生[17-18]。然而愈加酸化的环境反过来抑制了Lactococcus和Weissella的生长,使得这2种LAB走向衰亡[19]。此后杂菌数量迅速增加,在腌制第28天时,盐单胞菌属(Halomonas)替代了Lactobacillus的绝对优势地位,腌制第35天细菌群落多样性激增,尤其是拟杆菌门(Bacteroidetes)、螺旋体(Spirochaetae)、梭杆菌门(Fusobacteria)及一些相对丰度<1%的杂菌。值得一提的是,15 g/100mL盐质量浓度下仅在发酵第35天时细菌群落多样性有短暂的增加,后又恢复到稳定水平,说明高盐质量浓度能够有效抑制杂菌生长,提高腌制麻竹笋的食用安全性。蓝藻细菌属(Cyanobacteria_norank)和海细菌属(Marinobacterium)在2种盐浓度样本的发酵初期均属于优势菌属,可能对构建发酵环境中的微生物菌群结构具有重要作用。Cyanobacteria_norank在15 g/100mL盐质量浓度样本发酵过程中贯穿始终,与Lactobacillus及气球菌属(Aerococcus)一起组成了高盐腌制条件下麻竹笋发酵达到稳态时的主要菌属。李恒等[20]发现,Cyanobacteria_norank和Lactobacillus也是达到稳态的泡菜母水中的主要细菌属。Aerococcus为兼性厌氧的革兰氏阳性球菌,模式种为绿色气球菌(A.viaid-ans),有研究[21]显示其能在NaCl质量浓度不低于100 g/L的环境中存活,但显然15 g/100mL盐质量浓度条件也不能阻碍其生长。本课题组前期在盐质量浓度为19 g/100mL的腌制麻竹笋中也检测到了绿色气球菌[11]。由此可见,低盐浓度样本发酵过程以LAB为优势菌群,发酵后期LAB消亡,单纯依靠发酵前期LAB产生的有机酸难以抵抗杂菌滋生;而高盐浓度样本则以耐盐或是抗逆性较强的菌属为主要菌属,发酵过程中菌群多样性较低盐浓度样本小,但菌群结构稳定,显著抑制了杂菌滋生。
腌制发酵蔬菜的品质与风味特性很大程度上取决于驻留的微生物群落和发酵条件[8]。LAB对腌制发酵成功与否具有决定性作用,它们产生有机酸、细菌素、维生素和香气化合物,这些物质能够有效影响发酵食品的保质期、营养成分和感官特性[16]。其中,Leuconosto和Weissella通过异乳酸发酵途径启动发酵,产生有机酸、乙醇、乙醛、甘露醇等风味物质,创造有利于其他乳酸菌生长的环境的同时还能保持蔬菜颜色[22-23]。蔬菜发酵后酯类、醇类和醛类等挥发性风味物质含量的增加则与Lactobacillus等微生物的变化密切相关[24]。此外,隶属于变形菌门(Proteobacteria)的假单胞菌属(Pseudomonas)丰度的增加也可能是导致腌制竹笋中风味化合物产生的原因[25]。然而除Lactobacillus外,其余LAB在15 g/100mL盐质量浓度样本中相对丰度均较低,并且Pseudomonas仅在5 g/100mL盐质量浓度样本发酵28~35 d有明显的增殖,间接说明低盐浓度样本风味品质可能优于高盐浓度样本。
4 结论
本研究采用高通量测序对5 g/100mL和15 g/100mL 2种盐质量浓度腌制条件下麻竹笋发酵过程中的细菌群落结构进行研究。发酵前28 d 2种盐浓度样本中细菌群落丰富度差异较小,5 g/100mL盐质量浓度样本中以乳酸杆菌属、乳球菌属和魏斯氏菌属为优势菌属,而15 g/100mL盐质量浓度样本则以蓝藻细菌属、气球菌属和乳酸杆菌属为主要菌属。发酵进入第35天后,5 g/100mL盐质量浓度样本中细菌群落丰富度及多样性均显著增加,群落结构发生较大改变,而15 g/100mL盐质量浓度样本菌群丰富度小幅增加后迅速恢复至稳定水平,群落结构未发生较大改变。本实验仅对不同盐浓度腌制条件下麻竹笋发酵过程中细菌群落的动态演替进行了鉴定,进一步的研究可利用荧光定量-PCR技术对不同发酵期微生物进行定量检测,与腌制麻竹笋的挥发性风味物质进行关联分析,以期为麻竹笋腌制过程中风味形成机理研究及质量控制提供参考依据。
[1] 杨曼倩. 麻竹笋冰温保鲜技术研究[D].重庆:西南大学,2017.
YANG M Q.Study on controlled freezing-point storage technology of bamboo shoots[D].Chongqing:Southwest University, 2017.
[2] 姚荷, 谭兴和.竹笋加工方法研究进展[J].中国酿造,2017,36(11):24-27.
YAO H, TAN X H.Research progress of bamboo shoots processing methods[J].China Brewing, 2017,36(11):24-27.
[3] WU H C, ZHANG S Y, MA Y Y, et al.Comparison of microbial communities in the fermentation starter used to brew Xiaoqu liquor[J].Journal of the Institute of Brewing, 2017, 123(1):113-120.
[4] 刘国华, 叶正芳, 吴为中.土壤微生物群落多样性解析法:从培养到非培养[J].生态学报,2012,32(14):4 421-4 433.
LIU G H, YE Z F, WU W Z.Culture-dependent and culture-independent approaches to studying soil microbial diversity[J].Acta Ecologica Sinica, 2012,32(14):4 421-4 433.
[5] PETROSINO J F, HIGHLANDER S, LUNA R A, et al.Metagenomic pyrosequencing and microbial identification[J].Clinical Chemistry, 2009, 55(5):856-866.
[6] YU J, GAO W, QING M J, et al.Identification and characterization of lactic acid bacteria isolated from traditional pickles in Sichuan, China[J].Journal of General and Applied Microbiology, 2012,58(3):163-172.
[7] TANG Y Y, ZHOU X R, HUANG S L, et al.Microbial community analysis of different qualities of pickled radishes by Illumina MiSeq sequencing[J].Journal of Food Safety, 2019, 39(2).DOI:10.1111/jfs.12596.
[8] LIU D Q, TONG C.Bacterial community diversity of traditional fermented vegetables in China[J].LWT-Food Science and Technology, 2017, 86:40-48.
[9] 汪莉莎, 陈光静, 郑炯, 等.大叶麻竹笋腌制过程中品质变化规律[J].食品与发酵工业,2013,39(10):73-77.
WANG L S, CHEN G J, ZHENG J, et al.Study on the change in quality of bamboo shoots during pickling[J].Food and Fermentation Industries, 2013,39(10):73-77.
[10] 陈光静, 汪莉莎, 郑炯, 等.食盐质量浓度对大叶麻竹笋腌制过程中品质特性的影响[J].食品科学,2013,34(15):48-52.
CHEN G J, WANG L S, ZHENG J, et al.Effect of salt concentration on quality of bamboo shoots during pickling[J].Food Science, 2013,34(15):48-52.
[11] 郑炯, 夏雪娟, 叶秀娟, 等.PCR-DGGE技术分析腌制麻竹笋中微生物多样性[J].食品科学,2014,35(21):170-174.
ZHENG J, XIA X J, YE X J, et al.Diversity of microbial flora from pickled ma bamboo shoots analyzed by PCR-DGGE[J].Food Science, 2014,35(21):170-174.
[12] 夏雪娟, 李冠楠, 叶秀娟, 等.麻竹笋腌制过程中细菌群落动态变化分析[J].中国食品学报,2015,15(11):206-211.
XIA X J, LI G N, YE X J, et al.Dynamic changes of bacteria community diversity during the fermentation of pickled ma bamboo shoots[J].Journal of Chinese Institute of Food Science and Technology, 2015,15(11):206-211.
[13] 张承铭. 辽河保护区典型湿地净化特性及微生物群落结构研究[D].西安:长安大学,2017.
ZHANG C M.Study on the purification characteristics and bacterial community structures in constructed wetland of the Liao River Conservation Area[D].Xi′an:Chang′an University, 2017.
[14] 郭俊.上海市饮用水源水库微生物群落变化研究[D].上海:上海师范大学,2020.
GUO J.Changes of microbial community in drinking water source reservoirs in Shanghai[D].Shanghai:Shanghai Normal University, 2020.
[15] JIANG J, SHI B, ZHU D Q, et al.Characterization of a novel bacteriocin produced by Lactobacillus sakei LSJ618 isolated from traditional Chinese fermented radish[J].Food Control, 2012, 23:338-344.
[16] ZABAT M A, SANO W H, WURSTER J I, et al.Microbial community analysis of sauerkraut fermentation reveals a stable and rapidly established community[J].Foods, 2018, 7(5):77.
[17] BJORKROTH K J, SCHILLINGER U, GEISEN R, et al.Taxonomic study of Weissella confusa and description of Weissella cibaria sp.nov., detected in food and clinical samples[J].International Journal of Systematic and Evolutionary Microbiology, 2002, 52(1):141-148.
[18] ASO Y, TAKEDA A, SATO M, et al.Characterization of lactic acid bacteria coexisting with a nisin Z producer in Tsuda-turnip pickles[J].Current Microbiology, 2008, 57(1):89-94.
[19] CROWLEY S, MAHONY J, VAN S D.Current perspectives on antifungal lactic acid bacteria as natural bio-preservatives[J].Trends in Food Science & Technology, 2013, 33(2):93-109.
[20] 李恒, 陈功, 伍亚龙, 等.高通量测序方法研究传统四川泡菜母水中微生物群落的动态变化[J].食品科学,2018,39(24):131-138.
LI H, CHEN G, WU Y L, et al.Analysis of microbial community dynamics of traditional Sichuan paocai brine by high-throughput sequencing[J].Food Science, 2018,39(24):131-138.
[21] HOLT J G.Bergey′s Manual of Determinative Bacteriology(9th) ed[M].Baltimore:Williams and Wilkins, 2004:178-711.
[22] CHENG L L, LUO J F, LI P, et al.Microbial diversity and flavor formation in onion fermentation[J].Food & Function, 2014, 5(9):2 338-2 347.
[23] RHEE S J, LEE J E, LEE C H.Importance of lactic acid bacteria in Asian fermented foods[J].Microbial Cell Factories, 2011, 10(1):S5.
[24] KIM M J, LEE H W, LEE M E, et al.Mixed starter of Lactococcus lactis and Leuconostoc citreum for extending kimchi shelf-life[J].Journal of Microbiology, 2019, 57(6):479-484.
[25] YANG J X, CAO J L, XU H Y, et al.Bacterial diversity and community structure in Chongqing radish paocai brines revealed using PacBio single-molecule real-time sequencing technology[J].Journal of the Science of Food and Agriculture, 2018, 98(9):3 234-3 245.