豆浆是一种广受欢迎的传统纯天然植物饮料,蛋白质含量丰富,脂肪酸和糖类的含量较低[1-2],是在《中国居民膳食指南(2016版)》建议经常食用大豆制品[3]。
利用乳酸菌对豆浆进行发酵产酸,使大豆蛋白发生凝固[4]。发酵后的产品不仅具有豆浆中的营养成分,还增加了肠道益生菌的数量,提高多不饱和脂肪酸以及维生素等物质含量,具有促进肠道蠕动、增强免疫力等功能,使得豆乳更具有营养保健功效[5-7]。发酵豆乳与发酵牛乳相比,除不含胆固醇,主要存在2方面问题:一是大豆酸奶的风味较差,存在豆腥味、饭馊味、苦涩味等一系列不良风味[8-10];二是大豆酸奶的质地呈“豆腐状”的微观结构[11],与酸奶的柔滑糊状质构差距较大[12-13],且存在颗粒状、持水能力差等问题。这些问题除与豆浆的化学组分有关之外,发酵菌株也发挥着至关重要的作用。不同菌株发酵后的豆乳风味、质构及其营养效果具有显著的区别[14]。
本研究依据发酵豆乳的凝乳时间,筛选出1株凝乳时间显著短于已有报道的乳酸菌菌株唾液乳杆菌M18-6。该菌株可以明显改善发酵豆乳的风味和质地,显著提高豆乳体系对DPPH自由基清除能力,在发酵豆乳体系中具有良好的活菌贮藏稳定性,且在胃肠道消化环境下具有良好的耐受活性,为后期开发快速发酵大豆蛋白体系的益生菌菌株提供理论依据。
1 材料与方法
1.1 主要原材料与仪器
1.1.1 菌株
唾液乳杆菌M18-6(CGMCC No. 16199)、副干酪乳杆菌M11-4(CGMCC No. 16200),植物乳杆菌Zhang-LL、干酪乳杆菌KL1、保加利亚乳杆菌B和嗜热链球菌S均保藏于北京农学院微生物实验室。
1.1.2 主要培养基和试剂
(1)MRS液体培养基;MRS固体培养基[15]。
(2)酸性MRS液体培养基:在基础MRS培养基成分上加蒸馏水至900 mL,用1 mol/L盐酸以及1 mol/L氢氧化钠分别调节pH至2.0、2.5、3.0、3.5、6.5后,蒸馏水定容至1 000 mL,分装于试管中,121 ℃高压灭菌15 min。
(3)胆盐MRS液体培养基:在基础MRS培养基成分上分别称取0.5 g、1 g胆盐后加蒸馏水定容至1 000 mL,调节pH至6.5后分装于试管中,121 ℃高压灭菌15 min。
(4)人工胃液:在灭菌的pH 2.5的磷酸缓冲液以过滤除菌的方式加入3 g/L(的胃蛋白酶和5 g/L的NaCl。
(5)人工肠液:在灭菌的pH 6.8的磷酸缓冲液以过滤除菌的方式加入1 g/L的胰蛋白酶。
(6)豆乳培养液:5 g白砂糖加至100 mL现磨豆浆中充分均匀后115 ℃ 灭菌20 min。
1.1.3 主要仪器
DL-CJ-1N超净工作台,北京东连哈尔滨仪器制造有限公司;MLS-3750高压蒸汽灭菌锅,Sanyo Electric公司;PHS-3B便携式酸度计,上海雷磁仪器厂;THZ-C恒温振荡器,江苏太仓市实验设备厂;电热恒温培养箱,黄石市恒丰医疗器械有限公司;Centrifuge 5417R小型高速冷冻离心机,德国Eppendorf公司。
1.2 试验方法
1.2.1 试验菌株的筛选
将甘油保藏的唾液乳杆菌M18-6、副干酪乳杆菌M11-4,植物乳杆菌Zhang-LL、干酪乳杆菌KL1、保加利亚乳杆菌B和嗜热链球菌S接种到MRS液体培养基中(37 ℃),活化3代后,以106 CFU/mL的接种量接种到15 mL的豆乳培养基中,37 ℃恒温培养,完全凝固后,记录不同菌株发酵所需凝乳时间并且测定发酵豆乳的pH、滴定酸度、活菌数,并进行初步的感官评价。
滴定酸度测定:参照GB 5009.239—2016的方法测定。以100 mL样品消耗0.1 mol/L的NaOH体积(mL)为酸度°T[16]。
活菌数的测定:记录37 ℃培养条件下不同菌株发酵豆乳的活菌数。
凝乳时间:从接入不同菌株的发酵豆乳试管放入37 ℃培养箱开始计时到豆乳完全凝固所需时间。
1.2.2 试验菌株发酵体系中DPPH自由基清除率的测定
参考文献[17-18],取发酵后的样品溶液2 mL,再加入1 mL 0.2 mmol/L 的 DPPH·无水乙醇溶液,摇匀,避光反应 30 min,9 000 r/min 离心10 min,取上清液于紫外可见分光光度计在517 nm 处测定吸光度值Ai;以无水乙醇代替DPPH·无水乙醇溶液为空白组Aj,并以2 mL超纯水和1 mL无水乙醇混合液空白调0。
1.2.3 发酵豆乳的感官评价
对后熟12 h发酵豆乳进行感官品鉴。选择10名经过专业培训的感官评价小组成员对由不同菌株发酵的凝固性酸豆乳进行感官评价[19]。
表1 酸豆奶感官评分标准
Table 1 Soy milk Sensory Scoring Standard

项目评分标准分值/分色泽(15分)色泽均匀,呈乳白色或微黄色,有光泽10~15色泽较重且均匀5~10色泽较暗且不均匀0~5滋味(30分)口感细腻圆润,酸度适宜柔和20~30口感较好,质地较细腻,乳酸味稍高或稍低10~20颗粒感较重,过酸或过甜0~10气味(30分)有清香的乳酸味,或者微微的豆香味20~30可辨识的乳酸香味,有一定的豆腥味10~20豆腥味严重,几乎无乳酸清香味0~10组织状态(25分)质地细滑,无乳清析出、黏稠度合适20~25质地较细滑,有少量乳清析出,黏稠度良好10~20质地粗糙有较多乳清析出,有颗粒感0~10
1.2.4 试验菌株贮藏稳定性评价
经37 ℃活化后的菌株以106 CFU/mL的接种量分别接到豆乳培养基中,37 ℃发酵直至到达凝固点后,放置4 ℃后熟12 h,然后每隔24 h测定发酵豆乳的pH、滴定酸度、活菌数,连续测定24 d。
1.2.5 试验菌株耐酸性评价
将活化好的M18-6的3代菌液在4 500 r/min离心10 min,收集菌体沉淀,经PBS缓冲液(pH 7.4)洗涤2次后重悬于等体积的新鲜的pH分别为2.0、2.5、3.0、3.5、6.5的MRS培养基中,37 ℃胁迫4 h。每隔1 h取100 μL菌液,10倍梯度稀释倾注于MRS固体培养基上测定活菌数。
1.2.6 试验菌株耐胆盐评价
将活化好的M18-6的3代菌液在4 500 r/min离心10 min,收集菌体沉淀,经PBS缓冲液(pH 7.4)洗涤2次后重悬于等体积的新鲜的胆盐质量浓度分别为0.05%和0.1%的MRS培养基中,37 ℃胁迫4 h。每隔1 h取100 μL菌液,10倍梯度稀释倾注于MRS固体培养基上测定活菌数。
1.2.7 试验菌株人工模拟胃肠道耐受评价
将活化好的M18-6的3代菌液在4 500 r/min离心10 min,收集菌体沉淀,经PBS缓冲液(pH 7.4)洗涤2次后重悬于含有人工胃肠液的MRS培养基中胁迫4 h,每隔1 h取100 μL菌液,10倍梯度稀释倾注于MRS固体培养基上测定活菌数。
2 结果与分析
2.1 试验菌株发酵性能评价
经活化的唾液乳杆菌M18-6、副干酪乳杆菌M11-4、植物乳杆菌Zhang-LL、干酪乳杆菌KL1、保加利亚乳杆菌乳杆菌B和嗜热链球菌S发酵成的酸豆乳的性能评价。如表2所示:M18-6的凝乳时间为(2.50±0.20) h,活菌数为109 CFU/mL,与其他菌株相比,表现出对豆浆良好的凝乳效果。这为M18-6菌株作为后期快速发酵豆乳的发酵剂提供基本科学参考依据。
表2 试验菌株发酵酸豆乳的发酵性能评价
Table 2 Evaluation of fermentation performance of fermented soymilk in test strains
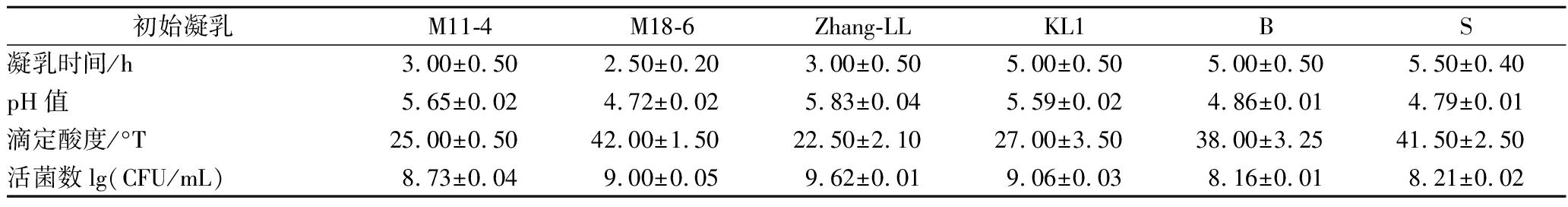
初始凝乳M11-4M18-6Zhang-LLKL1BS凝乳时间/h3.00±0.502.50±0.203.00±0.505.00±0.505.00±0.505.50±0.40pH值5.65±0.024.72±0.025.83±0.045.59±0.024.86±0.014.79±0.01滴定酸度/°T25.00±0.5042.00±1.5022.50±2.1027.00±3.5038.00±3.2541.50±2.50活菌数lg(CFU/mL)8.73±0.049.00±0.059.62±0.019.06±0.038.16±0.018.21±0.02
2.2 试验菌株发酵体系的抗氧化性评价
2.2.1 试验菌株发酵体系的抗氧化性结果
由图1可知,由唾液乳杆菌M18-6发酵豆乳的体系中,对DPPH自由基的清除率显著高于空白对照组以及其他菌株的发酵体系(P<0.05),清除率达到90%以上,具有潜在的强抗氧化性,为后续发酵豆乳的营养功能性研究指明方向。
2.3 发酵豆乳的感官评价结果
为了获得具有良好风味、质构的发酵豆乳,对不同菌株发酵豆乳体系的色泽、滋味、气味以及组织状态等方面进行综合性感官评价,总得分情况如图2所示。

图1 不同菌株发酵体系对DPPH自由基清除率的作用
Fig.1 Effect of fermentation system of different strains
on DPPH free radicals clearance rate
注:*表示不同菌株发酵体系在P<0.05时有显著性差异
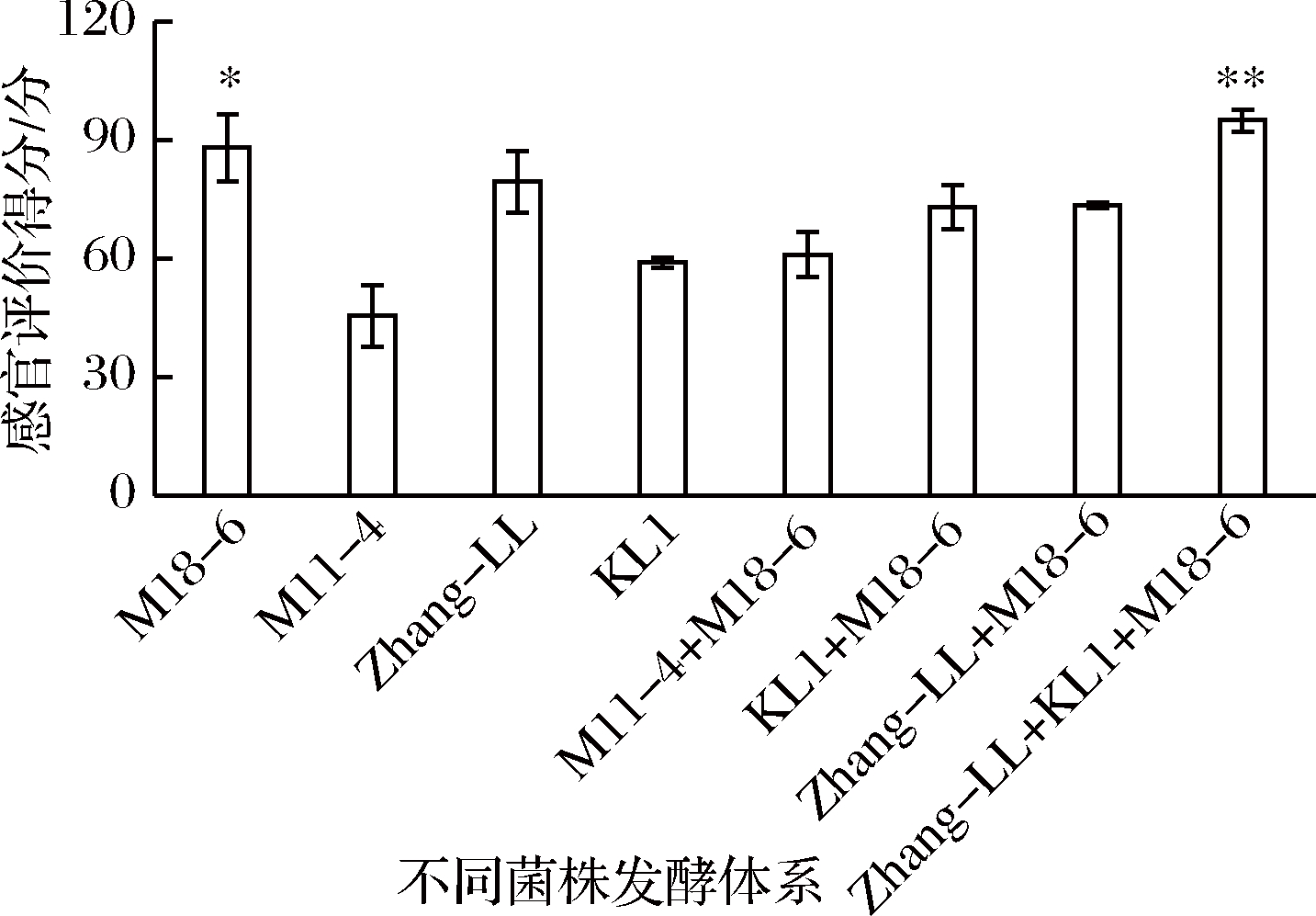
图2 不同菌株发酵豆乳感官评价总分结果
Fig.2 Results of sensory evaluation of different strains
of fermented soymilk
注:*表示单菌株发酵豆乳感官评价结果在P<0.05
时有显著性差异;**表示三菌株复合发酵豆乳感官评价
结果在P<0.01时有极显著性差异
结果显示,M18-6菌株发酵的豆乳总得分显著高于其他单菌株(P<0.05);对于双菌株复合发酵豆乳,3种形式复配评分结果间均没有显著性差异(P>0.05);而Zhang-LL、KL1和M18-6复合3种菌株发酵的豆乳总得分为95分,极显著高于其他菌株发酵体系(P<0.01),具有良好的风味以及质地[20],可能是3种菌株在发酵过程中因协同作用抑制了部分醛酮类物质的产生,为进一步研究菌株发酵性能奠定基础。
2.4 试验菌株的贮藏性评价结果
2.4.1 试验菌株发酵体系贮藏期间pH、酸度的变化结果
任何产品功能性开发都离不开贮藏性结果的评价。本实验对由不同菌株发酵的豆乳进行24 d的贮藏性评价。pH和滴定酸度变化结果如表3、4所示。随着贮藏时间的延长,与其他发酵体系相比,M18-6菌株发酵豆乳体系中pH值和滴定酸度变化基本趋于平稳,无显著变化,说明M18-6菌株具有良好的酸度稳定性。
表3 发酵豆乳贮藏期pH的变化
Table 3 Changes in pH of fermented soymilk during storage

贮藏阶段/dM18-6M11-4M11-4+M18-6Zhang-LL+M18-6KL1+M18-6Zhang-LL+KL1+M18-664.32±0.15a4.08±0.28b3.92±0.06b4.06±0.03a4.20±0.03a3.85±0.10b124.43±0.07a3.62±0.04b3.93±0.10b4.13±0.11a4.12±0.10a3.80±0.06b184.16±0.17a3.42±0.05b3.93±0.03b4.13±0.03a4.16±0.07a3.87±0.12b244.11±0.24a3.42±0.09b3.83±0.13b4.13±0.17a4.11±0.06a3.58±0.06b
注:相同字母表示不同菌株之间无显著性差异,不同字母表示同一时间点不同菌株发酵体系之间有显著性差异(P<0.05)(下同)
表4 发酵豆乳贮藏期滴定酸度的变化 单位:°T
Table 4 Changes in titration acidity of fermented soymilk during storage

贮藏阶段/dM18-6M11-4M11-4+M18-6Zhang-LL+M18-6KL1+M18-6Zhang-LL+KL1+M18-6649.45±0.21c64.00±0.71a78.45±0.21b52.95±0.08c50.51±0.69c104.5±0.71a1257.42±0.59c113.00±0.51a99.88±0.59b62.77±0.33c64.60±0.56c101.75±0.35a1867.24±0.37c160.00±0.06a78.53±0.37b55.80±0.29c57.76±0.34c151.44±2.21a2465.04±0.05c178.00±0.04a69.13±0.05b44.50±0.71c59.53±0.74c164.84±0.08a
2.4.2 试验菌株发酵体系贮藏期间活菌数的变化
发酵豆乳贮藏期间酸度稳定性和活菌数稳定性是益生菌产品贮藏稳定性的重要指标。贮藏期间活菌数的变化。由表5所示,随着贮藏时间的延长,不同发酵体系中活菌数均呈下降趋势,可能原因是菌株长期处于酸环境中,能量消耗显著增大,在贮藏后期又由于能量严重缺乏导致菌体大量死亡。但是,对于单菌株发酵,M18-6发酵的体系在24 d后活菌数仍保持在108 CFU/mL以上;而复合发酵发酵体系中,尤其是3种菌株发酵的体系中(Zhang-LL+KL1+M18-6) 24 d后活菌数能达到109 CFU/mL以上,显著高于双菌株复合发酵体系(P<0.05)。
2.5 试验菌株的耐受性评价
基于以上结果,进一步研究M18-6菌株的耐酸、耐胆盐特性以及在模拟胃肠道环境中,M18-6菌株的存活情况,结果如图3所示。正常人体的胃液pH在1.5~4.5之间,而乳酸菌在pH 2.0的环境中不生长[21]。图3-A的结果表明,M18-6菌株在pH 2.0的环境中作用连续4 h,活菌数整体呈现下降趋势,但是仍能达到108.5~109 CFU/mL;图3-C结果同样验证了M18-6较强的耐酸性。这对于益生菌在肠胃中存活以及更好地发挥其益生功能提供可能。
表5 发酵豆乳贮藏期活菌数的变化
Table 5 Changes in viable counts of fermented soy milk during storage

贮藏阶段/dM18-6lg(CFU/mL)M11-4lg(CFU/mL)M11-4+M18-6lg(CFU/mL)Zhang-LL+M18-6lg(CFU/mL)KL1+M18-6lg(CFU/mL)Zhang-LL+KL1+M18-6lg(CFU/mL)69.10±0.01a9.19±0.06a8.62±0.05b8.82±0.05b8.79±0.02b9.24±0.08a129.08±0.09a9.84±0.04a8.57±0.05b8.67±0.05b8.84±0.01b8.96±0.04a188.83±0.07a8.56±0.01a8.01±0.01b8.58±0.07b8.78±0.01b9.75±0.05a248.69±0.10a7.93±0.02a8.23±0.05b8.50±0.03b8.28±0.12b9.07±0.03a
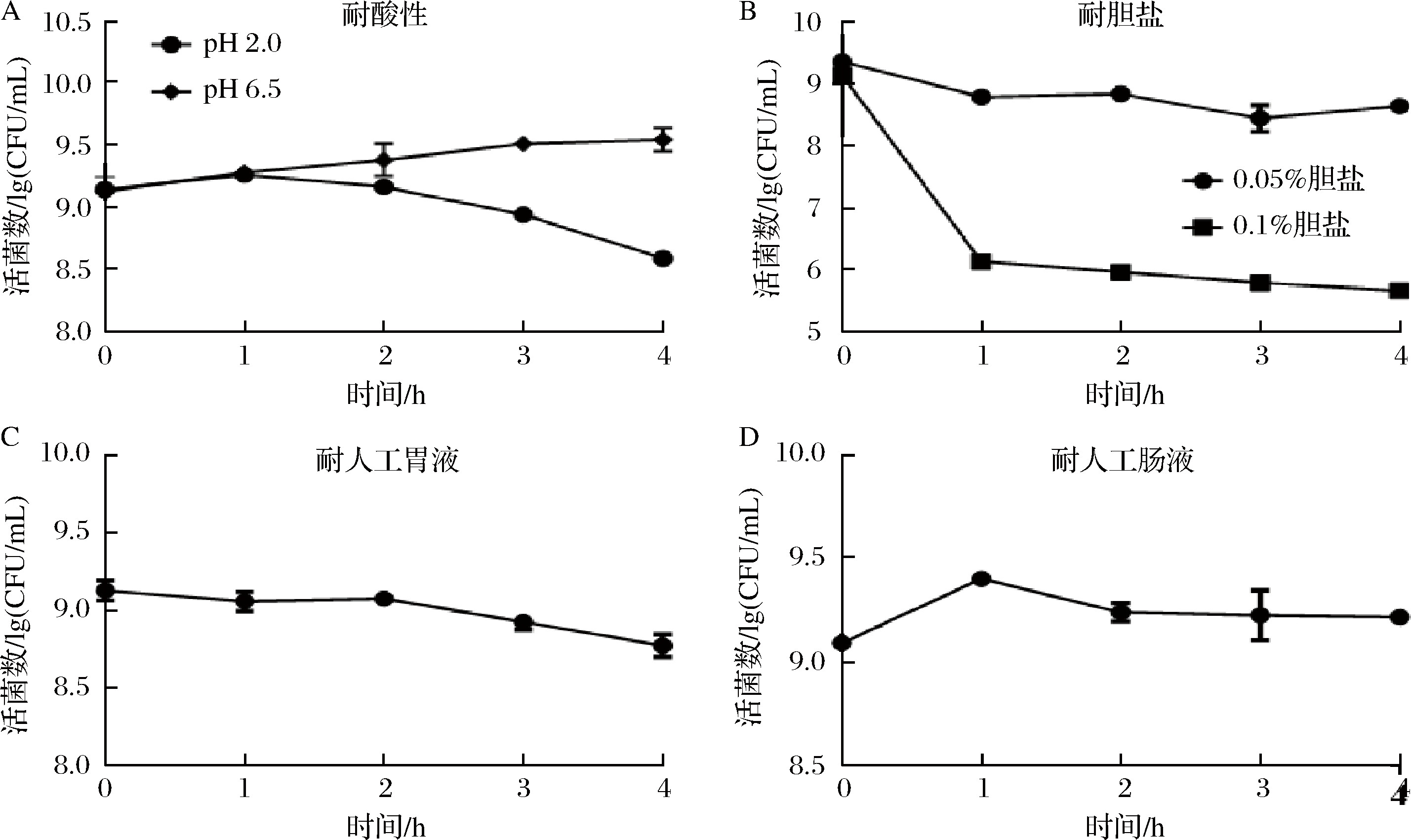
A-耐酸性;B-耐胆盐;C-耐人工胃液;D-耐人工肠液
图3 唾液乳杆菌M18-6的耐受性评价
Fig.3 Tolerance evaluation of L. salivarius M18-6
耐胆盐作为乳酸菌必备的另一种特性,乳酸菌在经过小肠上的某段部位时,必须具有较好的耐受力,人体十二指肠的胆盐质量浓度,一般在0.03%~0.3%之间[22]。由图3-B可知,M18-6菌株在质量浓度为 0.05% 的胆盐作用下,4 h后活菌数仍保持在108.5 CFU/mL以上,但是在质量浓度为 0.1% 的胆盐作用下,活菌数在0~1 h内急速下降,最终保持在106 CFU/mL;同时在人工肠液环境中胁迫4 h后,活菌数保持在109 CFU/mL的高水平。可见试验菌株不仅出良好的耐酸性,对胆盐的耐受性也呈现出良好的耐受特性。这为由该试验菌株发酵的豆乳能更好地被人体消化吸收提供功能性保障。
3 结果与讨论
本文首先通过乳酸菌对豆浆的凝固时间的长短进行初次筛选,发现唾液乳杆菌M18-6在以106 CFU/mL为初始接种量发酵豆浆,(2.50±0.20) h后豆浆完全凝固,这比同时用其他单一乳杆菌发酵的凝乳时间缩短0.5~1.5 h,并且与目前已有报道的乳杆菌菌株和双歧菌株相比,凝乳时间也明显缩短2 h[23]。此外,该菌株发酵体系还具有良好清除DPPH自由基的能力。经感官评定分析可知,M18-6菌株发酵的豆乳体系评分在单菌株发酵豆乳体系中最高,为88分,且对于Zhang-LL、KL1和M18-6 3种复合菌株发酵体系中,感官评价总得分为95分,显著高于其他菌株发酵体系,可能是3种菌株共同作用下产酸能力强,生成的挥发性香味掩盖了豆浆本身浓郁的豆腥味,从而散发出淡淡的清香味,给人以愉悦感,且质地较为细腻,适宜凝固型豆奶产品的研发。
进一步对菌株耐受性评价发现,M18-6菌株在模拟胃肠道坏境中胁迫4 h后活菌数仍然保持在3.16×108 CFU/mL以上,这为发酵豆乳能够更好地被人体胃肠道充分吸收提供有力的保障;最后,通过对发酵豆乳24 d内的贮藏性评价测定发现,M18-6菌株在豆乳中的存活率最终保持在108 CFU/mL,为后期研究功能性发酵豆乳制品提供基础理论依据。
4 结论
本研究对M18-6单一菌株发酵豆乳在贮藏期间的pH、滴定酸度以及活菌数的变化进行测定发现,唾液乳杆菌M18-6凝乳时间仅为(2.50±0.20) h,与商业乳酸菌发酵4 h相比,大大缩短了发酵时间;同时,良好的活菌贮藏稳定性以及潜在的高抗氧化活性,为开发快速稳定的发酵大豆蛋白体系乳酸菌菌剂提供了良好的应用前景。
[1] 尤燕莉.全豆浆在冰淇淋中的应用研究[D].无锡:江南大学,2015.
[2] 吴琼,于寒松,张岚,等.益生菌发酵豆乳中营养成分变化研究[J].中国粮油学报,2013,28(10): 92-95;105.
[3] 史信.《中国居民膳食指南(2016)》发布[J].中国妇幼健康研究,2016,27(5):30-30.
[4] 郭颖,涂顺明,骆练,等.益生菌混合发酵酸豆乳的工艺条件优化[J].食品与发酵工业,2014,40(10):108-112.
[5] CATALIN IANCU, VASILICA BARBU, ANCA NICOLAU, et al.Attempts to obtain a new symbiotic product based on soy milk[J].Innovative Romanian Food Biotechnology,2010,7:21-29.
[6] DO AMARAL SANTOS,CLAUDIA CRISTINA AULER,DA SILVA LIBECK,et al.Co-culture fermentation of peanut-soy milk for the development of a novel functional beverage[J].International journal of food microbiology,2014:32-41.
[7] GHOSH D, RAY L, CHATTOPADHYAY P. Nutraceutical potential of cow milk and soy milk curd (dahi)[J].Indian Chemical Engineer,2010,52(4):336-346.
[8] THANANUNKUL D,TANAKA M,CHICHESTER C O,et al. Degradation of raffinose and stachyose in soybean milk by α-galactosidase from Mortierella vinacea. Entrapment of α-galactosidase within polyacrylamide gel[J].Journal of Food Science,2010,41(1):173-175.
[9] KANEKO D, IGARASHI T, AOYAMA K, et al.Reduction of the off-flavor volatile generated by the yogurt starter culture including Streptococcus Thermophilus and Lactobacillus delbrueckii subsp. bulgaricus in soymilk[J].Journal of Agricultural &Food Chemistry,2014,62(7):1 658-1 663.
[10] SRINIVAS H,SWAMYLINGAPPA B,CHAND N. Secondary extraction of soybeans using hexane-acetic acid,effect on beany flavor removal and physicochemical properties[J].Journal of Agricultural & Food Chemistry,1992,40(2):276-279.
[11] YAZICI F,ALVAREZ V B,HANSEN PMT. Fermentation and properties of calcium-fortified soy milk yogurt[J]. Journal of Food Science,2010,62(3):457-461.
[12] SKYTTE J L,GHITA O,WHELAN P F,et al. Evaluation of yogurt microstructure using confocal laser scanning microscopy and image analysis[J]. Journal of Food Science,2015,80(6):1 218-1 218
[13] TRINDADE C S, TERZI S C, TRUGO L C, et al. Development and sensory evaluation of soymilk based yoghurt[J]. Arch latinoam nutrition,2001, 51:100-104.
[14] CHENG-LIANG XIE, CHUNG EUN HWANG, CHEOL KYU OH,et al.Fermented soy-powder milk with Lactobacillus plantarum P1201 protects against high-fat diet-induced obesity[J].International Journal of Food Science & Technology,2017,7(52):1 614-1 622.
[15] LIU Z G,SONG G,ZOU C,et al. Acrylamide induces mitochondrial dysfunction and apoptosis in BV-2 microglial cells[J]. FreeRadical Biology and Medicine, 2015, 84: 42-53.
[16] 中华人民共和国国家卫生和计划生育委员会.GB5009.239-2016食品安全国家标准食品酸度的测定[S].2016-08-31.
[17] 陆婧. 藏灵菇酸奶及酸奶粉的制作工艺优化[D].兰州:甘肃农业大学,2013.
[18] 柳青.具有潜在益生特性乳酸菌的筛选鉴定及其特性研究[D].呼和浩特:内蒙古农业大学,2018.
[19] RUBIO R, JOFRÉ A, MART N B, et al. Characterization of lactic acid bacteria isolated from infant faeces as potential probiotic starter cultures for fermented sausages[J]. Food Microbiology, 2014, 38: 303-311.
N B, et al. Characterization of lactic acid bacteria isolated from infant faeces as potential probiotic starter cultures for fermented sausages[J]. Food Microbiology, 2014, 38: 303-311.
[20] 王水泉.益生植物乳杆菌 P8 在豆乳及牛乳中发酵特性的研究[D].呼和浩特:内蒙古农业大学,2011.
[21] XU R, SHANG N, LI P. In vitro and in vivo antioxidant activity of exopolysaccharide fractions from Bifidobacterium animals RH[J]. Anaerobe, 2011, 17(5): 226-231.
[22] 胡爱华,敖晓琳,陈岑,等.乳酸菌耐酸耐胆盐机制的研究进展[J]. 食品工业科技, 2015, 36(8): 380-383;389.
[23] 赵丽艳,杨柳,陈宇飞.酸豆乳益生菌发酵条件探析[J].食品安全导论,2018,3(1):129-129.