樱桃属蔷薇目蔷薇科樱桃属的落叶乔木,因在落叶果树中成熟期较早,有“春果第一枝”的美誉[1]。由于樱桃属于不耐贮运易腐烂变质的水果[2],因此各地对种植樱桃持谨慎态度,影响樱桃产业化发展。目前研究表明:樱桃富含花青素、黄酮、褪黑激素等生物活性物质,这些物质具有抗氧化、消炎、镇痛等作用[3]。而樱桃果酒开发既符合粮食酒向果酒转变的行业政策[4],同时又赋予果酒保健的功效,具有良好的发展潜力。
目前,市面上樱桃酒产品多采用葡萄酒酵母发酵而成,产品存在特征香气不够明显、果香不够浓郁、口感较差等问题[5]。而现阶段对于樱桃果酒研究集中在2个方面:1.对樱桃果酒发酵工艺研究。如李志友等[1]、范兆军等[6]通过优化发酵工艺参数,得到酒精度在10%vol~11%vol的樱桃果酒。2.对樱桃果酒香气成分研究。如秦伟帅等[7]、于海燕等[8]采用顶空固相微萃取-气相色谱-质谱联用(headspace solid phase micro-extraction combine with gas chromatography mass spectrometry,HS-SPME/GC-MS)技术对樱桃果酒中香气成分检测,结果表明辛酸乙酯、异戊醇、苯甲醛等在樱桃酒中含量较高,是樱桃酒特征香气物质。但针对筛选适合樱桃果酒酿造优良酵母的报道较少[9]。在果酒酿造中,酵母性能的好坏直接影响果酒的风味和口感,决定果酒质量[10]。现阶段樱桃果酒酵母筛选还处于初级阶段,筛选出适合樱桃果酒酿造的优良酵母尤为重要。
本次研究对酵母发酵产乙醇能力和耐受性进行筛选,结合细胞形态和分子生物学鉴定,并对发酵樱桃果酒香气成分及香气活度值(odor activity value, OAV)分析。以期筛选出适合樱桃果酒的优良酿酒酵母,为樱桃果酒酿造提供宝贵的菌株资源,从而提高樱桃果酒品质,为果酒产业发展奠定基础。
1 材料与方法
1.1 实验材料
樱桃、自然腐败樱桃,品种为“美早”,购自零售市场;果园土壤,内江市庆卫镇樱桃种植基地。白砂糖,市售。F15:市售商业酿酒酵母(简称F15)。
1.2 试剂与培养基
葡萄糖、NaOH、偏重亚硫酸钾等均为分析纯,成都市科龙化工试剂厂;2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)为分析纯,上海灵锦精细化工有限公司;2-辛醇为色谱纯,成都艾科达化学试剂有限公司;孟加拉红培养基,北京奥博星生物技术有限公司;YPD液体培养基、YPD固体培养基、TTC培养基参考文献[11]。
1.3 仪器与设备
恒温摇床(SKY-2102C)、培养箱(GZ-250-M),韶关市广智科技设备有限公司;pH计(STO210),奥豪斯仪器(上海)有限公司;固相微萃取头(50 μm/30 μm DVAB/CAR/PDMS)、手动SPME进样器,美国Supelco公司;气相色谱-质谱联用仪(Agligent 6890N-5975B),美国安捷伦公司。
1.4 实验方法
1.4.1 酵母菌富集与分离纯化
将新鲜樱桃、腐败樱桃、土壤样品分别加入无菌水制成菌悬液。将菌悬液加入YPD液体培养基中,28 ℃、150 r/min富集培养24 h。典型的酵母菌落表面光滑、湿润、黏稠,质地柔软,易挑起,多为乳白或奶油色,具有愉悦香气等特征[12]。取富集液稀释涂布于孟加拉红分离培养基,根据上述特征来观察和闻香挑选具有典型酵母特征和愉悦香气的酵母,在YPD固体培养基斜面上4 ℃保藏。
1.4.2 酵母菌初筛
TTC是一种显色剂,它能对酵母中脱氢酶发生呈色反应,通过颜色深浅可以判断酵母中呼吸酶活力的大小,即初步判断酵母产酒精能力的高低,产酒精能力强的酵母会显深红色,次之显红色、微红色或不显[13],将1.4.1中酵母活化得到的菌悬液,稀释涂布于TTC下层平板,倒置培养,选取菌落数在50~100个的平板倒入TTC上层培养基覆盖原有菌落,避光培养,最后挑选颜色深红的菌株作为初筛菌株。
1.4.3 酵母菌复筛
采用果汁发酵法对初筛酵母进行复筛[14],樱桃发酵液中樱桃汁含量为35%(体积分数),调整外观糖度到25°Bx,SO2含量为80 mg/L(以偏重亚硫酸钾形式添加),酵母接种量为105个/mL发酵液,发酵温度28 ℃。以总糖含量小于4 g/L时为发酵终点,发酵结束后测其理化指标:酒精度、总酸、总酯和感官评价,最终筛选出发酵果酒酒精度高、酸度适中、感官评分高的酵母为复筛目的菌株,以F15作对照。
樱桃酒理化指标中总酯参考胡志平等[15]方法;酒精度、总酸参考GB/T 15038—2006[16]。感官评分标准参考贾瑞楠等[17]的方法并稍作调整,见表1所示。
表1 樱桃果酒感官评分标准
Table 1 Cherry fruit wine sensory scoring standard

指标标准满分/分外观颜色深红、透明澄清、无悬浮物及沉淀20香气果香、酒香浓郁、无其他异杂气味30滋味酒体爽口、口感柔和40典型性有典型樱桃酒特征、香气馥郁、酒香纯正优雅10
1.4.4 酵母菌耐受性实验
将目的酵母菌按表2条件进行耐受性研究。将酵母菌以107个/mL接种于装有YPD液体培养基试管中,28 ℃静置培养,每隔12 h观察杜氏小管内产气情况,以F15作对照。
表2 酵母菌耐受性试验条件及梯度
Table 1 Test yeast tolerance test conditions and gradients
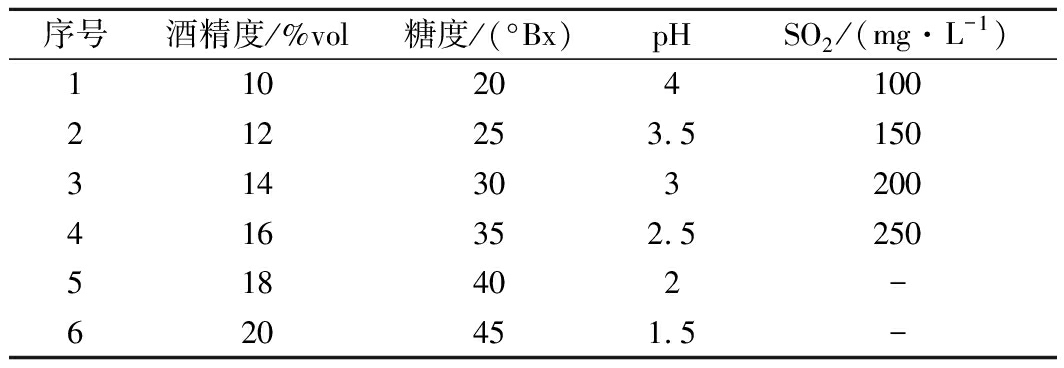
序号酒精度/%vol糖度/(°Bx)pHSO2/(mg·L-1)110204100212253.5150314303200416352.5250518402-620451.5-
注:“-”表示未设置条件梯度
1.4.5 酵母菌形态学观察及分子生物学鉴定
将酵母菌接种到YPD固体培养基上划线,观察酵母菌落形态;用水浸法制片于显微镜下观察酵母细胞形态和出芽情况。同时将目的酵母活化后送至上海生工进行测序,将测序结果于NCBI进行BLAST分析,用MEGA6构建菌株发育树。
1.4.6 樱桃果酒香气成分及OAV分析
将复筛目的酵母按105个/mL接种于1.4.3发酵液中,发酵结束后对其香气成分测定及OAV分析,以F15发酵试验作对照。
1.4.6.1 香气成分分析
运用HS-SPME/GC-MS对樱桃果酒进行测定。取樱桃果酒5 mL,2 g NaCl于15 mL顶空瓶内,50 ℃平衡15 min,萃取30 min。萃取完成后将固相微萃取头插入解析口,解析5 min,进行GC-MS分析,以2-辛醇为内标进行半定量分析,升温程序参考于海燕等[8]的方法。
1.4.6.2 香气活度值分析
根据1.4.6.1樱桃果酒所含香气物质基础上,查阅香气物质在体积分数9.5%~14%乙醇水溶液中的阈值,根据阈值和含量计算出香气物质的OAV值,计算方式参考李凯等[13]的方法。
1.4.7 数据分析
采用SPSS 23.0软件来进行统计和方差分析,显著性界值P<0.05,从而判断数据差异;数据图采用Origin绘制。
2 结果与分析
2.1 酵母菌分离纯化
通过菌落形态和细胞镜检观察,从样本中分离纯化出35株酵母菌,编号J1-J35。将35株酵母稀释涂布到TTC平板,从中筛选出8株显色深红的菌株作为初筛菌株,由图1可知不同酵母显色不一样。
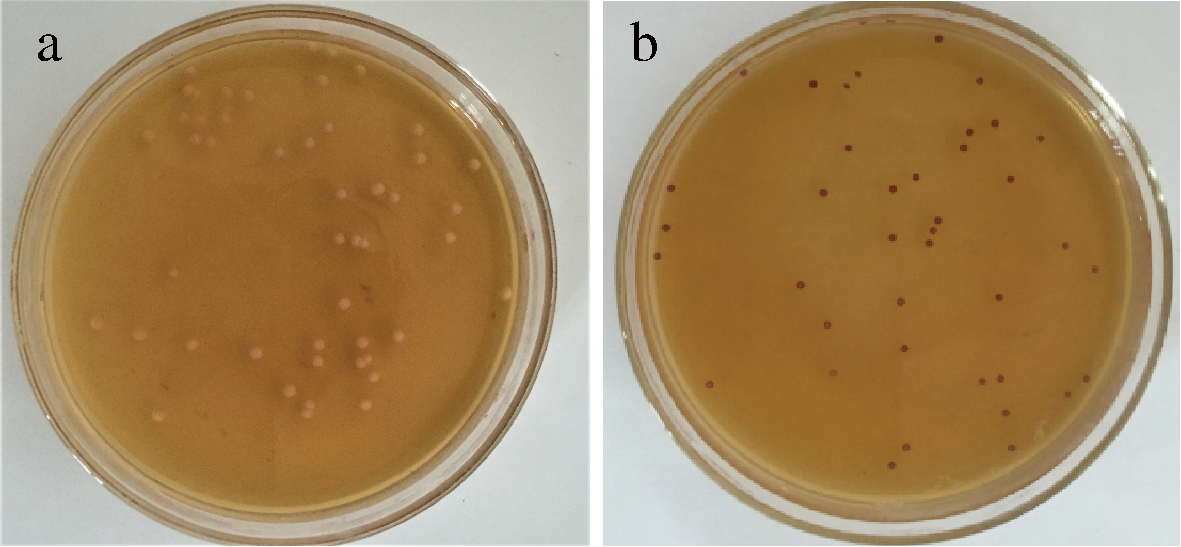
a-不显色酵母;b-显深红色酵母
图1 酵母染色对比图
Fig.1 Yeast staining comparison chart
2.2 酵母菌复筛
将初筛出的8株酵母与F15进行果酒发酵,待发酵结束后测其理化指标并进行感官评定,由图2可知,复筛酵母中J35发酵樱桃果酒酒精度与总酯含量最高,分别为12.57%vol和5.55 g/L,与F15果酒差异显著。根据行业标准要求果酒中总酸含量应在4~9 g/L[18],J35发酵樱桃果酒总酸含量适中,为5.46 g/L,与F15果酒差异不显著。在樱桃果酒感官评定中,J35果酒得分最高,与F15果酒相比,两者差异显著,其中J35樱桃果酒色泽深红、果香浓郁、酯香突出、口感醇厚、典型性强。产酒精能力的强弱是评价果酒酵母性能的一个重要指标[11]。樱桃果酒中有机酸主要为苹果酸和柠檬酸,有机酸含量过高会给人酸涩、粗糙的感觉[19],酒中酸度适当、比例协调,可以使酒呈现回甜感[20]。因此,复筛选择发酵樱桃果酒酒精度高、总酯含量高、酸度适中、感官评分高的J35作为复筛目的菌株。
2.3 菌株耐受性
比较酵母菌在不同糖浓度、pH、酒精度、SO2添加量下杜氏小管中产气情况,在相同时间内产气更多则耐受能力更强,从而反应出酵母能够适应的发酵环境,结果如表3所示。

a-酒精度;b-总酸;c-总酯;d-感官评分
图2 樱桃果酒理化指标及感官评分
Fig.2 Physical and chemical indicators and sensory scores of cherry fruit wine
注:不同字母表示差异性显著(P<0.05)
表3 不同条件梯度下酵母产气情况
Table 3 Yeast gas production under different gradients
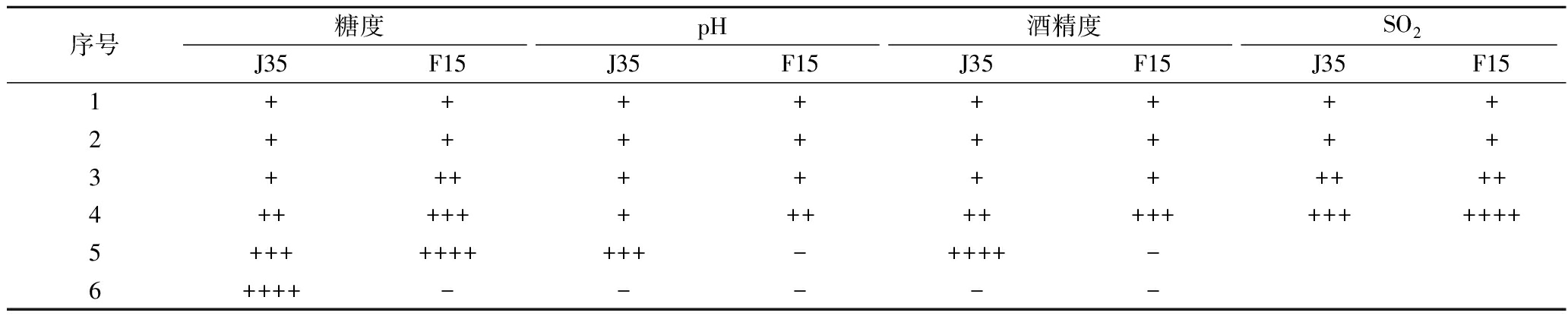
序号糖度pH酒精度SO2J35F15J35F15J35F15J35F151++++++++2++++++++3+++++++++++4++++++++++++++++++++5++++++++++-++++-6++++-----
注:“+”为12 h产气充满杜氏小管;“++”为24 h产气充满杜氏小管;“+++”为36 h产气充满杜氏小管;“++++”为48 h充满杜氏小管,“-”为不产气。序号1~6的实验条件同表2中的序号1~6
果酒酿造中,糖作为酵母生长代谢所需要的碳源,但糖浓度过高会提高酵母渗透压从而抑制其生命活动[21]。由表3可以看出,当糖浓度在45°Bx时候,J35能在48 h内产气充满杜氏小管,而F15不再产气,说明J35糖耐受性较强。pH过低会影响酵母的生长及代谢[11],J35在pH为2时能在36 h产气充满杜氏小管,而F15在pH为2时不产气,因此J35具有较好的低pH耐受性。酒精是酵母的代谢产物之一,但浓度过高会对自身有毒害作用[21]。当酒精浓度为18%vol时,J35能在48 h产气充满杜氏小管,而F15不产气,因此J35耐酒精能力较强。在果酒酿造时会添加一定量的SO2来抑制杂菌生长繁殖,GB 2760—2014[22]中SO2最大添加量为250 mg/L。J35和F15均能在250 mg/L条件下产气充满杜氏小管,但J35产气速率更快,因此J35对SO2耐受性较强。
2.4 菌株形态观察及分子生物学鉴定
将J35置于显微镜下观察细胞形态,结果如图3所示,并将测序结果在NCBI进行比对,构建菌株系统发育树,结果如图4所示。
由图3可见,酵母菌J35经培养24 h后菌落呈乳白色、湿润、表面光滑、菌落中间隆起边缘光滑。酵母菌J35在光学显微镜下观察细胞椭圆形,单端出芽。将J35测序结果与NCBI中GenBank核酸序列数据库中酵母模式菌株基因序列进行比对,选取相似度高的模式菌株序列,运用Mega软件中Neighbor-Joining 法构建系统发育树,由图4可见,与酿酒酵母相似度高达98%,初步确定J35为酿酒酵母。

图3 酵母J35菌落形态及显微形态
Fig.3 Yeast J35 colony morphology and microscopic
morphology
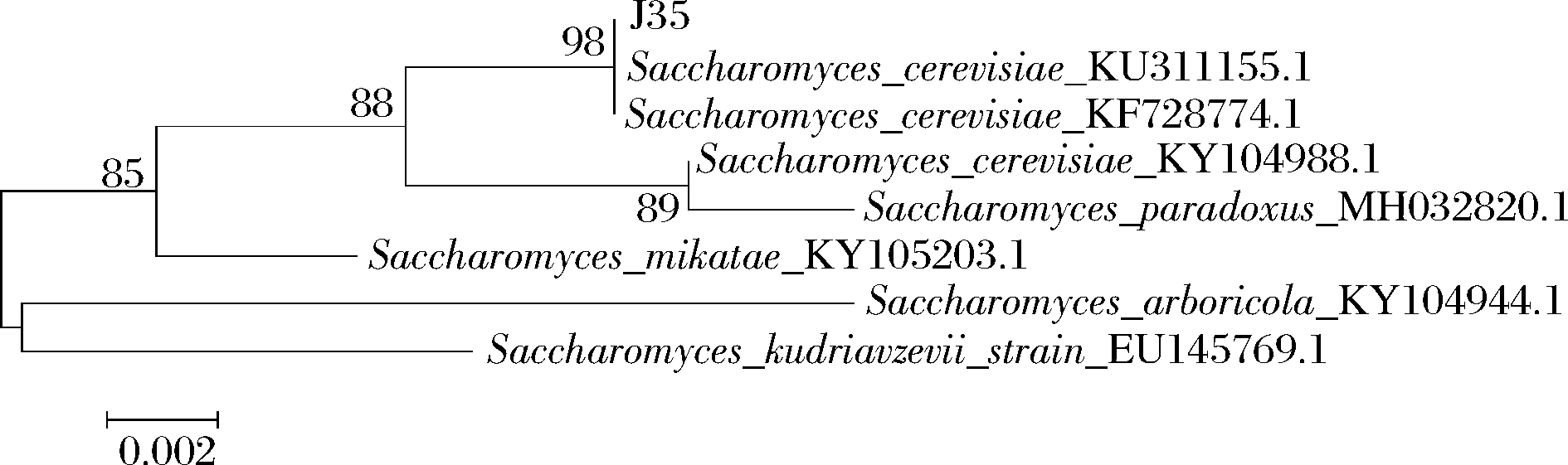
图4 J35系统发育树
Fig.4 J35 phylogenetic tree
2.5 樱桃果酒香气成分及香气活度值分析
2.5.1 樱桃果酒香气成分分析
将复筛目的菌株J35与F15发酵得到的樱桃果酒采用HS-SPME/GC-MS进行香气成分分析,其结果见表4。2种樱桃酒共检测出38种挥发性物质,其中酯类物质17种、醇类物质13种、酸类物质2种、酮醛类物质3种、萜烯类物质2种、其他1种。
2.5.1.1 酯类化合物比较分析
香气成分是评价果酒品质的重要指标之一,其中酯类物质既呈香也呈味,是酒类中重要的风味化合物[23]。从表4可以看出2种樱桃果酒中主要酯类为癸酸乙酯、辛酸乙酯、月桂酸乙酯、己酸乙酯等,这些物质也是樱桃酒重要酯类物质[7],酯类物质中癸酸乙酯和辛酸乙酯所占比例较高,其中J35果酒中这2种物质是F15的1.59和1.49倍。在果酒中,酯类物质一部分来源于果实本身,一部分来源于发酵过程中醇与酸的酯化反应。由文献[8,24]可知樱桃果实中含有一定量的癸酸乙酯、辛酸乙酯等物质,随着发酵过程的进行,其含量明显增加。
表4 樱桃果酒香气成分表
Table 4 Cherry fruit wine aroma ingredients table

序号化合物香气描述J35/(μg·L-1)F15/(μg·L-1)酯类1丁酸乙酯菠萝香、玫瑰香30.71±3.34-2乙酸异戊酯香蕉香、甜香、苹果香422.02±82.56-3己酸乙酯甜香、水果香、窖香431.88±7.4a94.66±8.27b4乙酸己酯果香27.51±2.91-5乳酸乙酯朗姆酒、奶油香46.10±5.19a52.00±7.62a6辛酸乙酯果香似杏、奶油香、甜的酒香2 535.23±195.79a1 703.82±250.47b7癸酸乙酯果香、脂肪味3 483.05±236.12a2 187.63±217.73b8苯甲酸乙酯梨和苹果香310.61±51.09a169.60±33.02b9乙基9-癸烯酸酯-313.59±41.03a850.86±84.91b10乙酸苄酯茉莉花香111.78±10.73a72.63±2.45b11丙酸-2-苯乙酯玫瑰香、果香、蜜香111.06±9.31-12月桂酸乙酯甜香、花果香、奶油香914.95±99.34a774.38±54.98b13癸酸异戊酯蜡香72.63±9.34a40.57±5.71b14棕榈酸乙酯-164.09±50.14a51.12±10.83b15庚酸乙酯花香、甜香-8.26±0.7216苯乙酸乙酯蜂蜜香-33.48±5.9417乙酸苯乙酯甜蜜香-95.38±15.45醇类18丙醇醇香、水果香212.87±30.87a143.88±22.57b19异丁醇醇香、水果香1 457.59±108.52a680.87±83.81b20正丁醇水果香和青草香32.60±5.76a15.06±6.16b21异戊醇水果香、花香7 775.06±755.31a2 320.49±140.73b22正己醇花香、甜香、青草香230.35±35.42a89.38±8.44b232-乙基己醇甜香、花香34.99±5.87a87.34±3.24b242,3-丁二醇黄油和奶油香气769.44±55.14a425.75±70.93b25正辛醇具有强烈的油脂气味、柑橘、玫瑰气味147.19±26.02a79.05±22.28b26苯甲醇甜香、柑橘水果香、花香841.45±72.84a677.88±45.24b27苯乙醇玫瑰花香、木香3 859.99±889.62a927.54±81.36b28正庚醇柑橘香、油脂气味-54.65±8.17292-壬醇果香-29.81±8.84
续表4

序号化合物香气描述J35/(ug·L-1)F15/(ug·L-1)303-吲哚乙醇--89.86±10.76酸类31乙酸醋酸味324.26±49.40a171.85±32.05b32辛酸奶酪香、脂肪臭715.81±32.03a373.41±28.29b酮醛类333-羟基-2-丁酮水果香、霉腐味和木香64.21±8.34a75.13±6.92a342-壬酮水果香、花香、油脂香、药香15.64±3.49-35苯甲醛樱桃果香、杏仁香、花香2 724.46±188.32a43.91±6.00b萜烯类36β-香茅醇青香、花香玫瑰香157.78±14.92a115.88±19.53b37α-松油醇海桐花香、紫丁香、铃兰香-19.87±3.24其他382,4-二叔丁基酚石炭酸味202.21±17.48a120.87±10.43b
注:“-”为未检测出;同行不同字母表示差异性显著(P<0.05)
2.5.1.2 醇类化合物比较分析
醇类物质是酵母在酒精发酵过程中利用氨基酸或糖代谢产生的次级产物,构成酒类的主体香气成分[25]。2种发酵樱桃果酒的醇类物质中异戊醇、苯乙醇、异丁醇含量较高,并且J35果酒这些物质是F15果酒的3.35、4.16、2.14倍。在本次研究中异戊醇是含量最高的醇类物质,这与文献报道较一致[26],同时它也被认为是葡萄酒中重要的物质[27]。樱桃酒中的某些醇类已在樱桃果实中被鉴定出来,如苯乙醇、异戊醇等,随着发酵进行,这些醇类在樱桃果酒中含量明显增加[8]。
2.5.1.3 酸类化合物比较分析
酸类物质是构成樱桃酒香气特征重要的贡献者[4]。本次发酵得到的樱桃果酒中检测出乙酸和辛酸,J35果酒的这2种物质是F15果酒的1.89、1.92倍,其中含量最大的是辛酸,这与于海燕等[8]的报道较一致。
2.5.1.4 酮醛类、萜烯类合物比较分析
樱桃果酒中还检测出酮醛、萜烯类物质。这些物质也赋予樱桃酒特殊香气,其中苯甲醛在J35发酵樱桃果酒酮醛类物质中含量最高,它也被报道是樱桃酒的主要香气成分,使樱桃酒具有特殊的苦杏仁气息、焦糖气味[28]。
通过上述分析,2种酵母发酵樱桃果酒在香气成分含量有较大差异。FRAILE[29]认为葡萄酒中香气成分含量由发酵过程中起主导作用的酵母决定。因此,这些香气物质的含量差异可能是酵母不同导致。
2.5.2 香气活度值分析
为了进一步说明各香气成分对樱桃果酒品质的影响,对这些物质的OAV值进行计算,通常认为化合物OAV值>1时,对整体香气贡献大[30]。化合物浓度高低不能说明对樱桃酒的整体香气有影响,这主要取决于化合物的阈值,如β-香茅醇含量低,但阈值低,OAV值>1,对樱桃果酒香气也有一定贡献。由表5可知,本次研究J35发酵樱桃果酒中的OAV值>1的风味化合物有癸酸乙酯、辛酸乙酯、己酸乙酯、乙酸异戊酯、苯甲酸乙酯、丁酸乙酯、苯乙醇、苯甲醛、辛酸、β-香茅醇,这些物质也是文献[4,28,31-32] 中报道的樱桃果酒典型香气物质。综合表4与表5,比较J35与F15樱桃果酒中典型香气物质,J35所含樱桃酒典型香气物质种类更多且含量较为丰富,结合感官评价结果,其果香浓郁、酯香突出、富有樱桃酒典型性风格,因此J35酵母菌可进一步开发为樱桃酒酿造专用酵母。
表5 J35与F15发酵樱桃果酒中OAV>1的香气物质
Table 5 Aroma substances of OAV>1 in J35 and F15
fermented cherry fruit wine
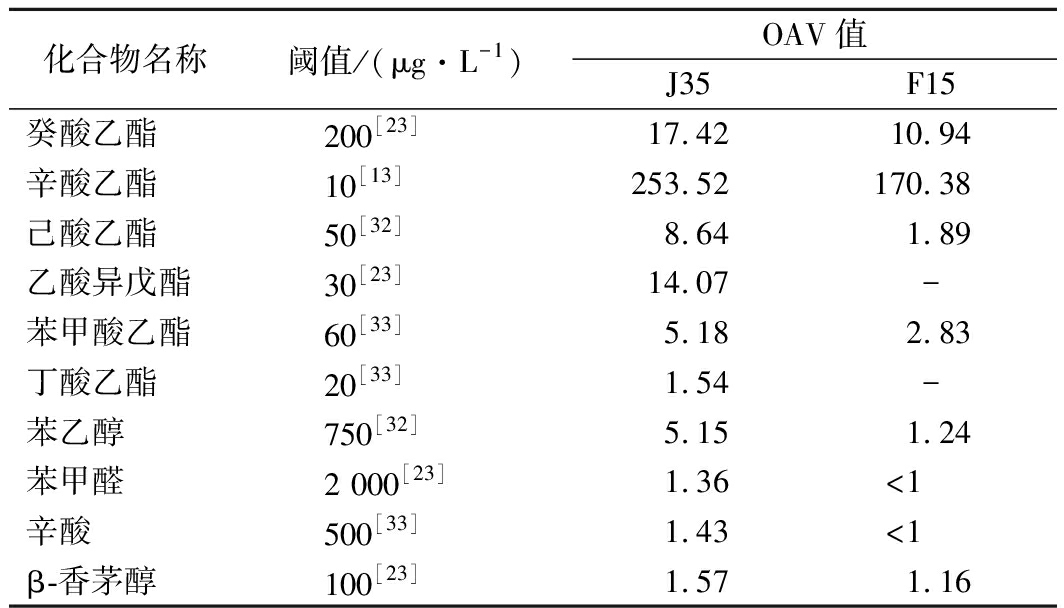
化合物名称阈值/(μg·L-1)OAV值J35F15癸酸乙酯200[23]17.4210.94辛酸乙酯10[13]253.52170.38己酸乙酯50[32]8.641.89乙酸异戊酯30[23]14.07-苯甲酸乙酯60[33]5.182.83丁酸乙酯20[33]1.54-苯乙醇750[32]5.151.24苯甲醛2 000[23]1.36<1辛酸500[33]1.43<1β-香茅醇100[23]1.571.16
注:“-”表示未检测出
3 结论
1株优良果酒酿酒酵母应具备良好的发酵性能,耐受性强,发酵产品香气丰富协调[17]。本次研究从樱桃及土壤中运用TTC显色法初筛、果汁发酵法复筛出1株在含糖量为25°Bx、果汁含量35%条件下,产酒精能力为12.57%vol、酸度适中、发酵后香气馥郁、口感较佳的优良酵母。通过耐受性实验表明,J35在含糖量为45°Bx、pH 2.0、酒精含量18%vol、250 mg/L SO2条件下具有良好发酵能力。J35樱桃酒经香气成分与OAV分析显示,果酒含有辛酸乙酯、癸酸乙酯、异戊醇、苯乙醇、苯甲醛、辛酸、β-香茅醇等樱桃酒典型香味成分并且含量较为丰富。但是J35发酵樱桃果酒与文献报道的香气物质种类及含量有一定差异,这可能是果实种类及菌株不同导致,有研究表明[10,31],酵母菌类型及发酵介质的组成对酒中香气成分有很大影响。后续还需针对樱桃品种选择、发酵条件及后处理工艺进行优化,进一步发掘J35的潜力和应用价值,开发成为适合樱桃酒酿造的专用酵母,从而为樱桃果酒产业化发展奠定基础。
[1] 李志友,李启要.樱桃果酒发酵条件的优化[J].贵州农业科学,2016,44(3):152-155.
[2] 陈杨.樱桃的贮藏保鲜与加工[J].新农村,2018(6):35-36.
[3] KIRAKOSYAN A,SEYMOUR E M,LLANES D E U,et al.Chemical profile and antioxidant capacities of tart cherry products[J].Food Chemistry,2009,115(1):20-25.
[4] 姜东琪,张云舒,武晓玮,等.酿酒酵母对樱桃酒挥发性组分及感官品质的影响[J].中国酿造,2019,38(8):94-99.
[5] 牛云蔚.樱桃酒的特征风味及品质调控研究[D].无锡:江南大学,2012.
[6] 范兆军.响应面优化樱桃果酒发酵条件的研究[J].农产品加工,2015(9):22-25.
[7] 秦伟帅,姜凯凯,孙玉霞,等. SPME-GC3MS联用测定“红灯”樱桃酒中香气成分[J].食品工业,2016,37(9):296-298.
[8] 于海燕,张妮,许春华.樱桃酒发酵过程中的主要香气成分及其变化[J].食品与发酵工业,2011,37(10):159-163.
[9] 许程,王晶,孙艳艳,等.樱桃酒专用酵母的筛选鉴定[J].食品科技,2017,42(11):14-18.
[10] SUN S Y,GONG H S,JIANG X M,et al.Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae on alcoholic fermentation behaviour and wine aroma of cherry wines[J].Food Microbiology,2014, 44:15-23.
[11] 李凯,王金晶,李永仙,等.红芯火龙果酒酿酒酵母的筛选及鉴定[J].食品与发酵工业,2019,45(5):115-120.
[12] 刘慧.现代食品微生物学[M].北京:中国轻工业出版社,2011.
[13] 李凯,王金晶,李永仙,等.红心火龙果果酒特征香气分析[J].食品与发酵工业,2019,45(13):217-223.
[14] 左勇,刘利平,鞠帅,等.无花果果酒酵母的筛选及发酵性能研究[J].现代食品科技,2013,29(6):1 293-1 296.
[15] 胡志平,柯锋,叶静萱,等.三种香型白酒蒸馏前后总酯的差异性分析[J].酿酒科技,2019,296(2):81-84.
[16] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006,葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[17] 贾瑞楠,单万祥,李永仙,等.橙酒酵母的分离、筛选及鉴定[J].食品与发酵工业,2018,44(7):122-127.
[18] NY/T 1508—2017,绿色食品果酒[S].北京:中国标准出版社,2017.
[19] SUN S Y,GONG H S,LIU W L,et al.Application and validation of autochthonous Lactobacillus plantarum starter cultures for controlled malolactic fermentation and its influence on the aromatic profile of cherry wines[J].Food Microbiology,2016,55(5):16-24.
[20] 王春,许德富,税梁扬,等.泸型白酒主要物质组分在蒸馏过程中的变化[J].酿酒科技,2009,183(9):61-64.
[21] 杜晶,余培斌,苏琪,等.杨梅果酒酿造酵母的筛选、鉴定及耐受性研究[J].食品与发酵工业,2015,41(9):34-39.
[22] GB 2760—2014,食品添加剂使用标准[S]北京:中国标准出版社,2014.
[23] 范文来,徐岩.酒类风味化学[M].北京:中国轻工业出版社,2014.
[24] SUN S Y,JIANG W G,ZHAO Y P.Characterization of the aroma-active compounds in five sweet cherry cultivars grown in Yantai (China)[J]. Flavour and Fragrance Journal, 2010, 25(4):206-213.
[25] 张婷,陈小伟,张沙沙,等.不同酒曲发酵生产木薯酒香气成分GC-MS分析[J].食品研究与开发,2019,40(2):125-131.
[26] SUN S Y,CHE C Y,SUN T F,et al.Evaluation of sequential inoculation of Saccharomyces cerevisiae and Oenococcus oeni strains on the chemical and aromatic profiles of cherry wines[J].Food Chemistry,2013,138(4):2 233-2 241.
[27] LAURE R,CLARK A C,SCHMIDTKE L M,et al.A robust method for quantification of volatile compounds within and between vintages using headspace-solid-phase micro-extraction coupled with GC-MS- Application on Semillon wines[J].Analytica Chimica Acta,2010,660(1-2):149-157.
[28] 肖作兵,周璇,牛云蔚,等.GC-O结合OAV分析樱桃酒的特征香气成分[J].中国食品学报,2017,17(8):246-254.
[29] FRAILE P,JULI N GARRIDO,CARMEN ANC
N GARRIDO,CARMEN ANC N. Influence of a Saccharomyces cerevisiae Selected Strain in the Volatile Composition of Rose Wines. Evolution during Fermentation[J]. Journal of Agricultural and Food Chemistry, 2000, 48(5):1 789-1 798.
N. Influence of a Saccharomyces cerevisiae Selected Strain in the Volatile Composition of Rose Wines. Evolution during Fermentation[J]. Journal of Agricultural and Food Chemistry, 2000, 48(5):1 789-1 798.
[30] HAUSCH B J,LORJAROENPHON Y,CADWALLADER K R.Flavor Chemistry of Lemon-Lime Carbonated Beverages[J]. Journal of Agricultural and Food Chemistry,2015,63(1):112-119.
[31] 李华敏,孙舒扬,黄萍萍,等.戴尔有孢圆酵母WA19与酿酒酵母F33混合发酵在樱桃酒酿造中的应用[J].食品科学,2018, 39(24):123-130.
[32] 肖作兵.樱桃酒特征香气成分研究[D].上海:上海应用技术学院,2016.
[33] 陶永胜.贺兰山东麓霞多丽葡萄酒的香气成分活性及其指纹特征研究[J].宁夏林业, 2019(3): 55-61.