魔芋葡甘聚糖(konjac glucomannan,KGM)是一种天然高分子多糖,平均分子量约为1 000 kDa,易溶于水,可以吸收相当于其自身80~100倍的水,通过氢键、偶极等作用力聚集形成巨型分子,具有优良的亲水性、凝胶性、成膜作用和增稠作用[1]。此外,KGM还具有多种生物学活性,如增强免疫力、抗肥胖、改善肠道微生物群、降血脂等[2-4]。大分子量虽然赋予了KGM优良的黏结性,但也使得KGM流动性较差,不利于产品加工,使其在作为食品添加剂或功能性物质应用方面受到很大限制[5]。降解后KGM的黏度降低、流动性变佳,这不但能改善消费者的口感体验、增加其在液体食品基质中的应用[6],还符合产业化生产要求,提高生产效率[7]。同时,黏度较低的KGM更有利于发挥其生物活性,如抗氧化活性[8]、益生菌活性[9]、提高机体免疫功能[10]、改善肠道环境[11]和维护皮肤健康[12]。因此,为了充分发掘和利用KGM在食品、医药及化工领域的潜力与价值,其黏度高、流动性差的问题亟待解决。
目前,降低KGM黏度的方法主要有酸法、碱法、酶法以及辐射处理,虽然这些方法均能改善KGM的流动性,但它们中有的会造成环境污染问题,有的则成本过高,不利于实际生产使用[13]。因此,还需要一种更加清洁、便利的技术来降低KGM黏度。近年来,超声波因其具有频率高、波长短、功率大、定向性好及便捷等特点,在食品加工领域日益展现出独特的优势[14]。它不仅可提高提取、分离及加工反应的效率[15],还可以改善多糖大分子的黏度、流动性等流变特性,如超声降解果胶[16]、黄原胶[17]、槐豆胶[18]等多糖大分子,其黏度与未处理组相比降低了60%~90%,且所得溶液稳定性高。目前,有关超声对KGM流变特性影响的研究,多集中在短时超声处理降低KGM水溶液的黏度及部分结构上[19-20],鲜见关于探讨超声处理对KGM流变特性及微观结构等方面系统的研究。为此,本试验系统地研究了不同超声处理时间、超声处理功率对KGM溶胶的流变、分子间相互作用和微观结构的影响,以期解决KGM黏度高、流动性差等突出问题,拓展KGM在饮料、酸奶、果冻等食品以及护发素、面霜等日用品中的应用,为KGM加工应用提供相关理论参考,也为其他大分子多糖的超声改性提供依据。
1 材料与方法
1.1 实验材料
1.1.1 主要实验材料
KGM(食品级),湖北七仙女生物有限公司;KBr(分析纯),成都市科龙化工试剂厂。
1.1.2 主要仪器与设备
SB-3200DTDN型超声波机器,宁波新芝生物科技股份有限公司;DHG-9140A型电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;HH-2型数显恒温水浴锅,常州奥华仪器有限公司;FA2104型高精数显电子天平,上海舜宇恒平科学仪器有限公司;SCIENTZ-10ND型冷冻干燥机,宁波新芝生物科技股份有限公司;Spectrum100红外光谱仪,美国PerkinElmer公司;DHR-1型流变仪,美国TA仪器;S-3000N型扫描电镜,HITACHI公司。
1.2 实验方法
1.2.1 KGM溶胶制备及超声处理
准确称取KGM 0.400 g,快速搅拌至完全溶解于50.0 mL纯水后,置于40 ℃水浴锅中溶胀1.5 h,取出,将其在设置特定参数的超声波机器中进行处理。超声过程中在装有样品的烧杯外围加入冰块,维持其恒定温度。然后把处理后的样品置于常温环境下待测。
按前期预实验结果,以加工效率及效果为依据,设定超声处理参数:(1) 处理时间0、30、60、120、240 min,功率180 W;(2) 超声波处理功率为0、72、108、144、180 W(超声波机器总功率为180 W,有效功率范围40%~99%),处理时间240 min。
1.2.2 流变性质的测定
取适量KGM溶胶于直径为60 mm的平行板转子上,设置测试间隙为1 000 μm,当探头到达设定位置后,小心擦去多余溶胶,并在周围涂上硅油,防止在测试过程中水分挥发。加样后,平衡时间1 min,然后在25 ℃下测定其流变学性质[21]。(1)表观黏度测定:剪切速率0.1~100 s-1,频率1 Hz;(2)动态黏弹性测试:频率扫描范围为100~1 rad/s,应变为2%。
1.2.3 傅里叶红外光谱(FT-IR)
采用KBr压片法,先将超声处理后的样品用冷冻干燥机处理48 h,然后取少量冷冻干燥后的样品与KBr粉末按照1∶80的质量比进行研磨混合并压片,以空气作为参比并测试样品,扫描范围为4 000~400 cm-1,光谱分辨率为4 cm-1,连续扫描32次自动平均[22]。
1.2.4 扫描电子显微镜(SEM)
将超声处理后的KGM溶胶倒入培养皿中预冷冻24 h,取出后进行真空冷冻干燥处理48 h,然后取适量样品固定于贴有导电胶的电镜样品铜台上,喷金处理后送入样品室进行观察,放大倍数分别为60倍和200倍,并选择合适的区域拍照[23]。
1.2.5 数据分析
实验数据均用OriginPro 8、SPSS 17.0进行处理与分析,每组实验均重复3次,结果以平均值±标准偏差表示,以Duncan(D)法(P<0.05)判定其显著性差异。
2 结果与分析
2.1 超声处理对KGM溶胶表观黏度的影响
2.1.1 处理时间对KGM溶胶表观黏度的影响
超声处理前后KGM的黏度均随着剪切速率的增大而降低(如图1),属于剪切变稀行为,表明KGM溶胶属于非牛顿流体,具有假塑性。由图1可知,超声处理0~60 min的KGM溶胶表观黏度下降幅度较小,从120 min起,表观黏度下降幅度较明显;在剪切速率为21.9 s-1时,处理30 min的KGM溶胶表观黏度下降5.6%(P<0.05,下同),处理60 min的KGM溶胶表观黏度下降了12.0%,而处理120 min与240 min的KGM溶胶表观黏度则分别下降了25.6%和 46.3%。这与10 g/L的KGM随着超声时间的增加,其黏度值降低的实验结果相一致[24]。短时超声处理对KGM溶胶黏度的影响不大,而延长超声时间能够显著降低KGM溶胶的黏度,处理时间越长黏度降低越多。这是由于短时超声处理时,只有部分KGM分子网络结构受到破坏,其整体网络结构仍然存在,而随着超声处理时间的增加,KGM分子间作用力削弱,KGM溶胶网络受到越来越严重的破坏,从而使KGM溶胶的表观黏度降低[19, 25]。
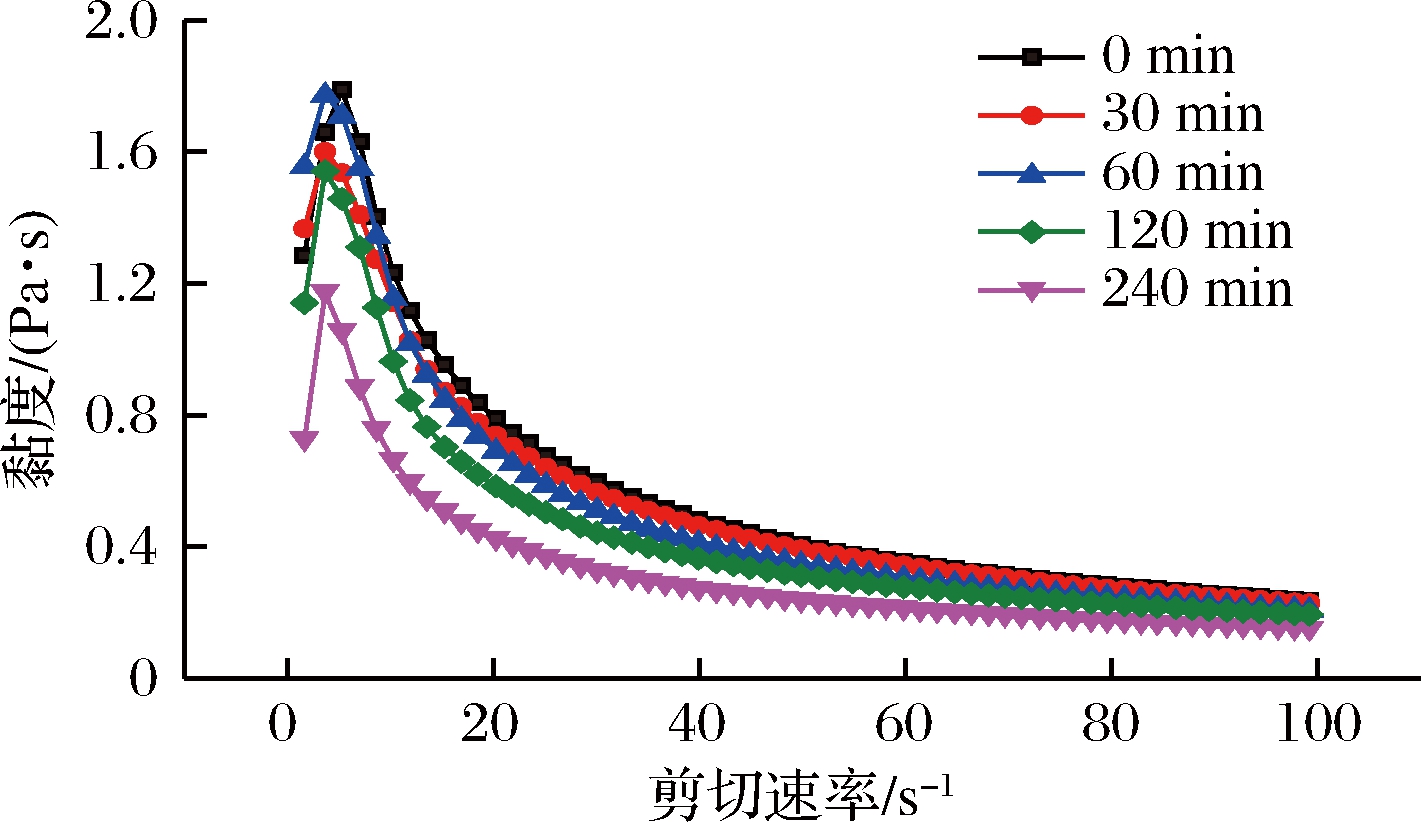
图1 超声时间对KGM溶胶表观黏度的影响
Fig.1 Effect of ultrasonic time treatment on apparent
viscosity of KGM sol
运用幂定律τ=Kγn回归拟合KGM剪切速率与剪切应力数据,稠度系数K、流动指数n、相关系数r2等参数如表1所示。所有r2均在0.965~0.992范围内,表明预测方程均能恰当拟合流变曲线。n在0.273~0.359范围内,均小于1,表明超声处理前后KGM溶胶均为假塑性流体,超声作用并不会改变KGM流体本质[26]。K随着超声时间的增加而减小,超声30、60、120、240 min后,K分别下降了18.4%、18.2%、37.2%和62.5%,这是超声破坏作用延长造成的。KGM溶胀后,大分子通过缠结会形成巨型网络结构,分子间作用力具有一定抵抗外力破坏的作用[27],因此超声30和60 min后KGM稠度系数K变化较小。随着超声时间的增加,KGM完整网络结构被逐步瓦解,因此超声240 min后稠度系数K显著减小[20]。
表1 不同超声时间处理的KGM流变特性拟合参数
Table 1 Fitting parameters of rheological properties
of KGM after different ultrasonic time treatment
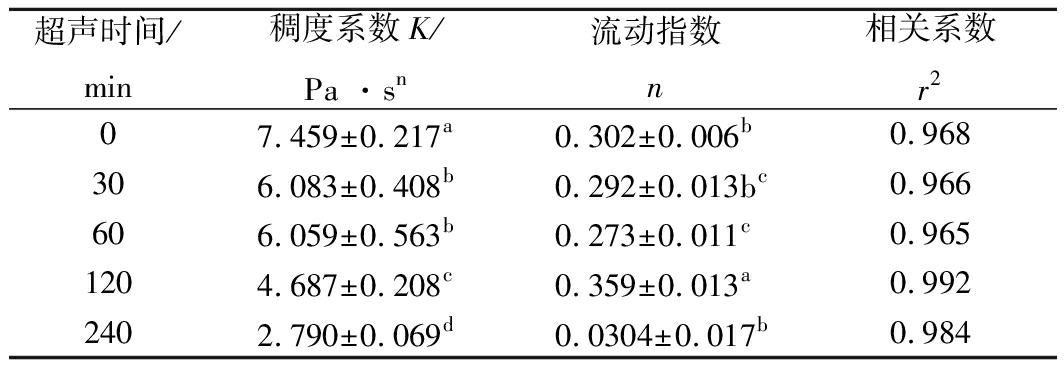
超声时间/min稠度系数K/Pa ·sn流动指数n相关系数r207.459±0.217a0.302±0.006b0.968306.083±0.408b0.292±0.013bc0.966606.059±0.563b0.273±0.011c0.9651204.687±0.208c0.359±0.013a0.9922402.790±0.069d0.0304±0.017b0.984
注:同列不同字母表示各数据间具有显著性差异(P<0.05)(下同)
2.1.2 处理功率对KGM溶胶表观黏度的影响
KGM的表观黏度随着超声功率的增大而降低(如图2),在剪切速率为21.9 s-1时,与未经超声处理的KGM相比,72~144 W超声处理后KGM溶胶的表观黏度下降了24%~28%,180 W超声处理后KGM溶胶的表观黏度则下降了66.1%,下降幅度约为72~144 W处理的两倍。不同功率超声降解冬虫夏草多糖有类似的结果,在51 W/cm2超声处理的冬虫夏草多糖黏度降幅为12 W/cm2的6倍[28]。随着超声功率的增大,溶胶所受的能量增加, “空化”作用加强,当超过临界值时,声压能量大于溶胶的内聚力,溶胶结构则被破坏[29]。这些空化泡破裂时会产生局部高压和剧烈温变,从而达到降低KGM分子量的效果,增强了KGM溶胶的流动性[30]。超声波作为一种机械波通过空化作用[31]将KGM吸水溶胀完全之后形成的紧密网络结构撕裂,并降低KGM分子量,从而使得其黏度降低[32]。当功率为180 W时,KGM网络结构已被严重破坏,溶胶流动性相对较强,因而其表观黏度有较大幅度的降低。
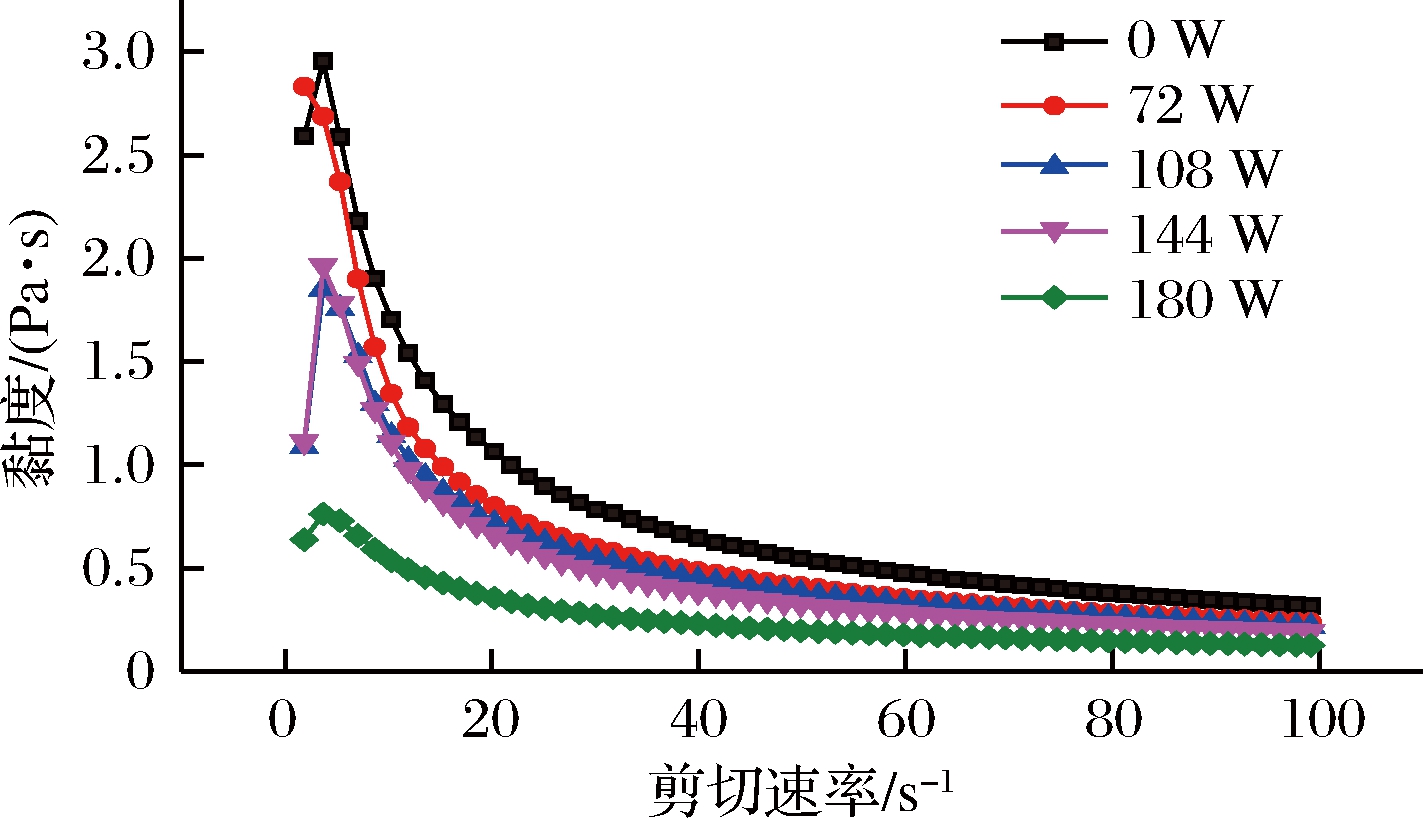
图2 超声功率对KGM溶胶表观黏度的影响
Fig.2 Effect of ultrasonic power treatment on the
apparent viscosity of KGM sol
运用幂定律τ=Kγn回归拟合KGM剪切速率与剪切应力数据,稠度系数K、流动指数n、相关系数r2等参数如表2所示。所有r2均在0.953~0.989范围内,表明预测方程较为准确。n在0.267~0.334范围内变化,均小于1,表明不同超声功率处理后的KGM溶胶也是假塑性流体,其流体本质并未发生改变。K随着超声功率的增加而减小,72、108、144、180 W超声后,K分别下降了12.5%、16.6%、32.6%和52.8%。当超声功率较低时,因超声所形成的空化泡较小,随着功率的增加,空化作用加强,破坏能力也变得更高[33]。因此,在相同作用时间内,使用越高的超声功率处理,KGM网络结构被严重破坏,宏观性质即表现为稠度系数K越小,这与前文黏度变化相一致。
表2 不同超声功率处理的KGM流变特性拟合参数
Table 2 Fitting parameters of rheological properties of
KGM after different ultrasonic power treatment
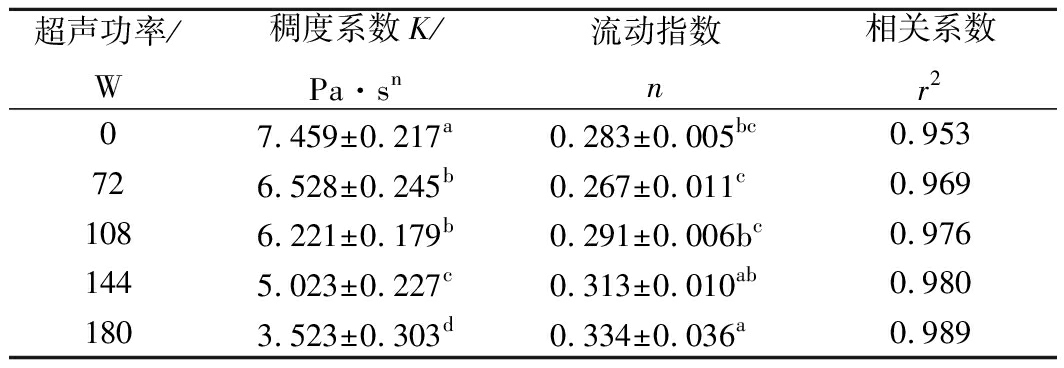
超声功率/W稠度系数K/Pa·sn流动指数n相关系数r207.459±0.217a0.283±0.005bc0.953726.528±0.245b0.267±0.011c0.9691086.221±0.179b0.291±0.006bc0.9761445.023±0.227c0.313±0.010ab0.9801803.523±0.303d0.334±0.036a0.989
2.2 超声处理对KGM溶胶动态黏弹性的影响
2.2.1 处理时间对KGM溶胶动态黏弹性的影响
动态黏弹性是凝胶力学性能的重要评价指标,它包括储能模量(G′)和损耗模量(G″),G′表示凝胶受力作用后变形程度,是衡量弹性的尺度,而G″则表示凝胶受力作用时阻碍物质流动的性质,是衡量黏性的尺度[34]。膜液加工的过程是一个动态变化的过程,动态黏弹性表示的是物质在变形范围内的黏弹性质及其变化规律,可为其产品配方、加工工艺以及设备选择提供参考依据。
不同时间超声处理样品的G′、G″均随着频率的增加而升高(图3)。KGM溶胶在此浓度下,G′总是高于G″,表现出弹性体性质。随着超声处理时间延长, G′和G″都随之降低;在角速度为75.0 rad/s时,与未经超声处理的KGM溶胶相比,超声处理时间为30、60、120、240 min的KGM溶胶的G′分别下降了16.8%、27.4%、39.1%、44.3%,G″则分别下降了15.3%、29.4%、42.9%、55.1%。LIN等[35] 使用超声处理浓度为3%的KGM溶胶,超声时间由8 min增加至15 min后,G′和G″也出现显著下降,与本实验结果相一致。溶胶中的KGM大分子受氢键、范德华力的作用而相互交叠、缠结[36],超声作用初期,主要是KGM大分子长链解聚占主导地位,解聚使得分子链之间的覆盖、交叠、缠结减少,随着超声处理时间的延长,超声波引起的空化作用效果逐渐加强,长分子链断裂,分子量降低,相对滑动变得容易,分子间的阻力也变小[37-38],因而KGM溶胶的流动性也增强,表现为动态黏弹性的降低。这与静态剪切中表观黏度随着剪切速率的增加而降低是一致的。

a-储能模量(G′);b-损耗模量(G″)
图3 超声时间对KGM溶胶动态黏弹性的影响
Fig.3 Effect of ultrasonic time treatment on the
dynamic viscoelasticity of KGM sol
2.2.2 处理功率对KGM溶胶动态黏弹性的影响
不同功率超声处理对KGM的黏弹性具有显著影响,呈现出超声功率越大其黏弹性越低的趋势(图4)。随着超声处理功率的增加, G′和G″都随之降低;在角速度为75.0 rad/s时,与未经超声处理的KGM溶胶相比,超声功率为72、108、144、180 W的KGM溶胶的G′分别下降了20.0%、26.3%、35.2%、43.2%, G″则分别下降了21.6%、30.6%、27.1%、41.0%。超声功率较小时,空化过程是稳态空化,空化泡的振动幅度变化较小,随着超声功率的增大,空化泡的运动加剧,振动幅度变大,此时,空化过程便会由稳态空化转变为瞬态空化,加强空化效应[39]。由G′与G″随频率变化的曲线可以看出,108 W与144 W对KGM溶胶的作用效果较为相似,这有可能就是正处于稳态空化向瞬态空化转变的过渡时期。随着功率的增加,KGM溶胀形成的致密网格结构在一定程度上被破坏,KGM大分子的缠结点发生解缠作用,当外力作用时,分子链之间更容易发生相对滑动,即分子流动性增加[40],故在动态黏弹性测试中表现为G′与G″降低。
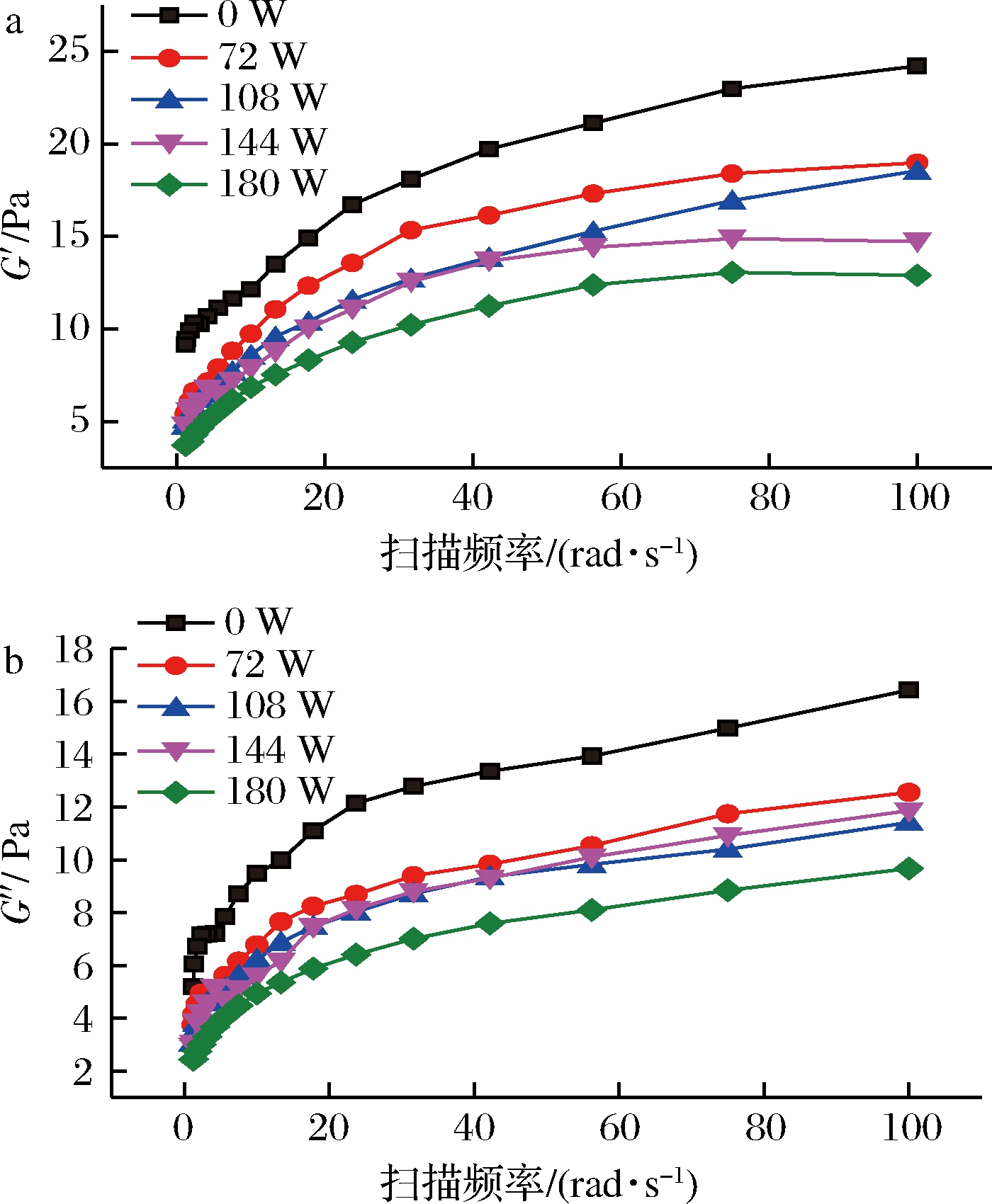
a-储能模量(G′);b-损耗模量(G″)
图4 超声功率对KGM溶胶动态黏弹性的影响
Fig.4 Effect of ultrasonic power treatment on the
dynamic viscoelasticity of KGM sol
2.3 不同超声处理下KGM的FT-IR表征分析
如图5所示,在3 424 cm-1(PK1)处有较宽的吸收峰,为O—H的振动,即KGM中含有大量的羟基(—OH),2 925 cm-1(PK2)处出现的吸收峰是烷基C—H的伸缩振动,1 641 cm-1(PK3)附近出现C![]() O的吸收峰,1 030 cm-1(PK4)附近出现C—O—C的不对称伸缩振动,而魔芋葡甘聚糖的甘露糖特征吸收峰则在870 cm-1(PK5)处[41]。
O的吸收峰,1 030 cm-1(PK4)附近出现C—O—C的不对称伸缩振动,而魔芋葡甘聚糖的甘露糖特征吸收峰则在870 cm-1(PK5)处[41]。
由图5可知,KGM的特征吸收峰没有发生明显位移或峰面积的改变,即超声对KGM分子的重复结构单元及功能基团并无影响。YAN等[42]在研究中也发现,超声处理并不会改变海雀菌丝体多糖的一级结构。TANG等[43]探索了超声对青钱柳中多糖的影响,采用FT-IR检测多糖结构发现超声处理前后的结构并无差异。由表3可以看出,超声处理前后KGM的PK2、PK3、PK4、PK5峰值并未发生明显变化,而主要的变化是发生在PK1上,超声处理30、60、120、240 min后,PK1分别由3 424 cm-1变为3 407、3 408、3 401、3 392 cm-1,而超声72、108、144和180 W处理后,PK1分别为3 409、3 402、3 399、3 392 cm-1。
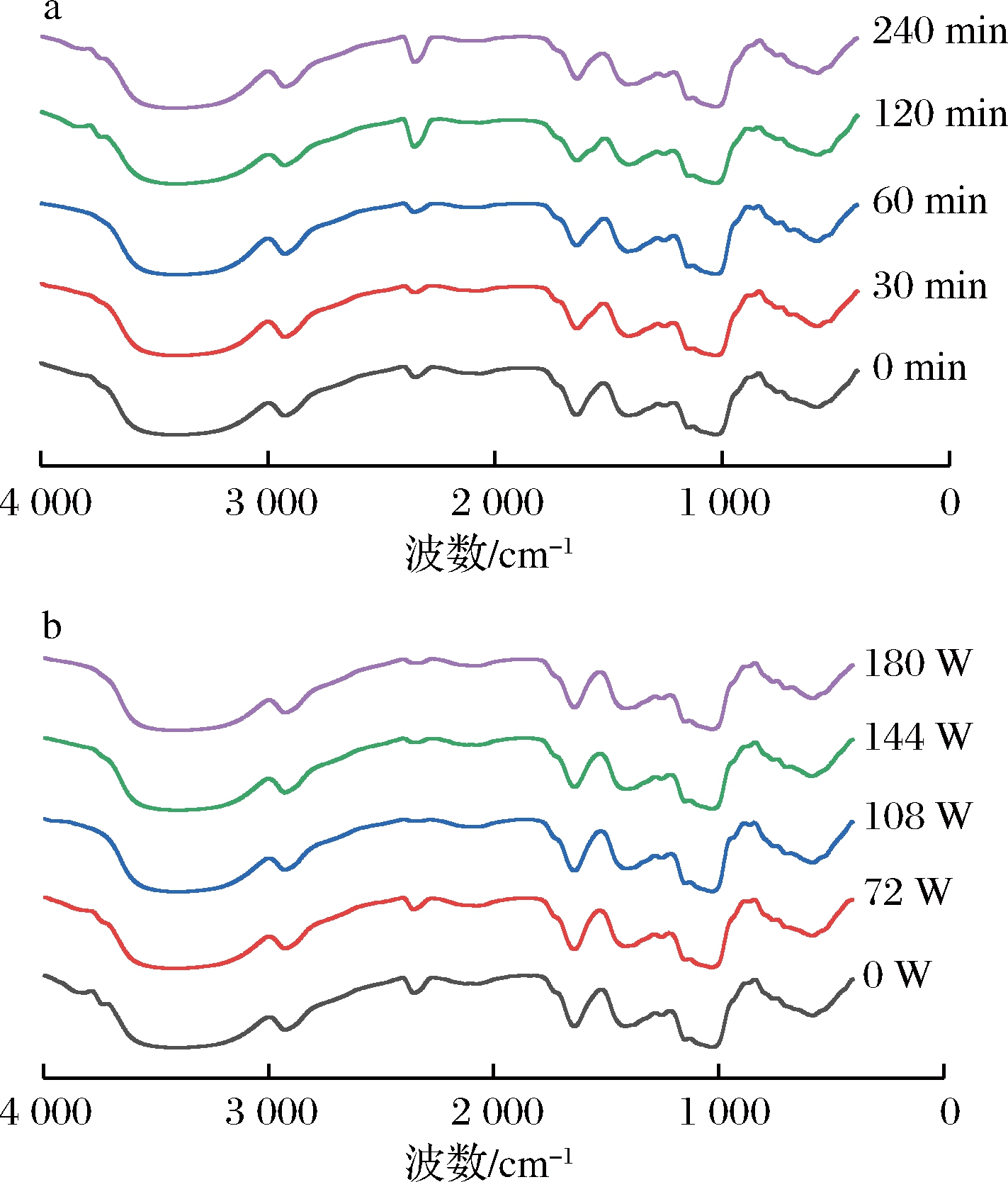
图5 不同超声时间(a)、功率(b)处理后的KGM的
傅里叶红外光谱图
Fig.5 FT-IR spectra of KGM after different ultrasonic
time(a) and power(b) treatment
表3 不同超声处理后KGM红外部分重要峰值数据
Table 3 Some important peak data of KGM after
different ultrasonic treatment

超声条件峰值/cm-1PK1PK2PK3PK4PK50 min3 4242 9251 6411 03086930 min3 4072 9241 6411 02986960 min3 4082 9251 6411 029867120 min3 4012 9251 6391 030866240 min3 3922 9241 6391 02886872 W3 4092 9261 6421 031866108 W3 4022 9271 6411 032866144 W3 3992 9251 6411 030867180 W3 3922 9251 6411 030868
随着超声时间或超声功率的增加,氢键特征峰出现在波数越小的位置,其中超声240 min和180 W作用后变化最为显著,下降比例均为0.93%。这与前文黏度和动态黏弹性在长时间、高功率超声处理时的变化趋势相似。KGM流变性质的改变是由其分子间的氢键被超声破坏,分子构象发生改变, KGM分子流动性变强导致的[20, 44]。
2.4 超声处理对KGM溶胶微观结构的影响
2.4.1 处理时间对KGM溶胶微观结构的影响
未经超声处理过的KGM溶胶(如图6-a、f)的微观结构呈现出较完整的薄壁状,且排列相对致密、有序、平整;超声处理时间较短(30、60 min)的KGM的微观结构未有明显变化,但边缘开始卷曲,薄壁状结构也有所弯折(如图6-b、g、c、h);随着超声时间的进一步延长,超声120 min的KGM的薄壁状结构被破坏,卷曲、翻折加重,逐渐变成混乱无序的状态(如图6-d、i);由图6-e、j可以明显看出,超声240 min后,KGM溶胶原本较为完整的薄壁已经被严重破坏,出现较大直径的孔洞,结构变得稀疏、无序。这与前面流变性质的改变是一致的,未经超声处理的KGM形成的网格结构较完整,大面积的连续结构导致了相当高的分子间内摩擦力[45],因而表观黏度高,随着处理时间延长,KGM分子链之间的氢键被破坏,分子链之间的缠结减少,从而表现出表观黏度和动态黏弹性的减低。

a-0 min;b-30 min;c-60 min;d-120 min;e-240 min;
f-0 min;g-30 min;h-60 min;i-120 min;j-240 min
a、b、c、d、e放大倍数为×60;f、g、h、i、 j放大倍数为×200,下同
图6 不同超声时间处理后KGM的SEM图
Fig.6 SEM of KGM after different ultrasonic time treatment
2.4.2 处理功率对KGM溶胶微观结构的影响
超声功率越大,空化作用越强,KGM分子链在水溶液中形成的氢键和范德华力受到的破坏越严重。图7-a、f为未经超声处理的KGM溶胶,其微观结构呈现出紧密连接且较完整的薄壁状;图7-b、g、c、h为相对较低的超声功率(72、108 W)处理后的KGM溶胶,其微观结构没有过于明显的改变,但可以看出薄壁状结构已开始有部分折叠和卷曲;随着超声功率的增加,薄壁状结构边缘卷曲加重,同一平面内的连续结构大面积断裂,薄壁上开始出现更多的孔洞(如图7-d、i)。180 W超声处理后的KGM网络结构已被完全破坏,由相对连续、平整变得断裂、卷曲、松散(如图7-e、j)。超声功率越强,其卷曲、皱缩程度越高,这与前面流变性质的改变是一致的,由于超声波将KGM分子链间的氢键破坏,分子链的缠结减少,凝胶网络结构变得松散,从而表观黏度和动态黏弹性随之下降。

a-0 W;b-72 W;c-108 W;d-144 W;e-180 W;
f-0 W;g-72 W;h-108 W;i-144 W;j-180 W
图7 不同超声功率处理后KGM的SEM图
Fig.7 SEM of KGM after different ultrasonic power treatment
3 结论
KGM溶胶经超声处理后可使表观黏度下降,且表观黏度随超声时间和超声功率的增加而降低;超声时间越长、超声功率越大,G′和G″越小。超声能够使KGM溶胶的连续结构发生折叠和卷曲,出现较大的孔洞,甚至变得稀疏且复杂无序。但由FT-IR结果可知,超声对KGM分子的重复结构单元和功能基团并不会造成影响,超声主要是通过作用于KGM氢键部分来改变KGM的黏度及动态黏弹性。因此,超声技术可作为一种改善KGM流动性的有效手段。超声处理后KGM溶胶黏度较低,可应用于护肤产品中,减少产品沉积、便于拿取、涂抹过程也更易匀开;添加于饮料或酸奶中,可提高产品稳定性、改善产品口感、还能减少黏瓶现象。虽然超声能够提高KGM的流动性,使其更便于加工利用,但超声对KGM生物活性和营养特性等方面的影响还有待进一步研究。
[1] 魏恩慧, 吴继红, 刘冰, 等. 魔芋葡甘聚糖的性质及在食品中的应用[J]. 食品工业, 2016, 37(5): 239-242.
[2] HUANG L, TAKAHASHI R, KOBAYASHI S, et al. Gelation behavior of native and acetylated konjac glucomannan[J]. Biomacromolecules, 2002, 3(6): 1 296-1 303.
[3] BEHERA S S, RAY R C. Konjac glucomannan, a promising polysaccharide of Amorphophallus konjac K. Koch in health care[J]. International Journal of Biological Macromolecules, 2016, 92: 942-956.
[4] ONAKPOYA I, POSADZKI P, ERNST E. The efficacy of glucomannan supplementation in overweight and obesity: a systematic review and meta-analysis of randomized clinical trials[J]. Journal of the American College of Nutrition, 2014, 33(1): 70-78.
[5] CHUA M, BALDWIN T C, HOCKING T J, et al. Traditional uses and potential health benefits of Amorphophallus konjac K. Koch ex N.E.Br[J]. Journal of Ethnopharmacology, 2010, 128(2): 268-278.
[6] PAN T, PENG S, XU Z, et al. Synergetic degradation of konjac glucomannan by γ-ray irradiation and hydrogen peroxide[J]. Carbohydrate Polymers, 2013, 93(2): 761-767.
[7] ZHAO X, LI J, JIN W, et al. Preparation and characterization of a novel pH-response dietary fiber: Chitosan-coated konjac glucomannan[J]. Carbohydrate Polymers, 2015, 117: 1-10.
[8] JIAN W, TU L, WU L, et al. Physicochemical properties and cellular protection against oxidation of degraded Konjac glucomannan prepared by gamma-irradiation[J]. Food Chemistry, 2017, 231: 42-50.
[9] YEH S L, LIN M S, CHEN H L. Partial hydrolysis enhances the inhibitory effects of konjac glucomannan from Amorphophallus konjac C. Koch on DNA damage induced by fecal water in Caco-2 cells[J]. Food Chemistry, 2010, 119(2): 614-618.
[10] ZHENG Q, WU Y, XU H, et al. Immune responses to Aeromonas hydrophila infection in Schizothorax prenanti fed with oxidized konjac glucomannan and its acidolysis products[J]. Fish & Shellfish Immunology, 2016, 49: 260-267.
[11] LIU R, LI Y, ZHANG B. The effects of konjac oligosaccharide on TNBS-induced colitis in rats[J]. International Immunopharmacology, 2016, 40: 385-391.
[12] AL-GHAZZEWI F, TESTER R, ALVANI K, et al. The use of konjac glucomannan hydrolysates (GMH) to improve the health of the skin and reduce acne vulgaris[J]. Journal of Neuroscience Research, 2013, 64(5): 476-486.
[13] JIANG M, LI H, SHI J S, et al. Depolymerized konjac glucomannan: preparation and application in health care[J]. Journal of Zhejiang University-SCIENCE B (Biomedicine & Biotechnology), 2018, 19(7): 505-514.
[14] ASHOKKUMAR M. Applications of ultrasound in food and bioprocessing[J]. Ultrasonics Sonochemistry, 2015, 25: 17-23.
[15] TAO Y, SUN D W. Enhancement of food processes by ultrasound: a review[J]. Critical Reviews in Food Science and Nutrition, 2015, 55(4): 570-594.
[16] ZHANG L, YE X, DING T, et al. Ultrasound effects on the degradation kinetics, structure and rheological properties of apple pectin[J]. Ultrasonics Sonochemistry, 2013, 20(1): 222-231.
[17] LI R, FEKE D L. Rheological and kinetic study of the ultrasonic degradation of xanthan gum in aqueous solution: effects of pyruvate group[J]. Carbohydrate Polymers, 2015, 124: 216-221.
[18] LI R, FEKE D L. Rheological and kinetic study of the ultrasonic degradation of locust bean gum in aqueous saline and salt-free solutions[J]. Ultrasonics Sonochemistry, 2015, 27: 334-338.
[19] LI J, LI B, GENG P, et al. Ultrasonic degradation kinetics and rheological profiles of a food polysaccharide (konjac glucomannan) in water[J]. Food Hydrocolloids, 2017, 70: 14-19.
[20] YIN J Y, MA L Y, SIU K C, et al. Effects of ultrasonication on the conformational, microstructural, and antioxidant properties of konjac glucomannan[J]. Applied Sciences, 2019, 9(3): 461.
[21] DU X, LI J, CHEN J, et al. Effect of degree of deacetylation on physicochemical and gelation properties of konjac glucomannan[J]. Food Research International, 2012, 46(1): 270-278.
[22] GONG J, WANG L, WU J, et al. The rheological and physicochemical properties of a novel thermosensitive hydrogel based on konjac glucomannan/gum tragacanth[J]. LWT-Food Science and Technology, 2019, 100: 271-277.
[23] LUO P, NIE M, WEN H, et al. Preparation and characterization of carboxymethyl chitosan sulfate/oxidized konjac glucomannan hydrogels[J]. International Journal of Biological Macromolecules, 2018, 113: 1 024-1 031.
[24] 黄永春, 谢清若, 马月飞, 等. 超声波降解魔芋葡苷聚糖的研究[J]. 食品科技, 2006, 27(9): 103-105.
[25] LIN W, NI Y, WANG L, et al. Physicochemical properties of degraded konjac glucomannan prepared by laser assisted with hydrogen peroxide[J]. International Journal of Biological Macromolecules, 2019, 129: 78-83.
[26] ZHU B, XIN C, LI J, et al. Ultrasonic degradation of konjac glucomannan and the effect of freezing combined with alkali treatment on their rheological profiles[J]. Molecules, 2019, 24(10): 1 860
[27] XIN C, CHEN J, LIANG H, et al. Confirmation and measurement of hydrophobic interaction in sol-gel system of konjac glucomannan with different degree of deacetylation[J]. Carbohydrate Polymers, 2017, 174: 337-342.
[28] WANG Z M, CHEUNG Y C, LEUNG P H, et al. Ultrasonic treatment for improved solution properties of a high-molecular weight exopolysaccharide produced by a medicinal fungus[J]. Bioresource Technology, 2010, 101(14): 5 517-5 522.
[29] LIU L, JIA W, XU D, et al. Applications of ultrasonic cutting in food processing[J]. Journal of Food Processing and Preservation, 2015, 39(6): 1 762-1 769.
[30] 徐力克, 邓慧萍, 史俊. 超声波降解有机物机理及其应用研究[J]. 环境科学与技术, 2010, 33(S2): 416-419;467.
[31] 李坚斌, 李琳, 李冰, 等. 超声降解多糖研究进展[J]. 食品工业科技, 2006, 27(9): 181-184.
[32] PAN Z, HE K, WANG Y. Deacetylation of konjac glucomannan by mechanochemical treatment[J]. Journal of Applied Polymer Science, 2008, 108(3): 1 566-1 573.
[33] LI Y, XIANG D, WANG B, et al. Oil-in-water emulsions stabilized by ultrasonic degraded polysaccharide complex[J]. Molecules, 2019, 24(6): 1 097
[34] NI X W, WANG K, WU K, et al. Stability, microstructure and rheological behavior of konjac glucomannan-zein mixed systems[J]. Carbohydrate Polymers, 2018, 188: 260-267.
[35] LIN K W, HUANG C Y. Physicochemical and textural properties of ultrasound-degraded konjac flour and their influences on the quality of low-fat Chinese-style sausage[J]. Meat Science, 2008, 79(4): 615-622.
[36] MAO C F, CHEN C H. A kinetic model of the gelation of konjac glucomannan induced by deacetylation[J]. Carbohydrate Polymers, 2017, 165: 368-375.
[37] 陈峰, 钱和. 超声波降解魔芋葡甘露聚糖工艺的响应面优化[J]. 食品工业科技, 2008, 29(1): 146-148;152.
[38] PRAWITWONG P, TAKIGAMI S, PHILLIPS G O. Effects of γ-irradiation on molar mass and properties of konjac mannan[J]. Food Hydrocolloids, 2007, 21(8): 1 362-1 367.
[39] 刘迎. 超声作用对聚丙烯及其复合材料结构与性能影响的研究[D]. 上海: 华东理工大学, 2016.
[40] JIN W, XU W, LI Z, et al. Degraded konjac glucomannan by γ-ray irradiation assisted with ethanol: preparation and characterization[J]. Food Hydrocolloids, 2014, 36: 85-92.
[41] LI B, LI J, XIA J, et al. Effect of gamma irradiation on the condensed state structure and mechanical properties of konjac glucomannan/chitosan blend films[J]. Carbohydrate Polymers, 2011, 83(1): 44-51.
[42] YAN J K, WANG Y Y, MA H L, et al. Ultrasonic effects on the degradation kinetics, preliminary characterization and antioxidant activities of polysaccharides from Phellinus linteus mycelia[J]. Ultrasonics Sonochemistry, 2016, 29: 251-257.
[43] TANG W, LIN L, XIE J, et al. Effect of ultrasonic treatment on the physicochemical properties and antioxidant activities of polysaccharide from Cyclocarya paliurus[J]. Carbohydrate Polymers, 2016, 151: 305-312.
[44] FU L, CHEN H, DONG P, et al. Effects of ultrasonic treatment on the physicochemical properties and DPPH radical scavenging activity of polysaccharides from mushroom Inonotus obliquus[J]. Journal of Food Science, 2010, 75(4): C322-C327.
[45] LUO X, HE P, LIN X. The mechanism of sodium hydroxide solution promoting the gelation of konjac glucomannan (KGM)[J]. Food Hydrocolloids, 2013, 30(1): 92-99.