多酚类化合物是一类苯环上连接多羟基基团结构的天然产物的总称[1],在植物界中大量存在。多种研究表明,多酚类化合物具有抗氧化、抗变应性、抗菌、抗炎、抗肿瘤、抗糖尿病、抗病毒等一系列生理活性[2],对人体健康有多种益处[3-4]。经研究证实,多酚类化合物中多羟基结构能结合蛋白质、多糖、金属、微生物、生物碱等多种物质[5-7],通过结合改变其功能性质,从而被广泛应用于医药研究、食品生产、皮革生产、油田化学等研究领域[8]。近年来,多酚与蛋白质的相互作用是多酚化学以及食品化学的核心内容,已有研究发现,多酚与蛋白质的相互作用方式主要包括二硫键、疏水相互作用、氢键等,相互作用使得多酚与蛋白质都会发生不同程度的结构改变,从而导致多酚生物可利用性、蛋白质功能特性等的改变[9],对两者在更多领域的应用提供了新的思路和理论基础。
血清白蛋白是体内的载体蛋白,多酚等生物小分子被人体摄入后, 首先与蛋白结合, 然后再发挥作用[10-11]。因此,了解多酚与蛋白的相互作用对更好发挥两者的生理活性有着重要意义[12]。近年来,已有多种研究表明,茶多酚能与大豆分离蛋白相结合,从而改善大豆分离蛋白的起泡性与乳化性[13];姜黄素可与血清白蛋白结合从而应用于临床药物配制[14];花青素与蛋白质分子结合,可有效减缓自身氧化进程,增加自身稳定性[15]。
异荭草素(isoorientin, ISO),由于从荭草中分离得到而命名,别名为3’,4’,5, 7-四羟基-6-C-吡喃葡萄糖基多酚或木犀草素葡萄糖苷[16],是一种水溶性多酚类物质,存在于山楂、竹茹、葫芦果、荞麦芽、黄荆和竹叶[17-18]、满天星等多种植物中。异荭草素还具有多种生理功效,如:通过清除自由基来抵抗氧化损伤,治疗糖尿病[19],抑制炎性疾病,抗肿瘤,抗病毒[20]。
安石榴苷(punicalagin)可从石榴的皮里提取,这种活性成分对人体有诸多益处,例如:抗氧化[21]、抗炎、抗菌等[22]。安石榴苷可在人体内被分解为鞣花酸,鞣花酸具有良好的抗氧化性,另外,鞣花酸(ellagic acid, EA)是一种多酚二内酯,具有抗氧化的作用,以及具有抗变异原性、抑制癌细胞增值的作用[23]。
目前,虽然异荭草素、安石榴苷以及鞣花酸均由于其优良的功能活性而引起学者们广泛的兴趣,但是,并没有此3种多酚与BSA相互作用的研究。因此,本实验采用荧光光谱法、同步荧光光谱法、圆二色谱法等多种测量方法,通过计算猝灭常数、结合常数、结合位点和热力学参数来判断猝灭类型、作用力类型,研究异荭草素、安石榴苷、鞣花酸与BSA的结合,为更深入研究多酚类物质的体内代谢和转运提供有价值的信息。
1 材料与方法
1.1 材料与试剂
鞣花酸、异荭草素、安石榴苷牛血清蛋白(纯度≥97%),上海永恒生物技术有限公司;多酚储备液:称取一定量的多酚,溶解于甲醇溶液并定容,配制成1.0×10 mmol/L的储备液,置于4 ℃冰箱避光保存,使用时按需要稀释;BSA储备液:称取一定量的BSA,溶于PBS缓冲液中并定容,配制成0.01 mmol/L的母液,并添加终浓度为0.1 mol/L的NaCl 以维持离子强度;PBS(磷酸盐缓冲液):将PBS粉末溶于水中并定容,用酸度计调节pH至7.4,121 ℃高压蒸汽灭菌30 min,室温保存备用。
1.2 仪器与设备
电子分析天平(BS 224 S),赛多利斯科学仪器(北京)有限公司;紫外分光光度计(UV300),上海仪迈仪器科技有限公司;电热恒温水浴锅(HH-S4),北京科伟永兴仪器有限公司;荧光分光光度计(RF-6000),岛津企业;红外光谱仪(Tensor27),德国布鲁克公司;圆二色谱仪(Chirascan),英国应用光物理公司;荧光分光光度计(RF-7000),岛津企业。
1.3 实验方法
1.3.1 紫外光谱法测定多酚与BSA的相互作用
取3组10 mL离心管,在离心管中分别加入BSA和不同体积的多酚稀释溶液, 最后以PBS缓冲溶液定容,使多酚的终浓度分别为0、2、3、4 μmol/L,BSA终浓度为1 μmol/L。充分混匀后,将混合溶液置于25 ℃下恒温水浴20 min,扫描范围:200~450 nm。
1.3.2 荧光光谱法测定多酚与BSA的相互作用
在10 mL离心管中分别加入BSA和不同体积的多酚稀释液,以PBS缓冲溶液定容,使多酚的终浓度分别为0、2、3、4、5、6、7、8、9和10 μmol/L,BSA终浓度为1 μmol/L。每种多酚配制2组溶液,充分混匀后,将第1组混合溶液于0 ℃恒温水浴20 min,将第2组混合溶液于25 ℃恒温水浴20 min,3种多酚的处理方法均是如此。多酚和BSA的检测条件如下:激发波长为285 nm,激发和发射光谱狭缝宽度均为10 nm, 扫描范围:300~450 nm的发射光谱。
1.3.3 圆二色光谱法测定多酚与BSA的相互作用
取3支10 mL的离心管,在离心管中分别添加 BSA溶液中和不同体积的稀释过的多酚溶液,使多酚溶液的终浓度分别为0、1、10 μmol/L,BSA终浓度为1.0×10 μmol/L,混合充分后静置20 min。以相应空白溶液为参比,3种多酚的处理方法均是如此,它们的测量条件如下:分辨率1 nm,狭缝1 nm,步长1 nm,灵敏度为5 m°/cm。
1.3.4 红外光谱法测定多酚与BSA的相互作用
于10 mL离心管中,分别配制1 μmol/L的BSA溶液、10 μmol/L的多酚溶液,以及BSA多酚混合溶液,使混合溶液的BSA终浓度为1 μmol/L、多酚终浓度为10 μmol/L,室温下静置20 min,以KBr为空白,利用液膜法分别记录以上溶液的红外光谱,分辨率为4 cm-1,采集范围为1 000~2 000 cm-1,3种多酚的处理方法相同。
1.3.5 同步荧光法测定多酚与BSA的相互作用
BSA和多酚溶液作用的处理方法同1.3.2,测量时需设置激发波长为285 nm,Δλ分别为15和60 nm,激发光谱和发射光谱狭缝宽度均为10 nm,扫描范围:300~450 nm。
2 结果与分析
2.1 紫外光谱法研究3种多酚与BSA的相互作用
蛋白质的色氨酸和酪氨酸残基约在280 nm具有吸收峰,蛋白质与小分子物质结合后构象发生改变,可用紫外光谱法研究小分子与BSA如何相互作用[24]。
本试验固定BSA的浓度,观察不同浓度多酚与BSA的紫外吸收光谱,结果如图1所示。随着异荭草素浓度的增加,BSA的吸收峰分别从273 nm移至267 nm,发生蓝移,随着安石榴苷、鞣花酸浓度的增加,BSA的吸收峰分别从273 nm移至275和274 nm,有微弱红移,说明3种多酚都改变了BSA的构象。因为动态猝灭不改变蛋白质的吸收光谱,而静态猝灭可以改变[25]。因此,结果说明异荭草素、安石榴苷、鞣花酸与BSA相互作用后形成了新的复合物,改变了BSA的吸收光谱,且异荭草素、安石榴苷、鞣花酸对BSA的荧光猝灭为静态猝灭。
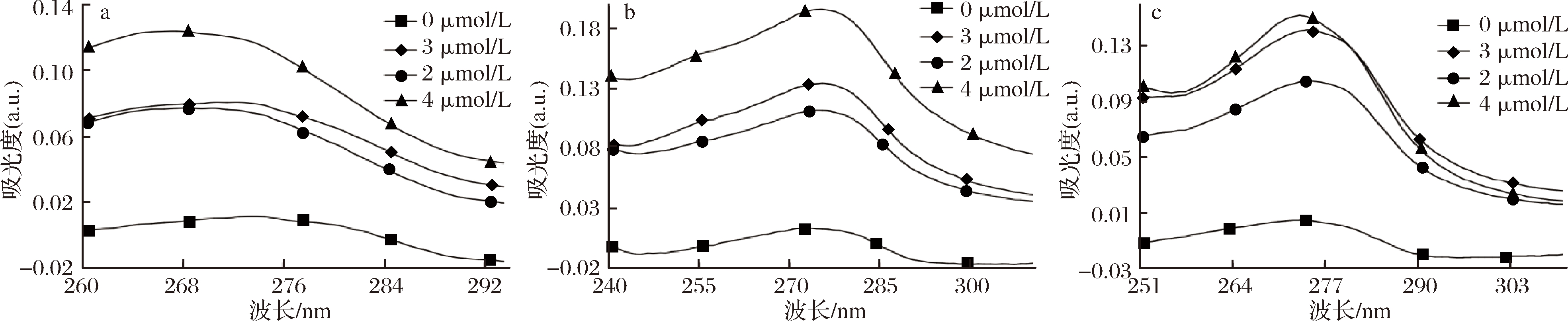
a-异荭草素+BSA;b-安石榴苷+BSA;c-鞣花酸+BSA
图1 异荭草素、安石榴苷、鞣花酸与BSA结合的紫外光谱图
Fig.1 Ultraviolet-visible spectrum of interaction between isoorientin, punicalagin, ellagic acid and BSA
2.2 荧光光谱法研究3种多酚与BSA的相互作用
蛋白质分子中的色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)3种芳香族氨基酸残基能够吸收紫外光并发射荧光,当发生分子相互作用、激发态反应、分子重排、能量转移、形成基态复合物以及碰撞猝灭时,荧光发色团的荧光强度下降,因此,研究小分子物质与蛋白质之间的相互作用时常用荧光光谱法[26]。本研究对一系列含有相同浓度BSA和不同浓度多酚的溶液进行荧光光谱测定,结果如图2所示。BSA溶液在约340 nm处有一发射峰,但随着多酚浓度的增加,BSA发射峰的荧光强度在0 ℃和25 ℃两种处理温度下均呈现降低的趋势,这种荧光猝灭现象,说明3种多酚和BSA均发生相互作用,并形成弱荧光的多酚-BSA复合物。
2.2.1 猝灭类型的确定
静态猝灭和动态猝灭2种猝灭机制是多酚等小分子物质和蛋白质的主要猝灭机制,二者的区别在于对温度和黏度的依赖性不同。静态猝灭是指多酚与BSA形成无荧光或弱荧光的复合物而导致的,猝灭常数随着温度的升高而降低;而动态猝灭是多酚和蛋白质分子之间相互碰撞引起的,猝灭常数随着温度升高而增大。分析多酚等小分子物质和蛋白质的荧光猝灭机制时采用Stern-Volmer方程[27]:
F0/F=1+KsvQ=1+Kqτ0Q
(1)
式中:F0和F,代表异荭草素等多酚不存在时和浓度为Q时BSA的荧光强度;Ksv,动态猝灭常数;Q,多酚的浓度;Kq,猝灭速率常数;τ0,猝灭剂不存在时生物大分子的平均寿命,约为10-8s[28]。
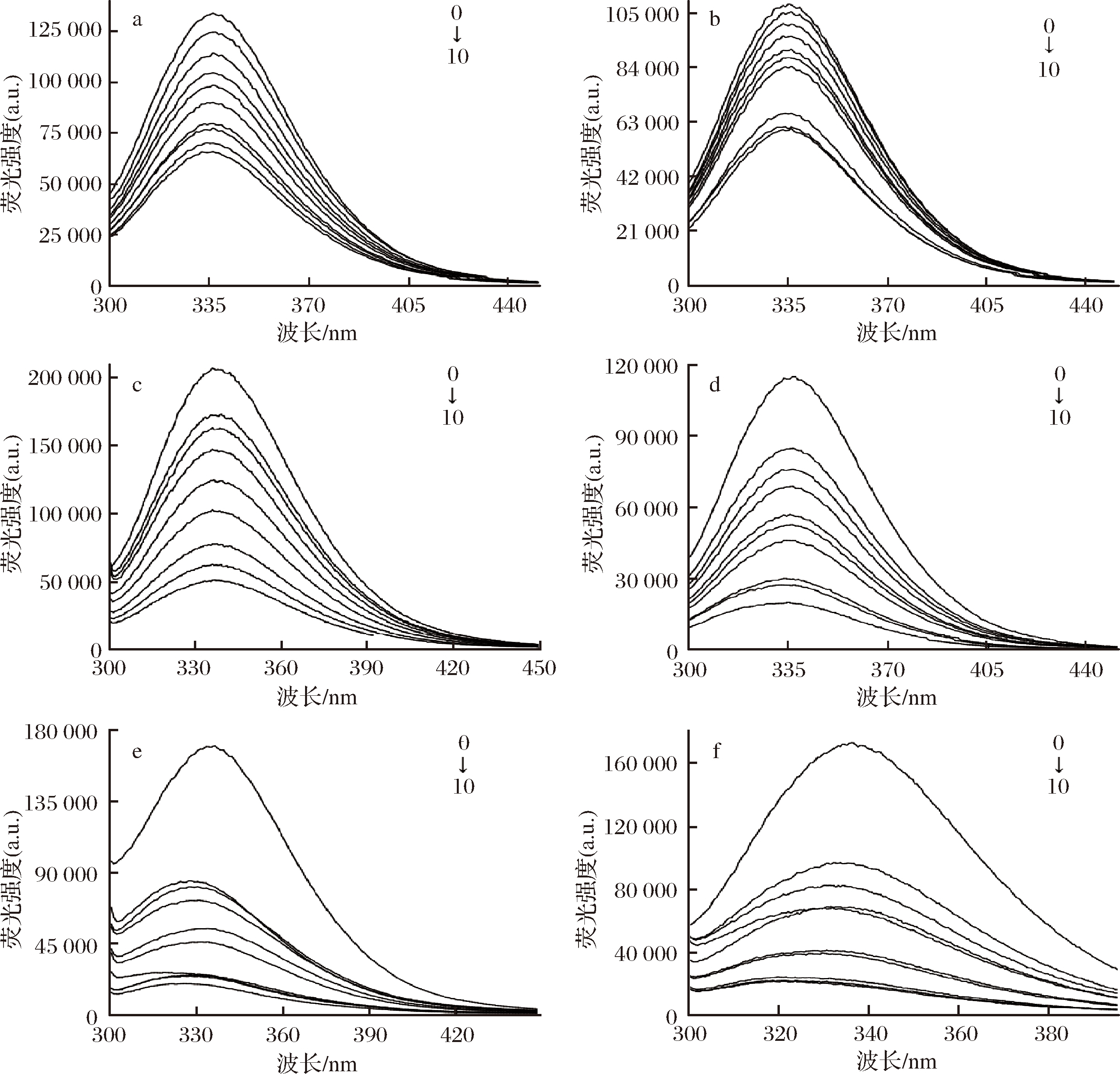
a-异荭草素+BSA(0 ℃);b-异荭草素+BSA(25 ℃); c-安石榴苷+BSA(0 ℃);d-安石榴苷+BSA(25 ℃)
e-鞣花酸+BSA(0 ℃);f-鞣花酸+BSA(25 ℃)
图2 三种多酚与牛血清蛋白结合的荧光光谱图
Fig.2 Fluorescence spectra of three polyphenols combined with BSA
注:多酚浓度从0到10依次为0、2、3、4、5、6、7、8、9、10 μmol/L,BSA浓度为1 μmol/L
根据数据绘制不同温度、不同多酚条件下的Stern-Volmer图,如图3所示。
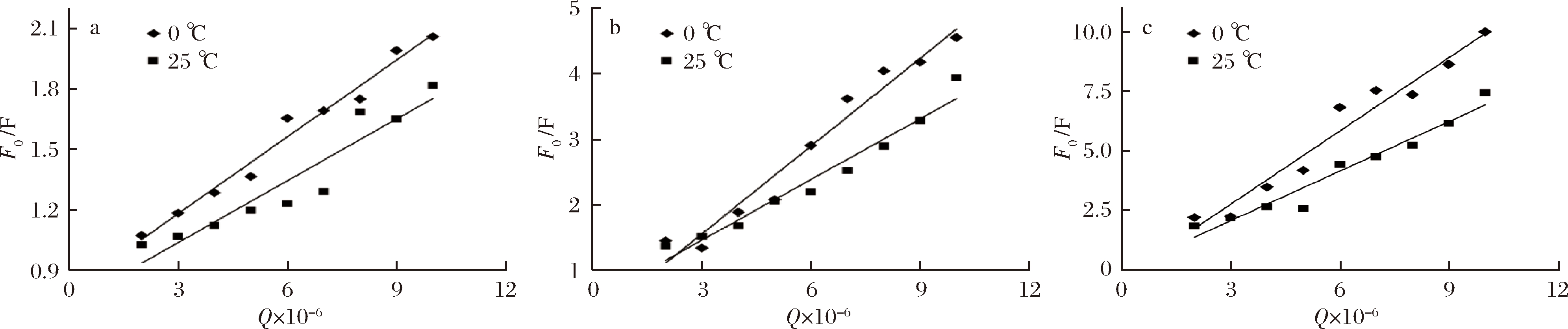
a-异荭草素+BSA;b-安石榴苷+BSA;c-鞣花酸+BSA
图3 0、25℃下3种多酚和牛血清蛋白相互作用的Stern-Volmer图
Fig.3 Stern-Volmer figures of three polyphenols under 0,25 ℃ and bovine serum albumin interaction
由图3可见,在3种多酚作用范围内的曲线具有良好的线性关系。由表1可见,随着处理温度的升高,Ksv值却随之下降,提示3种多酚和BSA相互作用的猝灭机制可能均是静态猝灭而不是动态猝灭。另外,各类猝灭剂对生物大分子的最大扩散碰撞猝灭常数2.0×1010 mol/(L·s)[29],而表1显示,0和25 ℃下BSA的猝灭速率常数Kq分别为3.590×1012、1.277×1012、22.241×1012、18.244×1012、58.421×1012和40.605 ×1012 L/(mol·s),均远高于2.0×1010 mol/(L·s)。该结果进一步揭示,异荭草素、安石榴苷以及鞣花酸对BSA的荧光猝灭均是静态猝灭。
表1 三种多酚和牛血清白蛋白相互作用的Stern-Volmer
猝灭常数
Table 1 Stern-Volmer quenching constants for the
interaction of ISO, punicalagin, EA with BSA
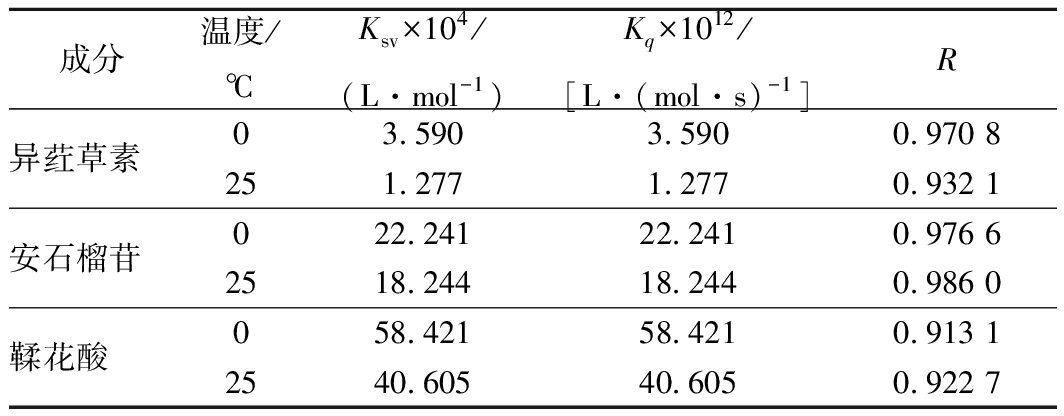
成分温度/℃Ksv×104/(L·mol-1)Kq×1012/[L·(mol·s)-1]R异荭草素03.5903.5900.970 8251.2771.2770.932 1安石榴苷022.24122.2410.976 62518.24418.2440.986 0鞣花酸058.42158.4210.913 12540.60540.6050.922 7
2.2.2 结合常数和结合位点的计算
上述结果表明异荭草素、安石榴苷、鞣花酸与牛血清蛋白的相互作用机制为静态猝灭,静态猝灭现象符合双对数公式,可通过双对数公式进一步来分析静态猝灭:
lg[(F0-F)/F]=lgKa+nlgQ
(2)
式中:Ka,结合常数,n结合位点数[30]。
根据数据绘制双对数图,如图4所示。Ka和n值分别通过图4中曲线的截距和斜率计算,表2为不同处理温度下的Ka和n值。由表2可知,异荭草素与BSA的结合位点n接近2,说明在实验浓度下,它与BSA的结合比例约为 2∶1,安石榴苷、鞣花酸与BSA的结合位点n均接近1,并且几乎不受温度的影响,它们与BSA的结合比例约为 1∶1,并且3种多酚与牛血清蛋白作用的结合常数Ka值以108为数量级,均远大于104数量级,说明异荭草素、安石榴苷、鞣花酸与牛血清蛋白之间均具有较强的结合作用。
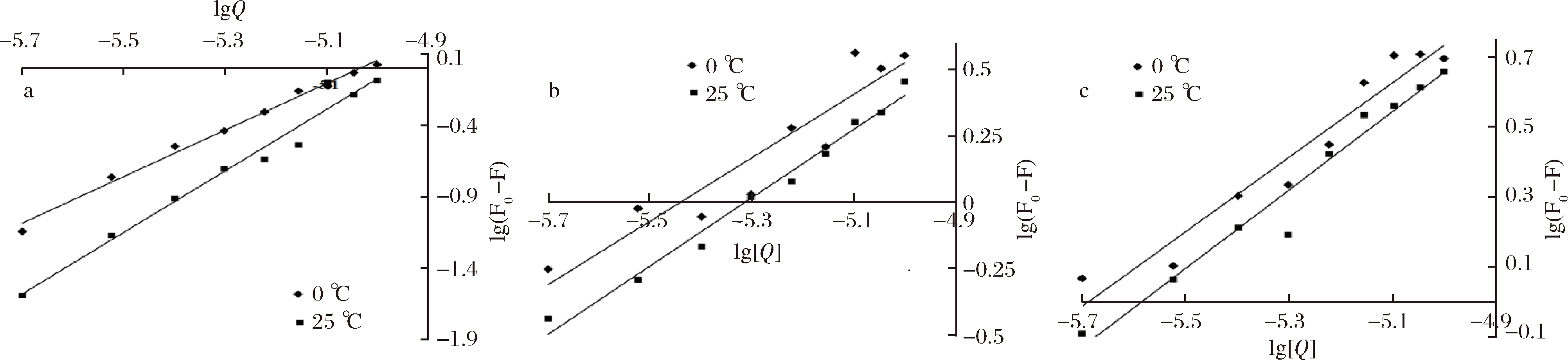
a-异荭草素+BSA;b-安石榴苷+BSA;c-鞣花酸+BSA
图4 0、25 ℃下3种多酚和牛血清蛋白相互作用的双对数图
Fig.4 Double logarithmic figures of three polyphenols under 0,25 ℃ and bovine serum
albumin interaction
表2 多酚与牛血清白蛋白相互作用的结合常数和
结合位点
Table 2 Binding constants and binding sites for the
interaction of ISO,punicalagin, EA with BSA
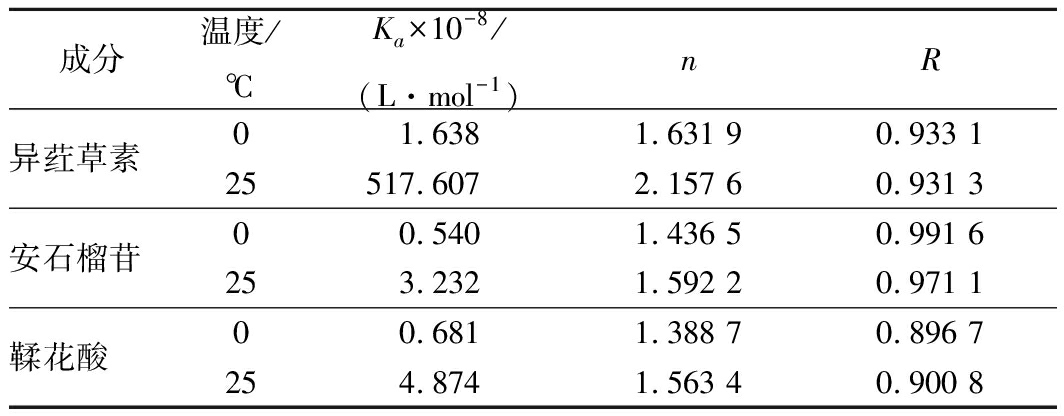
成分温度/℃Ka×10-8/(L·mol-1)nR异荭草素01.6381.631 90.933 125517.6072.157 60.931 3安石榴苷00.5401.436 50.991 6253.2321.592 20.971 1鞣花酸00.6811.388 70.896 7254.8741.563 40.900 8
2.2.3 热力学参数和作用力类型的计算
多酚等小分子物质与蛋白质结合反应的作用力类型主要由自由能变、焓变和熵变等热力学参数来确定。热力学参数自由能变(ΔG)、焓变(ΔH)和熵变(ΔS)可通过公式(3)、公式(4)进行计算:
(3)
ΔG=ΔH-TΔS=-RTlnKa
(4)
式中:T1温度下的结合常数为Ka1;T2温度下的结合常数为Ka2;R为气体常数。
由公式(3)、(4)可求出ΔG、ΔH和ΔS,根据数据绘制表3。
表3 多酚与牛血清白蛋白相互作用的热力学参数
Table 3 Thermodynamic parameters for the interaction
of ISO, punicalagin, EA with BSA
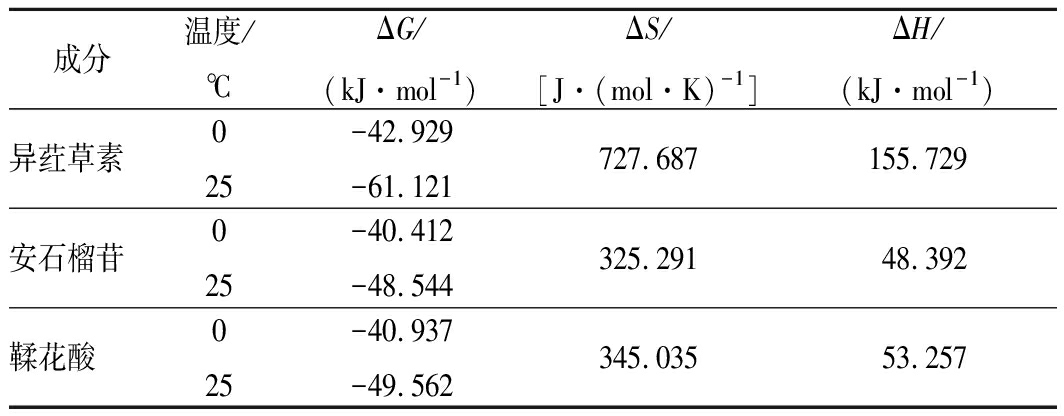
成分温度/℃ΔG/(kJ·mol-1)ΔS/[J·(mol·K)-1]ΔH/(kJ·mol-1)异荭草素025-42.929-61.121727.687155.729安石榴苷025-40.412-48.544325.29148.392鞣花酸025-40.937-49.562345.03553.257
研究表明[13],当ΔH>0且ΔS>0时主要作用力为疏水作用力;当ΔH<0且ΔS>0时静电引力起主要作用;当ΔH<0且ΔS<0时氢键和范德华力起主要作用[31-32]。
由表3可见,在同一温度下,ΔG值由小到大的多酚依次为异荭草素、鞣花酸、安石榴苷;不同温度下ΔG均小于0,表明异荭草素、安石榴苷、鞣花酸与BSA之间的相互作用均是自发进行的;3种多酚与BSA相互作用的ΔH和ΔS均为正值,提示此3种多酚与BSA之间的结合主要是吸热和熵驱动的反应,并且主要作用力为疏水作用力。
2.3 圆二色谱法研究3种多酚与BSA的相互作用
圆二色谱常用于研究多酚等小分子与蛋白质相互作用。BSA的紫外区段(190~240 nm)圆二色谱反映了主链构象[33]。从图5可以看出,BSA中加入不同浓度的异荭草素、安石榴苷、鞣花酸后,BSA在208 nm和222 nm 处吸收峰的振幅有不同程度的增大,但两处负吸收峰的形状和波峰位置均未发生明显变化。说明异荭草素、安石榴苷、鞣花酸与BSA的相互作用均可导致BSA结构发生变化。
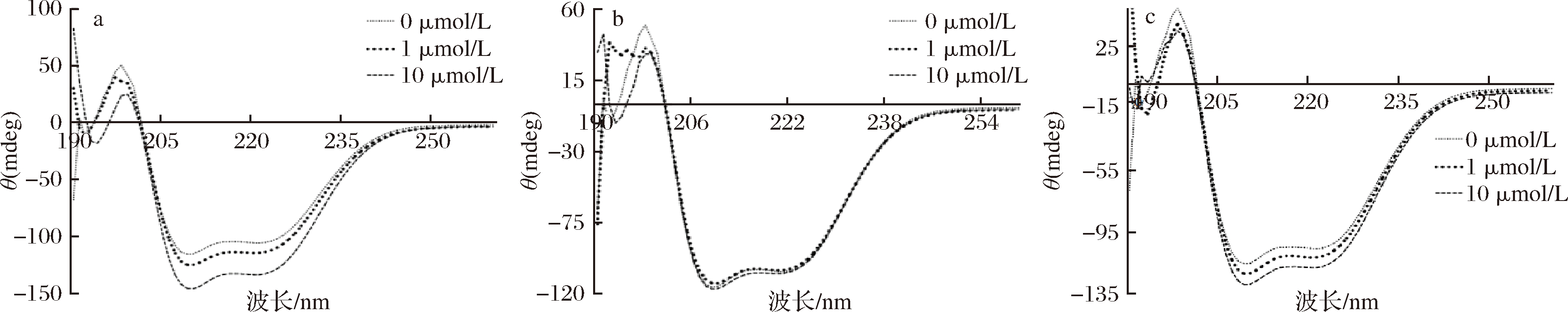
a-异荭草素+BSA;b-安石榴苷+BSA;c-鞣花酸+BSA
图5 三种多酚分别与BSA相互作用的圆二色谱图
Fig.5 Circular dichroism spectra of three polyphenols interacting with BSA, respectively
注:多酚浓度依次为0、1、10 μmol/L,BSA浓度为1 μmol/L
2.4 红外光谱研究3种多酚与BSA的相互作用
红外光谱能够反映蛋白质的多个酰胺带,不同的酰胺带代表蛋白质肽链不同的振动模式,蛋白质的酰胺Ⅰ带(1 600~1 700 cm-1)和酰胺Ⅱ带(1 500~1 600 cm-1)可以反映其二级结构。其中,酰胺Ⅰ带主要由C![]() O伸缩振动引起的,而酰胺Ⅱ带则是由C—N伸缩振动和N—H弯曲振动引起的[34]。因此通常用红外光谱分析蛋白质与小分子物质结合后构象的变化。图6为多酚与BSA结合前后蛋白质的红外光谱。
O伸缩振动引起的,而酰胺Ⅱ带则是由C—N伸缩振动和N—H弯曲振动引起的[34]。因此通常用红外光谱分析蛋白质与小分子物质结合后构象的变化。图6为多酚与BSA结合前后蛋白质的红外光谱。
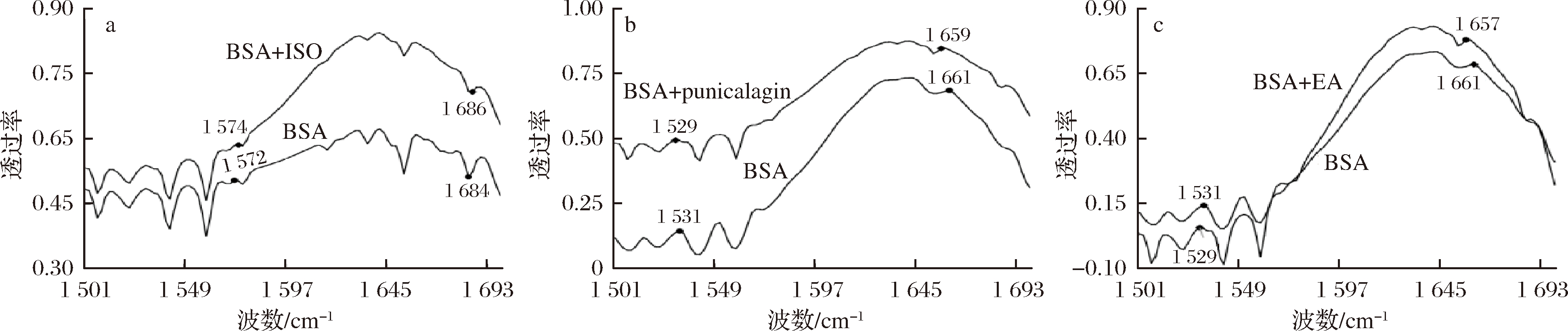
a-异荭草素+BSA;b-安石榴苷+BSA;c-鞣花酸+BSA
图6 三种多酚与BSA相互作用的红外光谱图
Fig.6 FTIP spectrum of three polyphenols interacting with BSA
注:多酚浓度为10 μmol/L,BSA浓度为1 μmol/L
由图6可以看出,异荭草素与BSA结合后,酰胺Ⅰ带的峰位置由1 684 cm-1红移至1 686 cm-1,酰胺Ⅱ带的峰位置由1 572 cm-1红移至1 574 cm-1;安石榴苷与BSA结合后,酰胺Ⅰ带的峰位置由1 661 cm-1蓝移至1 659 cm-1,酰胺Ⅱ带的峰位置由1 531 cm-1蓝移至1 529 cm-1;鞣花酸与BSA结合后,酰胺Ⅰ带的峰位置由1 661 cm-1蓝移至1 657 cm-1,酰胺Ⅱ带的峰位置由1 531cm-1蓝移至1 529cm-1。上述酰胺带峰位置的变化说明多酚与BSA发生相互作用,导致BSA构象的改变。
2.5 同步荧光光谱法研究3种多酚与BSA的相互作用
BSA的构象和发色团微环境的变化可以通过同步荧光光谱来反映。当激发和发射波长差Δλ分别为15、60 nm时,分别表示的是酪氨酸(Tyr)、色氨酸(Trp)残基的荧光特征。同时,最大发射波长向长波方向或者短波方向移动,即红移或者蓝移,说明氨基酸残基周围微环境极性增强或疏水性增强[35]。
根据数据绘制异荭草素等多酚与BSA的同步荧光光谱图,如图7所示。由图7可见,随着异荭草素、安石榴苷、鞣花酸浓度的增大,Tyr和Trp残基的荧光强度均有不同程度的下降。加入异荭草素后,Δλ为15 nm的这组最大发射波长从 285 nm移至286 nm,Δλ为60 nm的这组最大发射波长没有发生明显改变,说明异荭草素更接近Tyr 残基,并导致Tyr残基周围极性增加,疏水性降低;加入安石榴苷、鞣花酸后,Tyr残基的最大发射波长没有发生明显改变,说明其对Tyr残基的影响不大,Trp残基的最大发射波长分别从278 nm移至281 nm、280 nm移至281nm,发生微弱红移,表明安石榴苷、鞣花酸更接近于Trp残基,并导致Trp残基周围极性增加,疏水性降低。本试验结果表明,与3种多酚结合后BSA的构象发生了变化。
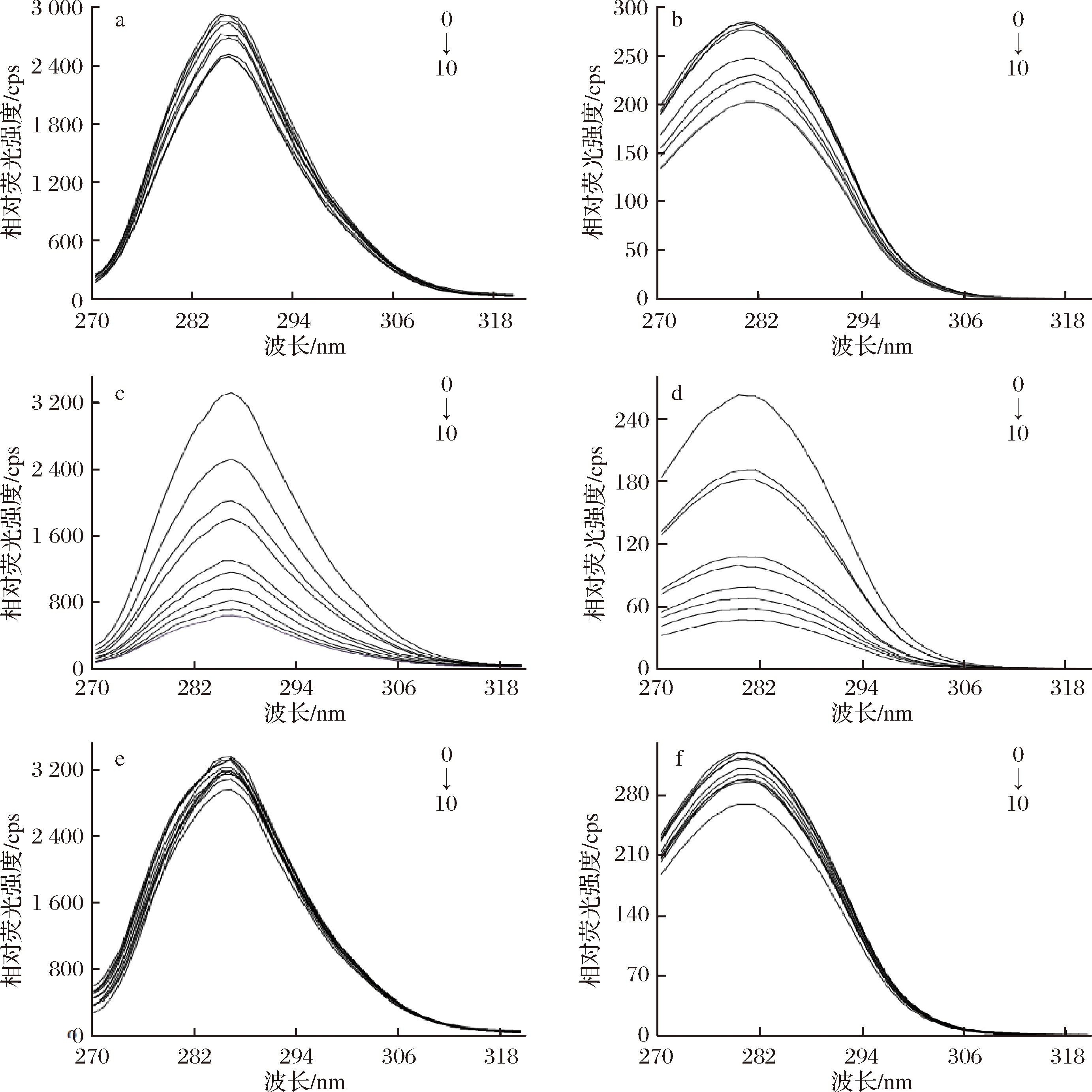
a-BSA+异荭草素(Δλ=15 nm); b-BSA+异荭草素(Δλ=60 nm); c-BSA+安石榴苷(Δλ=15 nm);
d-BSA+安石榴苷(Δλ=60 nm); e-BSA+鞣花酸(Δλ=15 nm); f-BSA+鞣花酸(Δλ=60 nm)
图7 三种多酚BSA相互作用的同步荧光光谱
Fig.7 Synchronous fluorescence spectra of three polyphenols interacting with BSA
注:多酚浓度从0到10依次为0、2、3、4、5、6、7、8、9、10 μmol/L,BSA浓度为1 μmol/L
3 结论
(1)异荭草素、安石榴苷、鞣花酸均可与BSA结合导致荧光猝灭,猝灭过程以静态猝灭为主;3种多酚与BSA相互作用后,蛋白质的二级结构发生改变。
(2)异荭草素与BSA的结合比例约为 2∶1;安石榴苷、鞣花酸与BSA的结合比例约为 1∶1。
(3)异荭草素、安石榴苷、鞣花酸与BSA之间的相互作用均是自发进行的,3种多酚与BSA之间的结合主要是吸热和熵驱动的反应,并且主要作用力可初步确定为疏水作用力。
(4)异荭草素使BSA的酪氨酸残基周围极性稍有增加,使得疏水性有降低的趋势;而安石榴苷、鞣花酸使BSA的色氨酸残基周围极性稍有增加,且疏水性有降低的趋势。
[1] 李春翼,田勇,杨雅轩,等.植物多酚与蛋白质互作机制表征方法研究进展[J].食品与发酵工业,2019,45(13):262-268.
[2] QUIDEAU S, DEFFIEUX D, DOUAT-CASASSUS C,et al. Plant polyphenols: chemical properties, biological activities, and synthesis[J]. Angew Chem Int Ed, 2011, 50(3): 586-621.
[3] 丁铭格,贾敏,屈引贤,等.安石榴苷减轻心肌缺血/再灌注损伤的作用及机制研究[J].心脏杂志,2018,30(5):503-507.
[4] 侯文芬. 光谱法研究黄酮类药物与溶菌酶的相互作用[D].桂林:广西师范大学,2010.
[5] LUO Wei, XIAO Gao, TIAN Fan, et al.Engineering robust metal-phenolic network membranes for uranium extraction from seawater[J].Energy & Environmental Science, 2019,12(2):607-614.
[6] GUO J, PING Y, EJIMA H, et al.Engineering multifunctional capsules through the assembly of metal-phenolic networks[J].Angewandte Chemie, 2014, 126(22):5 652-5 657.
[7] 石碧, 狄莹.植物多酚[M].北京:中国科学技术出版社, 2000.
[8] SINGH M, ARSENEAULT M, SANDERSON T, et al. Challenges for research on polyphenols from foods in Alzheimer’s disease: bioavailability, metabolism, and cellular and molecular mechanisms[M]. J Agric Food Chem, 2008, 56 (13): 4 855-4 873.
[9] 郄雪娇,程亚,曾茂茂,等.食品多酚与蛋白相互作用及其对多酚生物可利用性影响的研究进展[J].食品与发酵工业,2019,45(8):232-237.
[10] 杜淑霞,欧仕益,贝惠玲,等.茶多酚与牛奶蛋白互作对蛋白质离体消化率的影响[J]. 食品与发酵工业, 2010,36(2):76-79.
[11] 张丽娟,张宜欣,许子华. 姜黄素与牛血清白蛋白结合的反应机制研究[J]. 中医药导报, 2010,16(2):65-67.
[12] 姚惠芳,景浩. 笃斯越橘花青素与牛血清白蛋白的相互作用[J]. 食品科学, 2013,34(23):6-10.
[13] 张洁怡,陈艳豪,王凌琴,等.白背三七中黄酮类药物对牛血清白蛋白结构影响的研究[J].当代化工研究,2017(10):141-142.
[14] 李理. 天然黄酮类化合物与血清蛋白相互作用及抗氧化活性研究[D].上海:上海师范大学,2014.
[15] 张玉丽. 山竹黄酮和金属离子、血清白蛋白及DNA的相互作用研究[D]. 西安:西北大学, 2009.
[16] KUMAZAWA T, MINATOGAWA T, MATSUBA S, et al. An effective synthesis of isoorientin: the regioselective synthesis of a 6-C-glucosylflavone[J]. Carbohydrate Research, 2000, 329(3):507-513.
[17] 张琴. 异荭草素对人宫颈癌hela细胞凋亡的影响[D].衡阳:南华大学,2018.
[18] 李亚芹,臧学丽,冯贺达,等.异荭草素对老年耐药性前列腺癌的逆转作用[J].中国老年学杂志,2016,36(13):3 142-3 143.
[19] 于海瑶,李石化,孙丽艳,等.异荭草素对胃癌细胞自噬作用的研究[J].中国生化药物杂志,2015,35(12):36-38.
[20] YUAN L, WANG J, WU W, et al. Effect of isoorientin on intracellular antioxidant defence mechanisms in hepatoma and liver cell lines[J]. Biomedicine & Pharmacotherapy, 2016, 81:356-362.
[21] 蔡晨晨,叶丽霞,朱将虎,等.鞣花酸通过降低自噬作用减轻缺氧缺血性脑损伤[J].中国病理生理杂志,2019,35(2):311-319.
[22] 古丽米热,朱俊宇,梁华平,等.安石榴苷抗炎、抗氧化及抗感染活性的研究进展[J].感染、炎症、修复,2018,19(1):44-47.
[23] 焦士蓉,唐子尧,孙博瑞,等.石榴皮提取物和鞣花酸对人脂肪干细胞增殖和分化的影响[J].西华大学学报(自然科学版),2019,38(2):48-51.
[24] 兰玲,袁婧威,赵成新,等.异黄酮分子与人血清白蛋白的相互作用[J].河北联合大学学报(自然科学版),2015,37(4):45-52.
[25] 薛春霞,董社英.四种黄酮类化合物与牛血清白蛋白相互作用的光谱分析[J].化学研究,2014,25(2):152-157.
[26] PAPADOPOULOU A, GREEN R J, FRAZIER R A. Interaction of flavonoids with bovine serum albumin: a fluorescence quenching study[J]. Journal of Agricultural and Food Chemistry, 2005, 53(1):158-163.
[27] 尚永辉,李华,孙家娟.荧光光谱法研究木犀草素、芹菜素或葛根素与牛血清白蛋白的相互作用机理[J].理化检验(化学分册),2011,47(2):186-190.
[28] 周玲玲,龚小保.人血清白蛋白与4种黄酮类化合物相互作用研究[J].中南药学,2017,15(8):1 065-1 068.
[29] 王玲,屈凌波,杨冉,等.槲皮素和芦丁与牛血清白蛋白相互作用研究[J].分析科学学报,2006(6):719-722.
[30] KANG J, LIU Y, XIE M X, et al. Interactions of human serum albumin with chlorogenic acid and ferulic acid[J]. Biochimica et Biophysica Acta, 2004, 1674(2):205-214.
[31] SHI X, LI X, GUI M, et al. Studies on interaction between flavonoids and bovine serum albumin by spectral methods[J]. Journal of Luminescence, 2010, 130(4):637-644.
[32] 董黎明. 黄酮与牛血清白蛋白相互作用及共存金属离子影响的研究[D].哈尔滨:黑龙江中医药大学,2014.
[33] 相启森. 鼠尾草酸抗氧化、抗肿瘤生物学功能及其分子机制研究[D].杨凌:西北农林科技大学,2013.
[34] 贾万腾. 多酚类活性成分与血清白蛋白相互作用的研究[D].济南:山东师范大学,2012.
[35] 郑丹,张清峰.黄酮“落新妇苷”与牛血清白蛋白相互作用研究[J].食品与发酵工业,2018,44(6):83-87.