每年来源于化石原料的工业化学品多达8 000万t,产值在2万亿美元以上。化石原料不可再生,石化工业存在包括温室效应在内的环境污染。近年来,对利用微生物、以可再生生物质为原料生产化工平台化合物的研究越来越受到重视[1]。丁酸(butyric acid)是一种平台化合物,广泛应用于食品、化工、制药等行业,每年全球市场需求量约80 000 t。目前丁酸生产主要有2种方式:化学合成法与微生物发酵法。化学合成法产量高、产品专一性好,但生产操作在高温高压条件下进行、且使用不可再生的化石原料。
相对于化学合成法,发酵法在缓解全球气候变暖和温室效应,使用可再生资源等方面具有巨大的优势。目前能够生产丁酸的微生物有梭菌属(Clostridium)、丁酸弧菌属(Butyrivibrio)、丁酸杆菌属(Butyribacterium)细菌等[2]。丁酸发酵的主要原料包括传统复合培养基、淀粉类物质、糖蜜以及各种废弃生物质(农业废弃物、厨余垃圾等),原料中的还原糖(葡萄糖)是最常见的碳源[3]。以复合培养基为发酵原料、葡萄糖为碳源时,需辅以使用蛋白胨和酵母粉(各5 g/L)为有机氮源,并需添加少量无机盐,原料成本高、配料工序复杂。为降低原料成本,STEIN等利用秸秆、厨余垃圾等进行丁酸发酵[4]。但该过程也存在一些弊端:生物质密度低、前处理工艺繁琐复杂、产物浓度低。与丁醇发酵一样,丁酸发酵中的主产物丁酸对酪丁酸梭菌生长也有产物抑制作用,但抑制作用较弱,抑制浓度远高于丁醇发酵中的主产物丁醇对丙酮丁醇梭菌的抑制水平(约12 g/L)[5]。为维持细胞活性和解除产物抑制,JIANG等[6]以葡萄糖为原料,利用FBB(fibrous bed bioreactor)反应器,将发酵液连续泵入纤维素床单元维持丁酸梭菌的活性,丁酸质量浓度和生产效率分别可以达到86 g/L和1.1 g/(L·h)的高水平。但是,FBB反应器操作复杂、成本高,很难在工业生产上得到应用。
本研究室在前期研究中,以Clostridium tyrobutyricum ATCC 25755为实验菌株,使用葡萄糖复合培养基为原料,发酵生产丁酸,发酵60 h,丁酸质量浓度和生产效率分别达到27 g/L和0.45 g/(L·h)的水平[7]。以废弃生物质(木质素、厨余垃圾等)为原料,如果不使用FBB反应器和蛋白胨等高效有机氮源、丁酸浓度只能达到10~20 g/L的较低水平[3]。重组毕赤酵母(Pichia pastoris)是生产有用异源蛋白的重要宿主。异源蛋白主要分泌于发酵上清液,发酵结束后得到的高密度毕赤酵母是一种具有高能量密度化特征的废弃生物质。据研究报道,废弃毕赤酵母含有46%的蛋白质(氮源)和36%的多糖(碳源)[8]。为充分利用该废弃生物质,本研究室建立了以玉米粉/废弃毕赤酵母为混合原料高效发酵生产丁醇的操作策略和工艺。使用该策略,总糖的利用效率提高了80%、废弃酵母中的碳水化合物得到了有效转化[9]。本研究借鉴上述发酵策略,以废弃酵母为高效氮源强化丁酸发酵生产,探索废弃酵母的氮/碳源在丁酸发酵过程中的利用规律,旨在提高丁酸浓度、得率和生产效率,降低发酵原料成本,促进半固态废弃酵母的有效利用。
1 材料与方法
1.1 实验菌株
酪丁酸梭菌(C. tyrobutyricum ATCC 25755),为可利用葡萄糖厌氧发酵生产丁酸的微生物菌株。购自广东省微生物菌种保藏中心,保藏号为GIM1.262,菌株保藏于甘油管中(-20 ℃)。
1.2 主要仪器与设备
BIOTECH—7JG 7 L厌氧发酵罐(配有pH电极)、BIOTECH-2020 pH转换显示器,上海保兴生物设备工程有限公司(发酵罐配置有蛇形盘管,热水可在蛇管中循环,控制发酵温度);SBA-40C生物传感分析仪,山东省科学院生物研究所;GC126气相色谱仪,上海精密科学仪器有限公司;1525EF高效液相色谱仪,美国Waters公司;1100高效液相色谱仪,美国Agilent公司;MP-10C制冷/加热循环槽,上海一恒公司;HH-8数显恒温水浴锅,常州华普达公司;SHZ-D-(III)真空泵,河南巩义予华公司。
1.3 培养基
细胞活化培养基(g/L):葡萄糖30.0,酵母抽提物5.0,胰蛋白胨5.0,K2HPO4 1.5,C3H7NO2S·HCl·H2O 0.3,NaCl 6.0,FeSO4·7H2O 0.03,MgSO4·7H2O 0.6,(NH4)2SO4 3.0,pH自然。
发酵用复合培养基(g/L):葡萄糖60.0,酵母抽提物5.0,胰蛋白胨5.0,K2HPO4 1.5,FeSO4·7H2O 0.03,CaCO3 2.0,NaCl 6.0,(NH4)2SO4 3.0,MgSO4·7H2O 0.6,pH 6.0。
基础玉米粉发酵培养基:将玉米粉(市售)与蒸馏水一起配料,玉米粉含量为80 g/L,pH自然。混匀后,先置于约95 ℃沸水中糊化处理,加入α-淀粉酶(诺维信公司,40 000 U/g),加酶量为8.0 U/g(玉米粉)、液化处理45 min;液化后,将培养基置于水浴锅中、加入糖化酶(诺维信公司,100 000 U/g),加酶量为120.0 U/g玉米粉,62 ℃下糖化1 h,初始葡萄糖浓度为35~50 g/L。培养基置灭菌锅中121 ℃下灭菌20 min。
1.4 废弃毕赤酵母的预处理
使用产猪α-干扰素的毕赤酵母。废酵母离心后,室温收藏。固态废弃酵母规格:含水量约65%(细胞干重约35%)。称取适量废弃酵母于烧杯中,加入适量NaOH固体颗粒,再加水形成250~400 g/L的废弃酵母悬浊液(处理液)。将静置2~3 d的悬浊液置沸水浴中蒸煮100 min,冷却后,用98%浓H2SO4调pH至5.5~6.5。最后,按需向发酵液中添加上述悬浊液。
1.5 培养/发酵方法
酪丁酸梭菌活化培养:从甘油管中转接一定量的酪丁酸梭菌孢子悬浮液于活化培养基中,用真空泵抽真空1~2 min,除去厌氧瓶和培养基中的氧气,再置于37 ℃恒温水浴锅培养48 h,得到种子液。
100 mL厌氧瓶发酵:按10%的接种量将酪丁酸梭菌种子液转接于基础玉米粉培养基中,置于37 ℃恒温水浴锅培养。产气开始后,每隔6~8 h将气体排出,用排水集气法计量产气量。发酵约20 h,按1∶4的体积比添入所需的废弃酵母处理液或无葡萄糖复合培养基(总装液量50 mL)。产气明显减弱后结束发酵。
7 L厌氧发酵罐中静态发酵:用制冷/加热循环槽控制发酵温度在37 ℃。初始pH 6.5,装液量为2.7 L、加入10%种子液后,实际发酵液体积约3.0 L。
发酵前先通入无菌氮气30 min,去除氧气。接种后再次通入无菌氮气约10 min。使用压力调节阀将罐压维持在0.03~0.04 MPa。发酵过程中会自产气体,气泡不断从发酵液向顶空释放。自产气体可以保证发酵液相基本混合均匀,消耗分解后的玉米粉和固型废弃物颗粒逐步聚集到发酵液顶层。产酸/产气开始后,用氨水将pH手动控制在5.5~6.5。使用排水集气法计量总产气量、H2和CO2含量[10]。发酵约20 h,按1∶4的体积比添入不同规格的废弃酵母处理液或无糖复合培养基。在调节发酵液pH、添加废弃酵母处理液或无糖复合培养基、流加葡萄糖以及取样时,低速搅拌2~3 min(约70 r/min)。当发酵液pH不变且产气速度明显降低后,终止发酵。
1.6 分析方法
丁酸/乙酸:气相色谱仪测定。以异丁醇为内标,每个样品测定3次取平均值。色谱条件见参考文献[10]。
总糖:盐酸水解法[11],每个样品测定3次,取平均值。
葡萄糖/乳酸:生物传感分析仪测定。
二糖/三糖/三糖以上寡糖和氨基酸测定:分别使用Waters和Agilent公司的HPLC测量,色谱条件见文献[9]和[12]。
2 结果与讨论
2.1 基于厌氧瓶丁酸发酵的培养基优化
如表1所示,从使用50 g/L的基础玉米粉培养基开始,通过加大玉米粉用量、适时以1∶4的比例添加无糖复合培养基和不同规格的废弃酵母处理液,丁酸质量浓度从1.16 g/L逐渐增加到9.70 g/L。
表1 不同发酵策略下丁酸发酵性能比较(100 mL厌氧瓶)
Table 1 Comparison of butyrate fermentation performance under different operating conditions
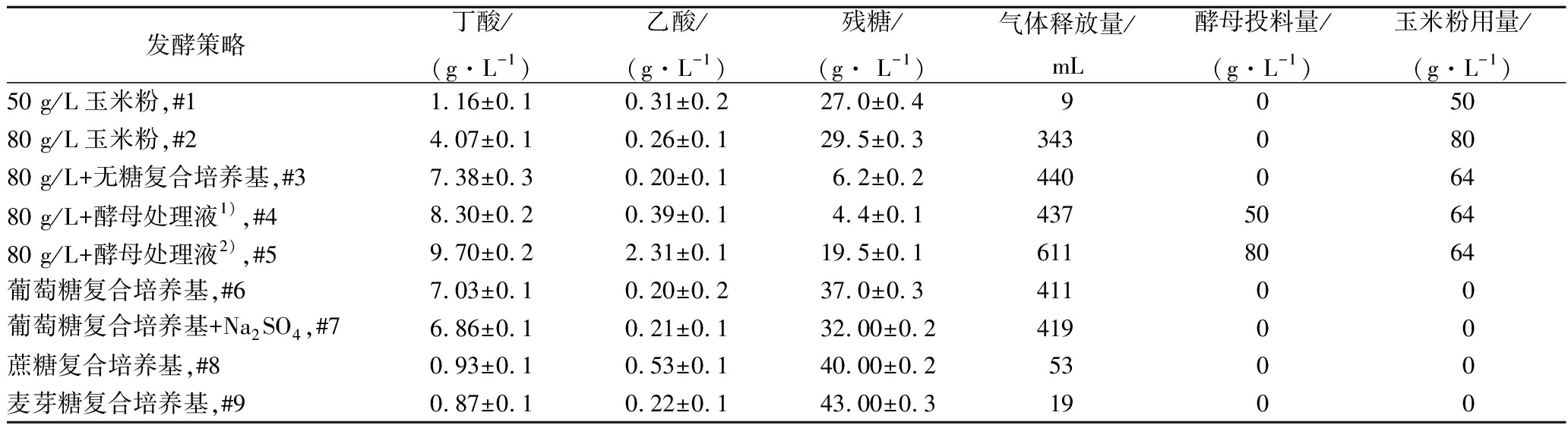
发酵策略丁酸/(g·L-1)乙酸/(g·L-1)残糖/(g· L-1)气体释放量/mL酵母投料量/(g·L-1)玉米粉用量/(g·L-1)50 g/L玉米粉,#11.16±0.10.31±0.227.0±0.4905080 g/L玉米粉,#24.07±0.10.26±0.129.5±0.334308080 g/L+无糖复合培养基,#37.38±0.30.20±0.16.2±0.244006480 g/L+酵母处理液1),#48.30±0.20.39±0.14.4±0.1437506480 g/L+酵母处理液2),#59.70±0.22.31±0.119.5±0.16118064葡萄糖复合培养基,#67.03±0.10.20±0.237.0±0.341100葡萄糖复合培养基+Na2SO4,#76.86±0.10.21±0.132.00±0.241900蔗糖复合培养基,#80.93±0.10.53±0.140.00±0.25300麦芽糖复合培养基,#90.87±0.10.22±0.143.00±0.31900
注:1)废酵母处理液为250 g/L规格,按1∶4的比例添加到发酵液后质量浓度为50 g/L;2)废酵母处理液为400 g/L规格,发酵液中实际质量浓度为80 g/L
由于玉米粉培养基中的氮源含量低,发酵前期细胞不能正常生长,在后续实验中均以80 g/L的玉米粉作为基础培养基。另外,在使用以蔗糖和麦芽糖(60 g/L)为碳源的复合培养基生产丁酸时(实验批次#8和#9),两者的最终丁酸质量浓度均低于1 g/L,仅为对照的13%(以葡萄糖为碳源的复合培养基,批次#6),说明酪丁酸梭菌对二糖的利用效率很低。另外,使用以葡萄糖为碳源的复合培养基,24 h向发酵液添加高浓度的Na2SO4溶液(发酵液中![]() 质量浓度为10 g/L),丁酸终浓度和总产气量与对照相差不大(表1,批次#6和#7)。
质量浓度为10 g/L),丁酸终浓度和总产气量与对照相差不大(表1,批次#6和#7)。
2.2 7 L厌氧发酵罐上的丁酸发酵
以80 g/L玉米粉为基础培养基,进行了7个批次实验。结果及发酵性能归纳于图1和表2中。

a-50 g/L玉米粉对照;b-80 g/L玉米粉+废弃酵母处理液(250 g/L规格);c-80 g/L玉米粉+葡萄糖浓缩液流加;
d-80 g/L玉米粉+无糖复合培养基+葡萄糖浓缩液流加;e-80 g/L玉米粉+废弃酵母处理液+葡萄糖浓缩液流加;
f-80 g/L玉米粉+废弃酵母处理液(400 g/L规格)+葡萄糖浓缩液流加
图1 不同发酵策略下丁酸发酵性能比较(7 L发酵罐)
Fig.1 Butyrate fermentation performance under different operating conditions in 7 L anaerobic fermentor
2.2.1 分批发酵
即便上罐条件下pH得到了控制,使用50 g/L玉米粉基础培养基时(批次#a),大量还原糖未被消耗利用(约10 g/L),发酵34 h、丁酸质量浓度仅为2.7 g/L。使用80 g/L玉米粉基础培养基时,发酵20 h,以1∶4的比例添加废弃酵母处理液(250 g/L规格,批次#b)。添加处理液后,产气有所增加,还原糖被迅速消耗。30 h时,还原糖消耗殆尽,产气和丁酸合成戛然停止,34 h时的丁酸质量浓度仅为6.55 g/L。相关研究显示[13],酪丁酸梭菌难以直接利用大多数寡糖(蔗糖等),这与上述结果是吻合的。
2.2.2 葡萄糖补料发酵
发酵批次#c,先使用80 g/L玉米粉基础培养基进行分批发酵。当还原糖浓度降低到接近于0 g/L时,向发酵液中流加600 g/L的葡萄糖浓缩液,将还原糖质量浓度提升到10~15 g/L以上。补糖2次,产气速度逐渐下降,到约40 h产气完全终止。最终的丁酸质量浓度依旧停留在7.44 g/L的低水平上。
表2 不同操作条件下丁酸发酵性能综合比较(7 L发酵罐)
Table 2 Butyrate fermentation performance under different operating conditions in 7 L anaerobic fermentor
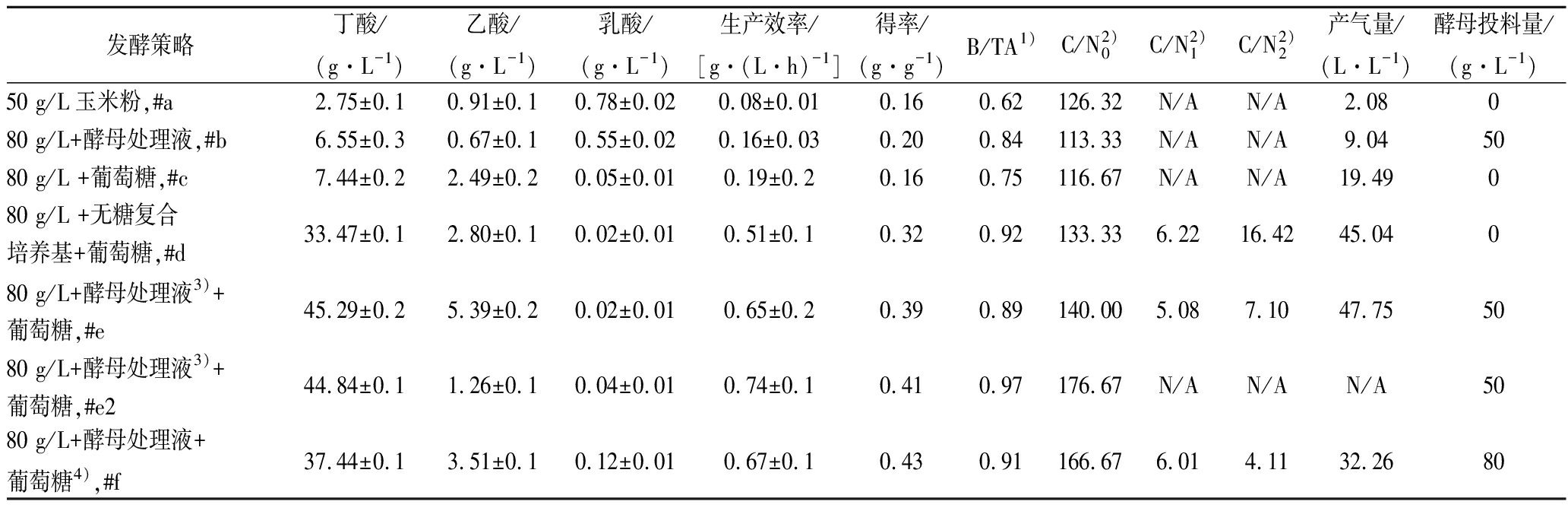
发酵策略丁酸/(g·L-1)乙酸/(g·L-1)乳酸/(g·L-1)生产效率/[g·(L·h)-1]得率/(g·g-1)B/TA1)C/N2)0C/N2)1C/N2)2产气量/(L·L-1)酵母投料量/(g·L-1)50 g/L玉米粉,#a2.75±0.10.91±0.10.78±0.020.08±0.010.160.62126.32 N/AN/A2.08080 g/L+酵母处理液,#b6.55±0.30.67±0.10.55±0.020.16±0.030.200.84113.33 N/AN/A9.045080 g/L +葡萄糖,#c7.44±0.22.49±0.20.05±0.010.19±0.20.160.75116.67 N/AN/A19.49080 g/L +无糖复合培养基+葡萄糖,#d33.47±0.12.80±0.10.02±0.010.51±0.10.320.92133.33 6.2216.4245.04080 g/L+酵母处理液3)+葡萄糖,#e45.29±0.25.39±0.20.02±0.010.65±0.20.390.89140.00 5.087.1047.755080 g/L+酵母处理液3)+葡萄糖,#e244.84±0.11.26±0.10.04±0.010.74±0.10.410.97176.67 N/AN/AN/A5080 g/L+酵母处理液+葡萄糖4),#f37.44±0.13.51±0.10.12±0.010.67±0.10.430.91166.67 6.014.1132.2680
注:1)B/TA,丁酸浓度/总有机酸浓度;2)碳氮比(C/N)下标“0”、“1”、“2”分别代表“发酵初始”、“添加有机氮源后”、“发酵结束”;3)废弃酵母处理液为250 g/L规格,发酵液中的实际质量浓度50 g/L;4)废弃酵母处理液为400 g/L规格,实际质量浓度80 g/L;N/A:没有测量或没有相应数据
2.2.3 添加无糖复合培养基的葡萄糖补料发酵
发酵批次#d,先使用80 g/L玉米粉基础培养基进行分批发酵。发酵20 h,以1∶4的体积比添加不含葡萄糖的发酵用复合培养基,使所有成分(包括蛋白胨和酵母膏)达到“材料与方法”中的规定水平。与此同时,当还原糖质量浓度降低到约10 g/L时,向发酵液中流加葡萄糖浓缩液,将还原糖质量浓度提升到约20 g/L。在此条件下,产气持续上升,66 h时丁酸质量浓度为33.47 g/L,丁酸得率和生产效率分别达到0.32 g/g和0.51 g/(L·h)。
2.2.4 添加废弃毕赤酵母处理液的葡萄糖补料发酵
前期研究结果显示,废弃酵母处理液中没有葡萄糖[9]。发酵批次#e和#e2先使用80 g/L玉米粉基础培养基进行分批发酵约20 h,以1∶4的比例添加废弃酵母处理液(250 g/L规格,发酵液中的废弃酵母实际浓度50 g/L)。与此同时,当还原糖质量浓度降低到约10 g/L时,向发酵液流加葡萄糖浓缩液进行补料,将还原糖质量浓度提升到约20 g/L。此时,产气显著上升,发酵70 h时的丁酸质量浓度、得率和生产效率分别达到44.84~45.29 g/L、0.39~0.41 g/g和0.65~0.74 g/(L·h)的高水平,比使用葡萄糖复合培养基为原料时分别提高61%、5%和57%[7]。由于酪丁酸梭菌只能快速、有效地利用还原糖(葡萄糖)来合成丁酸,发酵批次#f中,通过加大糖化酶用量和糖化时间,将玉米粉中的总糖全部转化成葡萄糖,提高玉米粉的有效利用率。与此同时,进一步加大废弃酵母的投料量,发酵24 h时,按1∶4的比例添加400 g/L规格的废弃酵母处理液(发酵液中的废弃酵母实际质量浓度80 g/L),其余操作方式与批次#e完全相同。发酵56 h时的丁酸质量浓度、丁酸得率、生产效率分别为37.44 g/L、0.43 g/g和0.67 g/(L·h)。
2.3 以废弃酵母处理液为高效氮源并连续补加葡萄糖浓缩液改善丁酸发酵性能
2.3.1 添加废弃酵母处理液提高发酵体系的丁酸质量浓度、得率和丁酸占总有机酸的比率
酪丁酸梭菌主要利用还原糖(葡萄糖)合成丁酸(乙酸和乳酸是副产物)。将丁酸得率和丁酸占总有机酸的比率(B/TA)分别按公式(1)(2)计算:
(1)
(2)
式中:YB、CB、CGt0、CGtf、CF、CA和CL分别代表丁酸得率、丁酸质量浓度(g/L)、初始葡萄糖质量浓度(g/L)、发酵结束时的葡萄糖质量浓度(g/L)、单位体积发酵液的葡萄糖流加量(g/L)、乙酸和乳酸质量浓度(g/L)。
如表2所示,相比于发酵批次#a~c,80 g/L玉米粉+无糖复合培养基添加+葡萄糖浓缩液连续流加的发酵体系(批次#d)中的CB和YB有明显提高(CB=33.47 g/L,YB=0.32)。使用80 g/L玉米粉+废弃酵母处理液(250 g/L规格,50 g/L)添加+葡萄糖浓缩液连续流加的发酵体系(批次#e和#e2),CB和YB进一步提高(CB为44.84~45.29 g/L,YB为0.39~0.41)。批次#f将废弃酵母投料量提升至80 g/L(废弃酵母处理液400 g/L规格),CB有所降低(37.44 g/L),但YB继续上升(0.43)。80 g/L玉米粉+50 g/L废弃酵母处理液+葡萄糖浓缩液连续流加的发酵体系(批次#e和#e2)的性能较为优越,因为虽然YB略有下降,但CB提升幅度比较明显,与添加成本较高的发酵用复合培养基相比,CB和YB分别提高了约36%和25%。B/TA也是衡量发酵性能的重要指标之一,B/TA越大、丁酸含量越高,越有利于缓解下游产品精制过程中的分离负担。加入无糖复合培养基和废弃酵母处理液后,B/TA均可从0.62~0.75增加到0.90以上(表2)。
2.3.2 氨基酸的有效利用与发酵体系C/N的控制
添加废弃酵母处理液(氮源)以后,有益于丁醇合成及丙酮丁醇梭菌生存的氨基酸浓度大幅提升[9]。为此,分析测量了添加酵母处理液和无糖复合培养基前后,以及发酵结束时发酵液中的氨基酸变化情况。一共检测到17种氨基酸,包括谷氨酸族和天冬氨酸族氨基酸。有研究报道指出,谷氨酸族和天冬氨酸族氨基酸是有益于酪丁酸梭菌生长的氨基酸[14]。图2的结果表明,添入2种不同的有机氮源后、总氨基酸质量浓度从0.1~0.2 g/L大幅提高至3.69 g/L(发酵批次#d)和4.32 g/L(发酵批次#e)。谷氨酸族氨基酸(谷氨酸、脯氨酸)和天冬氨酸族氨基酸(天冬氨酸、蛋氨酸、苏氨酸、赖氨酸、异亮氨酸)浓度也有大幅提升。发酵结束时,总氨基酸、谷氨酸族氨基酸和天冬氨酸族氨基酸的消耗量大约为2.5、0.4和0.90 g/L。上述结果表明,加入无糖复合培养基或酵母处理液后,不仅形成了高氨基酸的浓度环境,同时氨基酸还得到了有效利用,这与丁醇发酵体系(玉米粉培养基/废弃酵母处理液混合底物)有很大不同。后者添入酵母处理液后,只是形成了对丙酮丁醇梭菌生存/丁醇合成有益的高氨基酸浓度环境,但氨基酸本身并没有得到实质性的利用[9]。这样,在丁酸发酵中,废弃酵母处理液可以提供比无糖复合培养基更多的氨基酸,氨基酸利用效率基本相同,这大大降低了发酵原料成本,并实现了生物废弃物的有效利用。
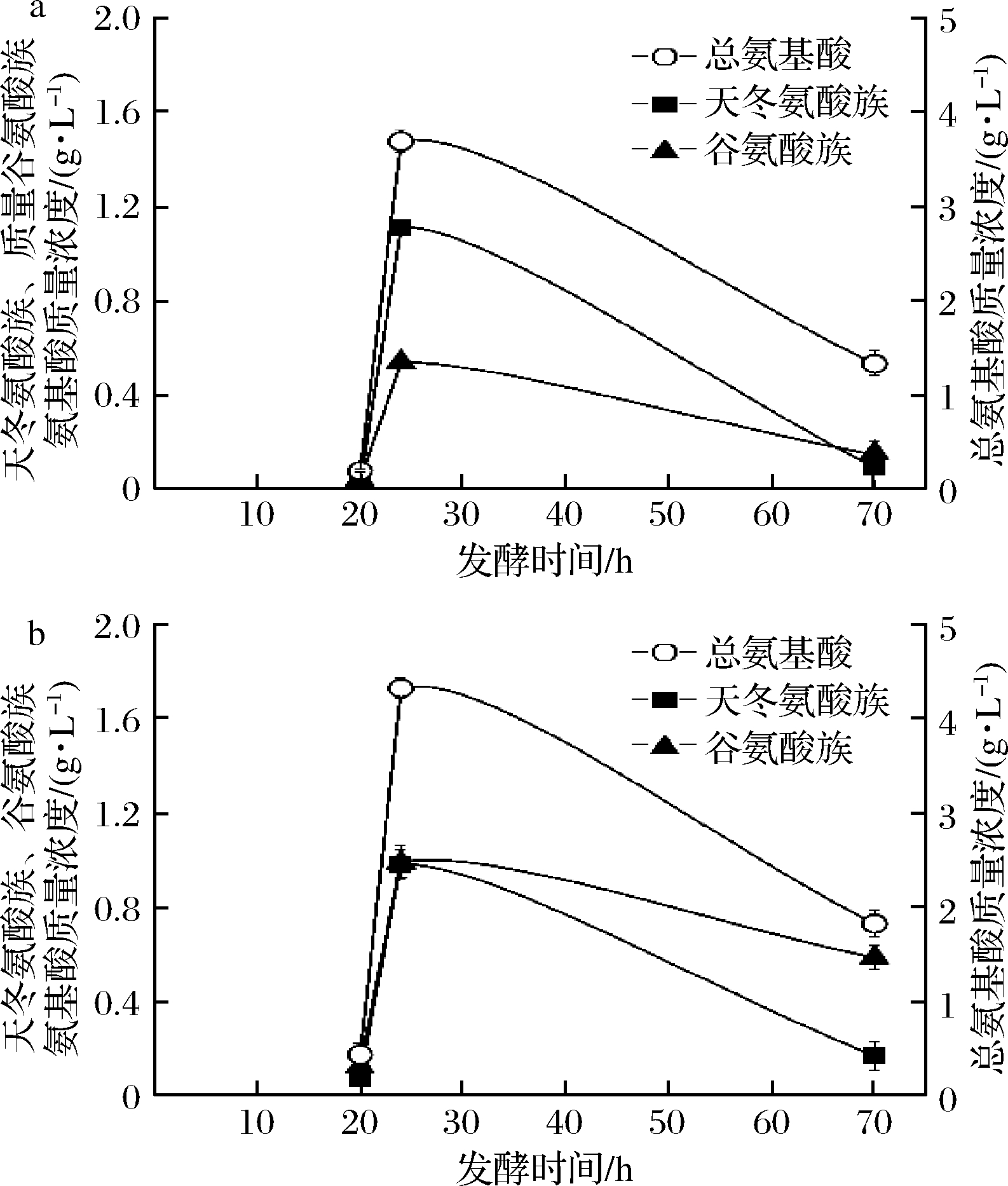
a-批次#d 80 g/L玉米粉+无糖复合培养基+连续流加
葡萄糖浓缩液;b-批次#e 80 g/L玉米粉+酵母处理液+
连续流加葡萄糖浓缩液
图2 7 L厌氧罐下、丁酸发酵过程中的天冬氨酸族氨基
酸、谷氨酸族氨基酸和总氨基酸的变化情况
Fig.2 Concentrations variations of aspartic acid family,
glutamic acid family and total amino acids in 7 L fermentor
丁酸是有机酸,其结构中没有氮成分,氨基酸消耗不可能直接用在丁酸合成上。利用发酵用复合培养基生产丁酸时,酪丁酸梭菌在发酵24 h后基本停止生长,但产酸产气并未停止[7]。因此,丁酸发酵属于典型的生长半耦联型发酵[公式(3)],遵从Luedeking-Piret公式),这也与LIU等[15]的研究结果相吻合。另外,使用纯葡萄糖培养基、必须外添3%的酪蛋白水解液(总氨基酸质量浓度约13 g/L)才能维持酪丁酸梭菌的生长和产酸[14]。
ρ=αμ+β, γB=ρX=ρ(αμ+β)X
(3)
式中:rB、ρ、X、μ、α和β分别代表丁酸合成速度[g/(L·h)]、丁酸比合成速度(h-1)、细胞质量浓度(g/L)、细胞比生长速度(h-1)、(生长)耦联系数和非耦联系数。酪丁酸梭菌生产丁酸属于典型的厌氧发酵,发酵液中的各类氨基酸是构成细胞的重要骨架物质。氨基酸依靠糖酵解途径中所生成的ATP的能量支撑,参与到细胞同化途径中、合成细胞,并最终得到消耗利用(图3)。
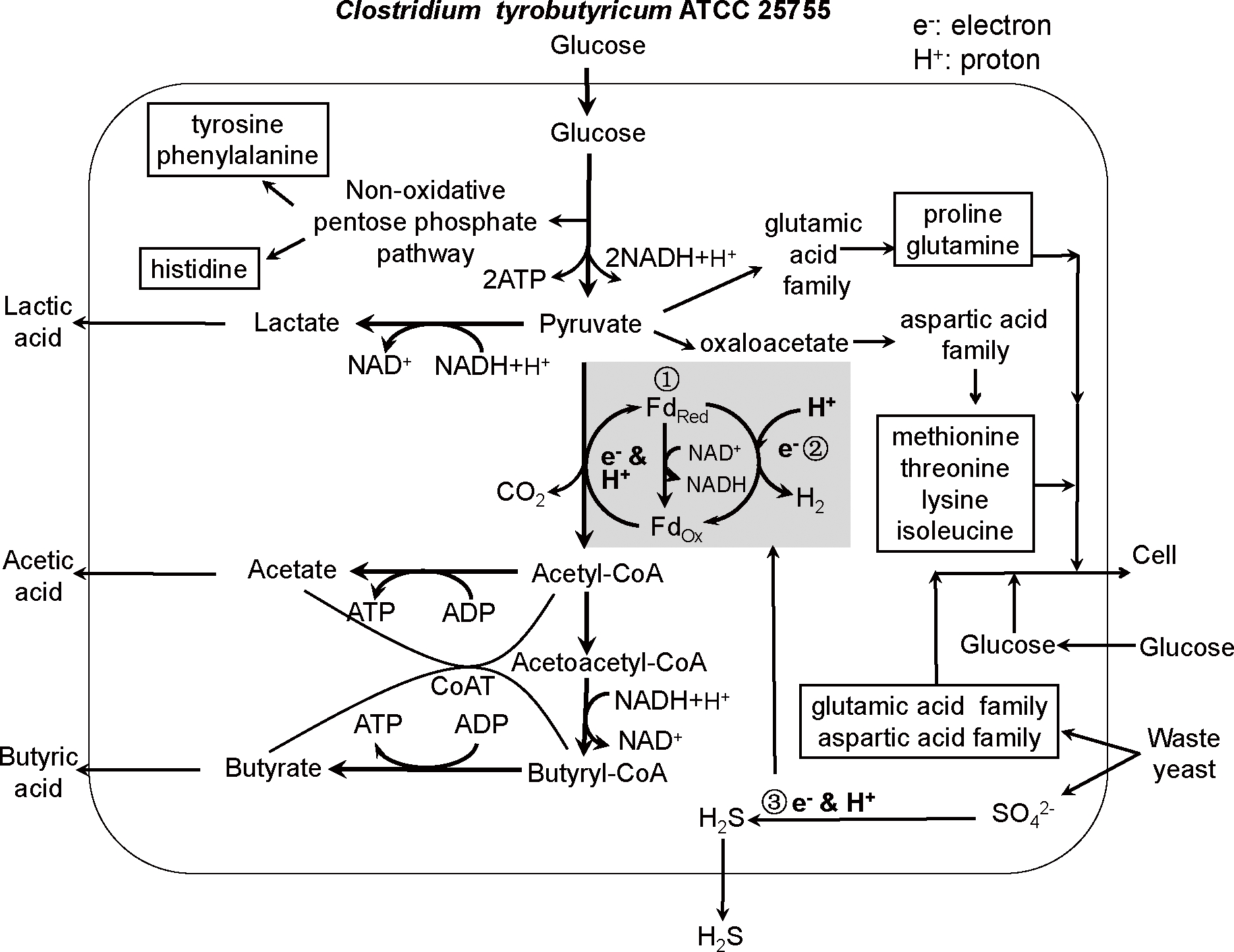
图3 本发酵策略下的酪丁酸梭菌合成丁酸的代谢图
Fig.3 C. tyrobutyricum ATCC 25755 metabolism
map under the proposed fermentation strategy
如公式(3)所示,在还原糖存在的条件下,细胞生长速度或浓度越大,丁酸合成速度越高。因此,氨基酸的消耗利用,提高了细胞生长速度和浓度,间接促进了丁酸合成。另外,C/N也是影响发酵性能的一个关键因素。表2概括总结了发酵初始、添入有机氮源后和发酵结束时的C/N。由于只有还原糖和氨基酸可以被酪丁酸梭菌快速有效利用,故将发酵体系的C/N定义为:发酵液中葡萄糖浓度CG(t)与总游离氨基酸浓度CTAA(t)之比。
(4)
前期实验结果表明[9],80 g/L玉米粉培养基中氨基酸含量很低,仅有约0.3 g/L。表2的结果显示,所有批次的初始C/N在110~180之间。添加有机氮源后、批次#d-f的C/N下降到5.0~6.2,发酵结束时的C/N维持在4.1~16.4(批次#d-f)。一般而言,高C/N有利于有机代谢产物的合成,而低C/N则有利于细胞生长。添入有机氮源(无糖复合培养基和废弃酵母处理液)后,C/N迅速下降到5.0~6.3,连续流加葡萄糖浓缩液后,细胞还可以继续生长直到较高浓度,使得最终丁酸浓度有较大幅度的提升。
2.3.3 高![]() 浓度环境促进依赖于NADH的丁酸合成
浓度环境促进依赖于NADH的丁酸合成
酪丁酸梭菌产丁酸的代谢途径与丙酮丁醇梭菌产丁醇的代谢途径是基本相同的,它们都存在电子往复穿梭系统[16-17]。在废弃酵母处理液配制过程中,由于调节pH自然形成了高![]() 的浓度环境(约12 g/L)。前期实验结果[18]表明,在
的浓度环境(约12 g/L)。前期实验结果[18]表明,在![]() 存在的条件下,丙酮丁醇梭菌可将
存在的条件下,丙酮丁醇梭菌可将![]() 还原成H2S,并同时消耗质子H+和e-,其中e-消耗的更多,这使得胞内电子往复穿梭系统中的质子流H+和电子流e-发生迁移。为了恢复 H+/e-的原有平衡、有效利用相对匮乏的 H+,最终导致更多的H+走向NADH合成途径。而丁酸合成也依赖于NADH,适度高的
还原成H2S,并同时消耗质子H+和e-,其中e-消耗的更多,这使得胞内电子往复穿梭系统中的质子流H+和电子流e-发生迁移。为了恢复 H+/e-的原有平衡、有效利用相对匮乏的 H+,最终导致更多的H+走向NADH合成途径。而丁酸合成也依赖于NADH,适度高的![]() 浓度环境强化了NADH的再生速度,可以进一步促进丁酸合成。单独使用玉米粉培养基或复合发酵培养基生产丁酸时,气体成分中的H2约占总气的50%(CO2约50%);在添入废弃酵母处理液
浓度环境强化了NADH的再生速度,可以进一步促进丁酸合成。单独使用玉米粉培养基或复合发酵培养基生产丁酸时,气体成分中的H2约占总气的50%(CO2约50%);在添入废弃酵母处理液![]() 存在的条件下,H+被还原反应
存在的条件下,H+被还原反应![]() 过量消耗(H+/e-=1.25),H2合成途径受阻,H2下降到总气的约40%(CO2约60%)。CHOI等[19]在用酪丁酸梭菌BAS 7发酵生产丁酸的研究中,通过添加电子载体甲基紫,直接造成e-过剩、H+匮乏,破坏了H+/e-间的原有平衡。NADH浓度比对照组提升了3倍,氢气产量下降65%,丁酸浓度从对照组的5.7 g/L提升至8.5 g/L。添加电子受体和载体都可以提高依赖于NADH的还原性强的代谢产物(丁酸或丁醇)合成速度。另外,电子受体
过量消耗(H+/e-=1.25),H2合成途径受阻,H2下降到总气的约40%(CO2约60%)。CHOI等[19]在用酪丁酸梭菌BAS 7发酵生产丁酸的研究中,通过添加电子载体甲基紫,直接造成e-过剩、H+匮乏,破坏了H+/e-间的原有平衡。NADH浓度比对照组提升了3倍,氢气产量下降65%,丁酸浓度从对照组的5.7 g/L提升至8.5 g/L。添加电子受体和载体都可以提高依赖于NADH的还原性强的代谢产物(丁酸或丁醇)合成速度。另外,电子受体![]() (约10 g/L)对细胞没有毒性,而甲基紫等色素电子载体对细胞有一定毒性[20],同时还需要增加后续的退色工艺步骤,这也加大了下游产品精制过程的负担。因此,高
(约10 g/L)对细胞没有毒性,而甲基紫等色素电子载体对细胞有一定毒性[20],同时还需要增加后续的退色工艺步骤,这也加大了下游产品精制过程的负担。因此,高![]() 浓度环境对改善丁酸发酵性能更具优势。
浓度环境对改善丁酸发酵性能更具优势。
2.3.4 添加废弃酵母处理液时提高丁酸得率
废弃酵母预处理无法将废弃酵母中的多糖降解成单糖,只能降解成难以用于丁酸合成的二糖、三糖以及三糖以上寡糖[9]。表3中总结归纳了发酵批次#e和#f中,添入不同酵母处理液前后,以及发酵结束时的二糖和三糖浓度。
表3 添加酵母处理液前后及发酵结束时发酵体系
中的二糖/三糖质量浓度 单位:g/L
Table 3 Concentrations of disaccharides and trisaccharides
before/after adding waste yeast suspension and at the end
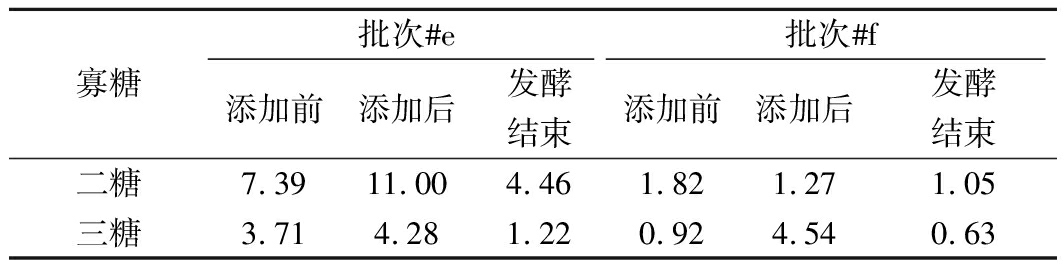
寡糖批次#e批次#f添加前添加后发酵结束添加前添加后发酵结束二糖7.3911.004.461.821.271.05三糖3.714.281.220.924.540.63
发酵批次#e中,由于玉米粉培养基没有完全糖化,添加酵母处理液前的二糖和三糖质量浓度高。加入酵母处理液(250 g/L)后,二糖和三糖质量浓度分别为11.00 g/L和4.28 g/L,发酵结束时,降低到4.46 g/L和1.22 g/L。批次#f中,玉米粉培养基糖化程度高,添加酵母处理液前的二糖和三糖质量浓度低。加入酵母处理液(400 g/L)后,二糖和三糖质量浓度分别是1.27 g/L和4.54 g/L,发酵结束时,降低到1.05 g/L和0.63 g/L。因此,酪丁酸梭菌仍然具有微弱的利用二糖和三糖的能力。批次#e和批次#f中的二糖和三糖总消耗量分别为9.60 g/L和4.13 g/L,虽然比葡萄糖消耗量(批次#e,约300 g/L;批次#f,约168 g/L)少得多,但这却意味着葡萄糖添加量有2.4%~3.2%降低的可能,丁酸得率在批次#d的基础上又有新的提升(32%上升至40%)。
图3是结合文献报道、总括碳代谢主路[15]、氨基酸代谢/作![]() 存在条件下的电子往复穿梭系统[18]时的酪丁酸梭菌合成丁酸的代谢图。使用以玉米粉为基础培养基、添加废弃酵母处理液辅以葡萄糖连续补料的发酵策略,可使废弃酵母处理液中的氨基酸得到有效利用、提高了细胞生长速度和浓度;高
存在条件下的电子往复穿梭系统[18]时的酪丁酸梭菌合成丁酸的代谢图。使用以玉米粉为基础培养基、添加废弃酵母处理液辅以葡萄糖连续补料的发酵策略,可使废弃酵母处理液中的氨基酸得到有效利用、提高了细胞生长速度和浓度;高![]() 浓度环境下的H+/e-迁移强化了NADH再生速度。在两者的共同作用下,丁酸发酵性能得到大幅改善。
浓度环境下的H+/e-迁移强化了NADH再生速度。在两者的共同作用下,丁酸发酵性能得到大幅改善。
3 结论
本研究建立了在以玉米粉为基础培养基、废弃酵母处理液为高效氮源、同时连续补加葡萄糖的高效丁酸发酵工艺。该工艺可以有效地利用来自于废弃酵母处理液中的氨基酸,提高细胞生长速度和浓度,增强NADH的再生速度,从而间接改善丁酸发酵的性能。与使用传统发酵用复合培养基相比较,该工艺可提高丁酸浓度,得率和生产效率达61%、5%和57%,价格昂贵的氮源(蛋白胨和酵母膏)可以得到完全替代,节约了发酵原料成本,提升了发酵过程的经济效益,实现了低值固态生物质的资源化、环境效益明显。但是,酪丁酸梭菌只能高效利用葡萄糖,玉米粉基础培养基和废弃酵母处理液中的寡糖利用率低,为利用残存寡糖,必须加大初始糖化酶用量并使用葡萄糖浓缩液进行补料。丁酸是丁醇发酵的前体物质之一,丁醇发酵中,使用丁酸为发酵原料比使用葡萄糖更为高效(但仍需来自于糖酵解途径的NADH)。丙酮丁醇梭菌可以分泌糖化酶,利用寡糖的能力强,但氨基酸的利用能力低;与之相反,丁酸发酵无法有效利用寡糖,但氨基酸利用能力强。根据上述特征,如果把丁酸和丁醇发酵有效结合起来,即利用部分丁酸发酵液作为丁醇发酵的共同底物,有望实现废弃酵母中的碳水化合物和蛋白质的完全利用/消化,同时联产丁酸和丁醇,实现发酵产品的多样化。最终达到利用厌氧发酵体系完全消化固态废酵母,生产有用平台化合物的目标。
[1] WANG J, LIN M, XU M, et al. Anaerobic fermentation for production of carboxylic acids as bulk chemicals from renewable biomass[J]. Advances in Biochemical Engineering/Biotechnology, 2016,156:323-361.
[2] ZIGOV J,
J,  TURD
TURD K E. Advances in biotechnological production of butyric acid[J]. Journal of Industrial Microbiology & Biotechnology, 2000,24(3):153-60.
K E. Advances in biotechnological production of butyric acid[J]. Journal of Industrial Microbiology & Biotechnology, 2000,24(3):153-60.
[3] LUO H Z, YANG R L, ZHAO YP, et al. Recent advances and strategies in process and strain engineering for the production of butyric acid by microbial fermentation[J]. Bioresource Technology, 2018,253:343-354.
[4] STEIN U H, WIMMER B, ORTNER M, et al. Maximizing the production of butyric acid from food waste as a precursor for ABE-fermentation[J]. Science of the Total Environment, 2017,598:993-1 000.
[5] SONG H, EOM M H, LEE S, et al. Modeling of batch experimental kinetics and application to fed-batch fermentation of Clostridium tyrobutyricum for enhanced butyric acid production[J]. Biochemical Engineering Journal, 2010,53(1):71-76.
[6] JIANG L, WANG J F, LIANG S Z, et al. Enhanced butyric acid tolerance and bioproduction by Clostridium tyrobutyricum immobilized in a fibrous bed bioreactor[J]. Biotechnology & Bioengineering, 2011,108(1):31-40.
[7] LUO H Z, ZENG Q W, HAN S, et al. High-efficient n-butanol production by co-culturing Clostridium acetobutylicum and Saccharomyces cerevisiae integrated with butyrate fermentative supernatant addition[J]. World Journal of Microbiology & Biotechnology, 2017,33(4):76-85.
[8] 陈超男. 巴斯德毕赤酵母多糖的分离纯化及生物活性研究 [D].大连: 大连理工大学, 2011.
[9] DING J, XU M, XIE F, et al. Efficient butanol production using corn-starch and waste Pichia pastoris semi-solid mixture as the substrate[J]. Biochemical Engineering Journal, 2019,143:41-47.
[10] 罗洪镇. 不同底物流加/供氧和发酵还原力调控模式下典型发酵产物合成的关键技术 [D]. 无锡: 江南大学, 2016.
[11] ZHANG L, YANG Y, SHI Z. Performance optimization of property-improved biodiesel manufacturing process coupled with butanol extractive fermentation[J]. Chinese Journal of Biotechnology, 2008,24(11):1 943-1 948.
[12] LI X, LI Z G, ZHENG J P, et al. Yeast extract promotes phase shift of bio-butanol fermentation by Clostridium acetobutylicum ATCC824 using cassava as substrate[J]. Bioresource Technology, 2012,125:43-51.
[13] DWIDAR M, LEE S, MITCHELL R J. The production of biofuels from carbonated beverages[J]. Applied Energy, 2012, 100:47-51.
[14] MEAD G C. The amino acid-fermenting clostridia[J]. Journal of General Microbiology, 1971,67(1):47-56.
[15] LIU X G, ZHU Y, YANG S T. Butyric acid and hydrogen production by Clostridium tyrobutyricum ATCC 25755 and mutants[J]. Enzyme & Microbial Technology, 2006,38(3-4):521-528.
[16] JIANG L, FU H X,YANG H K, et al. Butyric acid: Applications and recent advances in its bioproduction[J]. Biotechnology Advances, 2018,36:2 101-2 117.
[17] 邓名荣,郭俊,朱红惠.微生物催化生产丁酸研究进展[J].中国生物工程杂志,2009,29(3):117-122.
[18] DING J, LUO H Z, XIE F, et al. Electron receptor addition enhances butanol synthesis in ABE fermentation by Clostridium acetobutylicum[J]. Bioresource Technology, 2018,247:1 201-1 205.
[19] CHOI O, UM Y, SANG B I. Butyrate production enhancement by Clostridium tyrobutyricum using electron mediators and a cathodic electron donor[J]. Biotechnology & Bioengineering, 2012,109(10):2 494-2 502.
[20] PEGUIN S, GOMA G, DELORME P, et al. Metabolic flexibility of Clostridium acetobutylicum in response to methyl viologen addition[J]. Applied Microbiology & Biotechnology, 1994,42: 611-616.
[21] 李鑫.使用木薯原料和外部代谢调控策略提高丁醇发酵的丁醇/丙酮比[D].无锡:江南大学,2014.