近年来,廉价肉冒充牛羊肉、挂鹅头卖鸭肉等肉类及肉制品以次充好事件不断发生,严重损害了消费者的权益。掺假肉类及肉制品不仅扰乱了正常的市场秩序,而且存在导致特殊体质人群发生过敏反应的潜在危险,对社会诚信、人们身心健康造成了极大的困扰[1-3]。针对日益繁多的肉类及肉制品掺假现象,如何建立快速、准确有效的动物源性成分检测方法,已经成为肉类及肉制品安全领域的研究热点。
目前,用于动物源性成分的检测方法主要有常规理化检验技术、基于蛋白质的免疫分析技术和基于核酸的分子生物学技术[4-8]。其中,分子生物学技术中的重组酶介导扩增(recombinase-aid amplification, RAA)技术,以其操作简单、恒温条件下扩增、检测时间短、灵敏度高等特点[9-11],成为动物源性成分快速检测最有效的方法之一,但是核酸检测一般都存在环境中核酸污染的问题,气溶胶的扩散容易造成后续样本检测出现假阳性。相比之下,使用微流控技术能够很好地解决污染问题[12],微流控芯片中环境的封闭性,使得外界核酸难以进入芯片内污染,而芯片内各腔室的独立分布有效地隔断了内部污染情况,将核酸污染降低到了最低程度;同时微流控芯片技术还具有试剂消耗量低、分析速度快、检测通量高、设备体积小、自动化程度高、非专业人员使用、成本低等优点[13-15],特别适合于动物源性成分的快速检测。
本文将离心式微流控芯片和RAA技术相结合,使用一次性的高聚物微流控芯片,配合便携式微流控速测仪,用于牛、羊、猪、鸭和鸡源性成分的快速检测,并设计了一套密封盖片和芯片托盘装置,旨在实现动物源性成分的多样本、多指标快速检测。
1 材料与方法
1.1 材料与试剂
芯片材料:光学级聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)板材,苏州扬清芯片科技有限公司;光学级双面胶(厚0.1 mm),杭州霆科生物科技有限公司。
肉类样品:猪肉、牛肉、羊肉、鸭肉、鸡肉,购于杭州市萧山区农贸超市。
试剂:猪源性成分分子检测试剂盒、牛源性成分分子检测试剂盒、羊源性成分分子检测试剂盒、鸭源性成分分子检测试剂盒、鸡源性成分分子检测试剂盒(包含引物、裂解液、缓冲液 A、缓冲液 B),杭州众测生物科技有限公司。
1.2 仪器与设备
YoungLaser-V12型二氧化碳激光芯片雕刻机、苏州扬清芯片科技有限公司;微流控芯片缝合机,苏州扬清芯片科技有限公司;YQ-620C型超声波清洗机,上海易净超声波仪器有限公司;DW系列超低温保存箱(-86 ℃),海尔生物医疗公司;Scientz-N型真空冷冻干燥机,宁波新芝生物技术股份有限公司;FA-1604电子天平,上海精科实业有限公司;Milli-Q超纯水系统(18 MΩ),美国Millipore公司;MF-52型倒置荧光显微镜,广州明美光电技术有限公司。
1.3 实验方法
1.3.1 检测原理
采用RAA技术来检测分析动物源性成分。RAA技术原理[16]为在37 ℃恒温下,重组酶和引物紧密结合成酶与引物的聚合体,当引物在模板DNA上搜索到同源序列时,单链DNA结合蛋白辅助打开DNA双链结构,同时DNA聚合酶催化形成新的DNA互补链,扩增产物以指数级增长,并用荧光探针(荧光基团为FAM)标记目的基因进行实时荧光检测,激发光波长为490 nm,检测光波长为520 nm,扩增阳性的肉类样品会产生“S”型扩增曲线,从而实现对肉类样品的半定量检测分析。
1.3.2 芯片的设计与制作
如图1-a所示,设计的扇形微流控芯片由3层PMMA基片组成,盖板、通道层、底板的厚度分别为0.5、2.0、0.5 mm。芯片主要由进样孔、进样区、储液区、检测区(同时包含阳性质控区、阴性质控区)、微通道、锯齿形通道和通气孔构成(图1-b),其中,进样区、储液区、检测区的体积分别为140、20、20 μL。
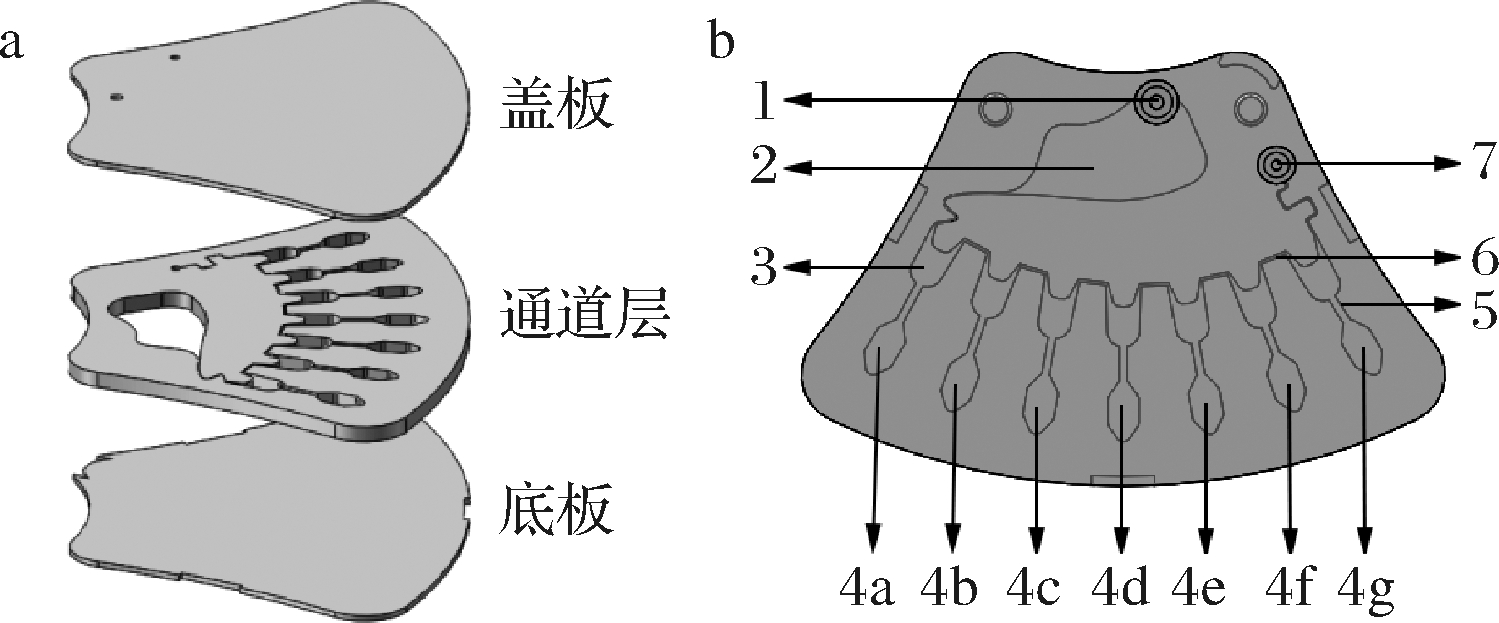
a-立体结构;b-平面结构;
1-进样孔;2-进样区;3-储液区;4a-阳性质控区;4b-牛肉检测区;
4c-羊肉检测区;4d-猪肉检测区;4e-鸭肉检测区;
4f-鸡肉检测区;4g-阴性质控区;5-微通道;
6-锯齿形通道;7-通气孔
图1 扇形微流控芯片结构示意图
Fig.1 Schematic diagram of fan-shaped microfluidic
chip structure
芯片的加工制作过程如下[17]:首先,用SolidWorks软件设计微流控芯片的立体结构,通过结构分割划分芯片为3层结构——底板、通道层、盖板,并使用AutoCAD软件绘制芯片各层的几何图案;其次,通过数据传输将设计好的芯片各层几何图案参数传送至CO2激光雕刻机,采用CO2激光直写法直接在PMMA基片上加工池体结构和微通道,形成通道层基片,同时切割获得底板、盖板基片;最后,将刻有微通道和池体结构的PMMA基片置于含去离子水的超声波清洗机中清洗并吹干,之后与底板、盖板基片使用双面胶进行常温键合,即得到一次性的PMMA微流控芯片。
1.3.3 密封盖片及芯片托盘装置的设计
为了避免环境中的核酸分子进入扇形微流控芯片内影响检测,本实验设计了1套配合扇形微流控芯片使用的密封盖片。如图2-a所示,密封盖片主要由压盖、卡扣和疏水透气膜构成,其中,疏水透气膜只允许芯片与外界进行通气,但不允许溶液通过。
如图2-b所示,芯片托盘装置上集成了5个可拆卸的扇形微流控芯片,检测时可以自由选择所放置扇形微流控芯片的个数,每次可同时检测5个样本,每个样本可同时检测5种指标,适用于动物源性成分的多样本、多指标检测。

a-密封盖片;b-芯片托盘装置;
1-压盖;2-卡扣;3-疏水透气膜
图2 密封盖片及芯片托盘装置
Fig.2 Sealing cover and chip tray
1.3.4 芯片上的试剂预存储
扇形微流控芯片键合之前,采用真空冷冻干燥法将所需试剂预先固定在芯片检测区中[18],具体操作方法如下:在图1-b所示芯片的检测区4b~4f中依次加入20 μL猪引物、牛引物、羊引物、鸭引物、鸡引物溶液,分别用于猪肉、牛肉、羊肉、鸭肉、鸡肉中肉源性成分的快速检测;同时,在阳性质控区4a、阴性质控区4 g中分别加入20 μL阳性质控试剂(含引物及其模板DNA片段)和超纯水,各自作为实验的阳性质控和阴性质控。质控仅作为芯片上判读结果是否有效的参考,不计入后面核酸扩增曲线研究。将加入试剂的芯片在超低温保存箱-80 ℃下预冻30 min,之后置于真空冷冻干燥机内进行冷冻干燥2 h,获得预存储试剂的微流控芯片。
1.3.5 便携式微流控速测仪的搭建
便携式微流控速测仪如图3-a所示,其基本组成包括恒温控制平台、流体控制模块、光电检测模块和数据处理模块等(3-b)。其中,流体控制模块包括电机和芯轴;光电检测模块由LED光源、滤光片组和光电池感应器组成。便携式微流控速测仪的运行过程如下:首先,流体控制模块驱动电机并带动微流控芯片沿中心位置转动,一定时间后转动停止;其次,微流控芯片在恒温控制平台的作用下逐渐达到设定温度;最后,LED光源将会与芯片上特定的检测区对准,检测区的荧光基团经激发后射出一定波长的检测光,通过光电池感应器读取信号,再经过数据处理模块,得到检测区的荧光强度。
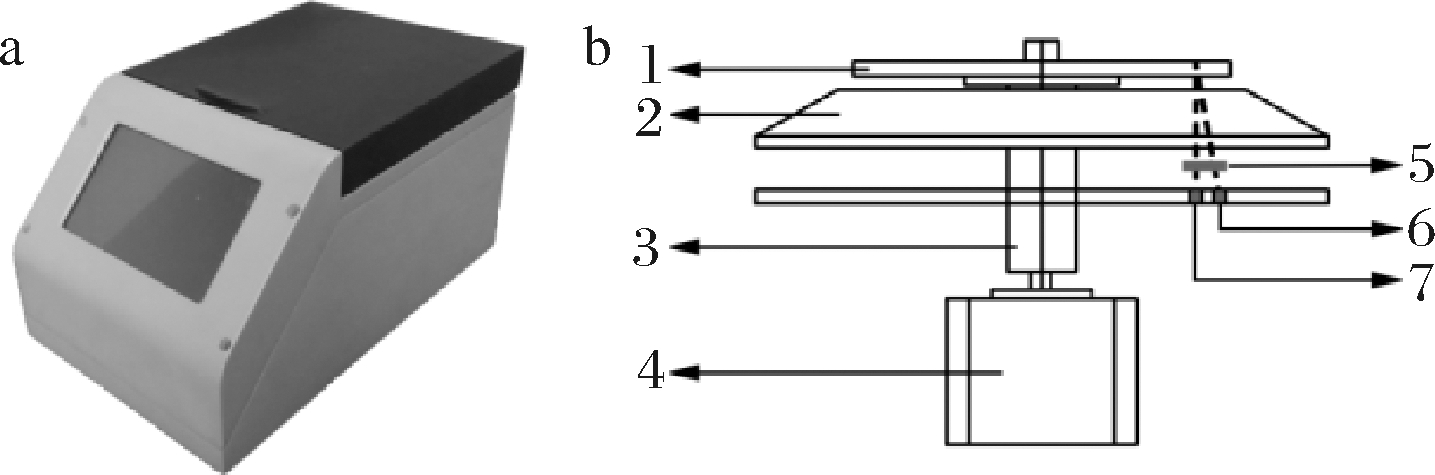
a-速测仪外观图;b-速测仪系统组成示意图;
1-微流控芯片;2-恒温控制平台;3-芯轴;4-电机;
5-滤光片组;6-LED光源;7-光电池感应器
图3 便携式微流控速测仪
Fig.3 Portable microfluidic tachymeter
1.3.6 芯片上的流体控制
微流控芯片的基本特征是集成多种操作单元于整体可控的微小平台上,进而实现微量液体在芯片内部的精密、可控转移[19]。图4显示了扇形微流控芯片上的流体驱动过程。首先,用移液枪将待检液加入进样区(步骤1);其次,待检液等量分成7份转移至储液区(步骤2);最后,储液区的待检液进入检测区,进行核酸扩增及实时荧光检测(步骤3),从而完成芯片上的流体驱动过程。
1.3.7 离心式微流控芯片系统的考察
1.3.7.1 试剂准备
模板DNA的提取:称取肉类样品50~100 mg,剪碎,置于含有裂解液500 μL的1.5 mL离心管中,上下颠倒混匀,70 ℃下加热10 min,待冷却后12 000 r/min离心2 min,吸取上清液作为模板DNA,提取的模板DNA作为质量分数100%的源性成分DNA。
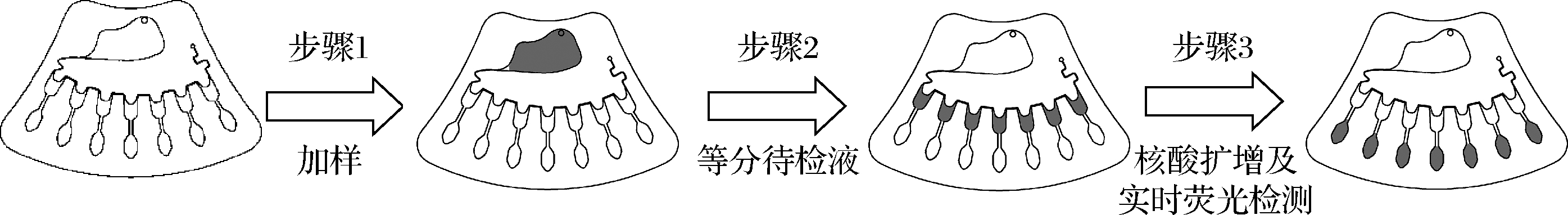
图4 扇形微流控芯片上的流体驱动过程
Fig.4 Fluid-driven process onfan-shaped microfluidic chips
反应液的制备:微流控芯片设计的进样体积是140 μL,取5.6 μL模板DNA于0.5 mL离心管中,先后加入127.4 μL缓冲液A、7 μL缓冲液 B,涡旋,离心,静置待用。
1.3.7.2 灵敏度实验
将不同肉类样品提取的模板DNA进行10倍梯度稀释,设计5个稀释度,用超纯水分别配制质量分数为100%、10%、1%、0.1%、0.01%的猪、牛、羊、鸭、鸡源性DNA进行实验考察,以对应梯度稀释的DNA为模板制备反应液。取140 μL反应液加入芯片进样区,将扇形微流控芯片配合托盘装置放入便携式微流控速测仪内,每1 min采集1次动物源性成分检测区的荧光值,以反应时间为横坐标,荧光强度为纵坐标,绘制5种动物源性成分的核酸扩增曲线。若动物源性成分对应检测区的核酸扩增曲线为直线或不规则的“S”型曲线,结果判读为阴性;若核酸扩增曲线为规则的“S”型曲线,结果判读为阳性。以产生“S”形扩增曲线的最小质量分数作为该动物源性成分的检出限,将扩增结束后的扇形微流控芯片置于荧光显微镜下判读结果,检测区有绿色荧光的为阳性,检测区无绿色荧光的为阴性,并与核酸扩增曲线的分析结果进行比较。
1.3.7.3 特异性实验
为了最大程度考察方法的特异性,对质量分数100%的猪、牛、羊、鸭、鸡源性DNA进行单独考察。取140 μL反应液加入芯片进样区,将扇形微流控芯片配合托盘装置放入便携式微流控速测仪内,每1 min采集1次动物源性成分检测区的荧光值,以反应时间为横坐标,荧光强度为纵坐标,绘制5种动物源性成分的核酸扩增曲线。在一定时间内,考察的具体源性成分只出现1条“S”型核酸扩增曲线,且“S”型核酸扩增曲线来自于源性成分对应检测区,而其他检测区的核酸扩增曲线为直线或不规则的“S”型曲线,则说明该源性成分的特异性良好,无交叉反应;若核酸扩增曲线未呈现上述特征,则说明该源性成分的特异性较差,存在交叉反应。
2 结果与分析
2.1 芯片上的流体控制
如图5-A所示,芯片上定量加样140 μL时,待检液充满整个进样区;当流体控制模块处于低速(介于500~700 r/min,逆时针)运行状态时,待检液等量分成7份转移至储液区,但无法突破储液区和检测区之间的“毛细管阀”作用(图5-b);当流体控制模块处于高速(大于1 800 r/min,逆时针)运行状态时,储液区的待检液将完全突破“毛细管阀”作用,进入并充满检测区(图5-c)。确定微流控芯片上的流体控制参数为:一次离心转速600 r/min,二次离心转速1 900 r/min。
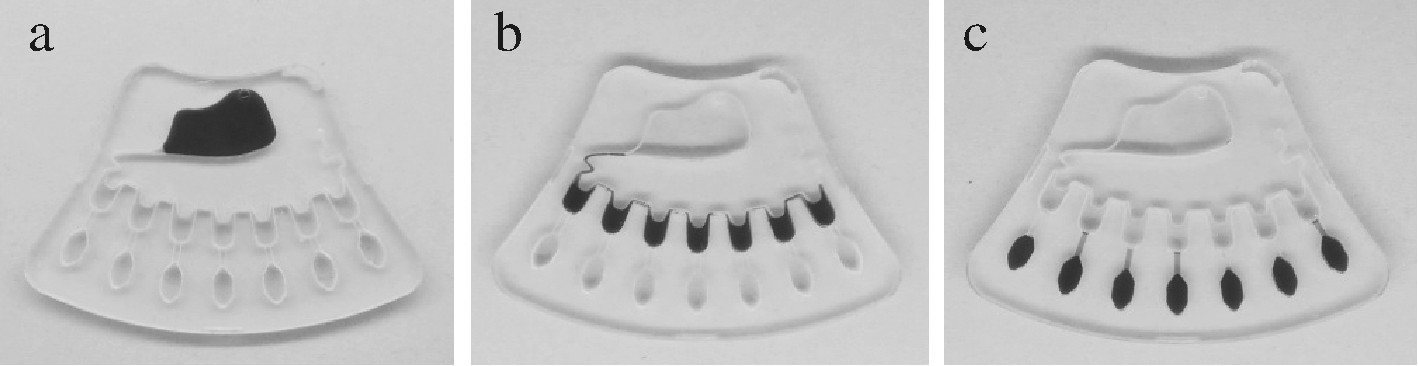
a-加样状态;b-低速离心状态;c-高速离心状态
图5 不同下状态下的微流控芯片
Fig.5 Microfluidic chips under different states
2.2 灵敏度实验
图6显示了微流控芯片中5种动物源性成分的灵敏度扩增曲线。在质量分数为100%、10%、1%、0.1%、0.01%的动物源性成分待检液中,以产生“S”型扩增曲线的最小质量分数作为该动物源性成分的检出限。
如图6-a所示,根据实时荧光扩增曲线的特征,质量分数为100%、10%、1%的牛源性成分扩增曲线呈现“S”型,而质量分数为0.1%、0.01%的牛源性成分扩增曲线为直线,说明最低可检出质量分数1%的牛源性成分。牛源性成分核酸扩增曲线的起峰时间在5~8 min、25 min时核酸扩增结束,表明离心式微流控芯片系统可以在25 min内实现牛源性成分的快速检测。同理,如图6-b,6-c,6-d,6-e所示,羊、猪、鸭、鸡源性成分的检出限分别为1%、0.1%、0.1%、1%,离心式微流控芯片系统可以在25 min内实现5种动物源性成分的快速检测。

a-牛源性;b-羊源性;c-猪源性;d-鸭源性;e-鸡源性
图6 微流控芯片中5种动物源性成分的灵敏度扩增曲线
Fig.6 Sensitivity curves of five animal derived components in microfluidic chips
为了确认离心式微流控芯片系统检测的准确性,将扩增结束的微流控芯片置于荧光显微镜下进行观察。根据检测区是否有绿色荧光判读结果,牛、羊、猪、鸭、鸡源性成分的检出限分别为1%、1%、0.1%、0.1%、1%,与便携式微流控速测仪检测的结果一致,这表明离心式微流控芯片系统的准确度较高。
2.3 特异性实验
图7显示了微流控芯片中5种动物源性成分的特异性扩增曲线。如图7-a所示,根据实时荧光扩增曲线的特征,在30 min内,考察的牛源性成分只出现1条“S”型核酸扩增曲线,且该“S”型核酸扩增曲线来自于牛肉检测区,而羊、猪、鸭、鸡肉检测区的核酸扩增曲线为直线,则说明微流控芯片对牛源性成分检测的特异性良好,无交叉反应;同理,如图7-b~7-e所示,考察的羊、猪、鸭、鸡源性成分均符合特异性良好的规定。综上所述,微流控芯片方法的特异性良好,可以用来进行5种动物源性成分的同时检测。

a-牛源性;b-羊源性;c-猪源性;d-鸭源性;e-鸡源性
图7 微流控芯片中5种动物源性成分的特异性扩增曲线
Fig.7 Specificity curves of five animal derived components in microfluidic chips
2.4 方法对比
将一些商品化的核酸扩增检测仪与本文提出的离心式微流控芯片系统进行对比。从表1可以看出,离心式微流控芯片系统的反应条件简单,能在37 ℃恒温下快速扩增目的基因;污染少,微流控芯片中环境的封闭性使得外界核酸难以进入芯片内污染,而芯片内各腔室的独立分布有效地隔断了内部污染情况;检测效率高,每次可同时检测5个样本,每个样本可同时检测5种指标;分析速度快,一般的核酸快速检测时间为1 h及以上,而离心式微流控芯片系统的检测时间仅为30 min。
表1 微流控芯片系统与商品化核酸扩增仪的对比
Table 1 Comparison of microfluidic chip system and commercial nucleic acid amplification instrument

方法反应条件核酸污染问题检测效率检测时间/min单指标样本用量/μL单指标反应体系用量/μL离心式微流控芯片系统37 ℃恒定温度轻微每次可同时检测5个样本,每个样本可检测5种指标300.820LAMP等温核酸扩增仪65 ℃恒定温度较严重每次仅检测1个样本的1种指标60714实时荧光定量PCR仪[20]复杂的变温过程严重每次仅检测1个样本的1种指标>6012.525
3 结论
本文基于RAA技术检测原理,设计了用于牛、羊、猪、鸭、鸡源性成分快速检测的扇形微流控芯片和配套使用的密封盖片、芯片托盘装置。同时,搭建了芯片配套使用的便携式微流控速测仪,其基本组成包括恒温控制平台、流体控制模块和光电检测模块等。扇形微流控芯片经便携式微流控速测仪的流体驱动测试后,得到了流体的控制参数:一次离心转速600 r/min,二次离心转速1 900 r/min。之后采用真空冷冻干燥技术,在微流控芯片上预存储牛、羊、猪、鸭、鸡的引物试剂,获得了预存储试剂的微流控芯片。对离心式微流控芯片系统进行考察,建立了半定量检测牛、羊、猪、鸭、鸡源性成分的方法。确定了牛、羊、猪、鸭、鸡源性成分的检出限分别为1%、1%、0.1%、0.1%、1%,离心式微流控芯片系统可以在25 min内实现5种动物源性成分的快速检测,检测的特异性良好,无交叉反应。
[1] 高志强, 汪琳, 蒲静, 等. 双重实时荧光PCR定量检测动物产品中牛源性成分[J]. 生物技术通报, 2018, 34(9): 190-194.
[2] 侯东军, 韩合敬,郝智慧, 等. 三重荧光PCR法鉴定食品中牛、猪、鸭3种动物源性成分[J]. 畜牧与兽医, 2016, 48(4): 45-48.
[3] 支琴, 郭金超, 龚强. 肉制品中动物源性成分DNA检测方法的研究进展[J]. 食品安全质量检测学报, 2018, 9(16): 4 204-4 211.
[4] 程浩, 李明生, 陈士恩, 等. 食品中猪源性成分检测方法研究进展[J]. 食品与机械, 2018, 34(8): 169-172.
[5] 崔震昆, 周威, 胡梁斌, 等. 动物源性食品安全检测技术研究进展[J]. 食品工业科技, 2018, 39(20): 314-319.
[6] 李家鹏, 乔晓玲, 田寒友, 等. 食品和饲料中动物源性成分检测技术研究进展[J]. 食品科学, 2011, 32(9): 340-347.
[7] 李宗梦, 赵良娟, 赵宏, 等. 肉及肉制品动物源性成分鉴别技术研究进展[J]. 食品研究与开发, 2014, 35(18): 122-127.
[8] 石盼盼, 李旭, 吴昊, 等. 肉及肉制品中动物源性成分核酸检测方法研究进展[J]. 食品研究与开发, 2016, 37(10): 211-214.
[9] 袁帅, 郑夔, 洪烨, 等. 重组酶介导扩增方法快速检测寨卡病毒[J]. 中国国境卫生检疫杂志, 2018, 41(3): 159-161.
[10] 张小平, 郑乐怡, 魏莹, 等. 重组酶介导扩增技术快速检测沙门菌方法的建立[J]. 中国国境卫生检疫杂志, 2017, 40(5): 317-319.
[11] 赵松, 李婷, 杨坤, 等. 重组酶介导的日本血吸虫特异性基因片段核酸等温扩增检测方法的建立[J]. 中国血吸虫病防治杂志, 2018, 30(3): 273-277.
[12] GIUFFRIDA M C, SPOTO G. Integration of isothermal amplification methods in microfluidic devices: Recent advances[J]. Biosens Bioelectron, 2017, 90: 174-186.
[13] AGUSTIN GONZ LEZ C, MIRIAM H, MIGUEL ANGEL L, et al. Real sample analysis on microfluidic devices[J]. Talanta, 2007, 74(3): 342-357.
LEZ C, MIRIAM H, MIGUEL ANGEL L, et al. Real sample analysis on microfluidic devices[J]. Talanta, 2007, 74(3): 342-357.
[14] HAMON M, OYARZABAL O A, HONG J W. Nanoliter/picoliter scale fluidic systems for food safety[J]. Acs Symposium, 2013, 1 143:145-165.
[15] JEONG-YEOL Y, BUMSANG K. Lab-on-a-chip pathogen sensors for food safety[J]. Sensors, 2012, 12(8): 10 713-10 741.
[16] 吕蓓, 程海荣, 严庆丰, 等. 体外核酸快速扩增技术的发展和不断创新[J]. 中国生物工程杂志, 2011, 31(3): 91-96.
[17] 周新丽, 申炳阳, 孔兵, 等. 用于水产品中甲醛、双氧水和二氧化硫同时快速检测的微流控芯片系统研制[J]. 食品与发酵工业, 2019, 45(4): 196-201.
[18] 苑宝龙, 王晓东, 杨平, 等. 用于农药残留现场快速检测的微流控芯片研制[J]. 食品科学, 2016, 37(2): 198-203.
[19] 叶嘉明, 邵佳美, 杨平, 等. 用于农残快速检测的离心式微流控芯片研制[J]. 食品科学, 2017, 38(12): 292-297.
[20] GB/T 25165—2010 明胶中牛、羊、猪源性成分的定性检测方法-实时荧光PCR法[S]. 北京: 中国标准出版社, 2010.