6′,7′-环氧佛手柑素(6′,7′-epoxybergamottin, 6′,7′-EB)是补骨脂素的5-O-取代衍生物,属于呋喃香豆素(furanoucoumarins, FCs)类物质。与之结构相似的物质还包括:佛手柑素、6′,7′-二羟佛手柑素(6′,7′-dihydroxybergamottin, 6′,7′-DHB)、异欧前胡素(isoimperatorin, IIR)、氧化前胡素、水合氧化前胡素、佛手柑内酯及佛手酚等(见图1)。FCs广泛分布于以芸香科和伞形科为代表的高等植物中[1-2],具有抗艾滋病、抗菌、抗血小板凝集、抗癌、抗结核、抗惊厥以及护肝等生理活性[3-9]。

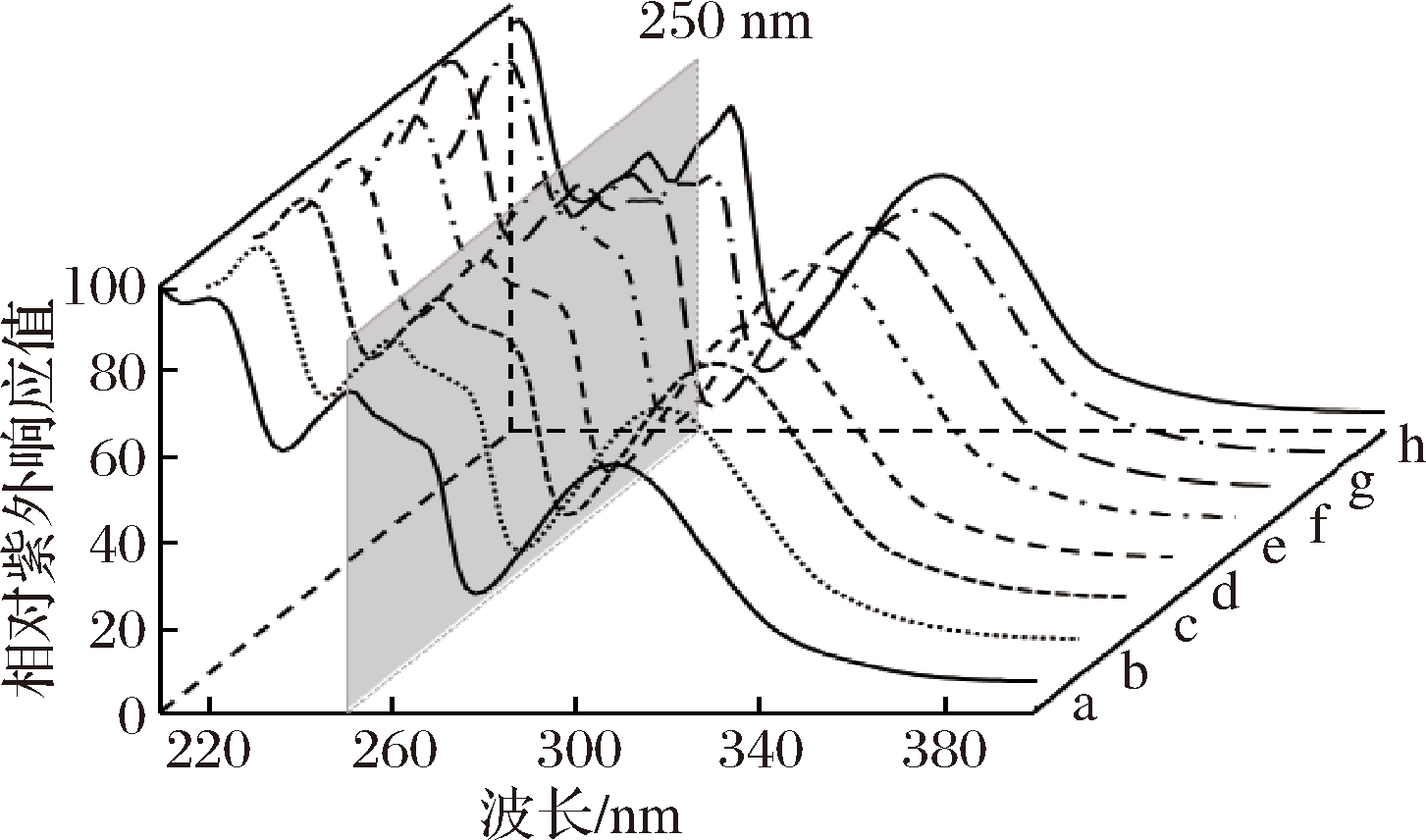
R=a-佛手柑素;b-6′,7′-环氧佛手柑素;c-6′,7′-二羟佛手柑素;d-异欧前胡素;e-氧化前胡素;f-水合氧化前胡素;g-佛手柑内酯;h-佛手酚
图1 柑橘中常见5-O-取代呋喃香豆素的结构
Fig.1 Structures of common 5-O-substituted furanocoumarins in citrus species
以葡萄柚为代表的某些柑橘中含有6′,7′-EB及其衍生物,它们还具有抑制哺乳动物细胞色素P450(cytochrome P450, CYP)的作用[10],使CYP依赖的药物代谢减缓,对于正在服药的患者具有一定的风险[11-13]。该抑制作用的强弱与侧链取代基的结构有关[14]。ROW等[15]认为5-O-侧链烃基长度与FCs的抑制效果呈正相关,取代基上存在烯键和6′,7′-亲水基团也会增强抑制作用,并研究得到上述FCs对小肠S9组分CYP3A4的半抑制浓度为6′,7′-EB 柑橘汁是柑果的主要加工产品,不同品种的柑橘汁中FCs的组成和含量各不相同,如甜橙和宽皮桔汁几乎不含FCs,葡萄柚汁含6′,7′-DHB和佛手柑素等[3],而柚子汁含有氧化前胡素和6′,7′-EB等[16];不同成熟期、灌装方法和贮藏条件对同一品种柑橘汁所含FCs也有影响[17];果肉的不同组分如汁胞液、汁胞壁、囊瓣壁等在加工破碎过程中对果汁FCs的贡献比例也有显著差异[18]。因此,要深入研究柑橘汁产品对人体CYP的作用,需能准确地定性、定量分析其中的FCs并进一步了解其变化情况。前期研究[19]发现,对pH 3.5的葡萄柚汁做6′,7′-EB和6′,7′-DHB的加标回收实验,前者回收率低于75%,而后者回收率高达120%以上。由此推测在该酸性条件下部分6′,7′-EB转化为6′,7′-DHB,即5-O-取代侧链上的环氧基开环并与水分子结合生成对应的邻二醇。此类反应的开环速率与质子酸催化剂的强度密切相关[20],因而柑橘汁酸度将对反应速率和进程产生重要的影响。 迄今尚未有果汁中6′,7′-EB等FCs的变化及反应产物和速率的报道。过往对食品成分化学反应的动力学研究大多关注单一反应物的简单反应速率[21-22],所用检测方法常为滴定、比色等传统方法[22-23],近年来才逐步采用色谱法及其联用技术,并同时对反应产物进行定性和定量分析[24-27]。然而,它们都采用人工定时取样的方式,且部分研究取样后并未立即终止反应,难以避免误差。本研究开发了一套柱前在线反应-高效液相色谱-二极管阵列检测联用的方法,通过全程自动控制,精确分析25 ℃常温下不同酸度的模拟柑橘汁中6′,7′-EB的反应产物和反应速率,并通过实际果汁样品予以验证,从而探究柑橘汁加工过程中FCs的变化情况,为评价柑橘汁对CYP的作用提供依据。 红葡萄柚(星路比)成熟果实,国家果树种质资源柑橘圃(重庆)。 蔗糖、果糖、葡萄糖、维生素C和柠檬酸(色谱纯),美国Sigma-Aldrich公司;NaOH(分析纯),天津市风船化学试剂科技有限公司。 标准对照品(HPLC级):6′,7′-环氧佛手柑素、佛手酚、佛手柑素,美国ChromaDex公司;佛手柑内酯,加拿大TRC公司;6′,7′-二羟佛手柑素、异欧前胡素、氧化前胡素、水合氧化前胡素,上海源叶生物有限公司。乙腈、甲醇、四氢呋喃、H3PO4(色谱纯),美国Honeywell公司;乙酸乙酯(分析纯),成都市科隆化学品有限公司。 装配恒温自动进样器的HPLC-DAD系统(Infinity 1260),安捷伦科技有限公司;阿贝折射仪(CAR-02),Contech Instruments Ltd.;全自动数字pH计(FE28),梅特勒-托利多(上海)有限公司;超纯水系统(Milli-Q Reference),德国Merck-Millpore公司;十万分之一天平(SQP),赛多利斯科学仪器(北京)有限公司;高速冷冻离心机(Sorvall ST 16R),赛默飞世尔科技有限公司;超声波清洗器(SB-5200 DTN)、真空冷冻干燥机(Scientz-10ND)、组织研磨器(Scientz-192),宁波新芝生物科技股份有限公司;DouR@SPT-H型氮空吹扫浓缩仪,北京斯珀特科技有限公司;搅拌器(MultiQuick),德国博朗电器。 1.3.1 模拟柑橘汁的配制 按PELEG等[28]方法并作修改:配制100.0 g糖溶液,含6.0 g蔗糖、3.0 g果糖和3.0 g葡萄糖,其余用水补足。配制1.0 mol/L柠檬酸溶液100 mL。分别取适量糖、酸溶液均匀混合,加入维生素C使其质量浓度为500.0 mg/L,得到模拟青柠汁(pH 2.0、7.8°Brix)、模拟葡萄柚汁(pH 3.5、9.2°Brix)和模拟沙田柚汁(pH 5.0、12.0°Brix)。准确吸取各模拟果汁950 μL于2.0 mL棕色样品瓶中。 1.3.2 模拟柑橘汁在线反应控制 进样器样品盘控温25 ℃,样品准备和反应于样品瓶中在线进行,设置并优化自动化程序如下: 进样针提针→甲醇润洗进样针外壁→吸取6′,7′-EB甲醇溶液50 μL→移入模拟柑橘汁样品瓶→瓶内吹打(100 μL×3次)混匀→[甲醇清洗进样针内外壁2次→吸取模拟柑橘汁反应液5 μL→吸取反应终止液5 μL→进样,六通阀切换至旁路→进样针提针→持续吹打(100 μL/min)混匀模拟柑橘汁反应液→单次HPLC分析结束前2 min提针]×N次→分析结束,彻底清洗进样系统和全流路 其中反应终止液为NaOH溶液,pH 2.0反应体系对应浓度为10.0 mmol/L,pH 3.5/5.0反应体系对应浓度为0.3 mmol/L。 1.3.3 模拟反应体系的样品分析条件 色谱柱:Thermo Scientific Accucore PFP(2.6 μm, 150 mm×4.6 mm);柱温30 ℃;流速1.0 mL/min。流动相条件根据不同酸度下反应速率的快慢进行优化。对pH 2.0体系采用等度洗脱,0~7 min保持V(水)∶V(乙腈)=35∶65。对pH 3.5和5.0体系采用梯度洗脱,流动相组成为:A水、B乙腈、C V(水)∶V(四氢呋喃)=50∶50;梯度程序为:0~4 min,57%A、15%B、28%C;6~10.5 min,35%A、35%B、30%C;10.51~20 min,后运行。检测器设置:DAD扫描波长为 210~400 nm,定量检测波长设为250 nm。 1.3.4 果肉和果汁样品的前处理和色谱条件 成熟葡萄柚果实去外果皮后,小心清理囊衣上附着的白皮层和残留筋络,将裸露果球称重。 果肉FCs提取:将已知质量的鲜果球粗分为4~6瓣,置于-45 ℃真空冷冻干燥机中脱水至恒重,经组织研磨器粉碎,加入适量乙酸乙酯进行超声辅助提取(25 ℃, 300 W, 10 min),重复3次,合并提取液并在40 ℃氮气流下吹干,用甲醇重溶解并过0.22 μm滤膜后,得到葡萄柚果肉原始FCs粗提物。 果汁FCs提取:将2批已知质量的鲜果球快速打碎成果浆,再分别进行超声处理(25 ℃, 300 W)30和60 min,迅速加入适量0.1 mol/L NaOH溶液,将果浆pH调至5.0~7.0之间,终止酸诱导反应。果浆过单层纱布滤出果汁,果渣用少量清水洗涤3次,合并果汁和洗涤液,加入适量乙酸乙酯萃取,重复3次后合并有机相,后续步骤同果肉萃取。 色谱条件:采用安捷伦Poroshell 120 EC-C8色谱柱(2.7 μm,4.6 mm×150 mm),流动相流速为1 mL/min,四元流动相组成:0.025%磷酸水溶液(A)、甲醇(B)、乙腈(C)和体积分数20%四氢呋喃水溶液(D),采用周琦等[29]的HPLC梯度洗脱方法;DAD设置同模拟果汁检测条件。 1.3.5 FCs成分的定性和定量分析 以紫外吸收光谱和色谱峰保留时间相结合的方法对模拟柑橘汁反应体系样品以及葡萄柚样品的FCs成分做定性分析。准确称取各FCs标准物质溶于甲醇中,配制成浓度为40.0 mmol/L储备液,逐级稀释得到摩尔浓度为2.0、1.5、1.0、0.5、0.25、0.10和0.01 mmol/L的系列稀释液,经HPLC测定后求出各物质的峰面积-浓度线性关系,采用外标法对样品中的目标成分做定量分析。 1.3.6 数据统计与分析 所有数据均平行测定3次,结果表示为平均值±标准偏差。数据分析及图表绘制由Excel 2016和Origin 8.5软件完成。 传统上,化学反应过程的在线分析一般依赖于专用或自研设备。随着商品化液相色谱功能的日益增强,利用其恒温、可编程的自动进样系统作为原位在线反应控制单元,结合HPLC的分离和分析能力,使得对反应体系的定时取样、反应生成物的定性鉴定以及反应速率的分析确定得以实现。进样器六通阀可使流路在主路(main-pass)和旁路(by-pass)间切换:主路模式下,流动相经定量器、进样环、进样针和针座,推动样品进入色谱柱;旁路模式下,上述进样部件被短接,流动相直接泵送至色谱柱以维持流路。基于对六通阀的充分利用,通过程序设置在分析样品的同时维持反应液的吹打、混匀操作,保证了反应平稳、充分。 为进一步消除从吸取反应液到反应终止前一小段时间对反应速率精确计算的影响,设计了进样针连续吸取反应液和终止液而后迅速进样的程序。由于进样针内径狭窄,两段液柱接触面极小,反应并不会立即终止;进样后,针内液柱被流动相迅速带到色谱柱前端,遇填料颗粒产生湍流而充分混合,此时反应终止。故每次进样的时间点即为反应过程中的数据采集点,时间精度达0.01 min。由于从反应到分析的全过程操作均由机器完成,最大限度地排除了包括人工在内的各种偶然因素,因而分析误差仅取决于仪器的系统误差,具有很高的精度优势。 利用DAD对8个5-O-取代呋喃香豆素(a~h)标准品溶液进行扫描,得到各物质的紫外吸收光谱,如图2所示。 a-佛手柑素;b-6′,7′-环氧佛手柑素;c-6′,7′-二羟佛手柑素; 母环上相同位置取代的FCs紫外光谱具有相似性,但精确对比发现各物质的主峰(310 nm附近)和肩峰(250 nm附近)仍有2~5 nm的区别,其中佛手酚(5-羟补骨脂素)差异最明显,羟基的存在减弱了母环的共轭效应,从而使主峰和肩峰都产生了约5 nm的蓝移。通过与标准物质比对光谱和保留时间,能够对模拟反应体系和真实样品中的目标FCs准确定性。为避免溶剂在低波长端的干扰,选择相对响应值较高的250 nm作为定量检测波长。各物质的回归方程如表1所示,相关系数R2在0.999 4~1.000 0之间。 表1 各呋喃香豆素的定量线性关系 编号名称CAS相对分子质量回归方程相关系数(R2)a佛手柑素7380-40-7338.40A=12.727×C0.999 7b6′,7′-环氧佛手柑素206978-14-5354.40A=7.974 0×C0.999 8c6′,7′-二羟佛手柑素264234-05-1372.41A=5.880 6×C0.999 9d异欧前胡素482-45-1270.28A=14.845×C0.999 8e氧化前胡素26091-73-6286.28A=16.411×C0.999 5f水合氧化前胡素2643-85-8304.29A=10.290×C1.000 0g佛手柑内酯484-20-8216.19A=17.578×C0.999 4h佛手酚486-60-2202.16A=22.162×C0.999 7 注:A为色谱峰面积,c为浓度(μmol/L) 在25 ℃、pH 5.0的相对低酸性模拟果汁中6′,7′-EB基本稳定,经过48 h反应仅有约0.3%损失,生成微量水合产物6′,7′-DHB,未检出其他FCs(色谱图略)。对常见酸果类柑橘(pH≈2.0)和汁用柑橘(pH≈3.5)模拟体系中6′,7′-EB反应进行分析,发现酸度是影响反应产物和速率的关键因素,酸性越强反应速率越快。 2.3.1 pH 2.0模拟体系 6′,7′-EB酸诱导反应过程中连续自动取样分析的色谱图如图3-A所示。追踪反应物和准确定性的2个产物的浓度变化情况,结果显示,6′,7′-EB首先发生了平行反应(parallel reaction),6′,7′-DHB为主反应产物,IIR为副反应产物;两者的摩尔浓度都呈现先升高、后降低的趋势,且极大值于约28 min同时出现(见图3-B),由此判断6′,7′-DHB和IIR还发生了后续反应(consecutive reaction),生成了其他未知物质。图3-C显示6′,7′-EB的ln(C0/Ct)值与反应时间的线性关系优良(R2=0.998 1),表明其浓度降低的过程符合一级反应规律。根据拟合方程得出6′,7′-EB在25 ℃ pH 2.0的模拟柑橘汁中表观反应速率常数k’=0.071 4 min-1,其半寿期为9.71 min。 A-各取样点反应样品色谱图;B-6′,7′-EB及其主要反应产物的浓度-时间曲线;C-6′,7′-EB按一级反应规律拟合的线性曲线 进一步分析反应过程,设6′,7′-DHB和IIR的后续反应表观级数也是一级,将模拟柑橘汁中的复杂反应简化如下(k1~k4为各简化反应的表观速率常数): 考察6′,7′-EB、6′,7′-DHB和IIR的实时浓度: 得到各反应速率方程为: (1) (2) (3) 6′,7′-DHB和IIR的浓度y1、y2积分通式为: (4) (5) 当[B]、[C]出现极大值时,公式(4)、(5)的一阶导数为零,此时有: (6) (7) (8) (9) 如图3-B所示,t1max=t2 max=28.0 min,y1max=1 206.2 μmol/L,y2max=168.4 μmol/L,C0=1 900 μmol/L,解出k1=0.066 7 min-1、k2=0.010 2 min-1、k3=0.016 2 min-1、k4=0.086 5 min-1。其中k1+k2与6′,7′-EB降低的速率常数k’接近(相对误差约7.7%),进一步验证了6′,7′-EB发生2个平行反应的模型与实际情况相符。对于酸度接近pH 2.0的酸果类柑橘,在测得果肉中6′,7′-EB初始含量C0的基础上,利用各速率常数通过公式(4)和(5)即可计算果实榨汁后任一时刻果汁中6′,7′-DHB和IIR的含量。 2.3.2 pH 3.5模拟体系 反应体系色谱图及各物质浓度变化情况如图4所示。由于酸度降低导致反应速率减缓,取样间隔适当放宽,色谱分析时间也随之延长。pH 3.5条件下, A-各取样点反应样品色谱图;B-6′,7′-EB及其主要反应产物的浓度-时间曲线;C-6′,7′-EB按一级反应规律拟合的线性曲线 6′,7′-EB的降解仍服从一级反应规律,表观速率常数k’=0.005 79 min-1,半寿期增至119.7 min,约是pH 2时的12倍。主副反应产物仍是6′,7′-DHB和IIR,但其浓度-时间曲线单调递增并逐步趋缓,反应物和产物的物质总量也基本保持稳定(图4-B),因此可以判断模拟体系中只发生了平行反应的第一步,pH 3.5酸度不足以催化后续反应的进行。 此时2.3.1中公式(2)、(3)简化为: 两式相除有: 在6′,7′-DHB和IIR初始浓度均为0的条件下,上式进一步简化为: (10) 由图4-B中6′,7′-DHB和IIR两条曲线在各时间点对应的高度求得,k1/k2=12.22±0.57,代入公式(1)中得到:k1=0.005 35 min-1,k2=0.000 438 min-1。 葡萄柚是柚类的一种,在我国又称西柚,是全球仅次于甜橙的第二大汁用柑橘类别,其中的红肉品系在西方也用于鲜食。由于红葡萄柚果汁色泽粉红诱人,具有独特的香气和风味,近年来已逐渐被国人接受和喜爱。葡萄柚汁加工从榨汁、精滤、均质到脱气等程序均在常温中进行,耗时约半小时到数小时不等;非浓缩还原(not from concentrate, NFC)汁和浓缩汁还要经过短时高温灭菌和蒸发等热处理,而当前最高档的超高压处理(high pressure processing, HPP)果汁则全程都处于常温状态。可利用已获得的6′,7′-EB反应机理和动力学参数,对常温处理过程中葡萄柚汁FCs的组成和含量变化进行预测。 6′,7′-环氧佛手柑素与酸接触反应从果实破碎即已开始,而果汁粗提物的前处理时间长达30 min以上,难以通过对果汁的检测获取FCs的准确初始含量,故采用冷冻干燥使红葡萄柚果肉脱水再进行有机溶剂萃取。干燥果肉提取物及榨汁破碎30、60 min后的粗滤汁提取物的色谱图如图5所示,果肉和果汁中均未检出氧化前胡素(e)和水合氧化前胡素(f),而干燥原始果肉中未检出异欧前胡素。 按果肉初始FCs含量计算果汁在2个时间点取样的FCs含量,比较计算预测值与实测值之间的差异,结果如表2所示。由表2可见,6′,7′-EB(b)、6′,7′-DHB(c)和IIR(d)的预测值与实测值的相对偏差在10.1%~14.9%之间;同时发现佛手柑素(a)在果肉和果汁中的实测含量也呈现较大的偏差(9.9%和11.0%)。由于常温下佛手柑素结构稳定,不发生酸诱导反应,其浓度应基本不随时间推移而变化,因而果肉与果汁间的测定差异应主要来源于前处理,即干燥果肉中的佛手柑素提取效率比果汁中更高;以干燥果肉提取效率为100%,30、60 min时果汁的相对提取效率为89.0%和90.1%,又由于b、c、d三物质的保留时间与a接近,可粗略认为它们的提取效率基本相同。据此,分别对2个时间点果汁中各FCs实测浓度进行修正,则果汁的实测修正值与预测值之间的相对偏差仅为:6′,7′-EB 0.8%和1.6%,6′,7′-DHB 2.2%和2.3%,IIR 3.4%和5.6%。该结果说明25 ℃模拟果汁动力学方程与实际反应基本相符,利用本方法能够较准确地预测pH约为3.5的柑橘汁加工过程中,6′,7′-EB及其相关FCs产物的组成和含量变化。 a-佛手柑素;b-6′,7′-环氧佛手柑素;c-6′,7′-二羟佛手柑素,d-异欧前胡素;e-氧化前胡素;f-水合氧化前胡素; 表2 红葡萄柚汁中FCs随时间变化的预测值、实测值及实测修正值的比较 保留时间/minFCs0 min30 min60 min果肉提取物实测值/(μg·kg-1)果汁提取物预测值/(μg·L-1)果汁提取物实测值/(μg·L-1)相对偏差1/%果汁提取物实测修正值∗/(μg·L-1)相对偏差2/%果汁提取物预测值/(μg·L-1)果汁提取物实测值/(μg·L-1)相对偏差1/%果汁提取物实测修正值/(μg·L-1)相对偏差2/%12.2h47.1±5.2NA45.2±3.74.0--NA39.5±3.516.1--17.8g22.5±0.8NA23.0±0.6-2.2--NA21.1±0.46.2--33.5c6 582.3±193.06 800.3±199.45 916.2±202.110.16 650.2±227.22.26 983.5±174.36 145.2±301.012.06 819.8±334.02.339.1dND17.8±0.015.3±3.414.017.2±3.83.432.8±0.027.9±3.714.931.0±4.15.640.4b1 478.8±62.11 243.0±52.21 097.3±84.311.71 233.4±94.80.81 044.8±45.5926.2±60.811.41 027.9±67.51.644.0a9 838.0±414.1NA8 752.1±442.011.09 838.0±496.80.0NA8 864.9±393.79.99 838.0±436.90.0 注:NA,未涉及化学变化,无需计算预测值;ND,未检出,计算中作0处理;*,利用a物质在果汁和果肉中的提取量之比为换算系数,对果汁实测值作换算修正;-,h和g物质保留时间距a较远,不符合修正条件,未做修正及相对偏差2计算;对于物质h/g/a,相对偏差1(%)=(果肉提取物实测值-果汁提取物实测值)/果肉提取物实测值× 100;对于物质c/d/b,相对偏差1(%)=(果汁提取物预测值-果汁提取物实测值)/果汁提取物预测值×100,相对偏差2(%)=(果汁提取物预测值-果汁提取物实测修正值)/果汁提取物预测值×100 构建在线柱前反应-HPLC-DAD系统,开发了全套程序化自动监测柑橘汁呋喃香豆素侧链环氧基酸诱导反应的方法,在鉴定反应产物的同时实现对反应速率的研究,具有精确度高和节省人力的突出特点。利用该方法研究了模拟柑橘汁体系中6′,7′-环氧佛手柑素的侧链反应,发现其主要通过开环水合生成6′,7′-二羟佛手柑素,还发生碳链缩短反应产生少量异欧前胡素。动力学研究表明上述反应均符合一级反应规律,pH越低、反应速率越快。验证实验结果显示,应用模拟体系反应速率常数能够较准确地计算红葡萄柚汁中6′,7′-EB及其产物的实时浓度,与修正后测量值的偏差范围仅为0.8%~5.6%。研究加深了对柑橘FCs采后加工变化的认识,为评估柑橘汁生物活性作用提供了新的工具和途径。 [1] FREROT E, DECORZANT E. Quantification of total furocoumarins in citrus oils by HPLC coupled with UV, fluorescence, and mass detection[J]. Journal of Agricultural and Food Chemistry, 2004, 52(23): 6 879-6 886. [2] PEROUTKA R, SCHULZOVA V, BOTEK P, et al. Analysis of furanocoumarins in vegetables (Apiaceae) and citrus fruits (Rutaceae)[J]. Journal of the Science of Food and Agriculture, 2010, 87(11): 2 152-2 163. [3] DUGRAND-JUDEK A, OLRY A, HEHN A, et al. The distribution of coumarins and furanocoumarins in Citrus species closely matches Citrus phylogeny and reflects the organization of biosynthetic pathways[J]. PLoS ONE, 2015, 10(11)e0142757. [4] WU T S, WU P L, TSANG Z J, et al. New constituents and antiplatelet aggregation and anti-HIV principles of Artemisia capillaris[J]. Bioorganic and Medicinal Chemistry, 2001, 9(1): 77-83. [5] 敖平. 什姆干栓翅芹中具有抗免疫缺陷病毒活性的香豆素及呋喃香豆素衍生物[J]. 国外医学(中医中药分册), 2002(4): 231-232. [6] ADAMS M, ETTL S, KUNERT O, et al. Antimycobacteria activity of geranylated furocoumarins from Tetradium daniellii[J]. Planta Medica, 2006, 72(12): 1 132-1 135. [7] LIN H C, TSAI S H, CHEN C S, et al. Structure-activity relationship of coumarin derivatives on xanthine oxidase-inhibiting and free radical-scavenging activities[J]. Biochemical Pharmacology, 2008, 75(6): 1 416-1 425. [8] APPENDINO G, BIANCHI F, BADER A, et al. Coumarins from Opopanax chironium. New dihydrofuranocoumarins and differential induction of apoptosis by imperatorin and heraclenin[J]. Journal of Natural Products, 2004, 67(4): 532-536. [9] SRIKRISHNA D, GODUGU C, DUBEY P K. A Review on pharmacological properties of coumarins[J]. Mini-Reviews in Medicinal Chemistry, 2018, 18(2): 113-141. [10] GIRENNAVAR B, POULOSE S M, JAYAPRAKASHA G K, et al. Furocoumarins from grapefruit juice and their effect on human CYP 3A4 and CYP 1B1 isoenzymes[J]. Bioorganic and Medicinal Chemistry, 2006, 14(8): 2 606-2 612. [11] STRAUGHAN J L. Grapefruit-drug interactions[J]. Cardiovascular Journal of South Africa: Official Journal for Southern Africa Cardiac Society and South African Society of Cardiac Practitioners, 2007, 18(1): 39-40. [12] DE CASTRO W V, MERTENS-TALCOTT S, RUBNER A, et al. Variation of flavonoids and furanocoumarins in grapefruit juices: A potential source of variability in grapefruit juice? drug interaction studies[J]. Journal of Agricultural and Food Chemistry, 2006, 54(1): 249-255. [13] BAILEY D G, ARNOLD J M O, MUNOZ C, et al. Grapefruit juice-felodipine interaction: mechanism, predictability, and effect of naringin[J]. Clinical Pharmacology and Therapeutics, 1993, 53(6): 637-642. [14] UESAWA Y, MOHRI K. Quantitative structure-activity relationship (QSAR) analysis of the inhibitory effects of furanocoumarin derivatives on cytochrome P450 3A activities[J]. Pharmazie, 2010, 65(1): 41-46. [15] ROW E C, BROWN S A, STACHULSKI A V, et al. Design, synthesis and evaluation of furanocoumarin monomers as inhibitors of CYP3A4[J]. Organic and Biomolecular Chemistry, 2006, 4(8): 1 604-1 610. [16] XU J, MA L L, JIANG D, et al. Content evaluation of 4 furanocoumarin monomers in various citrus germplasms[J]. Food Chemistry, 2015, 187: 75-81. [17] CANCALON P F, BARROS S M, HAUN C, et al. Effect of maturity, processing, and storage on the furanocoumarin composition of grapefruit and grapefruit juice[J]. Journal of Food Science, 2011, 76(4): C543-C548. [18] MANTHEY J A, BUSLIG B S. Distribution of furanocoumarins in grapefruit juice fractions[J]. Journal of Agricultural and Food Chemistry, 2005, 53(13): 5 158-5 163. [19] LI G J, WU H J, WANG Y, et al. Determination of citrus juice coumarins, furanocoumarins and methoxylated flavones using solid phase extraction and HPLC with photodiode array and fluorescence detection[J]. Food Chemistry, 2019, 271(1): 29-38. [20] 周婵,许家喜. 非对称环氧乙烷的区域选择性亲核开环反应[J]. 化学进展, 2011, 23(1): 165-180. [21] 郭庆启,张娜,何娇,等. 蓝靛果汁花色苷热降解动力学的研究[J]. 食品与发酵工业, 2011, 37(9): 74-78. [22] 尚远,卢立新,许文才. 橙汁饮料中维生素C的无氧分解动力学[J]. 食品工业科技, 2008(10): 120-122. [23] 蒋海萍,廖丹葵,孙建华,等. 抗氧化肽HDHPVC和HEKVC的反应动力学及抗氧化能力评价方法[J]. 食品科学, 2014, 35(17): 109-113. [24] 胡静,李巨秀. 采用牛血清白蛋白/果糖体系研究荧光性AGEs生成的动力学[J]. 食品科学, 2017, 38(1): 7-12. [25] 卢永翎,肖留榜,夏秋琴,等. 精氨酸——还原糖体系中1,2-二羰基化合物的形成和抑制研究[J]. 食品与机械, 2018, 34(10): 1-7. [26] 周梦舟,丁城,关亚飞,等. 原花青素抑制丙烯酰胺的动力学[J]. 食品科学, 2018, 39(3): 123-128. [27] 常瑞,何江,罗先锟,等. 羟自由基与Neu5Gc抽氢反应的理论动力学研究[J]. 现代食品科技,2019,35(10):66-75 [28] PELEG H, NAIM M, ZEHAVI U, et al. Pathways of 4-vinylguaiacol formation from ferulic acid in model solutions of orange juice[J]. Journal of Agricultural and Food Chemistry, 1992, 40(5): 764-767. [29] 周琦,谈安群,易鑫,等. 基于柑橘汁多甲氧基黄酮特征成分鉴别橙汁中宽皮桔汁的方法[J]. 食品与发酵工业:,2019,45(17):227-233.1 材料与方法
1.1 材料与试剂
1.2 仪器与设备
1.3 实验方法
2 结果与讨论
2.1 环氧佛手柑素在线反应与自动化控制
2.2 5-O-取代FCs的紫外光谱和定量方程
d-异欧前胡素;e-氧化前胡素;f-水合氧化前胡素;g-佛手柑内酯;
h-佛手酚
图2 常见5-O-取代呋喃香豆素的紫外吸收光谱
Fig.2 UV absorbance spectra of common 5-O-
substituted furanocoumarins
Table 1 Linearity of each furanocoumarins for quantitative analysis
2.3 模拟果汁中6′,7′-EB的反应产物和速率分析
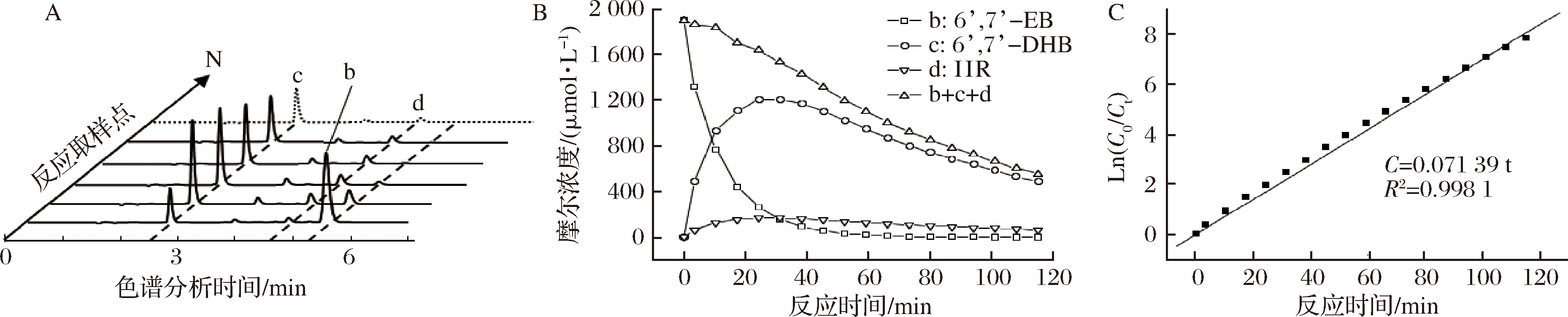
b-6′,7′-环氧佛手柑素;c-6′,7′-二羟佛手柑素;d-异欧前胡素;由于系统误差低,图中未显示误差线
图3 25 ℃, pH 2.0模拟柑橘汁中6′,7′-EB酸诱导反应主要产物和动力学分析
Fig.3 Major products and kinetic analysis of 6′,7′-EB acid induced reaction in pH 2.0 imitated citrus juice at 25 ℃
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

b-6′,7′-环氧佛手柑素;c-6′,7′-二羟佛手柑素;d-异欧前胡素
图4 25 ℃, pH 3.5模拟柑橘汁中6′,7′-EB酸诱导反应主要产物和动力学分析
Fig.4 Major products and kinetic analysis of 6′,7′-EB acid induced reaction in pH 3.5 imitated citrus juice at 25 ℃
注:由于系统误差低,图中未显示误差线![]()
![]()
![]()
2.4 葡萄柚汁中FCs组成和含量变化的计算预测和实验验证
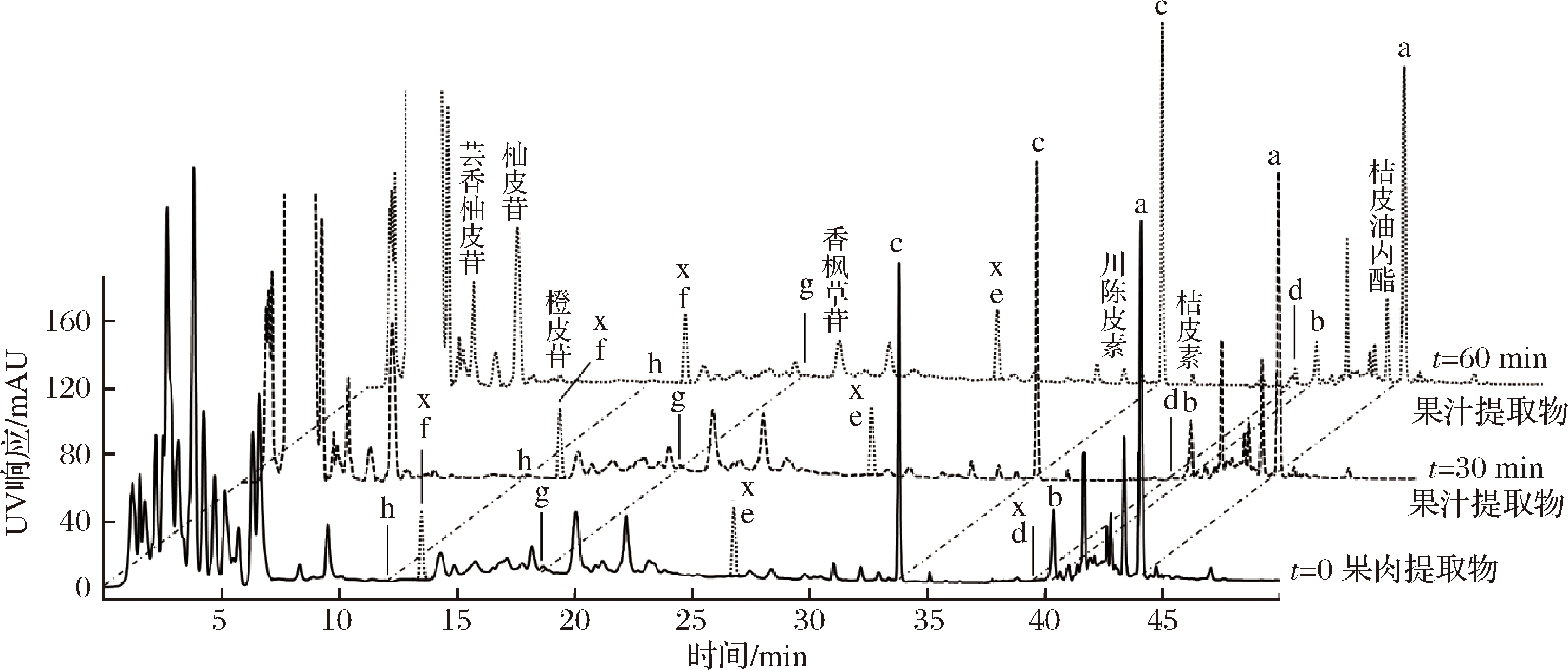
g-佛手柑内酯;h-佛手酚;同时标示其他主要次生代谢物
图5 25 ℃, pH约3.4~3.6红葡萄柚汁中与6′,7′-EB相关的主要FCs色谱图
Fig.5 Chromatograms of major FCs related to 6′,7′-EB in pH 3.4~3.6 red grapefruit juice at 25 ℃
Table 2 Comparison of predicted value, measured value and corrected measured value showing FCs changes with time
in red grapefruit juice 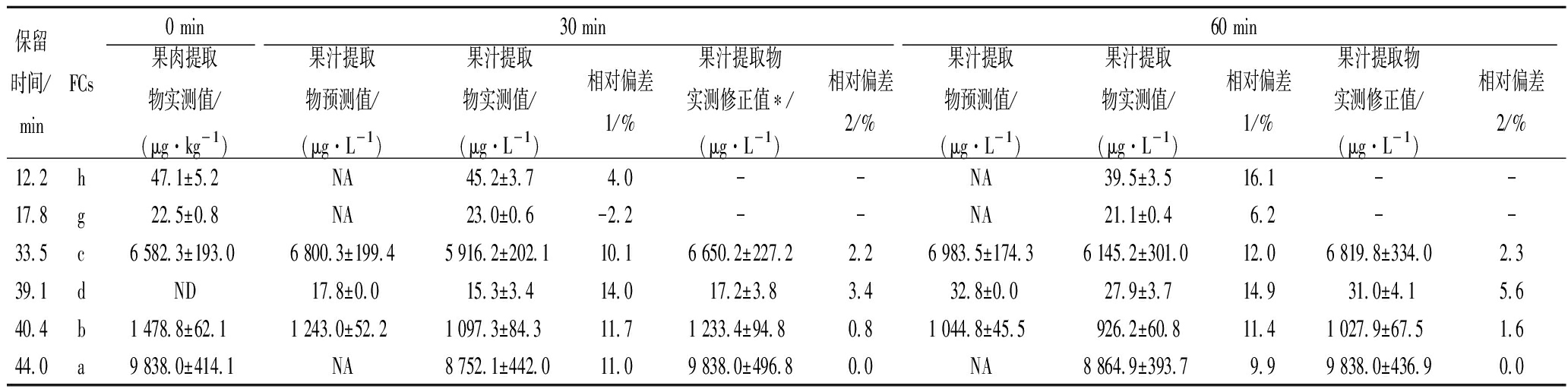
3 结论