茯砖茶是以黑毛茶为原料,经过汽蒸、渥堆、压制成型、发花等工艺精制而成的一种黑茶[1]。茯砖茶属于后发酵茶,微生物对其独特品质的形成具有重要意义,它们以茶叶为培养基生长繁殖产生金黄色闭囊壳,形成茶砖内部肉眼可见的金黄色颗粒,俗称“金花”,同时通过代谢活动转化茶叶的各种成分,形成独特的色香味品质特征,茶叶泡水汤色橙红或黄色,味道醇厚甘甜,散发浓郁的“菌花香”或者茯苓草药香[2-3]。陕西是茯砖茶的起源地,相传汉代茶商运输黑毛茶经过泾阳,不慎将茶落入河里,数月之后发现茶叶上布满“金花”。茶叶最早于泾阳自然“发花”成功,得益于其环境中的天然微生物,以及适宜“金花菌”生长繁殖的气候、水质、温度、湿度等自然条件[4]。曾经有“离开了泾河的水、关中的气候、陕西人的技术不能制”的“三不能制”说法[3],印证了陕西特有的自然条件和技术造就了独特的茯砖茶。
我国学者从1940年代开始[5-6],围绕茯砖茶的微生物开展了大量研究,其进展主要有2个方面:(1)阐述了“金花菌”是优势菌群,为曲霉属(Aspergillus)[5-7]。较多研究认为“金花”是曲霉产生的黄色闭囊壳,其中有子囊孢子,属于有性型。曲霉(Aspergillus)是无性型的属名,应该采用与之对应的有性型属名——散囊菌属(Eurotium)[5]。2012年国际曲霉委员会(International Commission on Penicillium and Aspergillus, ICPA)将Eurotium与Aspergillus同义化,采用“一菌一名”的新原则,以前包含在属Eurotium中的菌株以Aspergillus属名显示[8],因此优势菌属可归结为曲霉属。(2)论述了加工过程中微生物的变化。细菌在原料汽蒸时被全部杀死或者仅有极少数幸存,在随后的发酵中真菌是主要的发酵微生物,除了优势的曲霉/散囊菌之外,还存在黑曲霉、青霉、酵母等真菌种类,对发酵也有贡献[9-10]。目前有关微生物的研究也存在一些局限,例如:(1)优势菌群在种水平的鉴定目前还存在较大争议,较多研究报道为冠突散囊菌(Eurotium cristatum)[9-11],但是也有研究鉴定为谢瓦氏曲霉(Aspergillus chevalieri)[6]、阿姆斯特丹曲霉/散囊菌(Aspergillus/Eurotium amstelodami)[12]。造成这些分歧的一个原因是研究方法,大部分研究采用培养法,根据曲霉的形态特征来判断菌种,然而某些形态特征是不稳定的,例如培养方法不同,曲霉的子囊孢子或者分生孢子的形态和大小有可能改变,或者孢子的成熟度不同其形态也可能有差异,从而影响种类判断[7,13]。近年的研究运用了18S rRNA/ITS基因序列分析[9,14]或者Illumina高通量测序[11]的方法鉴定优势菌种,由于曲霉属的序列相对比较保守,或者数据库比对等原因,获得的种水平信息仍然不足[7]。(2)次优势菌群的种类研究较少。(3)针对真菌的研究多,而细菌的研究很少。因此,仍然需要更多的研究以阐明其中微生物的多样性和群落结构。
茯砖茶微生物的研究主要集中于湖南产区的样品,陕西产区的研究不多。陕西是茯砖茶的起源地和主产区之一,茯砖茶是地理标志性产品,陕西这一特定地域环境中生产出的茯砖茶的微生物组成可能是地域特异性的,阐明微生物的多样性和群落结构有助于地理标志产品的保护。为此,本研究采用Illumina MiSeq测序技术研究陕西茯砖茶样品中细菌和真菌的多样性和群落结构。
1 材料与方法
1.1 实验材料
1.1.1 实验原料
从陕西采集茯砖茶样品6个,sx1、sx2、sx6采自咸阳市,sx3、sx5采自泾阳县,sx4采自紫阳县。
1.1.2 药品试剂
食品基因组DNA提取试剂盒DNeasy mericon Food Kit (69514),德国Qiagen公司;琼脂糖Regular Agarose G-10,西班牙BIOWEST;TransStart® FastPfu DNA Polymerase,北京全式金生物技术有限公司。
PBS缓冲液:称取NaCl 8 g,KCl 0.2 g,Na2HPO4·12H2O 3.62 g,KH2PO4 0.24 g,溶解于800 mL蒸馏水中,用HCl调pH值为7.4,然后加水定容至1 L。
引物:338F(5′-ACTCCTACGGGAGGCAGCAG-3′)、806R(5′-GGACTACHVGGGTWTCTAAT-3′)[15]、ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)、ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)[16],委托生工生物工程(上海)股份有限公司合成。
1.1.3 仪器设备
T100 PCR仪、Power pacbasic电泳仪,美国Bio-Rad公司;5810R高速冷冻离心机,德国eppendorf股份公司;G:BOX EF凝胶成像系统,美国Syngene公司;P100/P100+超微量分光光度计,美国Pultton公司。
1.2 实验方法
1.2.1 宏基因组DNA 的提取
分装100 mL PBS缓冲液于500 mL三角瓶中,加入直径2 mm的玻璃珠5 g,121 ℃灭菌20 min,冷却后备用。准确称取10.000 g茶叶,加入已灭菌的装有100 mL PBS缓冲液的三角瓶中,于摇床(180 r/min,37 ℃)振荡1 h,用纱布过滤,取滤液10 000 r/min离心 20 min,将沉淀用灭菌的PBS溶液洗1遍,用DNeasy mericon Food Kit试剂盒按照说明书的步骤提取微生物的宏基因组DNA[9,11]。用P100/P100+超微量分光光度计检测DNA的浓度和纯度,用1%琼脂糖凝胶电泳检测DNA的质量。提取的宏基因组DNA保存于-80 ℃备用。
1.2.2 PCR扩增
用引物338F和806R扩增细菌的16S rRNA基因。20μLPCR反应体系包括:4 μL 5ⅹFastPfu缓冲液,2 μL 2.5 mmol/L dNTPs, 0.8 μL 5 μmol/L引物,0.4 μL FastPfu聚合酶,10 ng DNA模板。扩增程序为:95 ℃预变性3 min,30次循环(95 ℃变性30 s,57 ℃褪火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min[15]。用引物ITS1F和ITS2R扩增真菌的ITS1基因,退火温度为55 ℃,其余条件相同[16-17]。
1.2.3 Illumina MiSeq测序
经过验证的茯砖茶样品宏基因组DNA送上海美吉生物医药科技有限公司,运用Illumina MiSeq PE300平台对细菌16S rRNA基因的V3-V4可变区测序,引物为338F和806R,长度为468 bp[15],同时用ITS1F和ITS2R引物对真菌的ITS1区测序,长度为300 bp[16-17]。
1.2.4 数据分析
原始序列使用Trimmomatic软件质控[18],用FLASH软件进行拼接[19]:(1)设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,去除质控后长度低于50 bp的序列;(2)barcode需精确匹配,引物允许2个碱基的错配,去除模糊碱基;(3)根据重叠碱基overlap将两端序列进行拼接,overlap需大于10 bp。去除无法拼接的序列。将获得的高质量序列采用定量研究微生物群落包(quantitative insights into microbial ecology,QIIME,version 1.7)[20]做生物信息分析。用UCLUST算法对序列在97%的相似度水平下进行聚类,获得分类操作单元(operational taxonomic units,OTUs)[21],将16S rRNA序列基于Silva(Release132, http://www.arb-silva.de)[22]细菌数据库进行比对,ITS序列基于Unite(unite7.0/its_fungi,Release 7.0,http://unite.ut.ee/index.php)[23]真菌数据库进行比对,比对阈值均为70%,得到每个OTU对应的物种分类信息,生成不同分类水平上的物种丰度表。用QIIME计算α多样性指数Shannon、ACE、Chao1、Coverage,绘制OTU水平下的Shannon指数图。用R语言绘制样品在门、属、种水平下的物种构成图。部分数据分析在上海美吉生物医药科技有限公司的I-Sanger免费在线云平台中完成(https://www.i-sanger.com/)。
1.2.5 NCBI序列号
本研究中细菌的16S rRNA序列和真菌的ITS1序列被存入NCBI 的Sequence Read Archive (SRA)数据库(https://www.ncbi.nlm.nih.gov/sra),注册号分别为BioProject ID PRJNA590942和PRJNA560449。unclassified Aspergillus OTU的序列也提交到NCBI GenBank中,OTU38、135、59、45、71、77、118的序列注册号依次为MN318427~MN318433。
2 结果与分析
2.1 Illumina MiSeq测序的基本数据和α多样性指数
用PCR扩增6个茯砖茶样品的细菌16S rRNA基因,只有sx4和sx5 样品产生条带,其余4个样品没有条带,可能因为细菌含量很低。6个样品的真菌ITS1基因扩增均产生条带。用Illumina MiSeq对细菌的16S rRNA基因V3-V4可变区和真菌的ITS1基因测序,其基本数据和α多样性指数如表1所示。Coverage均为1.000,说明测序深度已经基本覆盖到样品中的所有物种。样品sx4和sx5的细菌OTU数和α多样性指数大于真菌的数据,说明其多样性高于真菌。
图1为细菌和真菌在OTU水平上的Shannon曲线图。由图1可知,随着测序深度的增加,物种的数量也随之增加,当测序深度达到10 000 之后,Shannon曲线进入了平台期,说明细菌或真菌多样性已经不再增加,本研究的测序数量已足够充分。
2.2 细菌和真菌在不同分类水平下的数量统计
由Illumina MiSeq测序得到的茯砖茶样品中细菌和真菌在不同分类水平下的数量统计如表2所示。
2.3 细菌的多样性和群落结构
样品sx4、sx5的细菌在门、属水平上种类构成如图2所示。
表1 陕西茯砖茶样品细菌和真菌多样性测序的基本数据和α多样性指数
Table 1 The general data of Illumina MiSeq sequencing in the analysis of bacterial and fungal diversity in Shaanxi Fu
brick tea samples and their alpha diversity indices
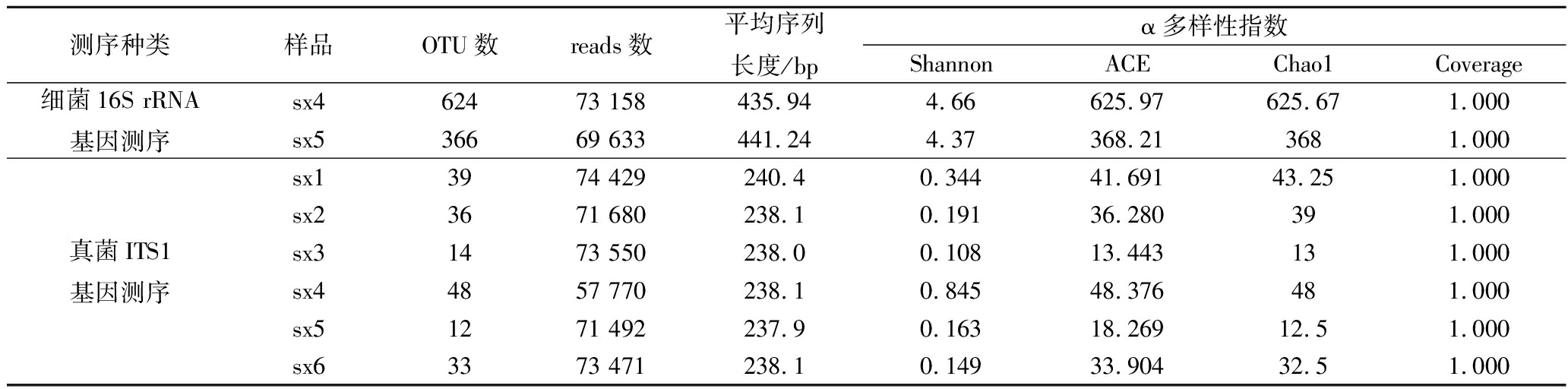
测序种类样品OTU数reads数平均序列长度/bpα多样性指数ShannonACEChao1Coverage细菌16S rRNA基因测序sx462473 158435.944.66625.97625.671.000sx536669 633441.244.37368.213681.000真菌ITS1基因测序sx13974 429240.40.34441.69143.251.000sx23671 680238.10.19136.280391.000sx31473 550238.00.10813.443131.000sx44857 770238.10.84548.376481.000sx51271 492237.90.16318.26912.51.000sx63373 471238.10.14933.90432.51.000

a-细菌;b-真菌
图1 陕西茯砖茶样品细菌和真菌在OTU水平的
Shannon指数图
Fig.1 The Shannon's diversity index curves generated
from the OTU data of bacteria and fungi present in Shaanxi
Fu brick tea samples
表2 陕西茯砖茶样品的细菌和真菌在不同分类水平下的
数量统计
Table 2 The statistical table of the distribution of bacteria
and fungi at different taxonomic levels in Shaanxi Fu
brick tea samples

测序种类样品门纲目科属种细菌16S rRNA基因测序sx4264998155272394sx5214488134216265总计2859118197362526真菌ITS1基因测序sx13912162230sx23911131924sx32788911sx451520232934sx5255579sx63811131725总计51828365366
2.4 真菌的多样性和群落结构
茯砖茶样品的真菌种类构成如图3所示。最优势的门是子囊菌门Ascomycota,6个样品的平均相对丰度为99.67%,其次为担子菌门Basidiomycota(0.20%)、unclassified_k_Fungi(0.10%)、接合菌门zygomycota(0.03%)。最优势的属是曲霉属Aspergillus,平均相对丰度为99.123%,还包括酵母:念珠菌Candida(0.230%)、Cyberlindnera(0.167%)、隐球菌属Cryptococcus(0.073%)、低温酵母Guehomyces(0.060%);霉菌:被孢霉属Mortierella(0.130%)、腐质霉属Humicola(0.110%)、镰刀霉Fusarium(0.025%)、赤霉属Gibberella(0.023%)、茎点霉Phoma(0.005%);以及其他真菌:Wallemia(0.124%)、Westerdykella(0.110%)。
经过“unite7.0/its_fungi”数据库注释,从Aspergillus属的序列中仅鉴定出3个种:Aspergillus cibarius、Aspergillus piperis、Aspergillus penicillioides,平均相对丰度分别为4.138%、0.879%、0.019%,其余相对丰度94.591%的序列未能得到种水平信息。unclassified_g_Aspergillus的序列共有7条,其OTU编号为38、135、59、71、118、45、77,将它们输入GenBank数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,得到的种类鉴定结果如表3所示。OTU118的Query Coverage只有85%,即与数据库中序列重合度只有85%,其余15%的序列无参考序列与之比对,尽管序列相似度(Percent Identity)达到100%,其菌种鉴定结果有可能不可靠。与序列OTU38、135、59、71匹配度最高的参考序列都为曲霉属的序列,同源性大于99%,但是存在多个菌种,即可能为阿姆斯特丹曲霉Aspergillus amstelodami、谢瓦氏曲霉Aspergillus chevalieri、Eurotium sp.、Aspergillus spiculosus、Aspergillus heterocaryoticus、Aspergillus sp.、Aspergillus ruber、Aspergillus cristatus中的一种或几种,由于ITS1序列同源性比较高而不容易区分。根据真菌ITS序列鉴定的原则,如果所提交序列与数据库中最匹配序列为同属内不同种之间的序列,并且序列的同源性均≥98%时,认为其可鉴定至属一级[24],即可认为序列OTU38、135、59、71鉴定至属Aspergillus。类似地OTU77也可能为Aspergillus versicolor、Aspergillus creber、Aspergillus protuberus中的一种或几种。用MEGA (v7.0.14)软件对这6条序列和GenBank中相应的参考序列一起采用Neighbor Joining法构建系统进化树(图4),待测序列与参考序列的聚类关系与GenBank数据库的比对结果一致。综合上述结果可知:陕西茯砖茶中最优势的菌种可能为阿姆斯特丹曲霉Aspergillus amstelodami、谢瓦氏曲霉Aspergillus chevalieri、Eurotium sp.、Aspergillus spiculosus、Aspergillus heterocaryoticus、Aspergillus sp.、Aspergillus ruber、Aspergillus cristatus中的一种或几种,其次还含有Aspergillus cibarius(4.138%)、Aspergillus piperis(0.879%)、Aspergillus penicillioides(0.019%)、Aspergillus gracilis(0.005 8%)等曲霉属的菌种。
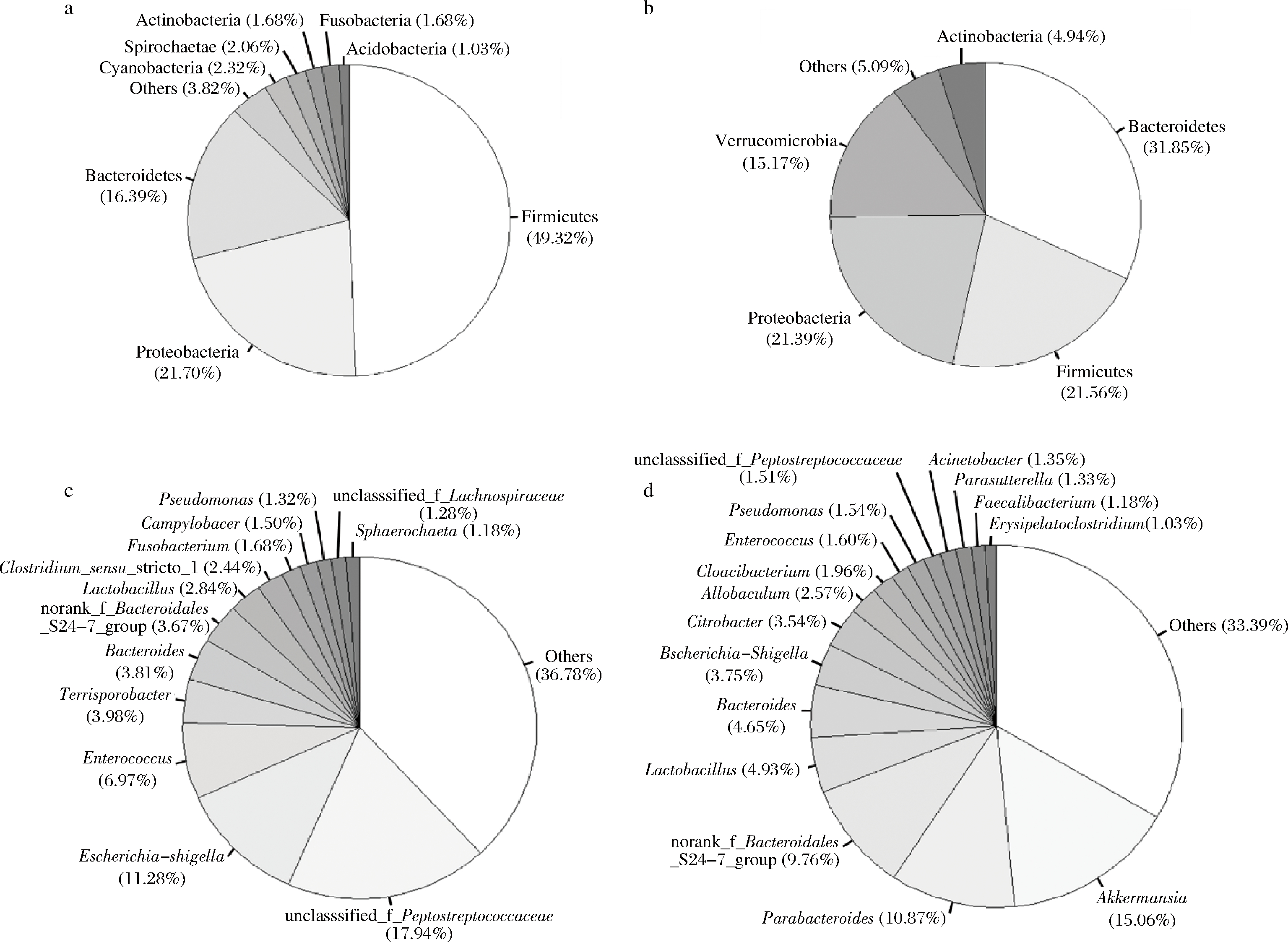
a-sx4门水平;b-sx5门水平;c-sx4属水平;d-sx5属水平
图2 陕西茯砖茶样品的细菌在门和属水平上的种类构成
Fig.2 The composition of bacteria at the level of phylum and genus in Shaanxi Fu brick tea samples
注:图中标出平均相对丰度≥1%的种类,平均丰度低于1%的种类归并为others

a-门水平;b-属水平;c-种水平
图3 陕西茯砖茶样品的真菌在门、属、种水平上的种类构成
Fig.3 The composition of fungi at the level of phylum, genus and species in Shaanxi Fu brick tea samples
表3 unclassified Aspergillus OTUs在NCBI BLAST网页上的菌种鉴定结果
Table 3 The identification results of unclassified Aspergillus OTUs by sequence alignment
method on NCBI BLAST web page

OTU编号Blast鉴定结果(number of hits)Query Coverage/%Percent Identity/%样品的平均相对丰度/%38Aspergillus amstelodami (13), Aspergillus chevalieri (9), Eurotium sp. (3), Asper-gillus spiculosus (2),.Aspergillus heterocaryoticus (2), Aspergillus sp. (2), Aspergil-lus ruber (2), Aspergillus cristatus (1)10010092.229 9135Aspergillus amstelodami (13), Aspergillus chevalieri (9), Eurotium sp. (3), Asper-gillus spiculosus (2),.Aspergillus heterocaryoticus (2), Aspergillus sp. (2), Aspergil-lus ruber (2), Aspergillus cristatus (1)10099.581.631 859Aspergillus amstelodami (12), Aspergillus chevalieri (9), Eurotium sp. (3), Asper-gillus spiculosus (2),.Aspergillus heterocaryoticus (2), Aspergillus sp. (2), Aspergil-lus ruber (2), Aspergillus cristatus (1)10099.580.242 171Aspergillus amstelodami (13), Aspergillus chevalieri (9), Eurotium sp. (3), Asper-gillus spiculosus (2),.Aspergillus heterocaryoticus (2), Aspergillus sp. (2), Aspergil-lus ruber (2), Aspergillus cristatus (1)10099.160.000 9118Aspergillus amstelodami851000.000 645Aspergillus gracilis (8) 991000.005 877Aspergillus versicolor (51), Aspergillus creber (6), Aspergillus protuberus (6)1001000.002 0总计94.113 0

图4 unclassified Aspergillus OTU序列的系统进化树图
Fig.4 The phylogenetic tree of unclassified Aspergillus OTU sequences
3 讨论
陕西茯砖茶样品中只有sx4和sx5两个样品检出细菌,可能因为细菌在汽蒸时几乎全部被杀死或者仅有少数幸存。细菌优势的属(相对丰度>1%)包含肠球菌属Enterococcus、乳杆菌属Lactobacillus、阿克曼菌属Akkermansia、狄氏副拟杆菌属Parabacteroides、粪杆菌属Faecalibacterium,从这些属名中推测茯砖茶的细菌中可能存在潜在的益生菌菌株。已知的大多数益生菌菌株属于乳杆菌属或者肠球菌属。近年来,人体肠道微生物的研究揭示:肠道内阿克曼粘细菌(Akkermansia muciniphila)的丰度与肥胖症、Ⅱ型糖尿病、动脉粥样硬化、炎症性肠病、克罗恩病等代谢性疾病呈负相关[25-26];狄氏副拟杆菌(Parabacteroides distasonis)是人体核心菌群之一,其含量与肥胖、非酒精性脂肪肝、糖尿病等疾病状态呈显著负相关,可能在糖脂代谢方面发挥正向调节作用[27];普氏粪杆菌(Faecalibacterium prausnitzii)也是健康人群最丰富的肠道微生物之一,具有抗炎效应,可明显改善肠道炎症[28]。在sx5样品中,Akkermansia、Parabacteroides、Faecalibacterium菌属的丰度分别为15.06%、10.87%和1.18%,有可能是相关益生菌菌株的潜在来源。
陕西茯砖茶样品真菌群落中最优势的菌种可能为阿姆斯特丹曲霉Aspergillus amstelodami、谢瓦氏曲霉Aspergillus chevalieri、Eurotium sp.、Aspergillus spiculosus、Aspergillus heterocaryoticus、Aspergillus sp.、Aspergillus ruber、Aspergillus cristatus中的一种或几种。根据相对丰度最高的OTU38“number of hits”分析,可能性最高的是阿姆斯特丹曲霉Aspergillus amstelodami或者谢瓦氏曲霉Aspergillus chevalieri,冠突曲霉Aspergillus cristatus的hit数只有1,在进化树(图4)中其参考序列与OTU序列和其他菌种的参考序列之间有一定的区分度,由此推测冠突曲霉作为优势菌种的可能性比较低。现有的陕西茯砖茶微生物研究多次报道过Aspergillus/Eurotium amstelodami,例如孟雁南等[29]采用 Illumina Miseq 高通量测序技术研究了10个陕西茯砖茶样品的真菌群落结构,也通过UNITE和NCBI比对,论述了“金花菌”可能为Aspergillus chevalieri、A. amstelodami、A. montevidensis、A. cristatus、A. spiculosus、A. cibarius、Eurotium amstelodami、E. rubrum 中的一种或几种,与本研究的结果一致。吕嘉枥等[30-31]将分离纯化出的“金花菌”采用ITS序列或者18S rRNA序列分析法鉴定为阿姆斯特丹曲霉(Aspergillus amstelodami);此外,刘石泉等[12]用PCR-DGGE法研究湖南茯砖茶发花过程中的真菌群落结构和种类,发现第10天后的优势菌种为阿姆斯特丹散囊菌。韩省华等[32]从杭州陈置多年的茯砖茶中分离鉴定出阿姆斯特丹散囊菌。欧惠算等[33]采用分子生物学方法将六堡茶的“金花菌”鉴定为阿姆斯特丹散囊菌,该菌能够降解茶中的茶多酚、黄酮类、游离氨基酸、可溶性糖,影响茶黄素、茶红素、茶褐素等呈色物质的浓度,对六堡茶品质成分的转化产生关键作用。这些研究论证了阿姆斯特丹曲霉/散囊菌也是产生“金花”的重要菌种之一。除了孟雁南等的文献[29]之外,陕西茯砖茶的研究比较少报道谢瓦氏曲霉(Aspergillus chevalieri)。赵仁亮等[34]将从浙江茯砖茶中分离出的2株非优势“金花菌”鉴定为谢瓦氏曲霉(Aspergillus chevalieri)。其余的菌种很少文献报道为优势菌种。由本研究的分析过程可知,曲霉属中不同种之间ITS1序列相似度比较高,不容易区分,有必要探讨更有效的基因序列或者形态特征鉴别方法。
4 结论
(1)从sx4和sx5两个茯砖茶样品中检出细菌,优势的属(相对丰度>1%)包括:肠球菌属Enterococcus、乳杆菌属Lactobacillus、阿克曼菌属Akkermansia、狄氏副拟杆菌属Parabacteroides、粪杆菌属Faecalibacterium,有可能为潜在的益生菌菌株的来源。
(2)从6个茯砖茶样品中都检出真菌,最优势的属是曲霉属Aspergillus,平均相对丰度为99.123%,最优势的种可能为阿姆斯特丹曲霉Aspergillus amstelodami、谢瓦氏曲霉Aspergillus chevalieri、Eurotium sp.、Aspergillus spiculosus、Aspergillus heterocaryoticus、Aspergillus sp.、Aspergillus ruber、Aspergillus cristatus中的一种或几种。其次还含有Aspergillus cibarius(4.138%)、Aspergillus piperis(0.879%)、Aspergillus penicillioides(0.019%)、Aspergillus gracilis(0.0058%)等曲霉属的菌种。真菌群落中还存在酵母:Candida、Cyberlindnera、Cryptococcus、Guehomyces;霉菌:Mortierella、Humicola、Fusarium、Gibberella、Phoma;以及其他真菌:Wallemia、Westerdykella。
(3)本研究采用高通量测序法比较全面分析了陕西茯砖茶样品中细菌和真菌的多样性和群落结构。
[1] 吉杰丽,杨勇,袁丹丹,等.茯砖茶加工工艺及保健功效研究进展[J].食品与药品,2016,18(2):136-144.
[2] 杨抚林,邓放明,赵玲艳,等.茯砖茶发花过程中优势菌的研究进展[J].茶叶科学技术,2005(1):4-7.
[3] 王亚丽.茯砖茶“金花菌”分离鉴定及“发花”效应研究[D].西安:陕西科技大学,2018.
[4] 史璐.“泾阳茯砖茶”地理标志法律保护调研报告[D].西安:西北大学,2018.
[5] 齐祖同,孙曾美.茯砖茶中优势菌种的鉴定[J].真菌学报,1990,9(3):176-179.
[6] 仓道平,温琼英.茯砖茶发酵中优势菌与有害菌类的分离鉴定[J].茶叶通讯,1981(3):12-14.
[7] 吕嘉枥,杨柳青,孟雁南.茯砖茶中金花菌群的研究进展[J/OL].食品科学:1-11[2020-01-10].http://kns.cnki.net/kcms/detail/11.2206.TS.20190917.1357.010.html.
[8] SAMSON R A,VISAGIE C M,HOUBRAKEN J,et al.Phylogeny, identification and nomenclature of the genus Aspergillus[J].Studies in Mycology,2014,78:141-173.
[9] 胡治远,刘素纯,赵运林,等.茯砖茶生产过程中微生物动态变化及优势菌鉴定[J].食品科学,2012,33 (19):244-248.
[10] 温琼英,刘素纯.茯砖茶发花中优势菌的演变规律[J].茶叶科学,1991,11(S1):56-62.
[11] RUI Ying,WAN Peng,CHEN Guijie,et al.Analysis of bacterial and fungal communities by Illumina MiSeq platforms and characterization of Aspergillus cristatus in Fuzhuan brick tea[J].LWT - Food Science and Technology,2019(110):168-174.
[12] 刘石泉,赵运林,胡治远.DGGE法初步解析茯砖茶发花过程中真菌群落结构[J].生态学杂志,2014,33(10):2 687-2 693.
[13] 彭晓赟,章卫民,刘淑云,等.湖南地区茯砖茶中金花菌的分离鉴定[J].菌物研究,2011,9(3):157-161.
[14] 王磊,谭国慧,潘清灵,等.黑茶砖茶中两种产生“金花”的曲霉菌[J].菌物学报,2015,34(2):186-195.
[15] 杨吉霞,张玉礼,王学锦,贺稚非.榨菜腌制过程中变红或产膜现象相关微生物的分离鉴定[J/OL].食品与发酵工业:1-10[2020-01-10].https://doi.org/10.13995/j.cnki.11-1802/ts.022260.
[16] 高庆超,常应九,马蓉,等.黑果枸杞酵素自然发酵过程中微生物群落的动态变化[J].食品与发酵工业,2019,45(13):126-133.
[17] ADAMS R I,MILETTO M,TAYLOR J W,et al. Dispersal in microbes: fungi in indoor air are dominated by outdoor air and show dispersal limitation at short distances[J].The ISME Journal,2013,7(7):1 262-1 273.
[18] BOLGER A M,LOHSE M,USADEL B.Trimmomatic:a flexible trimmer for Illumina sequence data[J]. Bioinformatics,2014,30(15):2 114-2 120.
![]() T,SALZBERG S L.FLASH:fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics,2011,27(21):2 957-2 963.
T,SALZBERG S L.FLASH:fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics,2011,27(21):2 957-2 963.
[20] CAPORASO JG,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods,2010,7(5):335-336.
[21] EDGAR R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2 460-2 461.
[22] QUAST C,PRUESSE E,YILMAZ P,et al.The SILVA ribosomal RNA gene database project: improved data processing and web-based tools[J].Nucleic Acids Research,2013,41(D1):D590-D596.
[23] ABARENKOV K,HENRIK N R,LARSSON K H,et al.The UNITE database for molecular identification of fungi-recent updates and future perspectives[J].New Phytologist,2010,186(2):281-285.
[24] 陈源源,陈浩,石贵阳,等.ITS序列在酵母批量分子鉴定中的适用性[J].食品与发酵工业,2012,38(4):11-14.
[25] ZHANG Ting,LI Qianqian,CHENG Lei,et al.Akkermansia muciniphila is a promising probiotic[J].Microbial Biotechnology, 2019,12(6):1 109-1 125.
[26] 提盼盼,逄晓阳,吕加平.阿克曼粘细菌研究进展[J].食品工业科技,2018,39(13):311-314;324.
[27] WANG Kai,LIAO Mingfang,ZHOU Nan,et al.Parabacteroides distasonis alleviates obesity and metabolic dysfunctions via production of succinate and secondary bile acids[J].Cell Reports,2019,26(1):222-235.
[28] 黄晓丽,王国品,于成功.普拉梭菌与肠道疾病关系的研究进展[J].世界华人消化杂志,2017,25(9):810-815.
[29] 孟雁南.陕西茯砖茶优势菌群及其功能性研究[D].西安:陕西科技大学,2019.
[30] 吕嘉枥,孟雁南,史朝烨,等.陕西茯茶中“金花菌”的ITS序列特性分析[J].陕西科技大学学报,2018,36(4):47-51.
[31] 吕嘉枥,雷晟,孟雁南.陕西茯砖茶中优势Eurotium属孢子形态学分析及其分子鉴定[J].陕西科技大学学报,2019,37(2):45-51.
[32] 韩省华,夏湛恩,吴文娟,等.阿姆斯特丹散囊菌鉴别与发酵[J].浙江农业科学,2015,56(3):380-383.
[33] 欧惠算,张灵枝,王维生.阿姆斯特丹散囊菌对六堡茶品质成分的影响研究[J].中国茶叶加工,2019(2):45-50.
[34] 赵仁亮,吴丹,姜依何,等.不同产区加工的茯砖茶中“金花”菌的分离及分子鉴定[J].湖南农业大学学报(自然科学版),2016,42(6):592-600.