羊肚菌(Morchella esculenta)因具有较高的营养价值和独特的香味,在海内外久享盛誉。据《本草纲目》记载,羊肚菌对胃肠炎症、消化不良[1]病症具有良好的治疗效果。羊肚菌多糖是羊肚菌的主要成分之一。因其具有抗疲劳[2]、抗肿瘤[3]、抗氧化[4]、抗菌活性[5]、抑制癌细胞增殖[6]等诸多作用成为研究热点。
羊肚菌多糖(Morchella esculenta polysaccharides, MEP)的分离纯化与结构分析影响对多糖生物活性的研究。魏芸等[7]采用DEAE-纤维素离子交换柱及SepharoseCL-6B柱纯化羊肚菌菌丝体得到单一多糖MEP-SP1,并得出其主要由木糖、葡萄糖、阿拉伯糖和半乳糖4种单糖组成。明建等[8]利用DEAE-52纤维素柱层析Sephadex G-100 凝胶色谱纯化羊肚菌多糖,得到均一组分PMEP-1,并推测出其结构中含有吡喃环。孙玉军等[9]从羊肚菌菌丝体中分离出组分MEP-II,测出分子质量为2.8×104 Da。
山西省羊肚菌资源丰富,本实验以安泽县褐赭羊肚菌子[10]实体为原料,利用超声波辅助酶法提取羊肚菌多糖,脱蛋白、脱色,通过DEAE-52纤维素柱和SephadexG-100凝胶柱层析纯化,利用紫外光谱法、红外光谱法、液相色谱法对2种组分进行纯度鉴定、光谱特征、单糖组成等基本特征研究,并进行抗氧化实验,旨在为更好地开发和利用羊肚菌的多糖组分提供理论依据。
羊肚菌子实体购于山西省安泽县惠原科贸有限公司,经山西大学生命科学学院韩建荣教授鉴定为褐赭羊肚菌 (Morchella umbrina);D-甘露糖、D-葡萄糖、D-木糖、D-阿拉伯糖、L-鼠李糖、D-半乳糖、1-苯基-3-甲基-5-吡唑啉酮(PMP)、三氟乙酸(trifluoroacetic acid, TFA),北京百灵威科技有限公司;乙腈 (色谱纯),Ther-moFisher公司;右旋糖酐标准品、纤维素酶,美国Sigma公司;其他试剂均为国产分析纯。
Agilent 1260 Infinity II高效液相色谱仪,美国安捷伦公司;UV-1801紫外分光光度计,北京北分瑞利分析仪器有限责任公司;FD-1D-50冷冻干燥机,北京博医康实验仪器有限公司;SC-3614离心机,安徽中科中佳科学仪器有限公司;SP-2000UV型紫外分光光度计,上海光谱仪器有限公司;AL204 电子天平,梅特勒-托利多仪器有限公司;72-1电热恒温干燥箱,湖北省黄石市医疗器械厂;Thermo Scientific Nicolet iS50红外光谱仪,美国Thermo Fisher公司;AFM Multimode8,美国Bruker公司;JSM-6701F扫描电镜(scanning electron microscope, SEM),日本电子公司。
1.3.1 粗多糖提取
羊肚菌粗多糖的提取参考课题组已有的方法[11]:羊肚菌子实体→干燥 (40 ℃、6 h) →粉碎过80目筛 →酶解→超声波提取→灭酶 (95 ℃、15 min) →离心 (4 500 r/min、15 min) →取上清液→浓缩→4倍体积无水乙醇醇沉过夜→离心 (4 500 r/min、15 min) →沉淀溶解(蒸馏水)→定容→TCA法脱蛋白→H2O2法脱色素→MEP。
1.3.2 分离纯化
1.3.2.1 DEAE-52 柱层析
用Tris-HCl溶液将DEAE-52纤维素层析柱(2.6 cm×30 cm)平衡12 h,将羊肚菌粗多糖配制成5 mg/mL 的溶液,上样量2 mL,流速2.5 mL/min,分别用Tris-HCl、0.1、0.2、0.3、0.4 mol/L 的NaCl 溶液进行梯度洗脱[12],每2 min收集1管,采用苯酚-硫酸法测定洗脱液中多糖含量,以每管洗脱液吸光度为纵坐标,合并相同组分的收集液,浓缩,透析,冻干。
1.3.2.2 Sephadex G-100 柱层析
将DEAE-52 柱层析收集的冻干组分配制成5 mg/mL的多糖溶液,上样2 mL,Sephadex G-100 柱层析洗脱液为0.1 mol/L NaCl,流速为0.5 mL/min,每5 min收集1管[13],采用苯酚-硫酸法测定洗脱液中多糖含量,以每管洗脱液吸光度为纵坐标,以收集管数为横坐标绘制洗脱曲线收集主峰的洗脱液,浓缩,透析,冻干。
1.3.3 羊肚菌多糖结构鉴定
1.3.3.1 羊肚菌多糖紫外光谱分析
利用紫外分光光度计在190~400 nm 范围内扫描,扫描间距为1 nm,观察在280和260 nm处是否有明显的吸收峰。
1.3.3.2 羊肚菌多糖红外光谱分析
称取经真空冷冻干燥后的羊肚菌多糖组分MEP-2、MEP-3各5 mg 置于红外光谱仪样品台上,固定样品,用红外光谱仪7 800~350 cm-1 扫描。
1.3.3.3 羊肚菌多糖分子质量测定
根据文献[14]报道的方法,采用HPGPC法测定多糖的平均相对分子质量。色谱条件:色谱柱:TSKgel GMPWXL(7.8 mm×300 mm,5 μm),检测器:示差折光检测器,SHODEX Rl-201H,柱温箱HT-330,柱温:35 ℃,进样量:20 μL上样浓度:5 mg/mL,洗脱液:去离子水,流速:0.5 mL/min。用已知分子质量的右旋糖酐做标准品,以色谱峰的保留时间(Rt),右旋糖苷葡聚糖标准品 (T-180, T-2000, T-4600, T-7100, T-10,000, T-21,400, T-84,400, T-133,800, 和T-2,000,000) 的平均分子质量的对数值 (logMw) 制作标准曲线,标准曲线方程为lg MW=-0.480 3Rt+12.798,R2=0.989 1。
1.3.3.4 羊肚菌多糖单糖组成分析
单糖组成分析用 PMP 柱前衍生化单糖,经高效液相色谱分离鉴定,具体试验操作参考文献[15]并做适当的修改。多糖样品5 mg,加入5 mL 4 mol/L TFA,置于样品瓶中,生料带封口,110 ℃ 水解4 h,冷却至室温,加入甲醇,真空干燥3次。取400 μL单糖混样加入4 500 μL 0.3 mol/L NaOH、450 μL 0.5 mol/L PMP 甲醇溶液中,混匀,70 ℃衍生2 h,冷却至室温,加入450 μL 0.3 mol/L HCl 中和,加入1 mL氯仿,充分振荡,弃去有机相,重复萃取3次,过0.45 μm 膜,置于样品瓶,待上样。
HPLC条件: 流速 1.0mL/min,上样体积:10 μL,检测波长 250 nm,柱温:40 ℃,洗脱液:流动相 A(乙腈)∶流动相 B(0.06 mol/L 磷酸缓冲液)=16∶84(体积比)。
1.3.3.5 羊肚菌多糖三螺旋结构分析
将多糖样品配制成2 mg/mL,加入等体积的0.2 mmol/L的刚果红溶液与NaOH溶液,混合均匀,使NaOH的最终摩尔浓度由 0~0. 4 mol/L等梯度增加[16],室温静置5 min,测定最大吸收波长的变化。
1.3.3.6 羊肚菌多糖表观形貌观察
将羊肚菌组分MEP-2、MEP-3经过冷冻干燥制成白色絮状物,挑取适量黏到铜质样品台,表面喷金,用扫描电镜观察多糖外部结构。
1.3.3.7 羊肚菌多糖分子形貌观察
称取羊肚菌组分MEP-2、MEP-3各1 mg溶解于10 mL 蒸馏水中,稀释到最终质量浓度为10 μg/L,用 0.45 μm 滤膜过滤,取40 μL 滴在云母片上,自然干燥。用双面胶将云母片固定在样品台上,用原子力显微镜(atomic foree microscope, AFM)观测多糖分子形貌。
1.3.4 抗氧化能力测定
1.3.4.1 清除DPPH自由基能力测定
参考MA等[17]的方法并加以改动,样品组(A1)为2 mL DPPH试剂与2 mL多糖样品,空白组(A0)用水代替样品,对照组(A2)用无水乙醇代替DPPH试剂,Vc 为阳性对照。
1.3.4.2 清除·OH能力测定
采用水杨酸法[18]测定羊肚菌多糖对羟自由基的清除能力,在试管中依次加入 9 mmol/L FeSO4溶液、9 mmol/L 水杨酸-乙醇溶液、不同浓度多糖溶液1 mL 以及 30%的 H2O2 溶液 1.0 mL,静置 30 min,510 nm 波长处测定吸光度。对照组(A2)用蒸馏水代替H2O2,空白组(A0)用蒸馏水代替样品,Vc 为阳性对照。
1.3.4.3 清除![]() 能力测定
能力测定
采用文献[19]方法测定超氧阴离子清除率,取 4.5 mL Tris-HCl缓冲液,加入 2.4 mL 蒸馏水及多糖溶液1 mL,混匀,25 ℃水浴 10 min,再加入 0.1 mL 邻苯三酚,摇匀,25 ℃ 水浴 3 min,加入 0.5 mL 0.1 mol/L HCl,320 nm 处测定吸光度(A1),对照组(A2)用蒸馏水代替邻苯三酚,空白组(A0)用蒸馏水代替样品,VC作为阳性对照。
1.3.4.4 清除ABTS·能力测定
采用谢惠等[20]的方法测定清除ABTS自由基的能力,样品组(A1)为3.9 mL ABTS试剂与0.1 mL样品,空白组(A0)用水代替样品,对照组(A2)用95%乙醇代替ABTS试剂,VC作为阳性对照。
1.3.4.5 还原力测定
采用普鲁士蓝显色法[21]测定MEP的还原力,取不同浓度多糖溶液 1.0 mL于试管中,加入 0.2 mol/L 磷酸缓冲液、2.0 mL K3(Fe(CN)6),50 ℃水浴 30 min,冷却,加入 2.0 mL TFA。吸取反应液 2.0 mL,加入2.0 mL蒸馏水、0.4 mL FeCl3 溶液,混匀,暗室反应 30 min,700 nm处测定吸光度,Vc 为阳性对照。
1.3.4.6 清除率
清除率按公式(1)计算:
清除率![]()
(1)
2.1.1 羊肚菌多糖DEAE-52柱层析
羊肚菌粗多糖经过脱蛋白、脱色后得率为7.79%。采用DEAE-52纤维素柱对羊肚菌粗多糖进行纯化,得到3个组分MEP-1、MEP-2和MEP-3(如图1所示)。因MEP-1含量较少,将组分MEP-2和MEP-3透析,干燥,进一步纯化。

图1 羊肚菌多糖DEAE-52 色谱柱洗脱曲线
Fig.1 Elution curves of Morchella esculenta polysaccharides
on DEAE-52 cellulose column
注:MEP-1、MEP-2和MEP-3分别为DEAE-52色谱柱洗脱后
3个组分
2.1.2 羊肚菌多糖Sephadex G-100色谱柱进一步纯化
利用Sephadex G-100色谱柱对初步纯化的羊肚菌多糖MEP-2和MEP-3组分进一步纯化(如图2所示)。
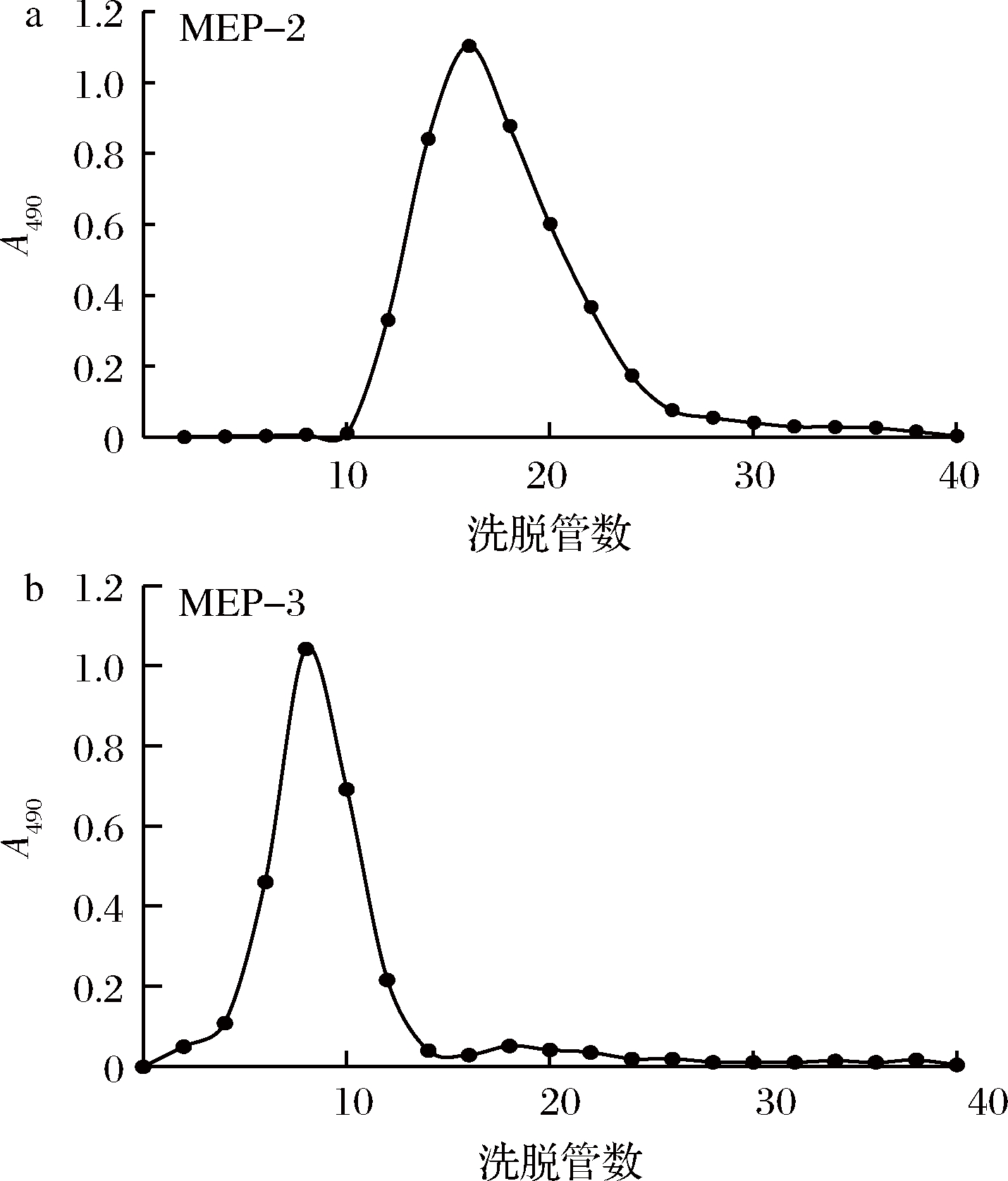
图2 羊肚菌多糖Sephadex G-100色谱柱洗脱曲线
Fig.2 Elution curve of Morchella esculenta polysaccharides
on Sephadex G-100 colum
由图2可知,经过Sephadex G-100凝胶色谱柱进一步分离纯化得到的2个组分均为单一洗脱对称峰,证明所得的羊肚菌多糖为较纯均一多糖,收集2组组分液,透析、干燥,得到羊肚菌多糖纯品MEP-2和MEP-3。
2.2.1 羊肚菌多糖紫外光谱分析
由图3可知,羊肚菌纯化组分MEP-2、MEP-3在紫外扫描范围内均无吸收峰,表明经过分离纯化后得到的MEP-2、MEP-3样品中均不含有核酸或蛋白质等物质。
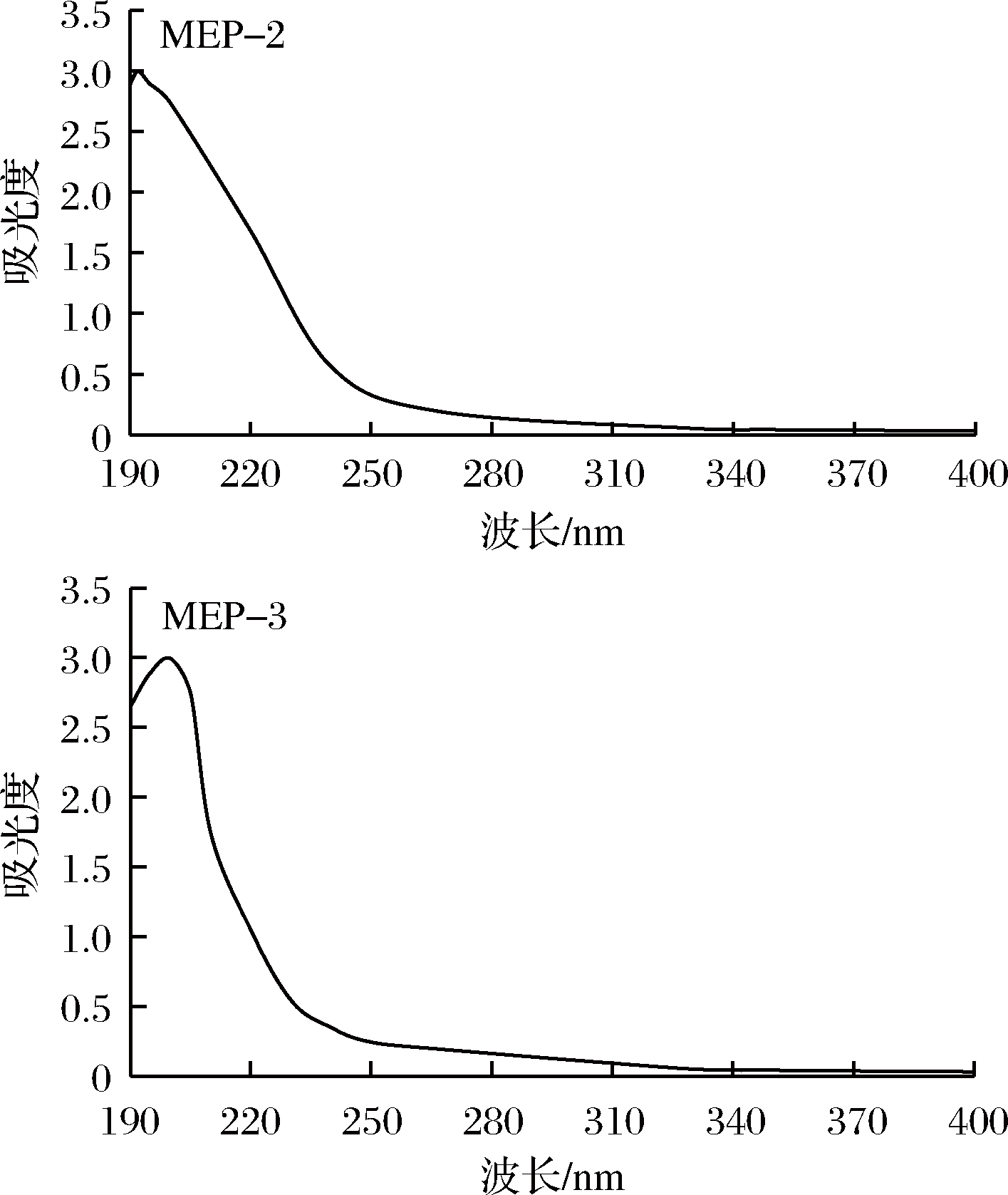
图3 羊肚菌多糖紫外-可见光谱扫描图
Fig.3 UV-vis spectrum of Morchella esculenta polysaccharides
2.2.2 羊肚菌多糖的红外光谱分析
MEP红外光谱如图4所示。
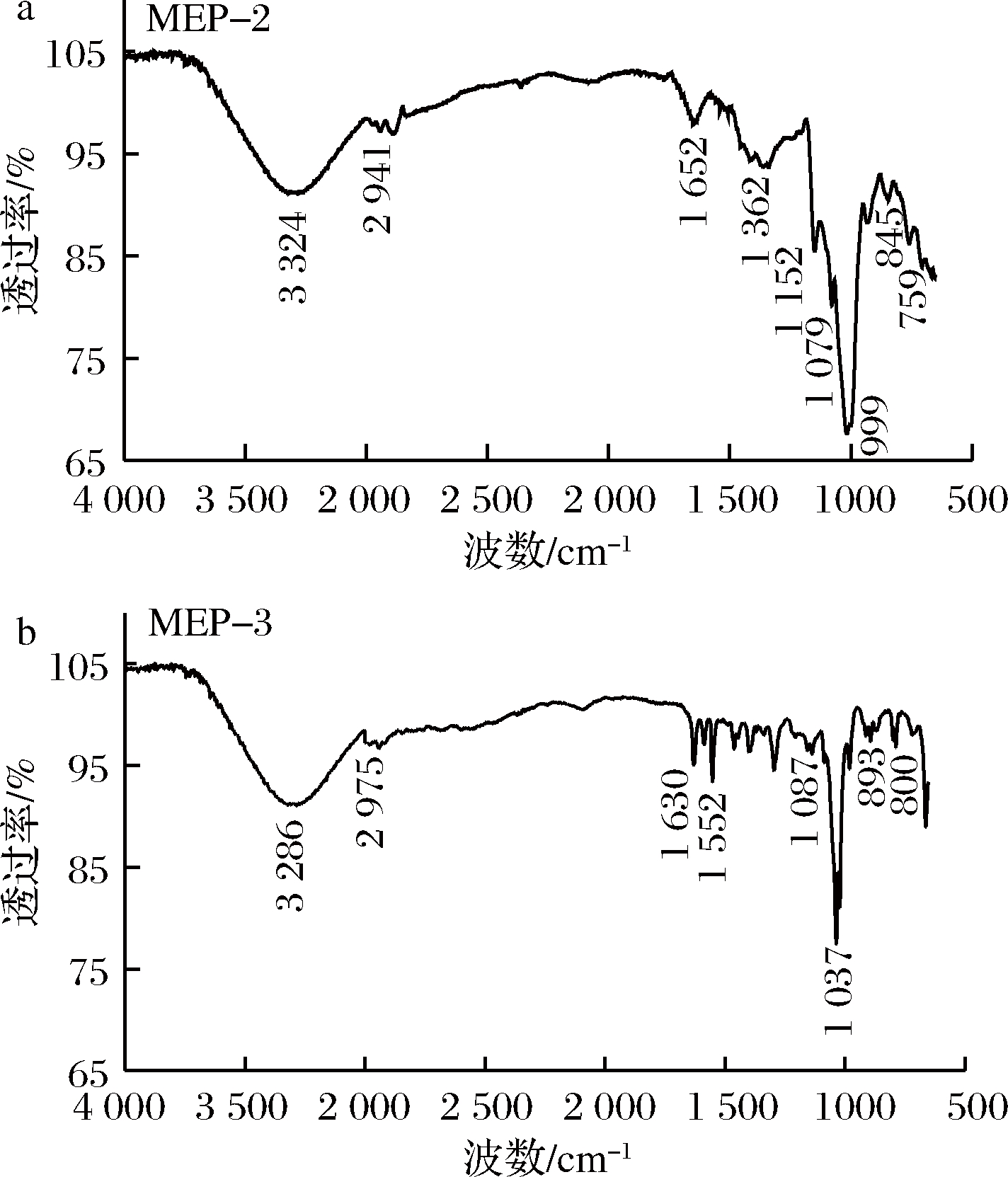
图4 羊肚菌多糖红外光谱扫描图
Fig.4 FT-IR spectrum of Morchella esculenta
polysaccharides
MEP-2和 MEP-3在3 500~3 100 cm -1处具有宽广和强烈的多糖的特征吸收峰,是O—H伸缩振动的结果[22],MEP-2与MEP-3在3 324、3 286 cm-1处的吸收峰表明分子间或分子内存在O—H;在MEP-2的红外光谱中2 941 cm-1处的吸收峰是C—H的伸缩振动;1 652 cm-1处的吸收峰是C![]() O的非对称伸缩振动;1 417、1 362 cm-1处的吸收峰是C—H的弯曲振动[23];1 152 cm-1为糖的酯基C—O—C 伸缩振动吸收峰;1 079 cm-1 处的吸收峰是糖醛上C—OH伸缩振动引起的;1 019 cm -1是糖类羧基中C
O的非对称伸缩振动;1 417、1 362 cm-1处的吸收峰是C—H的弯曲振动[23];1 152 cm-1为糖的酯基C—O—C 伸缩振动吸收峰;1 079 cm-1 处的吸收峰是糖醛上C—OH伸缩振动引起的;1 019 cm -1是糖类羧基中C![]() O的伸缩振动;845 cm-1为α型糖苷键的吸收峰;759 cm-1是吡喃环的特征吸收峰。在MEP-3的红外光谱中,2 975 cm-1处为弱的 C—H 伸缩振动峰。1 552及1 630 cm-1 处是羰基的弯曲振动。MEP-3 在1 087和 1 037 cm -1所呈现的强吸收为伯醇和仲醇的特征峰;893 cm-1 处吸收峰是吡喃糖β型C—H变角振动的吸收峰[24],800 cm-1 处吸收峰表明含有甘露糖。
O的伸缩振动;845 cm-1为α型糖苷键的吸收峰;759 cm-1是吡喃环的特征吸收峰。在MEP-3的红外光谱中,2 975 cm-1处为弱的 C—H 伸缩振动峰。1 552及1 630 cm-1 处是羰基的弯曲振动。MEP-3 在1 087和 1 037 cm -1所呈现的强吸收为伯醇和仲醇的特征峰;893 cm-1 处吸收峰是吡喃糖β型C—H变角振动的吸收峰[24],800 cm-1 处吸收峰表明含有甘露糖。
2.2.3 MEP的分子量测定
由图5可知,经HPGPC检测,羊肚菌多糖2个组分MEP-2和MEP-3的洗脱峰单一且较为对称,这说明2个组分纯度相对较高。羊肚菌多糖MEP-2、MEP-3两组分的保留时间分别为18.482、18.182 min,通过线性回归方程计算,得到它们的分子质量分别为8.3和11.6 kDa。
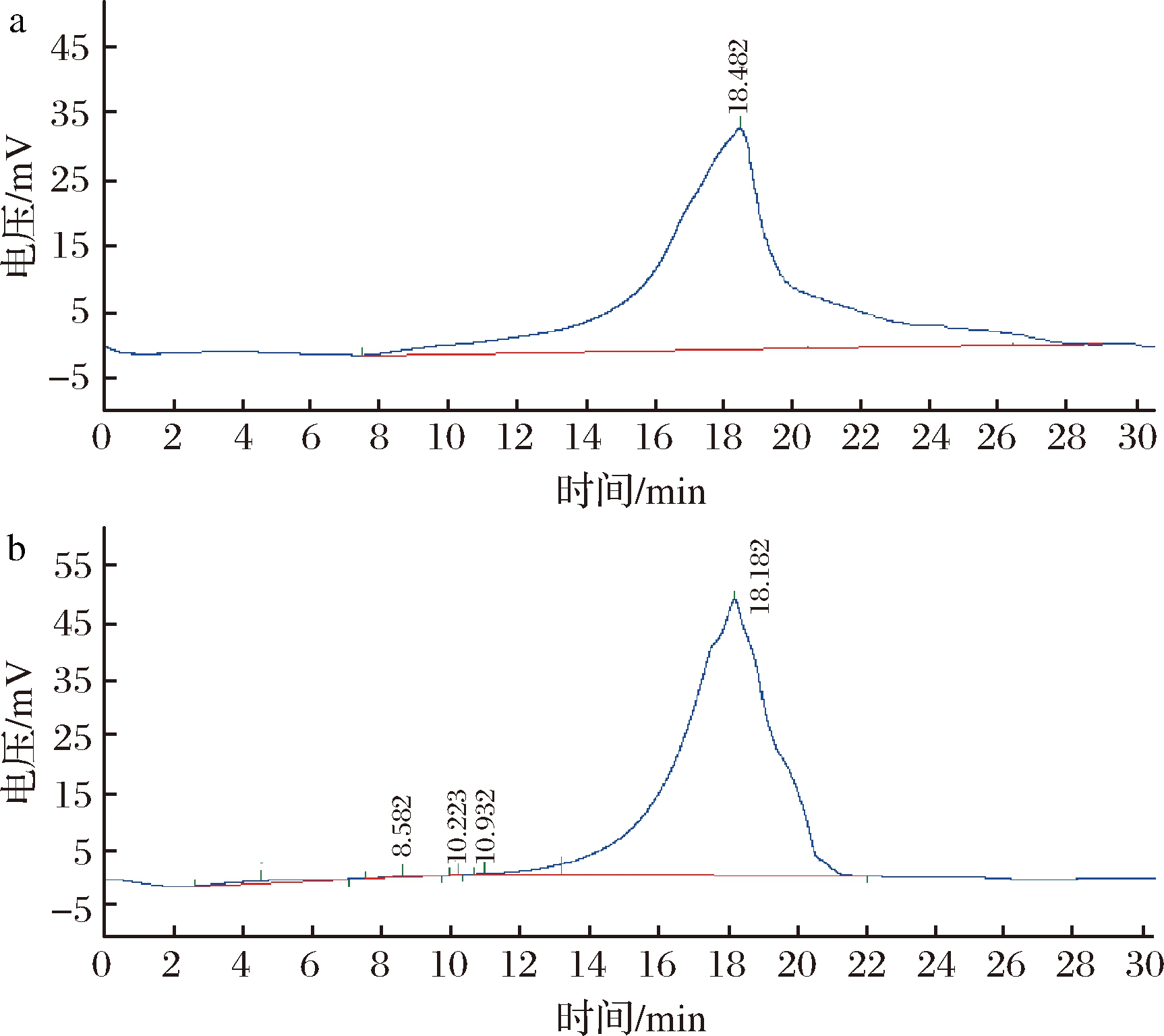
a-MEP-2;b-MEP-3
图5 羊肚菌多糖HPGPC色谱图
Fig.5 HPGPC chromatograms of Morchella esculenta
polysaccharides
如图6所示,MEP-2是由D-甘露糖、D-葡萄糖、D-半乳糖、D-阿拉伯糖组成,摩尔比为2.97∶13.69∶1∶2.60;MEP-3的单糖组成为D-甘露糖、L-鼠李糖、D-葡萄糖、D-半乳糖,摩尔比为18.25∶0.84∶1∶1.53。

a-标准单糖;b-MEP-2;c-MEP-3;1-D-甘露糖;2-L-鼠李糖;
3-D-葡萄糖;4-D-半乳糖;5-D-木糖;6-D-阿拉伯糖
图6 标准单糖、MEP-2、MEP-3高效液相色谱图
Fig.6 HPLC of mixed standard monosaccharides,
MEP-2 and MEP-3
2.2.5 MEP三螺旋结构分析
由图7可知,随着NaOH浓度的增加,MEP-2与刚果红反应形成的络合物的最大吸收波长是先增加后降低的。在弱碱性条件下,即NaOH溶液摩尔浓度在0~0.06 mol/L区间内逐渐增大时,溶液的最大吸收波长也随之逐渐增大;随着溶液碱性的逐渐增大,最大吸收波长基本呈现逐渐减小的趋势,可能是因为多糖之间的氢键在碱性条件下被破坏[25],因此可以推断,MEP-2具有三股螺旋结构。MEP-3无此现象,可以证明MEP-3无双螺旋结构。
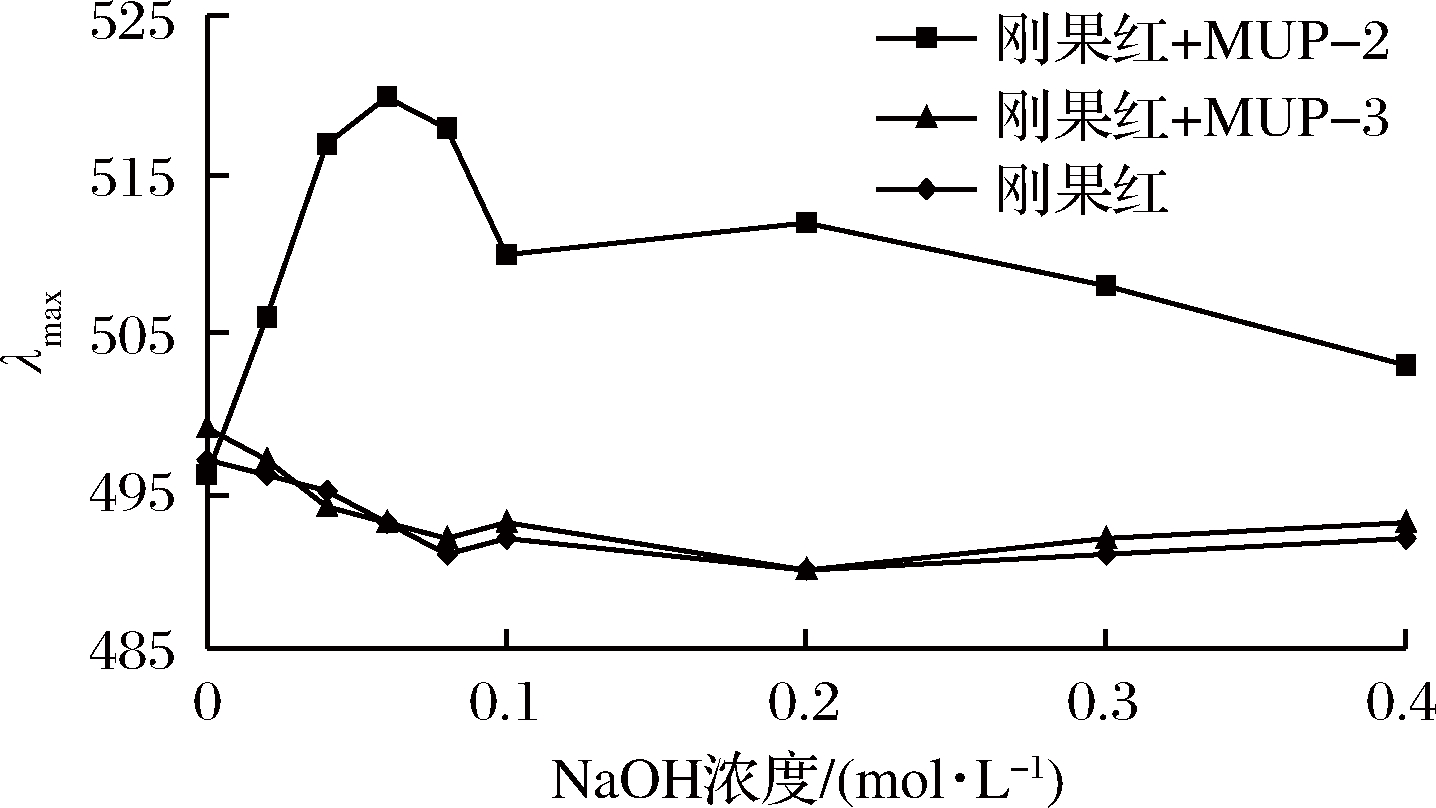
图7 不同摩尔浓度NaOH刚果红试剂与多糖混合液
λmax变化图
Fig.7 Changes in absorption wavelength maximum of
mixture of congo red and polysaccharides at various
concentrations of NaOH
2.2.6 MEP表观形貌分析
如图8所示,在放大500倍时MEP表面光滑,呈现不规则的网状结构,物质间相互作用强,紧密结合,MEP-2呈现不同大小的球形构象,MEP-3主要为球状和片状,碎片大小不一。放大1 000倍下观察发现,MEP部分网状结构有小的间隙。MEP-2晶体间有非常微小的空隙,使得多糖并未完全集合,这说明多糖分子间存在相互排斥力,分子间吸引力较为弱小[26]。MEP-3具有一面光滑,一面粗糙的形貌。

a-MEP×500;b-MEP×1 000;c-MEP-2×500;d-MEP-2×1 000;
e-MEP-3×500;e-MEP-3×1 000
图8 羊肚菌多糖扫描电镜观察外部形貌
Fig.8 Observation of the polysaeeharides from
Morchella eseulenta
2.2.7 MEP分子形貌分析
MEP的原子力显微镜(atomic force microscope, AFM)图像如图9所示,扫描范围为2 μm×2 μm,由图9可知,MEP-2聚集体呈链状与带有裂纹球形体,链高0.53~1.34 nm,链宽40.16~98.62 nm;球形体直径约为50.46~100.02 nm;MEP-3呈现球状,球形体直径约为60.52~104.62 nm,高度在1.62~4.86 nm。
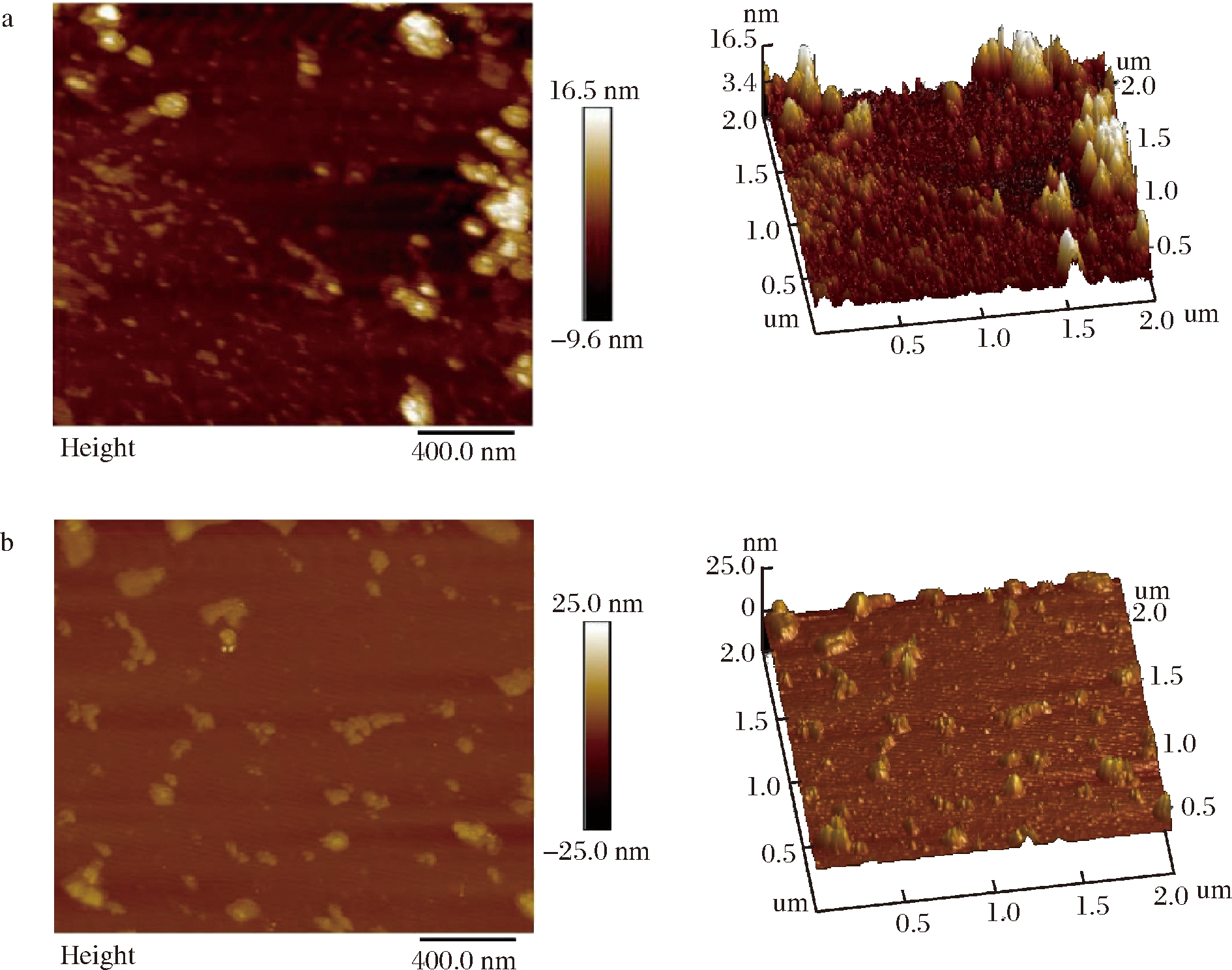
a-MEP-2;b-MEP-3
图9 羊肚菌多糖原子力显微镜图
Fig.9 The AFM images of the polysaeeharides from
Morchella eseulenta
由图10可知,质量浓度为1 mg/mL时,MUP-2对DPPH自由基![]() 的清除率分别为65.64%、86.86%、83.79%、37.67%,MUP-3对DPPH自由基
的清除率分别为65.64%、86.86%、83.79%、37.67%,MUP-3对DPPH自由基![]() 的清除率分别为79.50%、89.62%、77.67%、42.96%,MUP-2、MUP-3还原力吸光度为0.577、0.686。
的清除率分别为79.50%、89.62%、77.67%、42.96%,MUP-2、MUP-3还原力吸光度为0.577、0.686。
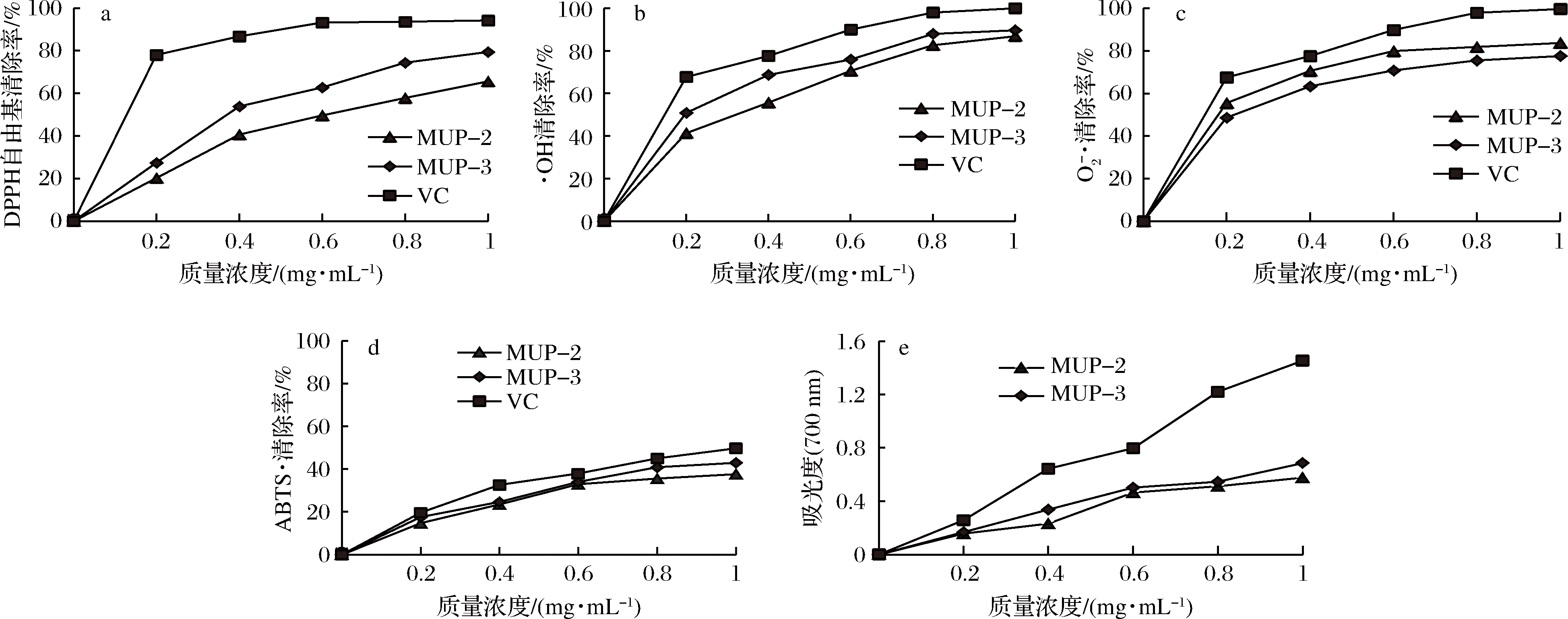
a-DPPH自由基清除率;b-·OH清除率;![]() 清除率;d-ABTS·清除率;e-吸光度
清除率;d-ABTS·清除率;e-吸光度
图10 抗氧化能力结果图
Fig.10 The chart of antioxidant capacity result
MEP清除·OH的能力较强,推测可能与多糖分子含有的单糖种类和糖苷键连接方式有关,多糖分子中含有大量的羟基,羟基上的氢和化学性质活泼的·OH反应,生成稳定碳自由基和水,达到清除·OH的目的[27]。MUP-3清除DPPH自由基、·OH、ABTS·的能力、还原力强于MUP-2, 清除![]() 的能力弱于MUP-2。
的能力弱于MUP-2。
利用超声波辅助酶法提取MEP、经过醇沉、脱蛋白、脱色、透析、冷冻干燥后得到MEP。经过分离纯化得到2个组分MEP-2与MEP-3。经紫外分光光度计检测2种组分均为为单一多糖。红外光谱结果显示MEP-2含有吡喃环,MEP-3含有甘露糖。HPGPC测定MEP-2与MEP-3的分子质量分别为8.3和11.6kDa。MEP-2是由甘露糖、葡萄糖、半乳糖、阿拉伯糖组成,摩尔比为2.97∶13.69∶1∶2.60;MEP-3由甘露糖、鼠李糖、葡萄糖、半乳糖组成,摩尔比为18.25∶0.84∶1∶1.53。MEP-2具有双螺旋结构,而MEP-3无此结构。在SEM与AFM下观察到MEP-2呈现球形结构,MEP-3主要为片状。MUP-3清除DPPH自由基、·OH、ABTS·的能力、还原力由于MUP-2, 清除![]() 的能力弱于MUP-2。本实验对MEP的2个组分进行了研究,旨在为更好地开发和利用羊肚菌的多糖组分提供理论依据。
的能力弱于MUP-2。本实验对MEP的2个组分进行了研究,旨在为更好地开发和利用羊肚菌的多糖组分提供理论依据。
[1] 李烨,温鲁. 羊肚菌的研究与开发[J]. 中国食用菌, 2004, 23(1): 9-11.
[2] 孙晓明,张卫明,吴素玲,等. 羊肚菌抗疲劳作用研究[J]. 中国野生植物资源, 2001, 20(1): 17-18;32.
[3] 陈彦, 潘见, 周丽伟, 等. 羊肚菌胞外多糖抗肿瘤作用的研究[J]. 食品科学, 2008, 29(9): 553-556.
[4] 杨芳, 王新风, 翁良, 等. 两种羊肚菌胞内多糖体外抗氧化性[J]. 食品科学, 2010, 31(23): 76-78.
[5] 龙正海, 纪其雄, 周惠燕, 等. 羊肚菌多糖体外抗菌活性研究[J]. 时珍国医国药, 2006, 17(6): 902-903.
[6] 李谣, 陈金龙, 王丽颖, 等. 羊肚菌多糖抑制人乳腺癌细胞MDA-MB-231增殖和诱导细胞凋亡研究[J]. 食品科学, 2016, 37(21): 214-218.
[7] 魏芸, 张天佑, 张姝, 等. 羊肚菌多糖MEP-SP1分离纯化及性质鉴定[J]. 食用菌学报, 1999(3): 13-16.
[8] 明建, 曾凯芳, 赵国华, 等. 羊肚菌水溶性多糖PMEP-1的分离纯化与结构特征分析[J]. 食品科学, 2009, 30(15): 104-108.
[9] 孙玉军, 陈彦, 周丽伟. 羊肚菌胞内多糖MEP-Ⅱ的分离纯化及其性质分析[J]. 食品与发酵工业, 2007, 33(12): 44-47.
[10] 韩鹏远, 柴美清, 陈斌, 等.山西中南部地区羊肚菌资源及生境调查[J].山西农业科学, 2018, 46(3): 426-428.
[11] 范三红, 任嘉兴, 张锦华, 等. 响应面优化羊肚菌多糖提取工艺及抗氧化性[J]. 食品工业科技, 2019, 40(6): 179-185;192.
[12] LIN L Y, CHENG K L, XIE Z Q, et al. Purification and characterization a polysaccharide from Hedyotis diffusa and its apoptosis inducing activity toward human lung cancer cell line A549[J]. International Journal of Biological Macromolecules, 2018, 122:64-71.
[13] 王远辉, 余晓宇. 铁棍山药多糖纯化及抗氧化活性[J]. 食品科技, 2018, 43(3): 165-172;180.
[14] 杨毅, 李文燕, 郭丽, 等. HPGPC 联合 HPLC-ELSD 测定樟芝子实体中多糖分子量、多糖组成和单糖含量[J]. 中药材, 2018, 41 (5):1 145-1 147.
[15] YANG X B, ZHAO Y, WANG Q W, et al. Analysis of the monosaccharide components in Angelica polysaccharides by high performance liquid chromatography.[J]. Analytical Sciences, 2005, 21(10):1 177-1 180.
[16] DILIP R, SOUMITRA M, INDRANIL C, et al. The structure and conformation of a water-insoluble (1→3)-(1→6)-β-D-glucan from the fruiting bodies of Pleurotus florida[J]. Carbohydrate Research, 2008, 343(5): 982-987.
[17] MA C W, FENG M Y, ZHAI X F, et al. Optimization for the extraction of polysaccharides from Ganoderma lucidum and their antioxidant and antiproliferative activities[J]. Journal of the Taiwan Institute of Chemical Engineers, 2013, 44(6): 886-894.
[18] 梁绍兰, 覃冬, 黄连秋, 等. 柑橘皮多糖抗氧化性研究[J]. 安徽农业科学, 2012,40(5): 2 624-2 625.
[19] 张燕平, 张虹, 洪泳平, 等. 羊栖菜提取物体外自由基清除能力的研究[J]. 郑州工程学院学报, 2003, 24(1): 50-53; 57.
[20] 谢惠, 韩娅婷, 邵佩兰, 等. 红枣可溶性膳食纤维的抗氧化活性研究[J]. 食品工业科技, 2017, 38(22): 37-41.
[21] AHMADI F, KADIVAR M, SHAHEDI M. Antioxidant activity of Kelussia odoratissima Mozaff. in model and food systems[J]. Food chemistry, 2007, 105(1): 57-64.
[22] 王慈, 张海, 李文杰, 等. 四种典型竹种多糖的化学成分及结构表征[J]. 分子学报, 2015, 20(3): 4 162-4 179.
[23] 李顺峰, 王安建, 田广瑞, 等. 双孢菇菇柄多糖柱层析纯化及单糖组成[J].食品工业科技, 2018, 39(12): 16-20.
[24] 岳雨曦, 王小燕, 柏丁丁, 等. 野阳合多糖及其纯化组分对胆汁酸的结合能力[J]. 食品科学, 2018, 39(12): 154-160.
[25] LUO Qiang, SUN Qun, WU Lisha, et al. Structural characterization of an immunoregulatory polysaccharide from the fruiting bodies of Lepista sordida[J]. Carbohydrate polymers, 2012, 88(3): 820-824.
[26] ZHU Y P, YANG L, YANG C G, et al. Structural and functional analyses of three purified polysaccharides isolated from Chinese Huaishan-yams[J]. International Journal of Biological Macromolecules, 2018, 120: 693-701.
[27] 景永帅, 张丹参, 吴兰芳, 等. 远志多糖的分离纯化、结构特征及生物活性[J]. 食品科学, 2017, 38(17): 126-131.