高果糖浆作为一种新型的甜味剂,近年来得到广泛应用[1-2] 。淀粉经液化、糖化、异构化等步骤得到果葡糖浆,果葡糖浆经果葡分离后,果糖部分作为高果糖浆成品出售或再加工[3],其余部分杂糖成分复杂,处理困难,增加了企业的负担。
β-1,3-葡聚寡糖是一类重要的生理活性物质[4-5],具有抗菌抗肿瘤活性[6-9]。内切β-1,3-葡聚糖酶能随机断开葡聚糖中的β-1,3-糖苷键,得到功能性寡糖(DP 2-10)[10]。因此,通过内切β-1,3-葡聚糖酶降解β-1,3-葡聚糖是获取β-1,3-葡聚寡糖的理想方法。
毕赤酵母是近年来极受青睐的一种外源蛋白表达系统[11]。其生长速度快,可达到高密度发酵,这让碳源成为毕赤酵母发酵过程中消耗量最大的营养元素[12]。本研究室前期研究中分别利用PGAP和PAOX1两种常规启动子在毕赤酵母中分泌表达内切β-1,3-葡聚糖酶,并验证其均能有效水解热凝胶并获得功能性β-1,3-葡聚寡糖[13]。PGAP型毕赤酵母多以葡萄糖为碳源,有数据显示葡萄糖是PGAP型毕赤酵母发酵生产抗菌肽-MP1102的最佳碳源[14]。PAOX1型毕赤酵母多以甘油为碳源,且其外源表达需要甲醇诱导[15]。葡萄糖和甘油市场价格都较昂贵,寻求一种廉价的替代性碳源可大幅度降低毕赤酵母发酵过程中的碳源费用,具有非常大的商业价值。
本研究使用高果糖浆废液杂糖(下文统称为杂糖)作为碳源,使用2种不同启动子(PAOX1、PGAP)调控的毕赤酵母外源表达β-1,3-葡聚糖酶。建立了1种杂糖废液做碳源进行发酵的资源利用的有效途径。
1 材料与方法
1.1 材料与设备
1.1.1 菌株与试剂
内切β-1,3-葡聚糖酶基因BGN13.1 (GenBank:X84085.1)来源于哈茨木霉(Trichoderma harzianum)。P. pastoris GS115和质粒pPIC9K均为本实验室保藏。重组毕赤酵母pPIC9K-BGN13.1a(PAOX1型毕赤酵母)及pGAP9K-BGN13.1a(PGAP型毕赤酵母)均由本实验室构建[14]。
杂糖,江苏先卓食品有限公司;胰蛋白胨、酵母粉、葡萄糖、甘油,国药集团化学试剂有限公司。
1.1.2 培养基
种子培养基(g/L):葡萄糖 20,酵母粉 10,胰蛋白胨 20。
重组毕赤酵母pGAP9K-BGN13.1a发酵培养基(g/L):葡萄糖/杂糖40,酵母粉10,蛋白胨40,MgSO45.7,CaSO4 0.1,K2SO4 4.8,KH2PO4 14.3,(NH4)2SO4 5,PTM1 4.8 mL/L,pH 6.0。
重组毕赤酵母pPIC9K-BGN13.1a发酵培养基(g/L):甘油/杂糖 40,H3PO4 20 mL/L,CaSO4 0.1,K2SO4 18.2,MgSO4·2H2O 14.9,KOH 4.13,PTM1 4.8 mL/L,pH 6.0。
1.1.3 仪器与设备
LCS-5000离子色谱仪,美国戴安公司;ultrafle xtreme型MALDI-TOFMS,美国Bmker Daltonics公司;傅里叶红外光谱仪,美国高力公司;LC-2010A高效液相色谱仪,日本岛津公司;7L发酵罐,美国Eppendf NBS公司。
1.2 方法
1.2.1 单糖组成分析
杂糖稀释2倍后,经5倍醇沉可去除大部分单糖,再对醇沉后的样品使用石墨化碳固相萃取柱进行分离除去单糖[14],经薄层层析板检测,单糖被全部去除。称取去除单糖后样品0.005 0 g,加入300 μL 2 mol/L的三氟乙酸(CF3COOH),100 ℃恒温酸解12 h,氮吹仪吹干,并加入甲醇操作3次除去CF3COOH,将水解产物用超纯水溶解后,定容至25 mL,ICS-5000离子色谱仪进行色谱分析。色谱柱为CarboPac PA20;洗脱方式为梯度洗脱,流动相为A (超纯水),B (250 mmol/L NaOH),C (1 mol/L NaAc)。
1.2.2 分子量分布及聚合度分析
基质辅助激光解析电离串联飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectro metry, MALDI-MS)可以通过测定离子的质荷比(m/z)从而对物质的分子量进行测定。取样品约为0.1 mg/mL,吸取样液1.0 μL加到样品板上,晾干,样品与基质混合结晶后进行测量。
1.2.3 傅里叶红外光谱
傅里叶红外光谱(fourier transform infrared spectrometer, FTIR)是测定物质的官能团结构的质谱手段。样品与KBr晶体适量混合后充分研磨,制片,在400~4 000 cm-1对测定样品进行红外波长扫描。
1.2.4 总糖及主要物质含量测定
采用蒽酮硫酸法测定总糖含量。采用高效液相色谱仪测定葡萄糖、果糖、二糖及三糖含量。色谱柱为Hypersil APS2;流动相为70%乙腈;检测器为RID检测器。
1.2.5 培养方法
1.2.5.1 摇瓶培养
重组毕赤酵母pGAP9K-BGN13.1a:按接种量4%(体积分数)将种子液接入装有50 mL培养基的500 mL三角瓶,温度30 ℃,转速220 r/min,每隔6 h测定OD600、残余葡萄糖浓度,最终发酵液测酶活。
重组毕赤酵母pPIC9K-BGN13.1a:按接种量4%(体积分数)将种子液接入装有50 mL培养基的500 mL三角瓶,温度30 ℃,转速220 r/min,碳源耗尽后,饥饿培养一段时间,每隔24 h补加1%(v/v)甲醇,每隔6 h测定OD600、残余甘油或葡萄糖浓度,最终发酵液测酶活。
1.2.5.2 发酵罐培养
重组毕赤酵母PGAP9K-BGN13.1a:将2.7 L 初始培养基置于7 L发酵罐内,灭菌,接种前调节发酵培养基使其在30 ℃、pH 6.0稳定2 h。加入300 m L的种子液。调节通气量和转速,维持溶氧量(dissolved oxygen, DO)在10%之上。测定发酵过程中的OD600及葡萄糖含量,待葡萄糖耗尽后,以6 mL/L/H补加500 g/L葡萄糖或杂糖。
重组毕赤酵母pPIC9K-BGN13.1a:将2.7 L 的初始培养基置于7 L发酵罐内,灭菌,接种前调节发酵培养基使其在30 ℃、pH 6.0稳定 2 h。加入300 mL的种子液。当初始碳源耗尽后(DO突然上升,补加少量碳源后DO骤然下降),开始使用DO-Start程序流加碳源[16],DO水平维持在20%。当细胞密度达到一定量后,饥饿培养1~2 h以彻底耗尽残余甘油或葡萄糖,之后开始进行纯甲醇诱导。利用甲醇电极在线测量甲醇含量。每隔2~5 h使用气相色谱法离线测定甲醇含量[17],维持甲醇质量浓度10 g/L直至发酵结束。
1.2.6 酶活测定
本研究中内切β-1,3-葡聚糖酶活力定义为:以热凝胶为底物,水解反应1 min生成1μg寡糖所需的酶量为一个酶活单位(U)。
反应体系5 mL,包含1.5 mL 20 g/L热凝胶悬浮液,2.5 mL 醋酸钠缓冲液(0.025 mol/L,pH 6.0),1 mL 毕赤酵母发酵液上清,反应液置于50 ℃水浴2.5 h后沸水浴加热10 min终止反应。随后,水解液中寡糖含量采用薄层层析法测定[18]。
1.2.7 蛋白含量测定
使用考马斯亮蓝法测定蛋白含量[19]。
2 结果与分析
2.1 杂糖组分分析
2.1.1 单糖组成、分子量及聚合度分析
对二糖以上部分进行单糖组成分析,结果如图1,经标准糖对比分析,证明杂糖二糖以上部分是由葡萄糖单体组成的聚合物。
1-岩藻糖;2-鼠李糖;3-阿拉伯糖;4-半乳糖;5-葡萄糖;
6-木糖;7-甘露糖;8-果糖
图1 单糖祖成分析
Fig.1 The monosaccharide compositions analysis
利用MALDI-MS表征手段对杂糖的分子量进行检测,结果如图2。
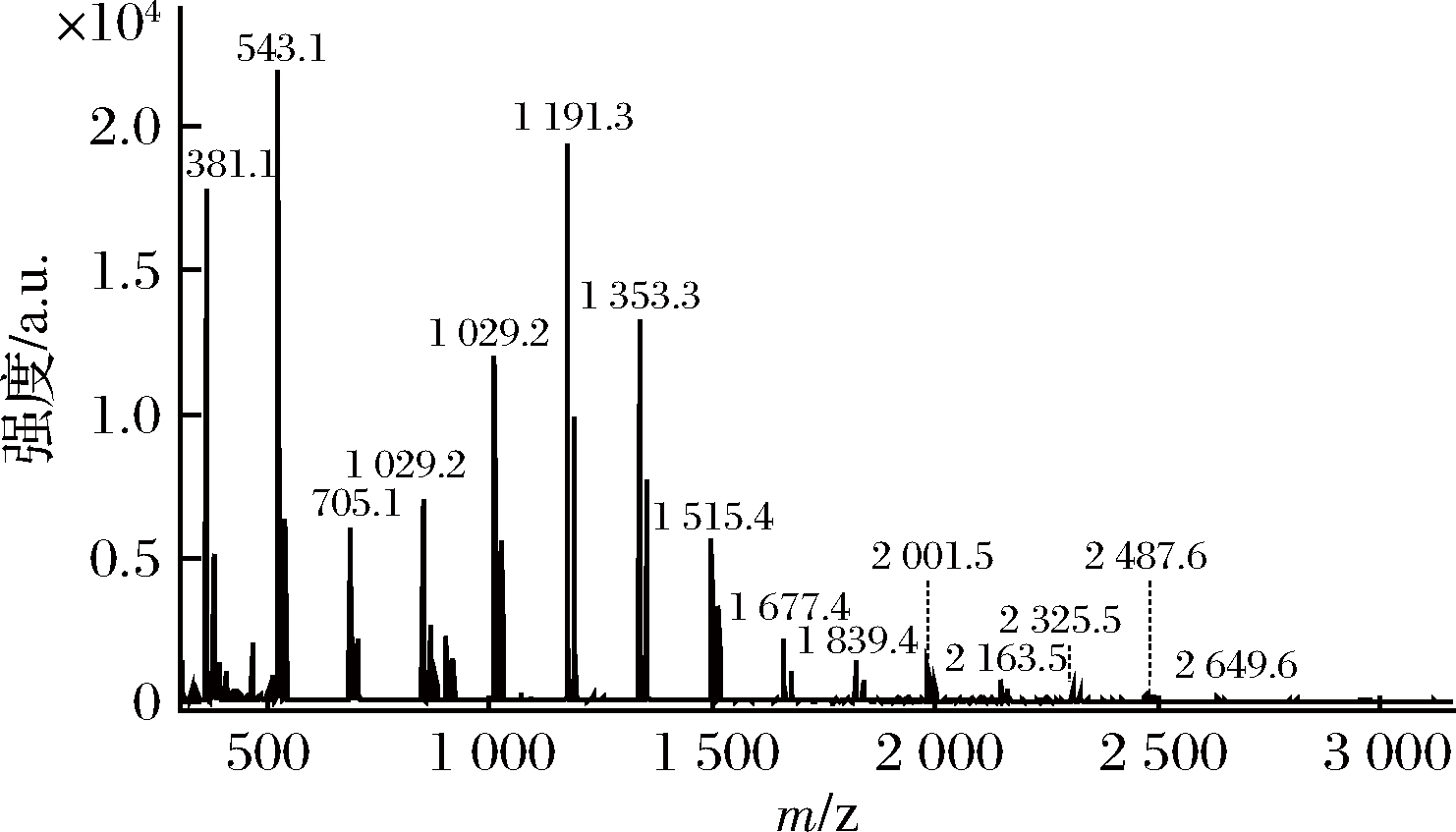
图2 杂糖的MALDI-MS质谱鉴定
Fig.2 The MAOLDI-MS identification of the mixed
carbohydrate
线性葡聚糖的质荷比(m/z)=162×n+18+39(MrK) (n表示聚合度)[20];结合单糖组成分析的结果(图2仅显示二糖以上质谱结果),对样品糖进行MALDI-MS 图谱分析,目标核质比数据显示杂糖是含有 1~16 个聚合度的线性多糖。
2.1.2 傅里叶红外光谱
使用红外光谱法验证杂糖立体构型是否发生改变,如图3所示, 在3 200~3 600 cm-1处的伸缩振动峰是—OH的特征吸收峰,2 915~2 940 cm-1处的伸缩振动峰吸收峰是—CH的特征吸收峰[21]。在840 cm-1处是α-型糖苷键的特征吸收峰。这些结果表明,杂糖中寡糖均是α-型葡寡糖[22]。

图3 杂糖的FTIR分析
Fig.3 The FTIR spectra of the mixed carbohydrate
2.1.3 总糖及主要物质含量
结合以上分析,杂糖的寡糖部分是聚合度2~16的α-型线性葡聚糖,单糖部分包括葡萄糖和果糖。采用蒽酮硫酸法测总糖,测得杂糖的总糖含量为802.3 g/L。利用HPLC法测定杂糖中单糖、二糖及三糖含量,结果:葡萄糖480 g/L,果糖92 g/L,麦芽糖103.6 g/L,麦芽三糖36.8 g/L。理论上其可作为优质的生物发酵的可替代碳源。
2.2 PAOX1型毕赤酵母发酵培养
2.2.1 发酵初始碳源含量
PAOX1型毕赤酵母外源表达过程需要甲醇诱导,是应用最广泛的毕赤酵母之一。发酵初始碳源含量对发酵过程有着重要的影响。初始碳源含量过低,发酵液中营养成分不足,菌株生长缓慢,过高可能会对菌株生长起到抑制作用[23]。选取3个碳源梯度,如图4所示,初始甘油为20和60 g/L时,菌株生长均被不同程度抑制。相同条件下使用杂糖做碳源时高浓度抑制作用不明显,但最大生物量与甘油相比低21%左右。
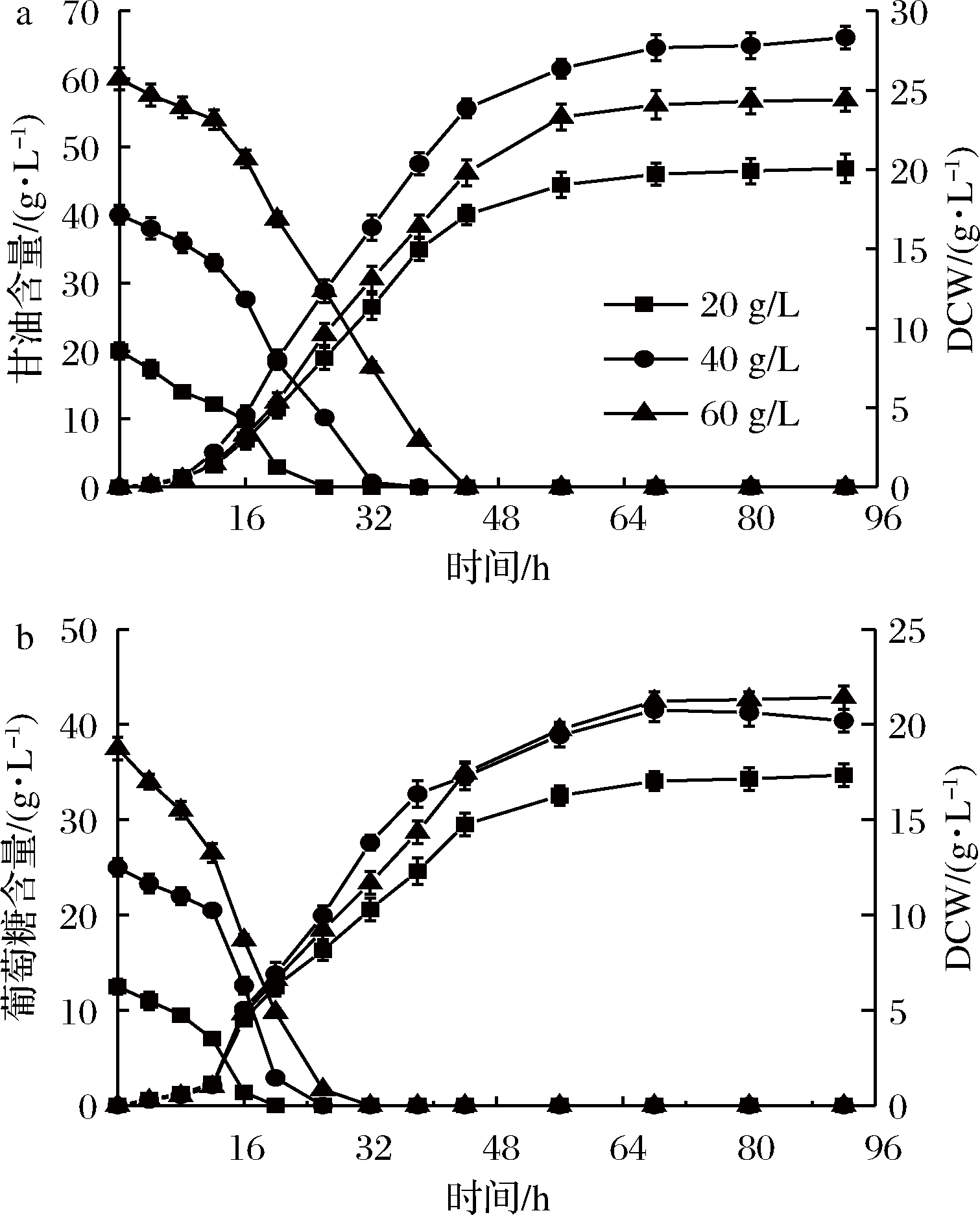
a-甘油作碳源;b-杂糖作碳源
图4 不同初始碳源含量对PAOX1型毕赤酵母
生长效果的影响
Fig.4 Effects of different initial carbon source contents on
cell growth of P. pastoris PAOX1
2.2.2 7 L发酵罐发酵培养
在7 L发酵罐水平进行放大培养,如图5所示。
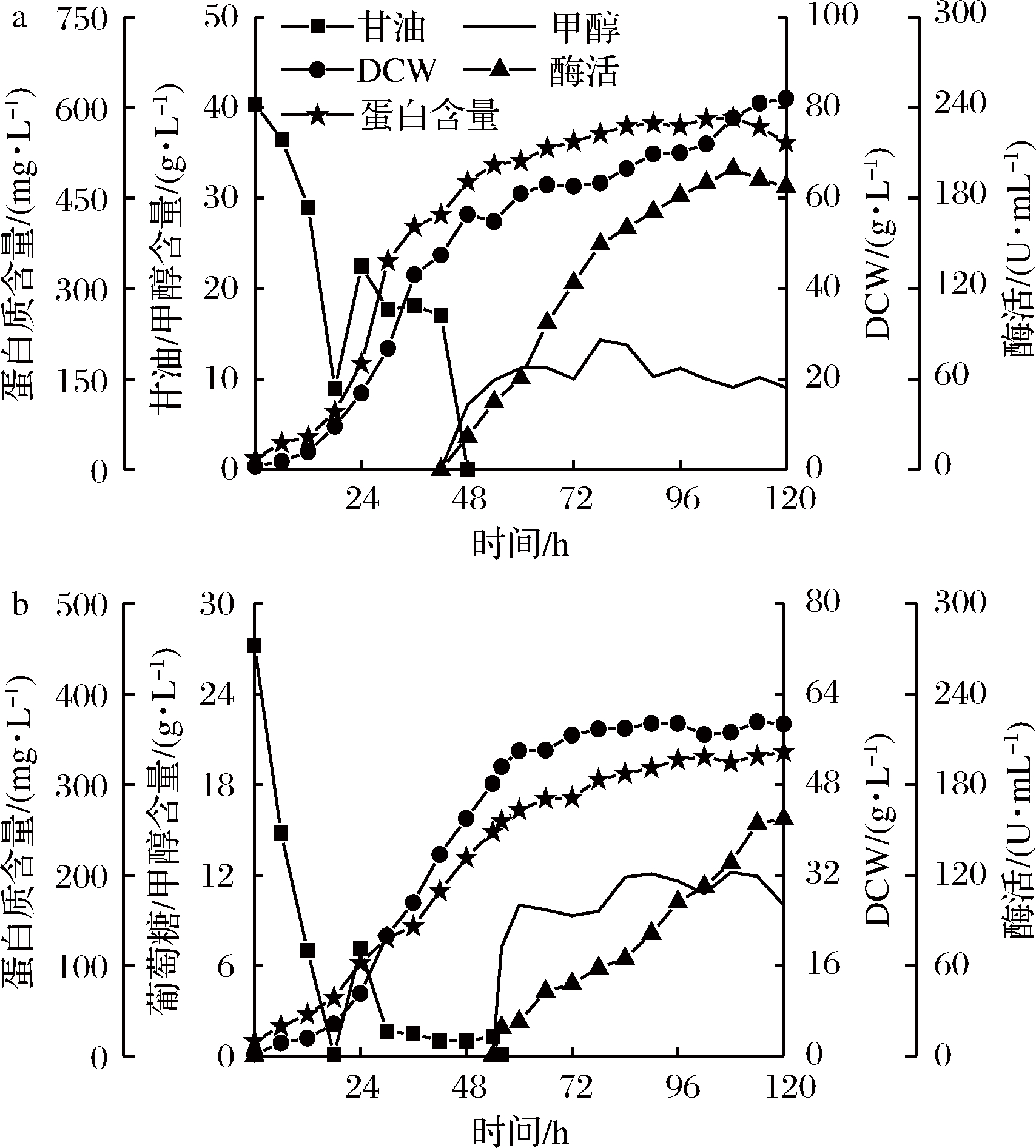
a-甘油作碳源;b-杂糖作碳源
图5 7 L发酵罐水平PAOX1型毕赤酵母发酵过程图
Fig.5 The batch profiles of P. pastoris PAOX1
in 7 L bioreactor
以杂糖为碳源的PAOX1型毕赤酵母发酵过程与甘油有较大区别。在生物量方面,杂糖做碳源时最大生物量为59.1 g/L,比甘油的82 g/L低20%左右。进入诱导期时间比甘油组晚8 h,且在诱导期几乎不再生长。对于PAOX1型毕赤酵母,甘油作碳源时菌株生长效果往往优于葡萄糖,而杂糖的主要成分为葡萄糖,所以使用杂糖作碳源在PAOX1型毕赤酵母的菌株积累方面与甘油相比不占优势;在诱导期,杂糖为碳源时最高酶活性为157.29 U/mL,比甘油的199.2 U/mL低21%左右,葡萄糖以及低聚寡糖等对AOX1启动子具有强烈抑制作用[12],尽管经过饥饿培养阶段,培养基中的葡萄糖已被耗尽,但不排除杂糖中的寡糖对产酶的抑制作用。但考虑到杂糖成本远低于甘油,所以杂糖仍可作为PAOX1型毕赤酵母可选择的生长期碳源。
2.3 PGAP型毕赤酵母发酵培养
2.3.1 发酵初始碳源含量
GAP启动子是毕赤酵母表达系统中AOX1启动子的常用替代启动子之一,其表达过程不需要甲醇诱导,可以有效利用葡萄糖供菌体生长以及外源蛋白表达。
如图6所示,初始葡萄糖为40和60 g/L时生长效果较好,但两者相差不大。出于经济性考虑,应选取40 g/L的初始葡萄糖含量进行发酵。相同条件下使用杂糖做碳源时生长效果与葡萄糖相当,两者呈现出相似的生长规律。由此可见,杂糖可被PGAP型毕赤酵母有效利用,供菌体生长。
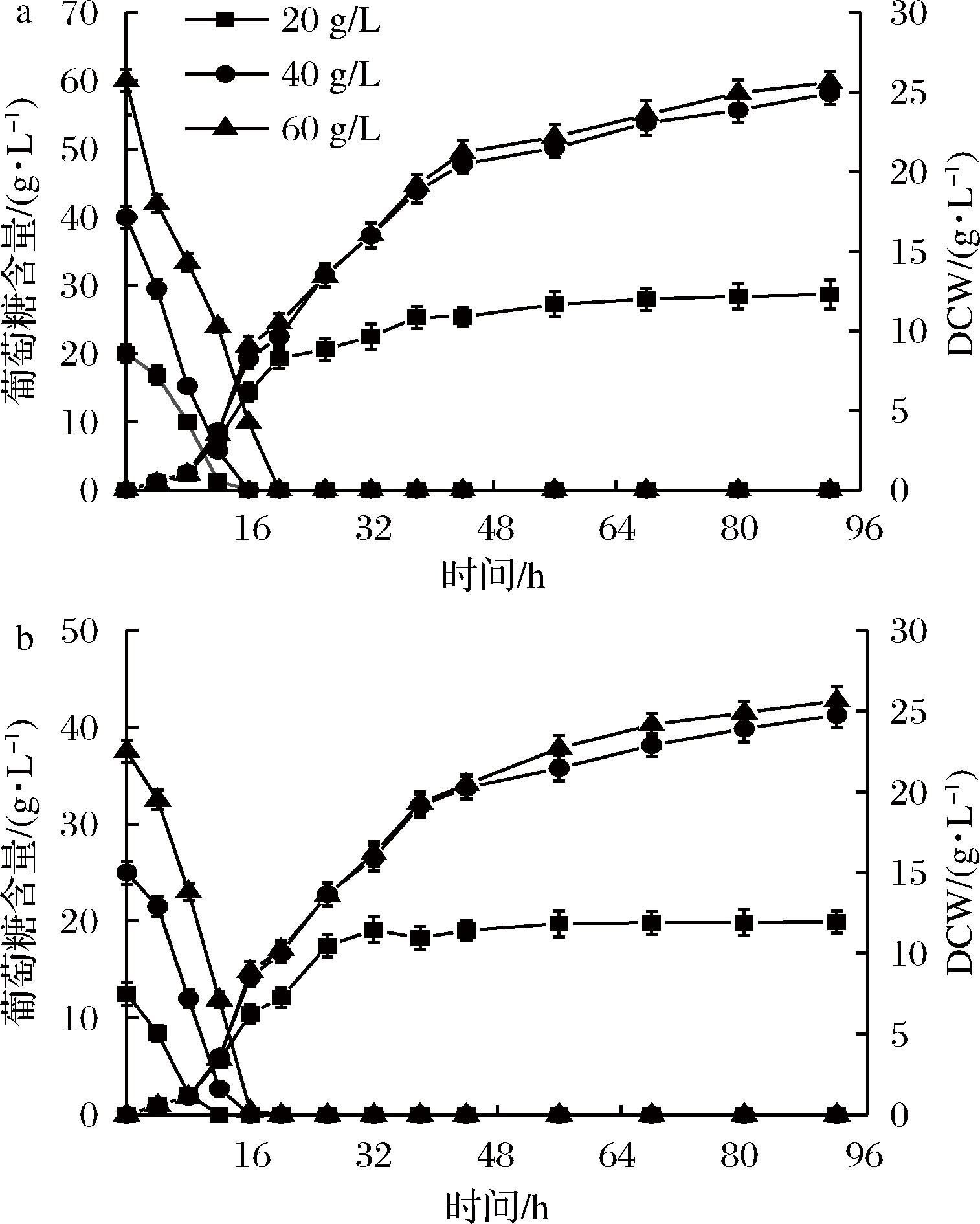
a-葡萄糖作碳源;b-杂糖作碳源
图6 不同初始碳源含量PGAP型毕赤酵母生长
效果的影响
Fig.6 Effects of different initial carbon source contents
on cell growth of P3 pastoris PGAP
2.3.2 7 L发酵罐发酵培养
在7 L发酵罐水平进行放大培养。如图7所示,以杂糖为碳源的PGAP型毕赤酵母发酵效果与葡萄糖相当,最大生物量分别达到69.3和71.6 g/L,最高酶活分别为180.2和176.5 U/mL。说明本实验所用杂糖可以作为PGAP型毕赤酵母的优质替代性碳源生产内切β-1,3葡聚糖酶。
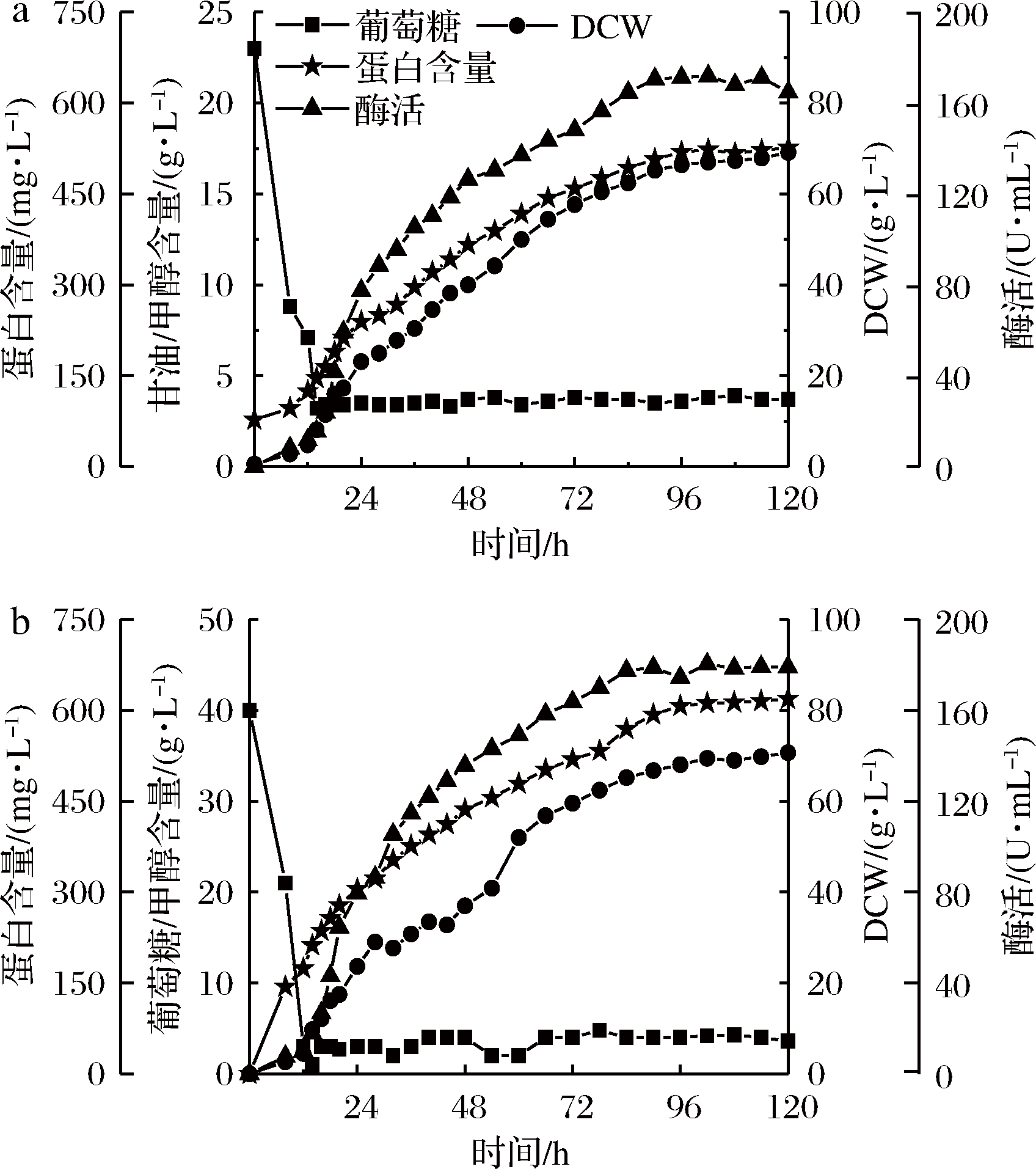
a-葡萄糖作碳源;b-杂糖作碳源
图7 7 L发酵罐水平PGAP型毕赤酵母发酵过程图
Fig.7 The batch profiles of P. pastoris PGAP in 7 L
bioreactor
3 结论
杂糖为碳源代替葡萄糖或甘油利用2种不同启动子调控的毕赤酵母外源表达内切β-1,3葡聚糖酶。杂糖成分为葡萄糖和果糖以及聚合度为2~16的线性葡聚糖,主要为葡萄糖480 g/L、果糖92 g/L、麦芽糖103.6 g/L、麦芽三糖36.8 g/L、总糖含量为802.3 g/L。以40 g/L的初始碳源质量浓度对2株毕赤酵母进行发酵培养,在7 L发酵罐水平,杂糖与葡萄糖在做PGAP型毕赤酵母碳源时发酵效果相当,其可以作为优质替代性碳源代替葡萄糖;在此条件下,使用杂糖作替代碳源可节省约37.1元碳源成本。对于PAOX1型毕赤酵母,杂糖做碳源细胞密度和酶活性与甘油相比均有所下降,最大生物量分别为59.1和82.0 g/L,最高酶活性分别为157.29和199.2 U/mL,在此条件下,使用杂糖作替代碳源可节省约17.7元碳源成本,但杂糖发酵效果较差这一现象还有待进一步展开相关研究,以期得到杂糖做PAOX1型毕赤酵母替代性碳源更好的方法。
[1] JIA D X, ZHOU L, ZHENG Y G. Properties of a novel thermostable glucose isomerase mined from Thermus oshimai and its application to preparation of high fructose corn syrup [J]. Enzyme and Microbial Technology,2017,99:1-8.
[2] 郭亮.山东某高果糖浆废水的治理研究[D].济南:山东大学,2013.
[3] SABRINA G, STEFAN M, MARCUS A , et al. Identification and quantification of six major α-dicarbonyl process contaminants in high-fructose corn syrup [J]. Analytical and Bioanalytical Chemistry, 2012,403(10):2 923-2 931.
[4] 刘晓玲,王金晶,李永仙,等.特基拉芽孢杆菌来源β-1,3-1,43葡聚糖酶重组菌发酵培养基的优化[J].食品与发酵工业,2013,39(2):80-85.
[5] LI J, ZHU L, ZHENG Z Y, et al. A new effective process for production of curdlan oligosaccharides based on alkali-neutralization treatment and acid hydrolysis of curdlan particles in water suspension [J]. Applied Microbiology and Biotechnology,2013,97(19):8 495-8 503.
[6] KONDORI N, EDEBO L, MATTSBY B I. A novel monoclonal antibody recognizing β (1-3) glucans in intact cells of Candida and Cryptococcus [J]. APMIS, 2008,116(10):867-876.
[7] TOROSANTUCCI A, CHIANI P, BROMURO C, et al. Protection by anti-β-glucanantibodies is associated with restricted β-1, 3-glucan binding specificity and inhibition of fungal growth and adherence [J]. PLoS One,2009,4(4):e5 392
[8] TAYLOR P R, TSONI S V, WILLMENT J A, et al. Dectin-1 is required for β-glucan recognition and control of fungal infection [J]. Nature Immunology, 2006,8(1):31-38.
[9] JAMOIS F, FERRIERES V, GUEGAN J P, et al. Glucan-like synthetic oligosaccharides: iterative synthesis of linear oligo -β-(1, 3)-glucans and immunostimulatory effects [J]. Glycobiology, 2005,15(4):393-407.
[10] 徐敏,李晶,郑志永,等.哈茨木霉产水解热凝胶的内切β-1,3-葡聚糖酶的分离纯化[J].食品工业科技,2014,35(12):157-161.
[11] 许黎明,成春燕,韦星明,等.大豆β-淀粉酶基因在毕赤酵母中的高密度发酵表达[J].食品与发酵工业,2017,43(9):28-33.
[12] HU J, ZHEN Z Y, GAO M J, et al. Effective induction of phytase in Pichia pastoris fed-batch culture using an ANN pattern recognition model-based on-line adaptive control strategy [J]. Biochemical Engineerin Journal,2007,37(1):26-33.
[13] 李菲菲,高敏杰,朱莉,等.土壤杆菌-毕赤酵母耦合培养直接生产热凝胶低聚糖[J].过程工程学报, 2019,19(4):801-808.
[15] MAO R Y, TENG D, WANG X M, et al. Optimization of expression conditions for a novel NZ2114-derived antimicrobial peptide-MP1102 under the control of the GAP promoter in Pichia pastoris X-33 [J]. BMC Microbiology, 2015,15.
[16] YANG Z L, ZHANG Z S. Engineering strategies for enhanced production of protein and bio-products in Pichia pastoris: A review [J]. Biotechnology Advances, 2018, 36:183-195.
[17] GAO M J, ZHEN Z Y, WU J R, et al . Improvement of specific growth rate of Pichia pastoris for effective porcine interferon-α production with an on-line model based glycerol feeding strategy [J]. Applied Microbiology and Biotechnology, 2012,93(4):1 437-1 445.
[18] 邓兵兵,方宏清,薛冲,等.甲醇营养型酵母高密度培养过程中甲醇和乙醇的GC快速检测[J].工业微生物,2001(2):26-29.
[19] LIANG Y, ZHU L, ZHAN X B, et al. Enhanced production of curdlan by coupled fermentation system of Agrobacterium sp. ATCC 31749 and Trichoderma harzianum GIM 3.442[J]. Carbohydrate Polymers, 2017,157:1 687-1 694.
[20] GAO M J, ZHU L, YU R S, et al. Methanol/sorbitol co-feeding induction enhanced porcine interferon-α production by P. pastoris associated with energy metabolism shift [J]. Bioprocess and Biosystems Engineering,2012,35(7):1 125-1 136.
[21] 曲娟娟,詹晓北,张洪涛,等.基于pH调控的环β-1,23葡聚糖合成及结构鉴定[J].中国生物工程杂志, 2018,38(6):43-51.
[22] TREVELYAN W E, HARRISON J S. Studies on yeast metabolism. I . Fractionation and microdetermination of cell [J]. Biochemical Journal. 1952,50(3):298-310.
[23] 田有秋,贾金霞,束旭,等.淡红侧耳子实体多糖的分离纯化及结构探析[J].食品与发酵工业,2018,44(12):66-72.
[24] LUO Z C, MIAO J, LUO W. Crude glycerol from biodiesel as a carbon source for production of a recombinant highly thermostable β-mannanase by Pichia pastoris[J]. Biotechnology Letters, 2017,40(1):1-7.