罗伊氏乳杆菌是目前报道的可存在于所有脊椎动物和哺乳动物肠道内的乳酸杆菌[1-2],它能够很好地黏附在肠黏膜上,调节肠道菌群结构,提高免疫力,促进人体健康[2]。乳酸菌通常采用真空冷冻干燥进行制备。真空冷冻干燥是将被干燥物料中的水冻结成冰,然后使冰升华而除去水的一种干燥方法[3],其基本原理是在低温低压下传热传质[4]。但是菌体在冷冻干燥过程中会有损伤,主要包括机械损伤和溶质损伤。机械损伤是由于低温时细胞内外冰晶生长产生的机械力量导致的。溶质损伤则是由于冻结过程中细胞间隙内的液体逐渐浓缩,电解质的浓度明显增大造成的,进而增加了细胞死亡的可能性[5-6]。因此在冷冻干燥过程中需要加入冻干保护剂来提高冻干后活菌数。
最常使用的保护剂有糖类、蛋白质、聚合物等,这些不同分子质量的保护剂以不同的途径保护着菌体,例如低聚糖等通过穿过细胞壁但不穿过细胞质膜的方式保护着菌体,甘油等通过穿过细胞壁和细胞质膜的方式保护着菌体,蛋白质等能在菌体表面形成蛋白膜,避免菌体暴露于外界环境中遭到损伤[7-8];另外,还有其他一些物质可能会加强冻干保护剂的保护效果。抗氧化物质能降低保护剂的氧化还原电位, 并消耗试验过程中的部分氧气[9];无机盐类能渗透进入细胞内部,从而使胞内电解质溶液的浓度升高,进而减少溶质损伤[10];氨基酸能作为pH调节剂以防止因pH变化导致的大分子物质变性[11];GSH能维持细胞膜的较高的不饱和度比和饱和脂肪酸的短链长度,从而获得完整的细胞结构[12];谷氨酸钠能与水密切作用使干粉保留适量的水分,满足微生物维持生命的最低需求[13];甜菜碱则能够调节细胞渗透压和离子平衡[14]。通常认为不同保护原理的保护剂复合后会提高菌体的冻干存活率,因此目前乳酸菌的冷冻干燥配方一般混合了多种保护剂即复合保护剂。但不同乳酸菌的冻干保护研究参差不齐,无规律可循。本文系统研究所有类保护剂,总结规律为乳酸菌冻干保护剂的选择提供明确且简便的方法。
真空冷冻干燥是一个高能耗过程,如何降低乳酸菌制剂产业化生产的能耗也是冻干研究的重要目标。现代工业中,乳酸菌冻干前菌悬液的干物质含量(即冻干结束干粉得率)通常在15%~20%。提高冻干前菌悬液的干物质含量,可减少菌悬液的体积,从而降低冻干机的使用面积,降低能耗。本文将在得到最优保护剂的基础上优化冻干前菌悬液的干物质含量,实现高密度冻干,减少冻干机的使用面积以实现降低冻干能耗的目的。
1.1.1 菌株
罗伊氏乳杆菌138-1 (Lactobacillus reuteri 138-1)(CCFM8631),江南大学食品生物技术中心保藏。
1.1.2 试剂
实验所用的MRS培养基,购自青岛海博生物技术有限公司;其余化学试剂(分析纯),国药集团化学试剂有限公司;岩藻糖、海藻糖、蔗糖、乳糖、水苏糖、山梨糖醇、甘油、赤藓糖醇、低聚果糖、低聚木糖、低聚半乳糖、菊粉、低聚异麦芽糖、抗性糊精、乳清蛋白、胶原蛋白、脱脂乳、谷氨酸钠、甜菜碱、硫酸锰、硫酸钠、谷胱甘肽、抗坏血酸等,创赛生物科技有限公司;复合维生素,惠氏制药有限公司;复合核苷酸(A、C、T、G),山西莱克生物科技有限公司;腺嘌呤(A),购自南京鑫越源生物科技有限公司;味之素(I+G),兴化市味之素食品配料有限公司;胰蛋白胨,郑州盛仁堂生物科技有限公司;大豆蛋白胨,安琪酵母股份有限公司。
GRP-9080型隔水式恒温培养箱,上海森信实验仪器有限公司;FE20型pH计、EL3002型电子天平,梅特勒-托利多仪器(上海)有限公司;MS 3 basic型涡旋振荡器,德国IKA公司;MLS-3750型高温高压灭菌锅,日本SANYO公司;ZHJH-C1115B型超净工作台,上海智诚分析仪器制造有限公司;泰事达冻干机,西班牙Telstar公司。
1.3.1 菌株的活化与培养
将置于-80 ℃的甘油保菌管取出,解冻。用接种环沾取菌液后在MRS固体培养基上平板划线,于37℃恒温培养箱中培养16~18 h。用接种环从平板上长出的菌落中挑取单菌落,将其接种到5 mL MRS液体培养基中,在37 ℃恒温培养箱中培养12 h。取200 μL再次接种到5 mL MRS液体培养基中,培养12 h后得到活化后的种子液。
1.3.2 罗伊氏乳杆菌的冻干
以8%的接种量接菌至MRS液体培养基中,37 ℃恒温培养12 h后8 000×g、4 ℃、20 min离心,去上清。将菌泥与水按质量比1∶1混匀后调pH至6.5左右,再将菌悬液以体积比2∶1与保护剂溶液混合,充分均匀后取1 mL分装至冻干瓶冻干。
冻干工艺:预冻,控制层板1 h内降温至-50 ℃,保持4 h;一次干燥,控制层板1.3 h升温至-30 ℃,保持30 h;二次干燥,控制层板1 h升温至25 ℃,保持20 h。
1.3.3 保护剂溶液的配制
(1)不同种类保护剂
分别准确称取糖(醇)类、蛋白质类、聚合物类等各类保护剂20 g,溶解后用蒸馏水定容至100 mL,即保护剂溶液质量浓度为200 g/L。
(2)不同分子量保护剂的复配
保护剂A(质量比1∶1复配):复合保护剂以两种保护剂复配且两者之间1∶1复配,即各100 g/L。
保护剂B(不同质量比复配):m(低聚异麦芽糖):m水苏糖=1∶2时,低聚异麦芽糖70 g/L,水苏糖140 g/L;m(低聚异麦芽糖)∶m(水苏糖)=2∶1时,低聚异麦芽糖140 g/L,水苏糖70 g/L;m(低聚异麦芽糖)∶m(水苏糖)=1∶3时,低聚异麦芽糖50 g/L,水苏糖150 g/L;m(低聚异麦芽糖)∶m(水苏糖)=3∶1时,低聚异麦芽糖150 g/L,水苏糖50 g/L。
(3)优势保护剂复配其他类保护剂
低聚异麦芽糖120 g/L,水苏糖60 g/L,其他类保护剂30 g/L。
糖类保护剂在115℃条件下灭菌20 min,蛋白质和聚合物类保护剂在85℃条件下灭菌30 min。
1.3.4 罗伊氏乳杆菌的高密度冻干
以8%的接种量接菌至MRS液体培养基中,37 ℃恒温培养12 h后8 000×g、4 ℃、20 min离心,去上清,收集菌泥。选取优化后的冻干保护剂配方配制保护剂,将菌泥干物质和保护剂干物质以质量比1.0∶0.8、1.0∶1.0、1.0∶1.2分别配制成质量分数为9%、17%、23%和29%的冻干体系,分别取1 mL分装至冻干瓶冻干。冻干工艺同1.3.2。
1.3.5 冻干存活率的测定[15]
将冻干后的菌剂用无菌蒸馏水还原到冻干前的质量,混匀后测定其中的菌落总数冻干存活率如公式(1)所示:
冻干存活率![]()
(1)
式中:活菌数的单位为CFU/mL。
1.3.6 冻干前后样品的活菌计数
采用活菌计数法[16],取0.5 mL菌液以10倍依次递增稀释至3个合适稀释度,各取1 mL稀释液注入无菌培养皿中,将已溶化并冷却至45 ℃左右的培养基倾注15 mL至培养皿中,立即放在桌上手动摇晃混匀,每个稀释度做3个平行,凝固后倒置于37℃培养箱,培养12 h取出并记录活菌数。
1.3.7 数据统计与分析
试验中每个实验值的测定均为3次平行实验的平均值,在后期的统计分析中不再重复强调。不同组(>3)之间的显著性差异通过进行ANOVA进行判断(Tukey’s检验),两组之间的显著性差异通过t检验进行判断(SPSS 16.0软件),P<0.05则认为差异显著。
罗伊氏乳杆菌在不同种类保护剂中的冻干存活率如表1所示。
表1 罗伊氏乳杆菌在不同种类保护剂中的冻干存活率
Table 1 Freeze-drying survival rate of Lactobacillus
reuteri in different types of protective agents

保护剂冻干存活率/%保护剂冻干存活率/%空白组1.02±0.15no棉子糖7.33±0.00lnmo赤藓糖醇8.88±1.57klm水苏糖50.10±5.16d木糖4.93±0.53nmo低聚果糖62.66±3.33ab阿拉伯糖6.71±1.82lnmo低聚异麦芽糖56.73±1.51bcd核糖7.30±0.66lnmo低聚糖低聚木糖66.94±5.17a鼠李糖9.58±0.47jklm低聚半乳糖55.98±6.93bcd半乳糖22.99±0.67fg甘露低聚糖68.20±2.86a单糖(醇)岩藻糖17.95±3.17gh麦芽糊精54.59±4.70cd甘露糖17.43±2.71ghi菊粉59.88±2.74bc果糖17.05±1.03ghij聚葡萄糖16.26±1.45ghijk山梨糖8.60±1.64lnm多糖羟乙基淀粉4.88±0.69nmo葡萄糖26.21±2.12f抗性糊精34.46±0.85nmo甘油0.14±0.05o蛋白质乳清蛋白28.87±1.95f半乳糖醇23.50±0.37fg胶原蛋白29.00±2.42f山梨糖醇10.19±1.01ijklm脱脂乳25.97±2.77f木糖醇17.95±1.71gh聚合物聚乙烯吡咯烷酮29.60±13.29f甘露糖醇0.50±0.10o明胶25.97±2.77f乳糖37.71±2.27e二糖(醇)麦芽糖醇13.78±1.92hijkl乳糖醇11.74±1.81hijklm蔗糖53.61±2.09cd海藻糖29.08±2.58f
注:表中不同字母代表显著性(P<0.05);a~o代表冻干存活率大~小
目前最常用的保护剂有糖(醇)类、蛋白质类以及聚合物类。糖(醇)类保护剂具有多个羟基,可替代水分子在冷冻干燥过程中与菌体细胞膜磷脂中的磷酸基团或与菌体蛋白质极性基团形成氢键,避免细胞膜和蛋白质结构与功能的完整性受到破坏[5,17];蛋白质类的保护剂能在菌体表面形成蛋白膜,稳定菌体细胞膜,为菌体提供了保护衣,保护菌体不因暴露于外界环境中而受到损伤[8,18]。它也为冻干的菌体提供了疏松、多孔的结构[19-20];聚合物类保护剂则可以显著提高生物制品混合溶液的玻璃化转变温度,抑制冷冻干燥过程中pH值的剧烈变化等。通常认为不同保护原理的冻干保护剂复合提高菌体的冻干存活率,这也为下面开展不同分子量的冻干保护剂复配奠定了基础。
为了系统探究这些糖(醇)类、蛋白质类、聚合物类保护剂对乳杆菌的冻干保护效果,将文献报道过的糖(醇)类、蛋白质类、聚合物类保护剂进行单因素实验,由表1可知,37种不同保护剂中大部分的保护效果均显著高于无菌水的对照样(P<0.05),低聚糖的冻干保护效果最好,罗伊氏乳杆菌138-1在不同低聚糖保护下的冻干存活率均达到60%左右。
由上述实验结果可知不能渗透进细胞壁的蛋白质和聚合物的冻干保护效果不好,这可能是由于大分子保护剂是通过“包裹”的形式保护菌体的,所以不能像有些糖(醇)类保护剂那样可以渗透进细胞壁,在细胞壁和细胞膜之间形成一层糖(醇)溶液保护层,保护细胞膜的功能和完整性。而通常认为的可渗透进细胞膜的赤藓糖醇、甘油的冻干保护效果也不好,充分说明乳杆菌的冻干过程细胞膜的保护是关键因素。不同分子量的糖(醇)类物质随着分子量的增大,玻璃化转变温度升高,更有利于菌体的冻干存活。因此相同浓度下低聚糖较单糖表现出更优的保护效果。
2.2.1 不同分子质量保护剂以质量比1∶1复配对菌体冻干存活的影响
罗伊氏乳杆菌在不同分子量变合保护剂中的冻干存活率如表2所示。
表2 罗伊氏乳杆菌在不同分子量复合保护剂中的冻干存活率
Table 2 Freeze-drying survival rate of Lactobacillus reuteri
in different molecular weight complex protective agents
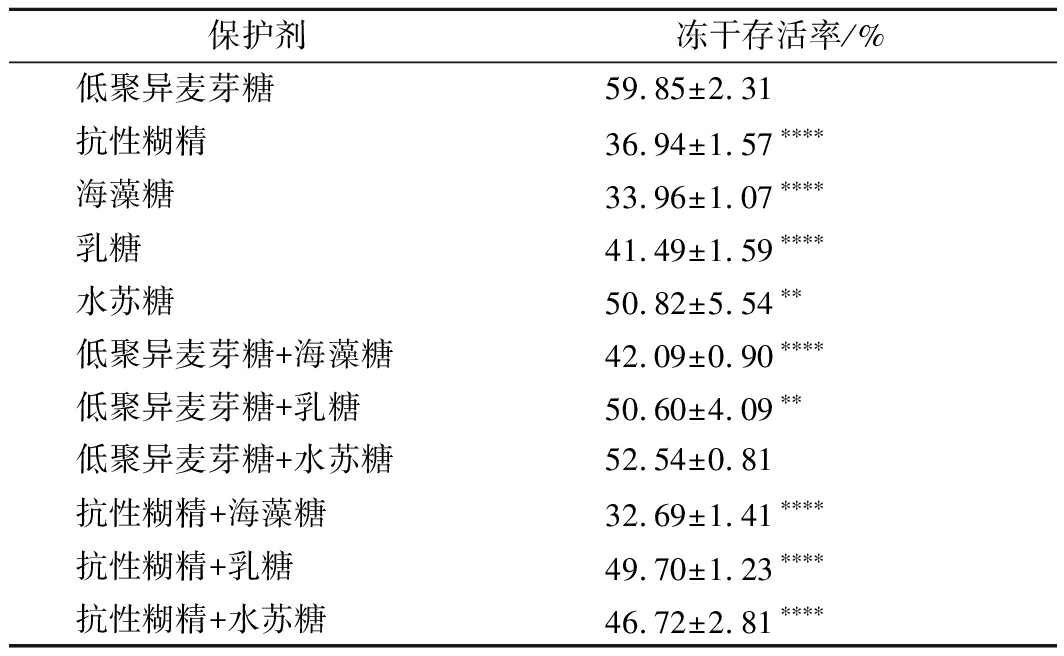
保护剂冻干存活率/%低聚异麦芽糖59.85±2.31抗性糊精36.94±1.57∗∗∗∗海藻糖33.96±1.07∗∗∗∗乳糖41.49±1.59∗∗∗∗水苏糖50.82±5.54∗∗低聚异麦芽糖+海藻糖42.09±0.90∗∗∗∗低聚异麦芽糖+乳糖50.60±4.09∗∗低聚异麦芽糖+水苏糖52.54±0.81抗性糊精+海藻糖32.69±1.41∗∗∗∗抗性糊精+乳糖49.70±1.23∗∗∗∗抗性糊精+水苏糖46.72±2.81∗∗∗∗
注:*代表与低聚异麦芽糖相比的显著性,*代表P<0.05,**代表P<0.01,****代表P<0.000 1(下同)
通过分析不同种类的冻干保护剂对罗伊氏乳杆菌的冻干保护作用,证实了大小分子对其保护方式是不一样的。那么单一保护剂与复合保护剂是否具有相同的冻干保护效果呢?焦琳等[21]在优化嗜热链球菌M5-5菌体细胞的冻干保护剂时选取了3种保护剂,包含小分子保护剂海藻糖、甘油和大分子保护剂:脱脂乳。发现海藻糖、甘油和脱脂乳作为单一冻干保护剂时,菌体细胞存活率最高为47.51%,但应用通过正交试验确定的大小分子复合保护剂配方后菌体的冻干存活率可达88.41%,提高了2倍左右。袁亚宏和韩德权等[22-23]对保加利亚乳杆菌和植物乳杆菌的冻干保护剂进行优化也得出了相似结论。这些都证明了单一的保护剂并不能满足冷冻干燥和菌体抵抗外界恶劣条件的要求,所以一般都是按一定配方混合使用。
因此选取不同分子质量的保护剂,大分子(抗性糊精)、低聚糖(低聚异麦芽糖、水苏糖)和小分子糖(海藻糖、乳糖)两两复配进行罗伊氏乳杆菌138-1的冻干。复配后的组别较单一低聚异麦芽糖组没有显著性提高,并不和大部分文献中提出的观点相同,多种保护剂混合运用效果更好,而且发现如果复配一个效果不好的保护剂反而会降低保护效果。低聚糖和不同低聚糖的复配依然呈现出最好的冻干保护效果。
2.2.2 不同低聚糖以不同比例复配对菌体冻干存活的影响
罗伊氏乳杆菌在不同低聚复合保护剂中的冻干存活率如表3所示。
表3 罗伊氏乳杆菌在不同低聚糖复合保护剂中的冻干存活率
Table 3 Freeze-drying survival rate of Lactobacillus reuteri
in different molecular weight complex protective agents

保护剂冻干存活率/%低聚异麦芽糖64.57±3.96水苏糖50.86±2.78m(低聚异麦芽糖)∶m(水苏糖)=1∶258.29±4.96m(低聚异麦芽糖)∶m(水苏糖)=2∶160.64±3.61m(低聚异麦芽糖)∶m(水苏糖)=1∶359.79±2.81m(低聚异麦芽糖)∶m(水苏糖)=3∶157.43±2.35
注:无显著性差异(P>0.05)
多数研究表明,复合保护剂因具有不同特性的保护剂,一般情况下按一定比例混合使用后可明显提高冻干保护效果[24]。但由表3可知,分别将2种低聚糖之间的质量比调整为1∶2、2∶1、1∶3以及3∶1,冻干存活率之间的差异性并不明显,为60%左右。由此可知道,不同低聚糖以不同比例复配,不影响整体冻干效果。这也进一步证实了低聚糖作为冻干保护剂的优势假设。
正如前言所述,冻干保护剂最常用的为糖类、聚合物、蛋白质等,但还有其他一些可能加强冻干保护效果的物质,这些物质以不同的原理对菌体有一定的保护效果。罗伊氏乳杆菌在优势保护剂复配其他类物质中的冻干存活率如表4所示。将这些可能加强冻干保护效果的物质与低聚糖复配之后,可以发现有的组别的冻干存活率有所提高,但并不显著。保护效果最好的组合为低聚异麦芽糖+水苏糖+复合核苷酸(I、G),冻干存活率为(66.44±2.46)%。而且依旧发现复合保护剂的保护效果较单一保护剂的保护效果没有显著性的提高。由此可知,低聚糖的冻干保护效果较好,复配其他已有文献报道的对菌冻干保护起积极作用的物质未表现出冻干保护效果的提升。
表4 罗伊氏乳杆菌在优势保护剂复配其他类物质中的
冻干存活率
Table 4 Freeze-drying survival rate of Lactobacillus
reuteri in other protective substances
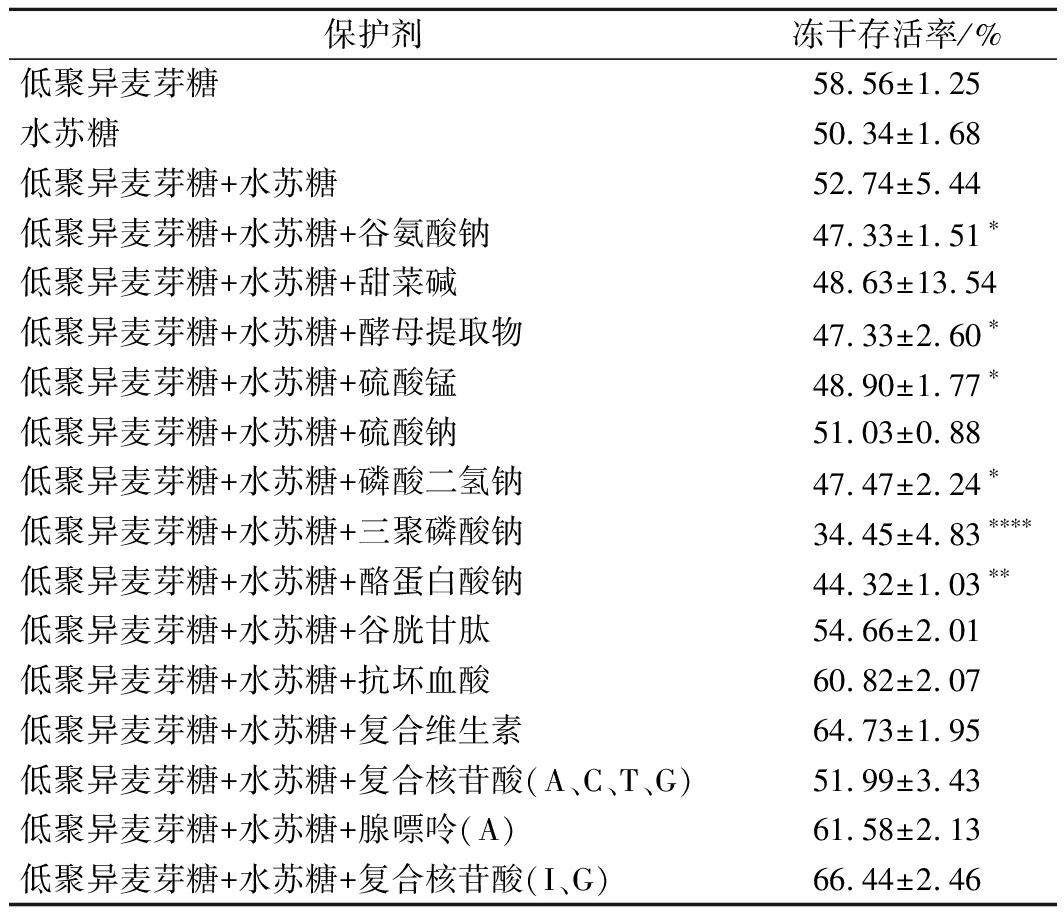
保护剂冻干存活率/%低聚异麦芽糖58.56±1.25水苏糖50.34±1.68低聚异麦芽糖+水苏糖52.74±5.44低聚异麦芽糖+水苏糖+谷氨酸钠47.33±1.51∗低聚异麦芽糖+水苏糖+甜菜碱48.63±13.54低聚异麦芽糖+水苏糖+酵母提取物47.33±2.60∗低聚异麦芽糖+水苏糖+硫酸锰48.90±1.77∗低聚异麦芽糖+水苏糖+硫酸钠51.03±0.88低聚异麦芽糖+水苏糖+磷酸二氢钠47.47±2.24∗低聚异麦芽糖+水苏糖+三聚磷酸钠34.45±4.83∗∗∗∗低聚异麦芽糖+水苏糖+酪蛋白酸钠44.32±1.03∗∗低聚异麦芽糖+水苏糖+谷胱甘肽54.66±2.01低聚异麦芽糖+水苏糖+抗坏血酸60.82±2.07低聚异麦芽糖+水苏糖+复合维生素64.73±1.95低聚异麦芽糖+水苏糖+复合核苷酸(A、C、T、G)51.99±3.43低聚异麦芽糖+水苏糖+腺嘌呤(A)61.58±2.13低聚异麦芽糖+水苏糖+复合核苷酸(I、G)66.44±2.46
冷冻干燥需要的时间较长,通常乳酸菌的冻干需要72 h左右,这使得冻干菌制剂的成本高,发展受到限制。另外,在全球能源紧缺的今天,节能降耗亦成为工业发展中不可忽视的问题。然而,冻干制品具有多重优越性,所以降低乳酸菌制剂产业化生产的能耗成为冻干研究的热点之一。提高冻干前菌悬液的干物质含量,可减少菌悬液的体积,降低冻干机的使用面积和能耗。
罗伊氏乳杆菌在高密度冻干下的存活率如表5所示。由表5可知,m(菌泥干物质)∶m(保护剂干物质)为1∶1.2时效果最好,冻干存活率普遍达到90%左右。也就是说冻干样品中保护剂干物质比菌泥干物质多时,才能达到较好的保护效果。现在工业上普遍采用15%~20%的总干物质含量,本次实验将总干物质含量提高到了30%左右,不仅使得能耗大大降低,存活率也保持在了90%以上。制得罗伊氏138-1冻干菌粉活菌含量2 500亿/g(2.5×1011 CFU/g)。
表5 罗伊氏乳杆菌在高密度冻干下的存活率
Table 5 Survival rate of Lactobacillus reuteri under
high-density freeze-drying
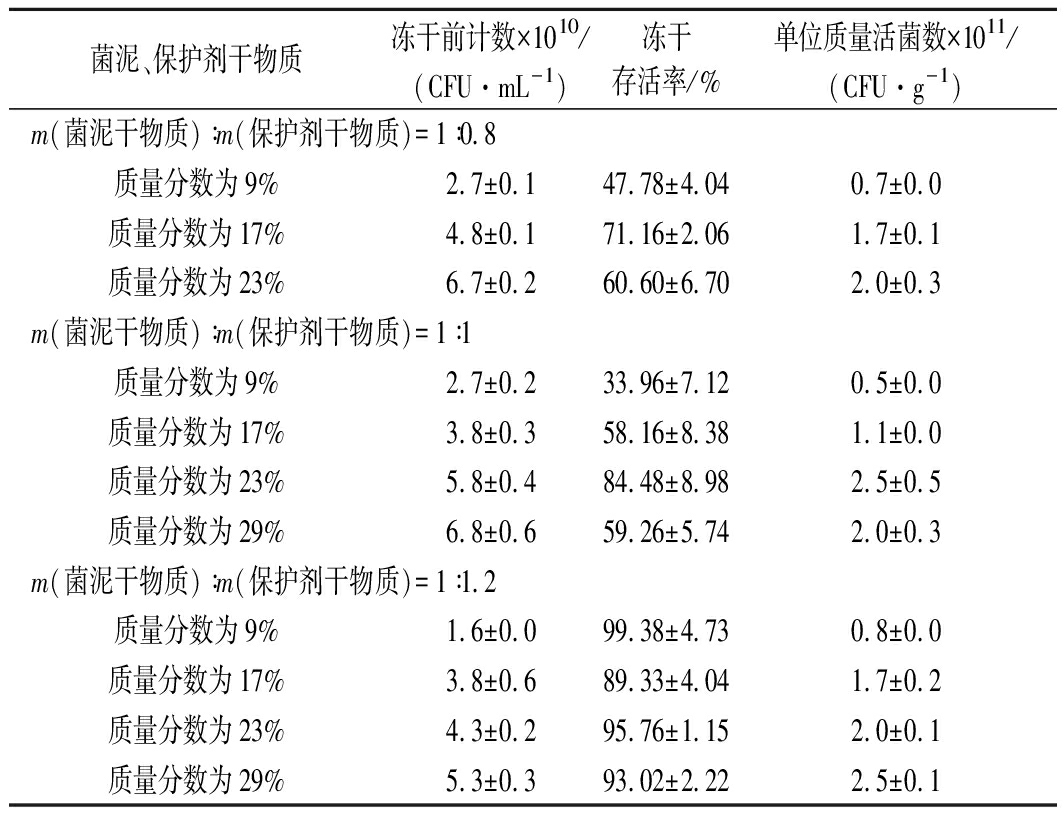
菌泥、保护剂干物质冻干前计数×1010/(CFU·mL-1)冻干存活率/%单位质量活菌数×1011/(CFU·g-1)m(菌泥干物质)∶m(保护剂干物质)=1∶0.8质量分数为9%2.7±0.147.78±4.040.7±0.0质量分数为17%4.8±0.171.16±2.061.7±0.1质量分数为23%6.7±0.260.60±6.702.0±0.3m(菌泥干物质)∶m(保护剂干物质)=1∶1质量分数为9%2.7±0.233.96±7.120.5±0.0质量分数为17%3.8±0.358.16±8.381.1±0.0质量分数为23%5.8±0.484.48±8.982.5±0.5质量分数为29%6.8±0.659.26±5.742.0±0.3m(菌泥干物质)∶m(保护剂干物质)=1∶1.2质量分数为9%1.6±0.099.38±4.730.8±0.0质量分数为17%3.8±0.689.33±4.041.7±0.2质量分数为23%4.3±0.295.76±1.152.0±0.1质量分数为29%5.3±0.393.02±2.222.5±0.1
(1)低聚糖较单糖(醇)、二糖、多糖、蛋白质和聚合物对罗伊氏乳杆菌具有更好的冻干保护效果,且不同的低聚糖之间无显著性差异。
(2)不同分子质量保护剂复配后冻干保护效果未显著提升,且复配保护效果差的保护剂后冻干保护效果反而降低;低聚异麦芽糖和水苏糖两种低聚糖的复合与单一低聚糖做保护剂的冻干保护效果无显著差异,且改变两者的复配比例后冻干保护效果亦无显著差异。
(3)低聚糖复配已有文献报道的对菌冻干保护起积极作用的物质:无机盐、氨基酸、抗氧化剂、缓冲剂、核苷酸等,未表现出冻干保护效果的提升。
(4)保护剂干物质量高于菌泥干物质量时,提高菌体的冻干存活率。菌泥与保护剂干物质的最优质量比为1∶1.2,冻干前菌悬液的干物质质量分数可提高至30%左右,冻干存活率达93.02%。降低了冻干体积,提高了冻干效率。
[1] 朱丹凤,王园园,崔树茂,等.罗伊氏乳杆菌氮源利用的选择性与特征分析[J].食品与发酵工业,2018,44(11):35-41.
[2] 庞洁,周娜,刘鹏,等.罗伊氏乳杆菌的益生功能[J].中国生物工程杂志,2011,31(5):131-137.
[3] 曹永梅,张灏,许时婴,等.保护剂在冷冻干燥双歧杆菌中的作用[J].食品与发酵工业,2000,26(2):40-45.
[4] MOORE W E C,HOLDEMAN L V.Human fecal flora:the normal flora of 20 Japanese Hawaiians[J].Appl Microbiol,1974,27:961-979.
[5] 蒲丽丽,刘宁,张英华,等.乳酸菌冻干保护剂及保护机理的研究进展[J].中国畜牧兽医文摘,2005(6):50-52.
[6] SAITO ISAO,UENO EIJI,OSHIMA HARUMI,et al.Levels of phthalates and adipates in processed foods and migration of di-isononyl adipate from polyvinyl chloride film into foods[J].Shokuhin Eiseigaku Zasshi,2002,43(3):185-189.
[7] 朱琳,刘宁,张英华,等.乳酸菌细胞膜的冻干损伤及保护[J].现代食品科技,2005,21(4):103-106.
[8] 朱战波,刘存霞,刘宇,等.二次正交旋转组合设计优化猪源罗伊乳杆菌冷冻干燥保护剂[J].中国生物制品学杂志,2009,22(11):1 091-1 094.
[9] LIU K Z,HOU W,ZUMBIKA E,et al.Clinical features of chronic hepatitis B patients with YMDD mutation after lamivudine therapy[J].Zhejiang Univ Sci B,2005,6(12):1 182-1 187.
[10] MOLINA-HOPPNER A,DOSTER W,VOGEL R F,et al.Protective effect of sucrose and sodium shloride for Lactococcus lactis during sublethal and lethal high-pressure treatments[J].Applied and Environmental Microbiology, 2004,70(4):2 013-2 020.
[11] 吴宝川,李敏.冷冻干燥保护剂在改善冻干食品品质中的应用进展[J].中国食品添加剂,2012(6):219-224.
[12] ZHANG Juan,LIU Qian,CHEN Wei,et al.Short communication:Protection of lyophilized milk starter Lactobacillus casei Zhang by glutathione[J].Journal of dairy science,2016,99(3).
[13] MORICHI T,IRIE R,YANO N,et al.Protective effect of glutamic acid and related compounds on bacterial cells subjected to freeze-drying[J].The Journal of General and Applied Microbiology,1963,9(2):149-161.
[14] 李慧.甜菜碱的作用及测定方法[J].吉林畜牧兽医,2012,33(6):24-26.
[15] 曾小群,潘道东,包红燕,等.干酪乳杆菌冻干保护剂研究[J].中国食品学报,2013,13(1):44-50.
[16] 沈萍,范秀容,李广武.微生物学试验[M].北京:高等教育出版社,1999:92-95.
[17] SHARMAN M,READ W A,CAWTLE L,et al. Levels of di-(2-ethylhexyl) phthalate and total phthalate esters in milk,cream,butter and cheese[J].Food Additives and Contaminants.1994,11(3): 375-385.
[18] 朱琳,刘宁,张英华,等.乳酸菌细胞膜的冻干损伤及保护[J].现代食品科技,2005,21(4):103-106.
[19] 田芬,陈俊亮,霍贵成.益生菌冻干保护剂优化及菌粉保存稳定性研究[J].食品科技,2012,37(2):15-19.
[20] CARVALHO A S,SILVA J,HO P,et al. Relevant factors for the preparation of freeze-dried lactic acid bacteria[J].Int Dairy J,2004,14(10):835-847.
[21] 焦琳,郑晓卫,屈晓宇,等.嗜热链球菌M5-5冻干保护剂配方的优化[J].中国酿造,2017,36(3):95-98.
[22] 袁亚宏,岳田利,高振鹏,等.冻干高活力乳酸菌粉保护剂的研究[J].西北农林科技大学报(自然科学版),2003,31(S1):82-84;88.
[23] 韩德权,杨丽娟,孙庆申,等.响应面法优化植物乳杆菌冻干保护剂[J].食品科学,2010,31(5):219-224.
[24] 陈合,齐康儒,李轶超,等.响应面法优化两歧双歧杆菌益生元类冻干保护剂[J].中国酿造,2017,36(5):81-84.