海地瓜是我国大宗低值海参品种,虽食用品质较差,但营养价值与刺参、梅花参等高品质海参相似,生理活性物质含量丰富[1]。目前海参加工产业增长速度虽快,但发展水平低,低值海参资源利用不充分、精深加工产品较少。对低值海参活性物质的深入研究,是充分利用海参资源、实现海参精深加工的关键科学问题。海参岩藻聚糖硫酸酯 (acaudina fucoidan,AFuc)是海地瓜体壁主要活性物质之一,具有抗辐射、增强免疫、抗氧化、增殖巨噬细胞等多种功能[2-4]。AFuc是一类主要由岩藻糖及硫酸基团组成的多糖,单糖组成及硫酸基团含量的不同会导致其抗凝血活性有较大差异[5]。张殉等[6]研究发现冰岛刺参AFuc的硫酸酯化程度比海地瓜AFuc稍高一些,冰岛刺参AFuc抑制肿瘤生长和转移的作用也优于海地瓜AFuc,由此推测AFuc的抗肿瘤作用可能与高硫酸酯化程度有关。朱玉婕等[7]研究发现AFuc改善胰岛素抵抗的效果与硫酸酯化位点、支链结构等分子特征密切相关,硫酸酯化位点多且无支链的AFuc的改善效果显著。多糖的硫酸酯化修饰可提高其水溶性、增强负电荷、改变多糖的空间立体结构,从而使其生物学活性明显改变[8-9]。选择适宜的硫酸酯化剂对AFuc进行酯化处理以增强其生理活性,成为提高海地瓜AFuc物质经济价值、促进低值海参资源高值化利用的有效途径。
目前人们对不含硫酸基的多糖的酯化修饰做了大量研究工作[10-11],而对含硫酸基的多糖的酯化修饰研究鲜见报道。海地瓜AFuc虽结构本身含硫酸基团,但硫酸酯化反应不仅增加硫酸基的含量,也可改变多糖分子结构,从而提高原有的生物活性,甚至增加新的功能[12]。故AFuc的硫酸酯化研究可为揭示AFuc的构效关系、研发高活性AFuc产品提供理论指导,进而拓宽其产业化应用范围。目前多糖硫酸酯化常用的酯化剂有氯磺酸、浓硫酸和三氧化硫吡啶复合物,通过酯化可使单糖残基上的羟基连接上硫酸基团[13-14]。氯磺酸法操作困难、反应剧烈、危险性大,浓硫酸法易导致多糖碳化,三氧化硫吡啶复合物法反应温和、易于操作,且效果较好。硫酸酯化常用的溶剂有N, N- 二甲基甲酰胺(DMF)、吡啶和二甲基亚砜(DMSO),但有研究发现DMSO不适宜用作多糖硫酸酯化溶剂[15]。本文拟以海地瓜AFuc为原料,采用三氧化硫吡啶复合物法对其进行硫酸酯化,以硫酸基取代度为指标设计正交试验,确定DMF和吡啶两种不同溶剂下的最佳酯化工艺参数,并对酯化产品进行红外光谱分析和抗氧化活性的测定。
AFuc粗品(纯度为56.12%,硫酸基取代度为0.83),为本实验室自制[16];N, N-二甲基甲酰胺、吡啶、三氧化硫吡啶复合物(C5H5N·SO3)、明胶、NaOH、K2SO4、乙醇等试剂,均为分析纯。
WCT-200型磁力加热搅拌器,常州国华电器有限公司;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;KDC-1044型低速离心机,科大创新股份有限公司;FT/IR-480型傅里叶红外光谱仪,日本岛津公司;Cary50型紫外可见分光光度计,美国Varian公司;JDG-0.2B型真空冷冻干燥机,兰州科近真空冻干技术有限公司。
1.3.1 三氧化硫吡啶复合物/N,N-二甲基甲酰胺法(C5H5N·SO3/DMF法)
将15 mL吡啶加入锥形瓶中,磁力搅拌下加入一定量的C5H5N·SO3,热水浴加热至反应温度,再加入AFuc产品0.2 g,保温反应。反应完毕后冷却至室温,用2 mol/L的NaOH溶液调至中性,蒸馏水透析72 h,旋蒸浓缩10倍后加入3倍体积95%的乙醇,4 ℃下静置过夜,收集沉淀冷冻干燥,得硫酸酯化海参岩藻聚糖硫酸酯(sulfated acaudina fucoidan,SAFuc)产品。
在单因素试验基础上,选定反应温度、酯化剂用量、反应时间3个参数为影响因素,每个因素取3个水平,设计正交试验L9(33)。
1.3.2 三氧化硫吡啶复合物/吡啶法(C5H5N·SO3/C5H5N法)
将15 mL吡啶加入锥形瓶中,磁力搅拌下加入一定量的C5H5N·SO3,热水浴加热至反应温度,再加入AFuc产品0.2 g,保温反应。反应完毕后冷却至室温,用2 mol/L的NaOH溶液调至中性,蒸馏水透析72 h,旋蒸浓缩10倍后加入3倍体积95%的乙醇,4 ℃下静置过夜,收集沉淀冷冻干燥,得SAFuc产品。
在单因素试验基础上,选定反应温度、酯化剂用量、反应时间3个参数为影响因素,每个因素取3个水平,设计正交试验L9(33)。
采用明胶-比浊法[17-18]测定硫酸基的质量百分数S%,然后按公式(1)计算硫酸基取代度(degree of substitution,DS)。
(1)
红外光谱分析:称取1 mg干燥产品与适量溴化钾成均匀粉末,然后用压片机压片,形成透明薄片,在500~4 000cm-1进行红外扫描,测定其红外光谱图。
DPPH体系法[18-19]测定清除1,1-二苯基-苦肼基自由基(DPPH·)的能力;
Fenton反应体系法[20-21]测定清除羟基自由基(·OH)的能力。
2.1.1 单因素试验结果
C5H5N·SO3在DMF中的溶解性较好,常温下可溶解,反应过程可常温操作。考察了DMF为溶剂时反应温度、酯化剂用量、反应时间对硫酸酯化效果的影响,结果如图1所示。
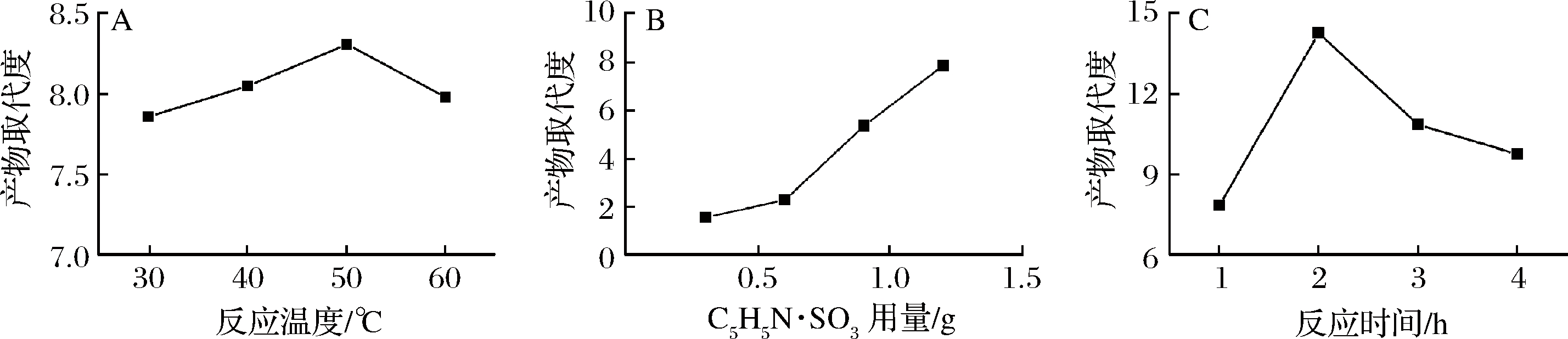
A-反应温度;B-CSH5N·SO3用量;c-反应时间
图1 DMF为溶剂时反应温度(A)、C5H5N·SO3用量(B)和反应时间(C)对产物取代度的影响
Fig.1 Effects of reaction temperature, C5H5N·SO3 dosage and time on DS of DMF as solvent
图1-A显示,温度低于50 ℃时,随着反应温度的增加,产物取代度逐渐升高;60 ℃时,取代度略有下降。在一定温度范围内,随反应温度的上升,分子运动加快,取代反应的几率增加。但温度过高也会导致多糖的降解及结构的破坏,所以取代度先上升后下降;图1-B表明,30 ℃下反应1 h,取代度随着酯化剂用量的增加而上升,说明随着硫酸盐浓度的升高,硫酸基团和多糖间的结合逐渐增多[22],故酯化剂用量越高越利于酯化反应的进行,但酯化剂用量越高成本越高;图1-C显示,反应温度30 ℃下,在2 h内取代度随反应时间的增加而增加,超过2 h取代度呈下降趋势,过长的反应时间不利于酯化,这说明过长的反应时间会导致多糖的降解及结构的破坏。同时酯化时间过长也会增加经济成本,故反应时间以2 h为宜。
2.1.2 正交试验结果
在单因素试验的基础上,采用正交试验法确定C5H5N·SO3/DMF法的最适条件,各因素水平及实验结果列于表1。
由表1可以看出,运用C5H5N·SO3/DMF法进行AFuc的酯化修饰,影响酯化反应因素的主次顺序为 B>A>C,即酯化剂用量对酯化度影响最大,其次是反应温度和反应时间。最佳工艺组合为A1B3C3,即反应温度为40 ℃、酯化剂用量1.2 g、反应时间为3 h时酯化效果最好,产品取代度可达15.63(该产品编号为SAFuc-1)。为进一步考察优化工艺的可靠性和稳定性,称取3批各0.2 g AFuc产品按上述最佳工艺条件进行验证试验,结果产品取代度为14.87±1.13,说明该工艺条件下,产品取代度较高。验证试验结果表明,该优选工艺稳定可靠。
表1 DMF为溶剂时正交试验设计及结果
Table 1 Orthogonal experiment design and results of
DMF as solvent
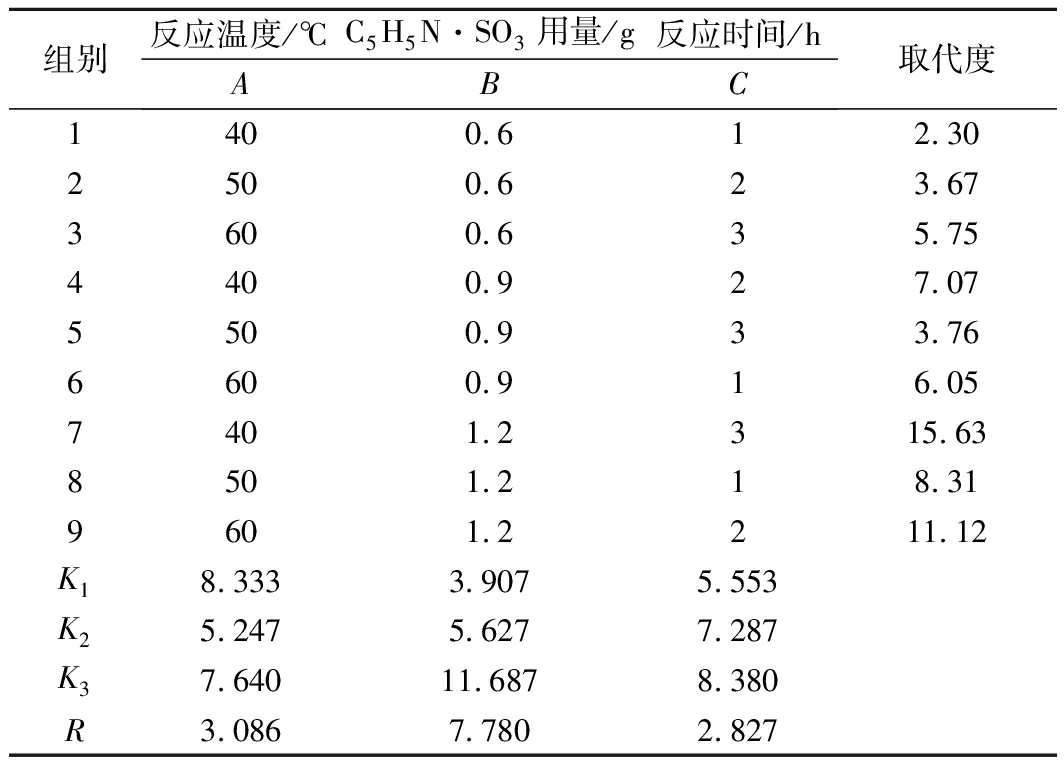
组别反应温度/℃C5H5N·SO3用量/g 反应时间/hABC 取代度1400.612.302500.623.673600.635.754400.927.075500.933.766600.916.057401.2315.638501.218.319601.2211.12K18.3333.9075.553K25.2475.6277.287K37.64011.6878.380R3.0867.7802.827
2.2.1 单因素试验结果
C5H5N·SO3在吡啶中溶解性较差,常温下酯化剂不溶解,必须加热至60 ℃才可溶解。同样考察了吡啶为溶剂时反应温度、酯化剂用量、反应时间对硫酸酯化效果的影响,结果如图2所示。
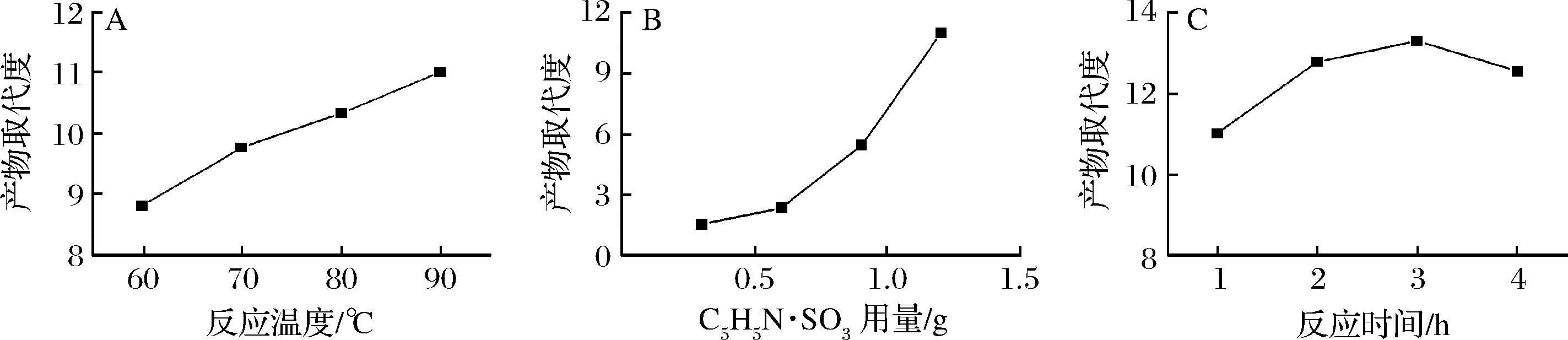
A-反应温度;B-C5H5N·SO3用量;C-反应时间
图2 吡啶为溶剂时反应温度、C5H5N·SO3用量和反应时间对产物取代度的影响
Fig.2 Effects of reaction temperature, C5H5N·SO3 dosage and time on the degree of substitution of pyridine as solvent
图2-A显示,随温度的上升,取代度逐渐增加,高温利于酯化。可能原因在于,随反应温度的上升,C5H5N·SO3在吡啶中的溶解性越好,分子运动也越快,更利于取代反应;图2-B显示,90 ℃下反应1 h,取代度随着酯化剂用量的增加而显著增加,同样是因为随着硫酸盐浓度的升高,硫酸基团和多糖间的结合逐渐增多从而使取代度增大,但高温条件下,酯化剂用量过高也会使多糖结构发生破坏[22]。图2-C表明,反应温度90 ℃下,随着反应时间的增加,硫酸基取代度先升高后有所下降。在3 h内,酯化时间增加,有助于酯化反应的进行;但在高温条件下,酯化时间过长,也会引起多糖的部分降解,导致取代度有所下降。
2.2.2 正交试验结果
在单因素试验的基础上,采用正交试验法确定C5H5N·SO3/C5H5N法的最适条件,各因素水平及实验结果列于表2。
表2 吡啶为溶剂时正交试验设计及结果
Table 2 Orthogonal experiment design and results of
Py as solvent
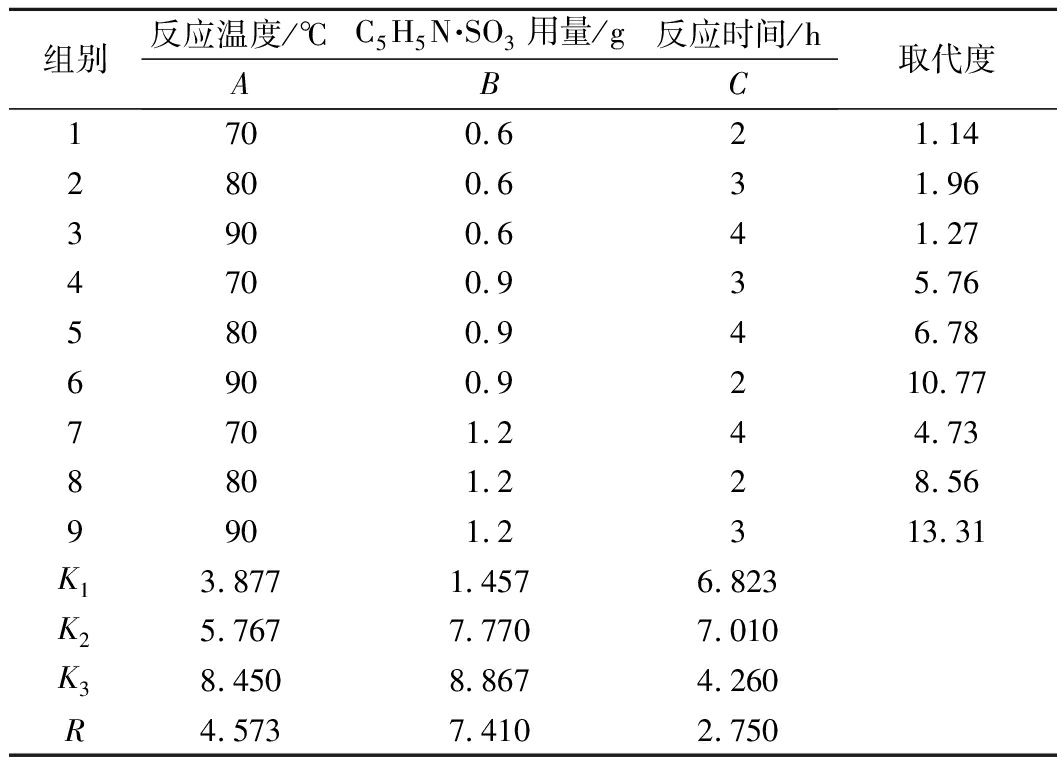
组别反应温度/℃C5H5N·SO3用量/g 反应时间/hABC 取代度1700.621.142800.631.963900.641.274700.935.765800.946.786900.9210.777701.244.738801.228.569901.2313.31K13.8771.4576.823K25.7677.7707.010K38.4508.8674.260R4.5737.4102.750
表2显示,运用C5H5N·SO3/C5H5N法进行AFuc的酯化修饰,影响酯化反应因素的主次顺序为B>A>C,即酯化剂用量对酯化度影响最大,其次是反应温度和反应时间。最佳工艺组合为A3B3C2,即反应温度为90 ℃、酯化剂用量1.2 g、反应时间为3 h时酯化效果最好,产品取代度可达13.31(该产品编号为SAFuc-2)。为进一步考察优化工艺的可靠性和稳定性,称取3批各0.2 g AFuc产品按上述最佳工艺条件进行验证试验,结果产品取代度为13.11±1.25,说明该工艺条件明显优于正交试验的其他组。验证试验结果表明,该优化工艺也是稳定可靠的。
图3为AFuc和SAFuc的红外光谱图,图中3 422 cm-1是O—H及N—H的伸缩振动峰、2 941 cm-1为C—H伸缩振动峰、1 677 cm-1为C![]() O的伸缩振动峰,1 049 cm-1为C—O—C的伸缩振动峰,它们都是多糖的特征吸收峰,酯化反应前后无明显变化,说明C5H5N·SO3对AFuc的多糖结构并无明显影响。1 232 cm-1为S
O的伸缩振动峰,1 049 cm-1为C—O—C的伸缩振动峰,它们都是多糖的特征吸收峰,酯化反应前后无明显变化,说明C5H5N·SO3对AFuc的多糖结构并无明显影响。1 232 cm-1为S![]() O 伸缩振动峰,830 cm-1为C—O—S的伸缩振动峰,两者均是硫酸酯的特征吸收峰[23-24],SAFuc-1和SAFuc-2的红外光谱显示相同的官能团吸收,酯化后硫酸酯的特征吸收峰明显增强,由此可以证实硫酸基被酯化到AFuc的多糖骨架上。
O 伸缩振动峰,830 cm-1为C—O—S的伸缩振动峰,两者均是硫酸酯的特征吸收峰[23-24],SAFuc-1和SAFuc-2的红外光谱显示相同的官能团吸收,酯化后硫酸酯的特征吸收峰明显增强,由此可以证实硫酸基被酯化到AFuc的多糖骨架上。

图3 AFuc、SAFuc-1及SAFuc-2的红外光谱图
Fig.3 Infrared spectra of AFuc, SAFuc-1 and SAFuc-2
测定质量浓度为2 mg/mL的AFuc和SAFuc溶液对DPPH·及·OH的清除效果,结果如图4所示。图4显示AFuc、SAFuc-1及SAFuc-2溶液对DPPH·的清除效果高于·OH; AFuc酯化修饰后对DPPH·和·OH的清除效果均显著增强,且SAFuc-1(取代度15.63)对DPPH·和·OH的清除效果均优于SAFuc-2(取代度13.31),说明硫酸基团的增加利于AFuc抗氧化活性的提高。该结论与不含硫酸基的多糖(如鱼腥草多糖[25]、怀山药多糖[26]等)硫酸酯化修饰后抗氧化活性测定结果一致。谢明勇等[27]分析了硫酸酯化改变抗氧化活性的原因在于:硫酸基团的引入使得多糖的构象变得更为伸展,改变了多糖在溶液中的构象,从而利于其活性的表达。与氯磺酸吡啶法相比,C5H5N·SO3为酯化剂所得产品的硫酸基含量虽低,但抗氧化活性却更高[17-18],可能原因在于:酯化反应条件不同,对多糖空间构象的改变影响不同。
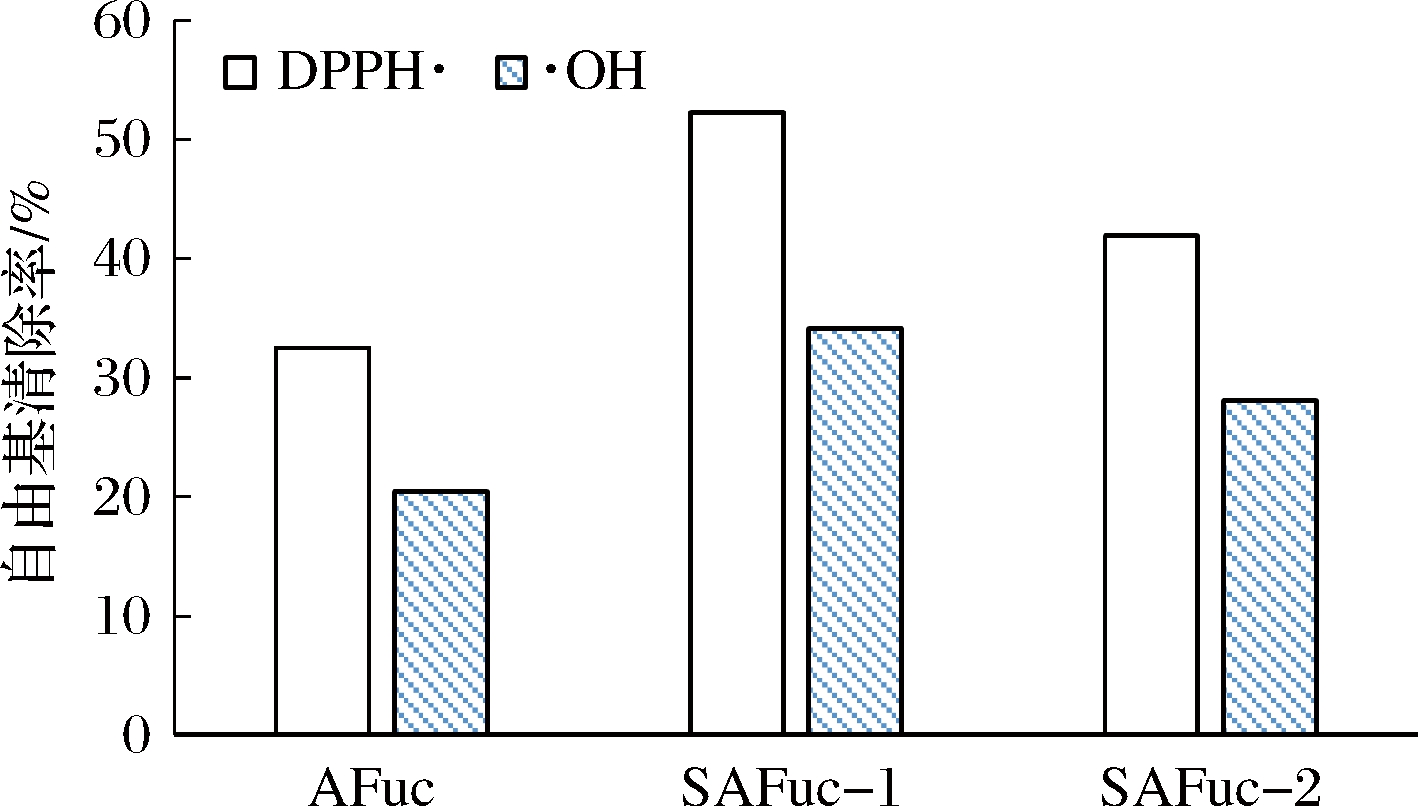
图4 AFuc、SAFuc-1及SAFuc-2对DPPH·和·OH的清除效果
Fig.4 Scavenging effect on DPPH· and ·OH of AFuc,
SAFuc-1 and SAFuc-2
采用C5H5N·SO3为酯化剂可有效对AFuc进行酯化改性,且在DMF和吡啶两种不同溶剂下,影响酯化效果的诸因素主次顺序均为:酯化剂用量影响最大,其次是反应温度、反应时间。DMF为溶剂时最佳酯化工艺条件为:反应温度为40 ℃、酯化剂用量1.2 g、反应时间为3 h,硫酸基的取代度由0.83提高至15.63;吡啶为溶剂时最佳酯化工艺条件为:反应温度为90 ℃、酯化剂用量1.2 g、反应时间为3 h,产品取代度提高至13.31。红外光谱检测表明,SAFuc在硫酸酯处的特征吸收峰明显加强;抗氧化活性测定显示,酯化反应后,产品抗氧化活性提高。总体而言,DMF为溶剂时,酯化反应条件温和、硫酸基取代度较高,且产品抗氧化活性更优,故C5H5N·SO3/DMF法更适于AFuc的酯化反应,是一种很有应用前景的硫酸酯化多糖的方法。本试验为低值海参的高值化开发应用提供了科学依据,为丰富多糖构效关系、拓宽多糖的应用领域研究提供了理论基础。
[1] KARIYA Y, MULLOY B, IMAI K, et al. Isolation and partial characterization of fucan sulfates from the body wall of sea cucumber Stichopus japonicus and their ability to inhibit osteoclastogenesis[J]. Carbohydr Res., 2004, 339(7): 1 339-1 346.
[2] 张健, 刘芳, 张金浩,等. 海参多糖制备、化学分析及生物活性研究进展[J]. 食品安全质量检测学报, 2018, 9(8):16-22.
[3] CHEN S, XUE C, YIN L, et al. Comparison of structures and anticoagulant activities of fucosylated chondroitin sulfates from different Sea cucumbers[J]. Carbohydr Polym, 2011, 83(2): 688-696.
[4] 张祺, 李学敏, 李兆杰, 等. 海参岩藻聚糖硫酸酯对巨噬细胞的调节作用及信号通路研究[J]. 中国药理学通报, 2015,31(1):87-92.
[5] LUO L, WU M, XU L, et al. Comparison of physicochemical characteristics and anticoagulant activities of polysaceharides from three sea cucumbers [J].Marine Drugs, 2013, 11(2): 399-417.
[6] 张珣, 王静凤, 徐雷, 等. 海地瓜和冰岛刺参海参岩藻聚糖硫酸酯抗肿瘤作用的比较研究[J]. 食品科学, 2012, 33(7):251-255.
[7] 朱玉婕, 常耀光, 王静凤. 3种海参岩藻聚糖硫酸酯改善胰岛素抵抗的构效关系研究[C]. 中国食品科学技术学会第十五届年会, 2018:174.
[8] ZHANG M, CUI S W, CHEUNG P C K, et al. Antitumor polysaccharides from Mushrooms: A review on their isolation process, structural characteristics and antitumor activity[J]. Trends Food Sci Technol, 2007, 18(1):4-19.
[9] BEDINI E, LAEZZA A, PARRILLI M, et al. A review of chemical methods for the selective sulfation and desulfation of polysaccharides[J]. Carbohydrate Polymers, 2017, 174:1 224-1 239.
[10] 杜湛湛, 张嫱, 徐平,等. 粒毛盘菌多糖纯化、硫酸酯化修饰及抗氧化活性评价[J]. 合肥工业大学学报(自然科学版), 2016, 39(1):134-139.
[11] PANDYA U, DHULDHAJ U, SAHAY N S. Bioactive mushroom polysaccharides as antitumor: An overview[J]. Natural Product Research, 2018(3):1-13.
[12] ERMAKOVA S P, MENSHOVA R V, ANASTYUK S D, et al. Structure, chemical and enzymatic modification, and anticancer activity of polysaccharides from the brown alga Turbinaria ornata[J]. Journal of Applied Phycology, 2016, 28(4):2 495-2 505.
[13] QI J, KIM S M. Effects of the molecular weight and protein and sulfate content of Chlorella ellipsoidea polysaccharides on their immunomodulatory activity[J]. International Journal of Biological Macromolecules, 2017, 107(Pt A):70-77.
[14] SU C W, CHIANG M Y, LIN Y L, et al. Sodium dodecyl sulfate-modified doxorubicin-loaded chitosan-lipid nanocarrier with multipolysaccharide-lecithin nanoarchitecture for augmented bioavailability and stability of oral administration in vitro and in vivo[J]. Journal of Biomedical Nanotechnology, 2016, 12(5):962-972.
[15] 刘燕琼, 黄雪松. 几种硫酸化试剂和溶剂对菊糖硫酸化改性的影响[J]. 天然产物研究与开发, 2006, 18(5):747-750.
[16] 王瑞芳, 吴光斌, 谢远红,等.海参岩藻聚糖硫酸酯的超滤纯化工艺研究[J]. 食品研究与开发, 2017,38(2):58-61.
[17] DODGSON K S, PRICE R G. A Note on the determination of the ester sulphate content of sulphate polysaccharides[J]. Biological Chemistry, 1962, 84: 106-110.
[18] 王瑞芳, 吴光斌, 谢远红,等. 氯磺酸-吡啶法酯化修饰海参岩藻聚糖硫酸酯的研究[J]. 内蒙古民族大学学报:自然科学版, 2016, 31(4):288-292.
[19] 王瑞芳, 吴光斌, 谢远红,等. 硫酸酯化剂和溶剂对海参岩藻聚糖硫酸酯化修饰的影响[J]. 天然产物研究与开发, 2016(11):1 806-1 809.
[20] IMBS T I, SKRIPTSOVA A V, ZVYAGINTSEVA T N. Antioxidant activity of fucose-containing sulfated polysaccharides obtained from Fucus evanescens by different extraction methods[J]. Journal of Applied Phycology, 2015, 27(1):545-553.
[21] HAN N, WANG L, SONG Z, et al. Optimization and antioxidant activity of polysaccharides from Plantago depressa[J]. International Journal of Biological Macromolecules, 2016, 93(Pt A):644-654.
[22] 阚国仕, 韩璐, 陈红漫,等. 硫酸酯化胡萝卜多糖工艺及其抗氧化活性的研究[J]. 食品与发酵工业, 2014, 40(5):147-151.
[23] LAEZZA A, IADONISI A, PIROZZI A V, et al. A Modular Approach to a library of semi-synthetic fucosylated chondroitin sulfate polysaccharides with different sulfation and fucosylation patterns[J]. Chemistry-A European Journal, 2016, 22(50):18 215-18 226.
[24] 王新宇. 小刺猴头菌硫酸化多糖的制备与活性研究[D]. 长春:吉林农业大学, 2011.
[25] 姚秋萍, 何可群, 黎璐,等. 鱼腥草多糖硫酸酯化修饰及清除自由基活性[J]. 食品工业, 2019, 40(8):36-39.
[26] 许春平, 孙懿岩, 白家峰,等. 怀山药多糖的提取、硫酸酯化修饰及抗氧化活性研究[J]. 河南工业大学学报(自然科学版), 2019, 40(3):50-55.
[27] 谢明勇, 王之珺, 谢建华. 多糖的硫酸化修饰及其结构与生物活性关系研究进展[J]. 中国食品学报, 2015, 15(2):1-8.