茶叶(Camellia sinensis (L.) O. Ktze)主要生长在热带和温带地区,包括中国、印度、斯里兰卡、日本以及几个非洲和南美洲国家,根据发酵程度可以分为绿茶、白茶、红茶和乌龙茶。其中绿茶是未发酵的,黄酮、多酚等功能成分得到了很好的保存[1]。在许多体外、动物和人体试验中,发现绿茶具有抗癌、抑菌、抗氧化、降低心血管疾病死亡率等多种功效[2-5]。BALSAN等[2]探究了绿茶提取物的抑菌活性。MIJA等[3]通过大鼠实验证明了绿茶具有降血脂的健康功效。来自日本的两项研究表明,每天饮用绿茶能够降低人的心血管疾病死亡率[4-5]。
桑(Morus alba L.)是桑科植物,在世界各地都有种植,特别是在亚洲,非洲和拉丁美洲。桑树的所有部分,包括根、树皮、果实和叶子,都是生物活性物质的良好来源,具有很高的药用价值[6]。现有的研究证明桑叶具有治疗发热、保护肝脏、降低血压、抗炎和抗癌等功效[7-8]。
臭黄荆(Premna ligustroides Hemsl)是一种马鞭草科腐婢属灌木,广泛分布于中国的西南地区。臭黄荆叶含有丰富的果胶,是制作民间小吃“神仙豆腐”的原料;用来外敷涂抹时还可以起到消毒解肿、消除毒疮的作用,具有丰富的食用和药用价值[9]。
人们将这3种植物叶片冲调饮用的习惯由来已久,且已有研究证明三者均具有抑菌和抗氧化活性[2,8-9]。随着对其认识逐渐深入,新的饮品也不断出现,同时开始将细粉用作食品添加剂来制造各种健康食品,如面包和糖果等[10-11]。目前对于绿茶、桑叶和臭黄荆叶的研究集中于其全叶和粗粉的醇提液活性研究,且对于三者生物活性的比较研究还未见报道。因为溶剂极性和原料粒度不同,提取液中活性成分的种类和含量差异很大,抑菌能力和抗氧化活性也有所不同。因此开展3种水提液的抑菌和抗氧化活性比较,能够准确清晰地认识到3种植物细粉在日常摄入中的功效,为其健康消费选择和生产开发提供理论依据。
绿茶,湄潭翠芽成品,贵州茶海大自然茶旅发展有限公司产;桑叶粉,重庆康家客食品有限公司提供(100%过200目筛);臭黄荆叶粗粉,重庆源宇旅游开发有限公司提供;供试菌种为西南大学食品科学学院微生物实验室保存菌种。
芦丁、没食子酸,抗坏血酸,北京索莱宝科技有限公司;1,1-二苯基-2-苦肼基自由基(DPPH),东京化成工业株式会社;其他试剂均为国产分析纯。
759紫外可见分光光度计,上海菁华科技仪器有限公司;HH-4数显恒温水浴锅,金坛市富华仪器有限公司;KQ-3200DB(40kHz)数控超声波清洗器,昆山超声仪器有限公司;H1850台式高速离心机,湘仪离心机仪器有限公司;DHP-9162电热恒温培养箱,上海齐欣科学仪器有限公司。
1.3.1 原料预处理
将绿茶、臭黄荆叶粗粉用粉碎机精粉碎后,过200目筛得细粉,密封包装,低温阴凉避光干燥处存放备用。
1.3.2 黄酮、多酚含量测定
参考卢秀彬[9]的方法,分别测定3种粉剂材料醇提和水提2种方式的黄酮和多酚含量。
1.3.2.1 供试样品液制备
参照文献[9]的提取方法,适当调整。称取1.50 g的样品(干基计),按料液比1∶30加入体积分数为70%的乙醇或蒸馏水,在70 ℃(加蒸馏水提取时为90 ℃)条件下超声振荡回流提取30 min,抽滤得滤液,连续提取3次,合并3次滤液,分别用70%的乙醇和蒸馏水定容至250 mL容量瓶中,摇匀。
1.3.2.2 黄酮含量测定
采用改良的NaNO2-Al(NO3)3-NaOH比色法[12]测定黄酮含量。取1.3.2.1制备的样品液1.0 mL,加入5%的NaNO2溶液1.0 mL,放置5 min,加10%的Al(NO3)3溶液1.0 mL混匀,放置5 min后加4%的NaOH溶液10.0 mL,最后用30%的乙醇定容至25 mL,摇匀,静置10 min。以不加样品液管调零,于510 nm处测定吸光度值,黄酮含量以芦丁当量计。芦丁标准曲线为y=0.658 3x-0.034 3(R2=0.999 4),式中y为OD510值,x为芦丁浓度,单位为mg/mL。
1.3.2.3 多酚含量测定
使用Folin-Ciocalteu法[13]测定多酚含量。取1 mL样品液,加入3 mL稀释10倍的福林酚试剂混匀,反应10 min后,再加入3 mL 10%的Na2CO3溶液混匀,避光显色2 h后用蒸馏水定容至10 mL,在765 nm处测吸光度,多酚含量以没食子酸当量计。没食子酸标准曲线为y=0.011 8x-0.038 9(R2=0.996 8),式中y为OD765值,x为没食子酸浓度,单位为mg/mL。
1.3.3 抑菌能力测定
1.3.3.1 样品液制备
参照文献[14]的提取方法,稍作调整。准确称取3 g样品(干基计),加入200 mL蒸馏水,沸水浴加热15 min,离心取上清液,得绿茶水提液(GE)、桑叶水提液(ME)和臭黄荆叶水提液(PE),装入棕色瓶,保存于4 ℃冰箱中。
1.3.3.2 最小抑菌浓度(minimal inhibit concentration,MIC)与最小杀菌浓度(minimum bactericidal concentration,MBC)测定[15]
取13支试管,每支试管加入无菌肉汤培养基2.0 mL,然后于第一支试管中加入浓缩20倍的样品液(0.3 g/mL)2.0 mL,混合均匀后取出2.0 mL注入第2支试管中,依次类推,直到第11管取出2.0 mL弃去。第12管不加样品,作阳性对照;第13管不加菌液,作阴性对照。接着在1~12管中加入0.1 mL OD600值为1的菌液混合摇匀,第13支试管加入0.1 mL灭菌生理盐水,将各试管37 ℃恒温培养24 h,观察结果。
得出最小抑菌浓度(MIC)后,将未见细菌生长的试管培养物混匀,分别取培养物0.1 mL均匀涂布于琼脂平板上,37 ℃恒温培养24 h,用活菌计数器计数平板上的菌落数,平均菌落数小于5个的样品浓度即为最小杀菌浓度(MBC)。
1.3.3.3 抑菌圈测定(牛津杯法)
根据文献[16]的方法稍作修改。在无菌培养皿中加1.5%的水琼脂10 mL,凝固后在平板上均匀放置4个牛津杯。再按1∶100的比例将OD600值为1的菌液接种至60 ℃左右的固体培养基中混合均匀,迅速加入培养皿中。凝固后取出牛津杯,在形成的4个小孔中分别加100 μL无菌生理盐水和100 μL一定浓度的样品液,37 ℃培养24 h后,测量抑菌圈直径。
1.3.4 抗氧化能力测定
1.3.4.1 样品的制备
与1.3.3.1的制取方法一致,同时取出制得的部分样品液以1∶1的比例两两混合,得到绿茶+桑叶水提液(GEME)、绿茶+臭黄荆叶水提液(GEPE)、桑叶+臭黄荆叶水提液(MEPE),探究它们之间抗氧化能力的协同性。
1.3.4.2 DPPH自由基清除率
参照文献[17]的方法,稍作调整。准确称取DPPH 0.02 g,用无水乙醇定容于250 mL容量瓶中,配成浓度为0.2 mmol/L的DPPH溶液。取3支试管,分别标记为A0、A1、A2。A0:2 mL蒸馏水+2 mL DPPH溶液;A1:2 mL样品+2 mL DPPH溶液;A2:2 mL样品+2 mL无水乙醇,摇匀后避光静置30 min,在517 nm处测吸光值,每组做3个平行。
(1)
式中:S,DPPH自由基清除率,%;A0,A0管测得的吸光度值;A1,A1管测得的吸光度值;A2,A2管测得的吸光度值。
以VC为标品,得到VC浓度x(μg/mL)与DPPH自由基清除率y(%)的标准曲线方程为y=0.299 6x+7.632(R2=0.999 2)。样品的DPPH自由基清除率以达到同等效果所需VC的浓度计,单位为μgVc/mL。
1.3.4.3 羟自由基清除率
参考HUI等[18]的方法,稍作修改。取2.0 mL样品液,依次加入9 mmol/L的FeSO4溶液、9 mmol/L的水杨酸乙醇溶液和8.8 mmol/L的H2O2溶液各2.0 mL,置于37 ℃水浴锅中水浴30 min。用同体积蒸馏水代替样品液作空白组,用同体积的蒸馏水代H2O2溶液做对照,在510 nm波长处测量吸光度值。
(2)
式中:S,羟自由基清除率,%;A0,不加样品液测得的吸光度值;A1,样品液测得的吸光度值;A2,不加水杨酸测得的吸光度值。
以VC为标品,得到VC浓度x(μg/mL)与羟自由基清除率y(%)的标准曲线方程为y=0.148 7x+3.846(R2=0.995 4)。样品的羟自由基清除率以达到同等效果所需VC的浓度计,单位为μg Vc/mL。
1.3.4.4 Fe2+螯合能力
参照文献[19]的方法,稍作调整。取2 mL的样品液、依次加入2 mmol/L的FeCl2溶液和蒸馏水各3 mL,混匀后加入0.4 mL 5 mmol/L的菲啰嗪溶液,37℃水浴30 min,测定562 nm波长下的吸光度。
(3)
式中:S,Fe2+螯合能力,%;A0,不加样品液测得的吸光度值;A1,样品液测得的吸光度值。
以VC为标品绘制标准曲线,得到VC浓度x(μg/mL)与Fe2+螯合能力y(%)的回归方程为y=0.440 5x-3.985(R2=0.998 9)。样品的Fe2+螯合能力以达到同等效果所需VC的浓度计,单位为μg Vc/mL。
1.3.5 数据统计分析
采用SPSS 23进行统计分析,数据结果以“平均值±标准差”(n=3)表示,Pearson法进行相关性分析,Duncan法进行显著性分析,用Origin 8.5做图。
2.1.1 黄酮含量
绿茶粉、桑叶粉、臭黄荆叶粉醇提液和水提液中黄酮含量见图1。由图中可以看出,无论是醇提液还是水提液,黄酮含量从高到低均表现为绿茶粉>桑叶粉>臭黄荆叶粉,且三者差异性显著(P<0.05)。绿茶粉醇提液和水提液中黄酮含量没有显著差异,RUSAK等[20]测定的绿茶醇提液和水提液中黄酮含量也得到了相同的结果。桑叶粉和臭黄荆叶粉醇提液中黄酮含量远远高于其水提液中的含量(P<0.05)。这可能是因为桑叶粉和臭黄荆粉叶中的黄酮大多是极性较小的异黄酮,黄烷酮,甲基化黄酮和黄酮醇,而极性较大的类黄酮糖苷含量比较少[21]。从黄酮溶出的角度看,相较桑叶粉和臭黄荆叶粉,绿茶粉更适合沸水冲泡饮用。

图1 3种原料醇提液和水提液中黄酮含量
Fig.1 Flavonoids in alcohol extracts and aqueous
extracts of three raw materials
注:大写字母不同表示不同提取方式差异显著(P<0.05);
小写字母不同表示不同原料同一提取方法差异显著(P<0.05),下同
2.1.2 多酚含量
绿茶粉、桑叶粉、臭黄荆叶粉醇提液和水提液中多酚含量见图2。从图中可以看出绿茶粉醇提液和水提液中多酚含量均显著高于桑叶粉和臭黄荆叶粉醇提液和水提液中多酚含量,分别为166.58 mg/g、133.82 mg/g。桑叶粉和臭黄荆叶粉相比,无论是在醇提液中还是水提液中,两者的多酚含量均没有显著差异。3种植物醇提液中多酚含量均显著大于其水提液(P<0.05),苑子夜等[22]也在研究中发现杜仲叶醇提液中多酚含量高于其水提液。这是因为存在于植物组织中的多酚通常通过氢键和疏水键与其他分子(例如蛋白质和多糖)结合,分子的对称性增加,极性减弱。相比于极性较强的水,多酚更容易溶解于极性较弱的乙醇水溶液中[23]。
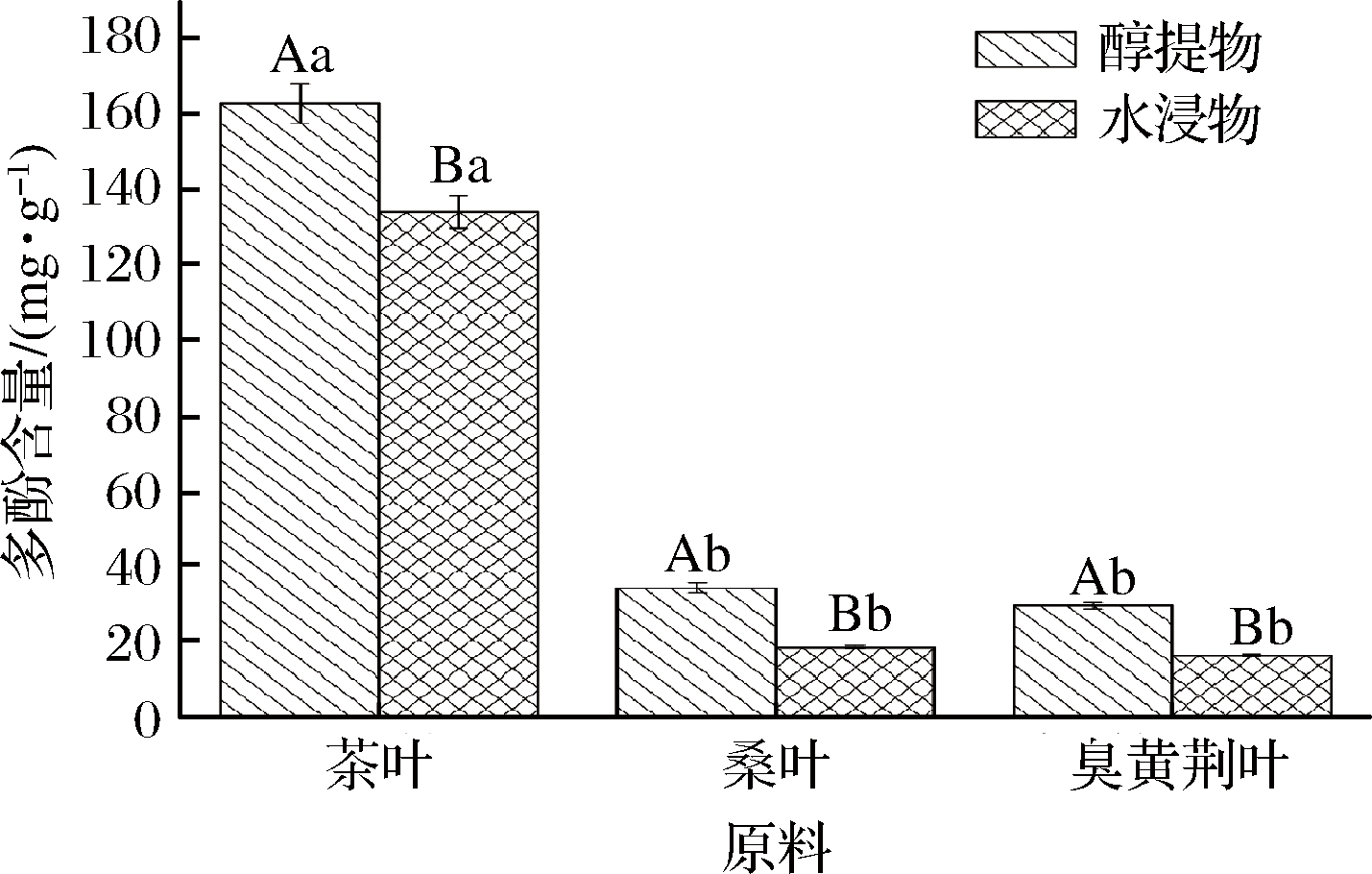
图2 3种原料醇提液和水提液中多酚含量
Fig.2 Polyphenol in alcohol extracts and aqueous
extracts of three raw materials
原料中黄酮、多酚含量的测定结果表明,绿茶粉中黄酮、多酚含量最高;桑叶粉和臭黄荆叶粉依次减少,且水提液中黄酮、多酚含量低于醇提液中的含量,差异显著(P<0.05)。已有研究证明,物质的抑菌、抗氧化能力与其黄酮、多酚含量有关[24-25]。因此,研究原料日常消费的水提液的抑菌和抗氧化活性,能够更清晰地认识到原料所带来的健康益处。
2.2.1 MIC和MBC测定
由表1可以看出3种水提液抑菌能力由强到弱依次为GE、ME、PE。GE对大肠杆菌的MIC为0.018 6 g/mL,MBC为0.037 5 g/mL,对金黄色葡萄球菌的MIC、MBC均为0.009 4 g/mL。ME对金黄色葡萄球菌的MIC、MBC均小于对大肠杆菌的MIC、MBC。梁薇等[26]的研究表明桑叶醇提液对金黄色葡萄球菌、大肠杆菌、变形杆菌和绿脓杆菌均有抑制效果,且对金黄色葡萄球菌的抑制作用最强。PE的抑菌能力较弱,对金黄色葡萄球菌的抑菌作用优于大肠杆菌,对金黄色葡萄球菌的MIC为0.300 0 g/mL。
表1 3种原料水提液最小抑菌浓度(MIC)和最小杀菌
浓度(MBC)测定结果
Table 1 Determination of minimum inhibitory concentration
(MIC) and minimum bactericidal concentration (MBC) of
aqueous extracts of three raw materials
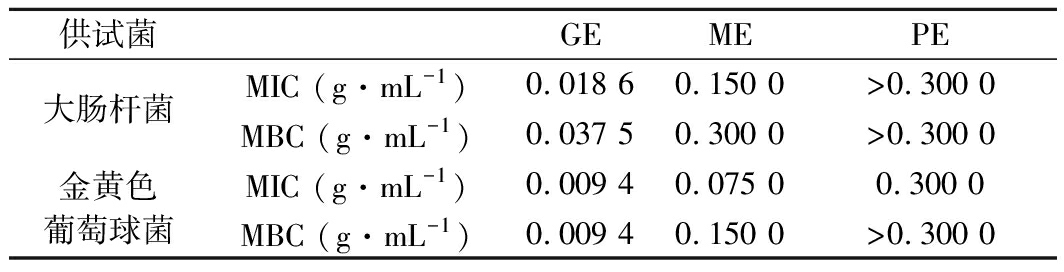
供试菌GEMEPE大肠杆菌MIC (g·mL-1)0.018 60.150 0>0.300 0MBC (g·mL-1)0.037 50.300 0>0.300 0金黄色葡萄球菌MIC (g·mL-1)0.009 40.075 00.300 0MBC (g·mL-1)0.009 40.150 0>0.300 0
2.2.2 抑菌圈直径测定
由表2可以看出GE、ME和PE的抑菌效果均随着浓度的增大而增强,在相同浓度下,对金黄色葡萄球菌的抑菌圈直径大于对大肠杆菌的抑菌圈直径。三者相比,GE的抑菌效果最好,抑菌圈直径最大,边缘清晰完整,其次是ME,PE的抑菌效果最弱。
表2 3种原料水提液抑菌圈直径测定结果
Table 2 Determination of the diameter of the inhibition
zone of the aqueous extracts of the three raw materials

样品质量浓度/抑菌圈直径/mm(g·mL-1)大肠杆菌金黄色葡萄球菌GE0.300 017.56±0.1525.12±0.530.150 014.34±0.2820.36±0.480.075 010.13±0.2615.98±0.22ME0.300 010.21±0.3212.21±0.320.150 08.64±0.4610.56±0.460.075 07.54±0.358.63±0.35PE0.300 07.43±0.418.23±0.410.150 0-7.21±0.180.075 0--
注:-表示抑菌圈直径小于6 mm
抑菌能力测定结果表明,GE的抑菌效果最好,ME次之,PE最弱,3种水提液对革兰氏阳性菌的抑菌效果均优于革兰氏阴性菌。这是因为两者细胞膜的组成和排列方式不同。革兰氏阳性菌细胞膜外部有一个肽聚糖层,它是无效的渗透屏障。而革兰氏阴性菌的外部磷脂膜带有结构性脂多糖,它与孔蛋白构成选择性屏障,使得溶菌酶这类亲脂类的抑菌物质不能渗透,从而无法起到抑菌作用[27]。GE、ME和PE的抑菌能力大小与其黄酮、多酚含量相关。这与对樱桃果渣抑菌能力的研究[27]中所得结果一致。研究表明,黄酮、多酚分子上有很多酚羟基,这些基团能够与蛋白质或酶以氢键的方式结合,破坏蛋白质的分子结构使其变性失活,导致细菌细胞质固缩、解体,从而起到抑菌作用[28]。
2.3.1 DPPH自由基清除率
DPPH自由基带有一个单电子,抗氧化剂对DPPH自由基有清除作用,表明其有提供电子或质子的能力,因此测定DPPH自由基清除率是评估抗氧化剂活性的常用方法[17]。由图3可知3种细粉水提液DPPH自由基清除率由高到低依次为GE>ME>PE,差异性显著(P<0.05)。GEME的DPPH自由基清除率与GE没有显著性差异。GEPE的DPPH自由基清除率高于PE,低于GE。MEPE的DPPH自由基清除率与PE没有显著差异。三者混合后水提液的DPPH自由基清除率均小于混合前的DPPH自由基清除率,表明三者水提物在DPPH自由基清除能力方面无协同增效作用。
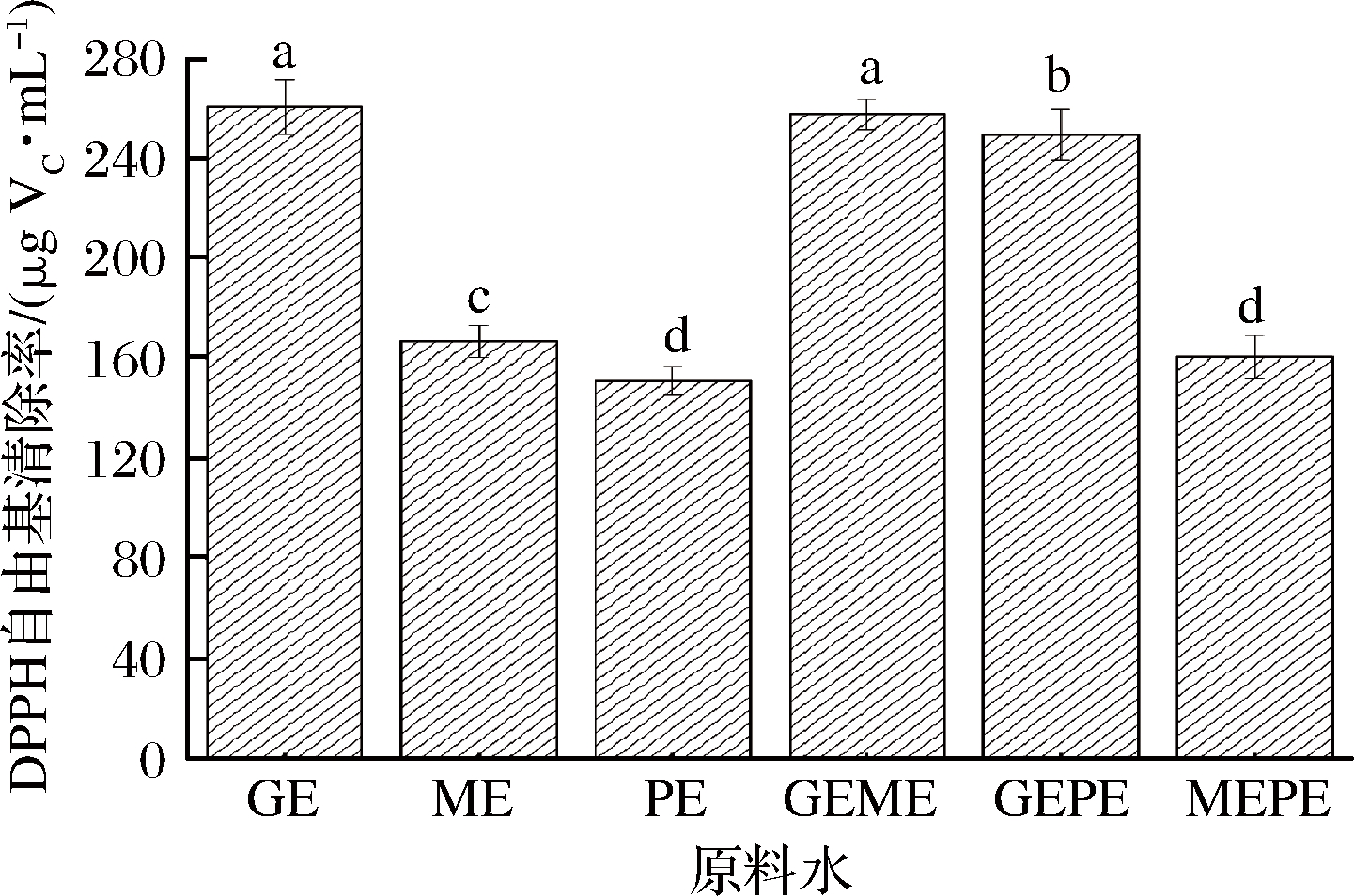
图3 3种原料水提液对DPPH自由基清除能力
Fig.3 DPPH free radical scavenging ability of water
extracts from three raw materials
注:所有样品浓度均为0.015 g/mL,小写字母不同
表示差异显著(P<0.05),下同
2.3.2 羟自由基清除率
羟自由基具有非常强的电子获得能力,它是自然界中仅次于氟元素的氧化剂[18]。羟自由基清除能力在一定程度上代表着物质的抗氧化能力。由图4可知,GE的羟自由基清除率最高,ME次之,PE最低。GEME、GEPE、MEPE的羟自由基清除率均在其混合前单独水提液的羟自由基清除率范围内,即GE、ME和PE在羟自由基清除率方面没有协同作用。

图4 3种原料水提液的羟自由基清除能力
Fig.4 Hydroxyl scavenging ability of aqueous
extracts of three raw materials
2.3.3 Fe2+螯合能力
Fe2+可以催化脂质过氧化反应,络合Fe2+,降低Fe2+浓度,可以减缓氧化反应速率[19]。由图5可知GE的Fe2+螯合力最强,显著高于PE(P<0.05),但GE与ME间没有显著性差异。GEME和GEPE的Fe2+螯合能力略低于GE。MEPE的Fe2+螯合能力低于ME,高于PE。混合后的水提液在Fe2+螯合能力方面没有表现出协同效果。
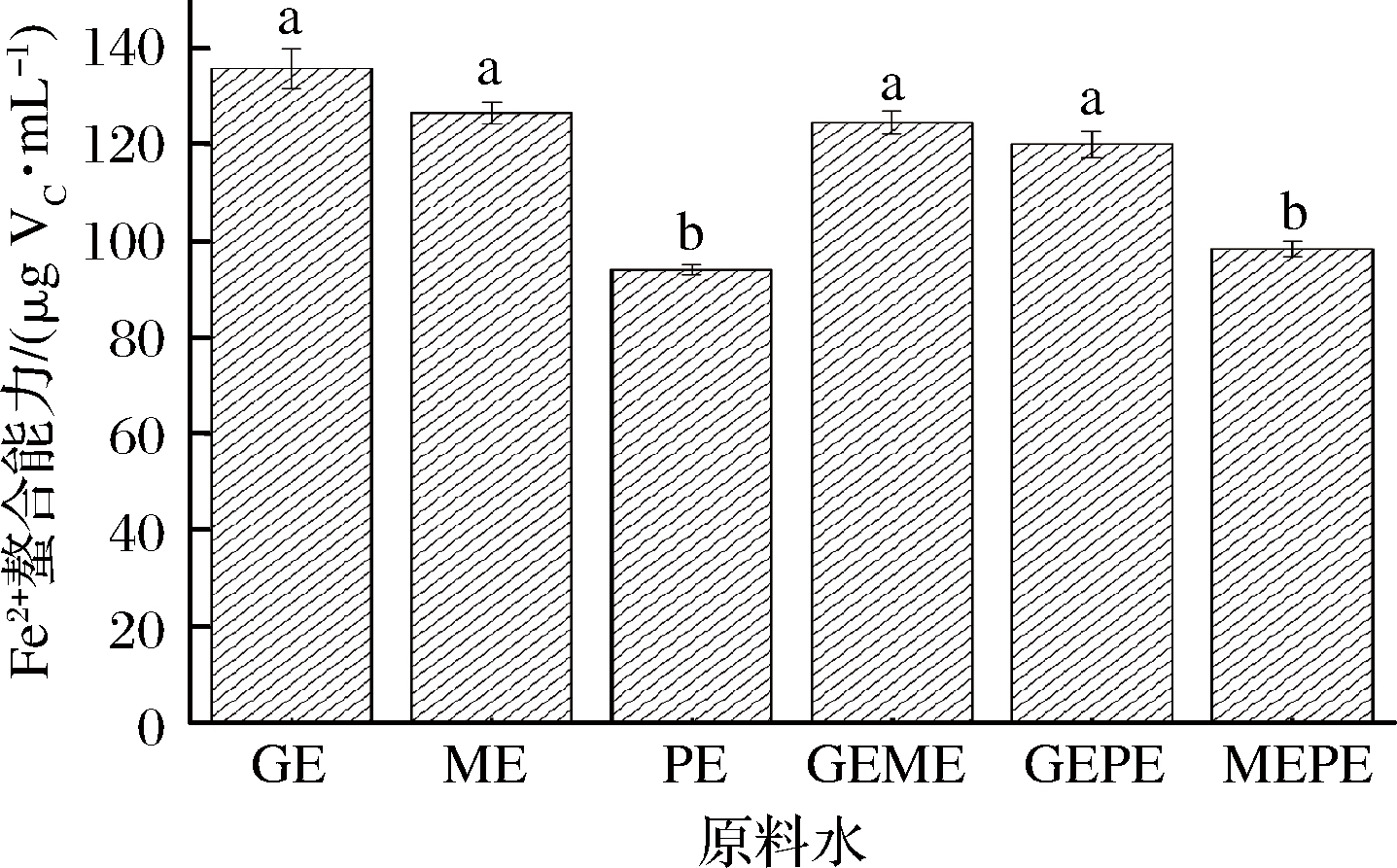
图5 3种原料水提液的Fe2+螯合能力
Fig.5 Fe2+ chelation ability of aqueous extracts
of three raw materials
3种抗氧化指标的结果均表明,GE、ME和PE的抗氧化活性依次减弱,且在抗氧化能力方面无协同作用。抗氧化能力强弱与试验测得的黄酮、多酚含量相对应。李玉晶等[25]发现啤酒花中黄酮、多酚含量与其抗氧化活性相关。有研究表明,黄酮和多酚能够通过提供电子或氢原子来中和自由基,从而降低氧化反应速率,具有抗氧化活性[27]。
原料中黄酮、多酚含量与DPPH自由基清除率、羟自由基清除力、Fe2+螯合能力的相关性分析见表3。结果表明,3种抗氧化指标结果相关,Fe2+螯合力与DPPH自由基清除率呈显著正相关(P<0.05),羟自由基清除力与DPPH自由基清除率和Fe2+螯合能力呈极显著的正相关(P<0.01)。黄酮含量与3种抗氧化指标均呈极显著的正相关(P<0.01),多酚含量与DPPH自由基清除率和羟自由基清除率有极显著的正相关性(P<0.01)。这表明3种原料中黄酮和多酚含量与其抗氧化能力间存在显著的量效关系(P<0.05),即黄酮和多酚为3种植物主要的抗氧化成分。
表3 3种原料黄酮多酚含量与抗氧化活性的相关性分析
Table 3 Correlation analysis between flavonoids and polyphenol
content and antioxidant activity of three raw materials
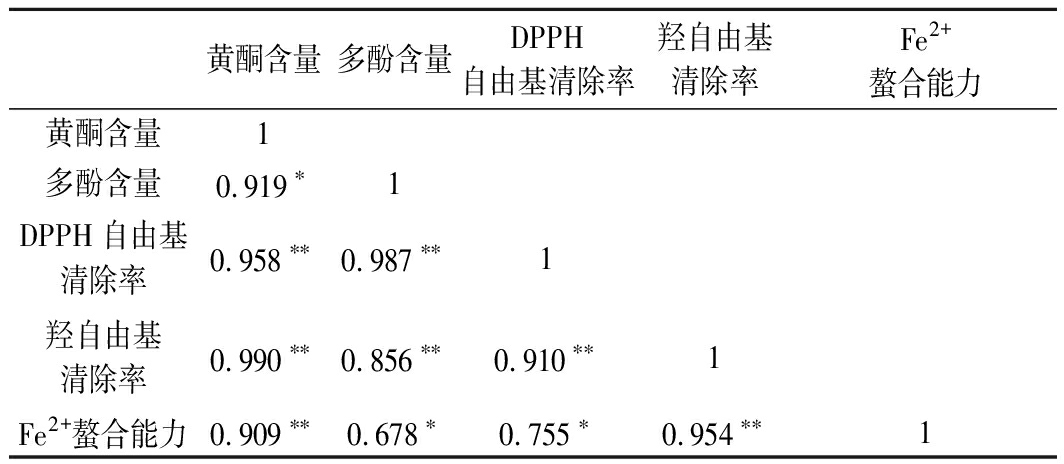
黄酮含量多酚含量DPPH自由基清除率羟自由基清除率Fe2+螯合能力黄酮含量1多酚含量0.919∗1DPPH自由基清除率0.958∗∗0.987∗∗1羟自由基清除率0.990∗∗0.856∗∗0.910∗∗1Fe2+螯合能力0.909∗∗0.678∗0.755∗0.954∗∗1
注:*显著相关(P<0.05),**极显著相关(P<0.01)
本文系统地研究了绿茶、桑叶和臭黄荆叶细粉水提液的抑菌和抗氧化能力,并且探究了3种植物抗氧化活性的协同性。结果表明:(1)绿茶粉水提液中黄酮、多酚含量最高,其次是桑叶粉,臭黄荆叶粉最低;(2)绿茶、桑叶和臭黄荆叶细粉水提液的抑菌能力依次减弱,且对金黄色葡萄球菌的抑制作用强于大肠杆菌;(3)绿茶、桑叶和臭黄荆叶细粉水提液均有一定的抗氧化能力,且绿茶粉优于桑叶粉优于臭黄荆叶粉,三者抗氧化活性无协同增效作用;(4)绿茶、桑叶和臭黄荆叶细粉中黄酮和多酚含量与其抑菌和抗氧化能力存在显著的量效关系(P<0.05)。
[1] BORA A F, MA S, LI X, et al. Application of microencapsulation for the safe delivery of green tea polyphenols in food systems: Review and recent advances[J]. Food Research International, 2018, 105: 241-249.
[2] BALSAN G, PELLANDA L C, SAUSEN G, et al. Effect of yerba mate and green tea on paraoxonase and leptin levels in patients affected by overweight or obesity and dyslipidemia: A randomized clinical trial[J]. Nutrition Journal, 2019, 18: 5.
[3] CHOI MIJA. Effects of green tea and aronia mixture on blood lipids and liver lipids in OVX rats[J]. Journal of the Korean Tea Society, 2019, 25(2): 43-49.
[4] JOCHMANN N, BAUMANN G, STANGL V, et al. Green tea and cardiovascular disease: From molecular targets towards human health[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2008, 11(6): 758-765.
[5] NAKACHI K, MATSUYAMA S, MIYAKE S, et al. Preventive effects of drinking green tea on cancer and cardiovascular disease: Epidemiological evidence for multiple targeting prevention[J]. Biofactors, 2000: 13(1-4): 49-54.
[6] SUN C, WU W, MA Y, et al. Physicochemical, functional properties, and antioxidant activities of protein fractions obtained from mulberry (morus atropurpurea roxb.) leaf[J]. International Journal of Food Properties, 2017, 20(sup3): S3 311-S3 325.
[7] CHANG Y C, YANG M Y, CHEN S C, et al. Mulberry leaf polyphenol extract improves obesity by inducing adipocyte apoptosis and inhibiting preadipocyte differentiation and hepatic lipogenesis[J]. Journal of Functional Foods, 2016, 21(59): 249-262.
[8] KATSUBE T, IMAWAKA N, KAWANO Y, et al. Antioxidant flavonol glycosides in mulberry (Morus alba L.) leaves isolated based on LDL antioxidant activity[J]. Food Chemistry,2006,97(1):25-31.
[9] 卢秀彬. 臭黄荆叶中抗氧化成分分析和凉粉凝胶优化工艺研究[D]. 重庆: 西南大学, 2010.
[10] 陈光静, 汪莉莎, 张甫生, 等. 超微粉碎对桑叶粉理化性质的影响[J]. 农业工程学报, 2015, 31(24): 307-314.
[11] 王丽娟. 桑叶提取物抑菌活性及抗氧化活性的研究[D]. 杭州: 浙江工业大学, 2012.
[12] LI A N, LI S, LI H B, et al. Total phenolic contents and antioxidant capacities of 51 edible and wild flowers[J]. Journal of Functional Foods, 2014, 6: 319-330.
[13] EBRAHIMABADI A H, DJAFARI-BIDGOLI Z, MAZOOCHI A, et al. Essential oils composition, antioxidant and antimicrobial activity of the leaves and flowers of Chaerophyllum macropodum Boiss[J]. Food Control, 2010, 21(8): 1 173-1 178.
[14] FEI T, FEI J, HUANG F, et al. The anti-aging and anti-oxidation effects of tea water extract in Caenorhabditis elegans[J]. Experimental Gerontology, 2017, 97: 86-96.
[15] 叶文初. 苦豆子提取物的抑菌、抗炎及对小鼠免疫功能的影响和毒性作用研究[D]. 杨凌: 西北农林科技大学, 2016.
[16] 叶晓婉, 朱润琪, 倪新程, 等. 明党参内生菌的分离鉴定及其对金黄色葡萄球菌的抑制作用[J]. 微生物学杂志, 2019, 39(3): 35-43.
[17] 许恩婷, 许梦洁, 邵清松, 等. 金线莲不同器官及萃取部位的抗氧化活性研究[J]. 中国食品学报, 2019, 19(1): 34-39.
[18] HUI Y, JUNLI H, CHUANG W. Anti-oxidation and anti-aging activity of polysaccharide from Malus micromalus Makino fruit wine[J]. International Journal of Biological Macromolecules, 2018, 121: 1 203-1 212.
[19] 管瑛, 汪瑨芃, 李文, 等. 豆渣固态发酵过程中主要营养成分及抗氧化特性变化[J]. 食品科学, 2016, 37(21): 189-194.
[20] HUI Y, JUNLI H, CHUANG W, et al. Phenolic content and antioxidative capacity of green and white tea extracts depending on extraction conditions and the solvent used[J]. Food Chemistry, 2008, 110(4): 852-858.
[21] FERREIRA O, PINHO S P. Solubility of flavonoids in pure solvents[J]. Industrial & Engineering Chemistry Research, 2012, 51(18): 6 586-6 590.
[22] 苑子夜, 苏印泉, 张强, 等. DPPH·法评价杜仲叶提取物的抗氧化活性[J]. 西北林学院学报, 2011, 26(6): 119-123.
[23] FONTESCANDIA C, RAMOSSANCHEZ V H, CHAVEZFLORES D, et al. Extraction of different phenolic groups from oats at a nonthermal pilot scale: Effect of solvent composition and cycles[J]. Journal of Food Process Engineering, 2018, 59: 527-533.
[24] 周玮婧, 佀国涵, 孙智达, 等. 荔枝皮黄酮抑菌性能及其作用机理研究[J]. 天然产物研究与开发,2011,23(2): 332-336.
[25] 李玉晶, 刘玉梅. 啤酒花活性成分与抗氧化活性的相关性[J]. 食品科学, 2019, 40(5): 24-30.
[26] 梁薇, 梁莹, 应惠芳. 桑叶水提物及醇提物抗菌作用的研究[J]. 时珍国医国药, 2005, 16(8): 753-753.
[27] KOLODZIEJCZYK K, SOJKA M, ABADIAS M, et al. Polyphenol composition, antioxidant capacity, and antimicrobial activity of the extracts obtained from industrial sour cherry pomace[J]. Industrial Crops and Products, 2013,51: 279-288.
[28] TSAO R. Chemistry and biochemistry of dietary polyphenols[J]. Nutrients, 2010, 2(12): 1 231-1 246.