竹笋作为一种绿色森林蔬菜,富含蛋白质、膳食纤维、氨基酸、矿物质、无机盐等多种营养成分[1],越来越受到消费者的欢迎。鲜竹笋贮藏时间短,故常被加工成笋干、水煮笋、腌制笋等食品。随着竹笋加工业的快速发展,竹笋加工过程中往往会产生大量的笋壳、笋头和笋脚等副产物,其中大部分副产物被随意丢弃或利用率低,造成了相当大的环境污染和资源浪费[2]。研究表明竹笋副产物中的膳食纤维(dietary fiber,DF)含量可达干重的40%左右,高于一般食用蔬菜[3]。竹笋膳食纤维(bamboo shoot dietary fiber,BSDF)的添加被证明可以降低油炸鱼丸面包吸收脂肪的能力[1],有效改善牛奶布丁的流变性能和组织性能[4]。添加BSDF可以解决食品中DF缺乏问题以及改善食品的质构和感官特性。因此,利用竹笋加工副产品作为DF的来源,既可以解决DF来源不足的问题,同时还可以减少环境污染,实现竹笋的综合利用,提高其附加值。
DF根据其溶解性可分为可溶性膳食纤维(solubble dietary fiber,SDF)和不溶性膳食纤维(insoluble dietary fiber,IDF)。与IDF相比,SDF具有更多的功能特性和更大的黏度、乳化性,SDF通常也会提供更好的质地和口感,因此很容易应用于食品加工。竹笋中DF含量高,但竹笋中的DF大多是不溶性的,SDF含量低限制了其在食品工业中的应用。因此,生物法、化学法和物理法被用来改性DF以提高SDF含量[5-8]。近年来,一些研究者利用挤压结合纤维素酶[9]、超声波辅助蒸煮碱处理[10]、挤压结合酶[11]、高温蒸煮结合纤维素酶[12]等联合处理方式对DF进行改性。根据结构决定性质的原理,改性处理可减小DF的粒径,使DF中更多的功能基团暴露,从而增强其持水性、溶胀性、油脂结合能力、黏度、阳离子交换能力、抗氧化等理化性质及功能特性。然而,目前对于高温蒸煮协同纤维素酶改性BSDF后理化性质和结构的研究鲜有报道。因此,本文采用高温蒸煮协同纤维素酶改性BSDF,并比较了单独高温蒸煮和酶解处理以及高温协同酶解处理后BSDF的粒径、微观结构、水合性质、持油能力、色泽、热稳定性和官能团组成,旨在为BSDF改性提供一种新的方法。
麻竹笋,重庆市北碚区天生菜市场;金龙鱼食用油,重庆市北碚区永辉超市;纤维素酶(40 U/mg)、木瓜蛋白酶(800 U/mg)等,上海源叶生物科技有限公司有限公司。
HH-ZK8数显恒温水浴锅,巩义市予化仪器有限责任公司;FA1004A电子分析天平,上海精天电子仪器有限公司;GR60DA高压灭菌锅,美国Zealway致微公司;Zetasizer Nano ZS粒度分析仪,英国马尔文仪器有限公司;Phenom Pro扫描电镜,荷兰Phenom World公司;UltraScan PRO分光测色仪,美国HunterLab公司;TGA55热重分析仪,美国TA公司;Spectrum 100傅里叶红外光谱仪,美国Perkin Elmer公司。
取新鲜无损伤麻竹笋,洗净切片,取用麻竹笋肉,用沸水漂烫8 min,60 ℃烘干,用粉碎机粉碎后过100目筛得到麻竹笋粉,加木瓜蛋白酶800 U/g,料液比1∶20 (g∶mL),55 ℃ 酶解2 h后沸水灭酶15 min,在3 000 r/min下离心15 min,收集离心得到的沉淀物,冷冻干燥,粉碎得到BSDF。
取BSDF加纤维素酶300 U/g,料液比1∶12 (g∶mL),60 ℃酶解1.5 h得到纤维素酶解组BSDF(ET),取BSDF在温度120 ℃,设置不同的蒸煮时间(20、40 min)进行高温蒸煮处理分别得到HT20、HT40组BSDF;取纤维素酶处理后的BSDF在温度120 ℃,设置不同的蒸煮时间(20、40 min)进行高温蒸煮分别得到ET-HT20、ET-HT40组BSDF。以未处理的BSDF作为空白对照(CK)。
1.4.1 粒径和电位的测定
将样品用蒸馏水稀释1 000倍后,采用纳米粒度仪测定其粒径大小和电位。粒径测定条件:平衡时间2 min,测定温度25 ℃,所用光源为最大输出功率10 W的He-Ne激光,检测角90°,检测波长633 nm。避免多重光散射,每次循环扫描10~120次。电位测定条件:折叠毛细管样品池,0.45 cm2铂电极,折叠毛细管间距0.4 cm,平衡时间2 min,测定温度25℃,每次循环扫描10~100次。每个样品重复测定3次。
1.4.2 微观结构
将干燥至恒重的BSDF粉末固定于双面导电的样品台上,喷金使其具有导电性,采用扫描电镜观察样品的微观结构并拍照记录。扫描电镜电压10 kV,放大倍数1 000倍。
1.4.3 色泽的测定
BSDF的色泽使用分光测色仪进行测定。记录每个样品的明度(L*)、绿/红度(a*)、蓝/黄度(b*)等不同颜色参数的值。总色差(△E)表示颜色强度,采用公式(1)计算:
(1)
1.4.4 持水力、膨胀性、持油性的测定
参考CHEN等[13]和HUA等[14]的方法略作修改,一式3份测定持水力(water holding capacity,WHC)、膨胀性(swelling capality,SC)、持油性(oil holding capacity,OHC)。
称取样品0.5 g,放入烧杯中,加入20 mL蒸馏水后静置6 h,在4 500 r/min下离心15 min后,收集沉淀物称重测定WHC。称取0.2 g样品,放入10 mL量筒中读取体积V1,量取8 mL纯水转移到10 mL量筒中,振荡均匀,室温下放置24 h,记录BSDF吸水后的体积测定SC。
称取样品0.5 g,放入烧杯中,加入食用油20 mL后静置6 h,在4 500 r/min下离心15 min后,收集沉淀物,用滤纸吸收BSDF表面多余的油脂后,称重测定OHC。
1.4.5 热重测定
取5~10 mg干燥样品用同步热分析仪进行热重分析,采用热重法(thermogravimetry,TG)和微分热重分析法(differential thermogravimetry analysis,DTG)测定样品的热力学性质。试验在充N2的条件下进行,升温速率为10 ℃/min,测定范围为25~600 ℃。
1.4.6 红外光谱分析
取样品1 mg干燥至恒重,放于玛瑙研钵中,加入100 mg的干燥的KBr粉末,研磨混匀至细微的粉末状。取0.05 g研磨后的混合物粉末,装入并使其均匀平铺于压片模具中,抽气加压,保持3 min左右,将制成的透明薄片迅速放入红外光谱仪中进行分析扫描,扫描次数32次,分辨率4 cm-1,扫描范围500~4 000 cm-l。
使用SPSS 25.0统计软件,对数据进行方差分析;试验数据通过数据分析系统软件对数值进行差异显著性分析(P<0.05表示显著,P>0.05表示不显著)。每个试验重复3次。运用Origin 8.0软件对数据进行处理绘图。
图1为不同处理BSDF的粒径和电位。由图1可知,不同处理均能显著减小BSDF的粒径(P<0.05),HT组与ET组粒径无显著差异(P>0.05),HT40和ET-HT40组粒径分别小于HT20和ET-HT20组,ET-HT40组粒径((423±23.7) nm)最小,粒径的减小可能是纤维素被水解为小分子以及BSDF颗粒断裂所致[5]。DF粒径与其吸收水和油的能力、在结肠中的运输和发酵等理化性质和功能特性密切相关[15]。有研究表明粒径减小会增加DF分子间的范德华力、静电引力和表面活性,对DF的理化性质有重要影响[16]。BSDF的电位在不同处理后均显著减小(P<0.05),各处理组间电位无显著差异(P>0.05)。处理后BSDF含有较大的负电荷,可能是大量的羟基和羧基存在所致。电位绝对值较大,则粒子间的静电排斥作用较大,可以防止絮凝和凝聚,从而提高稳定性[17]。HAN等[18]发现少量的麦麸DF增强了小麦淀粉颗粒间的排斥力,增加了颗粒间的稳定性。
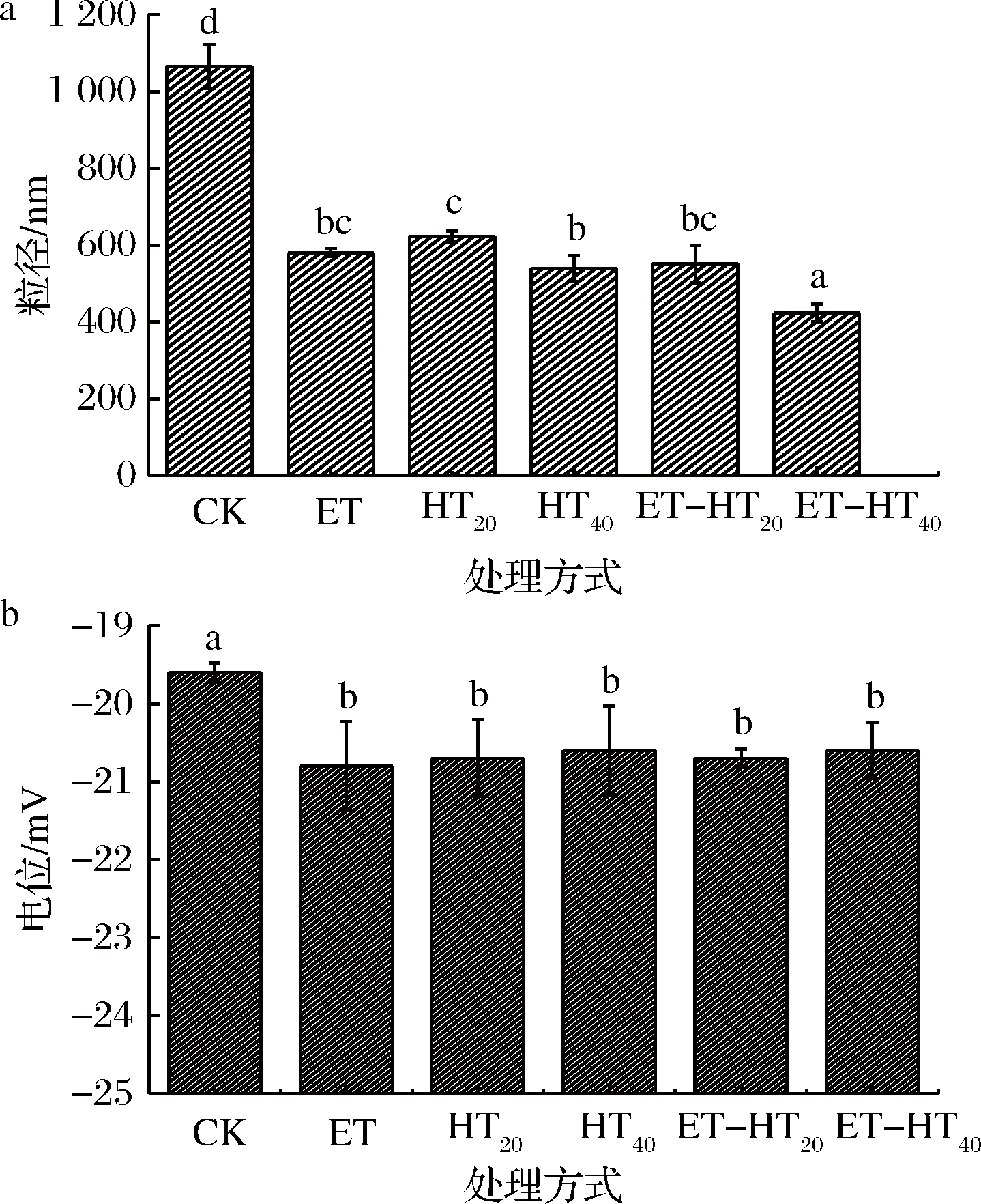
a-粒径;b-电位
图1 不同处理方式对BSDF的粒径和电位的影响
Fig.1 Effects of different treatments on the particle size
and potential of BSDF
注:图中不同处理小写字母代表差异显著(P<0.05)
图2为不同处理后BSDF放大1 000倍的扫描电镜图。经过处理后的BSDF颗粒更细小,ET-HT40组BSDF颗粒细小均匀,与粒径结果一致。颗粒尺寸的减小和比表面积的增加促进了酶的水解和DF结构的崩解[5]。CK、ET和HT组BSDF呈球状,ET-HT组呈片状,有孔隙结构出现。这可能是在高温高压条件下糖苷键断裂,分子颗粒减小,纤维素酶的水解导致BSDF表面的纤维素颗粒松散,分子质量和聚合度降低[19]。有研究发现挤压处理后BSDF为片状,有浅裂纹和深裂纹,酶解处理后有多块碎片和层状结构,而挤压结合酶解处理后BSDF表面结构呈蜂窝状[9]。也有研究发现酶解后BSDF呈蜂窝状结构,有较多的孔洞和裂纹,有助于葡萄糖等的扩散[21]。BSDF微观结构的改变使得BSDF更容易与水接触,从而提高BSDF的水溶性和保水能力[20]。HT和ET-HT组BSDF表面可见少量块状和球状物质,可能是残留的蛋白质颗粒[22]。

a-CK;b-ET;c-HT20;d-HT40;e-ET20;f-ET-HT40
图2 BSDF的SEM图(×1 000)
Fig.2 The SEM photograph of BSDF
不同处理后BSDF的色泽变化如表1所示,各改性组的L*显著降低(P<0.05),a*值显著升高(P<0.05),表明各改性处理后BSDF颜色均变暗、变红。HT组的a*值显著大于ET组(P<0.05),L*显著小于ET组(P<0.05),ET-HT40组的L*(54.26±0.64)值最小,ET-HT20组有最大的a*值(9.63±0.17)。ET、HT组的b*升高,ET-HT组的b*略有下降。HT20组的b*(20.43±0.68)最大。各改性组BSDF的ΔE均大于1.5,ET-HT40组BSDF的ΔE达到11.11±0.56,表明改性后BSDF颜色变化显著。这可能是在高温高压条件下,纤维素降解产生的糖类与BSDF中的某些物质产生美拉德反应,出现明显的褐变,导致色泽变暗,红黄度增加[23]。改性后BSDF颜色较深,可以添加在肉类制品或棕色面包等食品中,具有较好的潜在应用价值。
表1 不同处理方式对BSDF颜色的影响
Table 1 Effects of different treatments on the colors of BSDF
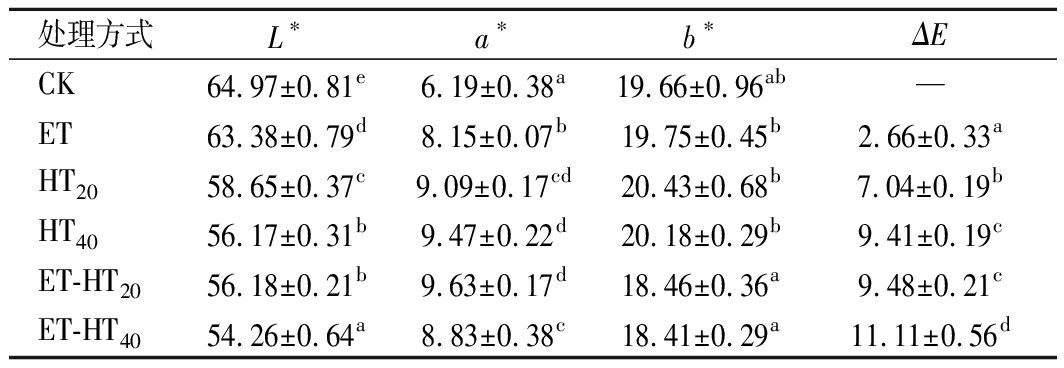
处理方式L∗a∗b∗ΔECK64.97±0.81e6.19±0.38a19.66±0.96ab—ET63.38±0.79d8.15±0.07b19.75±0.45b2.66±0.33aHT2058.65±0.37c9.09±0.17cd20.43±0.68b7.04±0.19bHT4056.17±0.31b9.47±0.22d20.18±0.29b9.41±0.19cET-HT2056.18±0.21b9.63±0.17d18.46±0.36a9.48±0.21cET-HT4054.26±0.64a8.83±0.38c18.41±0.29a11.11±0.56d
注:—表示无,不同小写字母表示差异显著(下同)
由表2可知,改性后BSDF的WHC、SC和OHC均有所提升。ET组的WHC显著增加(P<0.05),HT组的SC显著提升(P<0.05),ET-HT组的WHC和SC较对照组均显著提升(P<0.05)。HT组和ET组的WHC无显著差异(P>0.05),SC显著提升(P<0.05)。ET-HT20组的WHC((5.29±0.17) g/g)和SC((13.22±0.12) mL/g)最大,可能是纤维素酶解以及高温高压的作用使BSDF疏松多孔,羧基、羟基和氨基等亲水基团更多的暴露,粒径减小,较高的WHC与减小的粒径也有关系[18]。
改性后BSDF的OHC较对照均显著提升(P<0.05),各改性组间OHC无显著差异(P>0.05),ET-HT40组OHC((8.35±0.03) g/g)最高。OHC与BSDF的表面性质、疏水性和总电荷密度有关,高温蒸煮和酶解过程中各种力和酶的作用使得BSDF原本紧密的结构变得变得松散,孔隙增多,更多的亲脂基团暴露,油容易渗透到DF分子中被结合,使持油力得到改善[24]。
HT20组和ET-HT20组BSDF的WHC、SC和OHC较HT20和ET-HT20组均有所下降。郑刚等[25]发现高压蒸煮15 min后苹果DF的膨胀性升高,30、45 min处理后又下降。这可能是随时间的延长,酶解后产生的葡聚糖等SDF被进一步降解,一些活性基团和孔隙结构被破环,致使其持水和持油能力下降[26]。较高的WHC、SC和OHC可以改变食品的黏度和质地,与降低血清胆固醇、改善血糖控制和肠道发酵等多种功能性质有关[27]。
表2 不同处理方式对BSDF的WHC,SC和OHC的影响
Table 2 Effects of different treatments on the WHC,
SC and OHC of BSDF
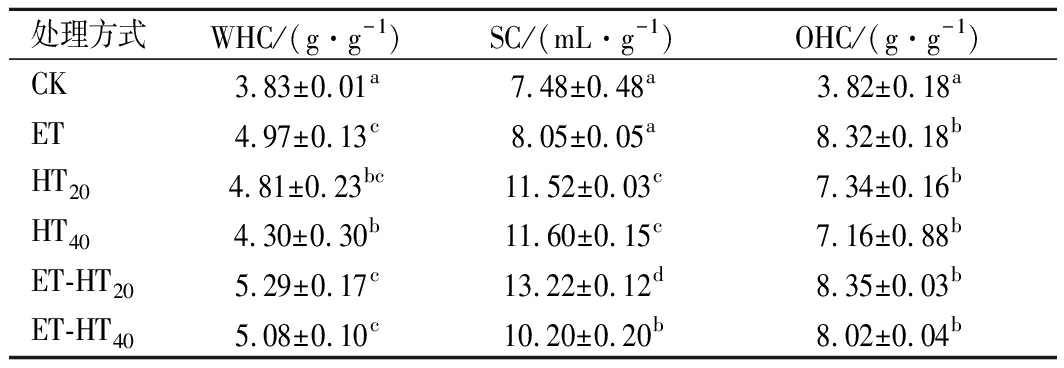
处理方式WHC/(g·g-1)SC/(mL·g-1)OHC/(g·g-1)CK3.83±0.01a7.48±0.48a3.82±0.18aET4.97±0.13c8.05±0.05a8.32±0.18bHT20 4.81±0.23bc11.52±0.03c7.34±0.16bHT404.30±0.30b11.60±0.15c7.16±0.88bET-HT205.29±0.17c13.22±0.12d8.35±0.03bET-HT405.08±0.10c10.20±0.20b8.02±0.04b
不同处理后BSDF的热分解过程如图3所示,BSDF的热分解大致分为3个阶段:50~200 ℃、200~400 ℃、400~600 ℃。这与人参渣DF的热分解过程相似[14]。在50~200 ℃的热分解范围内是水在120 ℃条件下蒸发。ET组BSDF有明显的失水峰,HT和ET-HT组无明显的失水峰。在200~400 ℃可能是果胶和半纤维素的分解,在400~600 ℃的可能是木质素和纤维素的分解。不同处理后BSDF的最大热分解温度都在300 ℃左右,ET-HT20组BSDF的最大失重率为0.43%/min,大于其他组。HT20组BSDF的最大失重率(0.39%/min)最小。各种改性处理后BSDF的热稳定性较对照均提高。HT20和HT40改性的BSDF残留率分别为26.49%和27.16%,高于ET改性BSDF的残留率24.20%,ET-HT20组BSDF的热稳定性最高,残留率为27.31%。BSDF较高的热稳定性,可能与其较高的结晶度和降解温度有关[21]。

a-CK;b-ET;c-HT20;d-HT40;e-ET20;f-ET-HT40
图3 不同处理方式BSDF的热重分析图
Fig.3 Thermal analysis of BSDF in different treatments
不同处理BSDF的红外光谱如图4所示,处理组与CK组BSDF的光谱分布相似,但在相应波长处的吸收强度有变化。在1 041 cm-1处的峰值是糖苷键所致[28],ET、HT、ET-HT组BSDF在此处峰的强度小于CK组,说明改性后BSDF中的部分糖苷键断裂。BSDF在1 225 cm-1和1 375 cm-1处出现较小的峰,与C=O拉伸振动[29]和C-H弯曲有关[16]。在1 640 cm-1的峰是结合水和一些羧酸基团、酯羰基(—COOR)所致,表明醛酸的存在[6]。有研究认为甘蔗DF在1 646 cm-1的峰是多糖和半纤维素中的C=O拉伸振动或木质素中酯基团所引起[30]。在2 928 cm-1处的峰是由木质素、纤维素和半纤维素中C-H伸缩振动引起的[31]。BSDF在3 402 cm-1附近均有较强的宽峰,主要是O—H键的延伸所致,是多糖组分的特征吸收峰[15,32]。总体来说,BSDF的红外图谱特征吸收峰的峰型和基本位置未发生特别明显的变化,改性对BSDF主要官能团没有较大影响。LUO等[22]发现酶解后BSDF的吸收峰与未处理组基本一致,BSDF的基本结构没有被破坏。
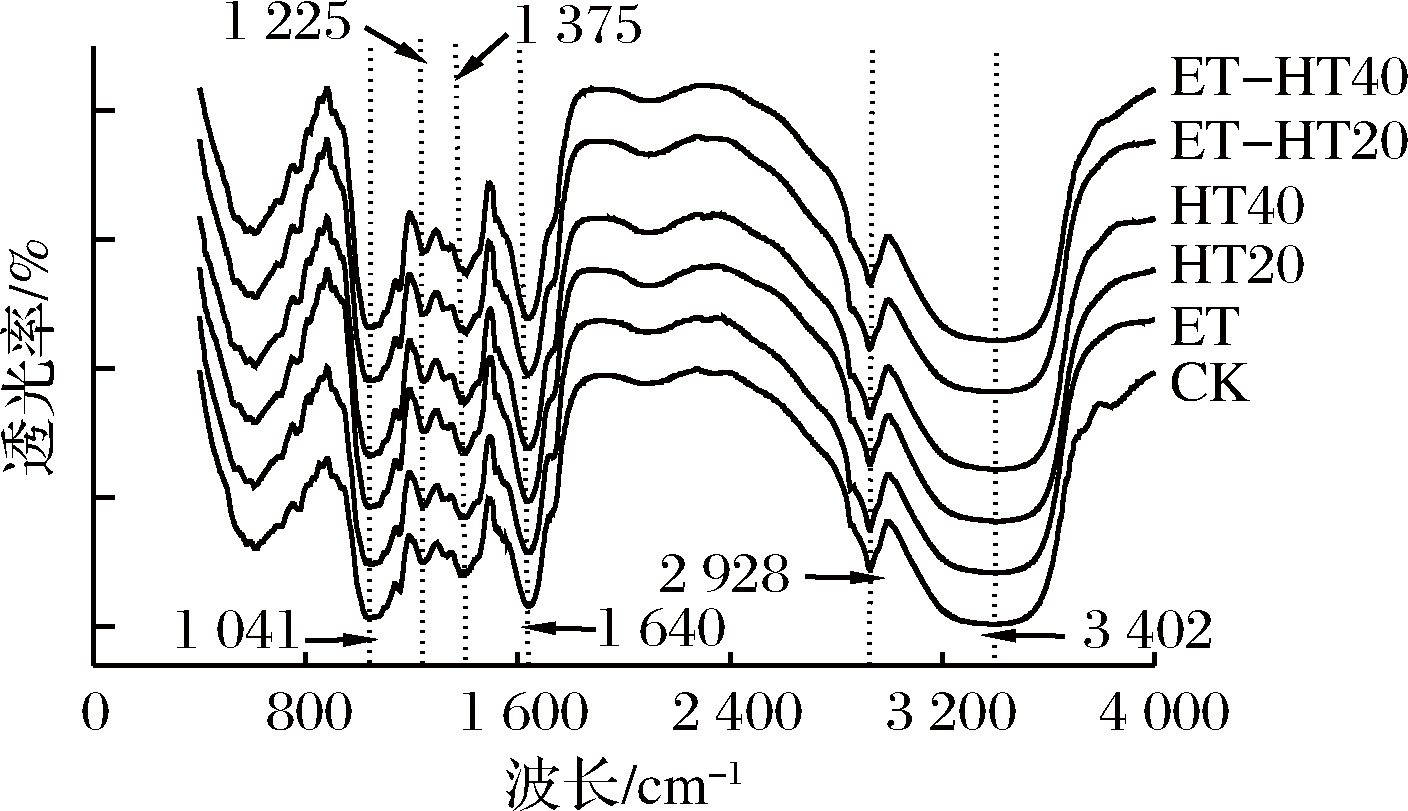
图4 不同处理方式BSDF的红外光谱图
Fig.4 The FT-RI of BSDF by different treatments
本文研究了纤维素酶解、高温蒸煮、高温蒸煮协同纤维素酶处理对BSDF结构和理化性质的影响。研究结果表明,改性后的BSDF颜色偏暗、偏红和偏黄,高温蒸煮协同纤维素酶处理BSDF具有最小的粒径,BSDF的持水力、膨胀力和持油力得到改善。通过热重、扫描电镜和红外光谱分析,高温蒸煮协同纤维素酶处理BSDF成片状,颗粒减小,热稳定性增强,主要官能团结构未发生改变。综上所述,高温蒸煮结合纤维素酶处理有效地改善了BSDF的结构和理化性质,是一种绿色有效的方法,可以为今后BSDF的开发利用提供新的参考。
[1] ZENG Heng,CHEN Jiwang,ZHAI Jinling,et al. Reduction of the fat content of battered and breaded fish balls during deep-fat frying using fermented bamboo shoot dietary fiber[J].LWT-Food Science and Technology,2016,73:425-431.
[2] LUO Xianliang,WANG Qi,ZHENG Baodong,et al. Hydration properties and binding capacities of dietary fibers from bamboo shoot shell and its hypolipidemic effects in mice[J]. Food and Chemical Toxicology,2017,109:1 003-1 009.
[3] LI Xiufen,GUO Juan,JI Kailong,et al. Bamboo shoot fiber prevents obesity in mice by modulating the gut microbiota[J]. Scientific Reports,2016,6:1-11.
[4] ZHENG Jiong,WU Jiahao,DAI Yaoyi,et al. Influence of bamboo shoot dietary fiber on the rheological and textural properties of milk pudding[J]. LWT-Food Science and Technonlogy,2017,84:364-369.
[5] MO Yang,WU Liangru,CAO Chongjiang,et al. Improved function of bamboo shoot fibre by high-speed shear dispersing combined with enzyme treatment[J].International Journal of Food Science and Technology,2019,54:844-853.
[6] YAN Jingkun,WU Lixia,CAI Wudan,et al. Subcritical water extraction-based methods affect the physicochemical and functional properties of soluble dietary fibers from wheat bran[J]. Food Chemistry,2019,298:1-9.
[7] HUMA B U A,FARHAN S,AFTAB A.et al. Improving the physicochemical properties of partially enhanced soluble dietary fiber through innovative techniques: A coherent review[J]. Journal of food processing and preservation,2019,43:1-12.
[8] 孙静,邵佩兰,徐明.高温蒸煮结合酶解改性枣渣膳食纤维[J].食品工业科技,2017,38(23):137-142.
[9] SONG Yu,SU Wei,MU Yingchun. Modification of bamboo shoot dietary fiber by extrusion-cellulase technology and its properties[J]. International Journal of Food Properties,2018,21(1):1 219-1 232.
[10] CHEN Bifen,CAI Yongjian,LIU Tongxun,et al. Improvements in physicochemical and emulsifying properties of insoluble soybean fiber by physical-chemical treatments[J]. Food Hydrocolloids,2019,93:167-175.
[11] TEM T D, VASANTHAN T. Modification of rice bran dietary fiber concentrates using enzyme and extrusion cooking[J]. Food Hydrocolloids,2019,89:773-782.
[12] 周丽珍,刘冬,李艳,等.高温蒸煮结合酶解改性豆渣膳食纤维[J]食品研究与开发,2011,32(1):27-30.
[13] CHEN Huanhuan,ZHAO Chunmei,LI Jie,et al. Effects of extrusion on structural and physicochemical properties of soluble dietary fiber from nodes of lotus root[J]. LWT-Food Science and Technology,2018,93:204-211.
[14] HUA Mei,LU Jiaxi,QU Di,et al. Structure,physicochemical properties and adsorption function of insoluble dietary fiber from ginseng residue:A potential functional ingredient[J]. Food Chemistry,2019,286:522-529.
[15] XUE Zihan,CHEN Yue,JIA Yanan,et al. Structure, thermal and rheological properties of different soluble dietary fiber fractions from mushroom Lentinula edodes (Berk.) Pegler residues[J]. Food Hydrocolloids,2019,95:10-18.
[16] YANG Bing,WU Qunjun,SONG Xue,et al. Physicochemical properties and bioactive function of Japanese grape (Hovenia dulcis) pomace insoluble dietary fibre modified by ball milling and complex enzyme treatment[J]. International Journal of Food Science and Technology,2019,54:2 363-2 373.
[17] 刘成梅,蓝海军,涂宗财,等.复合稳定剂对膳食纤维在微射流瞬时高压下团聚性的影响[J].食品科学,2007,28(8):33-36.
[18] HAN Wen,MA Sen,LI Li,et al. Influence of wheat starch on the structural changesand size distribution of gluten induced by adding wheat bran dietary fiber[J].Starch,2018:70.
[19] XIE Fengying,ZHAO Tian,WAN Hongchen,et al. Structural and physicochemical characteristics of rice bran dietary fiber by cellulase and high-pressure homogenization[J].2019,9:1 270-1 280.
[20] IKRAM U,YIN Tao,XIONG Shanbai,et al. Effects of thermal pre-treatment on physicochemical properties of nanosized okara (soybean residue) insoluble dietary fiber prepared by wet media milling[J]. Journal of Food Engineering,2018,237:18-26.
[21] WANG Caihong,MA Yilong,ZHU Danye,et al. Physicochemical and functional properties of dietary fiber from Bamboo Shoots (Phyllostachys praecox)[J]. Emirates Journal of Food and Agriculture,2017,29(7):509-517.
[22] LUO Xianliang,WANG Qi,FANG Dongya,et al. Modification of insoluble dietary fibers from bamboo shoot shell: Structural characterization and functional properties[J]. International Journal of Biological Macromolecules,2018,120:1 461-1 467.
[23] 张明,马超,吴茂玉,等.蒸汽爆破压力对西兰花老茎膳食纤维品质及理化特性的影响[J/OL].食品工业科技:1-11[2020-02-18].http://kns.cnki.net/kcms/detail/11.1759.TS.20190801.1001.004.html.
[24] JIA Mengyun,CHEN Jiajun,LIU Xiaozhen,et al. Structural characteristics and functional properties of soluble dietary fiber from defatted rice bran obtained through Trichoderma viride fermentation[J]. Food Hydrocolloids,2019,94:468-474.
[25] 郑刚,何李,赵国华.高压蒸煮对苹果膳食纤维理化特性及发酵性能的影响[J].食品与发酵工业,2009,35(5):90-93.
[26] 王佳,张颜笑,郑炯.酶解处理对竹笋膳食纤维理化特性的影响[J].食品与发酵工业,2016,42(9):104-108.
[27] DONG Jilin,WANG Lei,LU Jing,et al. Structural,antioxidant and adsorption properties of dietary fiber from foxtail millet (Setaria italica) bran[J]. Journal of the science of food and agriculture,2019,99:3 886-3 894.
[28] KABIR M M,WANG H,LAU K T,et al. Effects of chemical treatments on hemp fibre structure[J]. Applied Surface Science,2013,276:13-23.
[29] CHEN Huanhuan,LI Jie,YAO Ruixue,et al. Mechanism of lipid metabolism regulation by soluble dietary fibre from micronized and non-micronized powders of lotus root nodes as revealed by their adsorption and activity inhibition of pancreatic lipase[J]. Food Chemistry,2019,305:125 434-125 442.
[30] GILL PEZ D I,LOISCORREA J A,S
PEZ D I,LOISCORREA J A,S NCHEZPARDO M E,et al. Production of dietary fibers from sugarcane bagasse and sugarcane tops using microwave-assisted alkaline treatments[J]. Industrial Crops & Products,2019,135:159-169.
NCHEZPARDO M E,et al. Production of dietary fibers from sugarcane bagasse and sugarcane tops using microwave-assisted alkaline treatments[J]. Industrial Crops & Products,2019,135:159-169.
[31] ANUPAMA K, MANDEEP S. Isolation and characterization of cellulose nanofibrils from wheat straw using steam explosion coupled with high shear homogenization[J]. Carbohydrate Research,2011,346:76-85.
[32] ZHANG Mengyun,LIAO Aimei,KIRAN T,et al. Modification of wheat bran insoluble dietary fiber with carboxymethylation, complex enzymatic hydrolysis and ultrafine comminution[J]. Food Chemistry,2019,297:124 983-124 992.