枯草芽孢杆菌YA215发酵螺旋藻渣产抑菌活性的工艺
付云1,赵谋明1, 2,卢美杉1,余炼1,刘小玲1*
1(广西大学 轻工与食品学院,广西 南宁, 530004)2(华南理工大学 食品学院,广东 广州, 510000)
摘 要 为充分利用螺旋藻渣副产物,获得较佳的抗菌活性发酵产物,该文以团队筛选的枯草芽孢杆菌(Bacillus subtilis YA215)为发酵剂,对螺旋藻渣进行液态发酵。以发酵上清液中性蛋白酶活、多肽含量及对金黄色葡萄球菌(Staphylococcus aureus)抑菌率为指标,通过单因素实验、Plackett-Burman实验和正交试验,优化发酵工艺条件。结果表明,发酵初始溶液中,螺旋藻渣添加量15 g/L、果糖添加量10 g/L、NaCl添加量10 g/L、YA215接种量75 mL/L(发酵剂菌落含量为107~108CFU/mL)、pH 7.0,37 ℃摇床培养48 h(转速200 r/min),其发酵上清液中性蛋白酶活达到147.4 U/mL,多肽含量为16.8 mg/mL,对金黄色葡萄球菌抑菌率为64.6%,产生的抑菌圈直径大小为15.3 mm,且抑菌率与多肽含量正相关。螺旋藻渣可通过枯草芽孢杆菌YA215发酵获得良好抗菌性,提升其作为饲料配料的价值。
关键词 枯草芽孢杆菌YA215;螺旋藻渣;中性蛋白酶;多肽含量;抑菌率
第一作者:硕士研究生(刘小玲教授为通迅作者,E-mail:1106133912@qq.com)
基金项目:广西壮族自治区科技攻关计划资助项目(AA17204075);广西科学基金资助项目(2016GXNSFEA380003)
收稿日期:2019-10-04,改回日期:2019-11-30
DOI:10.13995/j.cnki.11-1802/ts.022454
引用格式:付云,赵谋明,卢美杉,等.枯草芽孢杆菌YA215发酵螺旋藻渣产抑菌活性的工艺[J].食品与发酵工业,2020,46(4):146-152.FU Yun,ZHAO Mouming,LU Meishan, et al. Optimization of the production of antimicrobial using spirulina residue by Bacillus subtilis YA215 fermentation[J].Food and Fermentation Industries,2020,46(4):146-152.
Optimization of the production of antimicrobial using spirulina residue by Bacillus subtilis YA215 fermentation
FU Yun1, ZHAO Mouming1, 2, LU Meishan1, YU Lian1, LIU Xiaoling1*
1(College of Light Industry and Food Engineering, Guangxi University, Nanning 530004, China)2(South China University of Technology, School of Food Science and Engineering, Guangzhou 510000, China)
ABSTRACT The purpose of this study was to make full use of the by-products of spirulina residue to obtain higher antimicrobial activity fermented products. In this study, Bacillus subtilis YA215 was selected as the seeding culture for spirulina residue fermentation. The neutral protease activity, polypeptide content and antimicrobial activity (against Staphylococcus aureus) of the supernatant were analyzed and used as indexes. Based on the indexes, the fermentation conditions were optimized using the single factor, Plackett-Burman, and orthogonal experiment methods. The optimized condition as follows: 1.5% (w/w) of spirulina residue, 1% (w/w) of fructose, 1% (w/w) of NaCl, and 7.5% (v/v) of YA215 starter culture (107-108 CFU/mL), pH 7.0 and under 37 ℃ for 48 h with agitation of 200 r/min. The results showed that the neutral protease activity of the fermentation supernatant reached 147.4 U/mL. Moreover, the polypeptide reached 16.8 mg/mL and antimicrobial rate was 64.6%. Meanwhile the diameter of the produced bacteriostatic circle was 15.3 mm. In addition, the antimicrobial activity was positively related to the polypeptide content. In summary, the spirulina residue can be fermented using Bacillus subtilis YA215 to obtain high antibacterial property. This product has a high potential value in feed application.
Key words Bacillus subtilis YA215; spirulina residue; neutral protease activity; poly peptide content; bacteriostatic rate
螺旋藻是工业化规模养殖的微藻之一[1],其蛋白质含量丰富,氨基酸种类齐全,被誉为天然食物之冠[2]。螺旋藻渣是螺旋藻粉生产过程中沉积物,其蛋白质含量占其干重的60%左右。目前大部分螺旋藻渣被以污水排放的形式进行处理,小部分作为水产饲料低价销售[3]。藻渣作为一种蛋白质资源不仅没有被充分利用,反而成为了螺旋藻生产企业的经济负担。因此,螺旋藻渣资源开发应用不仅可以提高螺旋藻的经济价值,降低企业生产成本,同时也为废弃蛋白质资源的开发利用提供了一条新途径。然而,关于螺旋藻渣资源的回收利用相关的研究却鲜有报道。
枯草芽孢杆菌(Bacillus subtilis)是一种需氧型革兰氏阳性菌,分泌蛋白酶能力强,具有公认的安全特性[4]。大量研究表明,该菌次级代谢产物中的抗菌肽如杆菌肽[5]、表面活性素(Surfactin)[6]和伊枯草菌素(Iturin)[7]等对植物病原菌和食品病原菌都具有不同程度的抑制作用[8]。枯草芽孢杆菌YA215是本研究团队从海洋中分离出的1株高产中性蛋白酶菌株,可适应海水和半海水的生长环境及基质,繁殖能力强,抗逆性强。如能通过枯草芽孢杆菌YA215发酵螺旋藻渣,提高螺旋藻的抑菌性,则可将发酵后的螺旋藻应用于饲料,提高动物的抗病性,从而有效提高藻渣的价值。为此,本研究探究发酵液螺旋藻渣、碳源、无机盐的添加量,接种量和发酵时间等因素对枯草芽孢杆菌YA215发酵螺旋藻渣效果的影响,通过对发酵产物中性蛋白酶活、多肽含量及对金黄色葡萄球菌抑菌效果等相关指标的监测,优化发酵条件,获得抑菌作用突出的发酵产物,为科学合理开发利用螺旋藻渣提供技术支撑,同时也为后续研究枯草芽孢杆菌YA215发酵产物中抗菌物质及抑菌机理奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株
指示菌:金黄色葡萄球菌(Staphylococcus aureus)CGMCC14519,中国普通微生物菌种保藏管理中心提供;实验菌:枯草芽孢杆菌(Bacillus subtilis YA215),本课题组研究人员从北部湾海洋中分离并保存。
1.1.2 培养基
细菌基础(luria-bertani,LB)培养基(g/L):蛋白胨10,酵母浸粉5,NaCl 10。制备固体培养基时添加20 g/L琼脂粉,pH 7.0。
1.1.3 试剂
螺旋藻渣(冷链运输后快速冻结放于-20 ℃备用),广西生巴达生物科技有限公司。
NaOH、NaCl、CuSO4、硫酸铜和葡萄糖均为分析纯,成都金山化学试剂有限公司;尼萨普林,丹尼斯克(中国)有限公司;福林酚、果糖,北京索莱宝科技有限公司;蛋白胨、酵母浸粉、琼脂粉,北京奥博星生物技术有限责任公司。
1.2 仪器与设备
UV-6100紫外可见分光光度计,上海美谱达仪器有限公司;CR21N高速冷冻离心机,日立公司;SUNRISE酶标仪,帝肯(上海)贸易有限公司;Sherlock微生物计数仪,美国MIDI公司;ZQZY-85CS振荡培养箱,上海知楚仪器有限公司;SQP电子天平,赛多利斯科学仪器有限公司;SW-CJ-2F洁净工作台,苏州安泰空气技术有限公司;GI80TW高压蒸汽灭菌锅,致微(厦门)仪器有限公司;DHP-9082电热恒温培养箱,上海齐欣科学仪器有限公司。
1.3 实验方法
1.3.1 菌种的活化与发酵剂制备
将保存于-80 ℃冰箱内的Bacillus subtilis YA215菌种接种于LB固体培养基中,37 ℃恒温培养24 h。再将活化好的菌种挑单菌落,接种于250 mL含有100 mL LB液体培养基锥形瓶中,200 r/min、37 ℃摇床培养24 h,得到用于接种藻渣培养的发酵剂(107~108CFU/mL)。
1.3.2 单因素实验设计
取50 mL活化后的Bacillus subtilis YA215菌液(107~108CFU/mL),按一定接种量接种于不同添加量的藻渣溶液中并添加一定量的碳源、NaCl,最后用无菌水定容到1 L,在37 ℃下 200 r/min转速的摇床中培养一定时间,培养结束后,发酵液经4 000 r/min离心10 min,取其发酵上清液并测定上清液中的中性蛋白酶酶活、多肽含量及对金黄色葡萄球菌抑菌率。实验考察的单因素及其水平如表1所示。进行每个单因素实验时,其他因素维持恒定见表1。进行下一组单因素时,选择前一因素最佳水平进行。
1.3.3 Plackett-Burman试验设计
在单因素实验基础上,利用Plackett-Burman(PB)试验设计法,对螺旋藻渣添加量、果糖添加量、NaCl添加量、接种量和发酵时间5个因素进行探究,筛选出显著影响发酵上清液抑菌活性的因素。每个试验因素均取高(1)、低(-1)两水平,用来考察试验过程中的随机误差。以发酵上清液对金黄色葡萄球菌的抑菌率作为响应值,Plackett-Burman设计因子水平及编码如表2所示。
表1 发酵条件单因素试验因素水平表
Table 1 different factors and levels of fermentation condition
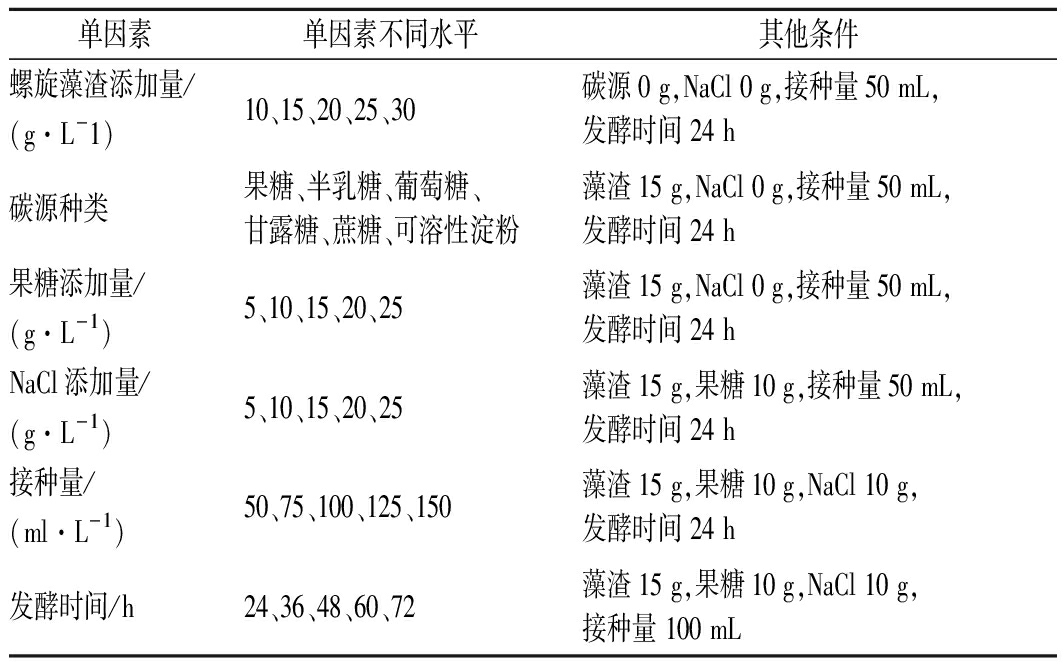
单因素单因素不同水平其他条件螺旋藻渣添加量/(g·L-1)10、15、20、25、30碳源0 g,NaCl 0 g,接种量50 mL,发酵时间 24 h碳源种类果糖、半乳糖、葡萄糖、甘露糖、蔗糖、可溶性淀粉藻渣15 g,NaCl 0 g,接种量50 mL,发酵时间 24 h果糖添加量/(g·L-1)5、10、15、20、25藻渣15 g,NaCl 0 g,接种量50 mL,发酵时间 24 hNaCl添加量/(g·L-1)5、10、15、20、25藻渣15 g,果糖10 g,接种量50 mL,发酵时间 24 h接种量/(ml·L-1)50、75、100、125、150藻渣15 g,果糖10 g,NaCl 10 g,发酵时间 24 h发酵时间/h24、36、48、60、72藻渣15 g,果糖10 g,NaCl 10 g,接种量 100 mL
表2 Plackett-Burman试验设计因素及编码水平
Table 2 Factor and code level of Plackett-Burman
experimental design
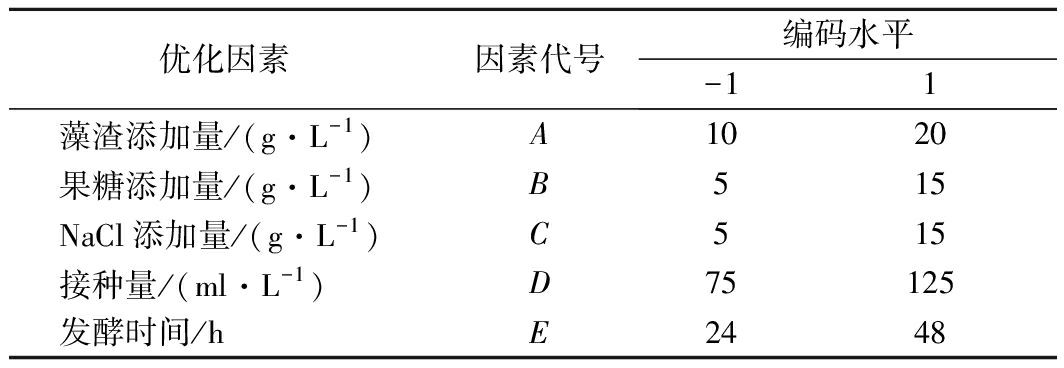
优化因素因素代号编码水平-11藻渣添加量/(g·L-1)A1020果糖添加量/(g·L-1)B515NaCl添加量/(g·L-1)C515接种量/(ml·L-1)D75125发酵时间/hE2448
1.3.4 正交实验设计
根据单因素及PB试验所筛选出的对发酵上清液抑菌活性有显著影响的因素进行L9(33)正交优化试验,其他影响因素条件为在装液量1 L,发酵温度37 ℃,摇床转速200 r/min条件下,果糖添加量为10 g/L,NaCl添加量为10 g/L。以发酵上清液中的中性蛋白酶活力、多肽含量及对金黄色葡萄球菌抑菌率为指标,确定Bacillus subtilis YA215发酵螺旋藻渣的最佳发酵条件,各因素和各水平的选择,如表3所示。
表3 正交试验因素水平表
Table 3 Factors and levels of used in orthogonal experiment

水平ABC藻渣添加量/(g·L-1)接种量/(ml·L-1)发酵时间/h11075242151003632012548
1.3.5 优化与对照实验
正交试验得到的最优组合与仅含10 g/L藻渣底物的发酵液、LB为底物的发酵液做对照试验。检测指标主要包括发酵上清液的中性蛋白酶活力、多肽含量、金黄色葡萄球菌抑菌率及抑菌圈直径大小。
1.3.6 蛋白酶活性的测定
参照GB/T 23527—2009所示[9],取Bacillus subtilis YA215发酵上清液稀释一定倍数,采用福林酚法测定中性蛋白酶活力。
1.3.7 多肽含量的测定
取2 mL发酵上清液,加入10%三氯乙酸2.0 mL,混匀,静置10 min,5 000 r/min离心15 min,取0.5 mL上清液于另一试管中,再加入2 mL双缩脲试剂,混匀后静置15 min,3 000 r/min离心15 min后,取上清液于540 nm处测吸光度值,以加0.5 mL蒸馏水和2.0 mL双缩脲试剂作空白[10]。
1.3.8 抑菌活性的测定
1.3.8.1 抑菌率测定
吸取100 μL指示菌菌悬液(108~109CFU/mL,下同)于100 mL LB培养液中,实验组添加10 mL枯草芽孢杆菌YA215发酵上清液,空白组不添加枯草芽孢杆菌发酵滤液,进行抑菌试验。培养12 h后,测定菌液在600 nm波长下吸光度值。通过实验组与空白组的菌液浓度计算出抑菌率[11-12]如公式(1)所示。
抑菌率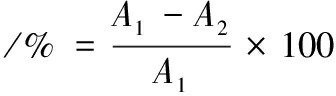
(1)
式中:A1,空白组吸光度值;A2,实验组吸光度值。
1.3.8.2 抑菌圈直径测定
LB琼脂培养基溶解冷却至45 ℃左右,无菌条件下接入1%指示菌菌悬液,混匀倒入置有1 mL枪头的平板中,凝固后将枪头取出,孔内加入100 μL发酵上清液,37 ℃恒温静置培养24 h,观察抑菌并记录抑菌圈直径大小(mm)[13-15]。
1.3.9 数据统计与分析
所有试验均进行3次平行实验,试验数据均采用Minitab 15软件、IBM SPSS Statistics 19与Origin 9.1进行数据分析,以平均值±标准差的形式呈现。
2 结果与分析
2.1 影响藻渣发酵液产物活性的因素
2.1.1 螺旋藻渣添加量的选择
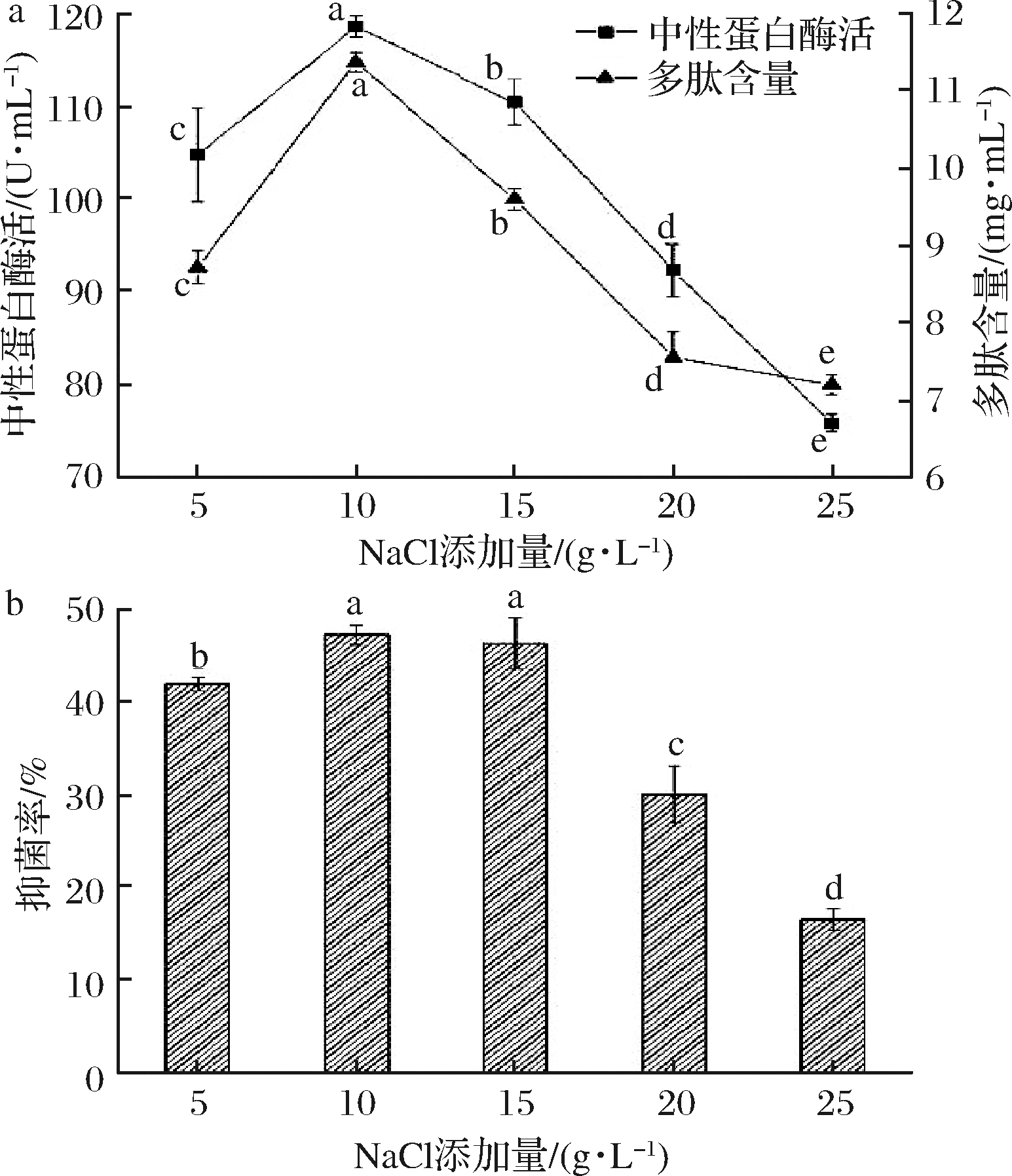
藻渣添加量对中性蛋白酶活、多肽含量和抑菌率的影响如图1所示。图1-a表明,螺旋藻渣添加量在10~15 g/L,随着藻渣的增加,微生物营养充足,故发酵液中性蛋白酶酶活升高,蛋白质水解速度加快,多肽含量增加,在藻渣添加量达到15 g/L时,中性蛋白酶活和多肽含量达到最高,分别为68.2 U/mL和6.52 mg/mL;藻渣添加量在15~30 g/L时,中性蛋白酶活和多肽含量均呈下降趋势,由于枯草芽孢杆菌是好氧微生物,过高的藻渣添加量使三角瓶内溶氧量不足,菌体产酶量减少,酶活降低,多肽含量减少[16]。由图1-b可知,藻渣添加量为15 g/L时,发酵上清液对S. aureus的抑菌率显著高于其他添加量(P<0.05),因此螺旋藻渣添加量选择15 g/L为宜。
2.1.2 碳源的选择
枯草芽孢杆菌YA215在15 g/L螺旋藻渣培养液中,分别添加质量浓度为10 g/L的不同碳源后发酵24 h,其上清液中性蛋白酶活、多肽含量如图2所示。由图2可知,可溶性淀粉为碳源时,其发酵上清液的中性蛋白酶活、多肽含量最低,且比无碳源添加的发酵上清液还低,其次为蔗糖,这可能是由于枯草芽孢杆菌YA215不具有分解糖苷键的能力,无法有效利用聚合糖所致[17]。4种单糖中,果糖最有利于促进枯草芽孢杆菌YA215分泌中性蛋白酶,并进而分解蛋白质产生更多的多肽含量。蛋白酶酶活与其发酵上清液多肽含量呈同步递增的趋势。因此,在藻渣液中增加适量的单糖,尤其是果糖,可获得更高酶活和多肽含量。
2.1.3 果糖添加量的选择
由图3-a可知,果糖添加量在5~10 g/L时,中性蛋白酶活和多肽含量均随果糖添加量的增加而增大;继续增大果糖添加量,中性蛋白酶活和多肽含量均呈下降趋势。这可能是因为适当的果糖添加量对枯草芽孢杆菌的生长具有促进作用, 然而果糖添加过多后,严重加速菌体呼吸作用,导致培养基中溶氧不足,使枯草芽孢杆菌的生长和产酶受到抑制[18]。由图2、图3-b可知,果糖添加量为10、15 g/L时,发酵上清液对S. aureus的抑菌率没有显著性差异(P>0.05)。因此,综合发酵上清液中中性蛋白酶活、多肽含量和对S. aureus的抑菌率考虑,果糖添加量选择10 g/L。
2.1.4 NaCl添加量的选择
无机盐可以为微生物提供矿质元素、调节培养基pH和渗透压等。图4-a表明,发酵上清液中性蛋白酶活和多肽含量随NaCl的增加均呈现先上升后下降的趋势,在NaCl添加量为10 g/L时,发酵上清液中性蛋白酶活和多肽含量达到最大值;当NaCl添加量超过10 g/L时,中性蛋白酶活和多肽含量急剧降低,这是因为盐浓度增大使微生物处于高渗透压环境,导致微生物脱水死亡[19]。由图4-b可知,NaCl添加量为10、15 g/L时,发酵上清液对S. aureus的抑菌率没有显著性差异(P>0.05)。因此,综合考虑下,NaCl添加量选择10 g/L。
2.1.5 接种量的选择
接种量对发酵上清液中性蛋白酶活、多肽含量和S. aureus的抑菌率如图5所示。随着接种量的增加,发酵上清液中性蛋白酶活、多肽含量和对S. aureus的抑菌率均呈上升趋势,在接种量为100 mL/L时各项指标达到最大值,之后抑菌率趋于平稳,当接种量在100~150 mL/L之间时,发酵上清液对S. aureus的抑菌率均无显著性差异(P>0.05),而中性蛋白酶活和多肽含量呈现下降趋势,这是因为当接种量过大时,微生物大量生长繁殖,导致发酵后期培养基内营养不足,部分微生物死亡或利用酶解出的小分子多肽用于自身生长发育[20-21]所致。因此,接种量选择100 mL/L为最佳。
2.1.6 发酵时间的选择
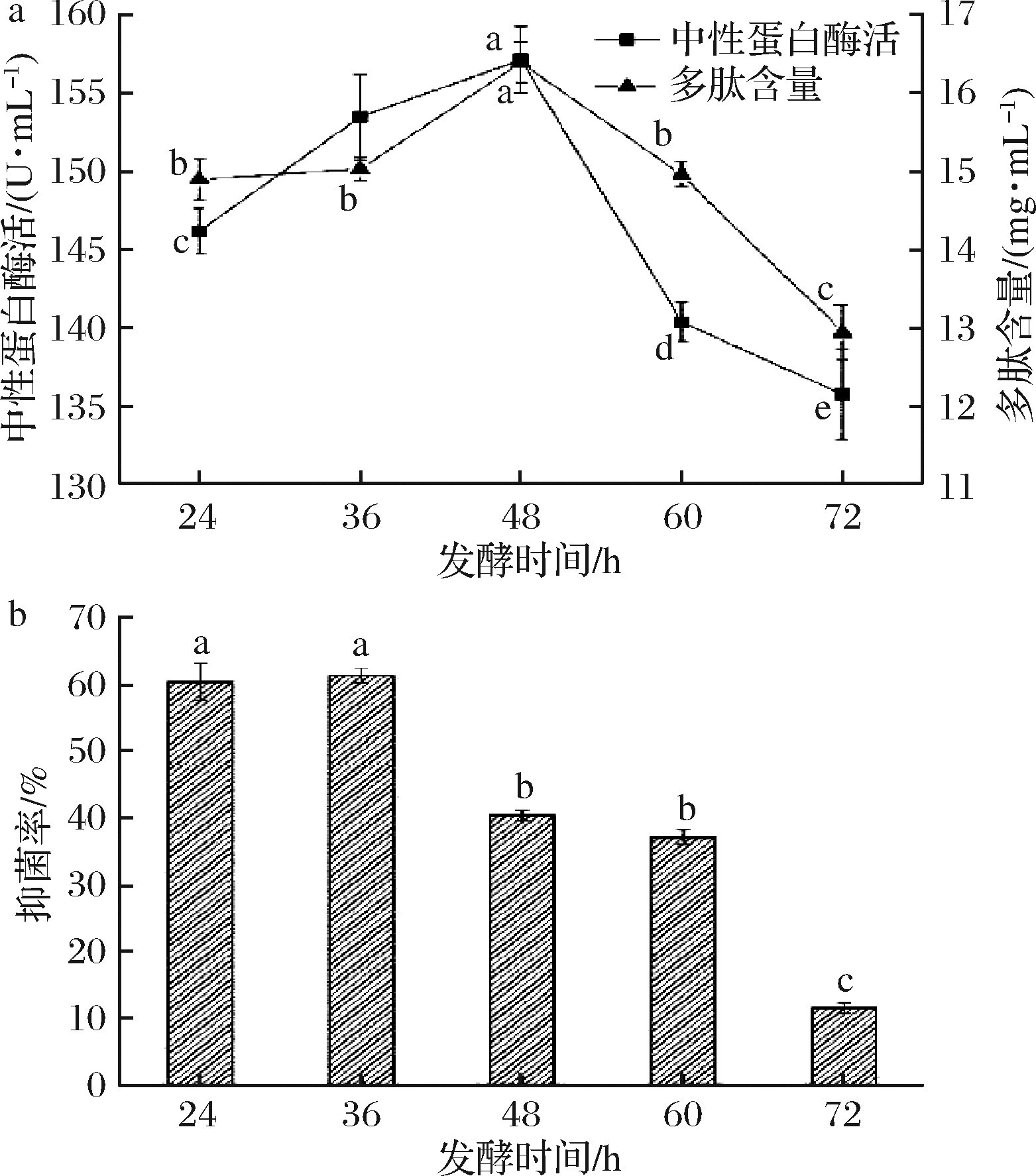
图6-a表明,在24~48 h,发酵上清液中性蛋白酶活和多肽含量随发酵时间的增加而逐渐升高,在发酵48 h时中性蛋白酶活和多肽含量达到最高,分别为157.1 U/mL,16.3 mg/mL。而随着发酵时间的继续延长,中性蛋白酶活和多肽含量均呈下降趋势,其原因可能是当菌体数量积累到一定程度时,培养液中营养不足,微生物需要利用酶解出的小分子多肽用于生长繁殖[22],也可能是因为发酵液中的大量蛋白酶继续将产生的多肽水解成氨基酸,导致多肽含量持续下降[23]。
由图6-b可知,发酵时间为24、36 h时,发酵上清液对S. aureus的抑菌率显著高于其他发酵时间。因此,兼顾中性蛋白酶活、多肽含量和抑菌率3指标的考虑,选择发酵时间为36 h。
2.2 Plackett-Burman试验确定影响发酵的显著因素
Plackett-Burman(PB)试验结果如表4所示,采用Minitab 15软件对表4试验结果进行数据处理及效应分析,结果如表5所示。由表5可知,接种量和发酵时间对抑菌率具有极显著性影响(P<0.01),螺旋藻渣添加量对抑菌率具有显著性差异(P<0.05),而果糖和NaCl对抑菌率无显著性影响(P>0.05)。因此,选择螺旋藻渣添加量、接种量和发酵时间等3个显著影响因素进行进一步的发酵优化实验。
表4 Plackett-Burman试验设计和结果
Table 4 Results of Plackett-Burman experimental design
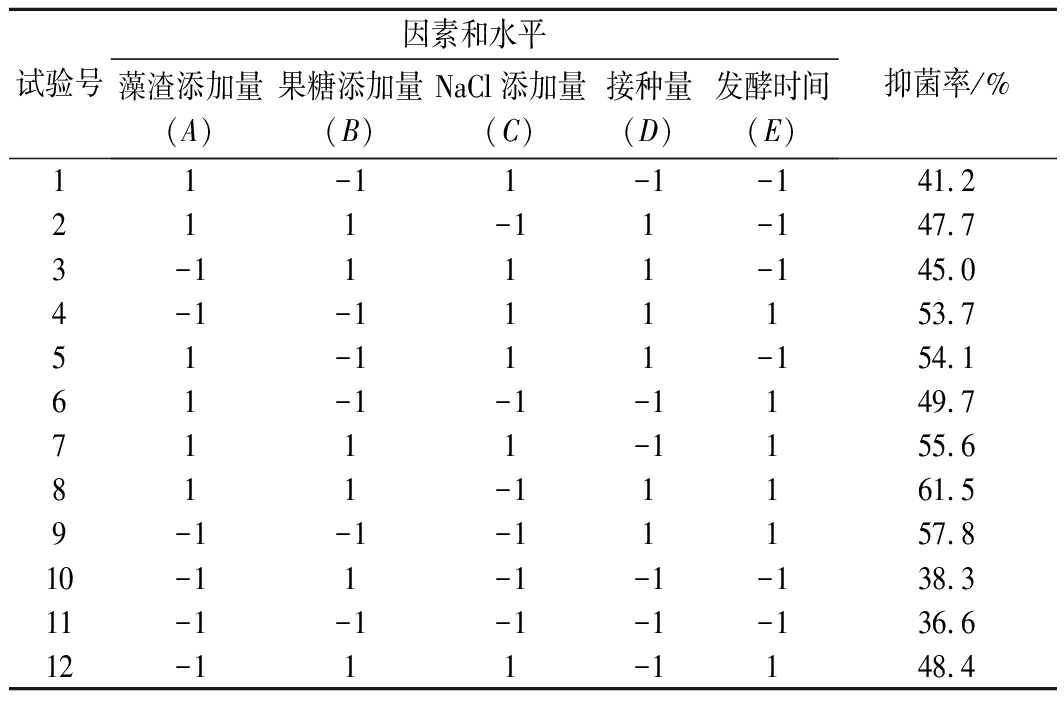
试验号因素和水平藻渣添加量(A)果糖添加量(B)NaCl添加量(C)接种量(D)发酵时间(E)抑菌率/%11-11-1-141.2211-11-147.73-1111-145.04-1-111153.751-111-154.161-1-1-1149.77111-1155.6811-11161.59-1-1-11157.810-11-1-1-138.311-1-1-1-1-136.612-111-1148.4
表5 Plackett-Burman试验设计回归各因子效应分析
Table 5 Analyses of Plackett-Burman experimental design

系数项效应系数系数标准误差T值P值常量49.13330.798061.570.000A5.00002.50000.79803.130.020B0.56670.28330.79800.360.735C1.06670.53330.79800.670.529D8.33334.16670.79805.220.002E10.63335.31670.79806.660.001R-Sq=93.18% R-Sq(Adj)=90.50%
2.3 正交试验优化藻渣发酵条件
在Plackett-Burman(PB)试验基础上,设计L9(33)正交试验以确定Bacillus subtilis YA215发酵螺旋藻渣的最佳条件,试验结果,如表6所示。由表6可知,影响Bacillus subtilis YA215中性蛋白酶活的各因素顺序是A>C>B;影响多肽含量的各因素顺序是A>B>C;影响发酵上清液对金黄色葡萄球菌抑菌率的各因素顺序是A>B>C。
表6 正交试验因素水平表
Table 6 Results of orthogonal experimental
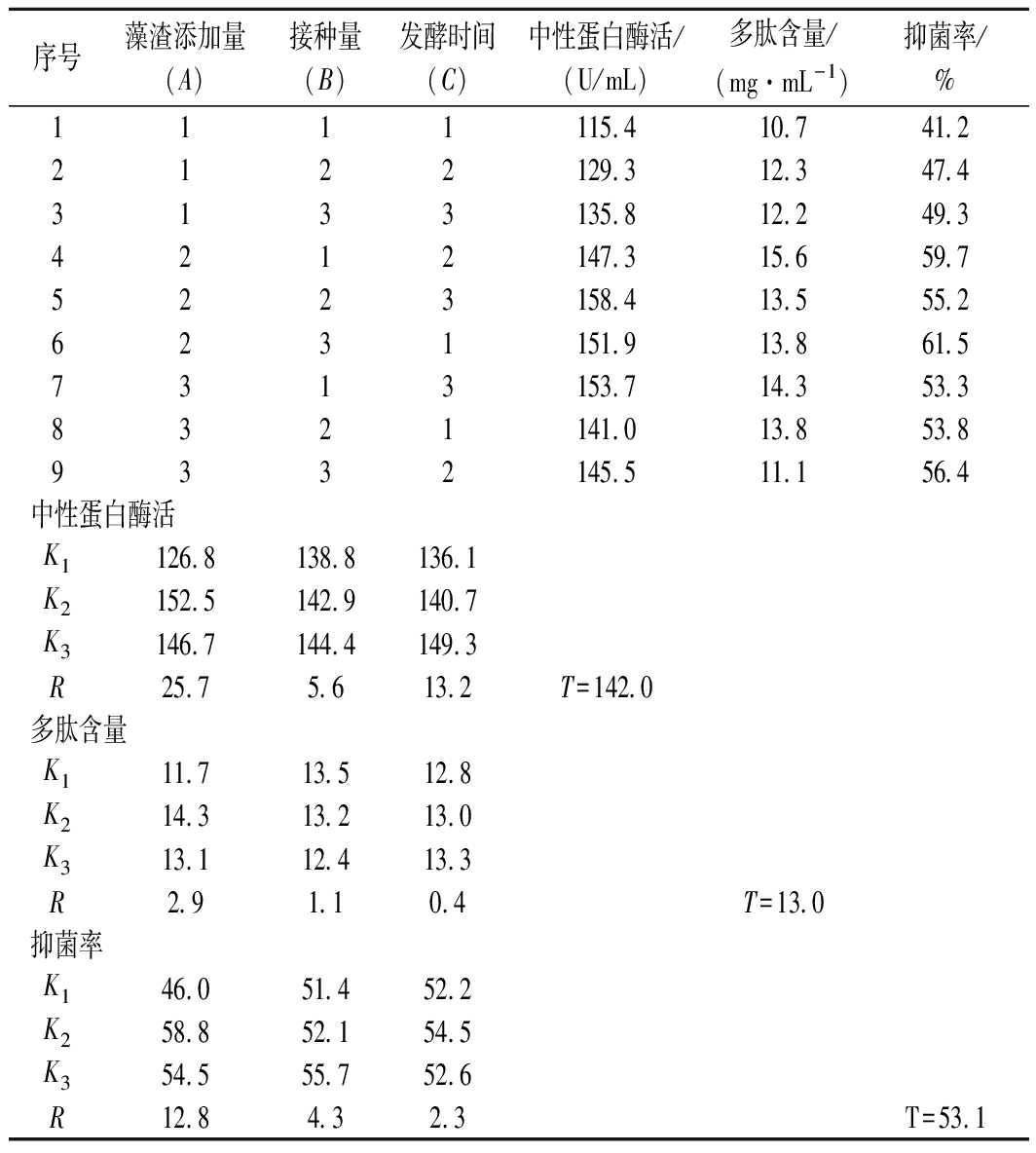
序号藻渣添加量(A)接种量(B)发酵时间(C)中性蛋白酶活/(U/mL)多肽含量/(mg·mL-1)抑菌率/%1111115.410.741.22122129.312.347.43133135.812.249.34212147.315.659.75223158.413.555.26231151.913.861.57313153.714.353.38321141.013.853.89332145.511.156.4中性蛋白酶活K1126.8138.8136.1K2152.5142.9140.7K3146.7144.4149.3R25.75.613.2T=142.0多肽含量K111.713.512.8K214.313.213.0K313.112.413.3R2.91.10.4T=13.0抑菌率K146.051.452.2K258.852.154.5K354.555.752.6R12.84.32.3T=53.1
以中性蛋白酶活、多肽含量、抑菌率为指标时,最优培养基的组合分别:A2B3C3、A2B1C3、A2B3C2。由于试验设计方案都不包括最优组合,故需做验证试验进行对比,结果如表7所示。
表7 Bacillus subtilis YA215发酵培养基验证结果
Table 7 Verification results for the Bacillus subtilis YA215
fermentation culture

最优组合中性蛋白酶活/(U·mL-1)多肽含量(mg·mL-1)抑菌率/%A2C3B3158.713.652.3A2B1C3147.416.864.6A2B3C2153.215.360.5
表7中在最佳组合A2B1C3条件下发酵,多肽含量为16.8 mg/mL,对S. aureus的抑菌率为64.6%,优于组合A2C3B3和A2B3C2,中性蛋白酶活为147.4 U/mL,略低于组合A2C3B3和A2B3C2。由于多肽是枯草芽孢杆菌重要发酵产物,且与抑菌作用的产生有紧密联系[5],故选择A2B1C3为最佳组合,即藻渣添加量为15 g/L,接种量75 ml/L,发酵时间48 h。
2.4 优化与对照试验结果分析
由表8可知,藻渣发酵条件优化后,与优化前10 g/L藻渣培养液相比,中性蛋白酶活、多肽含量和抑菌率分别提高119.3%,217.0%,196.3%;与LB培养基相比,中性蛋白酶活、多肽含量和抑菌率分别提高65.1%,127%,92.8%。优化前,LB培养基和10 g/L藻渣培养基发酵上清液对S. aureus作用产生的抑菌圈直径大小(抑菌圈直径=外圈直径)分别为12.8 mm和12.1 mm,优化后,最佳培养基发酵上清液产生的抑菌圈直径为15.3 mm,接近阳性对照尼萨普林产生的抑菌圈16.6 mm。张雯等[11]利用枯草芽孢杆菌BS08发酵无菌滤液进行抑菌圈实验的测定,其抑菌活性物质产生的抑菌圈直径大小也仅10 mm。由此可见,优化后的培养基不仅能显著提高螺旋藻渣的利用率,也能产生更多的抑菌活性物质。
表8 Bacillus subtilis YA215发酵培养基优化对照
Table 8 The comparison of the optimation and control
experiment for the Bacillus subtilis YA215 fermentation
culture
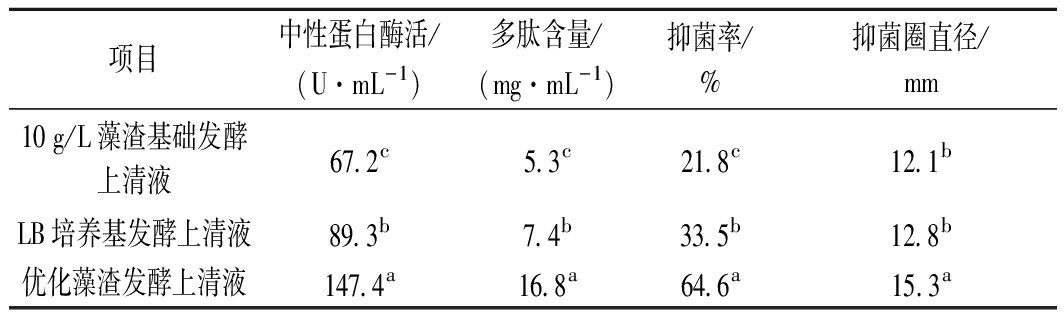
项目中性蛋白酶活/(U·mL-1)多肽含量/(mg·mL-1)抑菌率/%抑菌圈直径/mm10 g/L藻渣基础发酵上清液67.2c5.3c21.8c12.1bLB培养基发酵上清液89.3b7.4b33.5b12.8b优化藻渣发酵上清液147.4a16.8a64.6a15.3a
注:各数据同列间不同字母符号存在显著性差异(P<0.05)
3 结论
本研究通过对枯草芽孢杆菌YA215发酵螺旋藻渣的工艺条件进行优化,确定其最佳发酵条件。即pH 7.0的1 L初试发酵底物中,螺旋藻渣添加量15 g/L,果糖添加量10 g/L,NaCl添加量10 g/L,YA215的接种量75 ml/L,发酵温度37 ℃,发酵时间48 h,转速200 r/min时,其发酵产物中的中性蛋白酶活、多肽含量及对金黄色葡萄球菌抑菌率比常规LB培养基分别提高了65.1%,127%,92.8%,为今后进一步研究枯草芽孢杆菌YA215对螺旋藻渣资源转化和利用提供了实验依据。然而,本研究采用的三角锥形瓶摇床发酵,由于三角瓶空间有限,螺旋藻渣发酵培养基优化配方和发酵条件是否具备放大稳定性还需要进一步验证,本研究还有待结合实际生产进一步考察影响因素、扩大实验规模,优化生产条件。
参考文献
[1] THENGODKAR R R M, SIVAKAMI S. Degradation of Chlorpyrifos by an alkaline phosphatase from the cyanobacterium Spirulina platensis[J]. Biodegradation, 2010, 21(4):637-644.
[2] 郑建仙. 二十一世纪的主导食品——功能性食品[J].广州食品工业科技,1995(2):15-17;21.
[3] 刘惠芳. 螺旋藻在饲料工业中的应用[J]. 猪业科学, 2001, 18(2):62-65.
[4] SCHALLMEY M, SINGH A, WARD O P. Developments in the use of Bacillus species for industrial production[J]. Canadian Journal of Microbiology, 2004, 50(1):1-17.
[5] 贾锐,陆兆新. 原桃胶中1株芽孢杆菌的分离鉴定及其主要抗菌物质[J]. 食品科学, 2016, 37(21):136-143.
[6] BACON C W, HINTON D M, MITCHELL T R, et al. Characterization of endophytic strains of Bacillus mojavensis and their production of surfactin isomers[J]. Biological Control, 2012, 62(1):1-9.
[7] PATHAK K V, KEHARIA H. Identification of surfactins and iturins produced by potent fungal antagonist,Bacillus subtilis K1 isolated from aerial roots of banyan (Ficus benghalensis) tree using mass spectrometry[J]. Biotech, 2014, 4(3):283-295.
[8] ZHENG G, SLAVIK M F. Isolation, partial purification and characterization of a bacteriocin produced by a newly isolated Bacillus subtilis strain[J]. Letters in Applied Microbiology, 1999, 28(5):363-367.
[9] GB 23527 —2009 蛋白酶制剂[S].北京:中国标准出版社,2009.
[10] 鲁伟,任国谱,宋俊梅. 蛋白水解液中多肽含量的测定方法[J]. 食品科学, 2005, 26(7):169-171.
[11] 张雯,卞丹,沈燕秋,等. 枯草芽孢杆菌抑菌活性物质鉴定、抑菌特性及发酵条件优化[J]. 中国食品学报, 2017, 17(12):105-115.
[12] WANG T, LIANG Y, WU M, et al. Natural products from Bacillus subtilis with antimicrobial properties[J]. Chinese Journal of Chemical Engineering, 2015, 23(4):744-754.
[13] 魏薇薇. 鱿鱼加工副产物的生物转化营养制品研究[D].舟山:浙江海洋大学,2017.
[14] 郝鹏飞. 辣椒叶“金花”菌发酵产物及活性研究[D].北京:北京中医药大学, 2013.
[15] LEE S Y, KIM K B W R, LIM S I, et al. Antibacterial mechanism of Myagropsis myagroides extract on Listeria monocytogenes[J]. Food Control, 2014, 42:23-28.
[16] 罗娟. 超声波对枯草芽孢杆菌液态发酵豆粕及其产物功能特性的影响[D]. 镇江:江苏大学,2016.
[17] 田苗苗,毛思宇,王伟. 响应面法优化液态发酵产多肽条件及其抗氧化性能初探[J]. 饲料工业, 2018, 39(14):51-57.
[18] 李晓飞,田锡炜,王永红. 拟干酪乳杆菌乳酸发酵培养基氮源优化[J]. 食品与发酵工业, 2015, 41(2):102-106.
[19] 李秀婷,赵进,鲁绯,等. 米曲霉固态发酵产酶条件及酶活力研究[J]. 中国酿造, 2009(2):26-28.
[20] 王銮,包怡红,康宁. 混菌固态发酵榛仁粕制备降血压肽工艺优化研究[J]. 中国粮油学报, 2018, 33(12):43-49.
[21] TANG W, YUAN H, ZHANG H, et al. An antimicrobial peptide screened from casein hydrolyzate by Saccharomyces cerevisiae cell membrane affinity method[J]. Food Control, 2015, 50:413-422.
[22] 鞠光荣,王雪峰,王立峰,等.混菊固态发酵菜籽的制备菜籽肽的菌种筛选[J].食品与发酵工业,2011,37(9):104-108.
[23] 陈旋,杨国琴,高书彦,等. 响应曲面优化苦荞多肽固态发酵工艺及其抗菌活性研究[J]. 食品与发酵科技, 2018,54(1):30-38.